柑橘是芸香科(Rutaceae)柑橘亚族(Citrinae)的一类植物,包括柑橘属(Citrus)和枳(Poncirus)、金柑(Fortunella)等5个近缘属。柑橘果实营养丰富,还具有很高的药用价值,我国2022年产量已逾6 000万t,其精深加工与高值化利用潜力巨大。天然香豆素类化合物是一类存在于芸香科、伞形科、菊科、豆科等高等植物中的次生代谢产物,常以游离态或糖苷化形态出现。一般认为,香豆素的生物合成是植物响应逆境胁迫的重要机制。近年来,研究发现柑橘香豆素在抗抑郁[1]、干预老年痴呆[2]、干扰人类免疫缺陷病毒(human immunodeficiency virus, HIV)[3]和新型冠状病毒[4]以及预防慢性疾病[5-6]等诸多健康领域显示出积极作用。这些功效及其天然的来源决定了柑橘香豆素在功能性食品和药物创新等方面具有广阔的前景。据此,本文综合了近年来关于柑橘香豆素类化合物的文献报道,重点归纳和分析论述了柑橘香豆素的结构和分布特点、提取纯化和分析技术以及生物活性作用等方面的研究进展,以期为深入研究柑橘香豆素的活性机理、开发其高价值产品、推进其工业化生产和市场应用提供理论和技术依据。
1 柑橘香豆素的结构和分布
香豆素是一类含苯并α-吡喃酮结构的芳香含氧杂环化合物。如图1所示,根据母核上有无取代以及7-羟基是否和C-6/C-8异戊烯基成环,可将香豆素分为简单香豆素(伞形花内酯、蛇床子素等)、呋喃香豆素(花椒毒素、异佛手柑内酯等)、吡喃香豆素(鲁望桔内酯、邪蒿素等)和其他香豆素(二聚体类香豆素等)。呋喃和吡喃香豆素依据三环的位置关系又可分为线型和角型。迄今为止在柑橘中发现约1 300个香豆素物质,绝大部分为简单香豆素和线型呋喃/吡喃香豆素。香豆素还可与糖结合形成香豆素苷。
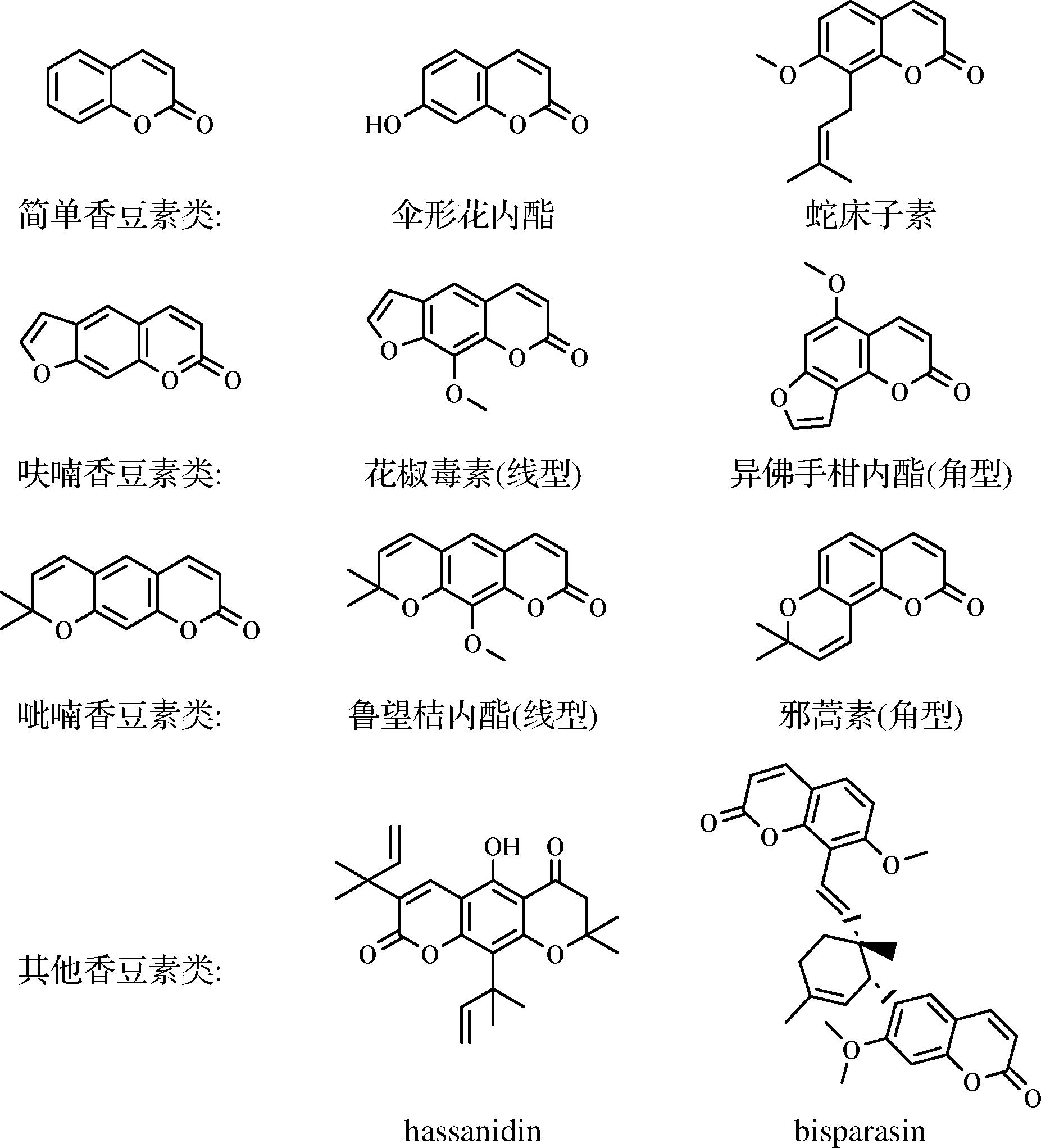
图1 柑橘香豆素的结构分类及示例
Fig.1 Structural categories and instance chemicals of citrus coumarins
香豆素母核上的常见取代基主要有羟基、甲氧基、异戊烯基、香叶基等,它们通过不同的修饰(如异戊烯基双键的环氧化、水合、邻羟基化等)、组合(如香叶氧基)以及不同位置和数量的取代,形成结构各异的香豆素。过往文献尚未对常见柑橘香豆素结构和分布特点作系统的归纳总结。本文统计了20余篇定性和定量分析柑橘香豆素的文献,研究品种涵盖橙类、宽皮柑橘、柚类、柠檬、枸橼、金柑、枳及其杂种,这其中分布较广的常见香豆素有30余种,它们的结构、分布和含量信息如表1所示。总体而言,简单香豆素在几乎所有柑橘大类中均有发现,呋喃香豆素在柚类、柠檬、枸橼、酸橙等类别中较多,吡喃香豆素多分布于部分宽皮柑橘和枸橼等品种中。不同品种果实中香豆素总量差异明显,柚类、酸橙、柠檬和枳含量高,宽皮柑橘次之,甜橙类较低,金柑含量极低[7]。不同组织部位香豆素含量也有很大差异,一般果皮远高于果肉,黄皮层远高于白皮层,根部和叶片也高于果肉[8]。此外,香豆素在不同柑橘品种中还具有高度特征性,HAN等[9]对158个柑橘果汁样品中的13种简单香豆素和16种呋喃香豆素进行了全面检测和组学分析,结合其他次生代谢产物构建判别模型,可应用于柑橘汁掺假检验。最后,不同发育阶段果实香豆素的含量及组分均有差异,幼果期香豆素含量最高,种类也较多,随着果实逐渐成熟,香豆素含量大幅降低,组分也趋于减少[8,10-11]。香豆素在柑橘植株尤其是果实生长发育过程中的时空分布变化规律仍有待进一步研究明确。
表1 常见柑橘香豆素类化合物的结构和分布
Table 1 Structure and distribution characteristics of common coumarin compounds in citrus plants
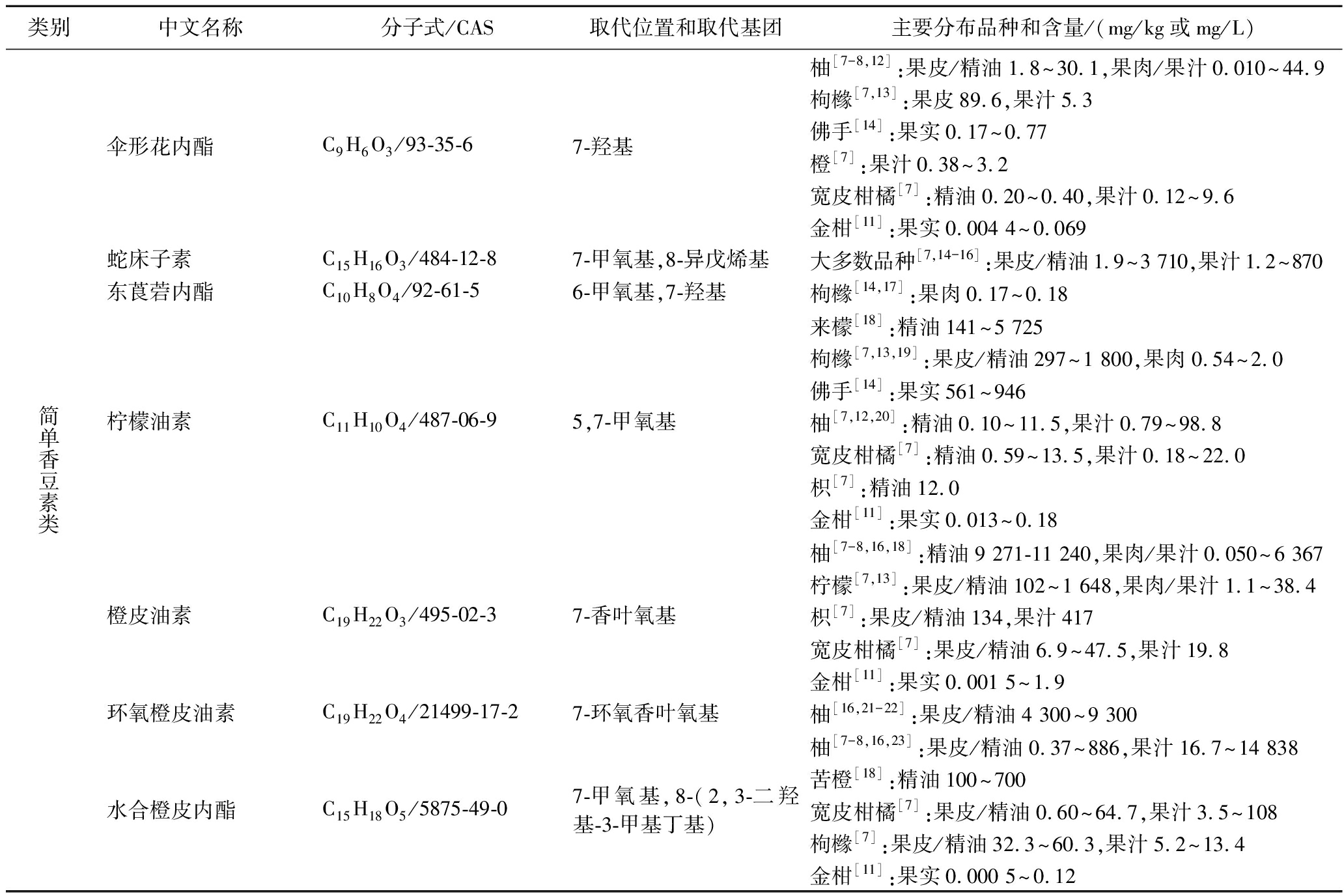
类别 中文名称分子式/CAS取代位置和取代基团主要分布品种和含量/(mg/kg或mg/L)简单香豆素类伞形花内酯C9H6O3/93-35-67-羟基柚[7-8,12]:果皮/精油1.8~30.1,果肉/果汁0.010~44.9枸橼[7,13]:果皮89.6,果汁5.3佛手[14]:果实0.17~0.77橙[7]:果汁0.38~3.2宽皮柑橘[7]:精油0.20~0.40,果汁0.12~9.6金柑[11]:果实0.004 4~0.069蛇床子素C15H16O3/484-12-87-甲氧基,8-异戊烯基大多数品种[7,14-16]:果皮/精油1.9~3 710,果汁1.2~870东莨菪内酯C10H8O4/92-61-56-甲氧基,7-羟基枸橼[14,17]:果肉0.17~0.18柠檬油素C11H10O4/487-06-95,7-甲氧基来檬[18]:精油141~5 725枸橼[7,13,19]:果皮/精油297~1 800,果肉0.54~2.0佛手[14]:果实561~946柚[7,12,20]:精油0.10~11.5,果汁0.79~98.8宽皮柑橘[7]:精油0.59~13.5,果汁0.18~22.0枳[7]:精油12.0金柑[11]:果实0.013~0.18橙皮油素C19H22O3/495-02-37-香叶氧基柚[7-8,16,18]:精油9 271-11 240,果肉/果汁0.050~6 367柠檬[7,13]:果皮/精油102~1 648,果肉/果汁1.1~38.4枳[7]:果皮/精油134,果汁417宽皮柑橘[7]:果皮/精油6.9~47.5,果汁19.8金柑[11]:果实0.001 5~1.9环氧橙皮油素C19H22O4/21499-17-27-环氧香叶氧基柚[16,21-22]:果皮/精油4 300~9 300水合橙皮内酯C15H18O5/5875-49-07-甲氧基,8-(2,3-二羟基-3-甲基丁基)柚[7-8,16,23]:果皮/精油0.37~886,果汁16.7~14 838苦橙[18]:精油100~700宽皮柑橘[7]:果皮/精油0.60~64.7,果汁3.5~108枸橼[7]:果皮/精油32.3~60.3,果汁5.2~13.4金柑[11]:果实0.000 5~0.12
续表1
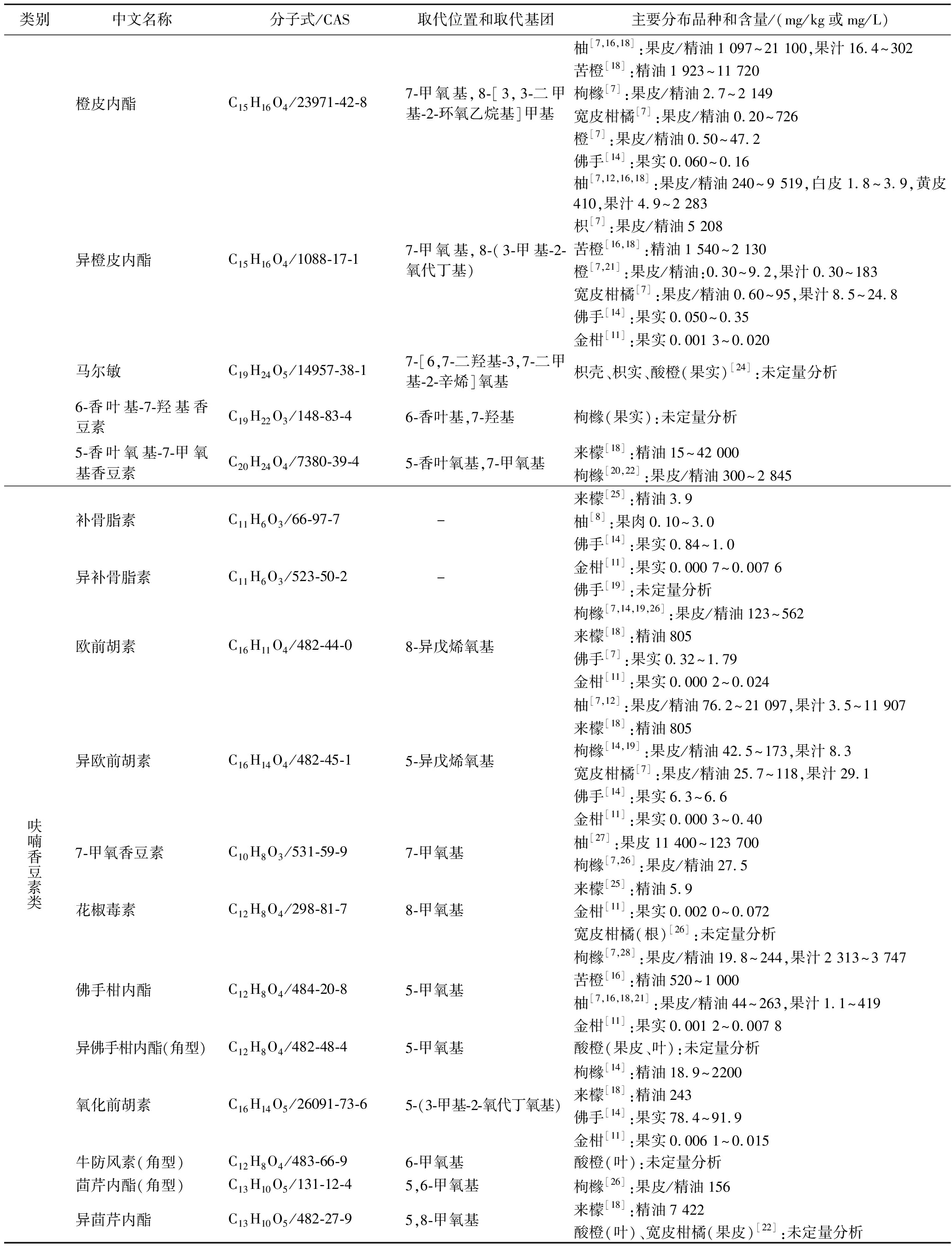
类别 中文名称分子式/CAS取代位置和取代基团主要分布品种和含量/(mg/kg或mg/L)橙皮内酯C15H16O4/23971-42-87-甲氧基,8-[3,3-二甲基-2-环氧乙烷基]甲基柚[7,16,18]:果皮/精油1 097~21 100,果汁16.4~302苦橙[18]:精油1 923~11 720枸橼[7]:果皮/精油2.7~2 149宽皮柑橘[7]:果皮/精油0.20~726橙[7]:果皮/精油0.50~47.2佛手[14]:果实0.060~0.16异橙皮内酯C15H16O4/1088-17-17-甲氧基,8-(3-甲基-2-氧代丁基)柚[7,12,16,18]:果皮/精油240~9 519,白皮1.8~3.9,黄皮410,果汁4.9~2 283枳[7]:果皮/精油5 208苦橙[16,18]:精油1 540~2 130橙[7,21]:果皮/精油:0.30~9.2,果汁0.30~183宽皮柑橘[7]:果皮/精油0.60~95,果汁8.5~24.8佛手[14]:果实0.050~0.35金柑[11]:果实0.001 3~0.020马尔敏C19H24O5/14957-38-17-[6,7-二羟基-3,7-二甲基-2-辛烯]氧基枳壳、枳实、酸橙(果实)[24]:未定量分析6-香叶基-7-羟基香豆素C19H22O3/148-83-46-香叶基,7-羟基枸橼(果实):未定量分析5-香叶氧基-7-甲氧基香豆素C20H24O4/7380-39-45-香叶氧基,7-甲氧基来檬[18]:精油15~42 000枸橼[20,22]:果皮/精油300~2 845呋喃香豆素类补骨脂素C11H6O3/66-97-7 -来檬[25]:精油3.9柚[8]:果肉0.10~3.0佛手[14]:果实0.84~1.0异补骨脂素C11H6O3/523-50-2 -金柑[11]:果实0.000 7~0.007 6佛手[19]:未定量分析欧前胡素C16H11O4/482-44-08-异戊烯氧基枸橼[7,14,19,26]:果皮/精油123~562来檬[18]:精油805佛手[7]:果实0.32~1.79金柑[11]:果实0.000 2~0.024异欧前胡素C16H14O4/482-45-15-异戊烯氧基柚[7,12]:果皮/精油76.2~21 097,果汁3.5~11 907来檬[18]:精油805枸橼[14,19]:果皮/精油42.5~173,果汁8.3宽皮柑橘[7]:果皮/精油25.7~118,果汁29.1佛手[14]:果实6.3~6.6金柑[11]:果实0.000 3~0.407-甲氧香豆素C10H8O3/531-59-97-甲氧基柚[27]:果皮11 400~123 700枸橼[7,26]:果皮/精油27.5花椒毒素C12H8O4/298-81-78-甲氧基来檬[25]:精油5.9金柑[11]:果实0.002 0~0.072宽皮柑橘(根)[26]:未定量分析佛手柑内酯C12H8O4/484-20-85-甲氧基枸橼[7,28]:果皮/精油19.8~244,果汁2 313~3 747苦橙[16]:精油520~1 000柚[7,16,18,21]:果皮/精油44~263,果汁1.1~419金柑[11]:果实0.001 2~0.007 8异佛手柑内酯(角型)C12H8O4/482-48-45-甲氧基酸橙(果皮、叶):未定量分析氧化前胡素C16H14O5/26091-73-65-(3-甲基-2-氧代丁氧基)枸橼[14]:精油18.9~2200来檬[18]:精油243佛手[14]:果实78.4~91.9金柑[11]:果实0.006 1~0.015牛防风素(角型)C12H8O4/483-66-96-甲氧基酸橙(叶):未定量分析茴芹内酯(角型)C13H10O5/131-12-45,6-甲氧基枸橼[26]:果皮/精油156异茴芹内酯C13H10O5/482-27-95,8-甲氧基来檬[18]:精油7 422酸橙(叶)、宽皮柑橘(果皮)[22]:未定量分析
续表1

类别 中文名称分子式/CAS取代位置和取代基团主要分布品种和含量/(mg/kg或mg/L)白当归素C17H18O7/482-25-75-甲氧基,8-(2,3-二羟基-3-甲基丁氧基)枸橼[19,26]:果皮/精油70~706珊瑚菜素C17H16O5/2543-94-45-甲氧基,8-异戊烯氧基佛手[14]:果实2.5~18.6金柑[11]:果实0.001 2~0.002 6异紫花前胡内酯C14H14O4/13849-08-67-(2-羟基-2-丙基)佛手[14]:果实0.12~0.17金柑[11]:果实0.004 1~0.013环氧佛手柑素C21H22O5/206978-14-55-环氧香叶氧基柚[16,21,26]:果皮/精油1 732~11 260苦橙[18]:精油592~3 280佛手柑素C21H22O4/7380-40-75-香叶氧基来檬[18]:精油950~45 699枸橼[29]:果皮/精油1 000~4 056柚[5,7-8,16,18,26]:果皮/精油76.8~2 000,果汁3.74~6 367苦橙[26]:精油112吡喃香豆素类花椒内酯C14H12O3/553-19-5 -大多数品种的根皮:未定量分析邪蒿素(角型)C14H12O3/523-59-1 -宽皮柑橘(根)、酸橙(根):未定量分析美花椒内酯C15H14O4/84-99-15-甲氧基枸橼(根):未定量分析鲁望桔内酯nC15H14O4/483-92-18-甲氧基宽皮柑橘(精油):未定量分析
注:-表示无数据。
柑橘香豆素的含氧杂环母核及其多样化的取代修饰结构,能够与生物体的活性或调控位点产生诸如疏水、配位、π-π堆叠等非共价相互作用,使之具有多种生物活性,因而具备开发利用的价值。目前香豆素大都仍从植物体中提取,总体上看得率低、成本高,因而明确其分布特点对于选择含量富集的品种和组织部位作为提取原料、实现降本增效具有重要的意义。作为次生代谢产物,香豆素的生物合成受环境因素影响较大,与之相关的柑橘功能基因乃至其时空表达调控机制仍有待探索。如能完全解析柑橘香豆素合成途径中的关键基因、明确其影响因素、实现其时空表达的精准调控,使产量巨大的柑橘成为“植物工厂”,必将从根本上促进柑橘香豆素类物质的大规模生产,进而极大推进其功能性产品开发和应用。
2 柑橘香豆素的提取、分离和分析
2.1 提取和纯化方法
提取方法直接影响柑橘香豆素的得率和生物活性,分离纯化将粗提混合物中的目标物质尽量分纯,两者共同组成了样品前处理工序,为后续研究和开发应用提供基础和便利条件。与众多小分子天然产物前处理方法类似,柑橘香豆素提取和纯化的常规方法为溶剂提取和色谱纯化。溶剂提取法根据物质在不同溶剂中的溶解度不同,选用目标成分易溶且其他成分不易溶的溶剂或其组合,将目标物萃取溶出。常用溶剂有水、甲醇、乙醇和其他中等极性的有机溶剂,常规手段有浸渍、煎煮、渗漉、回流等。溶剂提取操作简单、成本低,但存在耗时长、提取率低、杂质含量高以及溶剂残留等问题。色谱纯化法最常使用分配柱层析,利用提取物中各组分在固定相和流动相中分配系数不同,经多次反复分配将组分分开,从而收集得到目标物质。该方法需反复操作且分离能力有限,常需结合分子筛、离子交换等其他手段。基于经典固-液分配色谱原理,上世纪80年代又发展出一种连续高效的液-液分配色谱——高速逆流色谱,适合复杂天然产物的分离制备,特别适用于结构和性质高度相似化合物的有效分离。近年来新型溶剂和协同辅助提取以及特异性纯化等新技术得以广泛应用,进一步提升天然香豆素的获取效率。现将柑橘香豆素各类前处理方法及其特点比较呈现,如表2所示,并就其中代表性进展做简要介绍。
表2 柑橘香豆素类化合物提取、分离和纯化方法比较
Table 2 Comparison of extraction, separation and purification methods for citrus coumarins

方法目标香豆素效率指标优点缺点溶剂提取5-香叶氧基-7-甲氧基香豆素[20]、佛手柑内酯等4种[25]回收率75.0%~86.5%经典提取方法,操作简单、成本低提取时间长、提取率低、溶剂用量大残留多超临界流体萃取欧前胡素、橙皮内酯、水合橙皮内酯[30]提取率18.0%~84.0%CO2超临界流体脂溶性强、扩散性能好、条件温和、无毒无残留、可添加夹带剂提高极性、扩大提取范围极性物质提取率低、夹带剂选择面窄、设备昂贵、能耗较高双水相提取蛇床子素[31]、蟛蜞菊内酯[32]提取率98.2%得率0.67%操作条件温和、可连续化操作、回收效率高、具有一定的选择性双水相体系易乳化超声波辅助萃取5, 7-二甲氧基香豆素[33]、7-甲氧基香豆素等4种[27]回收率90.4%~98.5%因超声热效应无需额外加热供能、节省时间、节约溶剂、提取率高超声波衰减、存在空白场域、设备不易大型化、提取量小微波辅助萃取7-异戊烯基香豆素、橙皮油素[34]得率0.014%~0.054%提取率高、试剂少、绿色环保、节能省时微波处理具有一定选择性、不适合热敏性易挥发物质的提取压力辅助溶剂萃取东莨菪内酯、佛手柑素等6种[35]回收率95.1%~104.9%高压下溶剂扩散和渗透性好、萃取效率高、有机溶剂用量少不适合热敏性物质的提取柱色谱分离佛手柑素[5]纯度44.8%经典的天然产物分离纯化方法,操作简单、适用范围广得率低、重现性差高速逆流色谱佛手柑素[5]、橙皮内酯、异橙皮内酯、水合橙皮内酯[36]纯度92.4%~98.5%分离效率高、无死吸附现象,样品损失少溶剂体系的选择依据还未完全建立特异性分子印迹6, 7-二羟基香豆[37]、7-氨基-4-甲基香豆素[38]分配系数Kd:2.36~107.8选择系数K:1~4.69成分特定选择性、提取效率高、绿色环保适用于小分子物质、局限于实验室分离
注:分子印迹方法中,分配系数Kd值大,表示聚合物对底物的结合量大,选择性系数K值越大,表示聚合物对底物的选择性越好。
2.1.1 新型溶剂提取分离法
超临界流体萃取和色谱(supercritical fluid extraction/chromatography,SFE/SFC)技术是利用超临界流体作溶剂从液体或固态样品中萃取和分离目标组分的方法,最常用的超临界流体为CO2,具有溶解性强、扩散性能好、条件温和、无毒无残留、价廉可循环等优势。TENG等[30]对超临界二氧化碳萃取柑橘果皮香豆素如欧前胡素、橙皮内酯和水合橙皮内酯的效率进行了研究,在萃取温度/压力为50 ℃/27.6 MPa条件下,3个物质的提取率分别为84%、76%和18%。但此技术所用设备较昂贵,且不适合极性强的如香豆素苷等的分离。
双水相提取(aqueous two-phase extraction,ATPE)是一种利用化合物在2种互不相溶的水相间选择性分配从而同时实现目标物质的提取和初步纯化的技术,其典型体系如有机溶剂-盐系统具有廉价、相对环境友好、传质-平衡迅速和回收效率高等特点,因而在天然产物提取分离上得以快速推广。应用于香豆素提取方面,谢玲等[31]将非离子表面活性剂TritonX-114和(NH4)2SO4构成的双水相体系用于蛇床子素提取分离,其最大萃取率达到98.2%。GHARAT等[32]采用响应面法优化双水相提取旱莲草中蟛蜞菊内酯的工艺参数,结果表明,在最优工艺参数下最大得率为0.673%。
2.1.2 超声波、微波及压力辅助萃取法
超声能通过高频振动产生的多级效应帮助组织和细胞内容物在溶剂中溶解;微波则通过诱导分子旋转和振动产生热能加速物质扩散和溶解。压力辅助溶剂萃取法,也称加速溶剂萃取,是在较高的温度和压力下用有机溶剂萃取固体或半固体的方法。与传统溶剂提取法相比,超声、微波和压力辅助萃取法具有耗时耗能少和提取率高等优点。高幼衡等[33]采用超声辅助提取广佛手5, 7-二甲氧基香豆素,分别以甲醇、95%乙醇、乙酸乙酯为提取溶剂,对提取时间和溶剂用量进行了考察;结果表明,乙酸乙酯超声提取3次,每次15 min,可完全提取5, 7-二甲氧基香豆素,且杂质干扰少。GENOVESE等[34]以乙醇为萃取溶剂分别结合微波和超声辅助萃取7-异戊烯基香豆素和橙皮油素,结果显示微波提取得率为0.143 mg/g和0.535 mg/g,超声提取得率为0.168 mg/g和0.649 mg/g。CHU等[35]采用加速溶剂萃取法从佛手中提取香豆素类物质,甲醇为萃取溶剂,在90 ℃、压力10.342 1 MPa下,5 min内得到东莨菪内酯、异莨菪亭、7-羟基香豆素、6, 7-二甲氧基香豆素、5, 7-二甲氧基香豆素、佛手柑素等6种香豆素类物质,回收率为95.1%~104.9%。各类辅助提取均存在机理还未完全明确的问题,即目标物质受超声场、微波场以及压力作用的分子行为还有待解析;由于场能不均造成的局部高温、高能等因素也可能会对目标提取物产生影响。除上述辅助提取方法外,酶辅助法提取柑橘果胶和类黄酮的技术已经成熟,但未见用于香豆素的提取报道。农业农村部西南大学柑桔加工综合利用集成科研基地已建成完整的酶解-超声辅助-逆流提取中试科研生产线,未来将在多技术联合提取柑橘香豆素方面积极开展研究攻关和应用推广。
2.1.3 特异性分子印迹法
分子印迹聚合物具有特定的记忆功能,对模板分子具有强亲和力和高选择性,在生物、环境、食品、医药等领域显示出良好的应用前景。王惠芸等[38]合成了模板为7-氨基-4-甲基香豆素、支撑介质为聚偏氟乙烯微孔滤膜的分子印迹膜,采用荧光光度法验证了该印迹膜对模板分子具有良好的识别功能。钟海艺等[37]以6, 7-二羟基香豆素为模板分子、纳米SiO2为表面载体、丙烯酰胺为功能单体,二甲基丙烯酸乙二醇酯为交联剂,引入温敏单体N-异丙基丙烯酰胺,合成了具二羟基香豆素特异性吸附能力的温敏表面分子印迹聚合物。分子印迹研究对天然香豆素的提取检测提供了新思路和新方法,拥有重大发展潜力。
提取、分离和纯化技术是大规模生产制备柑橘香豆素的基础。传统方法和新技术都存在各自的优势和局限性,新技术通常具有更高的效率、更好的选择性,对环境也更友好,但受限于成本、技术成熟度等因素,尚未形成产业规模化。为更有效地开发和利用我国丰富的柑橘香豆素资源,需关注以下几个方面:首先,重点发展与传统方法适配的辅助提取技术,深入研究超声、微波等辅助提取的机理和工艺条件,研发安全高效、成熟稳定、广泛适用的工业化配套装备。其次,针对不同的品种资源、组织原料和目标物质,研究其最适的提取纯化组合方案,例如,水溶性香豆素苷可采用酶解-超声辅助-热水逆流提取-超滤-结晶-层析纯化的技术组合,而对于热稳定性强、极性低的香豆素,可采用压力和微波辅助-超临界流体萃取分离-重结晶等组合,并进一步在中试和生产放大环节优化技术参数,从而形成基于目标的、可定制调整的成套体系。最后,继续加强新理论、新技术、新材料等基础研发工作,推进技术成熟和更新迭代。
2.2 香豆素的分析方法
柑橘等植物性样品成分非常复杂,即使经过前处理,所得试样通常仍是混合物,需将各目标香豆素类物质和杂质之间进行有效分离,才能进一步分析鉴定。为此,一系列分离-分析检测联用设备和技术方法应需而生,其主流分析方法为色谱-波谱联用,将分析色谱强大的分离能力和现代波谱分析技术对分子质量和结构的精确测定充分结合,实现快速、灵敏、准确的定性和定量分析。
香豆素类物质具有中等到较弱极性,因此在分析前端最常用到反相高效液相色谱(high performance liquid chromatography, HPLC)和超高效液相色谱(ultra performance liquid chromatography, UPLC)进行分离。与之联用的后端分析方法和设备主要有紫外-可见光谱(如二极管阵列检测器photodiode array detector, PDA或DAD)、荧光激发-发射光谱(荧光检测器fluorescence detector, FLD)、质量谱(质谱检测器mass spectrometry detector, MSD)以及核磁共振谱(如1H-/13C-nuclear magnetic resonance spectroscopy, NMR)等,而红外光谱仪因溶剂影响和接口限制等原因与液相色谱在线联用技术尚不成熟。已有大量HPLC-PDA/MS联用分析柑橘香豆素的报道,如:RUSSO等[39]采用HPLC-PDA和同时配备ESI和APCI离子源的MS联用分析柠檬加工副产物中的生物活性成分,从中鉴定出7个香豆素物质并对其中的3个进行了精确定量;郝元元[27]通过多反应监测(multiple reaction monitoring, MRM)模式,建立了LC-MS/MS同时检测柚皮中8种香豆素及其衍生物的分析方法。SETZER等[40]同时利用LC-NMR和LC-MS,对芸香科Stauranthus perforates Liebm.树皮二氯甲烷提取物的细胞毒性组分作定性分析,鉴定出白芷属脑、花椒毒素、异茴芹素、独活素、白当归脑和欧前胡素共6个线型呋喃香豆素。HAN等[9]建立了HPLC-PDA-FLD联用分析法,采用紫外吸收和荧光发射双光谱相似度比对并结合液相色谱保留指数,对柑橘果汁样品中的39种含氧杂环类物质(包含29个香豆素类成分)实现了完全色谱分离以及准确的定性和定量分析。
近年来,一些新技术逐步开发成熟并实现商品化应用,使得前端分离性能进一步提升。LC-LC联用,亦称二维液相色谱(2D-LC)或多维液相色谱(multidimensional liquid chromatography, MDLC),采用先进接口切换技术将不同分离性能的色谱柱链接起来,特别适合从复杂混合体系中分离找出一维模式难以发现的共流出组分。MDLC常用2种分离模式:a)中心切割模式,即将前级色谱中某部分传递到后级色谱中继续分离;b)全二维(LC×LC)模式,即通过接口将前级色谱中的全部组分连续传递到后级色谱中分离。DUGO等[41]采用正相MDLC中心切割模式分离柑橘精油中的香豆素对映异构体,其中一维柱为微粒硅胶填料,二维柱为纤维素基手性填料,流动相为正己烷和异丙醇,在线检测器为PDA。结果显示,该方法能够分离取代基上含有手性碳原子的柑橘香豆素对映异构体并实现在线分析,相比传统制备-离线分析的方法,具有大幅缩短时间和节省溶剂用量的优势。
超高效合相色谱(ultra performance convergence chromatography, UPC2)是在二氧化碳超临界流体色谱基础上应用UPLC硬件开发的新技术。合相色谱采用CO2为流动相,通过与其他有机溶剂互溶,其洗脱范围含盖从强极性到弱极性的宽广区间,同时兼容正相和反相色谱固定相,还具有超快速、低成本和安全环保的特性,尤其适合高通量组学全谱分析和手性化合物分析。KIM等[42]使用配有CSH-Fluoro-Phenyl(2.1 mm×150 mm, 1.7 μm)色谱柱的Acquity UPC2-PDA系统,检测朝鲜当归中的质量标志物紫花前胡醇当归酯和紫花前胡素(吡喃香豆素类),显示出更高的分辨率和更短的分析时间,其运行时间仅需4 min。
此外,部分半挥发性香豆素类物质可通过气相色谱(gas chromatography, GC)联用技术予以分析,如与质谱、核磁共振、傅里叶变换红外光谱等联用。理论上只要香豆素沸点低于GC毛细管柱的最高耐受温度即可;实际操作中,考虑高温下的柱流失、香豆素降解和异构化等因素,柱箱最高温度设置常低于300 ℃,因此该方法只适用于小部分沸点较低的香豆素。GYAWALI等[43]采用GC-MS分析了柚子果皮和果肉的超临界CO2提取物,共鉴定出69种成分,其中7-甲氧基-8-(2-氧代-3-甲基丁基)香豆素峰面积占果皮总物质的11.4%。
当前,大型先进仪器资源越来越丰富,质谱等设备已趋常规化,但费用昂贵、操作复杂、耗时长、对样品前处理要求高、人员配置要求高等限制因素仍然存在。柑橘香豆素类化合物种类繁多、结构复杂,存在多种性质相近的同分异构体,且含量大多为微量甚至痕量水平,商品化标准对照物质也还比较缺乏,这些因素都给分析检测带来了很大的挑战。此外,仪器生成的巨量数据,也需要更高效、便捷的处理工具,以确保快速准确地获取分析结果。未来研究中,在开发更先进的分析技术和硬件装备的同时,也需同步研发更智能的数据处理软件,以提升数据挖掘分析和信息处理判断能力。
3 柑橘香豆素的生物活性
柑橘是我国传统医学常用药。橘皮(陈皮)最早以“橘柚”之名载于《神农本草经》:“味辛温。主胸中瘕热逆气,利水谷。久服去臭,下气通神。”《滇南本草》首载“佛手柑”(佛手)一药:“佛手柑气味辛、甘、平、无毒……可化痰、清火、延年。”此外,常见柑橘属药材还有枳壳、枳实、橘红、橘络、青皮等,具有顺气、止咳、健胃、化痰、消肿、止痛、疏肝理气等多种功效。香豆素是本属植物的重要成分,也是其生物活性的主要物质基础。现代研究发现,柑橘香豆素具有抗氧化、抗炎、抗肿瘤、抗菌及多方面保护作用,其中大量研究围绕橙皮油素、橙皮内酯衍生物以及佛手柑素等成分展开,其活性作用机制简要归纳如图2所示,并在下文予以概述。
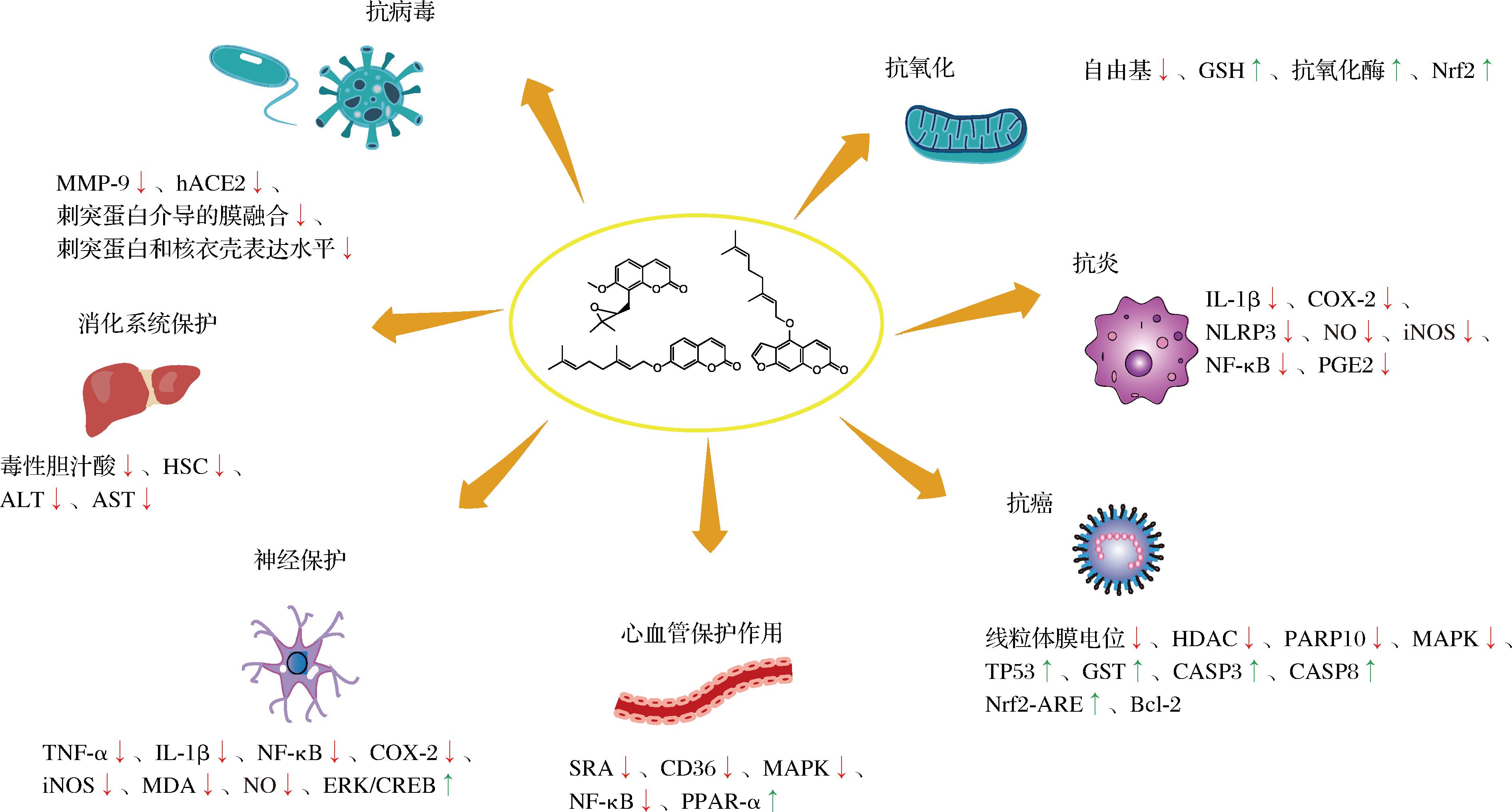
图2 柑橘香豆素的生物活性及作用机制
Fig.2 The biological activities and mechanisms of citrus coumarins
注:MMP-9:基质金属蛋白酶9(matrix metalloproteinase-9);HSC:肝星状细胞(hepatic stellate cell);ERK-CREB:细胞外调节蛋白激酶(extracellular regulated protein kinases)-环磷腺苷效应元件结合蛋白(cAMP response element binding protein);Nrf2:核红细胞2相关因子2(Nuclear factor erythroid-2 related factor2);Nrf2-AER:核红细胞2相关因子2(nuclear factor erythroid-2 related factor2)-抗氧化应答元件(antioxidant response element);HDAC:组蛋白去乙酰化酶(histone deacetylase);TP53:肿瘤抑制蛋白p53(tumor protein p53);图中箭头表示含量升高或降低。
3.1 抗氧化及抗炎症作用
体外和体内研究表明柑橘香豆素具有显著的抗氧化活性。柚子冷榨精油具有较好的体外抗氧化能力和清除自由基的长效活性[44],其中橙皮内酯、氧化前胡素、环氧橙皮油素、环氧佛手柑素等具有环氧取代基的香豆素被认为与该作用密切相关。KIM等[45]发现橙皮油素对排卵后老化的卵母细胞具有积极的保护作用,能激活控制Nrf2途径的抗氧化活性,通过减少自由基,提高谷胱甘肽(glutathione, GSH)的水平,增强抗氧化酶的活性,起到抗氧化的作用。
炎症反应与氧化应激密切相关,核因子-κB(nuclear factor-kappa B, NF-κB)则是机体内联系炎症反应和氧化应激通路的关键蛋白。柑橘香豆素类成分的抗炎症机制主要体现为抑制炎症相关信号通路NF-κB的激活、降低机体炎症介质前列腺素E2(prostaglandin E2, PGE2)和白细胞介素-1β(interleukine-1β, IL-1β)等细胞因子的表达,如:佛手柑内酯可通过降低细胞因子IL-6和肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的表达,抑制PGE2、IL-1β、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、一氧化氮(NO)和环氧合酶2(cyclooxygenase-2, COX-2)的活性,缓解脂多糖诱导的细胞炎症反应[46]。不仅如此,佛手柑内酯还可降低乙酸诱导的结肠炎小鼠炎症因子升高水平,保护结肠形态,降低肥大细胞脱颗粒率[28]。橙皮油素能通过抑制小胶质细胞活化及降低海马中COX-2的表达改善脂多糖诱导的小鼠脑缺血性炎症[47]。除此之外,柑橘香豆素中的异栓翅芹醇和花椒毒酚也有很好的抗炎作用:前者可降低脂多糖诱导的巨噬细胞RAW 264.7中NO、iNOS、COX-2及促炎因子IL-1β的释放[48];后者能抑制NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)活化进而抑制NF-κB信号通路激活,缓解骨关节炎症[49]。
3.2 抗癌活性
柑橘香豆素在预防结直肠癌、肾细胞癌、肺癌、肝癌等多项研究中均表现出显著的抗癌活性,其作用机制包括诱导癌细胞凋亡、阻滞细胞分裂周期、抑制癌细胞增殖和迁移等。佛手柑素能显著性抑制体外培养的人肝癌细胞HepG2、早幼粒白血病细胞HL-60和人胃癌细胞BGC-823的增殖活性[5],还能通过阻滞细胞周期G2/M及抑制细胞的迁移和侵袭作用降低肺癌细胞A549线粒体的膜电位,起到促进癌细胞凋亡的作用[29]。橙皮油素可通过抑制小鼠结肠癌细胞CT26的增殖和迁移促进癌细胞的凋亡[50],通过抑制聚(ADP-核糖)聚合酶10(poly ADP-ribose polymerase10, PARP10)的表达抑制人结肠癌细胞HCT116的活性[51],还可激活小鼠体内的Nrf2-ARE氧化通路,增加小鼠肝脏胞质谷胱甘肽S-转移酶(glutathione S-transferase, GST)的活性,从而降低小鼠肝癌的发生率[52]。其他柑橘香豆素,如5-香叶氧基-7-甲氧基香豆素,可以将细胞阻滞在G0/G1期,激活肿瘤抑制因子p53、胱天蛋白酶3(caspase-3, CASP3)、CASP8、B细胞淋巴瘤-2(B-cell lymphoma-2, Bcl-2)家族的相关基因,同时抑制p38丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)磷酸化,进而抑制人结肠癌细胞SW-480的活性[20]。
3.3 对心血脑管的作用
柑橘香豆素对心血管系统具有降低血压水平、抑制胆固醇摄入、改善脂质和葡萄糖代谢异常和炎症反应等有益作用。研究发现,橙皮油素不仅能激活过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor-α, PPAR-α),缓解苯肾上腺素诱导的心肌肥大导致的心力衰竭,还可通过控制小鼠细胞中三酰基甘油和游离脂肪酸的积累、减小脂肪细胞的体积及抑制空腹血糖的升高来改善由高糖脂饮食引起的代谢紊乱,起到缓解心血管疾病的作用[53]。对小鼠巨噬细胞系RAW 264.7研究表明,酸橙花中提取的佛手酚可阻断由脂多糖诱导的MAPK信号通路传导并抑制NF-κB激活,降低氧化低密度脂蛋白诱导的类固醇受体RNA激活因子(steroid receptor RNA activator, SRA)和白细胞分化抗原36(cluster of differentiation 36, CD36)依赖的胆固醇摄取,即同时干预炎症异常激活和脂质积累等关键诱发因素,减缓对动脉粥样硬化起关键作用的泡沫细胞的形成[6]。
3.4 对神经和精神类疾病的干预作用
持续的氧化应激和慢性炎症是抑郁症和其他精神类疾病的潜在作用机制,而柑橘香豆素有良好的体内外抗炎和抗氧化作用,因而具有缓解此类疾病的潜力。这其中对橙皮油素的研究最为深入。AMINI-KHOEI等[1]发现橙皮油素通过降低小鼠海马体和血清NO水平、血清丙二醛(malondialdehyde, MDA)水平以及提高抗氧化能力发挥抗抑郁作用。对双侧颈总动脉结扎导致的脑缺血痴呆大鼠使用橙皮油素干预,发现其脑组织病理损伤有所减轻,皮层和海马组织中MDA水平降低,GSH表达增加,学习和记忆能力得到改善[2]。FURUKAWA等[54]发现,橙皮油素可通过抑制小鼠小胶质细胞过度激活、海马星形胶质细胞中COX-2表达及脑黑质中多巴胺神经元细胞的死亡等途径发挥神经保护作用,并进一步研究了富含橙皮油素的河内晩柑(Citrus kawachiensis)果汁对人认知能力的影响。结果表明,富含橙皮油素的柑橘汁能够减缓老年人认知能力的下降,其作用达到显著水平。2018年日本消费者厅批准将富含橙皮油素的河内晩柑汁列入“功能性声明食品”名录。然而,除此之外尚未见其他关于橙皮油素临床研究及其商品应用的报道。
3.5 对消化系统的保护作用
柑橘香豆素还对胃肠道动力不足导致的消化系统疾病有良好的缓解作用。水合橙皮内酯可通过对H1组胺受体的拮抗作用促进胃肠运动,进而改善由顺铂诱导的大鼠胃排空延迟[55]。橙皮油素可以调节乙酰胆碱酯酶的活性促进小肠蠕动,减少小鼠体内毒性胆汁酸分泌、抑制肝星状细胞活化和炎症反应,从而缓解硫代乙酰胺诱导的小鼠肝纤维化[56]。TIAN等[57]研究表明耧斗菜苷(columbianoside)和水合橙皮内酯能抑制谷丙氨酸转氨酶(alanine transaminase, ALT)和天冬氨酸转氨酶(aspartate transaminase, AST)的活性进而表现出对肝脏的保护作用。消化系统疾病乃至很多慢性病都与肠道菌群和代谢失衡有关,柑橘香豆素对肠道微生态的作用还有待进一步研究。
3.6 其他活性作用
除上述功能外,柑橘香豆素常因其抗病毒活性、光敏性、抗贫血能力及骨骼保护等作用而广受关注。柑橘香豆素可通过抑制宿主细胞酶活性、降低蛋白表达及阻断病毒生命周期等作用发挥抗病毒作用。报道显示,佛手柑素能通过抑制刺突蛋白介导的膜融合及抑制人血管紧张素转换酶2(human angiotensin-convertingenzyme2, hACE2)的表达,干扰严重急性呼吸综合征冠状病毒2型的复制、成熟和释放,发挥抗病毒作用[4]。通过分子对接研究发现,水合氧化前胡素或可抑制新冠病毒关键蛋白3-糜蛋白酶样蛋白酶(3-chymotrypsin-like protease, 3CLpro)的活性,是治疗新型冠状病毒肺炎的潜在研究对象[58]。FENG等[3]发现从枳实茎皮中提取的anisocoumarin B、邪蒿素、5, 7-二甲氧基香豆素、花椒内酯等柑橘香豆素也具有抗HIV-1病毒的活性。呋喃香豆素是一种天然光敏剂,能增强各波段光吸收,从而增加生物体对紫外线的敏感性。花椒毒酚是呋喃香豆素中典型的强光敏活性物质,可用于临床治疗银屑病、白癜风和其他皮肤病[17]。GUERRINI等[59]证实柠檬油素和佛手柑内酯能够诱导人慢性髓系白血病细胞K562的红系分化,提高胞内γ-珠蛋白基因的表达,还能增加早期红系祖细胞BFU-E中胎儿型血红蛋白的含量,从而可用于β-地中海贫血和镰状细胞贫血的辅助治疗。有研究发现,佛手柑内酯能通过诱导破骨细胞及巨噬细胞RAW264.7的凋亡在体外阻止由脂多糖诱导的破骨细胞形成和骨吸收作用[60];还能抑制NF-κB、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和蛋白激酶B(protein kinase B, AKT)/雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路激活,保护骨小梁并减少破骨细胞分化,缓解由高脂肪饮食诱导的小鼠糖尿病骨质疏松[61]。除对动物体的功能性作用外,柑橘香豆素对植物病害也有一定的抗病效果。蛇床子素、东莨菪内酯和异补骨脂素对柑桔炭疽菌有抑制作用,且简单香豆素类抑制真菌的活性强于呋喃香豆素类[62]。
4 结语与展望
柑橘鲜果和加工产品消费面广,具有丰富的营养和保健价值。作为中药材,在临床方剂及现代中成药中应用广泛。其食药同源功效和现代药理作用广泛且显著,逐渐受到国内外研究者关注。近年来,国内外学者对柑橘天然产物及其活性作用研究愈发深入,随着高效、高分辨率和灵敏度的分析检测技术和方法的发展,大量柑橘香豆素类化合物被发现和鉴定,为其化学物质基础、功能活性及作用机制的研究提供了丰富的资源和坚实的基础。
本文综述了近年来研究柑橘香豆素类化合物的结构和分布特点、提取分析技术方法及其生物活性等方面的文献报道和进展。文中系统整理了30余种常见柑橘香豆素的结构和取代特征,归纳简述了它们在不同柑橘品种和组织中的分布特点,总结了橙皮油素、橙皮内酯、佛手柑素及其衍生物等代表成分的活性作用和机制。
香豆素的构成和含量在不同柑橘品种、砧穗组合、组织部位、环境条件及发育阶段均有差异,其多样性乃至精细时空分布规律还有待研究,其复杂的合成路径和调控机制尚未充分解析。柑橘香豆素化学成分复杂、结构类型多样、含量差异巨大,这就导致了提取和分离难度的增加;为实现柑橘精深加工、开发香豆素功能产品,建立更为高效的分离纯化技术工艺显得尤为重要。柑橘香豆素及其衍生物在计算模拟分析、体外细胞、实验动物体内乃至临床研究中展现出广泛的生物活性和作用潜力,这方面的工作方兴未艾,还有待深入研究:a)全面活性评价:当前的研究和开发主要集中在常见简单香豆素和线型呋喃香豆素,还有大量的资源没有被评价和利用,更多的功能活性如免疫调节等还未展开研究。利用计算机及人工智能辅助的高通量活性虚拟筛选技术可极大提升初期的工作效率。b)活性机制研究:柑橘香豆素生物活性涉及多种途径和靶点,口服摄入还可能影响肠道微生态和代谢组,与生物体产生更复杂的联系。对其的系统性研究还处于起步阶段,需利用现代分子生物学技术和多组学手段,全面揭示柑橘香豆素的活性机制和信号通路。同时,需深入研究其结构-活性关系,针对关键靶点筛选出高活性的目标成分,指导高价值产品的研发。c)相互作用和安全性:不同香豆素间能否产生协同、拮抗等相互作用,与其他活性物质或药物是否相互影响,以及潜在的安全风险和毒副作用尚未得到充分的评估。虽然佛手柑素等部分呋喃香豆素已被证实可抑制细胞色素P450酶系、影响治疗心血管疾病的药物代谢、或造成严重的安全隐患,但更多的柑橘香豆素还有待全面开展毒性、安全性和相互作用评价。d)公共卫生与临床研究:目前鲜有相关的人群健康研究和临床试验报告,且这些试验的样本量较小、研究期限较短,仍处于初级阶段。因此,在已确立有效性和安全性的基础上,需逐步开展更多的包括临床干预在内的人群纵贯性研究,以验证柑橘香豆素的人体功效。
[1] AMINI-KHOEI H, BOROUJENI S N, MAGHSOUDI F, et al. Possible involvement of L-arginine-nitric oxide pathway in the antidepressant activity of Auraptene in mice[J]. Behavioral and Brain Functions: BBF, 2022, 18(1):4.
[2] GHANBARABADI M, IRANSHAHI M, AMOUEIAN S, et al. Neuroprotective and memory enhancing effects of auraptene in a rat model of vascular dementia: Experimental study and histopathological evaluation[J]. Neuroscience Letters, 2016, 623:13-21.
[3] FENG T, WANG R R, CAI X H, et al. Anti-human immunodeficiency virus-1 constituents of the bark of Poncirus trifoliata[J]. Chemical &Pharmaceutical Bulletin, 2010, 58(7):971-975.
[4] ZHOU M M, LIU Y, CAO J Y, et al. Bergamottin, a bioactive component of bergamot, inhibits SARS-CoV-2 infection in golden Syrian hamsters[J]. Antiviral Research, 2022, 204:105365.
[5] LIU Y L, REN C H, CAO Y L, et al. Characterization and purification of bergamottin from Citrus grandis (L.) Osbeck cv. Yongjiazaoxiangyou and its antiproliferative activity and effect on glucose consumption in HepG2 cells[J]. Molecules, 2017, 22(7):1227.
[6] SHEN C Y, WANG T X, JIANG J G, et al. Bergaptol from blossoms of Citrus aurantium L. var. amara Engl inhibits LPS-induced inflammatory responses and ox-LDL-induced lipid deposition[J]. Food &Function, 2020, 11(6):4915-4926.
[7] 李贵节. 柑橘果汁和精油中的氧杂环化合物:分析方法学、化学表征和降血压活性研究[D]. 重庆: 西南大学, 2018. LI G J. Oxygen heterocyclic compounds in citrus juices and essential oils: analytical methodology, chemical characterization, and hypotensive activity[D]. Chongqing: Southwest University, 2019.
[8] 张念. 柚果实不同成熟期主要营养功能成分的变化规律[D]. 重庆: 西南大学, 2023. ZHANG N. Study on the change of nutrition and functional components in pemelo (Citrus Grandis Osbeck) frutis during maturity[D]. Chongqing: Southwest University, 2023.
[9] HAN L, CHENG Y J, ZHANG T H, et al. Targeted metabolomics with a chemometric study of oxygenated heterocyclic aglycones as a tool for preliminary authenticity assessment of orange and grapefruit juices[J]. Frontiers in Nutrition, 2022, 9:897982.
[10] BARRECA D, BELLOCCO E, CARISTI C, et al. Elucidation of the flavonoid and furocoumarin composition and radical-scavenging activity of green and ripe chinotto (Citrus myrtifolia Raf.) fruit tissues, leaves and seeds[J]. Food Chemistry, 2011, 129(4):1504-1512.
[11] 尹会平, 王夜梅, 李江南, 等. 不同生长阶段金柑果实中类黄酮等活性物质含量差异分析[J]. 食品与发酵工业, 2023, 49(17):274-282. YIN H P, WANG Y M, LI J N, et al. Analysis of difference in content of flavonoids and other active substances in fruits of kumquat at different growth stages[J]. Food and Fermentation Industries, 2023, 49(17):274-282.
[12] 聂嘉琳, 赵希娟. 六种柚果实不同部位次生代谢产物的靶向筛查及其差异研究[J]. 陕西师范大学学报(自然科学版), 2021, 49(3):105-116. NIE J L, ZHAO X J. Targeted screening of secondary metabolites in different parts of six pummelo(Citrus grandis(L.)Osbeck)fruits and their difference investigation[J]. Journal of Shaanxi Normal University (Natural Science Edition), 2021, 49(3):105-116.
[13] 赵希娟, 庞雯辉, 谭涛, 等. UPLC-Q-TOF-HRMS技术结合SWATH采集方法同时测定柠檬果实中26种生物活性成分的含量[J]. 食品与发酵工业, 2022, 48(23):306-314. ZHAO X J, PANG W H, TAN T, et al. Simultaneous determination of 26 bioactive components in lemon fruits based on UPLC-Q-TOF-HRMS and SWATH acquisition mode[J]. Food and Fermentation Industries, 2022, 48(23):306-314.
[14] 谭涛, 董思龙, 秦艳, 等. 佛手类黄酮和香豆素类物质的靶向筛查和定量分析研究[J]. 食品与发酵工业, 2023, 49(18):297-305. TAN T, DONG S L, QIN Y, et al. Targeted screening and quantitative analysis of flavonoids and coumarins in fingered citron(Citrus medica L.var.sarcodactylis Swingle)[J]. Food and Fermentation Industries, 2023, 49(18):297-305.
[15] ABOSHARAF H A, DIAB T, ATLAM F M, et al. Osthole extracted from a citrus fruit that affects apoptosis on A549 cell line by histone deacetylasese inhibition (HDACs)[J]. Biotechnology Reports, 2020, 28: e00531.
[16] DUGO P, MONDELLO L, LAMONICA G, et al. Characterization of cold-pressed key and Persian lime oils by gas chromatography, gas chromatography/mass spectroscopy, high-performance liquid chromatography, and physicochemical indices[J]. Journal of Agricultural and Food Chemistry, 1997, 45(9):3608-3616.
[17] GAO T H, JIANG M Y, DENG B, et al. Aurantii Fructus: A systematic review of ethnopharmacology, phytochemistry and pharmacology[J]. Phytochemistry Reviews, 2021, 20(5):909-944.
[18] DUGO P, PIPERNO A, ROMEO R, et al. Determination of oxygen heterocyclic components in citrus products by HPLC with UV detection[J]. Journal of Agricultural and Food Chemistry, 2009, 57(15):6543-6551.
[19] 周胡怿, 赵希娟, 焦必宁. 基于UPLC-QqQ-MS/MS同时检测佛手中香豆素类化合物含量[J/OL]. 食品与发酵工业, 2023. DOI: 10.13995/j.cnki.11-1802/ts.035236. ZHOU H Y, ZHAO X J, JIAO B N. A rapid UPLC-QqQ-MS/MS method for simultaneous detection of coumarins in Citrus medical L. var. sarcodactylis swingle[J/OL]. Food and Fermentation Industries, 2023. DOI: 10.13995/j.cnki.11-1802/ts.035236.
[20] PATIL J R, JAYAPRAKASHA G K, KIM J, et al. 5-Geranyloxy-7-methoxycoumarin inhibits colon cancer (SW480) cells growth by inducing apoptosis[J]. Planta Medica, 2013, 79(3-4):219-226.
[21] 李贵节, 谭祥, 王华, 等. HPLC-DAD-FLD同时测定柑橘果汁中12种多甲氧基黄酮和香豆素类物质[J]. 食品科学, 2017, 38(20):112-118. LI G J, TAN X, WANG H, et al. Simultaneous determination of twelve compounds of polymethoxyflavones, coumarins and furocoumarins in Citrus juices by using HPLC-DAD-FLD[J]. Food Science, 2017, 38(20):112-118.
[22] DUGRAND A, OLRY A, DUVAL T, et al. Coumarin and furanocoumarin quantitation in citrus peel via ultraperformance liquid chromatography coupled with mass spectrometry (UPLC-MS)[J]. Journal of Agricultural and Food Chemistry, 2013, 61(45):10677-10684.
[23] 张耀海, 张念, 王成秋, 等. 基于超高效液相色谱-三重四极杆串联质谱技术的柚果实不同成熟期生物活性成分的靶向筛查与定量[J]. 食品与发酵工业, 2023, 49(15):279-287. ZHANG Y H, ZHANG N, WANG C Q, et al. Targeted screening and quantification of bioactive components of pomelo fruits at different maturity stages based on ultra-high performance liquid chromatography-quadrupole-tandem mass spectrometry[J]. Food and Fermentation Industries, 2023, 49(15):279-287.
[24] 张永勇, 叶文才, 范春林, 等. 酸橙中一个新的香豆素苷[J]. 中国天然药物, 2005, 3(3):141-143. ZHANG Y Y, YE W C, FAN C L, et al. A new coumarin glucoside from the fruits of Citrus aurantium[J]. Chinese Journal of Natural Medicines, 2005, 3(3):141-143.
[25] NIGG H N, NORDBY H E, BEIER R C, et al. Phototoxic coumarins in limes[J]. Food and Chemical Toxicology: An International Journal Published for the British Industrial Biological Research Association, 1993, 31(5):331-335.
[26] FRÉROT E, DECORZANT E. Quantification of total furocoumarins in citrus oils by HPLC coupled with UV, fluorescence, and mass detection[J]. Journal of Agricultural and Food Chemistry, 2004, 52(23):6879-6886.
[27] 郝元元. LC-MS/MS法测定柚子皮中香豆素类物质 组成及含量[J]. 食品研究与开发, 2019, 40(16):146-152. HAO Y Y. Determination of the content of coumarins in grapefruit skin of Citrus maxima by liquid chromatography-mass spectrometry[J]. Food Research and Development, 2019, 40(16):146-152.
[28] ADAKUDUGU E A, AMEYAW E O, OBESE E, et al. Protective effect of bergapten in acetic acid-induced colitis in rats[J]. Heliyon, 2020, 6(8): e04710.
[29] WU H J, WU H B, ZHAO Y Q, et al. Bergamottin isolated from Citrus bergamia exerts in vitro and in vivo antitumor activity in lung adenocarcinoma through the induction of apoptosis, cell cycle arrest, mitochondrial membrane potential loss and inhibition of cell migration and invasion[J]. Oncology Reports, 2016, 36(1):324-332.
[30] TENG W Y, CHEN C C, CHUNG R S. HPLC comparison of supercritical fluid extraction and solvent extraction of coumarins from the peel of Citrus maxima fruit[J]. Phytochemical Analysis: PCA, 2005, 16(6):459-462.
[31] 谢玲, 周军, 田倩倩, 等. 双水相体系萃取分离-高效液相色谱法测定蛇床子中蛇床子素的研究[J]. 解放军药学学报, 2010, 26(4):310-314. XIE L, ZHOU J, TIAN Q Q, et al. Aqueous two-phase extraction and separation of osthole from Cnidium monnieri with analysis by high performance liquid chromatography[J]. Pharmaceutical Journal of Chinese PLA, 2010, 26(4):310-314.
[32] GHARAT N N, RATHOD V K. Response surface methodology for the extraction of wedelolactone from Eclipta alba using aqueous two-phase extraction[J]. Preparative Biochemistry &Biotechnology, 2020, 50(8):827-833.
[33] 高幼衡, 刁远明, 彭新生, 等. HPLC法测定广佛手中5, 7-二甲氧基香豆素的含量[J]. 中药新药与临床药理, 2003, 14(4):250-251. GAO Y H, DIAO Y M, PENG X S, et al. Determination of 5, 7-dimethoxycoumarin in fructus Citris sarcodactylis by HPLC[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2003, 14(4):250-251.
[34] GENOVESE S, EPIFANO F, PREZIUSO F, et al. A novel and efficient subcritical butane extraction method and UHPLC analysis of oxyprenylated phenylpropanoids from grapefruits peels[J]. Journal of Pharmaceutical and Biomedical Analysis, 2020, 184:113185.
[35] CHU J, LI S L, YIN Z Q, et al. Simultaneous quantification of coumarins, flavonoids and limonoids in Fructus Citri Sarcodactylis by high performance liquid chromatography coupled with diode array detector[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 66:170-175.
[36] HE Y J, ZHU S H, WU C Q, et al. Bioactivity-guided separation of potential D2 dopamine receptor antagonists from aurantii fructus based on molecular docking combined with high-speed counter-current chromatography[J]. Molecules, 2018, 23(12):3135.
[37] 钟海艺, 罗健伟, 李俊潮, 等. 6, 7-二羟基香豆素温敏表面分子印迹材料制备及吸附性能[J]. 化学试剂, 2023, 45(3):61-66. ZHONG H Y, LUO J W, LI J C, et al. Preparation and adsorption properties of 6, 7-dihydroxycoumarin thermosensitive surface molecularly imprinted polymer[J]. Chemical Reagents, 2023, 45(3):61-66.
[38] 王惠芸, 高云玲, 姚克俭. 荧光分子印迹膜选择性检测7氨-基-4-甲基香豆素[J]. 光谱实验室, 2011, 28(6): 2779-2783. WANG H Y, GAO Y L, YAO K J. Selective Detecmination of 7-amino-4-methyl-coumarin by fluorescence molecularly imprinted membrane[J]. Chinese Journal of Spectroscopy Laboratory, 2011, 28(6): 2779-2783.
[39] RUSSO M, BONACCORSI I, TORRE G, et al. Underestimated sources of flavonoids, limonoids and dietary fibre: Availability in lemon’s by-products[J]. Journal of Functional Foods, 2014, 9:18-26.
[40] SETZER W N, VOGLER B, BATES R B, et al. HPLC-NMR/HPLC-MS analysis of the bark extract of Stauranthus perforatus[J]. Phytochemical Analysis: PCA, 2003, 14(1):54-59.
[41] DUGO P, RUSSO M, SAR M, et al. Multidimensional liquid chromatography for the determination of chiral coumarins and furocoumarins in Citrus essential oils[J]. Journal of Separation Science, 2012, 35(14):1828-1836.
M, et al. Multidimensional liquid chromatography for the determination of chiral coumarins and furocoumarins in Citrus essential oils[J]. Journal of Separation Science, 2012, 35(14):1828-1836.
[42] KIM H S, CHUN J M, KWON B I, et al. Development and validation of an ultra-performance convergence chromatography method for the quality control of Angelica gigas Nakai[J]. Journal of Separation Science, 2016, 39(20):4035-4041.
[43] GYAWALI R, JEON D H, MOON J, et al. Chemical composition and antiproliferative activity of supercritical extract of Citrus grandis(L.) osbeck fruits from Korea[J]. Journal of Essential Oil Bearing Plants, 2012, 15(6):915-925.
[44] LI G J, CHENG Y J, ZHANG T H, et al. Characterization of oxygenated heterocyclic compounds and in vitro antioxidant activity of pomelo essential oil[J]. Drug Design, Development and Therapy, 2021, 15:937-947.
[45] KIM Y H, LEE S Y, KIM E Y, et al. The antioxidant auraptene improves aged oocyte quality and embryo development in mice[J]. Antioxidants, 2022, 12(1):87.
[46] ZHOU Y, WANG J, YANG W D, et al. Bergapten prevents lipopolysaccharide-induced inflammation in RAW264.7 cells through suppressing JAK/STAT activation and ROS production and increases the survival rate of mice after LPS challenge[J]. International Immunopharmacology, 2017, 48:159-168.
[47] OKUYAMA S, MINAMI S, SHIMADA N, et al. Anti-inflammatory and neuroprotective effects of auraptene, a citrus coumarin, following cerebral global ischemia in mice[J]. European Journal of Pharmacology, 2013, 699(1-3):118-123.
[48] SONG H Y, JO A, SHIN J, et al. Anti-inflammatory activities of isogosferol, a furanocoumarin isolated from Citrus junos seed shells through bioactivity-guided fractionation[J]. Molecules, 2019, 24(22):4088.
[49] 庄正陵, 吴志明, 柯广水, 等. 花椒毒酚通过抑制炎症治疗大鼠膝骨关节炎的实验研究[J]. 军事医学, 2019, 43(10):767-771. ZHUANG Z L, WU Z M, KE G S, et al. Xanthotoxol against knee osteoarthritis in rats by inhibiting inflammation: An experimental study[J]. Military Medical Sciences, 2019, 43(10):767-771.
[50] EBRAHIMI S, MOSTAFAVI-POUR Z, KHAZAEI M, et al. Suppression of metastasis by Citrus auraptene in a mouse model of colorectal cancer[J]. Revista Brasileira De Farmacognosia, 2023, 33(1):182-190.
[51] 朱李亮, 余巍. 香豆素降低PARP10表达抑制人结肠癌细胞HCT116增殖[J/OL]. 复旦学报(自然科学版) , 2023. DOI: 10.15943/j.cnki.fdxb-jns.20230514.001. ZHU L L, YU W. Coumarin reduces PARP10 expression and inhibits HCT116 proliferation in human colon cancer cells[J/OL]. Journal of Fudan University(Natural Science), 2023. DOI: 10.15943/j.cnki.fdxb-jns.20230514.001.
[52] DI STASI L C. Natural coumarin derivatives activating Nrf2 signaling pathway as lead compounds for the design and synthesis of intestinal anti-inflammatory drugs[J]. Pharmaceuticals, 2023, 16(4):511.
[53] SUNAGAWA Y, KAWAGUCHI S, MIYAZAKI Y, et al. Auraptene, a citrus peel-derived natural product, prevents myocardial infarction-induced heart failure by activating PPARα in rats[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2022, 107:154457.
[54] FURUKAWA Y, OKUYAMA S, AMAKURA Y, et al. Isolation and characterization of neuroprotective components from Citrus peel and their application as functional food[J]. Chemical &Pharmaceutical Bulletin, 2021, 69(1):2-10.
[55] HUANG W, HUANG X, XING Z H, et al. Meranzin hydrate induces similar effect to Fructus Aurantii on intestinal motility through activation of H1 histamine receptors[J]. Journal of Gastrointestinal Surgery: Official Journal of the Society for Surgery of the Alimentary Tract, 2011, 15(1):87-96.
[56] GAO X G, WANG C Y, NING C Q, et al. Hepatoprotection of auraptene from peels of citrus fruits against thioacetamide-induced hepatic fibrosis in mice by activating farnesoid X receptor[J]. Food &Function, 2018, 9(5):2684-2694.
[57] TIAN D M, WANG F F, DUAN M L, et al. Coumarin analogues from the Citrus grandis(L.) osbeck and their hepatoprotective activity[J]. Journal of Agricultural and Food Chemistry, 2019, 67(7):1937-1947.
[58] ABDIZADEH R, HADIZADEH F, ABDIZADEH T. In silico analysis and identification of antiviral coumarin derivatives against 3-chymotrypsin-like main protease of the novel coronavirus SARS-CoV-2[J]. Molecular Diversity, 2022, 26(2):1053-1076.
[59] GUERRINI A, LAMPRONTI I, BIANCHI N, et al. Bergamot (Citrus bergamia Risso) fruit extracts as γ-globin gene expression inducers: Phytochemical and functional perspectives[J]. Journal of Agricultural and Food Chemistry, 2009, 57(10):4103-4111.
[60] ZHENG M X, GE Y L, LI H Y, et al. Bergapten prevents lipopolysaccharide mediated osteoclast formation, bone resorption and osteoclast survival[J]. International Orthopaedics, 2014, 38(3):627-634.
[61] LI X J, ZHU Z, HAN S L, et al. Bergapten exerts inhibitory effects on diabetes-related osteoporosis via the regulation of the PI3K/AKT, JNK/MAPK and NF-κB signaling pathways in osteoprotegerin knockout mice[J]. International Journal of Molecular Medicine, 2016, 38(6):1661-1672.
[62] 王雪莲, 李敏敏, 胡军华, 等. 18种香豆素类化合物对柑桔炭疽菌的抑制作用[J]. 中国南方果树, 2013, 42(4):73-74; 77. WANG X L, LI M M, HU J H, et al. Inhibitory effect of 18 coumarins on citrus anthracnose[J]. South China Fruits, 2013, 42(4):73-74; 77.