天然大分子因具有功能多样性、生物相容性、生物降解性,以及易于改性等特点,在生物活性物质递送方面具有天然优势[1-3],可以作为绿色健康的食品胶体原材料。天然大分子来源于植物或动物,可分为多糖、蛋白质,脂类等。这些天然大分子可以通过单一组分或者复配的形式构成不同的胶体体系[4]。如利用多糖制备的水凝胶微球、微胶囊[5],利用蛋白制备的乳液、乳液凝胶、胶束等[6],以及利用脂质制备的脂质体、囊泡、固体脂质颗粒等体系[7],以形成不同亲和性内核、微观结构和机械性能的递送体系,如图1所示。根据胶体类型的不同,生物活性物质可能被包裹在胶体内部,溶解在基质中,与骨架共价连接,或吸附在表面,用于疏水性如姜黄素、虾青素、白藜芦醇和亲水性的氨基酸、维生素等生物活性物的递送,甚至是亲水和疏水物质共递送(图1-G)。递送体系的功能特性将取决于单个材料的特性和组成成分之间的相互作用。
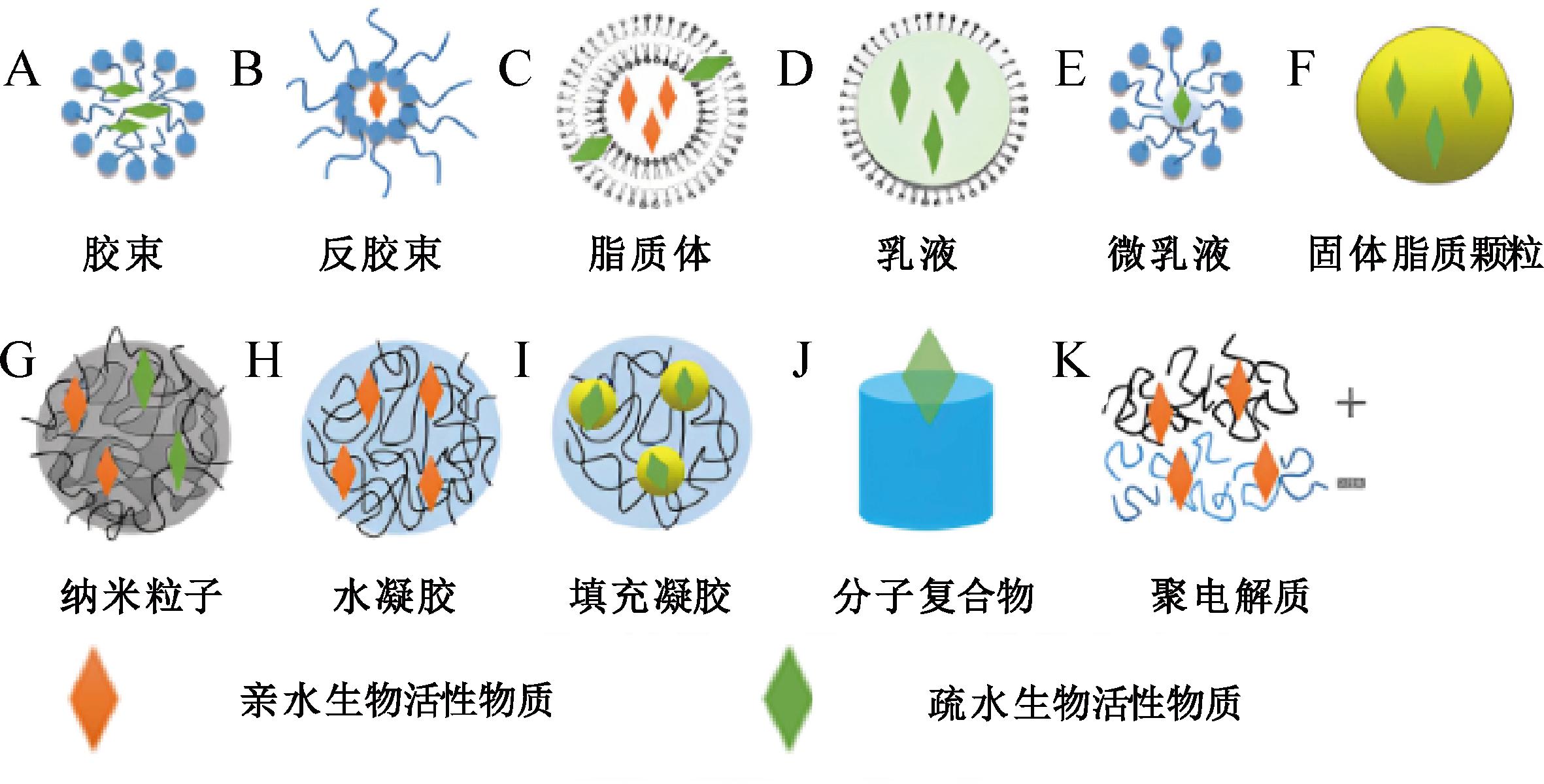
图1 不同类型的胶体递送系统
Fig.1 Different types of colloidal delivery systems
食品递送系统中生物活性物质的释放行为影响其在人体内的吸收利用,比如过快的释放速率可能导致其在人体内快速聚集产生生理毒性,而过慢的释放速率导致其在人体内无法有效吸收,也会导致生物利用度低。因此了解食品递送系统的释放机制,并通过载体结构调控活性物质的释放具有重要意义[8]。食品功能性物质的递送有2种重要的释放机制。首先,“迟缓释放”有助于保护某些生物活性物质,如肽类,使其不会在人体的上消化道(胃)中降解,并将其输送到目标作用部位(结肠)。第二种机制是“控制释放”,适用于需要恒定释放率的情况,如食品中的香气、风味、抗氧化剂或抗菌剂的释放等[9]。但是目前对于食品载体结构与释放机制之间关联性的研究还比较少,目前释放模型的理论研究也主要集中在小分子药物上。本文聚焦水凝胶载体体系,介绍了目前建立的物质通过胶体递送系统的释放机制和模型,重点探讨这些模型在食品功能性物质递送研究中的如何应用。
1 水凝胶递送系统
水凝胶作为最常用的食品胶体递送系统之一,通常是由聚合物链交联形成的三维网络结构,具有高含水量、柔韧性、多孔性和生物相容性等特点,在荷载和递送应用中获得了广泛关注[10]。功能性物质可以通过原位或后置负载到水凝胶的网络结构中,而水凝胶网络结构在特定条件(如pH、温度、酶等因素)下的变化(如溶胀,降解)决定了物质的释放行为,所以水凝胶递送系统具有显著的控制释放和靶向传递的优点[11]。
1.1 水凝胶的性质
1.1.1 水凝胶的持水性
水凝胶中水的存在对物质的荷载起着重要的作用。物质可以通过水扩散到已经形成的水凝胶网络中,也可以先溶解在预形成凝胶的溶液中被原位荷载。水凝胶中水的存在也与物质的释放相关,后面内容着重介绍。水凝胶的高含水量使水凝胶具有高黏弹性、柔韧性、多孔性以及相对极性的表面,因此水凝胶就像人体组织中的细胞外基质,具有良好的生物相容性[10]。
1.1.2 水凝胶的尺寸
水凝胶的大小影响物质的荷载和释放。一般来说,随着水凝胶尺寸的增大,物质荷载率增加,释放率降低。AHMADY等[12]制备2种粒径大小的海藻酸盐载体来荷载和释放百里酚,结果表明在载体结构没有任何变化的情况下,较大粒径的载体其荷载量更高而释放率更低。水凝胶网络结构大小是另一个重要特征,功能性物质尺寸大于孔径则会被保留,小于孔径会被释放[13]。可以根据不同触发因素(如pH、酶、温度等)改变孔径大小,使水凝胶到达特定环境后再释放出荷载物质。ZHANG等[14]开发了一种由特定比例的海藻酸盐和低甲氧基果胶形成的肠道特异性释放的水凝胶载体,用于在肠道中靶向释放白藜芦醇。该水凝胶具有pH敏感性,在胃液pH下网孔收缩,在小肠和结肠pH下网孔增大,可以使绝大部分荷载的白藜芦醇在2 h内转运至肠道在释放。水凝胶的孔隙度可以通过控制大分子材料的浓度和交联程度来控制[15]。
1.1.3 水凝胶材料的极性和带电性
水凝胶极性和带电性影响其荷载和释放功能性物质的能力,例如多糖凝胶一般为亲水性结构,常用来荷载水溶性生物活性物质,而蛋白凝胶为两亲性结构,可以荷载水溶性和疏水性生物活性物质。水凝胶材料和功能性物质的带电性与溶剂的pH相关,例如蛋白处于等电点以下的pH环境中带正电,处于等电点以上pH时带负电。当生物活性物质与凝胶材料带相反电荷时,产生的一个静电相互作用使得生物活性物质吸附于大分子上,进而实现减缓释放的效果。例如乳清蛋白原纤维和壳聚糖络合物作为姜黄素的载体比单独使用壳聚糖显示出更高的抗氧化活性和分散稳定性,可实现将姜黄素引入脱脂酸性功能饮料中[16]。一般来说,水凝胶的极性和带电性共同决定着生物活性物质的荷载和释放,这取决于天然大分子中亲水性、疏水性和带电基团的比例。
1.2 水凝胶的类型
水凝胶有多种类型,可以根据其来源、交联方式、生物降解性、物理外观、电荷、材料组合方式进行分类,如图2所示。对天然高分子水凝胶,主要从以下几个方面介绍:
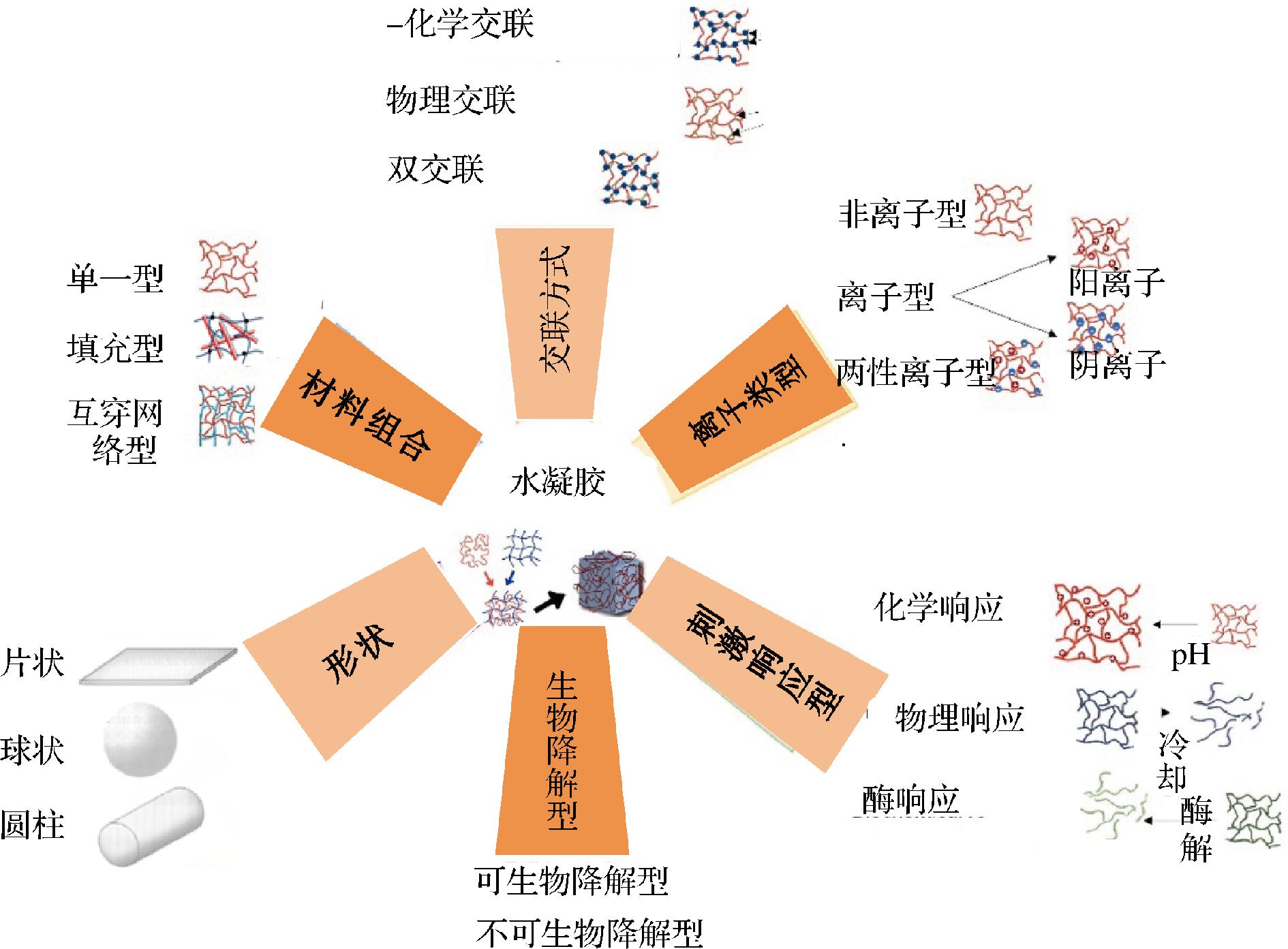
图2 根据各种标准对水凝胶进行分类
Fig.2 Classification of hydrogels according to various criteria
1.2.1 交联方式
根据交联的性质,水凝胶可以分为物理或化学交联。物理凝胶通过非共价键形成,例如离子键、静电相互作用、范德华力、疏水键和氢键或它们的组合。物理凝胶的形成是由温度、盐或pH值的变化引起的。物理凝胶是可逆的,不会破坏水凝胶的生物相容性和被荷载物质的功能性。尽管具有上述优势,但它对凝胶时间、凝胶孔径、功能性、降解或溶解等变量具有不灵活性,而且机械性能差,导致其在体内外性能不一致[17]。化学凝胶主要是由共价键(—OH, —COOH和—NH2等官能团)化学交联产生的,包括通过交联剂(戊二醛)、酶(漆酶)或美拉德反应交联的凝胶,化学凝胶一般是不可逆的,可以提供良好的机械强度和稳定性,还可以根据交联密度改变水凝胶的网络结构,作为递送载体具有较高的灵活性,但交联剂的增加和新共价键的形成可能增加水凝胶的生物毒性[10,17]。对于食品水凝胶来说,为了保证凝胶载体的无害性,一般采用物理交联方式。
1.2.2 离子电荷
水凝胶也可以根据电荷类别进行分类:离子、中性或两性离子。中性水凝胶是指大分子的分子链上不带电荷的水凝胶,其溶胀能力不受pH值影响,例如琼脂形成的冷制凝胶[18]。离子水凝胶在大分子的分子链上带有电荷,带正电时为阳离子水凝胶,带负电时为阴离子水凝胶,常见的阳离子凝胶和阴离子水凝胶分别如壳聚糖和海藻酸盐形成的水凝胶[19-20]。这些离子型水凝胶的特点在于pH变化可以改变其溶胀行为。两性水凝胶具有正负电荷和链状网络,在一定的pH值下保持平衡,也具有pH响应性。蛋白质凝胶为常见的两性凝胶,在不同pH条件下蛋白质凝胶具有不同的结构性质[21]。部分功能食品中的活性物质只在肠道发挥作用,要使得在胃液低pH的条件下不释放和功能性不被破坏,可以选择阴离子型凝胶如海藻酸盐作为载体。
1.2.3 材料组成
按照材料组成,水凝胶可分为单一、填充和互穿网络水凝胶。单一凝胶的特征是单一成分形成凝胶网络。单一水凝胶是确定蛋白质和多糖的凝胶机理以及流变学和力学性质的理想体系,但结构单一,机械性能较弱,作为递送载体效果不理想。填充凝胶包含填充颗粒,填充颗粒可以是固体(如纳米颗粒、纤维或细胞成分)、液体(如乳液凝胶中的油滴)或气体(例如,泡沫中的气泡)。填料的加入可以改变填充凝胶体系的能量耗散,从而影响水凝胶的流变性和结构特征[22]。流变学特性对于人体靶向递送非常重要,因为它们会影响水凝胶在生理条件下的稳定性,即在机械力(如咀嚼和胃蠕动的动态机械力)存在时凝胶结构是否被破坏[23]。互穿网络凝胶是由2个或2个以上聚合物网络相互贯穿缠结形成。与传统水凝胶相比,互穿网络水凝胶由于网络组分间的协同作用,一般表现为高的机械和热稳定性[24]。目前用于生物活性物质的水凝胶载体绝大部分为填充凝胶或互穿网络凝胶,例如,与单一黄原胶凝胶相比,由卵铁传递蛋白原纤维和黄原胶组装而成的填充水凝胶作为二氢杨梅素(黄酮类活性物质)递送载体具有更好的流变性能,可以提供更高的二氢杨梅素释放率[25]。
2 水凝胶递送系统的释放机制与模型
对功能性物质通过载体的释放进行建模是食品科学领域中重要的内容之一,关系到对物质释放行为的了解和调控,以及载体的设计。以食品生物活性物质递送为例,控制其释放的2个关键现象是从食品载体到胃液的扩散质量传输和由于胃部机械力造成的载体表面侵蚀。根据食品水凝胶种类和递送类型的不同,递送系统荷载活性物质的释放机制可分为3种[26]:a)扩散控制、b)降解溶蚀控制、c)溶胀控制。对于大多食品凝胶载体控释系统,主要是由扩散控制和降解溶蚀或溶胀控制的共同作用。不同的释放机制下,物质的释放速率不同。
2.1 扩散释放机制与模型
扩散控制是指溶剂通过递送载体孔隙或通道进入体系内将活性物质溶解和分散,然后通过溶剂分子的布朗运动将活性物质从载体内转移到载体外,从而达到释放的过程。单一扩散机制要求载体不溶于溶剂。扩散释放是由载体内外物质浓度梯度引起的,并随着浓度的梯度变化而变化。因此扩散释放模型的推导,基于微粒子扩散运动的Fick定律[27-28]。食品营养物质的递送过程涉及到酸和酶从胃肠道溶液扩散到食品凝胶载体,以及载体中功能物质扩散到胃肠道溶液的过程。此前在食品科学领域的研究表明,Fick第二扩散定律可以被认为是模拟胃肠液扩散到不同食物系统的理论支持[27]。
以水凝胶为例,如图3所示,活性物质可以是被包埋在中空的凝胶内部(图3-a,图3-b),也可以与凝胶材料以共混式存在(图3-c,图3-d)。不同的荷载方式,对应着不同的扩散释放行为。

a-高溶解度蓄积式荷载;b-低溶解度蓄积式荷载;c-高溶解度共混式荷载;d-低溶解度共混式荷载;e-3种类型释放曲线
图3 四种不同类型荷载活性物质的微胶
Fig.3 Four different types of microgels loaded with active substances
注:圆点表示溶解的活性物质,圆圈表示未溶解的活性物质。
2.1.1 高溶解度蓄积式荷载
如果荷载物质初始浓度低于其溶解度,且物质以分子溶液形式完全分散蓄积在(湿润的)凝胶壁内(壳内),如图3-a所示,并且当溶剂渗透到凝胶中时,物质颗粒迅速溶解。由于物质释放速率与浓度成正比,而凝胶壁内表面的活性物质的分子浓度不断下降,根据Fick扩散第二定律,可以计算活性物质量释放量随时间的函数,其模型为指数递减函数[28]如公式(1)所示:
(1)
式中:Qt是活性物质在时刻t的累积释放量(下同),Q∞是无限时刻累积释放量(下同),K是活性物质在凝胶壁和溶剂之间的分配系数,Ri为活性物质核心半径,Ro为凝胶半径,D为扩散系数(下同)。
由于该指数模型在半对数坐标图上则为直线,因此被称为一级释放动力学,其释放曲线如图3-e 中一级释放曲线所示[28]。一级释放模型可以简化为公式(2):
(2)
式中:k被称为活性物质释放的特性常数。
由于活性物质在水溶剂的高溶解度,一级释放表现为较高的初始释放速率。一级释放有助于快速达到食品载体中生物活性物质的有效浓度。
2.1.2 低溶解度蓄积式荷载
当溶剂渗透到凝胶中时,并不是所有的荷载物质都被溶解(溶解度有限),因此,凝胶内的溶液为饱和活性物质溶液,如图3-b所示。此时从凝胶内释放出活性物质分子后迅速被其余未溶解活性物质(部分)溶解取代,因此凝胶膜内外的活性物质浓度差保持恒定(只要存在活性物质过剩),其释放量等式如公式(3)所示:
(3)
式中:Cs是活性物质在溶剂中的饱和浓度(下同)。与一级释放动力学相比,公式(3)表明随着时间的延长,载体壁内活性物质浓度保持不变,壁内外浓度差不变。由于在半对数坐标中该释放曲线为直线,斜率为0,所以此种释放被称为零级释放动力学[28], 如图3-e中所示。这种荷载方式对于功能性物质来说是理想的释放动力学,因为可在规定的持续时间内以受控的速度输送物质。蓄积式荷载释放在食品乳液凝胶作为载体荷载高疏水性功能性物质中常见[29]。零级释放模型可以简化为公式(4):
(4)
2.1.3 高溶解度共混式荷载
共混式系统是指活性物质与水凝胶载体基材均匀混合在一起,壁材为不溶型骨架,没有控制释放速率的膜(壳),如图3-c。共混式载体荷载的物质均匀分散在基质中,扩散主要通过载体基质的空隙实现,但是载体没有可以作为扩散屏障的膜壁,因此共混式载体通常表现出较高的初始释放,之后随着时间的延长,释放速率随着载体内活性物质浓度梯度的减小而降低。在高溶解度情况下,当载体接触到溶剂时,溶剂扩散到载体内部使全部活性物质溶解并分散均匀,释放过程中载体中核心活性物质浓度整体下降。BAKER等[30]提出了2种简化的释放模型,分别用来解释初期和后期活性物质的释放动力学,如公式(5)、公式(6)所示:
(5)
(6)
2.1.4 低溶解度共混式荷载
如果初始活性物质浓度高于溶剂中的活性物质饱和浓度,在载体接触到溶剂时,只有部分活性物质被溶解,在释放过程中溶解的活性物质和非溶解的活性物质在载体骨架中共存,如图3-d所示。KOIZUMI等[31]给出一个简化的此种情况物质释放等式,如公式(7)所示:
![]()
(7)
公式(5)~公式(7)在实际状况下应用很少,最常用的模型还是经典的Higuchi模型 [32][公式(8)]:
(8)
在食品领域,共混式系统可以通过喷雾冷却或挤压产生,使荷载物质均匀地分散在碳水化合物、脂肪或其他基质颗粒中[9]。食品包装薄膜也可以看作是共混式系统,实现食品风味、香气、水分等物质的控制扩散和流失,达到保鲜目的[3]。
2.2 溶蚀释放机制与模型
溶蚀是指大分子材料降解产生可溶性单体或低聚物扩散出聚合物基体,发生质量上的损失(化学和物理过程)。在理想情况下,基体的溶蚀行为分为2种:本体溶蚀和表面侵蚀(图4-a)。在本体溶蚀中,载体的直径是恒定的,外部流体可以渗透到载体中,在此过程中载体发生了溶蚀;而在表面侵蚀中,随着载体外部边界被侵蚀,载体直径逐渐缩小。载体的溶蚀方式取决于基体内水的扩散率、聚合物官能团的降解率和基体形状大小[33]。

a-凝胶本体溶蚀和表面侵蚀过程的示意图;b-基于本体溶蚀的 活性物质释放示意图(1,2,3分别代表释放行为的3个阶段)
图4 水凝胶溶蚀释放示意图
Fig.4 Schematic diagram of dissolution and release of active substances from hydrogels
2.2.1 本体溶蚀释放模型
一般来说,对于本体溶蚀载体,荷载物质释放曲线分为3个阶段,如图3-e中多相释放曲线所示。第一阶段由于吸附在载体表面的活性物质快速溶解引起的突释(图4-b-1);第二阶段通常被称为缓释期,在此期间,活性物质通过相对致密的聚合物孔隙扩散而释放(图4-b-2);第三阶段被描述为快速释放期(图4-b-3),溶蚀作用使得载体孔隙变大,活性物质扩散的加快。HELLER等[34]以经典的Higuchi模型为基础,建立了本体溶蚀聚合物载体的数学模型。在活性物质溶解于溶剂之前,控制活性物质释放的主要过程是基体骨架的裂解。修正的Higuchi模型如公式(9)所示:
(9)
式中:Co是活性物质的初始浓度;S是膜两侧的表面积;Po是活性物质在聚合物基体的渗透性,与聚合物链的数量有关;K是键断裂过程的一级动力学速率常数。
2.2.2 表面侵蚀释放模型
当聚合物链降解速度大于水的扩散速度时,载体表现为表面侵蚀,在理想情况下,假定聚合物载体的表面降解速率和水进入基体的扩散速率保持相对不变,活性物质浓度分布均匀,则可以认为表面侵蚀引起的活性物质释放符合零级释放,此时溶剂在基体外部就被消耗完。有多种模型用来模拟基体表面侵蚀引起的活性物质释放动力学,其中最为著名的释放模型为WEIBULL 经验模型[35]如公式(10)所示:
(10)
式中:tlag是活性物质释放前的滞后时间,可以理解为开始溶蚀的时间,b表征释放曲线的形状。
HOPFENBERG[36]通过假设整体释放行为是零级释放,提出了一个经验活性物质释放模型。这种零级过程本质上是聚合物基体表面侵蚀和扩散作用的综合结果。该模型假设释放速率受表面侵蚀过程控制,收缩的球形载体面积与体积的立方根成正比,如公式(11)所示:
(11)
式中:kero是表面侵蚀速率常数。
2.3 溶胀释放机制与模型
溶胀是指载体在溶剂中体积发生膨胀的现象,如图5所示。溶胀释放中,荷载物质最初分散在玻璃态的载体中,当载体与水接触,聚合物开始由玻璃态转变成橡胶态,在载体内部形成清晰的界面层。当活性物质与水接触时,由于界面处的浓度差而溶解,由于2种状态的界面之间的浓度梯度而通过界面扩散。溶剂渗透到玻璃态基体中的方式一般认为是非Fick扩散(Case-II)[37],与Fick扩散随着扩散路径的变长溶剂的扩散逐渐减小的规律不同,Case-II转运中溶剂的渗透速度是恒定的,从分子水平分析溶胀动力学过程,可以认为Case-II 转运是由溶胀前后聚合物松弛造成的。
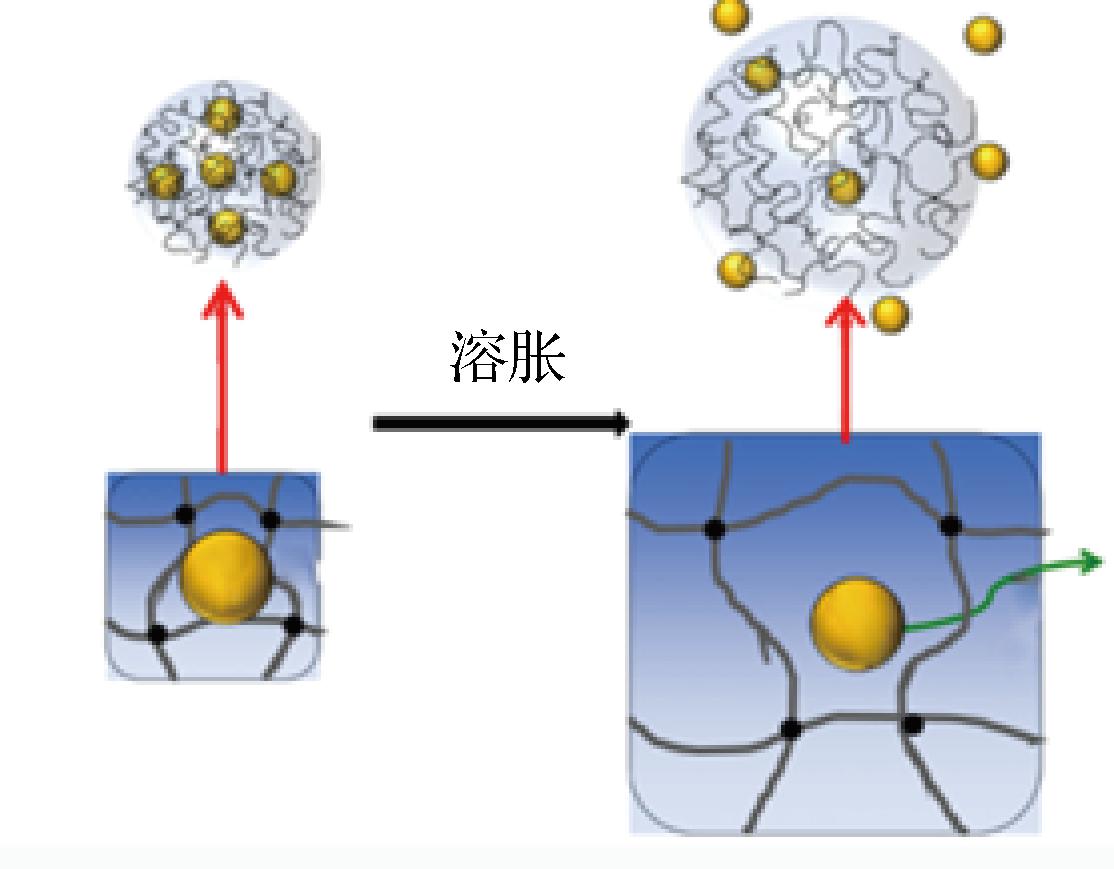
图5 水凝胶溶胀释放示意图
Fig.5 Schematic diagram of hydrogel swelling release
KORSMEYER和PEPPAS以最简单的方式建立了基于幂律表达式的半经验方程,建立了释放与时间之间的指数关系,描述了溶胀控制系统的活性物质释放[38],如公式(12)所示:
(12)
式中:k是常数,n是释放指数。
幂律方程可以看作是Fick扩散和Case-II转运2个过程的叠加。它用来识别Fick扩散 (n=0.5) 和Case-II转运 (n=1)之间的相对重要性。“异常运输”发生在2个过程的现象耦合的地方(0.5<n<1),此时活性物质释放受到Fick扩散和聚合物松弛的共同作用。RITGER和PEPPAS在文献中提供了圆柱和球形几何形状的不同n值[39]。在球形凝胶载体中,Fick扩散和Case-II转运的活性物质释放的数值n分别为0.43和0.85。
PEPPAS和SAHLIN对半经验模型进行了修正,用公式(13)表达式将Fick扩散和Case-II转运解耦[40]:
(13)
式中:k1,k2和m是常数,m与n有关。等式右边的第一项是Fick扩散贡献,而第二项是Case-II转运贡献。
3 释放模型的应用
3.1 设计食品功能物质载体
3.1.1 缓释载体
缓释载体的应用主要是降低荷载物质的释放速率,延长释放时间。例如可以延长食品中香料或者抗菌剂的释放时间,增加食品保质期。ANSARIFAR通过大豆分离蛋白原纤维(soy protein isolate, SPI)和高甲氧基果胶(high methoxyl pectin, HMP)的逐层静电吸附制备了新型多层微胶囊做为柠檬烯(植物精油)的载体[41](图6)。作者利用不同释放模型对柠檬烯释放速率进行拟合,发现层数较低时候,释放速度较快,符合一级释放模型,层数较高时,Higuchi模型最适,说明此时体系释放动力学是以共混式荷载中的扩散释放为主,随着微胶囊的层数从4层增加到6层,柠檬烯的释放速率常数k显著降低(表1)。在较高的层数时,Korsmeyer-Peppas[公式(12)]也较为符合,具有n=0.7~0.8,说明在较高层数时,体系的释放是扩散和溶胀共同作用的结果。MA等[42]以壳聚糖纳米粒子荷载马铃薯皮多酚(抗氧化剂),制备淀粉基缓释抗氧化膜,显著缓释了马铃薯皮多酚的释放(时间为1 440 min,而纯淀粉膜为瞬间释放),释放曲线符合高溶解度共混式载体的扩散释放,具有较低D值(1.343×10-6 mm2/min,而纯淀粉膜D值为4.325×10-6 mm2/min)。
表1 多层微胶囊释放柠檬烯的模型参数[41]
Table 1 Model parameters of limonene release from multilayer microcapsules[41]
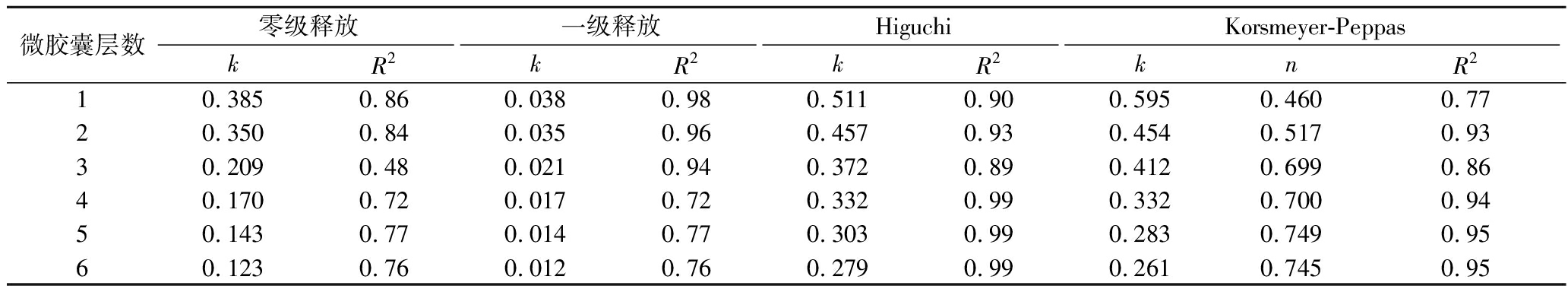
微胶囊层数零级释放一级释放HiguchiKorsmeyer-PeppaskR2kR2kR2knR210.3850.860.0380.980.5110.900.5950.4600.7720.3500.840.0350.960.4570.930.4540.5170.9330.2090.480.0210.940.3720.890.4120.6990.8640.1700.720.0170.720.3320.990.3320.7000.9450.1430.770.0140.770.3030.990.2830.7490.9560.1230.760.0120.760.2790.990.2610.7450.95
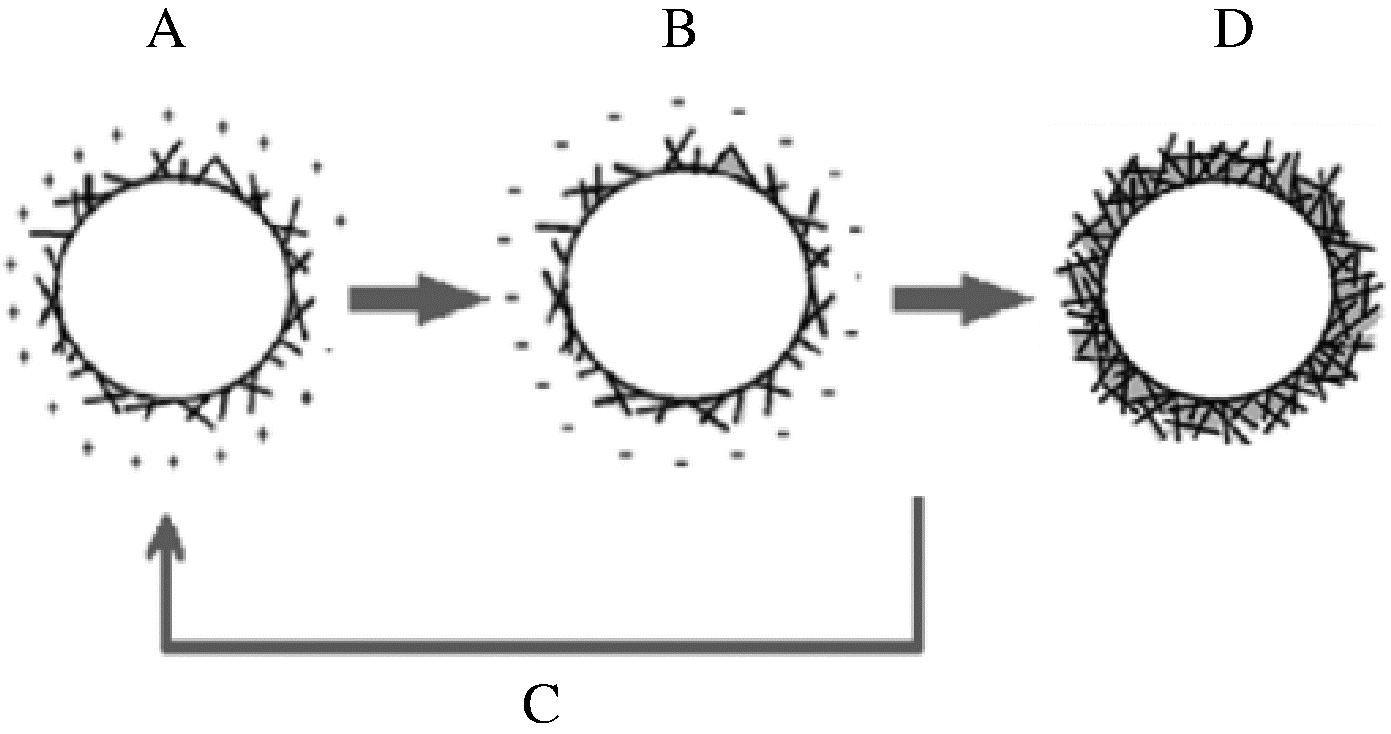
A-获得由SPI原纤维稳定的柠檬烯液滴,形成带正电的模板; B-去除多余的SPI后,一层HMP被吸附,形成带负电荷的模板; C-任意重复步骤A和B,以在柠檬烯液滴周围产生更厚的壳层; D-增强后的微胶囊
图6 逐层静电吸附制备多层微胶囊示意图[41]
Fig.6 Schematic representation of steps LBL polyelectrolyte encapsulation process[41]
3.1.2 控释载体
控释载体可以将食品中功能物质以可控制的速度释放,例如将营养物质按特定的速度从食品载体中释放出并被人体吸收,在人体内维持较为稳定的有效浓度。理想的控制释放曲线符合零级释放模型。TEBCHARANI等[43]用琼脂制备出一种乳液凝胶,琼脂凝胶中具有可水解的油滴,油滴中可荷载各种疏水性活性物质(图7)。活性物质随着油滴的水解而释放(低溶解度蓄积式荷载),通过拟合可以看出,活性物质的释放动力学为零级释放(图7-c)。结果表明可以通过改变初始水解油浓度来调节零级模型的释放速率。HUANG等[44]制备的乳清蛋白-高甲氧基果胶复合物作为熊果苷和香豆酸的控释载体,通过建模分析得出,当活性物质分子不与载体材料发生相互作用时,释放曲线主要取决于分子大小和载体孔隙大小。当分子尺寸大于孔半径但小于孔径时,孔隙1次只允许单分子通过,释放模型表现为零级释放模型。当活性物质分子与载体材料发生相互作用时,活性物质与载体之间的相互作用作为额外的驱动力和扩散行为共同影响物质释放,当相互作用力和扩散平衡时,释放模型表现为零级释放模型。WICHCHUKIT等[45]用乳清蛋白和海藻酸钠制备复合凝胶微珠作为核黄素的控释载体,通过Korsmeyer-Peppas模型和零级模型拟合,确定复合凝胶的零级释放主要由溶胀前后聚合物松弛造成的(n=0.85,Case-II转运),纯乳清蛋白凝胶和纯海藻酸珠分别提供了最慢和最快的释放速率,与2种凝胶珠的溶胀程度有关。
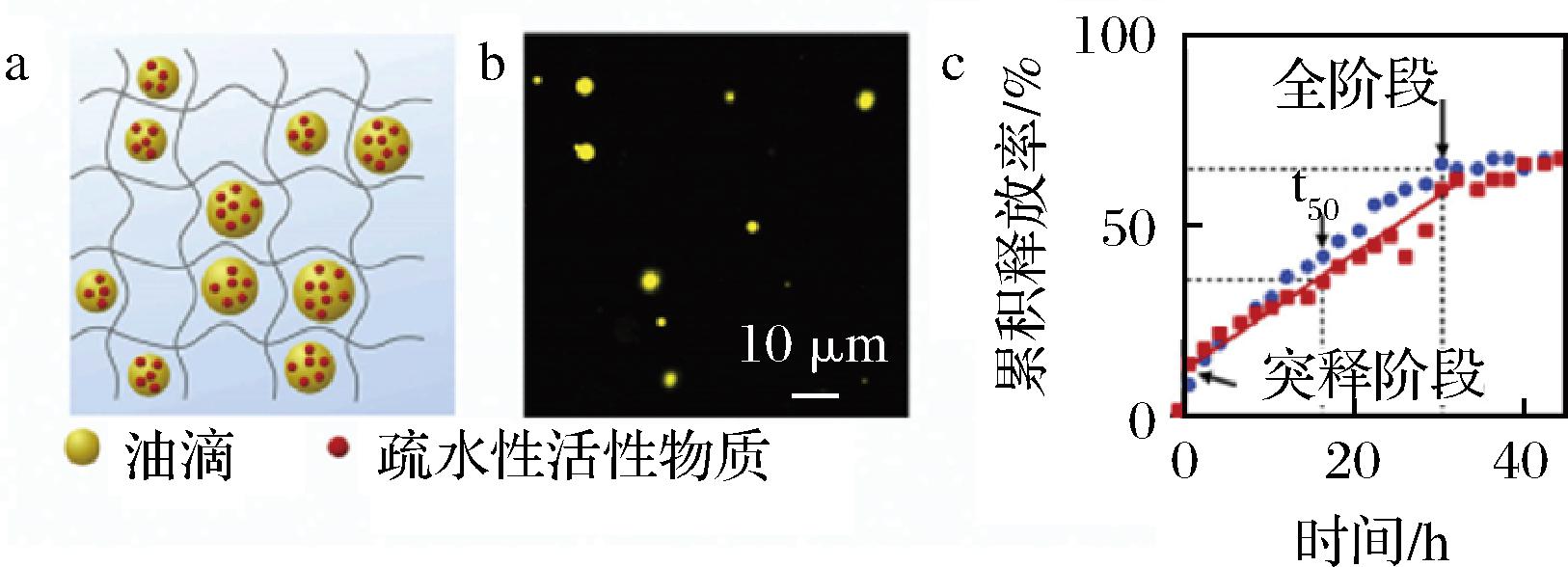
a-乳液凝胶结构荷载疏水性活性物质;b-乳液凝胶的 激光共聚焦图像;c-释放曲线
图7 TEBCHARANI制备出的乳液凝胶中活性物质 荷载与释放示意图[43]
Fig.7 Schematic diagram of loading and release of active substances in emulsion gel prepared by TEBCHARANI[43]
3.1.3 智能载体
智能载体是指具有独特的刺激响应机制的载体,可在外部环境(光、热、电磁场、超声等)或人体自身环境因素(pH和酶等)的刺激下自动调节释放速度、控制功能物质达到靶向部位。在食品领域,最常见的智能递送为功能食品中活性物质在胃肠道的靶向释放。CAI等[46]制备了一种果胶-钙凝胶,用于递送姜黄素。由于果胶水凝胶具有pH敏感性,其凝胶网络在胃中收缩,在肠道溶胀和降解,因此可以将姜黄素特异性输送到结肠释放。姜黄素-果胶-钙凝胶在胃液阶段可以认为是扩散释放机制,符合低速率的零级释放模型;在肠液阶段可以认为是扩散和溶胀的共同作用,可以通过Korsmeyer-Peppas模型或Peppas-Sahlin[公式(13)]模型拟合。与该体系类似,SAVIC等[47]将抗氧化剂万寿菊水提物包埋在海藻酸钙凝胶中,通过扩散和溶胀动力学控制,实现肠道释放。CHENG等[48]利用静电逐层吸附构建了一种具有多层海藻酸盐和鱼精蛋白交替层的酶响应熔丝状微胶囊包埋益生菌,由于益生菌体积较大,在胃中无法通过扩散机制穿过载体聚合物网络,而只有在载体受到肠道中胰蛋白酶特异性水解后,通过降解溶蚀释放到肠道中。
3.2 预测分析
已经建立的释放模型,也可以用来预测功能性物质的释放行为与材料和结构的关系,以评估系统的有效性,从而缩短实验时间和降低经济成本。比如抗菌薄膜中抗菌活性物质的浓度与食品中微生物生长动力学之间的平衡决定了食品包装系统的有效性,而包装膜的网络结构、包装膜厚度以及抗菌物质的初始剂量是涉及传输现象的关键控制因素,需要通过实验分析出不同因素影响下抗菌物质的释放行为[10]。然而,在实际释放实验分析中,抗菌物质释放实验的长周期,有时也会由于技术问题或缺乏合适的分析方法,执行释放实验分析是不切实际的。在这些情况下,数学模型可以作为一种有用的工具来研究食品包装系统中抗菌物质的释放过程。RUBILAR等[49]对食品包装系统中的控制释放过程进行数学建模,利用不同的释放模型确定传质参数,以预测包装系统中的抗菌物质是否能在延长产品保质期时间内以特定速率释放。CERISUELO 等[50]开发出一种新的基于有限元的数学模型来估计香芹酚在不同释放时间的释放效率,来预测包装食品的保质期。虽然数学模型有助于缩短时间和降低成本,但实际运用中条件的变化会使模型拟合产生误差,也要结合实验数据进行验证。
4 结论
本文综述了天然大分子形成的食品功能性物质的水凝胶递送系统的类型、材料、基本性质,介绍了水凝胶递送系统的释放机制。详细描述了不同结构载体的释放机制的原理和对应的释放模型。文章还讨论了释放模型在食品功能物质载体设计和释放行为预测方面的重要应用。一方面,通过使用适当的数学模型,可以预测配方参数以实现特定的释放行为,另一方面也可以通过新载体的结构设计对释放行为进行优化。本综述为进一步利用天然大分子设计食品功能性物质的递送体系提供了指导。
[1] FALSAFI S R, ROSTAMABADI H, SAMBORSKA K, et al. Protein-polysaccharide interactions for the fabrication of bioactive-loaded nanocarriers: Chemical conjugates and physical complexes[J]. Pharmacological Research, 2022, 178:106164.
[2] HA H K, RANKIN S A, LEE M R, et al. Development and characterization of whey protein-based nano-delivery systems: A review[J]. Molecules, 2019, 24(18):3254.
[3] LEYVA-JIMÉNEZ F J, OLIVER-SIMANCAS R, CASTANGIA I, et al. Comprehensive review of natural based hydrogels as an upcoming trend for food packing[J]. Food Hydrocolloids, 2023, 135:108124.
[4] TAN Y B, MCCLEMENTS D J. Plant-based colloidal delivery systems for bioactives[J]. Molecules, 2021, 26(22):6895.
[5] BALDE A, KIM S K, BENJAKUL S, et al. Pulmonary drug delivery applications of natural polysaccharide polymer derived nano/micro-carrier systems: A review[J]. International Journal of Biological Macromolecules, 2022, 220:1464-1479.
[6] TANG C H. Assembly of food proteins for nano-encapsulation and delivery of nutraceuticals (a mini-review)[J]. Food Hydrocolloids, 2021, 117:106710.
[7] GONÇALVES R F S, VICENTE A A, PINHEIRO A C. Incorporation of curcumin-loaded lipid-based nano delivery systems into food: Release behavior in food simulants and a case study of application in a beverage[J]. Food Chemistry, 2023, 405(Pt A):134740.
[8] IRFAN S A, RAZALI R, KUSHAARI K, et al. A review of mathematical modeling and simulation of controlled-release fertilizers[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2018, 271:45-54.
[9] MALEKJANI N, JAFARI S M. Modeling the release of food bioactive ingredients from carriers/nanocarriers by the empirical, semiempirical, and mechanistic models[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1):3-47.
[10] YANG Z Y, MCCLEMENTS D J, LI C C, et al. Targeted delivery of hydrogels in human gastrointestinal tract: A review[J]. Food Hydrocolloids, 2023, 134:108013.
[11] HE M Y, WANG C L, XU T, et al. Modification and preparation of four natural hydrogels and their application in biopharmaceutical delivery[J]. Polymer Bulletin, 2023, 80(7):7101-7144.
[12] AHMADY A R, RAZMJOOEE K, NAZAR V, et al. Alginate carrier as a controlled thymol delivery system: Effect of particle size[J]. Materials Chemistry and Physics, 2023, 294:126982.
[13] LI J L, JIA X, YIN L J. Hydrogel: Diversity of structures and applications in food science[J]. Food Reviews International, 2021, 37(3):313-372.
[14] ZHANG N, ZHANG C B, LIU J M, et al. An oral hydrogel carrier for delivering resveratrol into intestine-specific target released with high encapsulation efficiency and loading capacity based on structure-selected alginate and pectin[J]. Food &Function, 2022, 13(23):12051-12066.
[15] YIN H S, SONG P Q, CHEN X Y, et al. Smart pH-sensitive hydrogel based on the pineapple peel-oxidized hydroxyethyl cellulose and the Hericium erinaceus residue carboxymethyl chitosan for use in drug delivery[J]. Biomacromolecules, 2022, 23(1):253-264.
[16] HU Y, HE C X, JIANG C J, et al. Complexation with whey protein fibrils and chitosan: A potential vehicle for curcumin with improved aqueous dispersion stability and enhanced antioxidant activity[J]. Food Hydrocolloids, 2020, 104:105729.
[17] PARHI R. Cross-linked hydrogel for pharmaceutical applications: A review[J]. Advanced Pharmaceutical Bulletin, 2017, 7(4):515-530.
[18] VOYCHEVA C, SLAVKOVA M, POPOVA T, et al. Synthesis and characterization of PnVCL grafted agar with potential temperature-sensitive delivery of Doxorubicin[J]. Journal of Drug Delivery Science and Technology, 2022, 76:103725.
[19] HUA Y J, WEI Z H, XUE C H. Chitosan and its composites-based delivery systems: Advances and applications in food science and nutrition sector[J]. Critical Reviews in Food Science and Nutrition, 2023, 63(20):4579-4598.
[20] DE SOUZA J B, ROSA G D S, ROSSI M C, et al. In vitro biological performance of alginate hydrogel capsules for stem cell delivery[J]. Frontiers in Bioengineering and Biotechnology, 2021, 9:674581.
[21] ![]() M, MLEKO S, TERPI
M, MLEKO S, TERPI OWSKI K, et al. Aerated whey protein gels as a controlled release system of creatine investigated in an artificial stomach[J]. Innovative Food Science &Emerging Technologies, 2022, 79:103060.
OWSKI K, et al. Aerated whey protein gels as a controlled release system of creatine investigated in an artificial stomach[J]. Innovative Food Science &Emerging Technologies, 2022, 79:103060.
[22] KHALESI H, LU W, NISHINARI K, et al. Fundamentals of composites containing fibrous materials and hydrogels: A review on design and development for food applications[J]. Food Chemistry, 2021, 364:130329.
[23] WU B C, MCCLEMENTS D. Functional hydrogel microspheres: Parameters affecting electrostatic assembly of biopolymer particles fabricated from gelatin and pectin[J]. Food Research International, 2015, 72:231-240.
[24] CHE Y J, LI D P, LIU Y L, et al. Design and fabrication of a triple-responsive chitosan-based hydrogel with excellent mechanical properties for controlled drug delivery[J]. Journal of Polymer Research, 2018, 25(8):169.
[25] WEI Z H, CHEN Y S, WIJAYA W, et al. Hydrogels assembled from ovotransferrin fibrils and xanthan gum as dihydromyricetin delivery vehicles[J]. Food &Function, 2020, 11(2):1478-1488.
[26] BOOSTANI S, JAFARI S M. A comprehensive review on the controlled release of encapsulated food ingredients; fundamental concepts to design and applications[J]. Trends in Food Science &Technology, 2021, 109:303-321.
[27] VERGNAUD J M. Controlled Drug Release Of Oral Dosage Forms[M].Taylor and Francis: CRC Press:1993.
[28] SIEPMANN J, SIEPMANN F. Modeling of diffusion controlled drug delivery[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2012, 161(2):351-362.
[29] LU Y, MAO L K, HOU Z Q, et al. Development of emulsion gels for the delivery of functional food ingredients: From structure to functionality[J]. Food Engineering Reviews, 2019, 11(4):245-258.
[30] BAKER R W, LONSDALE H K. Controlled Release: Mechanisms and Rates[M\〗. Boston, MA: Springer US, 1974:15-71.
[31] KOIZUMI T, PANOMSUK S P. Release of medicaments from spherical matrices containing drug in suspension: Theoretical aspects[J]. International Journal of Pharmaceutics, 1995, 116(1):45-49.
[32] HIGUCHI T. Rate of release of medicaments from ointment bases containing drugs in suspension[J]. Journal of Pharmaceutical Sciences, 1961, 50:874-875.
[33] VON BURKERSRODA F, SCHEDL L, GÖPFERICH A. Why degradable polymers undergo surface erosion or bulk erosion[J]. Biomaterials, 2002, 23(21):4221-4231.
[34] HELLER J, BAKER R W. Theory and Practice of Controlled Drug Delivery from Bioerodible Polymers[M]. Amsterdam: Elsevier, 1980:1-17.
[35] WEIBULL W. A statistical distribution function of wide applicability[J]. Journal of Applied Mechanics, 1951, 18(3):293-297.
[36] HOPFENBERG H B. Controlled Release from Erodible Slabs, Cylinders, and Spheres[M]. Washington, D. C.: American Chemical Society, 1976:26-32.
[37] PEPPAS N A, KHARE A R. Preparation, structure and diffusional behavior of hydrogels in controlled release[J]. Advanced Drug Delivery Reviews, 1993, 11(1-2):1-35.
[38] KORSMEYER R W, LUSTIG S R, PEPPAS N A. Solute and penetrant diffusion in swellable polymers. I. Mathematical modeling[J]. Journal of Polymer Science Part B: Polymer Physics, 1986, 24(2):395-408.
[39] RITGER P L, PEPPAS N A. A simple equation for description of solute release II. Fickian and anomalous release from swellable devices[J]. Journal of Controlled Release, 1987, 5(1):37-42.
[40] PEPPAS N A, SAHLIN J J. A simple equation for the description of solute release. III. Coupling of diffusion and relaxation[J]. International Journal of Pharmaceutics, 1989, 57(2):169-172.
[41] ANSARIFAR E, MOHEBBI M, SHAHIDI F, et al. Novel multilayer microcapsules based on soy protein isolate fibrils and high methoxyl pectin: Production, characterization and release modeling[J]. International Journal of Biological Macromolecules, 2017, 97:761-769.
[42] MA Y J, ZHAO H Q, MA Q Y, et al. Development of chitosan/potato peel polyphenols nanoparticles driven extended-release antioxidant films based on potato starch[J]. Food Packaging and Shelf Life, 2022, 31:100793.
[43] TEBCHARANI L, WANZKE C, LUTZ T M, et al. Emulsions of hydrolyzable oils for the zero-order release of hydrophobic drugs[J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2021, 339:498-505.
[44] HUANG H, BELWAL T, LIN X Y, et al. Novel bind-then-release model based on fluorescence spectroscopy analysis with molecular docking simulation: New insights to zero-order release of arbutin and coumaric acid[J]. Food Hydrocolloids, 2021, 112:106356.
[45] WICHCHUKIT S, OZTOP M H, MCCARTHY M J, et al. Whey protein/alginate beads as carriers of a bioactive component[J]. Food Hydrocolloids, 2013, 33(1):66-73.
[46] CAI R, PAN S Y, LI R X, et al. Curcumin loading and colon release of pectin gel beads: Effect of different de-esterification method[J]. Food Chemistry, 2022, 389:133130.
[47] SAVIC GAJIC I M, SAVIC I M, SKRBA M, et al. Food additive based on the encapsulated pot marigold (Calendula officinalis L.) flowers extract in calcium alginate microparticles[J]. Journal of Food Processing and Preservation, 2022, 46(10): e15792.
[48] CHENG Q K, LIU L, XIE M Z, et al. A colon-targeted oral probiotics delivery system using an enzyme-triggered fuse-like microcapsule[J]. Advanced Healthcare Materials, 2021, 10(8): e2001953.
[49] RUBILAR J F, CRUZ R M S, ZU IGA R N, et al. Mathematical modeling of gallic acid release from chitosan films with grape seed extract and carvacrol[J]. International Journal of Biological Macromolecules, 2017, 104(Pt A):197-203.
IGA R N, et al. Mathematical modeling of gallic acid release from chitosan films with grape seed extract and carvacrol[J]. International Journal of Biological Macromolecules, 2017, 104(Pt A):197-203.
[50] CERISUELO J P, BERM DEZ J M, AUCEJO S, et al. Describing and modeling the release of an antimicrobial agent from an active PP/EVOH/PP package for salmon[J]. Journal of Food Engineering, 2013, 116(2):352-361.
DEZ J M, AUCEJO S, et al. Describing and modeling the release of an antimicrobial agent from an active PP/EVOH/PP package for salmon[J]. Journal of Food Engineering, 2013, 116(2):352-361.