有机酸是存在于各种食品中的天然化合物,可以用于防止食品变质以及延长食品的保质期,常作为食品添加剂和防腐剂使用[1]。有机酸具有广谱抑菌活性并且通常被认为是安全的化合物(generally recognized as safe,GRAS),除具有抑菌作用外,对产品的感官特性影响较小、成本低且易于使用,在食品工业中得到了广泛的应用[2]。如作为肉类的防腐剂[3]和清洗剂[4]、用于新鲜水果和蔬菜的消毒清洗[5]、挤奶工具或刀具的卫生清洁[6]等。常用的有机酸包括乳酸、乙酸、柠檬酸、苹果酸和丁酸等,前4种已被证明可以用于抑制新鲜农产品上包括大肠杆菌在内的食源性致病菌的生长[7-9],丁酸可用于消除家禽表面的沙门氏菌[10]以及减少仔猪肠道大肠杆菌的丰度[11]。单一有机酸在使用时需要达到一定的浓度,通常会导致成本提高、影响产品风味以及造成营养成分的损失。一些研究尝试联合有机酸应用于肉类和新鲜蔬菜的清洗消毒[12-13],能够取得较为有效的抑菌作用。
目前有关有机酸协同抑菌作用的理论研究较少,因此,本文通过测定5种有机酸(乙酸、乳酸、丁酸、柠檬酸、苹果酸)对大肠杆菌ATCC25922的最小抑菌浓度、半数有效抑菌浓度和有机酸组合(乙酸+乳酸、乙酸+乳酸+丁酸、乙酸+乳酸+柠檬酸、乙酸+乳酸+苹果酸)的联合抑菌指数,探究不同有机酸的联合抑菌效果。并研究有机酸及其组合对大肠杆菌细胞膜电位和微观形态的影响,初步探索有机酸及其组合的抑菌机理。
1 材料与方法
1.1 菌株、材料与试剂
大肠杆菌(Escherichia coli ATCC25922)由扬州大学乳品生物技术与安全控制重点实验室(中国扬州)保藏。使用前将大肠杆菌培养物与70%(体积分数)甘油溶液以1∶1的比例保存在-40 ℃冰箱。大肠杆菌培养在LB(luria-bertani)肉汤中。
乙酸、乳酸、丁酸、柠檬酸、苹果酸为分析纯,麦克林生化科技有限公司;罗丹明123染料,源叶生物有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
1501酶标仪,美国Thermo Scientific公司;RF-5301PC荧光分光光度计,日本岛津公司;S-4800Ⅱ场发射扫描电镜,日本日立公司。
1.3 实验方法
1.3.1 有机酸最小抑菌浓度和半数有效抑菌浓度测定
最小抑菌浓度(minimum inhibitory concentration, MIC)的测定参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)指南中描述的微量稀释法。
有机酸标准溶液的配制:有机酸使用生理盐水配制成100 mg/mL的标准溶液,利用过滤除菌法对供试样品进行除菌,防止后期杂菌的污染。
细菌悬液配制:大肠杆菌第一代培养12 h,离心去上清液(4 500 r/min,5 min),加入生理盐水调整OD600至0.35后,LB肉汤稀释100倍。
MIC测定:取无菌96孔聚苯乙烯微孔板,在生物安全柜中用微量移液枪在第1孔中加入经LB肉汤稀释后质量浓度为10 240 μg/mL的有机酸溶液200 μL,第2孔~第8孔中加入100 μL LB肉汤,使用移液枪依次进行二倍稀释,最后一孔弃去100 μL液体,每孔再加入细菌悬液100 μL。第1孔~第8孔有机酸质量浓度分别为5 120、2 560、1 280、640、320、160、80、40 μg/mL。每种有机酸至少设置3个平行,空白对照为等量的生理盐水。加液完成后加盖上板,轻微振荡混匀,37 ℃培养24 h。培养完成后使用酶标仪测定OD600值,OD600值和空白对照无显著差异的最小有机酸浓度为该有机酸的MIC。
半数有效抑菌浓度(median effective concentration,EC50)计算:通过非线性拟合曲线计算得到抑菌率为50%时的有机酸浓度,即为EC50,拟合模型为Dose Resp模型。
有机酸抑菌率计算如公式(1)所示:
抑菌率![]()
(1)
式中:OD对照组为培养24 h后空白对照组的OD600值,OD实验组为培养24 h后实验组的OD600值。
1.3.2 有机酸联合抑菌指数测定
参考文献[14]中的实验方法并做出适当改进。2种有机酸之间协同抑菌能力的测定:在96孔微孔板中设置棋盘格,以获得联合抑菌指数(fractional inhibitory concentration index, FICI),按照微量棋盘法横向和竖向分别加入乙酸和乳酸溶液,调整总体系浓度分别为1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC,加入LB肉汤定容至100 μL后在每个棋盘格中加入100 μL细菌悬液,37 ℃恒温培养箱中孵育24 h后测定OD600值。
FICI计算如公式(2)所示:
(2)
式中:![]() 和
和![]() 为单一组分A和B的
为单一组分A和B的![]() 和
和![]() 为A和B在组合中的有效质量浓度,μg/mL;FICI≤0.5,协同作用;0.5
为A和B在组合中的有效质量浓度,μg/mL;FICI≤0.5,协同作用;0.5
3种有机酸之间协同抑菌能力测定:根据微量棋盘法进行改进,将二维棋盘法升级为三维棋盘法,用于测试3种抑菌物质之间的联合抑菌能力,按照微量棋盘法横向和竖向分别加入乙酸和乳酸溶液,调整总体系浓度分别为1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC,每个棋盘格中再分布加入第3种有机酸(丁酸、柠檬酸和苹果酸),调整总体系浓度分别为1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC,加入LB肉汤定容至100 μL后,再加入100 μL菌悬液,37 ℃恒温培养箱中孵育24 h后测定OD600值。如公式(3)所示:
(3)
式中:![]() 和
和![]() 为单一组分A、B和C的
为单一组分A、B和C的![]() 和
和![]() 为A、B和C在组合中的有效质量浓度,μg/mL;FICI≤0.5,协同作用;0.5
为A、B和C在组合中的有效质量浓度,μg/mL;FICI≤0.5,协同作用;0.5
1.3.3 细胞膜电位测定
将培养至对数生长期的大肠杆菌于4 ℃、4 500 r/min离心10 min,生理盐水洗涤3次,加入无菌水制成菌悬液,调整菌株OD600值至0.4。加入有机酸标准溶液,调整至各有机酸的MIC和有机酸组合的最佳抑菌浓度,生理盐水作为对照组。洗涤后加入罗丹明123溶液(5 μg/mL),避光培养30 min后使用荧光分光光度计测定荧光强度,测定激发波长和发射波长分别为480 nm和540 nm,数据用平均荧光强度(average fluorescence intensity,MFI)表示。
1.3.4 细胞微观形态观察
将培养至对数生长期的致病菌于4 ℃、4 500 r/min离心10 min,生理盐水洗涤3次,加入生理盐水制成菌悬液,调整菌株OD600值至0.4。加入有机酸标准溶液,调整至各有机酸的MIC和有机酸组合的最佳抑菌浓度,生理盐水作为对照组。孵育4 h后收集菌体并用磷酸盐缓冲液清洗2次,在4 ℃下使用2.5%(体积分数)戊二醛固定4 h。样品经无菌去离子水洗涤3次除去戊二醛,再用不同体积分数乙醇溶液(30%、50%、70%、85%、90%、100%)进行梯度逐级脱水,每次脱水10 min,脱水结束后再用100%乙醇重复处理3次,每次15 min。脱水的细胞使用液氮处理以蒸发乙醇。干燥、喷金后使用场发射扫描电镜观察细菌细胞微观形态。
1.4 数据统计与分析
所有实验均重复3次取其平均值。实验数据采用OriginPro 2022绘图,采用SPSS 25.0统计软件进行单因素ANOVA判断,P<0.05表示具有显著性差异。EC50的计算使用OriginPro2022软件,选择Dose Resp模型进行非线性拟合。
2 结果与分析
2.1 有机酸对大肠杆菌MIC和EC50的影响
MIC是指微生物在特定生长环境下培养一段时间,可抑制某种微生物明显增长的最低药物浓度,用于定量测定抑菌物质的体外抗菌活性。由图1可知,本研究中乙酸、乳酸和丁酸的MIC为2 560 μg/mL,柠檬酸和苹果酸的MIC为5 120 μg/mL,通过测试得出不同有机酸的MIC后,利用棋盘格法研究不同有机酸的联合抑菌效果。EC50可以更加准确地反映不同有机酸之间的抑菌能力差异,根据图1-c、图1-e可知,丁酸抑制大肠杆菌的能力最强,EC50为964.32 μg/mL,苹果酸的EC50为1 727.72 μg/mL,抑菌能力最弱。由图1-a~图1-d可知,乙酸、乳酸、柠檬酸的EC50分别为1 004.90、1 497.50、1 406.02 μg/mL。
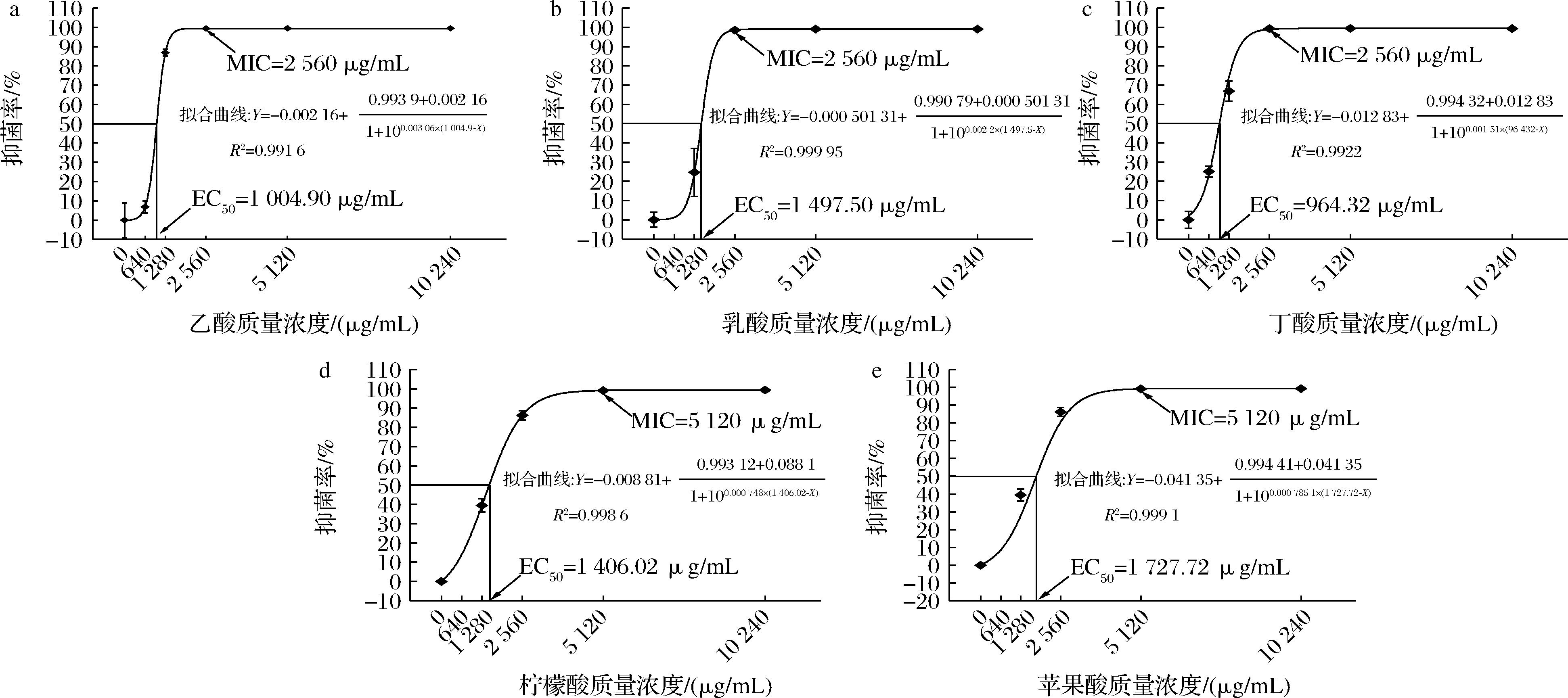
a-乙酸;b-乳酸;c-丁酸;d-柠檬酸;e-苹果酸
图1 有机酸对大肠杆菌的MIC和EC50
Fig.1 MIC and EC50 of organic acids against E.coli
注:抑菌率表示为多次实验的平均值(n≥3),误差线表示标准偏差。
2.2 有机酸对大肠杆菌的联合抑菌作用
棋盘格法和固定组合法通常用于研究有机酸的协同抑菌效果,BURNS等[15]利用棋盘格法研究了弱有机酸两两组合对部分致病菌的联合抑菌作用,结果表现为协同或相加效应。相关研究表明,乙酸和乳酸组合可用于新鲜叶菜的消毒处理,能够明显降低蔬菜表面大肠杆菌和李斯特菌等致病菌的活菌数,且不会造成蔬菜颜色和多酚含量的损失[13]。PEH等[16]将3~5种有机酸以固定的比例进行组合研究其协同抑菌效果,10种有机酸组合中有9组具有协同抑菌活性。
由图2-a可知,乙酸和乳酸的最佳抑菌组合为640 μg/mL乙酸+640 μg/mL乳酸,联合抑菌表现为相加作用(FICI=0.500)。因此,虽然乙酸和乳酸联用虽然能够降低有机酸的使用量,但是并不表现出明显的协同抑菌能力。由图2-b~图2-d可知,320 μg/mL乙酸+320 μg/mL乳酸+320 μg/mL丁酸、80 μg/mL乙酸+80 μg/mL乳酸+1 280 μg/mL柠檬酸和320 μg/mL乙酸+320 μg/mL乳酸+640 μg/mL苹果酸为抑制大肠杆菌生长的最佳抑制组合,FICI分别为0.375、0.316和0.375,均表现为协同作用,因此3种有机酸联用具有协同抑菌作用且强于两种有机酸联用。
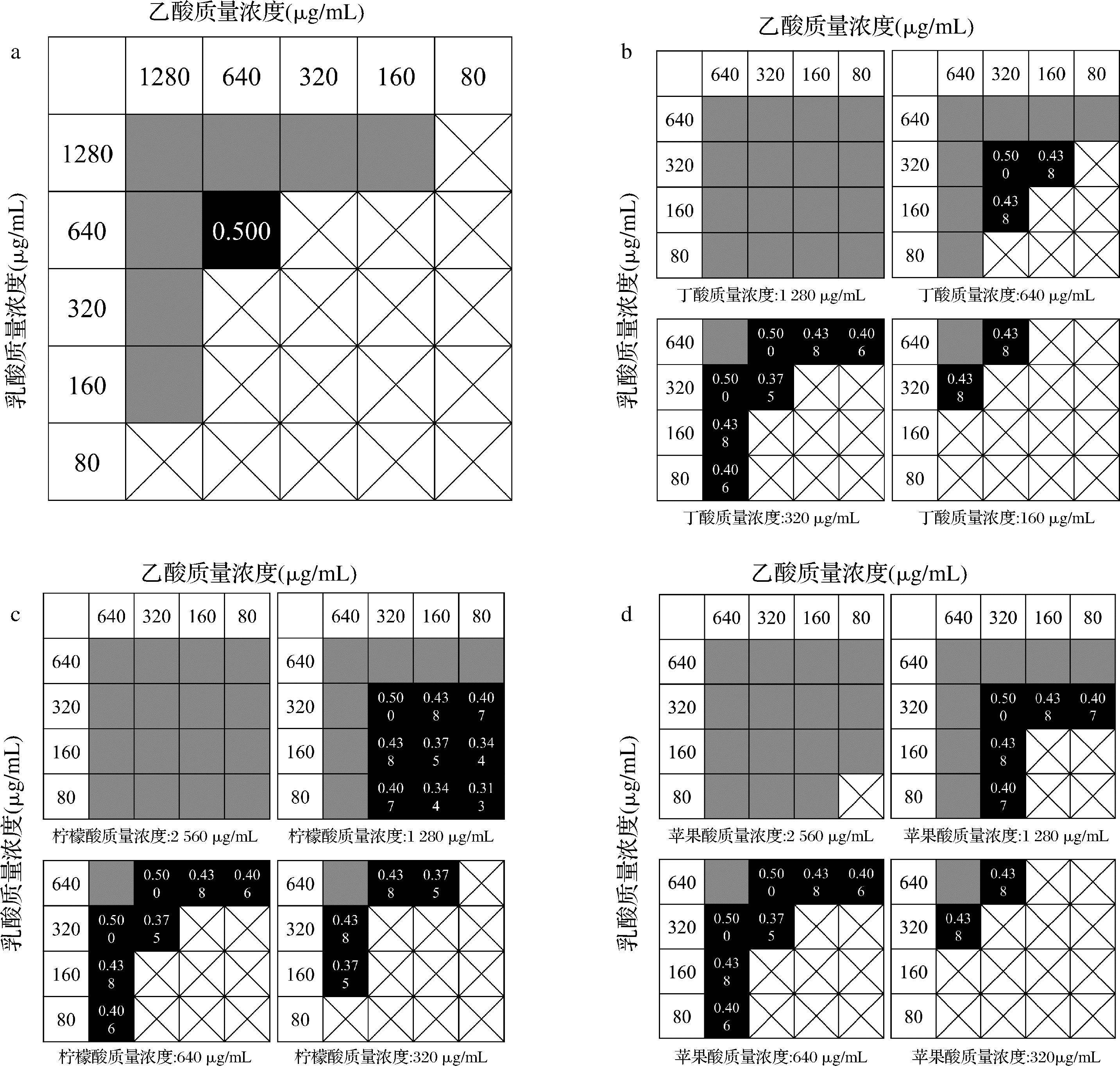
a-乙酸+乳酸;b-乙酸+乳酸+丁酸;c-乙酸+乳酸+柠檬酸;d-乙酸+乳酸+苹果酸
图2 有机酸组合的联合抑菌效果图示
Fig.2 Graphical representation of the combined antibacterial effect of organic acid combinations
注: 表示未观察到大肠杆菌生长;
表示未观察到大肠杆菌生长;  表示观察到大肠杆菌生长;
表示观察到大肠杆菌生长; ![]() 表示未观察到大肠杆菌生长且FICI≤0.500。
表示未观察到大肠杆菌生长且FICI≤0.500。
2.3 有机酸及其组合对大肠杆菌细胞膜电位的影响
膜电位是指生物细胞膜内部和外部之间的电势差,作为质子动力的一个元素参与了ATP的产生,在细菌维持微生物平衡和抗抑菌剂过程中起到重要作用[17-18],膜电位的降低会影响代谢功能从而导致细菌死亡[19]。罗丹明123是一种阳离子染料,可利用膜电位穿过细胞膜和细胞壁进入细胞基质,其荧光强度和膜电位呈正相关[20]。
由图3可知,相较于对照组,1MIC的乙酸、乳酸、柠檬酸和苹果酸处理大肠杆菌后,细胞膜电位分别降低了26.24%、22.22%、10.65%和23.96%,最佳抑制浓度的乙酸+乳酸、乙酸+乳酸+柠檬酸和乙酸+乳酸+苹果酸分别使大肠杆菌膜电位降低了11.81%、4.75%和18.28%,而丁酸和乙酸+乳酸+丁酸会导致大肠杆菌膜电位的上升。相关研究表明最小抑菌浓度的乙酸和乳酸会导致阴道嗜血杆菌细胞膜电位下降[21],柠檬烯同样也会导致荧光假单胞菌的膜电位下降[22]从而达到抑菌作用。因此,最小抑菌浓度的乙酸、乳酸、柠檬酸和苹果酸能够通过诱导大肠杆菌细胞膜去极化,导致细胞代谢功能紊乱以及细胞死亡,而最小抑菌浓度的丁酸不具有影响细菌膜电位的能力。
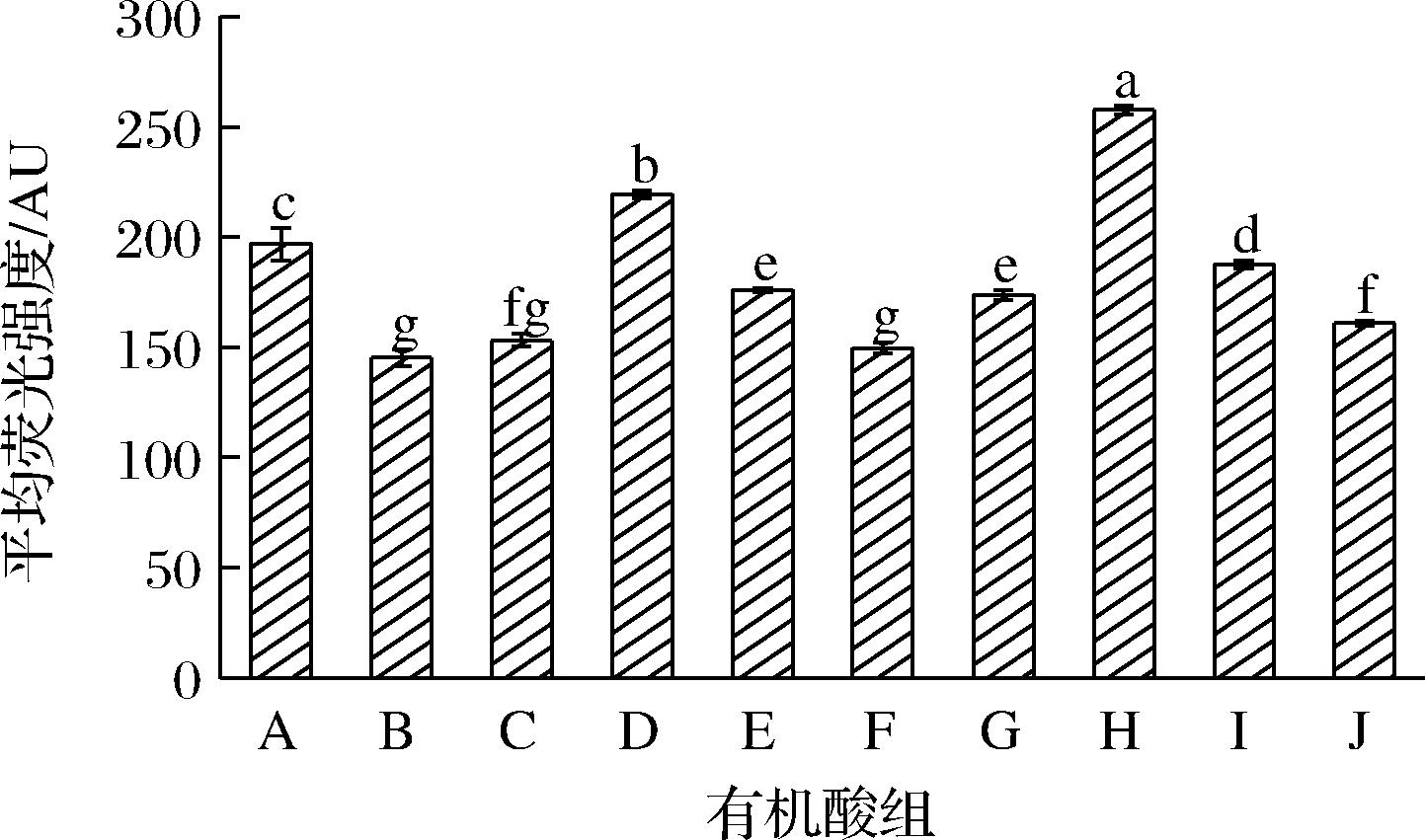
A-对照组;B-1MIC乙酸;C-乳酸:D-丁酸;E-柠檬酸;F-苹果酸; G-乙酸+乳酸;H-乙酸+乳酸+丁酸;I-乙酸+乳酸+柠檬酸; J-乙酸+乳酸+苹果酸
图3 有机酸及其组合对大肠杆菌细胞膜电位影响
Fig.3 Effect of organic acids and their combinations on the cell membrane potential of E.coli
注:结果表示为3次实验的平均值(n=3),误差线表示标准偏差, 不同小写字母表示有机酸组之间的统计学差异(P<0.05)。
2.4 食用有机酸及其组合对大肠杆菌细胞形态的影响
研究发现大肠杆菌暴露于0.5%乳酸后,利用透射电镜能够观察到细菌细胞的一般形态仍会保留,但细胞膜层结构的完整性受到严重破坏,大多数细菌细胞坍塌甚至破碎,细胞中可以观察到明显的凹坑和间隙[23],原子力显微镜同样观察到类似的现象[24]。宁亚维等[25]使用1MIC的苯乳酸和乙酸处理大肠杆菌,扫描电镜图分析表明大肠杆菌菌体出现凹陷变形,但对细胞壁和膜的完整性影响有限。本文利用扫描电镜分析有机酸对大肠杆菌细胞超微结构的影响,从图4-a中可以看出,对照组中大肠杆菌细胞显示出规则的杆状结构,细胞大小分布均匀。观察图4-b~图4-j,有机酸和有机酸组合处理过的大肠杆菌细胞表现出明显的形态变化,多数菌体出现收缩、弯曲变形和表面粗糙现象,少数个别菌体出现凹陷、胞内物质泄露和菌体粘连现象。
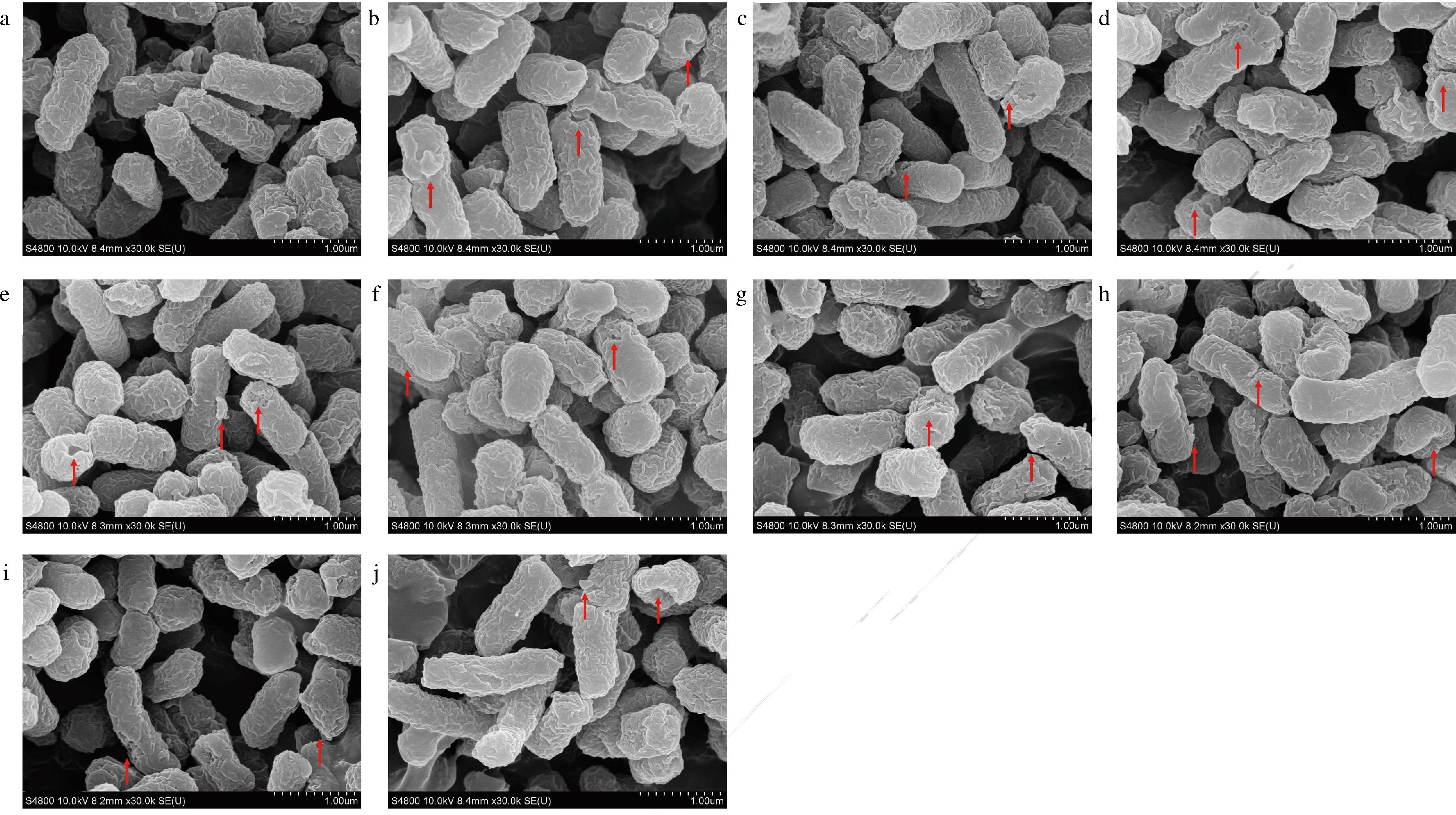
a-对照组;b-乙酸;c-乳酸;d-丁酸;e-柠檬酸;f-乙酸+乳酸;g-乙酸+乳酸;h-乙酸+乳酸+丁酸;i-乙酸+乳酸+柠檬酸; j-乙酸+乳酸+苹果酸
图4 有机酸及其组合对大肠杆菌细胞微观形态的影响
Fig.4 Effect of organic acids and their combinations on the microscopic morphology of E.coli cells
有机酸能够透过细胞膜对细胞内部产生作用,导致菌体变形以及细胞局部破裂。本文扫描电镜结果表明,最小抑菌浓度的单一有机酸以及有机酸之间的联合使用均会导致大肠杆菌胞内物质泄露,细胞膜皱缩以及细胞形态发生变化。
3 结论与展望
乙酸、乳酸和丁酸对大肠杆菌ATCC25922的MIC为2 560 μg/mL,柠檬酸和苹果酸对大肠杆菌的MIC为5 120 μg/mL。乙酸、乳酸、丁酸、柠檬酸和苹果酸的EC50分别为1 004.90、1 497.50、964.32、1 406.02/1 727.72 μg/mL。1/4 MIC乙酸+1/4 MIC乳酸、1/8 MIC乙酸+1/8 MIC乳酸+1/8 MIC丁酸、1/32 MIC乙酸+1/32 MIC乳酸+1/4 MIC柠檬酸以及1/8 MIC乙酸+1/8 MIC乳酸+1/8 MIC苹果酸,即可达到单一有机酸质量浓度为1 MIC时的抑菌效果。
乙酸和乳酸联用表现为相加作用,3种有机酸进行组合时(乙酸+乳酸+丁酸、乙酸+乳酸+柠檬酸、乙酸+乳酸+苹果酸)对大肠杆菌表现出显著的协同抑菌作用。1 MIC的乙酸、乳酸、柠檬酸、苹果酸以及最佳抑菌浓度的乙酸+乳酸、乙酸+乳酸+柠檬酸和乙酸+乳酸+苹果酸能够降低大肠杆菌细胞膜电位,影响大肠杆菌的代谢活性。1 MIC的有机酸和最佳抑菌浓度的有机酸组合均能够导致大肠杆菌细胞膜破裂,细胞微观形态发生改变。
有机酸在合理的比例下组合使用时能够起到协同抑菌作用,在较低的使用量下抑制致病菌的生长。有机酸组合在食品生产和加工过程中,可以用于控制微生物污染和食源性病原体的传播,有望成为克服细菌抗生素耐药性的替代方案。由于其抑菌特性受到生物体生理状态和外部环境的显著影响,并且有机酸的广泛使用可能导致细菌耐酸性提高,因此未来可以通过基因组学或蛋白组学等手段进一步深入研究有机酸协同抑菌的内在机制,并结合其他抑菌保鲜技术(化学、物理和生物),设计基于有效协同活性或附加效果的改进抑菌策略,用以满足现代消费者对食品安全和品质的要求。
[1] RICKE S C.Perspectives on the use of organic acids and short chain fatty acids as antimicrobials[J].Poultry Science, 2003, 82(4):632-639.
[2] COBAN H B.Organic acids as antimicrobial food agents:Applications and microbial productions[J].Bioprocess and Biosystems Engineering, 2020, 43(4):569-591.
[3] BEN BRAÏEK O, SMAOUI S.Chemistry, safety, and challenges of the use of organic acids and their derivative salts in meat preservation[J].Journal of Food Quality, 2021, 2021:6653190.
[4] WHEELER T L, KALCHAYANAND N, BOSILEVAC J M.Pre-and post-harvest interventions to reduce pathogen contamination in the U.S. beef industry[J].Meat Science, 2014, 98(3):372-382.
[5] YOON J H, LEE S Y.Review:Comparison of the effectiveness of decontaminating strategies for fresh fruits and vegetables and related limitations[J].Critical Reviews in Food Science and Nutrition, 2018, 58(18):3189-3208.
[6] AKBAS M Y, CAG S.Use of organic acids for prevention and removal of Bacillus subtilis biofilms on food contact surfaces[J].Food Science and Technology International, 2016, 22(7):587-597.
[7] CHEN L, LIU Q, ZHAO X, et al.Inactivation efficacies of lactic acid and mild heat treatments against Escherichia coli strains in organic broccoli sprouts[J].Food Control, 2022, 133:108577.
[8] AL-ROUSAN W M, OLAIMAT A N, OSAILI T M, et al.Use of acetic and citric acids to inhibit Escherichia coli O157∶H7, Salmonella typhimurium and Staphylococcus aureus in tabbouleh salad[J].Food Microbiology, 2018, 73:61-66.
[9] CHOI M R, LEE S Y, PARK K H, et al.Effect of aerosolized malic acid against Listeria monocytogenes, Salmonella typhimurium, and Escherichia coli O157∶H7 on spinach and lettuce[J].Food Control, 2012, 24(1-2):171-176.
[10] FERN NDEZ-RUBIO C, ORD
NDEZ-RUBIO C, ORD
 EZ C, ABAD-GONZ
EZ C, ABAD-GONZ LEZ J, et al.Butyric acid-based feed additives help protect broiler chickens from Salmonella enteritidis infection[J].Poultry Science, 2009, 88(5):943-948.
LEZ J, et al.Butyric acid-based feed additives help protect broiler chickens from Salmonella enteritidis infection[J].Poultry Science, 2009, 88(5):943-948.
[11] COELHO M, ADER P.PSIV-16 Effect of a 1-monoglyceride, 1, 2-diglyceride of butyric-, caproic-and caprilic acid, and Avilamycin on performance and intestinal E.coli when fed to piglets challenged with E.coli[J].Journal of Animal Science, 2019, 97(S2):188-189.
[12] ANDERSON M E, MARSHALL R T, DICKSON J S.Efficacies of acetic, lactic and two mixed acids in reducing number of bacteria on surface of learn meat[J].Journal of Food Safety, 1991, 12(2):139-147.
[13] WANG J Y, SUN Y T, TAO D B, et al.Reduction of Escherichia coli O157∶H7, Listeria monocytogenes, and naturally present microbe counts on lettuce using an acid mixture of acetic and lactic acid[J].Microorganisms, 2019, 7(10):373.
[14] GUTIERREZ J, BARRY-RYAN C, BOURKE P.The antimicrobial efficacy of plant essential oil combinations and interactions with food ingredients[J].International Journal of Food Microbiology, 2008, 124(1):91-97.
[15] BURNS J, MCCOY C P, IRWIN N J.Synergistic activity of weak organic acids against uropathogens[J].The Journal of Hospital Infection, 2021, 111:78-88.
[16] PEH E, KITTLER S, REICH F, et al.Antimicrobial activity of organic acids against Campylobacter spp.and development of combinations—A synergistic effect?[J].PloS One, 2020, 15(9):e0239312.
[17] MITCHELL P.Chemiosmotic coupling in oxidative and photosynthetic phosphorylation[J].Biological Reviews, 1966,41(3):445-501.
[18] BORGES A, FERREIRA C, SAAVEDRA M J, et al.Antibacterial activity and mode of action of ferulic and gallic acids against pathogenic bacteria[J].Microbial Drug Resistance, 2013, 19(4):256-265.
[19] RAMZAN R, STANIEK K, KADENBACH B, et al.Mitochondrial respiration and membrane potential are regulated by the allosteric ATP-inhibition of cytochrome c oxidase[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2010, 1797(9):1672-1680.
[20] BARACCA A, SGARBI G, SOLAINI G, et al.Rhodamine 123 as a probe of mitochondrial membrane potential:Evaluation of proton flux through F(0) during ATP synthesis[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2003, 1606(1-3):137-146.
[21] HUANG Y P, SHI J Y, LUO S C, et al.Antimicrobial substances and mechanisms of Lactobacillus rhamnosus against Gardnerella vaginalis[J].Probiotics and Antimicrobial Proteins, 2023, 15(2):400-410.
[22] SHU H Z, TANG Z L, LIU X, et al.Antibacterial activity and mechanism of limonene against Pseudomonas fluorescens[J].Science and Technology of Food Industry, 2019, 40:134-140.
[23] WANG C J, CHANG T, YANG H, et al.Antibacterial mechanism of lactic acid on physiological and morphological properties of Salmonella Enteritidis, Escherichia coli and Listeria monocytogenes[J].Food Control, 2015, 47:231-236.
[24] CHEN L, ZHANG H F, LIU Q, et al.Sanitising efficacy of lactic acid combined with low-concentration sodium hypochlorite on Listeria innocua in organic broccoli sprouts[J].International Journal of Food Microbiology, 2019, 295:41-48.
[25] 宁亚维, 付浴男, 何建卓, 等.苯乳酸和醋酸联用对大肠杆菌的抑菌机理 [J].食品科学, 2021, 42(3):77-84. NING Y W, FU Y N, HE J Z, et al.Antibacterial mechanism of phenyllactic acid combined with acetic acid on Escherichia coli[J].Food Science, 2021, 42(3):77-84.