茶树花着生于茶树新梢叶腋间,属于两性花,是茶树重要的生殖器官之一。茶树花黄酮与茶叶中黄酮基本类似,一般以糖苷结构为主,具有消炎、抗肿瘤、抗氧化、抗动脉硬化、抗菌及抗病毒、抗肝脏毒性、降低胆固醇等生物活性[1-3]。茶树花所含黄酮虽比茶叶、茶树新芽中所含黄酮种类少,但其含量远高于其他花卉。茶树花的生长会与第二年萌发的新芽争夺营养,致使新茶的品质降低。目前,茶农一般会将茶树花作为废弃物除去,造成资源的严重浪费[4-5]。据国家统计局数据推算,2020年我国茶树花产量可达300 t。因此,研究茶树花中丰富的茶树花黄酮,并进行充分加工利用已成为近年的研究热点。茶树花黄酮中多为杨梅素苷、槲皮素苷、山奈酚苷,均以三糖基黄酮苷为主,因而水溶度低,限制了其生物活性的发挥。
郑华明等[6]制备了玉米醇溶蛋白-香芹酚纳米颗粒,具有良好的贮存稳定性和抗氧化性能。马永强等[7]发现利用脂质体对番茄红素进行包埋后,其稳定性显著提高。刘烨等[8]采用反溶剂法制备负载白藜芦醇的玉米醇溶蛋白-果胶纳米颗粒,提高了白藜芦醇在体内的抗炎能力。因此纳米包埋技术能够较好地保护功能成分的生物活性,提高其稳定性及生物利用度[9-10]。利用玉米醇溶蛋白为载体制备负载多酚的纳米颗粒,以提高多酚的稳定性,延长其抗氧化活性具有重要意义。有研究表明,黄晓霞等[11]利用反溶剂法研制负载姜黄素的玉米醇溶蛋白纳米颗粒,其总抗氧化能力约为姜黄素乙醇溶液的2倍。HU等[12]探究了纳米颗粒能稳定柑橘类黄酮的稳定性和抗氧化活性。而目前,对茶树花黄酮的研究仍集中于分离、纯化和不同种类茶树花中黄酮含量的差别等方面,还未有对其进行包埋制作纳米颗粒的研究。
为保护茶树花黄酮的抗氧化活性,提高其利用率及稳定性,本文选取茶树花黄酮作为芯材,玉米醇溶蛋白及果胶纳米颗粒作为壁材制备茶树花黄酮纳米颗粒,同时探索了纳米颗粒的基本性质与抗氧化性,有望提高茶树花黄酮的利用价值,为茶树花资源开发利用提供一定理论参考。
1 材料与方法
1.1 材料与试剂
茶树花黄酮源于实验室制备,纯度为60.3%。
玉米醇溶蛋白,上海麦克林生化科技股份有限公司;芦丁,中国药品生物制品检定所;果胶、DPPH、ABTS,Sigma公司;无水乙醇、亚硝酸钠、硝酸银、氢氧化钠等均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
FS-1200pv型超声波探头处理器,上海生析超声仪器有限公司;UV-265型分光光度计,日本岛津公司;Omni型动态光散射粒径分析仪,美国Brookhaven科技有限公司;HT7700型透射电子显微镜,日本HITACHI公司;CR21 N型高速冷冻离心机,日本日立工机株式会社;RE-2000A型真空旋转蒸发仪,上海亚荣生化仪器厂;SYNERGY H1型多功能酶标仪,美国BioTek伯腾仪器有限公司;BTP-3XL型冷冻干燥仪,美国Virtis公司;Q20型差示扫描量热仪,美国TA仪器有限公司;Nicolet iS5型傅里叶红外光谱仪,赛默飞世尔科技公司;Nano nova 450型扫描电子显微镜,FEI公司。
1.3 实验方法
1.3.1 负载茶树花黄酮的玉米醇溶蛋白/果胶纳米颗粒的制备
参照周浓等[13]和FENG等[14]的试验方法,准确称取0.125 g玉米醇溶蛋白,加入到5 mL 70%(体积分数)的乙醇溶液中,使玉米醇溶蛋白完全分散溶解。再加入0.005 g茶树花黄酮样品,制备成m(茶树花黄酮)∶m(玉米醇溶蛋白)=1∶25的茶树花黄酮-玉米醇溶蛋白乙醇溶液。将上述茶树花黄酮-玉米醇溶蛋白乙醇溶液逐滴加入到50 mL去离子水中,同时将溶液置于脉冲模式1 s,超声波功率200 W的超声波探头处理器中。待完全溶解后用旋转蒸发仪蒸发溶液中的乙醇,随后用去离子水定容至50 mL,获得茶树花黄酮-玉米醇溶蛋白纳米溶液(tea flower flavonoids zein-nanoparticles,FZ-NPs)。将茶树花黄酮-玉米醇溶蛋白纳米溶液倒入25 mL果胶溶液中,不断搅拌5 min,以形成负载茶树花黄酮-玉米醇溶蛋白-果胶纳米颗粒(tea flower flavonoids zein-pectin nanoparticles,FZP-NPs)。采用同法制备芦丁-玉米醇溶蛋白纳米溶液(rutin zein-nanoparticles,RZ-NPs)和芦丁-玉米醇溶蛋白-果胶纳米颗粒(rutin zein-pectin nanoparticles,RZP-NPs),用以后续实验对照观察。
1.3.2 粒径及电位测定
参照FENG等[15]的方法,采用动态光散射粒径分析仪在25 ℃下测定样品粒径和电位。测量时取1 mL样品加入样品池,在25 ℃下平衡60 s后测量。所有样品均重复测定3次。
1.3.3 包埋率测定
参照LIU等[16]的方法,将样品在6 000 r/min下离心15 min,吸去上清液,从离心管底部收集所得沉淀物,溶解于2 mL 70%乙醇溶液中。将上述溶液与0.4 mL水一起加到10 mL容量瓶,加入0.4 mL 5%NaNO2,混合均匀后静置10 min,再加入0.6 mL 100g/L Al(NO3)3溶液,混合均匀。加入4 mL 40 g/L NaOH混合均匀后静置10 min,用水作为空白对照,紫外分光光度计在510 nm处测定吸光度A。样品中茶树花黄酮/芦丁的含量,根据芦丁标准曲线进行计算,芦丁标准曲线:y=0.027x-0.022,y代表吸光度A;x代表质量浓度(μg/mL)。包埋率(encapsalution efficency,EE)的计算如公式(1)所示:
(1)
式中:C游离和C总量分别是纳米分散体系中游离茶树花黄酮和总茶树花黄酮的浓度。
1.3.4 扫描电子显微镜(scanning electron microscope,SEM)测定
参照王记莲[17]的方法,利用SEM对样品粒子的表面形貌进行观察。将冻干粒子取少量放在清洁硅片上,在真空下将粒子镀上铂,随后使用SEM观察。
1.3.5 透射电子显微镜(transmission electron microscope,TEM)测定
参照韩赫等[18]的方法,利用TEM对样品粒子的微观形貌进行观察。用去离子水将样品稀释到合适的浓度。将约2 μL的纳米分散粒滴在铜网上,然后在室温(25 ℃)下干燥,无染色,用TEM观察。
1.3.6 傅里叶红外对纳米颗粒结构的测定
为检测不同类型分子之间的相互作用并检测茶树花黄酮的包封情况,参照徐群娜等[19]的方法,将样品粉末与溴化钾粉末同时研磨制备溴化钾压片,使用傅里叶红外光谱仪(Fourier transform infrared spectroscopy,FTIR)测量红外曲线。以2 cm-1的分辨率在500~4 000 cm-1的波数范围内扫描得到样品的FTIR图。
1.3.7 差示扫描量热法对纳米颗粒结构的测定
参照王国雨等[20]的方法,称取5 mg左右冻干粒子样品于铝盒中密封压紧后置于坩埚中,以密封空铝盒作为空白对照,在20 mL/min的氮气流下,设置实验温度从25 ℃加热至250 ℃(升温速率为10 ℃/min),对样品进行差示扫描量热分析。
1.3.8 DPPH自由基清除能力的测定
参照兰文忠等[21]的方法,取2 mL DPPH(0.1 mmol/L,溶于无水乙醇)标准溶液和2 mL样液到试管中,振荡混匀,25 ℃水浴30 min,517 nm下测定混合物吸光度。通过用无水乙醇代替DPPH乙醇溶液作为对照,用蒸馏水代替样液作为空白对照。清除率的计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:Ai为样品溶液+DPPH乙醇溶液吸光度值;Aj为样品溶液+无水乙醇吸光度值;A0为蒸馏水+DPPH乙醇溶液吸光度。
1.3.9 ABTS阳离子自由基清除能力的测定
参照马娇等[22]的方法,配制7 mmol/L的ABTS阳离子的储备液和2.45 mmol/L的过硫酸钾储备液,在使用前按体积比1∶1将两者混合,室温条件下避光静置12~16 h产生ABTS阳离子自由基。试验时用PBS缓冲溶液稀释(pH 4.0),使其在734 nm处吸光度值为0.70±0.02,得到ABTS阳离子工作液。取4 mL ABTS阳离子工作液与4 mL样品液混合,25 ℃下避光放置10 min,于734 nm下测定吸光度。试验用PBS缓冲溶液进行调零,空白管用蒸馏水代替样品。清除率的计算如公式(3)所示:
ABTS阳离子自由基清除率![]()
(3)
1.4 数据处理与分析
所有实验进行3次平行处理,采用Prism 8.0软件对数据进行处理,LSD多重比较在P<0.05显著和P<0.01水平极显著,结果以平均值±标准差表示。
2 结果与分析
2.1 纳米颗粒粒径、电位及包埋率
采用动态光散射粒径分析仪测得的负载茶树花黄酮纳米颗粒与负载芦丁的纳米颗粒的粒径见表1。可见,4种纳米颗粒的粒径分布为100~500 nm。未加入果胶的FZ-NPs和RZ-NPs纳米颗粒粒径较小,为168 nm和175 nm,加入果胶以后的FZP-NPs和RZP-NPs的粒径显著增大,为238 nm和476 nm。原因应是果胶的加入使纳米颗粒间发生交联反应,使得纳米颗粒粒径变大[23]。4种纳米颗粒的电位也有显著差异,FZ-NPs、FZP-NPs分别为-1.9、-27.38 mV,RZ-NPs、RZP-NPs分别为47.55、1.03 mV,说明在该制备条件下,茶树花黄酮比芦丁提供更多的羟基与玉米醇溶蛋白中的氨基发生相互作用。而果胶的加入,均引起茶树花黄酮纳米颗粒和芦丁纳米颗粒的电位下降,是由于阴离子的果胶吸附到蛋白质纳米颗粒表面,使颗粒稳定性逐渐增加,直到果胶在颗粒表面吸附达到饱和,形成稳定的纳米颗粒分散液[11]。4种纳米颗粒的包埋率都较高,均在96%以上,较文献中玉米醇溶蛋白-番石榴黄酮复合纳米颗粒(93.29%)和玉米醇溶蛋白-芦丁复合纳米颗粒(90%)的包埋率更高[15, 24],说明本试验的制备方式对茶树花黄酮与芦丁的包埋效果较好。
表1 纳米颗粒的粒径、电位及包埋率
Table 1 Particle size, potential and entrapment efficiency of nanoparticles

样品 粒径/nm电位/mV包埋率/%FZ-NPs 168±51.32c-1.9±0.45c98.56±0.049aRZ-NPs 175±103.98c47.55±1.67a96.23±0.014cFZP-NPs238±4.55b-27.38±1.08d 97.51±0.13bRZP-NPs476±3.39a 1.03±0.81b97.97±0.02b
注:采用LSD法进行多重比较,同一列中不同字母表示在P<0.05水平差异显著。
2.2 扫描电镜图分析结果
用SEM对茶树花黄酮纳米颗粒及芦丁纳米颗粒的形貌进行表征,结果如图1所示。由图1可以直观地观察到4种纳米颗粒的微观结构均为圆形或椭圆形,尺寸较为均匀。测得RZ-NPs、FZ-NPs、RZP-NP、FZP-NPs四种纳米颗粒的粒径与动态光散射粒径分析仪表征结果大小基本一致。RZP-NPs、FZP-NPs表面的褶皱可能是因为果胶的加入,FZ-NPs和RZ-NPs与果胶之间通过静电相互作用形成了蛋白质-多糖二元复合物[25]。
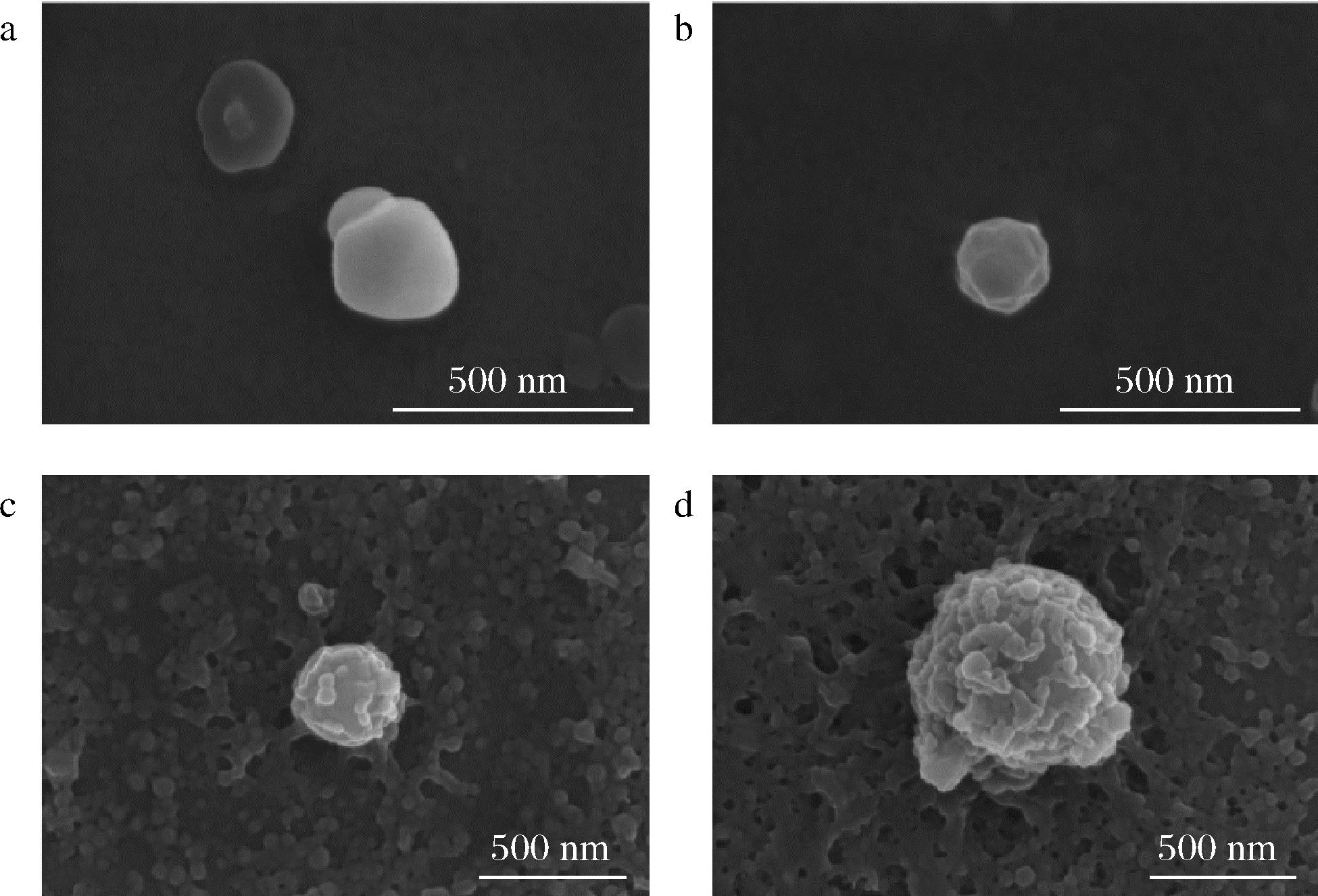
a-RZ-NPs;b-FZ-NPs;c-RZP-NP;d-FZP-NPs
图1 RZ-NPs、FZ-NPs、RZP-NPs、FZP-NPs的纳米 分散系的扫描电镜图
Fig.1 Scanning electron microscopy of nano dispersions of RZ-NPs, FZ-NPs, RZP-NPs, and FZP-NPs
2.3 透射电镜图分析结果
用TEM对4种纳米颗粒的形貌进行表征,结果如图2所示。由图2可以看出FZ-NPs、RZ-NPs、FZP-NPs、RZP-NPs的纳米颗粒为规则的球形,大小均一,黄酮及芦丁被玉米醇溶蛋白包裹。添加果胶之后,FZP-NPs、RZP-NPs因果胶吸附在纳米颗粒表面产生交联作用,使得表面变得粗糙并聚集在一起。

a-RZ-NPs;b-FZ-NPs;c-RZP-NP;d-FZP-NPs
图2 RZ-NPs、FZ-NPs、RZP-NPs、FZP-NPs的纳米分散系的 透射电镜图
Fig.2 Transmission electron micrographs of nano dispersions of RZ-NPs, FZ-NPs, RZP-NP, and FZP-NPs
2.4 傅里叶红外图分析结果
通过FTIR分析茶树花黄酮、芦丁与玉米醇溶蛋白、果胶之间的相互作用。如图3所示,Flavonoids在3 330 cm-1处存在分子间氢键伸缩振动引起的较强的吸收峰,且峰形较宽;在1 640 cm-1处存在芳环分子内双键伸缩振动引起的吸收峰。FZ-NPs、FZP-NPs的主要特征峰分别出现在3 370、1 520;3 310、1 530 cm-1,而芦丁、RZ-NPs、RZP-NPs的主要特征峰分别出现在3 440、1 660;3 290、1 540;3 420、1 540 cm-1处。芦丁、玉米醇溶蛋白、果胶的简单混合及茶树花黄酮、玉米醇溶蛋白、果胶的简单混合的主要特征峰出现在3 370、1 520;3 310、1 530 cm-1。比较FZP-NPs、RZP-NPs纳米颗粒的FTIR图,发现FZP-NPs、RZP-NPs的氢键向较低波数转移,分别出现在3 310 cm-1和3 420 cm-1处,同时导致芳环中双键也向低波数转移至1 530 cm-1、1 540 cm-1处,表明玉米醇溶蛋白中酰胺的氨基与芦丁和茶树花黄酮的羟基间发生相互作用形成氢键,说明茶树花黄酮和芦丁能较好地包埋在纳米颗粒中[15]。

图3 芦丁、茶树花黄酮、果胶、玉米醇溶蛋白、芦丁-蛋白-果胶 混合物(RZP混合)、黄酮-蛋白-果胶混合物(FZP混合)、 FZ-NPs、RZ-NPs、FZP-NPs、RZP-NPs的红外光谱图
Fig.3 FTIR spectra of rutin,tea flower flavonoids,pectin, zein,RZP mixture, FZP mixture, FZ-NPs, RZ-NPs, FZP-NPs, and RZP-NPs
2.5 差示扫描量热图分析结果
如图4所示,茶树花黄酮、FZ-NPs、FZP-NPs的放热峰分别出现在62.8、42.5、49 ℃,芦丁、RZ-NPs、RZP-NPs的放热峰分别出现在122.3、62.3、46.2 ℃,FZP-NPs、RZP-NPs、FZ-NPs的特征放热峰分布在40~60 ℃,RZ-NPs的特征吸收峰分布在60~80 ℃之间,可以看出纳米颗粒的DSC曲线中,茶树花黄酮、芦丁、玉米醇溶蛋白、果胶4种单体物质的特征峰消失,并出现了新的吸收峰,说明茶树花黄酮与芦丁被包埋在玉米醇溶蛋白纳米颗粒中,因此吸收峰被掩埋了[15,26]。

图4 果胶、玉米醇溶蛋白、芦丁、RZ-NPs、RZP-NPs、茶树花黄酮、 FZ-NPs、FZP-NPs的差示热量扫描热分析图
Fig.4 DSC thermograms of pectin, zein, rutin, RZ-NPs, RZP-NPs, tea flower flavonoids, FZ-NPs, and FZP-NPs
2.6 纳米颗粒DPPH自由基清除率测定结果
DPPH自由基清除法是比较常用的体外抗氧化活性测定方法之一,DPPH自由基的清除率越大说明样品的抗氧化活性越强[27-28]。图5显示了茶树花黄酮、芦丁、FZ-NPs、RZ-NPs、FZP-NPs、RZP-NPs对DPPH自由基的清除能力。在第1天、第5天及第10天3个时间段中,茶树花黄酮制成纳米颗粒FZ-NPs后,DPPH自由基清除能力显著增强,且高于RZ-NPs。这说明包埋以后,茶树花黄酮、芦丁的分散性改善,DPPH试剂容易渗透到颗粒的核心,增加了自由基接触的表面积,更易于DPPH中的自由基反应[29]。芦丁经包埋以后,抗氧化活性反而较茶树花黄酮降低,可能与包埋以后芦丁的活性基团与玉米醇溶蛋白分子间形成氢键,对活性基团产生了一定的屏蔽效果[30]有关。但经过果胶包裹后FZP-NPs的DPPH自由基清除能力显著下降。应该与DPPH的抗氧化试验原理有关,DPPH自由基清除率的试验是在醇溶液中进行,而果胶难溶于醇类溶剂,但可溶于水,因此,果胶的包裹反而使茶树花黄酮对DPPH自由基的清除效果下降。随着存储时间的延长,茶树花黄酮和芦丁DPPH自由基清除能力呈下降趋势,但RZ-NPs、FZ-NPs抗氧化活性变化不明显。纳米颗粒可以有效提高茶树花黄酮、芦丁的稳定性,延长两者的抗氧化活性。
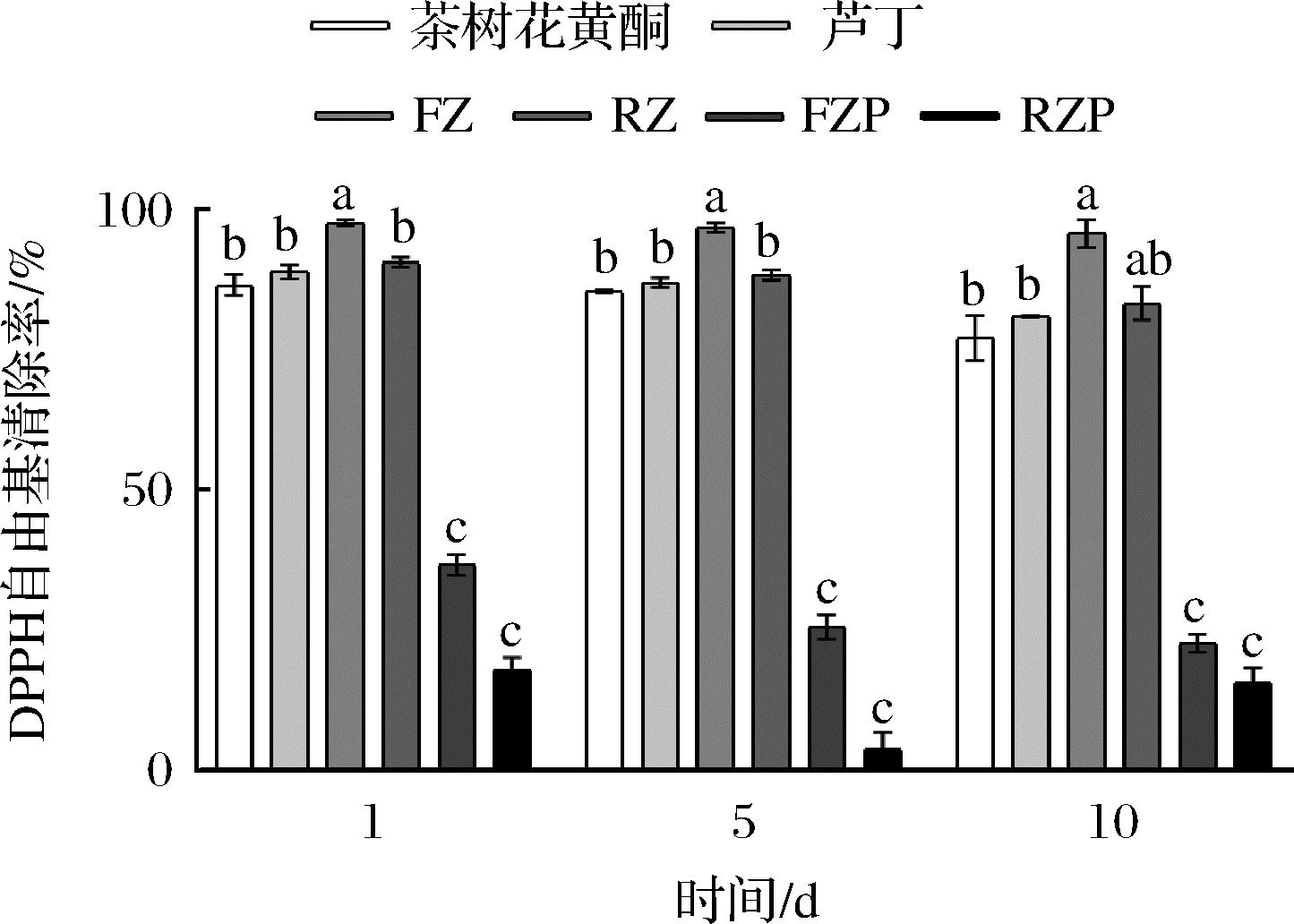
图5 第1、5、10天茶树花黄酮、芦丁、FZ-NPs、RZ-NPs、 FZP-NPs、RZP-NPs的DPPH清除率
Fig.5 DPPH clearance rate of tea flower flavonoids, rutin, FZ-NPs, RZ-NPs, FZP-NPs, and RZP-NPs at day 1, 5, and 10
注:不同字母表示在P<0.05 水平差异显著(下同)。
2.7 纳米颗粒ABTS阳离子自由基清除率测定结果
ABTS阳离子自由基的清除率越大说明样品的抗氧化活性越强,包埋前后纳米颗粒的ABTS阳离子自由基的清除率结果如图6所示,第1天时FZ-NPs的ABTS阳离子自由基的清除率相对茶树花黄酮显著降低,且低于RZ-NPs,但经过果胶包埋后FZP-NPs 的ABTS阳离子自由基的清除率没有显著变化。芦丁在经过果胶和玉米醇溶蛋白的包埋后RZP-NPs的ABTS阳离子自由基的清除率显著降低。说明经过包埋后的纳米颗粒对游离基的敏感程度有所降低,纳米包埋能够对茶树花黄酮、芦丁产生保护作用[31]。第5天时,各纳米颗粒ABTS阳离子自由基清除率无显著差异,但FZ-NPs、RZ-NPs、FZP-NPs、RZP-NPs 纳米颗粒的ABTS阳离子自由基清除率较第一天有所增加,抗氧化活性经时间的延长,有所增强。说明茶树花黄酮、芦丁经包埋后,随着时间延长,所降解形成的小分子酚酸使抗氧化能力小幅增加[32]。第10天时未包埋茶树花黄酮、芦丁ABTS阳离子自由基的清除率相对第1天有下降,然而FZ-NPs、RZ-NPs、FZP-NPs、RZP-NPs纳米颗粒ABTS阳离子自由基清除率保持稳定,说明纳米颗粒保护了茶树花黄酮与芦丁的抗氧化活性。应该与纳米颗粒提供了良好的物理稳定性和氧化稳定性有关,防止了茶树花黄酮和芦丁的氧化和降解,从而稳定了其抗氧化能力[33]。与DPPH清除能力相比,果胶的包裹保护了茶树花黄酮与芦丁ABTS阳离子自由基清除率。DPPH自由基和ABTS阳离子自由基清除率的测定试验原理不同,DPPH自由基清除率试验是在醇溶液中进行,而ABTS阳离子自由基清除率的试验是在水溶液中进行,果胶难溶于醇类溶剂,但可溶于水,因此,果胶的包裹使茶树花黄酮在DPPH和ABTS自由基清除率测定试验中体现出了不同的抗氧化能力。
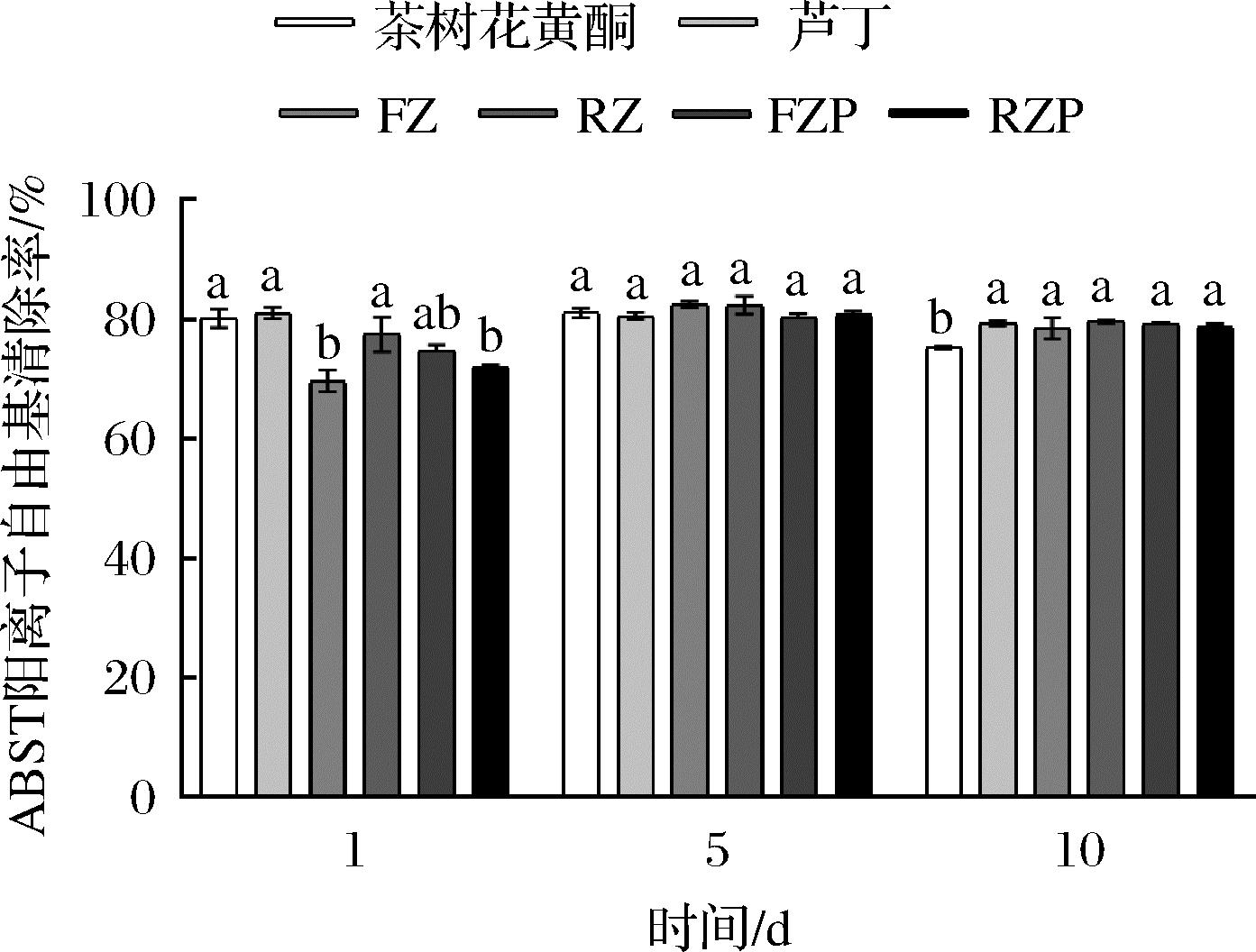
图6 第1、5、10天茶树花黄酮、芦丁、FZ-NPs、RZ-NPs、 FZP-NPs、RZP-NPs的的ABST清除率
Fig.6 ABTS clearance rate of tea flower flavonoids, rutin, FZ-NPs, RZ-NPs, FZP-NPs, and RZP-NPs at day 1, 5, and 10
3 结论与讨论
本研究通过反溶剂/静电沉积相结合的方法制备负载茶树花黄酮/芦丁的玉米醇溶蛋白果胶核/壳纳米颗粒,测定了纳米颗粒的粒径、电位、包埋率等性质,发现所制备的FZ-NPs、RZ-NPs、FZP-NPs、RZP-NPs四种纳米颗粒包埋率均在96%以上,粒径分别为(168±51.32)、(175±103.98)、(238±4.55)、(476±3.39) nm;电位存在显著差异,分别为-1.9、47.55、-27.38、1.03 mV。结果表明,茶树花黄酮、芦丁与玉米醇溶蛋白、果胶能有效结合,通过氢键和疏水相互作用形成纳米颗粒。扫描电镜和透射电镜的分析表明形成的纳米颗粒为规则圆形或椭圆形,大小分布均一。差示扫描量热法、傅里叶变换红外光谱分析验证了氢键、疏水相互作用是玉米醇溶蛋白、果胶分别与茶树花黄酮、芦丁形成纳米颗粒的主要作用力。DPPH自由基清除率与ABTS阳离子自由基清除率的结果表明经包埋后茶树花黄酮、芦丁的抗氧化性得到了一定的保护,表现出更好的贮藏稳定性。综上所述,采用玉米醇溶蛋白、果胶复合包埋茶树花黄酮,可制得较稳定、高水溶性的纳米分散系,可为茶树花黄酮纳米颗粒作为抗氧化剂或稳定剂提供新思路,促进其在食品工业中的发展。
[1] 石兴云, 刘伊琦, 念波, 等.云南茶树花茶加工工艺与化学成分研究[J].保鲜与加工, 2019, 19(3):70-77;83. SHI X Y, LIU Y Q, NIAN B, et al.Study on processing technology and chemical compounds of flower tea of camellia sinensis in Yunnan[J].Storage and Process, 2019, 19(3):70-77;83.
[2] 谭月萍, 彭雄根, 尹钟, 等.茶树花的主要生化成分及生物活性研究进展[J].茶叶通讯, 2019, 46(1):6-9. TAN Y P, PENG X G, YIN Z, et al.Progress in biochemical components and bioactivities of tea flower[J].Journal of Tea Communication, 2019, 46(1):6-9.
[3] 陈小萍, 张卫明, 史劲松, 等.茶树花黄酮的提取及对羟自由基的清除效果[J].南京师大学报(自然科学版), 2007, 30(2):93-97. CHEN X P, ZHANG W M, SHI J S, et al.Reserch on extracting tea flower flavonoids and its effect on scavenging hydroxyl radicals[J].Journal of Nanjing Normol University (Natural Science Edition), 2007, 30(2):93-97.
[4] 生吉萍, 宿文凡.茶树花多糖研究进展[J].食品科学技术学报, 2021, 39(3):22-29. SHENG J P, SU W F.Research progress on tea flower polysaccharide[J].Journal of Food Science and Technology, 2021, 39(3):22-29.
[5] 李树炎, 徐晓燕, 王林, 等.茶树鲜叶和鲜花精油成分及清除DPPH自由基能力的比较[J].江苏农业科学, 2020, 48(6):184-188. LI S Y, XU X Y, WANG L, et al.Comparative analysis of essential oil components from tea tree fresh leaves and flowers and their abilities to scavenge DPPH free radicals[J].Jiangsu Agricultural Sciences, 2020, 48(6):184-188.
[6] 郑华明, 王江丽, 田宇航, 等.玉米醇溶蛋白-香芹酚纳米颗粒的制备及其性能研究[J].包装工程, 2022, 43(13):53-60. ZHENG H M, WANG J L, TIAN Y H, et al.Preparation and properties of zein-carvacrol nanoparticles[J].Packaging Engineering, 2022, 43(13):53-60.
[7] 马永强, 修伟业, 黎晨晨, 等.星点设计-响应面法优化番茄红素纳米结构脂质载体的制备[J].食品科学, 2021, 42(3):121-127. MA Y Q, XIU W Y, LI C C, et al.Optimization of preparation process for lycopene-loaded nanostructured lipid carrier by central composite design-response surface methodology[J].Food Science, 2021, 42(3):121-127.
[8] 刘烨, 彭雅琦, 邹艳, 等.负载白藜芦醇的玉米醇溶蛋白-果胶纳米粒抗氧化活性及其对急性炎症小鼠的抗炎作用[J].现代食品科技, 2020, 36(5):7-13. LIU Y, PENG Y Q, ZOU Y, et al.Antioxidant activity and anti-inflammatory effect on acute inflammatory mice of resveratrol-loaded zein-pectin nanoparticles[J].Modern Food Science and Technology, 2020, 36(5):7-13.
[9] 程洋, 韦伟, 金青哲, 等.脂肪酸糖醇酯制备脂质纳米载体对姜黄素的包裹及释放性能的研究[J].中国油脂, 2020, 45(10):62-67. CHENG Y, WEI W, JIN Q Z, et al.Encapsulation and release properties of curcumin by lipid nanocarriers prepared from sugar alcohol fatty acid ester[J].China Oils and Fats, 2020, 45(10):62-67.
[10] 张金霞, 李楠, 李晓琴, 等.以蛋白质为载体的纳米制剂质量研究进展[J].中国新药杂志, 2021, 30(4):333-338. ZHANG J X, LI N, LI X Q, et al.Research advance in quality control of protein-based nano-preparations[J].Chinese Journal of New Drugs, 2021, 30(4):333-338.
[11] 黄晓霞, 黄旭琳, 胡坤.负载姜黄素的玉米醇溶蛋白-果胶纳米颗粒制备及抗氧化活性研究[J].广东农业科学, 2015, 42(18):88-92;2. HUANG X X, HUANG X L, HU K.Preparation and antioxidant activity of zein/pectin nanoparticles loading curcumin[J].Guangdong Agricultural Sciences, 2015, 42(18):88-92;2.
[12] HU Y, LI Y, ZHANG W L, et al.Physical stability and antioxidant activity of citrus flavonoids in arabic gum-stabilized microcapsules:Modulation of whey protein concentrate[J].Food Hydrocolloids, 2018, 77:588-597.
[13] 周浓, 余志良, 李承勇.玉米醇溶蛋白-番石榴黄酮复合纳米颗粒的制备及其抗氧化活性[J].食品科学, 2021, 42(3):186-193. ZHOU N, YU Z L, LI C Y.Fabrication and antioxidant activity of zein-guava flavonoid composite nanoparticles[J].Food Science, 2021, 42(3):186-193.
[14] FENG S M, WANG Z T, ZHAO J J, et al.Fabrication and characterization of water-soluble phytosterol ester nanodispersion by emulsification-evaporation combined ultrasonic method[J].Journal of Food Engineering, 2020, 276:109895.
[15] FENG S M, SUN Y X, WANG D, et al.Effect of adjusting pH and chondroitin sulfate on the formation of curcumin-zein nanoparticles:Synthesis, characterization and morphology[J].Carbohydrate Polymers, 2020, 250:116970.
[16] LIU Y F, HUANG K L, PENG D M, et al.Preparation and characterization of glutaraldehyde cross-linked O-carboxymethylchitosan microspheres for controlled delivery of pazufloxacin mesilate [J].International Journal of Biological Macromolecules, 2007, 41(1):87-93.
[17] 王记莲. 小麦醇溶蛋白-阿拉伯胶纳米颗粒的制备及表征[J].食品与发酵工业, 2020, 46(10):222-226. WANG J L.Preparation and characterization of gliadin-arabic gum[J].Food and Fermentation Industries, 2020, 46(10):222-226.
[18] 韩赫, 焦岩, 常影, 等.酶解玉米醇溶蛋白-叶黄素纳米粒的制备、结构表征及体外抗氧化和释放特性研究[J].中国粮油学报, 2021, 36(5):68-75. HAN H, JIAO Y, CHANG Y, et al.Preparation, structural characterization, in vitro antioxidant and releasing characteristics of corn protein hydrolysate-lutein nanoparticles[J].Journal of the Chinese Cereals and Oils, 2021, 36(5):68-75.
[19] 徐群娜, 白忠薛, 马建中, 等.自清洁玉米醇溶蛋白基TiO2微胶囊乳液的制备及皮革涂饰应用研究[J].中国皮革, 2021, 50(1):27-36;40. XU Q N, BAI Z X, MA J Z, et al.Synthesis and application as leather coating material of Zein@TiO2 microcapsules emusion[J].China Leather, 2021, 50(1):27-36;40.
[20] 王国雨, 孙梦捷, 王永香, 等.食品包装用复合膜材质分析方法研究[J].食品安全质量检测学报, 2019, 10(21):7152-7157. WANG G Y, SUN M J, WANG Y X, et al.Study on material analysis of laminated film for food packaging[J].Journal of Food Safety & Quality, 2019, 10(21):7152-7157.
[21] 兰文忠, 冀利, 贺晓芳, 等.冬枣汁与金丝小枣汁总酚、总黄酮含量及抗氧化性能的比较研究[J].食品与发酵科技, 2021, 57(1):90-94. LAN W Z, JI L, HE X F, et al.Comparative study on the contents of total phenols, flavonoids and antioxidant activity of winter jujube juice and golden-silk jujube juice[J].Food and Fermentation Sciences &Technology, 2021, 57(1):90-94.
[22] 马娇, 施志凡, 张海芬, 等.7种云南可食用昆虫醇提液对ABTS+自由基清除作用[J].化学工程师, 2021, 35(1):9-12. MA J, SHI Z F, ZHANG H F, et al.Study on the scavenging effect on ABTS+ free radicals of alcohol extracts of seven edible insects from Yunnan[J].Chemical Engineer, 2021, 35(1):9-12.
[23] HU K, MCCLEMENTS D J.Fabrication of biopolymer nanoparticles by antisolvent precipitation and electrostatic deposition:Zein-alginate core/shell nanoparticles[J].Food Hydrocolloids, 2015, 44:101-108.
[24] 朱美如, 潘贯珠.玉米醇溶蛋白-芦丁复合纳米颗粒制备Pickering乳液及其特性研究[J].粮食与油脂, 2018, 31(5):43-47. ZHU M R, PAN G Z.Research on fabrication and characterization of Pickering emulsions prepared by zein-rutin complex nanoparticles[J].Cereals &Oils, 2018, 31(5):43-47.
[25] 曲敏, 陈强, 孙冰玉, 等.多酚的功能性质及与蛋白质、多糖相互作用研究进展[J].食品工业科技, 2021, 42(11):405-413. QU M, CHEN Q, SUN B Y, et al.Advances in studies on the functional properties of polyphenols and their interactions with proteins and polysaccharides[J].Science and Technology of Food Industry, 2021, 42(11):405-413.
[26] 任晓鸣, 王丽娟, 王金梅, 等.超临界CO2反溶剂法制备大豆异黄酮一玉米醇溶蛋白复合纳米颗粒[J].食品工业科技, 2012, 33(24):273-276. REN X M, WANG L J, WANG J M, et al.Preparation of soybean isoflavone loaded zein composite nanoparticles by method of supercritical CO2 anti-solvent technology[J].Science and Technology of Food Industry, 2012, 33(24):273-276.
[27] 袁园, 张潇, 陈碧琼, 等.草果总黄酮的提取及DPPH自由基清除活性研究[J].食品研究与开发, 2017, 38(15):63-68. YUAN Y, ZHANG X, CHEN B Q, et al.Extraction method and DPPH radical scavenging activity of flavonoids from Amomum tsaoko[J].Food Research and Development, 2017, 38(15):63-68.
[28] 陈星, 罗晓, 史艳梅, 等.槐花散总黄酮提取工艺及抗氧化活性研究[J].时珍国医国药, 2020, 31(10):2363-2365. CHEN X, LUO X, SHI Y M, et al.Optimization of extraction process and antioxidant activity of total flavonoids from Hua-ihua powders[J].Lishizhen Medicine and Materia Medica Research, 2020, 31(10):2363-2365.
[29] 谢灏婷, 张霞, 丁玉琴, 等.阿拉伯胶对薏米醇溶蛋白-虾青素纳米颗粒性质影响[J].中国粮油学报, 2022, 37(6):83-90. XIE H T, ZHANG X, DING Y Q, et al.Effect of arabic gum on properties of coixin-astaxanthin nanoparticles[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(6):83-90.
[30] 樊永康. 载荷槲皮素的糖基化酪蛋白纳米粒子的制备、表征及性能研究[D].浙江:浙江大学, 2020. FAN Y K.Study on the preparation, characterization and properties of quercetin-loaded glycosylated casein nanoparticles[D].Zhejiang:Zhejiang University, 2020.
[31] 王永辉, 杨晓泉, 王金梅, 等.蛋白水解物及多糖负载姜黄素制备纳米颗粒及其稳定性[J].农业工程学报, 2015, 31(10):296-302. WANG Y H, YANG X Q, WANG J M, et al.Preparation of curcumin nanoparticles by protein hydrolysates and polysaccharids and its stabilization[J].Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(10):296-302.
[32] 吴越, 杨军, 王琦, 等.贮藏时间和温度对蓝莓花色苷微胶囊品质的影响[J].农业工程学报, 2017, 33(8):301-308. WU Y, YANG J, WANG Q, et al.Effects of storage time and temperature on quality of blueberry anthocyanin microcapsules[J].Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(8):301-308.
[33] 刘敏, 张岚, 王丹, 等.沙葱精油微胶囊的制备及其生物活性评价[J].粮食与油脂, 2022, 35(8):66-71. LIU M, ZHANG L, WANG D, et al.Preparation and biological activity evaluation of allium mongolicum regel essential oil microcapsules[J].Cereals &Oils, 2022, 35(8):66-71.