太子参,又称孩儿参,是中国传统中药,该名最早被记载于1757年的《本草从新》中,目前已被卫生部列入“可用于保健食品的中药材名单”[1]。与人参同效,但药性温和,有补气健脾、润肺生津,补虚养阴的功效,已有近百年的临床应用历史[2]。太子参的特征性化学成分多糖、皂苷和环肽具有免疫调节、降血糖、抗肿瘤、神经保护、抗炎和抗氧化等药理作用[3]。研究表明,太子参肽类可以通过Ca2+/CaN/NFATc1/IFNg途径对脾淋巴细胞进行免疫调节,从而增强人体免疫力[4];太子参环肽B(heterophyllin B, HB)通过激活腺苷酸激活蛋白激酶显著改善肠上皮稳态,以肠道微生物群依赖的方式改善结肠炎症[5],但是否通过肠-脑轴改善中枢系统疾病尚不明确;太子参复方颗粒灌胃外周神经损伤的动物模型,可以促进外周神经损伤的早期修复,促进功能恢复[6];前期研究发现HB能显著增强正常小鼠记忆和认知功能,促进神经突起再生,上调皮层和海马区5-羟色胺水平,并调控多巴胺的代谢[7]。HB还可改善脑室注射Aβ1-42引起的阿尔茨海默病小鼠记忆损伤,调节脾脏辅助T细胞功能,并改善神经炎症[8]。
阿尔兹海默症(Alzheimer′s disease, AD)是最常见的痴呆症的一种,患者表现出认知功能障碍和记忆缺陷[9-10]。由于其病因复杂,作用机制尚不明确。目前,美国食品和药物管理局批准用于AD治疗的药物仅有4种[11-12]。这些药物仅能缓解症状,尚不能治愈或逆转AD的进程,因此,抗AD药物的研发或食疗预防是目前亟待研究的课题。AD的主要病理学标志是胞外的β淀粉样斑块(β-amyloid plaque, Aβ)和胞内神经纤维缠结(neurofibrillary tangles, NFTs)[13]。根据发病年龄的不同,可分为早发性家族性AD(early-onset familial AD, EO-FAD)和晚发性散发性AD(late-onset sporadic AD, LO-SAD)[14]。EO-FAD与β淀粉样前体蛋白(amyloid precursor protein, APP)、早老素1、早老素2三个基因的突变密切相关,发病年龄在30~65岁;LO-SAD多发于60~65岁,受多因素影响,如年龄、遗传风险因素(如载脂蛋白E和许多其他基因的等位基因变异)、血管疾病、创伤性脑损伤等,是最常见的AD类型[15]。
为探究太子参改善记忆和认知障碍的作用,建立具有临床AD特征的动物模型是必要的。目前AD动物模型可分为衰老、转基因、物理损伤和化学损伤模型等。研究表明,APP/PS1双转基因小鼠皮质和海马发现Aβ沉积[16],且Aβ的增加伴有神经元的损伤、突触丢失及认知功能障碍等AD样病理特征[17]。虽然啮齿动物被广泛用于神经退行性疾病研究,但斑马鱼因其与人类基因组同源性高、繁殖周期短和成本低廉等优势,被作为一种新兴的AD模式动物广泛使用。研究表明,成年斑马鱼脑注射Aβ1-42后,出现神经元凋亡、小胶质细胞活化、突触丢失和学习障碍等AD病理特征[18]。因此,建立淀粉样蛋白诱导的成年斑马鱼模型可能为改善记忆药物和保健食品的研发开辟新途径[19]。
1 材料与方法
1.1 材料
太子参产自中国福建,北京同仁堂。太子参环肽B,上海源叶生物科技有限公司,纯度经HPLC检验大于98%;实验用野生型小鼠和APP/PS1双转基因小鼠购自江苏凌菲生物科技有限公司,护理和实验方案均按照广东海洋大学动物实验委员会的指导方针(SYXK2 021-0025)执行,遵循12 h光暗循环,温度(22±1) ℃,湿度(55±10)%,自由饮食;斑马鱼,上海佳誉水族馆,实验室保持光暗周期14/10 h,温度(28±0.5) ℃,养殖水pH=7.0~7.4;UPLC-Q-Exactive系统,美国Thermo Fisher Science公司。
1.2 实验方法
1.2.1 太子参不同部位的提取
太子参粉末蒸馏水煎煮后过滤、离心、冷冻干燥后得水提取物;太子参粉末在60 ℃条件下经85%(体积分数)乙醇超声提取1 h,过滤,离心,冷冻干燥后得醇提取物。太子参多糖提取用水提醇沉法,太子参粉末经40目筛,用蒸馏水微沸提取1 h,木瓜蛋白酶处理滤液,取上清液;上清液和Sevage试剂(氯仿和正丁醇体积比为4∶1)的体积比为1∶1,重复4次除蛋白,80%乙醇沉淀过夜后得粗多糖。参照LU等[20]的方法提取太子参总环肽,技术略有改动,太子参粉末经乙酸乙酯超声提取,提取物用正丁醇溶解,加入等体积40%的氨水萃取后,取正丁醇层,加入体积分数85%的乙醇除去多糖和其他杂质,过夜后,取乙醇层,浓缩干燥后得太子参总环肽。太子参皂苷部位:太子参粉末经70%乙醇超声提取,抽滤,取乙醇层,加入乙醚萃取除脂,再用水饱和的正丁醇萃取,冷冻干燥后得太子参皂苷。
1.2.2 原代皮层神经元的培养
取妊娠14 d胎鼠的皮层神经元,以2×104 cells/well的密度接种于96孔板,神经基础培养基、体积分数为2% B-27、0.6% D-葡萄糖和2 mmol/L的L-谷氨酰胺的培养基培养,10 μmol/L Aβ25-35(Sigma)处理建立AD模型。细胞分为空白组(ct)、模型组(veh)、太子参提取物处理组。空白组不做处理,模型组和太子参提取物处理组用Aβ25-35处理建立AD模型,太子参提取物处理组再给予不同浓度进行治疗。
1.2.3 存活率的测定
将冷冻干燥的样品用二甲基亚砜配成100 mg/mL的母液,稀释1‰后处理细胞,作用于细胞的质量浓度为5~100 μg/mL,HB浓度为1~100 μmol/L。对Aβ25-35建立的AD细胞模型用以上药物不同浓度处理,3 d后,用CCK8试剂盒测定细胞存活率。
1.2.4 荧光定量聚合酶链式反应
原代皮层神经元以8×105 cells/well的密度接种于6孔板,加入10 μmol/L Aβ25-35,30 min后加入1、10 μmol/L HB处理,12 h后收集细胞RNA。用Tritol溶液提取RNA,将RNA反转录为cDNA,稀释5倍后,作为荧光定量PCR的样品使用。p53和caspase3基因的引物序列见表1,ΔΔCt用于计算基因的相对表达量。
表1实验基因名称及引物序列
Table 1 Experimental of gene names and q-PCR primer sequence
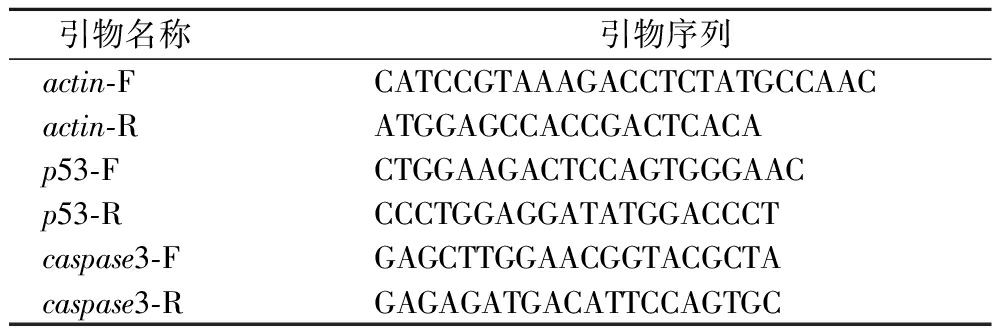
引物名称 引物序列actin-FCATCCGTAAAGACCTCTATGCCAACactin-RATGGAGCCACCGACTCACAp53-FCTGGAAGACTCCAGTGGGAACp53-RCCCTGGAGGATATGGACCCTcaspase3-FGAGCTTGGAACGGTACGCTAcaspase3-RGAGAGATGACATTCCAGTGC
1.2.5 细胞免疫荧光染色
原代皮层神经元以8×105 cells/well的密度接种于24孔板,分为ct组、veh组、HB(1、10 μmol/L)2个浓度处理组,ct组不做处理,veh组与HB组加入10 μmol/L Aβ25-35建立细胞AD模型。用一抗MAP2标记树突, β3-tubulin标记突起,DAPI标记细胞核。Image J软件统计细胞荧光强度。
1.2.6 动物实验
将HB溶解于5%(体积分数)二甲基亚砜的生理盐水中。小鼠实验分为3组:空白组(CT)、模型组(V)、给药组(V+HB),空白组为6月龄野生型小鼠,模型组和治疗组为APP/PS1转基因小鼠;空白组和模型组每天腹腔注射生理盐水,治疗组腹腔注射HB溶液,HB浓度为10 μmol/kg,持续给药2个月。后续进行旷场运动试验、新物体识别和新位置识别实验,每组使用9~10只小鼠。斑马鱼在实验中环境适应2周后,设置假手术组(Sham)、模型组(Veh)、太子参醇提物低浓度组(L, 13 mg/kg)、中浓度组(M, 26 mg/kg)和高浓度组(H, 39 mg/kg)。假手术组斑马鱼注射1 μL PBS,模型组脑室注射1 μL PBS溶解的Aβ1-42(20 μmol/L,Sigma)建立AD样急性毒性模型[21-22],每组11尾斑马鱼,第5天开始进行新物体识别实验和奖励记忆实验。
UPLC-MS/MS实验:太子参水提取物溶解于蒸馏水,空白组小鼠灌胃蒸馏水,治疗组灌胃太子参水提物溶液,给药剂量为10 g/kg,给药1 h后,用生理盐水灌流后取大脑皮层。脑组织加入1.2 mL甲醇,充分研磨匀浆,14 000×g离心10 min,取上清液,回收溶剂,加入100 μL的甲醇复溶,离心取上清液进UPLC-MS/MS分析。
UPLC条件:色谱柱为YMC-Pack-ODS-AQ(2.0 mm×150 mm,3 μm),柱温35 ℃,流速0.2 mL/min,进样量4 μL,流动相A为0.1%甲酸水溶液,B为乙腈。梯度洗脱条件如下:0~20 min,5%~95% B;20~22 min,95% B;22~24 min,95%~5% B;24~30 min,5% B。
MS条件:离子源为电喷雾离子源,正负离子切换采集模式和Full Scan/dd-MS2扫描模式,正、负极电压为3.2 kV,毛细管温度320 ℃,鞘气流速35 Arb,辅气流速15 Arb,扫描范围200~3 000 kDa。
1.3 数据统计
实验数据以平均值±标准误差![]() 表示,通过GraphPad Prism 8软件进行绘图和分析。组间差异采用单因素方差分析(One-way ANOVA),对结果进行显著性分析,P<0.05时,表示具有统计学意义。
表示,通过GraphPad Prism 8软件进行绘图和分析。组间差异采用单因素方差分析(One-way ANOVA),对结果进行显著性分析,P<0.05时,表示具有统计学意义。
2 结果与分析
2.1 太子参醇提物改善Aβ1-42脑室注射斑马鱼探索能力和记忆障碍
首先利用Aβ1-42脑室注射的斑马鱼模型,评价太子参对记忆的改善作用。结果如图1所示,在新物体识别实验中,Veh组相较于Sham组进入新臂的潜伏期显著增加,在新臂的游动路程和停留时间显著减少,表明成功建立斑马鱼记忆损伤模型。太子参醇提物低、中、高3个浓度均显著降低斑马鱼潜伏期,其中,高浓度醇提物显著增加斑马鱼在新臂的游动路程和停留时间(P<0.05);在奖励记忆实验中,与Sham组相比较,Veh组进入奖励臂的潜伏期显著增加(P<0.05),而进入奖励臂的次数和在奖励臂游动路程显著减少,中和高浓度太子参醇提物处理后斑马鱼进入奖励臂次数显著增加(P<0.05)。结果表明,太子参醇提物具有显著的记忆改善作用。
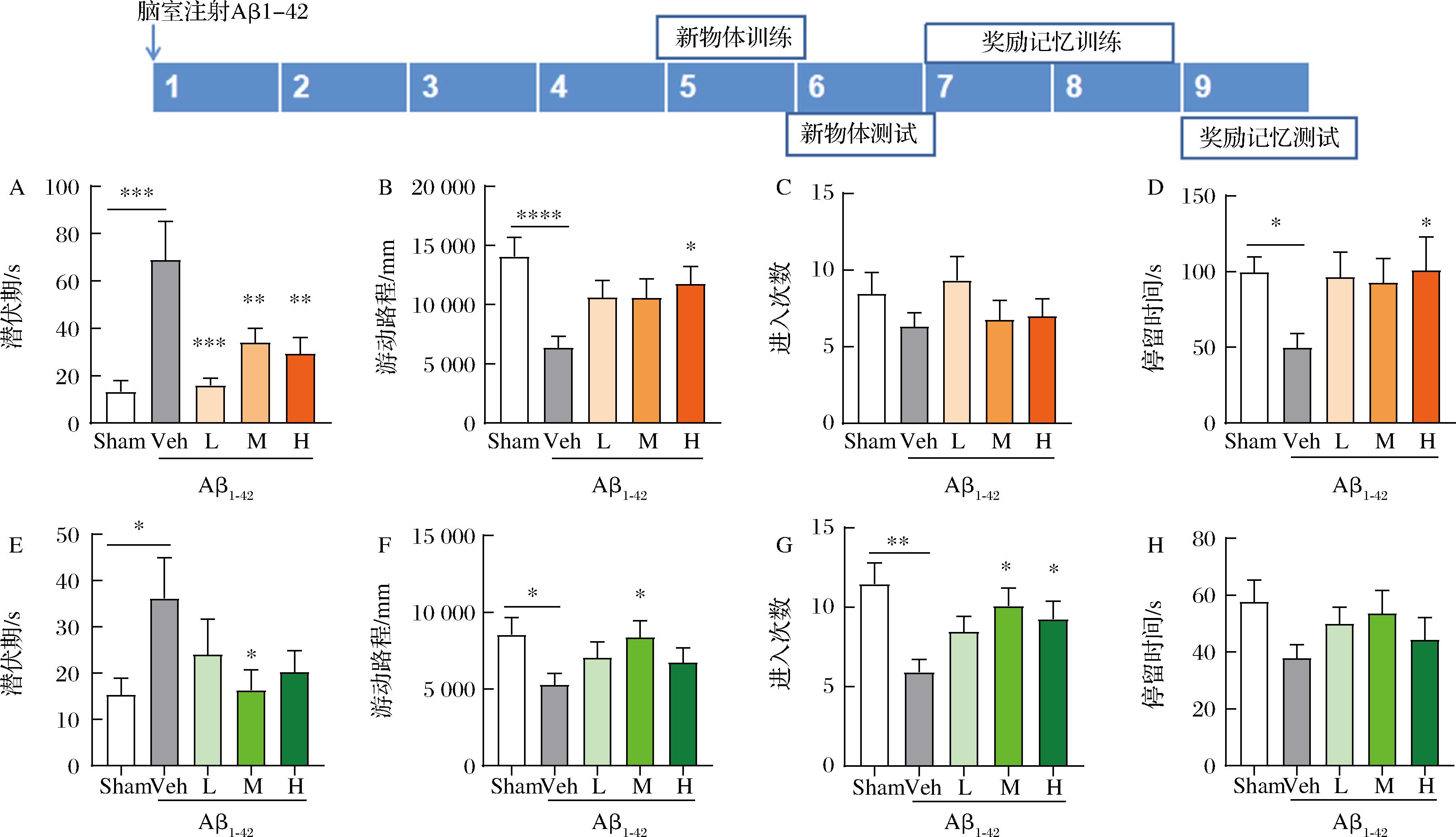
A-斑马鱼到达新臂的潜伏期;B-斑马鱼在新臂游动的总路程;C-斑马鱼进入新臂的次数;D-斑马鱼在新臂停留总时长;E-斑马鱼到达奖励 臂的潜伏期;F-斑马鱼在奖励臂游动的总路程;G-斑马鱼进入奖励臂的次数;H-斑马鱼在奖励臂停留总时长![]()
图1 太子参醇提物改善脑室注射Aβ1-42的斑马鱼的认知和记忆障碍
Fig.1 Improvement of cognitive and memory impairment in zebrafish intraventricular injection of Aβ1-42 treated with ethanol extract of Pseudostellaria heterophylla
注:与Veh组相比,****P<0.000 1,***P<0.001,**P<0.01,*P<0.05。
2.2 太子参对Aβ25-35诱导原代皮层神经元损伤的作用
2.2.1 太子参提取物改善原代皮层神经元的存活率
为研究太子参对神经元的保护作用,建立了Aβ25-35诱导的原代皮层神经元损伤模型。结果如图2-A所示,与正常的ct组相比,Aβ25-35处理的veh组神经元存活率显著降低,质量浓度为5、10 μg/mL的太子参水提物显著增加神经元存活率;太子参醇提物(5~100 μg/mL)均能显著增加神经元存活率,其中25 μg/mL有极显著作用(P<0.000 1)。
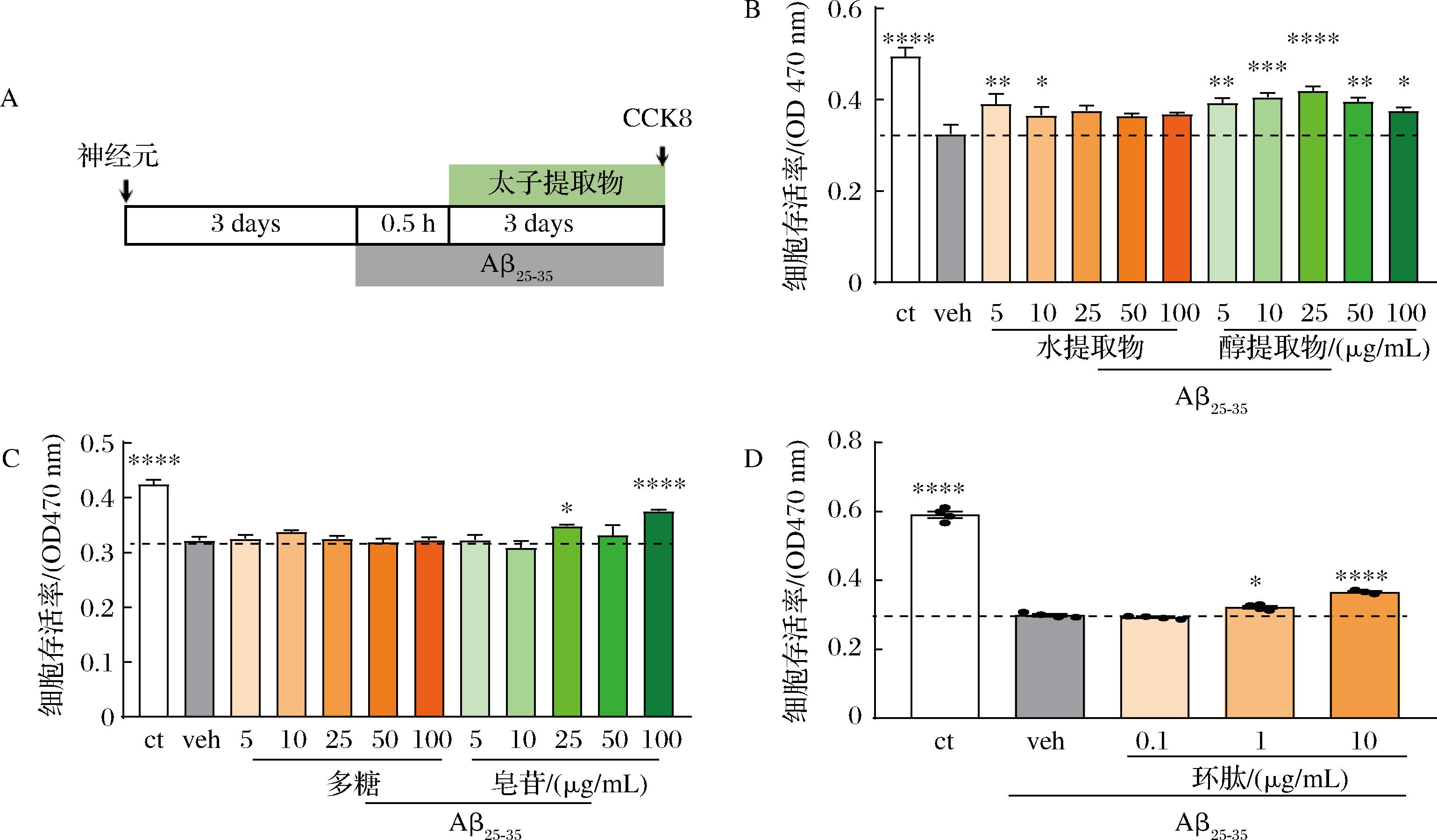
A-实验流程图;B-太子参水和醇提物对神经元存活率的影响;C-太子参多糖和皂苷对神经元存活率的影响;D-太子参环肽对神经元存活率的影响![]()
图2 太子参提取物改善Aβ25-35诱导的原代皮层神经元存活率
Fig.2 Improvement of survival rate of Aβ25-35-induced primary cortical neurons by extract of Pseudostellaria heterophylla
注:与veh组相比,****P<0.000 1,***P<0.001,**P<0.01,*P<0.05。
为进一步研究太子参起神经元保护的有效成分,对太子参中的主要成分太子参多糖、皂苷和环肽类进行神经元保护作用评价。如图2-B、图2-C所示,100 μg/mL太子参皂苷极显著增加神经元存活率(P<0.000 1),太子参多糖未见显著性保护作用。1、10 μg/mL太子参总环肽浓度依赖的显著增加神经元存活率。结果表明,太子参环肽和皂苷类成分可能是神经元保护作用的有效部位。
2.2.2 太子参入脑成分检测
为进一步探索太子参的有效作用成分,利用LC-MS技术研究了太子参的入脑成分。ICR小鼠灌胃给予10 g/kg太子参水提物,1 h后取脑组织进行LC-MS分析,结果如图3所示,在脑中检测到分子质量为779的[M+H]+峰,经二级质谱鉴定为HB,而在对照组中未检出。在前期研究中,从太子参中共鉴定了32个环肽类成分,30 min后在血液中检测到8个环肽,其中HB是唯一一个能透过血脑屏障进入大脑的原型环肽类成分[7]。因此,HB可能是太子参环肽类成分中起神经元保护作用的主要化合物。

A-空白组入脑成分检测;B-给药组入脑成分检测
图3 LC-MS检测太子参入脑成分
Fig.3 Detection of brain penetrated components of Pseudostellaria heterophylla by LC-MS
2.2.3 HB改善原代皮层神经元的存活率
前期研究发现太子参环肽中仅HB在大脑皮层中被检测到,因此评价了HB对神经元的保护作用。如图4所示,与ct组相比,veh组神经元存活率显著降低(P<0.000 1),不同浓度的HB处理组均能显著提高神经元存活率。
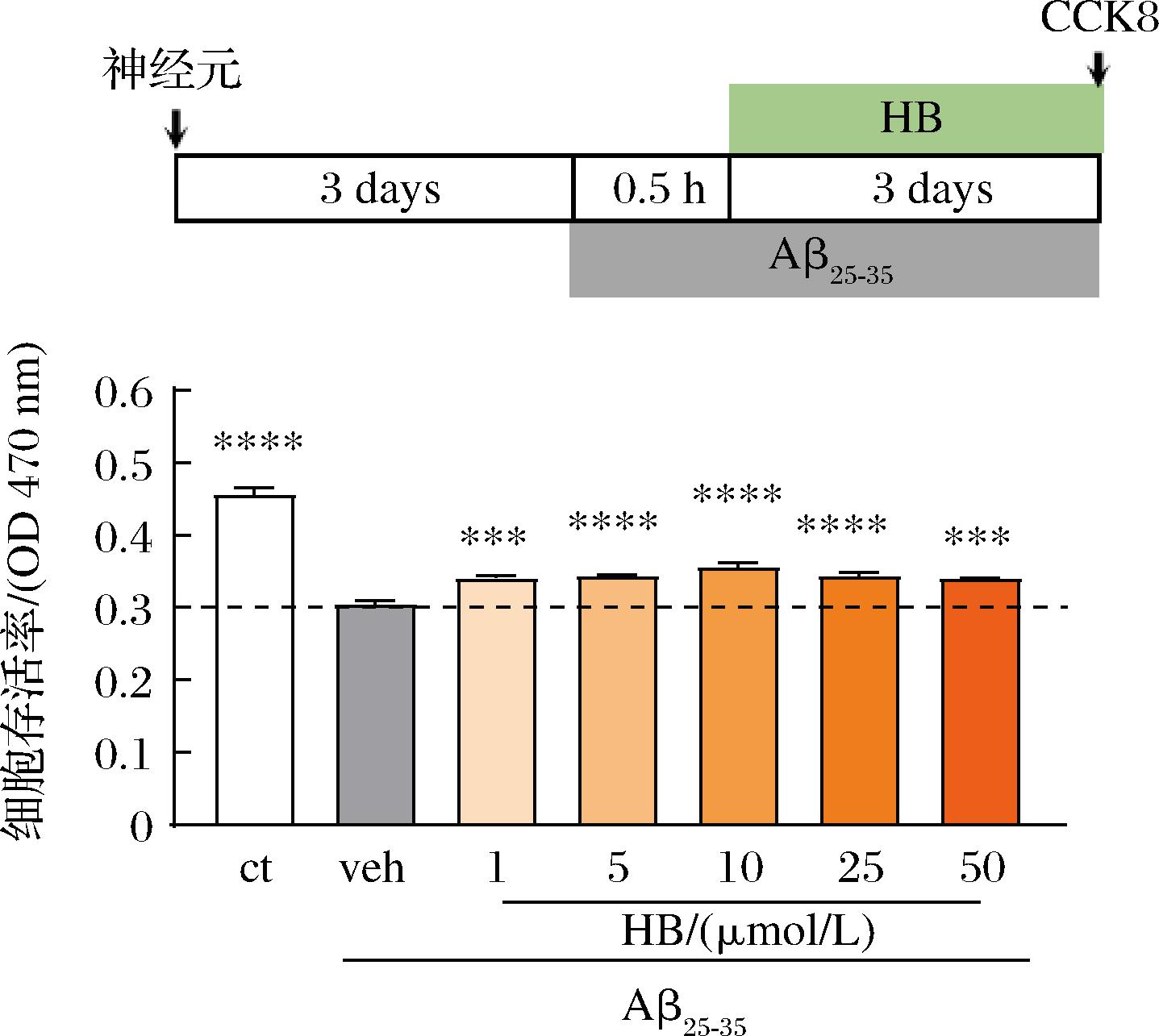
图4 HB改善Aβ25-35诱导的原代皮层神经元的存活率![]()
Fig.4 Improvement of survival rate of Aβ25-35-induced primary cortical neurons by HB
注:与veh组相比,****P<0.000 1,***P<0.001, **P<0.01,*P<0.05。
2.3 HB对APP/PS1双转基因小鼠学习记忆的改善作用
进一步探究HB是否对AD转基因小鼠的记忆有改善作用。如图5所示,给药期间各组体重均保持在一个稳定水平,与CT组相比,V组的体重增量显著降低。旷场实验中,各组小鼠的运动距离无显著差异,说明HB对小鼠无明显的毒副作用。在新物体识别实验中,与CT组相比,V组探索能力显著降低;与V组相比,HB给药后小鼠探索能力显著性增加(P<0.001);与CT组相比,V组新位置探索能力显著降低,HB给药后小鼠更倾向探索新位置物体,表明HB显著增强了AD小鼠的空间记忆(P<0.01)。
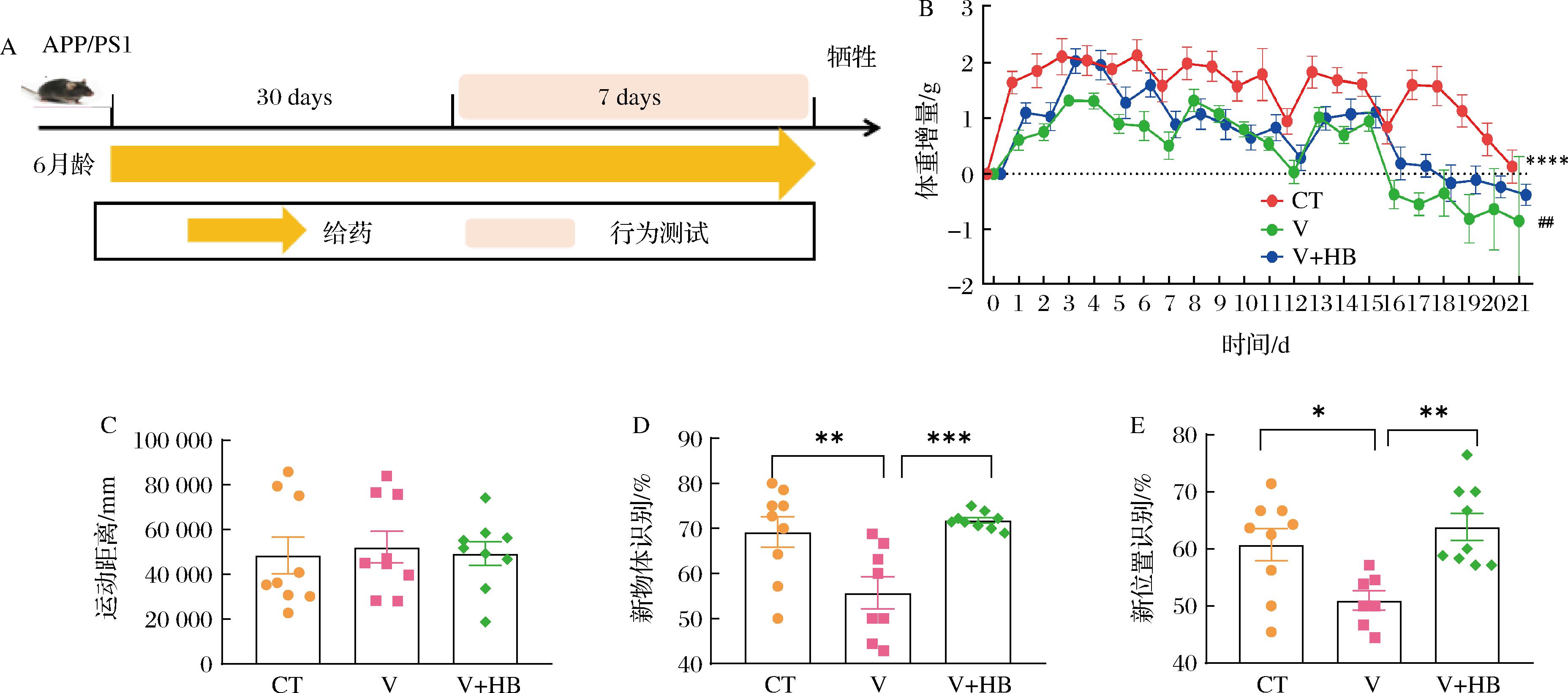
A-实验流程图;B-小鼠体重增量;C-小鼠旷场实验运动距离;D-小鼠新物体识别;E-小鼠新位置识别![]()
图5 HB改善APP/PS1小鼠认知和空间记忆障碍
Fig.5 Improvement of cognitive and memory deficits in APP/PS1 transgenic mice by HB
注:与空白组相比,*P<0.05;**P<0.01;***P<0.001。
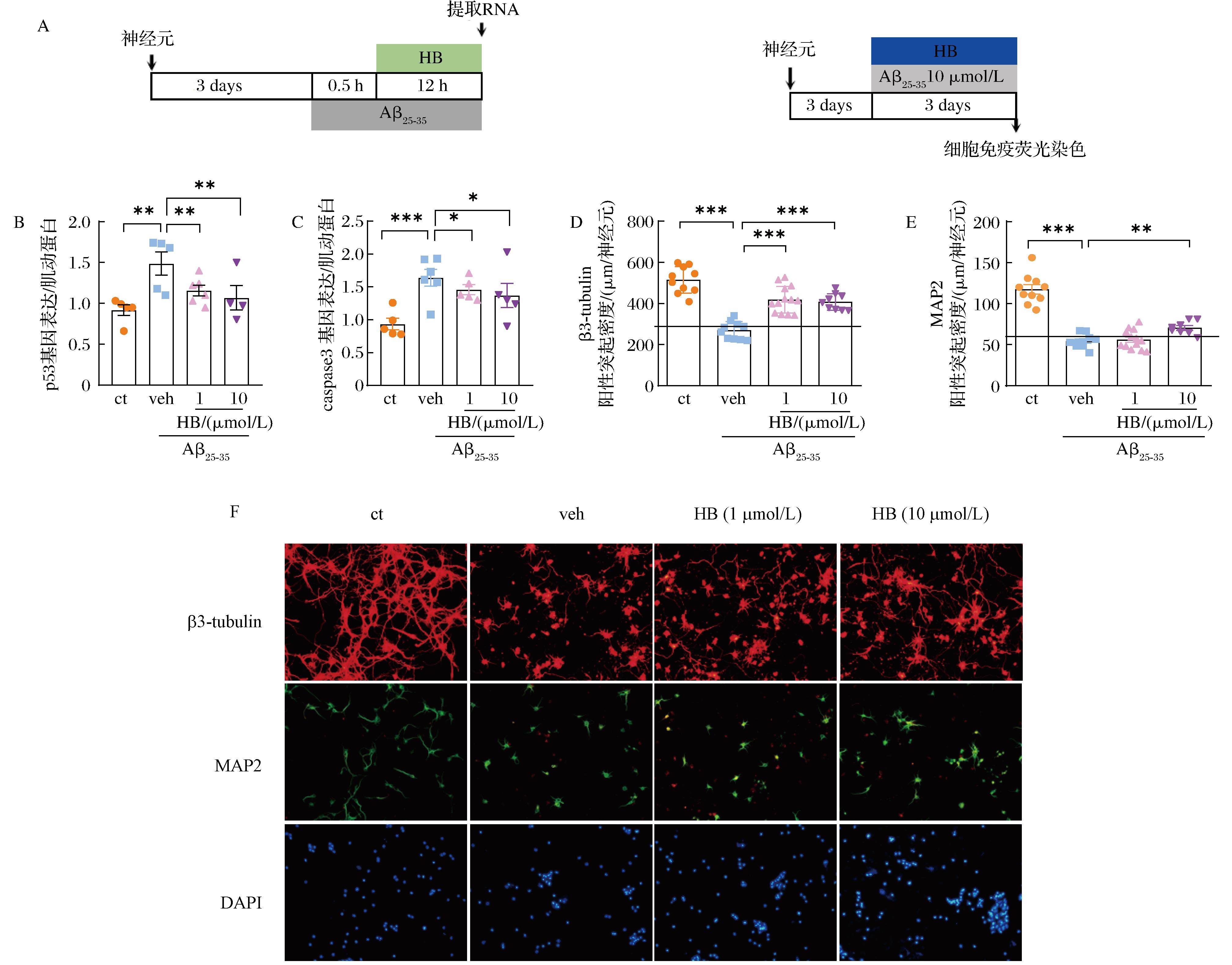
A-实验流程图;B-p53 mRNA表达;C-caspase 3 mRNA表达;D-神经元突起密度;E-神经元树突密度;F-免疫染色代表图
图6 HB对神经元凋亡基因及突起的影响
Fig.6 Effect of HB on apoptotic genes and neurite in neurons
注:MAP2:树突;β3-tubulin:突起;DAPI:细胞核。与veh组相比,****P<0.000 1,***P<0.001,**P<0.01,*P< 0.05。
2.4 HB改善Aβ诱导的神经元凋亡和突起萎缩
为进一步研究HB对记忆改善的作用机制,探索了HB对神经元凋亡相关基因和突起密度的作用。基因表达的结果如图6-B、6-C所示,与ct组相比,veh组中凋亡相关基因p53和caspase 3表达显著升高,1、10 μmol/L HB处理显著降低凋亡基因的表达(P<0.05)。细胞免疫荧光实验如图6-D、6-E所示,veh组与ct组相比,神经元树突和突起显著萎缩,1、10 μmol/L HB处理后β3-tubulin阳性突起密度显著增加,而10 μmol/L的HB处理后MAP2阳性树突密度显著升高(P<0.01)。
3 结论与讨论
本实验以太子参为研究对象,发现太子参能改善脑室注射斑马鱼和APP/PS1转基因小鼠的记忆损伤和功能障碍。作为中国传统中药,太子参有补气健脾、润肺生津的功效,含有多糖、皂苷、环肽等多种活性成分,具有抗炎、免疫调节、降血糖血脂、改善记忆等药理作用。HB是环肽中的特征性成分,有酪氨酸酶抑制、抗炎、抗氧化、神经保护等作用,可以透过血脑屏障进入中枢。本文建立了斑马鱼脑室注射急性AD模型评价太子参的记忆改善作用,结果发现Aβ处理组斑马鱼对新物体探究的兴趣减少,而太子参醇提物处理后,斑马鱼探索新臂潜伏期缩短,探索时间和游动路程延长;Aβ1-42延长斑马鱼进入奖励臂的潜伏期,而太子参醇提物可以缩短潜伏期,改善斑马鱼记忆障碍。本研究表明HB可以降低凋亡基因caspase3、p53的表达,显著增加神经元存活率和β3-tubulin和MAP2阳性突起密度,增强神经元突触可塑性,进而改善APP/PS1转基因小鼠的记忆和认知障碍。
尽管本实验结果显示HB有较好的神经元保护和改善记忆障碍的作用,但仍然存在许多不足:从存活率的结果看,应继续研究皂苷在神经保护上的作用效果;其次应继续探究HB在凋亡相关蛋白水平上的影响,在分子层面更有效地证明HB的神经保护作用。
目前,美国食品和药物管理局批准用于治疗AD的药物有加兰他敏、多奈哌齐、美金刚等。但这些药物效果不理想、存在一定的肝毒性,而大部分以淀粉样蛋白为靶点开发药物宣告失败,让AD药物研发步履维艰。一方面,AD病因复杂,其机制尚不清楚;另一方面,药物对血脑屏障的渗透性影响药物的疗效[23]。在将来的研究中需进一步明确:a)在蛋白、基因等分子水平上进一步验证HB的效果;b)更深层次探究HB对神经元突起调控的靶点和作用通路。c)借助药剂学研究方法,如纳米药物递送系统等提高HB的渗透性和在中枢神经系统里的生物利用度[24]。本实验旨在以改善突起萎缩和神经保护的角度揭示太子参改善AD的作用机制,为未来AD药物和保健食品的研发提供数据支持。
[1] WENG Q X, CAI X X, ZHANG F, et al.Fabrication of self-assembled Radix Pseudostellariae protein nanoparticles and the entrapment of curcumin[J].Food Chemistry, 2019, 274:796-802.
[2] HU D J, SHAKERIAN F, ZHAO J, et al.Chemistry, pharmacology and analysis of Pseudostellaria heterophylla:A mini-review[J].Chinese Medicine, 2019, 14:21.
[3] HU J, PANG W S, CHEN J L, et al.Hypoglycemic effect of polysaccharides with different molecular weight of Pseudostellaria heterophylla[J].BMC Complementary and Alternative Medicine, 2013, 13:267.
[4] YANG Q, CAI X X, HUANG M C, et al.Immunomodulatory effects of Pseudostellaria heterophylla peptide on spleen lymphocytes via a Ca2+/CaN/NFATc1/IFN-γ pathway[J].Food &Function, 2019, 10(6):3 466-3 476.
[5] CHEN C, LIANG H, WANG J Y, et al.Heterophyllin B an active cyclopeptide alleviates dextran sulfate sodium-induced colitis by modulating gut microbiota and repairing intestinal mucosal barrier via AMPK activation[J].Molecular Nutrition &Food Research, 2022, 66(17):e2101169.
[6] 汪宝军, 王和鸣, 王竹风.复方太子参颗粒促进周围神经损伤后再生的实验研究[J].福建中医学院学报, 2002, 12(4):28-30;44. WANG B J, WANG H M, WANG Z F.Experimental study of composite TAIZISHEN granule on promoting regeneration of post-injury peripheral nerve[J].Journal of Fujian College of Traditional Chinese Medicine, 2002, 12(4):28-30;44.
[7] YANG Z Y, ZHANG C, LI X H, et al.Heterophyllin B, a cyclopeptide from Pseudostellaria heterophylla, enhances cognitive function via neurite outgrowth and synaptic plasticity[J].Phytotherapy Research, 2021, 35(9):5 318-5 329.
[8] DENG J H, FENG X Y, ZHOU L J, et al.Heterophyllin B, a cyclopeptide from Pseudostellaria heterophylla, improves memory via immunomodulation and neurite regeneration in i.c.v.Aβ-induced mice[J].Food Research International, 2022, 158:111576.
[9] SCHELTENS P, DE STROOPER B, KIVIPELTO M, et al.Alzheimer′s disease[J].Lancet, 2021, 397(10284):1577-1590.
[10] WELLER J, BUDSON A.Current understanding of Alzheimer′s disease diagnosis and treatment[J].F1000Research, 2018, 7:1161.
[11] THOE E S, FAUZI A, TANG Y Q, et al.A review on advances of treatment modalities for Alzheimer′s disease[J].Life Sciences, 2021, 276:119129.
[12] KEVADIYA B D, OTTEMANN B M, THOMAS M B, et al.Neurotheranostics as personalized medicines[J].Advanced Drug Delivery Reviews, 2019, 148:252-289.
[13] SORIA LOPEZ J A, GONZ LEZ H M, LÉGER G C.Alzheimer′s disease[J].Handbook of Clinical Neurology, 2019, 167:231-255.
LEZ H M, LÉGER G C.Alzheimer′s disease[J].Handbook of Clinical Neurology, 2019, 167:231-255.
[14] BEKRIS L M, YU C G, BIRD T D, et al.Genetics of Alzheimer disease[J].Journal of Geriatric Psychiatry and Neurology, 2010, 23(4):213-227.
[15] ARMSTRONG R A.Risk factors for Alzheimer′s disease[J].Folia Neuropathologica, 2019, 57(2):87-105.
[16] HOLCOMB L, GORDON M N, MCGOWAN E, et al.Accelerated Alzheimer-type phenotype in transgenic mice carrying both mutant amyloid precursor protein and presenilin 1 transgenes[J].Nature Medicine, 1998, 4(1):97-100.
[17] WENGENACK T M, WHELAN S, CURRAN G L, et al.Quantitative histological analysis of amyloid deposition in Alzheimer′s double transgenic mouse brain[J].Neuroscience, 2000, 101(4):939-944.
[18] BHATTARAI P, THOMAS A K, COSACAK M I, et al.IL4/STAT6 signaling activates neural stem cell proliferation and neurogenesis upon amyloid-β42 aggregation in adult zebrafish brain[J].Cell Reports, 2016, 17(4):941-948.
[19] BASHIRZADE A A, ZABEGALOV K N, VOLGIN A D, et al.Modeling neurodegenerative disorders in zebrafish[J].Neuroscience and Biobehavioral Reviews, 2022, 138:104679.
[20] LU F, YANG H, LIN S D, et al.Cyclic peptide extracts derived from Pseudostellaria heterophylla ameliorates COPD via regulation of the TLR4/MyD88 pathway proteins[J].Frontiers in Pharmacology, 2020, 11:850.
[21] BHATTARAI P, THOMAS A K, COSACAK M I, et al.Modeling amyloid-β42 toxicity and neurodegeneration in adult zebrafish brain[J].Journal of Visualized Experiments, 2017(128):56014.
[22] KIZIL C, ILTZSCHE A, KASLIN J, et al.Micromanipulation of gene expression in the adult zebrafish brain using cerebroventricular microinjection of morpholino oligonucleotides[J].Journal of Visualized Experiments, 2013(75):e50415.
[23] WONG K H, RIAZ M K, XIE Y N, et al.Review of current strategies for delivering Alzheimer′s disease drugs across the blood-brain barrier[J].International Journal of Molecular Sciences, 2019, 20(2):381.
[24] SRIVASTAVA S, AHMAD R, KHARE S K.Alzheimer′s disease and its treatment by different approaches:A review[J].European Journal of Medicinal Chemistry, 2021, 216:113320.