青稞又称为裸大麦,是青藏高原中最具特色的高原农作物。青稞中蛋白质含量丰富,氨基酸比例均衡,可作为提供优质植物蛋白的潜在来源。研究发现,青稞中蛋白质平均含量为13.08%,最高含量可达20.33%,而且包含人体必需的8种氨基酸,对于补充机体每日必需氨基酸具有重要意义[1]。在食品领域,青稞蛋白的功能特性及其消化吸收性决定了其应用前景,但由于种植区域的限制,国内外对青稞蛋白功能特性和消化吸收特性的研究鲜有报道,在一定程度上限制了青稞的深加工利用。
目前,有多种食品加工技术应用于植物蛋白的改性处理,以提高其营养功能特性。其中,超声波技术作为一种绿色安全的非热加工技术,具有高效、绿色、可持续等特点,可应用于改善食品的营养功能特性和感官品质,更好地满足消费者对高质量食品的需求。研究发现,适当的超声波处理可改变蛋白质分子的空间结构,从而改善蛋白质的理化性质和体外消化特性,对进一步提高食品的营养功能、感官品质以及消化吸收性发挥重要的作用[2]。
因此,本研究以青稞粉为原料,探究功率为600 W的超声处理在不同时间条件下对青稞蛋白理化性质的影响,并通过测定蛋白质空间结构的变化进一步阐明超声波作用可改善青稞蛋白理化特性的原因,最后通过体外模拟实验探讨超声改性处理引起的青稞蛋白体外消化特性的变化,为改善青稞蛋白产品的营养功能特性和消化吸收性提供技术支撑,对提高青稞蛋白的利用价值具有重要意义。
1 材料与方法
1.1 材料与试剂
青稞粉,西安维特生物科技有限公司提供;胃蛋白酶(15 000 U/mg)、胰蛋白酶(30 000 U/mg),四川德博尔制药有限公司提供;氢氧化钠、盐酸、乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)等试剂均为分析纯,国药集团化学试剂有限公司提供。
1.2 仪器与设备
MODEL-3旋转蒸发仪,上海医疗器械专机厂;D5A-WS台式低速离心机,湖南湘仪离心机仪器有限公司;SB-25-12D超声仪,宁波新芝生物科技有限公司;SCIENTZ-10 N冷冻干燥机,北京博医康实验仪器公司;173Plus DLS动态光散射分析仪,美国Brook haven仪器公司;K9840凯氏定氮仪,济南海能仪器有限公司;SP-2102UV紫外可见分光光度计,美国PerkinElmer仪器公司;RF-5301PC荧光分光光度计,日本岛津公司;Navigator-100扫描电子显微镜,北京聚束科技有限公司。
1.3 实验方法
1.3.1 青稞蛋白的提取
参考DU等[3]的方法,并稍作改进。将青稞粉(200 g)与去离子水(5 000 mL)于室温下搅拌30 min,并调节pH至11.0。然后将混合物40 ℃下搅拌1 h后,将悬浮液以5 000×g离心15 min,在等电点(pH 4.5)处沉淀获得上清液。根据溶解度,分别使用去离子水、20 g/L氯化钠、700 mL/L乙醇和碱性溶液(pH 11)从上清液中提取青稞蛋白。在40 ℃下提取1 h,并以5 000×g离心15 min,通过旋转蒸发从700 mL/L乙醇上清液中获得青稞醇溶蛋白。再将溶液等电点调节至4.8,从碱性溶液上清液中获得青稞谷蛋白。将收集的青稞蛋白冷冻干燥并低温储存,以供进一步实验分析。
1.3.2 超声波处理青稞蛋白
取4.0 g青稞蛋白溶于100 mL蒸馏水中,于室温下以350 r/min磁力搅拌30 min,制备均匀的青稞蛋白悬浮液。参考JIN等[4]的超声改性方法并稍作改进。由预实验发现,在超声时间一定的条件下,超声波功率为600 W时,青稞蛋白的理化性质以及消化吸收特性较为可观。因此,本研究于室温下对青稞蛋白悬浮液进行600 W超声处理,脉冲开启时间为5 s,关闭时间为3 s,且超声探头浸入蛋白悬浮液表面下2 cm,超声处理时间分别为0、10、20、30、40、60 min,处理后的样品于4 ℃冰箱中保存。
1.3.3 青稞蛋白溶解度和浊度的测定
青稞蛋白溶解度的测定参考HU等[5]的方法,并稍作改进。将各组青稞蛋白样品与蒸馏水按料液比1∶100(g∶mL)混合得到青稞蛋白悬浮液,于8 000×g条件下离心30 min。用凯氏定氮法测定离心后上清液中蛋白质含量,青稞蛋白的溶解度表示为上清液蛋白质含量与离心前总蛋白含量之比,具体计算如公式(1)所示:
青稞蛋白溶解度![]()
(1)
青稞蛋白浊度的测定参考MARTINI等[6]的测定方法并稍作修改。将青稞蛋白溶液质量浓度稀释至4 mg/mL,于室温下磁力搅拌30 min后测定600 nm处吸光值,以去离子水为空白对照,每个样本测定3次取平均值。
1.3.4 青稞蛋白乳化性和乳化稳定性的测定
参考DABBOUR等[7]的测定方法并稍作修改。将青稞蛋白溶液稀释至质量浓度为5 mg/mL,稀释后的蛋白溶液与大豆油以3∶1体积比混合,用均质机对样品溶液以20 000 r/min匀浆2 min,立即取样0.05 mL并加入5 mL 0.1%的SDS溶液摇匀稀释100倍。测定波长为500 nm处的吸光值,样品于室温下静置10 min后,重复上述操作,均以SDS溶液作为空白对照。按公式(2)、公式(3)计算乳化性(EC,m2/g)和乳化稳定性(ES,%):
(2)
式中:C为蛋白质质量浓度,g/mL;A0表示样品吸光值;DF为稀释倍数;ρ是光程,1 cm;θ表示乳液中油相所占比例,0.25。
(3)
式中:EC和EC10分别表示0 min和10 min后的乳化能力。
1.3.5 青稞蛋白起泡性和泡沫稳定性的测定
参考GAO等[8]的方法测定青稞蛋白的起泡性和泡沫稳定性并稍作修改。将超声处理后的青稞蛋白溶液质量浓度稀释至0.01 g/mL,取10 mL样品溶液以20 000 r/min均质2 min后,记录泡沫体积V2,室温下,静置30 min后记录泡沫体积V30。按公式(4)、公式(5)计算起泡性(foaming characteristics,FC)和泡沫稳定性(foam stability,FS):
(4)
(5)
式中:V0为均质前蛋白溶液的体积;V2为均质2 min后的泡沫体积;V30为室温静置30 min后的泡沫体积。
1.3.6 青稞蛋白流变特性的测定
参考ZHANG等[9]的测定方法并稍作修改。用配备有平行板(直径40 mm,间隙1 000 μm)的流变分析仪恒温测定青稞蛋白溶液的流变性质,在0.1 s-1的剪切速率下进行流动分析,剪切速率范围为0~1 000 s-1。
1.3.7 青稞蛋白平均粒径与粒径分布的测定
取5 mL样品溶液,加入蒸馏水稀释至100 mL,使溶液中无肉眼可见的浑浊或沉淀杂质后进行离心,取出上清液,利用动态光散射仪进行扫描,在25 ℃平衡测定2 min,平行重复测量3次。
1.3.8 青稞蛋白微观结构的测定
参考FLORES-JIMÉNEZ等[10]的方法并稍作修改。用扫描电子显微镜(scanning electron microscope,SEM)观察超声对青稞蛋白微观结构的影响,将真空冷冻干燥后的青稞蛋白样品表面喷金使其导电,利用SEM在30 kV的加速电压下,放大200、500倍对青稞蛋白样品的微观结构进行扫描。
1.3.9 青稞蛋白紫外吸收光谱分析
参考WANG等[11]的方法并稍作修改。将超声处理后的青稞蛋白溶液用磷酸盐缓冲液(0.01 mol/L, pH 7)稀释至0.5 mg/mL,用紫外可见分光光度计测定紫外吸收强度,扫描波长为230~450 nm,扫描速度为5 nm/s。
1.3.10 青稞蛋白荧光光谱分析
参考HUANG等[12]的方法并稍作修改。用荧光分光光度计测定其荧光强度,将超声处理后的蛋白质溶液用磷酸盐缓冲液稀释至0.1 mg/mL,设定激发波长为290 nm,扫描在310~460 nm发射波长下的荧光光谱,狭缝宽度恒定为5 nm。
1.3.11 青稞蛋白体外消化特性的测定
参考WANG等[13]的方法并稍作修改。配制胃消化液中,取0.3 g胃蛋白酶、2.0 g氯化钠和0.7 mL浓盐酸溶液均匀混合,用去离子水定容至100 mL,并调节溶液pH为1.2;配制肠消化液中,将0.68 g的磷酸二氢钾用25 mL去离子水溶解完全后,依次加入19 mL 0.2 mol/L的NaOH溶液和40 mL去离子水混合,然后加入4.0 g胰蛋白酶,用去离子水定容至100 mL,并调节溶液pH为7.5。
体外模拟青稞蛋白胃和肠消化过程及其消化率的测定:将超声处理后的青稞蛋白样品与配制的胃、肠消化液混合。取10 mL蛋白溶液与12 mL配制的胃消化液分别置于37 ℃水浴中预热15 min后,将两溶液混合均匀于37 ℃水浴条件下消化2 h后,立即煮沸灭酶,冷却备用。再将溶液pH调节至7.0,加入等体积的肠消化液,于37 ℃水浴条件下消化2 h后,立即沸水灭酶,冷却备用。分别将上述两消化液以5 000×g离心30 min,收集上清液。用凯氏定氮仪测定蛋白质含量,计算青稞蛋白的体外消化率,如公式(6)所示:
体外消化率/%=
![]() 100
100
(6)
1.4 数据分析
所有实验平行重复3次,结果以平均值±标准差(SD)表示。实验数据用Excel进行初步整理,用SPSS 21.0进行数据方差分析和Duncan多重比较,并用Origin 8.0软件绘图。
2 结果与分析
2.1 超声对青稞蛋白溶解度和浊度的影响
蛋白质的溶解度主要取决于蛋白质变性和聚集的程度、表面疏水性以及蛋白质分子大小等。而浊度作为蛋白质聚集和结合程度的重要指标,与蛋白质的聚集程度呈正相关[14]。图1显示了超声时间对青稞蛋白溶解度和浊度的影响。发现未经超声处理的青稞蛋白溶解度为54.63%,超声处理0~20 min时,青稞蛋白的溶解度随超声处理时间的延长逐渐增大,当超声时间为20 min时,溶解度达到最大为78.45%。主要是因为超声作用改变了蛋白质的空间构象,使其分子结构变得疏松,蛋白分子与水之间的接触面积以及相互作用力增大,可溶性蛋白含量增多,从而溶解度显著提高[15]。而青稞蛋白浊度的变化与之相反,随着超声时间的延长,青稞蛋白的浊度先减小后增大又趋于平稳,当超声时间为20 min时,蛋白质的浊度最小。主要是因为超声波的高剪切效应破坏了青稞蛋白的完整结构,使蛋白质之间的分子键破裂,较大的蛋白质聚集体解聚成小分子,颗粒粒径减小,光散射的比表面积增大,青稞蛋白的浊度降低。若继续延长超声处理时间,小颗粒蛋白分子之间易发生重聚集形成较大的蛋白聚集体,影响光传播,从而增大蛋白质的浊度[16]。
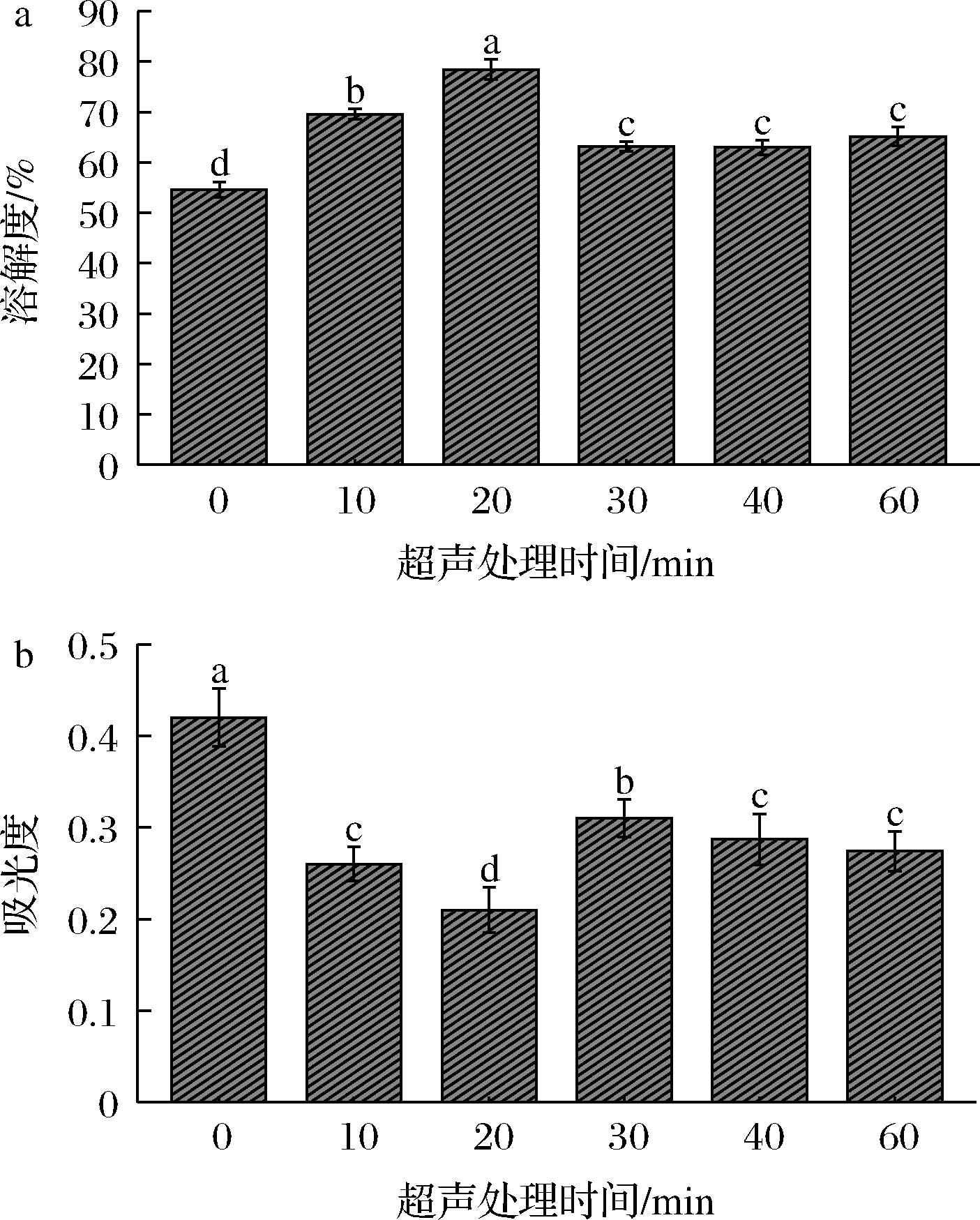
a-溶解度;b-浊度
图1 不同超声处理时间对青稞蛋白溶解度和浊度的影响
Fig.1 Effect of different ultrasonic treatment time on solubility and turbidity of barley protein
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 超声对青稞蛋白乳化性和乳化稳定性的影响
乳化活性指数(emulsifying activity index,EAI)是衡量蛋白质乳化能力的重要指标,其数值越高,表明蛋白质可越快速吸附在油滴表面,形成油水界面。乳化稳定性指数(emulsion stability index,ESI)则反映了蛋白质预防乳液分离的能力[17]。图2显示了不同超声处理时间对青稞蛋白乳化性和乳化稳定性的影响,发现青稞蛋白的乳化性随着超声时间的延长先升高后降低,当超声处理20 min时,青稞蛋白的乳化活性指数达到最大值11.05 m2/g。青稞蛋白的乳化稳定性变化趋势与蛋白乳化性相似,在600 W超声处理20 min时达到最大值。这主要是因为超声波作用促使青稞蛋白分子内部空间结构的展开,更多疏水性基团的暴露加速蛋白质分子扩散到水油界面与油脂相互作用,形成稳定的网络结构;或者由于超声波的剪切作用,蛋白质分子之间的相互作用力减弱,颗粒粒度分布均匀,从而有效提高了青稞蛋白的乳化性以及乳化稳定性。若继续延长超声处理时间,大量蛋白质颗粒易通过分子间力发生交联,从而降低了青稞蛋白的乳化性和乳化稳定性[18]。溶解性和浊度作为青稞蛋白的功能特性之一,超声处理对青稞蛋白乳化性和乳化稳定性的影响与蛋白质溶解性和浊度的变化结果一致。
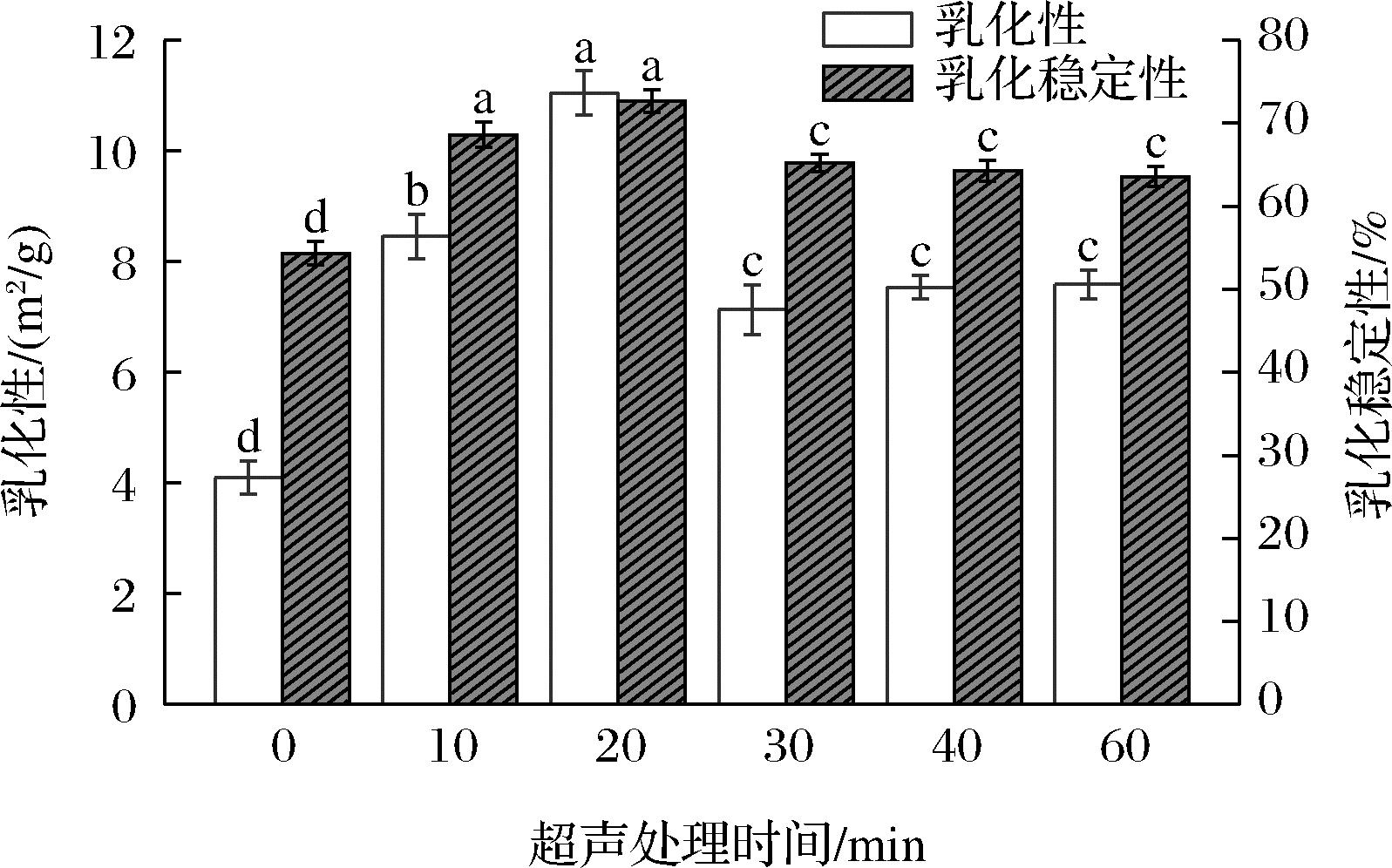
图2 不同超声处理时间对青稞蛋白乳化性和乳化 稳定性的影响
Fig.2 Effect of different ultrasonic treatment time on emulsification and emulsification stability of barley protein
2.3 超声对青稞蛋白起泡性和泡沫稳定性的影响
蛋白质的起泡能力与其形成液-气分散体的能力有关,而起泡稳定性表示一定时间后初始泡沫体积中剩余泡沫体积的百分比,是评估搅打食品质量稳定性的重要参数[19]。图3显示了超声处理对青稞蛋白起泡性和泡沫稳定性的影响,发现超声波处理后青稞蛋白样品的起泡性和泡沫稳定性均高于未经超声处理的蛋白质。在超声处理时间为20 min时,青稞蛋白的起泡能力达到最大值74.68%,蛋白质的泡沫稳定性最高为79.54%。这主要是因为超声波作用使蛋白质颗粒均匀分布于溶液中,而粒径较小的蛋白分子容易被吸附到空气和水的界面上展开,对样品的发泡性具有积极的作用。而且在超声波作用过程中,空化气泡的产生使蛋白质分子之间的相互作用力减弱,蛋白颗粒粒径减小,蛋白质更容易在空气和水的界面上展开并形成稳定性较高的泡沫[20]。超声处理对青稞蛋白起泡性和泡沫稳定性的影响与其对蛋白分子的乳化性和乳化稳定性的作用结果是一致的。
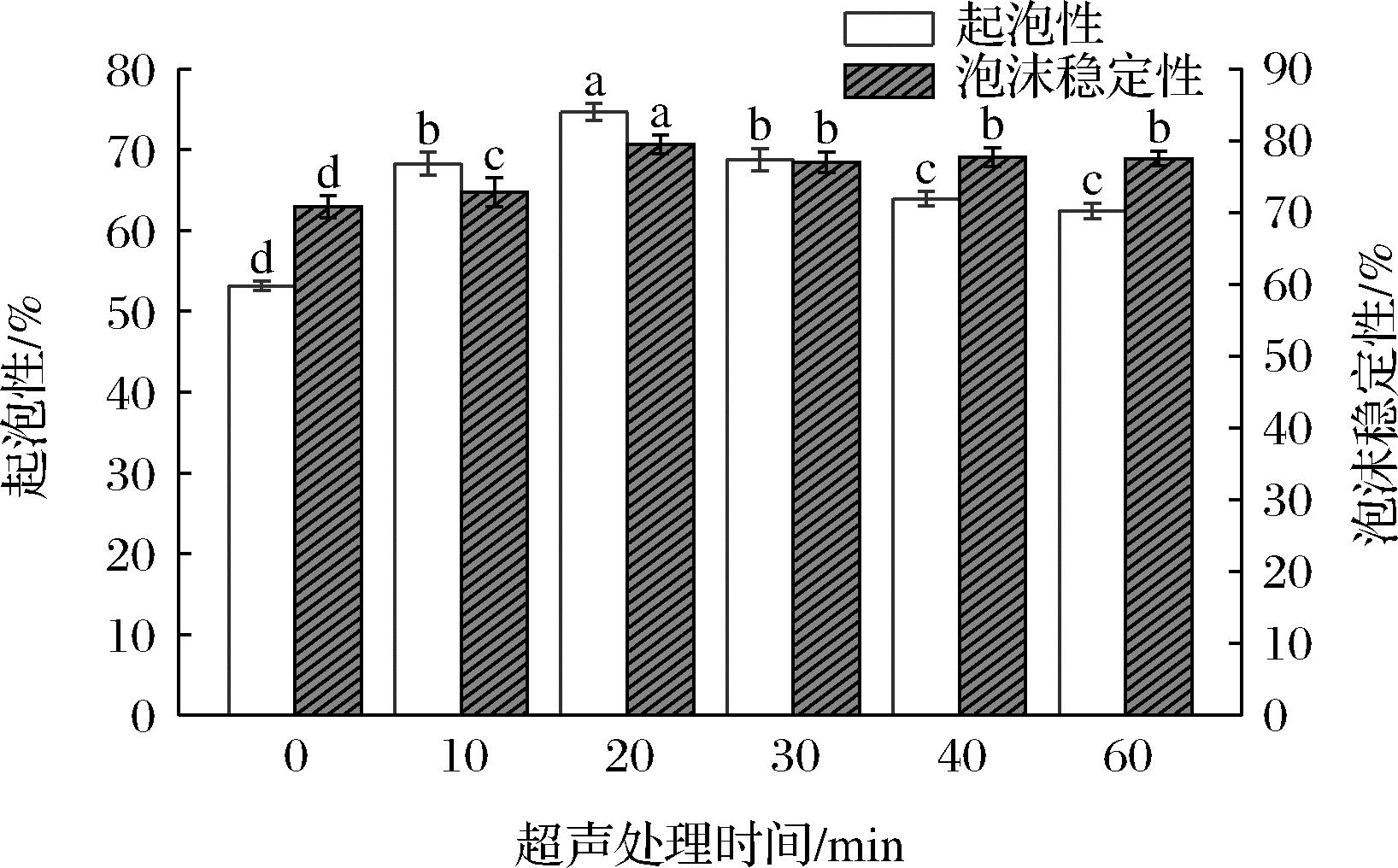
图3 不同超声处理时间对青稞蛋白起泡性和泡沫 稳定性的影响
Fig.3 Effect of different ultrasonic treatment time on foamability and foam stability of barley protein
2.4 超声对青稞蛋白流变特性的影响
蛋白质溶液的表观黏度主要取决于蛋白分子的理化性质及其表面疏水性的程度[21]。图4显示了不同超声处理时间条件下剪切速率对青稞蛋白表观黏度的影响以及剪切速率和剪切应力之间的变化关系。结果表明,超声波处理显著降低了青稞蛋白的表观黏度,并且随着剪切速率的增加,剪切应力增加,而表观黏度逐渐降低。与未经超声处理的青稞蛋白相比,超声处理可明显减小青稞蛋白的表观黏度和剪切应力。当超声处理20 min时,青稞蛋白的表观黏度降至最低,在相同的剪切速率下,超声处理时间达到30 min时,蛋白质的表观黏度呈现小幅度的增长后逐渐下降。这主要是因为超声波对青稞蛋白产生较强的剪切作用,改变了蛋白分子与水之间的结合能力或者破坏了蛋白质分子之间的化学键,使蛋白分子粒径减小,流动性增强,黏度降低[22]。然而,过长时间的超声波作用易诱导蛋白质颗粒与水之间形成较强的作用力以及蛋白分子之间发生连续的重聚集过程,使青稞蛋白粒径增大,流动性减弱,黏度增大。因此,超声波作用对青稞蛋白流变特性的影响与对蛋白分子的溶解度和粒径大小的关系密切相关。
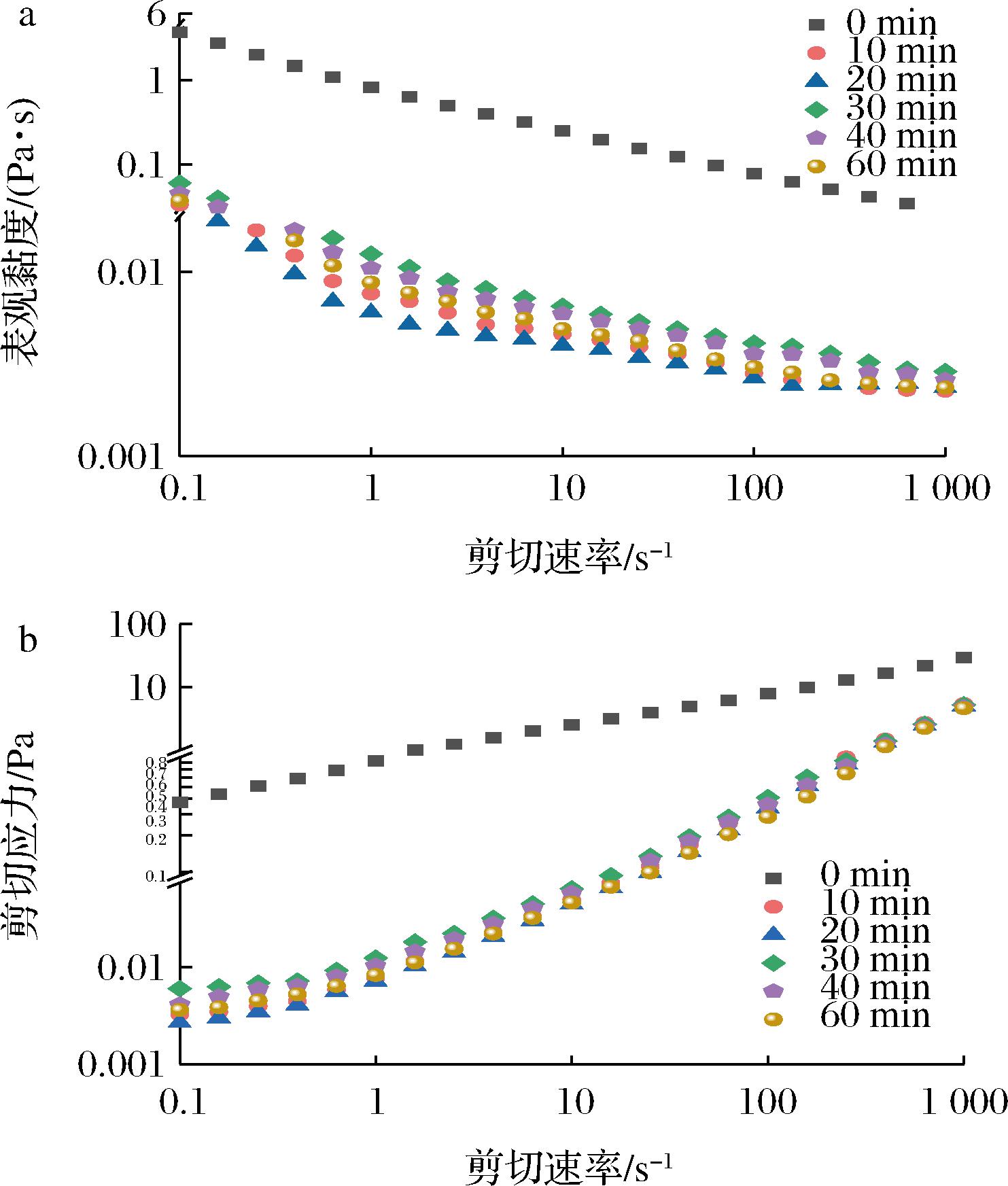
a-表观黏度;b-剪切应力
图4 不同超声处理时间条件下剪切速率对 青稞蛋白溶液表观黏度的影响
Fig.4 Effect of shear rate on apparent viscosity of barley protein solution under different ultrasonic treatment time
2.5 超声对青稞蛋白平均粒径与粒径分布的影响
超声波作用易使蛋白质发生变性,从而影响蛋白分子的结构特征,使其粒径减小[23]。图5显示了超声处理时间对青稞蛋白平均粒径的影响,发现超声作用显著降低了青稞蛋白的平均粒径,在超声20 min时,蛋白分子的平均粒径达到最小值。主要是因为超声波的空化作用破坏了蛋白质分子的空间结构,使其粒径减小。不同超声时间对青稞蛋白粒径分布的影响如图6所示。未经超声处理的蛋白质分子呈单峰分布,超声处理后青稞蛋白的粒径分布由单峰变为双峰,且主峰左移,粒径分布范围变窄。超声10 min和20 min时,在25~75 nm出现粒径次峰,表明超声作用使青稞蛋白分子发生解聚,粒径减小。超声30、40、60 min的青稞蛋白在1 000~3 000 nm出现粒径次峰,且主峰右移,粒径增大。主要是因为适当的超声波剪切作用可使蛋白质分子之间发生碰撞,破坏分子之间的相互作用力,使蛋白质聚集体转化为小片段亚基,粒径减小,粒径分布范围变窄,溶液更均匀稳定[24]。因此,粒径大小是蛋白质功能特性的重要部分,粒径小而表面积大,与水分子之间的作用力较强,溶解度增大,从而改善了蛋白质分子的乳化性和发泡性能。
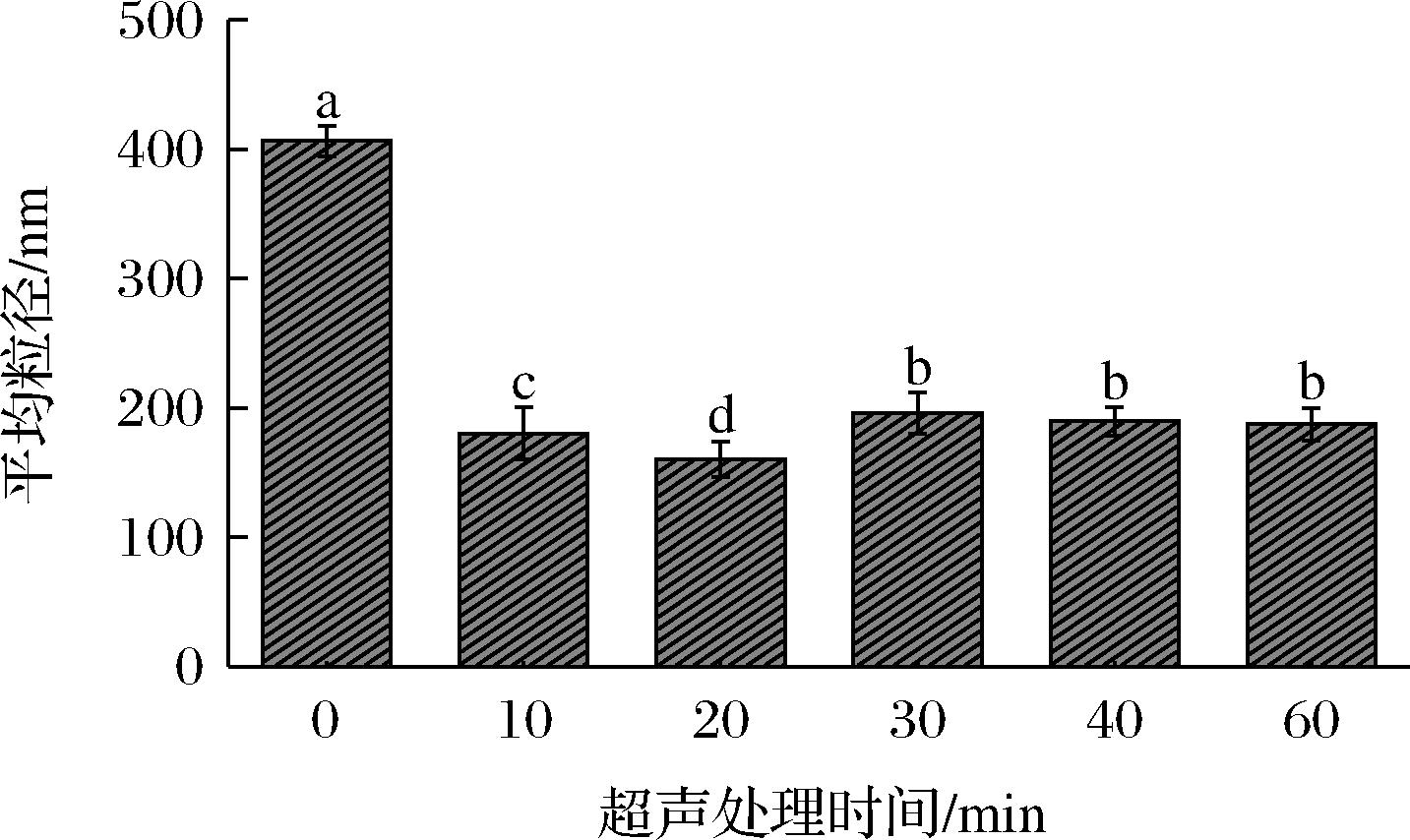
图5 不同超声处理时间对青稞蛋白平均粒径的影响
Fig.5 Effect of different ultrasonic treatment time on mean particle size of barley protein
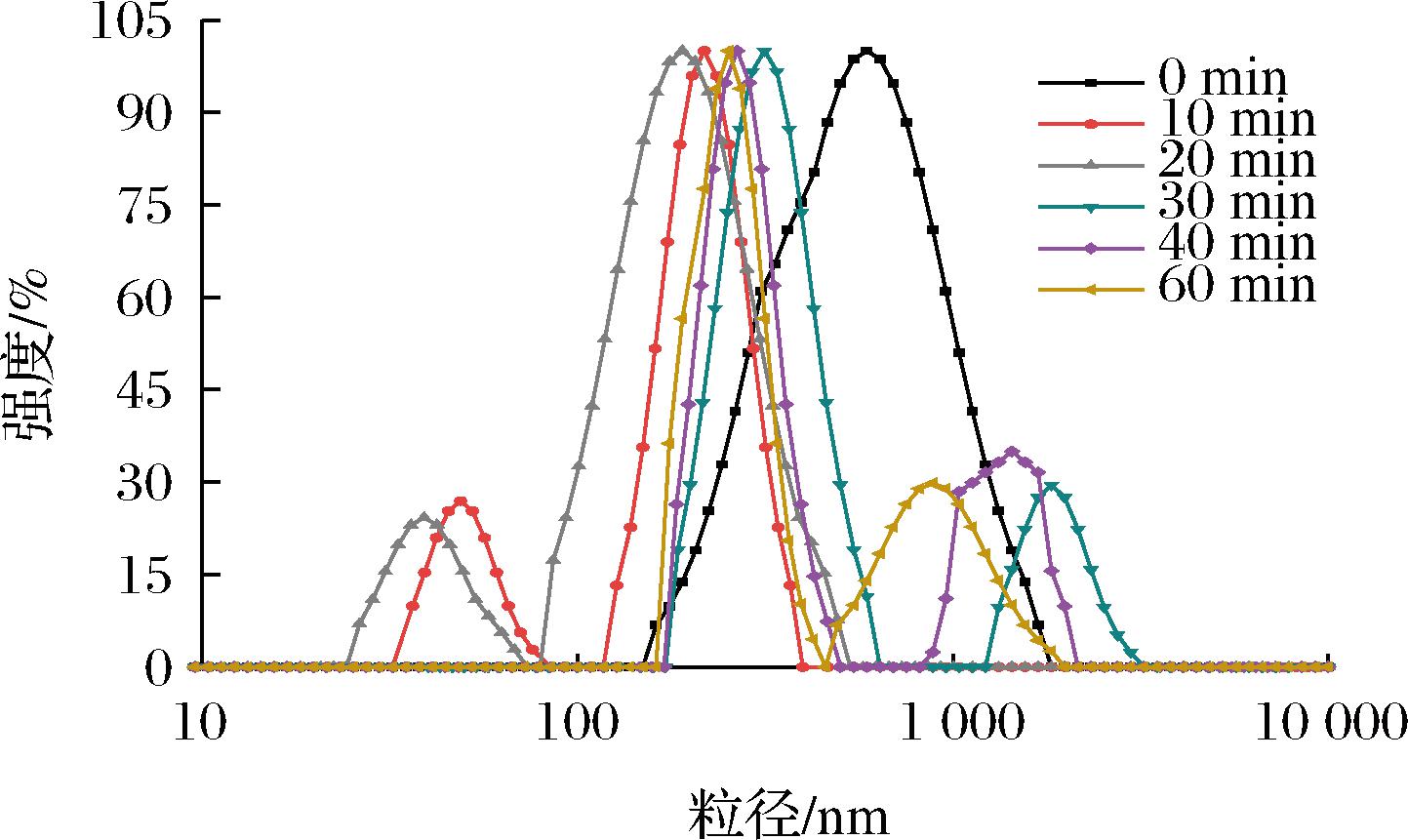
图6 不同超声处理时间对青稞蛋白粒径分布的影响
Fig.6 Effect of different ultrasonic treatment time on particle size distribution of barley protein
2.6 超声对青稞蛋白微观结构的影响
用SEM观察青稞蛋白的微观结构,探究在超声波作用下青稞蛋白结构的变化。图7显示了超声处理时间对青稞蛋白微观结构的影响,测定了放大200倍和500倍条件下青稞蛋白结构的变化。结果发现未进行超声处理的青稞蛋白表面较平整且呈大块状,超声处理后的青稞蛋白变得异质、无序,蛋白质结构更加疏松多孔且形成许多不同形状和大小的蛋白颗粒。主要是因为超声波空化作用促使青稞蛋白表面电荷的增加以及疏水性基团和巯基的暴露,而这些基团容易相互作用,从而形成不规则的片段[25]。当超声处理20 min时,青稞蛋白颗粒较小,结构更疏松多孔,这与超声对青稞蛋白粒径大小的影响结果一致。因此,超声强度600 W,超声处理时间为20 min时,青稞蛋白结构的变化更有利于其理化特性的改善。

a-青稞蛋白对照组(×200);b-超声处理20 min改性组(×200); c-青稞蛋白对照组(×500);d-超声处理20 min改性组(×500)
图7 青稞蛋白超声改性处理的SEM(×200)和(×500)图
Fig.7 The SEM (×200) and (×500) photographs of barley protein modified by ultrasonic treatment
2.7 超声对青稞蛋白紫外吸收光谱的影响
蛋白质中主要含有苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸,其微环境的变化以及在近紫外区域的光吸收强度可用于表征蛋白质空间构象的变化[26]。图8显示了不同超声时间对青稞蛋白紫外吸收光谱的影响。发现青稞蛋白的紫外吸收强度随超声时间的延长先增大后减小,但不会影响最大吸收峰位置。主要是因为在超声波的空化作用下,蛋白质分子空间结构展开促使其内部疏水基团暴露以及蛋白分子螺旋结构伸展,色氨酸、酪氨酸等显色基团从内部疏水区域转移至极性溶剂环境中,从而增大了蛋白质的紫外吸收强度[27]。若继续延长超声时间,蛋白质分子可能会发生折叠聚集,暴露的发色基团减少,紫外吸收强度降低。
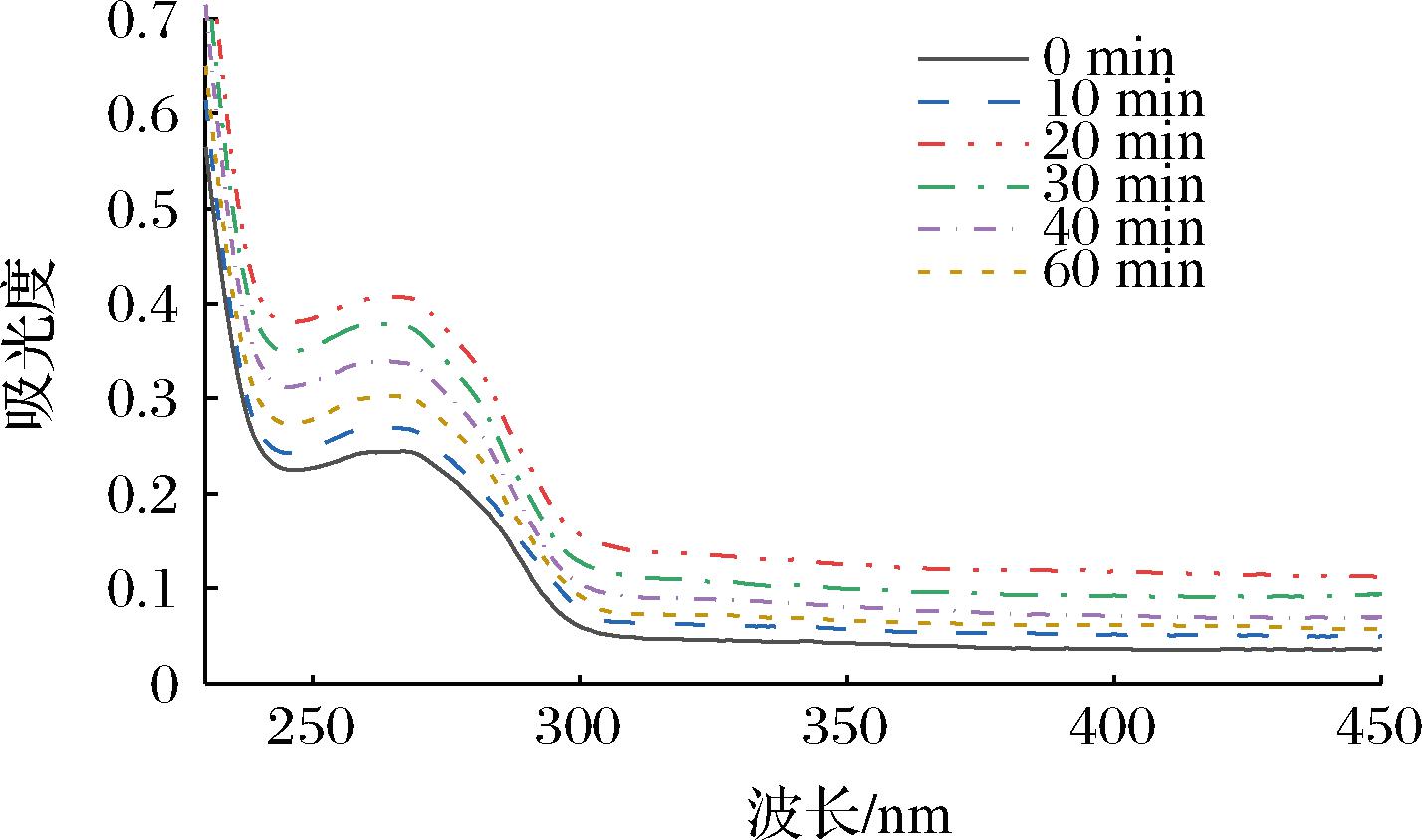
图8 不同超声处理时间对青稞蛋白紫外吸收光谱的影响
Fig.8 Effect of different ultrasonic treatment time on the ultraviolet absorption spectra of barley protein
2.8 超声对青稞蛋白荧光强度的影响
色氨酸和酪氨酸残基周围环境的极性决定了荧光强度,而荧光强度的波动可作为蛋白质三级结构变化的指标[28]。图9显示了不同超声时间对青稞蛋白荧光强度的影响。发现超声处理后青稞蛋白的荧光强度显著增强,但在不同超声时间内,青稞蛋白的最大发射波长几乎不变。这主要是因为超声波作用促使青稞蛋白内部疏水性基团的暴露以及极性区域的展开分离,蛋白质三级结构进一步拉伸,大量显色氨基酸暴露,从而增加了荧光强度[29]。超声20 min时的荧光强度最大,这一结果与青稞蛋白理化性质的变化一致。因此,适当的超声波处理可促使蛋白分子结构展开以及改变蛋白质三级结构,从而改善青稞蛋白的理化特性。
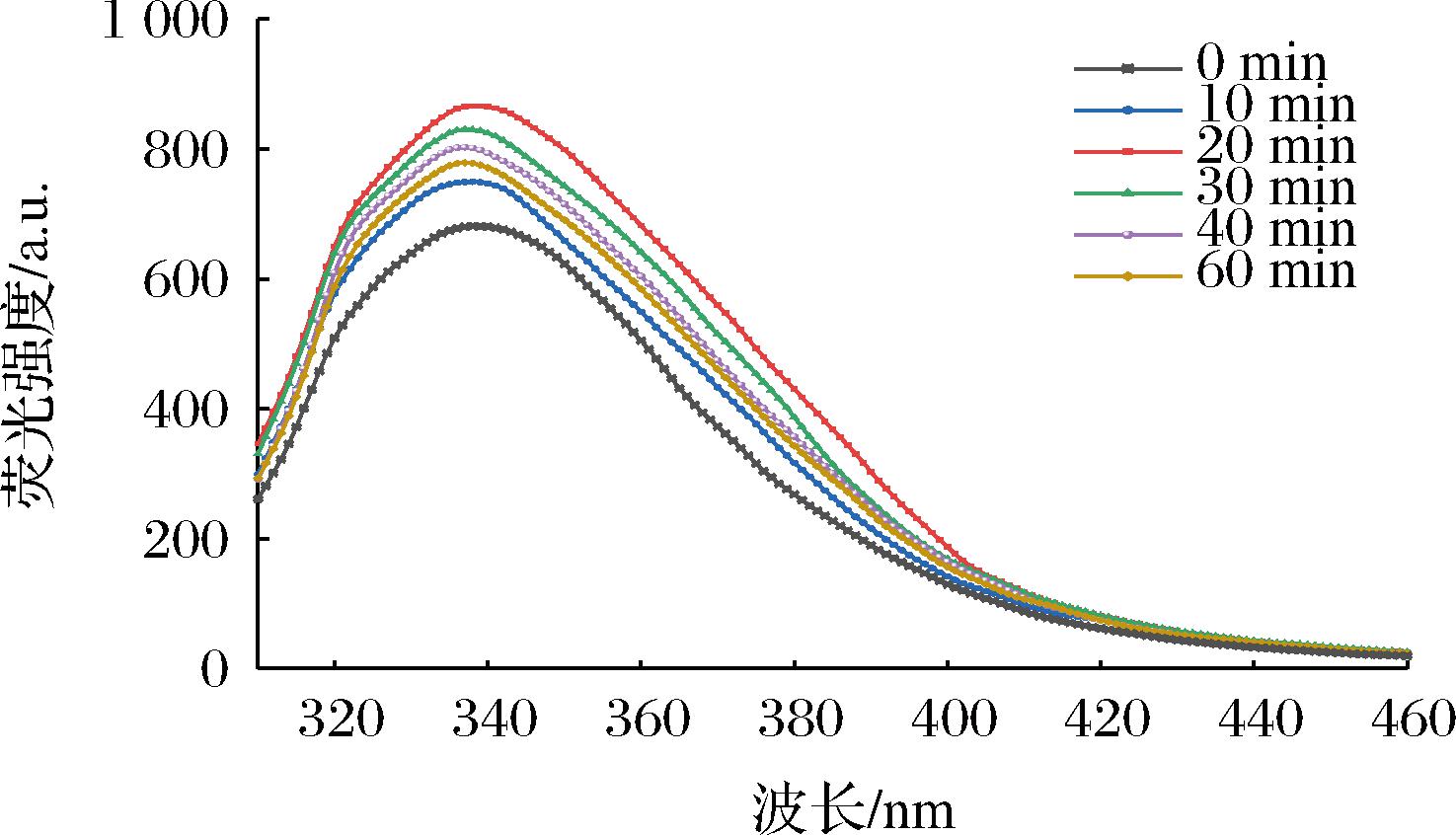
图9 不同超声处理时间对青稞蛋白荧光强度的影响
Fig.9 Effect of different ultrasonic treatment time on the fluorescence intensity of barley protein
2.9 超声对青稞蛋白体外消化率的影响
研究发现,对蛋白质分子进行超声波处理,由于超声波的空化作用,蛋白质分子被分解成较小的片段,显著提高了其反应消化速率[30]。图10显示了不同时间的超声处理对青稞蛋白体外消化率的影响。总体上来看,在模拟胃和肠液消化过程后,青稞蛋白的体外消化率变化趋势相似,超声改性处理显著提高了青稞蛋白的体外消化率,当超声处理时间为20 min时,体外消化率达到最大值79.3%。这主要是因为超声作用对青稞蛋白分子构象和微观结构的影响,使其暴露更多接触位点,增加了蛋白质对消化酶的可及性。然而,如果继续延长超声处理的时间,青稞蛋白的体外消化率逐渐减小后趋于平稳,可能是因为在外界因素的作用下,蛋白质分子的变性和复性处于平衡状态,其中变性有利于消化,而复性使蛋白质抵抗消化,适当的超声处理会促进其发生变性,从而提高蛋白质的体外消化率[31]。
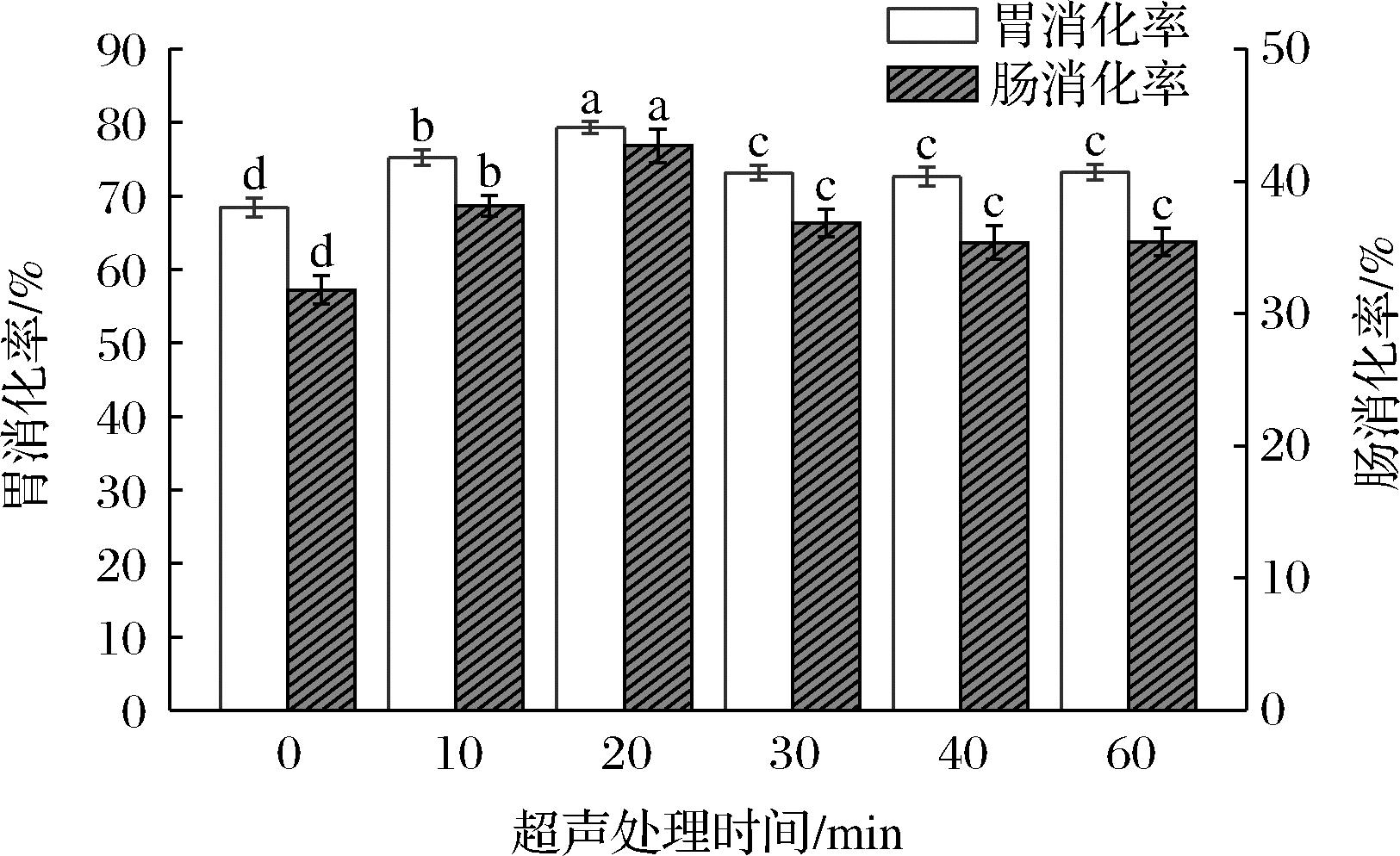
图10 不同超声处理时间对青稞蛋白体外消化率的影响
Fig.10 Effect of different ultrasonic treatment time on in vitro digestibility of barley protein
3 结论
本文以青稞蛋白为研究对象,探究超声处理时间对青稞蛋白理化性质和消化特性的影响,并从蛋白质微观结构变化等方面进一步阐述超声波作用对青稞蛋白理化特性的影响机制。结果表明,600 W超声处理20 min时,超声波的空化作用可改变蛋白质分子的空间结构并使其展开解离,显著改善了青稞蛋白的溶解度、起泡性、泡沫稳定性和乳化性等理化性质以及青稞蛋白的体外消化率,降低了青稞蛋白的浊度、蛋白分子的粒径和表观黏度,使蛋白质溶液的粒径分布范围变窄,溶液稳定性更强。此外,在超声处理20 min时,青稞蛋白的颗粒较小、结构更疏松,而且蛋白质分子内部结构的展开,促使其三级结构进一步拉伸以及疏水性基团和显色基团的暴露,紫外吸光度和荧光强度均增大,增强了超声波对青稞蛋白理化性质和体外消化特性的改善作用。综上所述,超声波是改善青稞蛋白功能特性的有效方法,且超声强度600 W、时间为20 min的处理条件对青稞蛋白的理化性质和体外消化率的改善作用最强。本研究对拓展青稞蛋白在食品工业中的应用以及提高青稞蛋白的经济价值具有重要意义。
[1] 杨希娟, 党斌, 吴昆仑, 等.青稞蛋白的超声波辅助提取工艺及其功能特性研究[J].中国食品学报, 2013, 13(6):48-56. YANG X J, DANG B, WU K L, et al.Study on functional properties and hulless barley protein by ulrasonic-assisted extraction[J].Journal of Chinese Institute of Food Science and Technology, 2013, 13(6):48-56.
[2] 刘远方, 李萌萌, 刘远晓, 等.功率超声波及其在食品工业中的降解应用研究进展[J].食品与发酵工业, 2018, 44(10):283-289. LIU Y F, LI M M, LIU Y X, et al.Progress in power ultrasound method and its application in degradation process in food industry[J].Food and Fermentation Industries, 2018, 44(10):283-289.
[3] DU Y, LIANG F, CHEN Z X, et al.Effects of decolorization on aggregation behavior of highland barley proteins:Comparison with wheat proteins[J].Food Research International, 2022, 160:111712.
[4] JIN J, OKAGU O D, YAGOUB A E A, et al.Effects of sonication on the in vitro digestibility and structural properties of buckwheat protein isolates[J].Ultrasonics Sonochemistry, 2021, 70:105348.
[5] HU H, WU J H, LI-CHAN E C Y, et al.Effects of ultrasound on structural and physical properties of soy protein isolate dispersions[J].Food Hydrocolloids, 2013, 30(2):647-655.
[6] MARTINI S, POTTER R, WALSH M K.Optimizing the use of power ultrasound to decrease turbidity in whey protein suspensions[J].Food Research International, 2010, 43(10):2444-2451.
[7] DABBOUR M, HE R, MINTAH B, et al.Changes in functionalities, conformational characteristics and antioxidative capacities of sunflower protein by controlled enzymolysis and ultrasonication action[J].Ultrasonics Sonochemistry, 2019, 58:104625.
[8] GAO K, ZHA F C, YANG Z Y, et al.Structure characteristics and functionality of water-soluble fraction from high-intensity ultrasound treated pea protein isolate[J].Food Hydrocolloids, 2022, 125:107409.
[9] ZHANG T H, ZHAO Y L, TIAN X, et al.Effect of ultrasound pretreatment on structural, physicochemical, rheological and gelation properties of transglutaminase cross-linked whey protein soluble aggregates[J].Ultrasonics Sonochemistry, 2021, 74:105553.
[10] FLORES-JIMÉNEZ N T, ULLOA J A, UR AS-SILVAS J E, et al.Influence of high-intensity ultrasound on physicochemical and functional properties of a guamuchil Pithecellobium dulce (Roxb.) seed protein isolate[J].Ultrasonics Sonochemistry, 2022, 84:105976.
AS-SILVAS J E, et al.Influence of high-intensity ultrasound on physicochemical and functional properties of a guamuchil Pithecellobium dulce (Roxb.) seed protein isolate[J].Ultrasonics Sonochemistry, 2022, 84:105976.
[11] WANG Y, ZHOU Y, LI P J, et al.Combined effect of CaCl2 and high pressure processing on the solubility of chicken breast myofibrillar proteins under sodium-reduced conditions[J].Food Chemistry, 2018, 269:236-243.
[12] HUANG L R, DING X N, Li Y L, et al.The aggregation, structures and emulsifying properties of soybean protein isolate induced by ultrasound and acid[J].Food Chemistry, 2019, 279:114-119.
[13] WANG X, LIN Q Q, YE A Q, et al.Flocculation of oil-in-water emulsions stabilised by milk protein ingredients under gastric conditions:Impact on in vitro intestinal lipid digestion[J].Food Hydrocolloids, 2019, 88:272-282.
[14] JIANG S, ZHANG M, LIU H, et al.Ultrasound treatment can increase digestibility of myofibrillar protein of pork with modified atmosphere packaging[J].Food Chemistry, 2022, 377:131811.
[15] RAHMAN M M, BYANJU B, GREWELL D, et al.High-power sonication of soy proteins:Hydroxyl radicals and their effects on protein structure[J].Ultrasonics Sonochemistry, 2020, 64:105019.
[16] YAN S Z, XU J W, ZHANG S, et al.Effects of flexibility and surface hydrophobicity on emulsifying properties:Ultrasound-treated soybean protein isolate[J].LWT, 2021, 142:110881.
[17] GUPTA A, SHARMA S, SURASANI V K R, et al.Quinoa protein isolate supplemented pasta:Nutritional, physical, textural and morphological characterization[J].LWT, 2021, 135:110045.
[18] CUI Q, ZHANG A Q, LI R, et al.Ultrasonic treatment affects emulsifying properties and molecular flexibility of soybean protein isolate-glucose conjugates[J].Food Bioscience, 2020, 38:100747.
[19] FIGUEROA-GONZ LEZ J J, LOBATO-CALLEROS C, VERNON-CARTER E J, et al.Modifying the structure, physicochemical properties, and foaming ability of amaranth protein by dual pH-shifting and ultrasound treatments[J].LWT-Food Science Technology, 2022, 153:112561.
LEZ J J, LOBATO-CALLEROS C, VERNON-CARTER E J, et al.Modifying the structure, physicochemical properties, and foaming ability of amaranth protein by dual pH-shifting and ultrasound treatments[J].LWT-Food Science Technology, 2022, 153:112561.
[20] WANG Y T, WANG S S, LI R, et al.Effects of combined treatment with ultrasound and pH shifting on foaming properties of chickpea protein isolate[J].Food Hydrocolloids, 2022, 124:107351.
[21] SHOKRI S, JAVANMARDI F, MOHAMMADI M, et al.Effects of ultrasound on the techno-functional properties of milk proteins:A systematic review[J].Ultrasonics Sonochemistry, 2022, 83:105938.
[22] HU A N, LI L.Effect mechanism of ultrasound pretreatment on fibrillation kinetics, physicochemical properties and structure characteristics of soy protein isolate nanofibrils[J].Ultrasonics Sonochemistry, 2021, 78:105741
[23] O′SULLIVAN J, MURRAY B, FLYNN C, et al.The effect of ultrasound treatment on the structural, physical and emulsifying properties of animal and vegetable proteins[J].Food Hydrocolloids, 2016, 53:141-154.
[24] ZHAO X Q, FAN X X, SHAO X Q, et al.Modifying the physicochemical properties, solubility and foaming capacity of milk proteins by ultrasound-assisted alkaline pH-shifting treatment[J].Ultrasonics Sonochemistry, 2022, 88:106089.
[25] MALIK M A, SAINI C S.Rheological and structural properties of protein isolates extracted from dephenolized sunflower meal:Effect of high intensity ultrasound[J].Food Hydrocolloids, 2018, 81:229-241.
[26] AMADEO B B, POLLET J, CHEN W H, et al.A method to probe protein structure from UV absorbance spectra[J].Analytical Biochemistry, 2019, 587:1-8.
[27] YANG X, LI Y L, LI S Y, et al.Effects of multi-frequency ultrasound pretreatment under low power density on the enzymolysis and the structure characterization of defatted wheat germ protein[J].Ultrasonics Sonochemistry, 2017, 38:410-420.
[28] SHEN L, TANG C H.Microfluidization as a potential technique to modify surface properties of soy protein isolate[J].Food Research International, 2012, 48(1):108-118.
[29] DONG Z Y, LI M Y, TIAN G, et al.Effects of ultrasonic pretreatment on the structure and functionality of chicken bone protein prepared by enzymatic method[J].Food Chemistry, 2019, 299:125103.
[30] QU W J, MA H L, LIU B, et al.Enzymolysis reaction kinetics and thermodynamics of defatted wheat germ protein with ultrasonic pretreatment[J].Ultrasonics Sonochemistry, 2013, 20(6):1408-1413.
[31] KHATKAR A B, KAUR A, KHATKAR S K.Restructuring of soy protein employing ultrasound:Effect on hydration, gelation, thermal, in vitro protein digestibility and structural attributes[J].LWT, 2020, 132:109781.