莲子心(Nelumbinis Plumula)是睡莲科植物莲(Nelumbo nucifera Gaertn.)成熟种子的干燥幼叶及胚根,其最早记载可以追溯到晚唐时期的《食性本草》[1]。作为药食同源的莲子心具有清心安神,交通心肾,涩精止血等功效,其特征性成分是以莲心碱、异莲心碱、甲基莲心碱为主的苄基异喹啉类生物碱,中国药典中也以甲基莲心碱作为指标成分,规定为其含量不得低于0.7%[2-3]。
研究表明,莲子心中的特征性生物碱具有抗炎功效。MENG等[4]研究了在脂多糖(lipopolysaccharide,LPS)刺激的BV2细胞模型中,莲心碱、异莲心碱、甲基莲心碱可抑制炎症因子NO、白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)的释放,从而可缓解炎症导致的神经退行性疾病;蓝秋梅等[5]研究发现甲基莲心碱可以缓解LPS诱导的大鼠软骨细胞炎症和抑制细胞外基质的降解,从而起到缓解骨关节炎的作用;莲心碱可以减轻小鼠败血症诱导的脾脏组织炎症、氧化应激和细胞凋亡[6]。
特应性皮炎(atopic dermatitis,AD)作为一种以瘙痒和湿疹性病变为特征的慢性炎症性皮肤病,因反复发作,现已成为一种可危害身心健康的皮肤科常见疾病。YANG等[7]阐明了在TNF-α和干扰素-γ(interferon-gamma,IFN-γ)刺激的HaCaT炎症细胞模型中,甲基莲心碱可通过抑制MAPK和NF-κB磷酸化水平缓解特应性皮炎,并且在2,4-二硝基氯苯诱导的BALB/c老鼠皮炎模型中得到了验证。因此,莲子心生物碱可能是一种治疗AD的潜在药物。然而,根据当前的研究报道,莲子心生物碱在体内经历初步代谢后才能被利用。林敏亭等[8]的研究表明,在Caco-2细胞中,莲子心生物碱主要通过去甲基化来实现生物利用;韩栋年[9]研究发现,莲子心生物碱在小鼠体内主要经历羟基化、去甲基化、葡萄糖醛酸化以及硫酸化等过程后方能被有效利用。因此,若欲在体外水平上应用莲子心生物碱,需先进行其初步代谢分解。
发酵的历史悠久,作为最简单、自然、有价值的技术之一[10],发酵技术已经被应用于生产生活的方方面面。微生物发酵中药,可以利用微生物中发达的酶系增强其药效或者产生新的药效。米曲霉作为一种食品工业上常见的菌种,具有发达的酶系。曹艺等[11]研究发现米曲霉可使中药材中的马兜铃酸类化合物发生转化,这表明米曲霉在莲子心特征性生物碱转化上存在可能。
本研究利用米曲霉对莲子心特征性生物碱进行转化,通过建立TNF-α和IFN-γ双炎症因子诱导的HaCaT细胞AD炎症模型,探究了莲子心发酵液及萃取后的水油两相物质对细胞炎症的影响,旨在开发功能性食品、化妆品及药品领域中用于改善皮肤状态的中药发酵制剂。
1 材料与方法
1.1 材料与试剂
米曲霉(CICC 40636);DMEM高糖培养基,青霉素-链霉素双抗,胰蛋白酶溶液,美国Gibco公司;PBS缓冲溶液,美国Cytiva公司;胎牛血清,新西兰Newzerum公司;ELISA检测试剂盒,美国SAB公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、过氧化氢酶(catalase,CAT)试剂盒、总谷胱甘肽(glutathione,GSH)试剂盒,中国碧云天公司;HaCaT人永生化角质形成细胞(BNCC 339817),北纳创联生物技术有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(methylthiazolyldiphenyl-tetrazolium bromide,MTT),美国Sigma公司;其余试剂均为AR级,上海国药集团。
1.2 仪器与设备
Synergy-H1多功能酶标仪,美国Biotek公司;MPW-325R低温离心机,波兰MPW公司;Ultimate 3000 RS超高效液相色谱仪,美国Thermo Fisher Scientific公司;MALDI SYNAPT MS超高效液相色谱串联四级杆飞行时间质谱联用仪,美国Waters公司。
1.3 试验方法
1.3.1 孢子悬浮液的制备
马铃薯琼脂斜面(potato dextrose agar,PDA)培养基:马铃薯200 g/L、葡萄糖20 g/L、琼脂20 g/L。
将在-80 ℃保存的菌种经过划线接种到PDA斜面培养基上,放置于30 ℃生化培养箱中培养,待菌株长出绿色孢子后,使用无菌的生理盐水进行冲洗,以备后续使用。
1.3.2 莲子心发酵液的制备
种子培养基:蛋白胨5 g/L、葡萄糖3.2 g/L、七水硫酸镁0.5 g/L、吐温-80 0.1 g/L、磷酸氢二钾1 g/L。
发酵培养基:莲子心30 g/L、蛋白胨5 g/L、葡萄糖10 g/L、七水硫酸镁0.5 g/L、吐温-80 0.1 g/L、磷酸氢二钾1 g/L。
在种子培养基中接种2%(体积分数)的孢子悬浮液,然后在30 ℃的恒温摇床中以200 r/min的速度培养48 h。随后将培养好的种子液接入到发酵培养基中,继续在30 ℃、200 r/min摇床中进行发酵培养。
1.3.3 莲子心发酵过程监测
分别取发酵前后的上清液1 mL,10 000 r/min离心2 min,将离心后的上清液通过0.22 μm微孔滤膜过滤,以便用于HPLC检测。同时配制0.2 mg/mL的标准品混合物进行对照检测。
色谱条件:色谱柱为AcclaimTM 120-C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水;流动梯度:0~30 min,65%~80%甲醇,30~40 min,100%甲醇;检测波长283 nm;流速:1 mL/min;进样量:10 μL(标准品),20 μL(样品)。
1.3.4 莲子心发酵样品(fermented nelumbinis plumula,FPN)的处理及鉴定
发酵液Fm经纱布过滤后,10 000 r/min离心10 min,取上清液,用0.45 μm微孔滤膜过滤。过滤清液经二氯甲烷萃取(体积比3∶1),得到水相Fw和油相Fo,并分别通过旋蒸法除去其中的液体。同时将发酵0 d的培养基进行同样的处理得到发酵前原液Bm,发酵前水相Bw,发酵前油相Bo。
采用硅胶G薄层板,将Bo(1 mg/mL)、Fo(20 mg/mL)和莲心碱、异莲心碱、甲基莲心碱混合物(Std)分别进行点样,点样量5 μL,展开剂为乙酸乙酯-二氯甲烷-三乙胺(体积比为6∶3∶1),待展开剂接近硅胶板上沿时,将硅胶板取出,烘干后用稀碘化铋钾溶液喷雾显色。同时利用LC/MS对Bo和Fo中含有苄基四氢异喹啉特征吸收波长(λ=283 nm)的生物碱成分进行分析。
1.3.5 HaCaT细胞培养及FPN对细胞存活率的测定
将人类永生化表皮细胞(HaCaT)培养于含有10%胎牛血清,1%青霉素-链霉素双抗的高糖DMEM培养基中,在37 ℃,5% CO2的恒温细胞培养箱中进行培养。待细胞生长至培养皿底部覆盖70%~80%时进行传代培养。
生长状态良好的HaCaT细胞以1×105个/mL的密度接种至96孔板中,每个孔加100 μL细胞悬浮液,培养24 h后去除培养基,用PBS清洗3次,然后加入100 μL DMEM培养基配制的待测样品。将96孔板置于培养箱中培养24 h后,弃去培养基并用PBS清洗3次,之后加入100 μL DMEM配制的0.5 mg/mL的MTT溶液,在培养箱中反应4 h后,弃去溶液,然后加入100 μL二甲亚砜溶液,混匀后在490 nm处测量吸光度,通过吸光度差异计算细胞存活率。
1.3.6 HaCaT细胞中氧化应激参数的测定
HaCaT细胞以5×105个/mL接种至6孔板中,每孔加入1.5 mL细胞悬浮液。当细胞生长至培养皿底部达到80%的覆盖率时,进行加样处理。对照组加1.5 mL DMEM培养基,模型组加入含有15 ng/mL TNF-α和15 ng/mL IFN-γ(TI)[12]的DMEM培养基,样品组加入含有样品和TI的DMEM培养基。再培养24 h后,弃去培养基,用预冷的PBS缓冲液清洗3次,收集细胞。根据试剂盒的说明,测定细胞中超氧化物歧化酶SOD、MDA、GSH和CAT的含量。
1.3.7 HaCaT细胞中分泌因子的测定
使用1.3.6节的方法对HaCaT细胞进行接种和加样。培养24 h后,收集上清液,2 500 r/min离心12 min,之后按照酶联免疫吸附测定试剂盒(ELISA)的说明书测定上清液中胸腺激活调节趋化因子(thymus and activation-regulated chemokine,TARC)、巨噬细胞来源趋化因子(macrophage-derived chemokine,MDC)和IL-6的含量。
1.3.8 数据处理
每组实验均进行至少3次的重复,采用Origin 2022处理数据,结果以平均值±标准差表示。数据分析采用One-way ANOVA模型进行显著性分析,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 发酵过程的成分变化及产物鉴定
2.1.1 莲子心发酵过程生物碱成分变化
图1为发酵上清液和标准品混合物在λ=283 nm下的HPLC图,峰1为莲心碱,峰2为异莲心碱,峰3为甲基莲心碱。在发酵前,莲子心中主要的生物碱成分为异莲心碱和甲基莲心碱,含量分别为0.04 mg/mL和0.14 mg/mL。随着发酵的进行,异莲心碱的峰面积降低90%,甲基莲心碱的峰面积降低91%,同时在t=6 min和t=8 min位置出现2个与苄基异喹啉生物碱衍生物特征吸收峰一致的信号峰。因此,可以推断米曲霉能够分解莲子心中的异莲心碱和甲基莲心碱,并且能够产生至少2种新的生物碱。
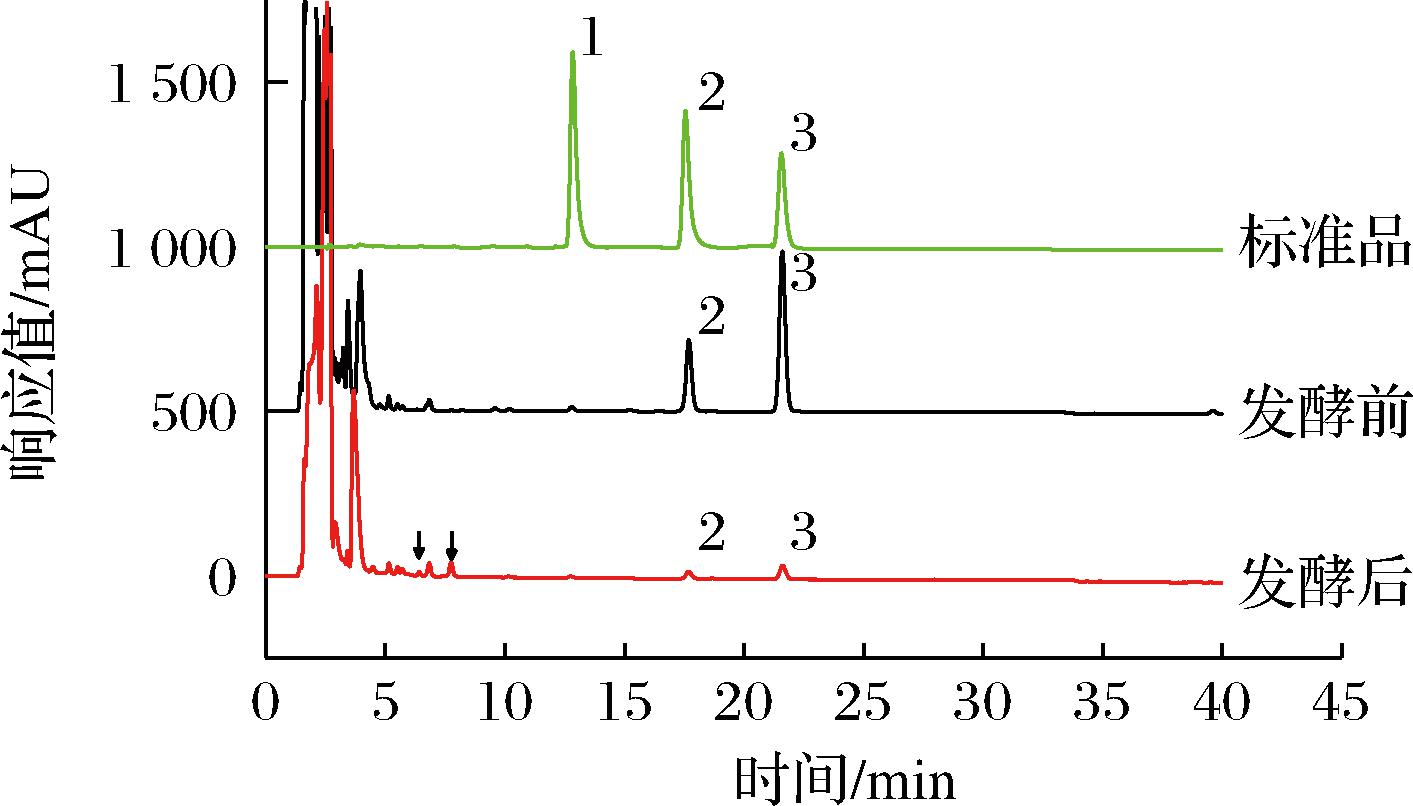
图1 莲子心发酵过程生物碱成分的变化
Fig.1 Changes in alkaloid components during the fermentation process of Nelumbinis Plumula
2.1.2 发酵产物的鉴定
Bo,Fo薄层色谱分析(thin-layer chromatography,TLC)结果见图2-a,1、2和3分别为莲心碱、异莲心碱和甲基莲心碱。二氯甲烷萃取后,苄基异喹啉类生物碱衍生物在油相中得到富集。Fo相比与Bo显示出至少两种极性更大的生物碱成分,这与HPLC结果是一致的。为了详细了解产物结构,对Bo,Fo进行LC/MS分析,总离子流图如图2-b所示。通过对比相关文献,结合保留时间,准分子离子峰,二级碎片离子峰等信息,鉴定了产物的结构,具体结果见表1。研究发现,通过微生物发酵,甲基莲心碱和异莲心碱可以分解成N-甲基乌药碱和杏黄罂粟碱。
表1 发酵后油相中成分鉴定
Table 1 Identification of components in the oil phase after fermentation
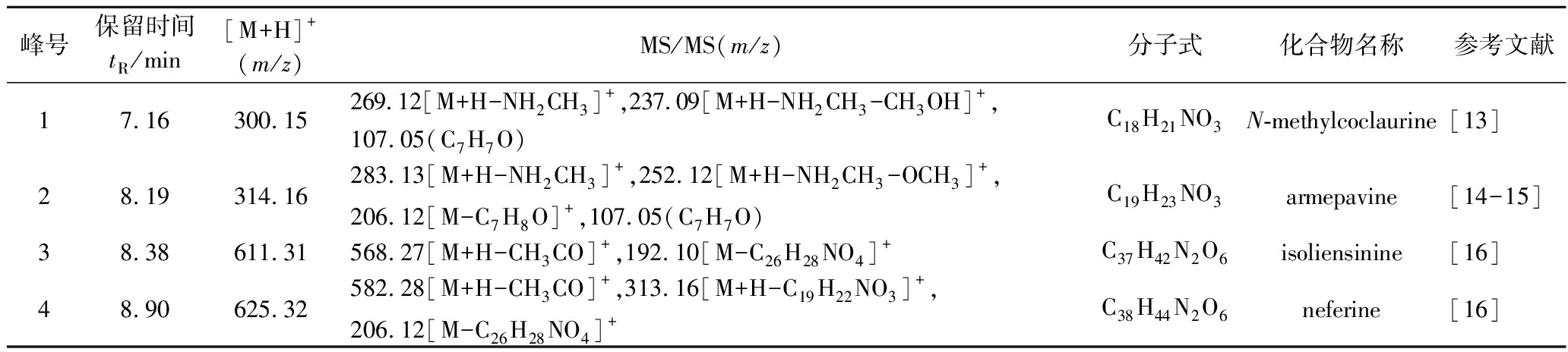
峰号保留时间tR/min[M+H]+(m/z)MS/MS(m/z)分子式化合物名称参考文献17.16300.15269.12[M+H-NH2CH3]+,237.09[M+H-NH2CH3-CH3OH]+,107.05(C7H7O)C18H21NO3N-methylcoclaurine[13]28.19314.16283.13[M+H-NH2CH3]+,252.12[M+H-NH2CH3-OCH3]+,206.12[M-C7H8O]+,107.05(C7H7O)C19H23NO3armepavine[14-15]38.38611.31568.27[M+H-CH3CO]+,192.10[M-C26H28NO4]+C37H42N2O6isoliensinine[16]48.90625.32582.28[M+H-CH3CO]+,313.16[M+H-C19H22NO3]+,206.12[M-C26H28NO4]+C38H44N2O6neferine[16]
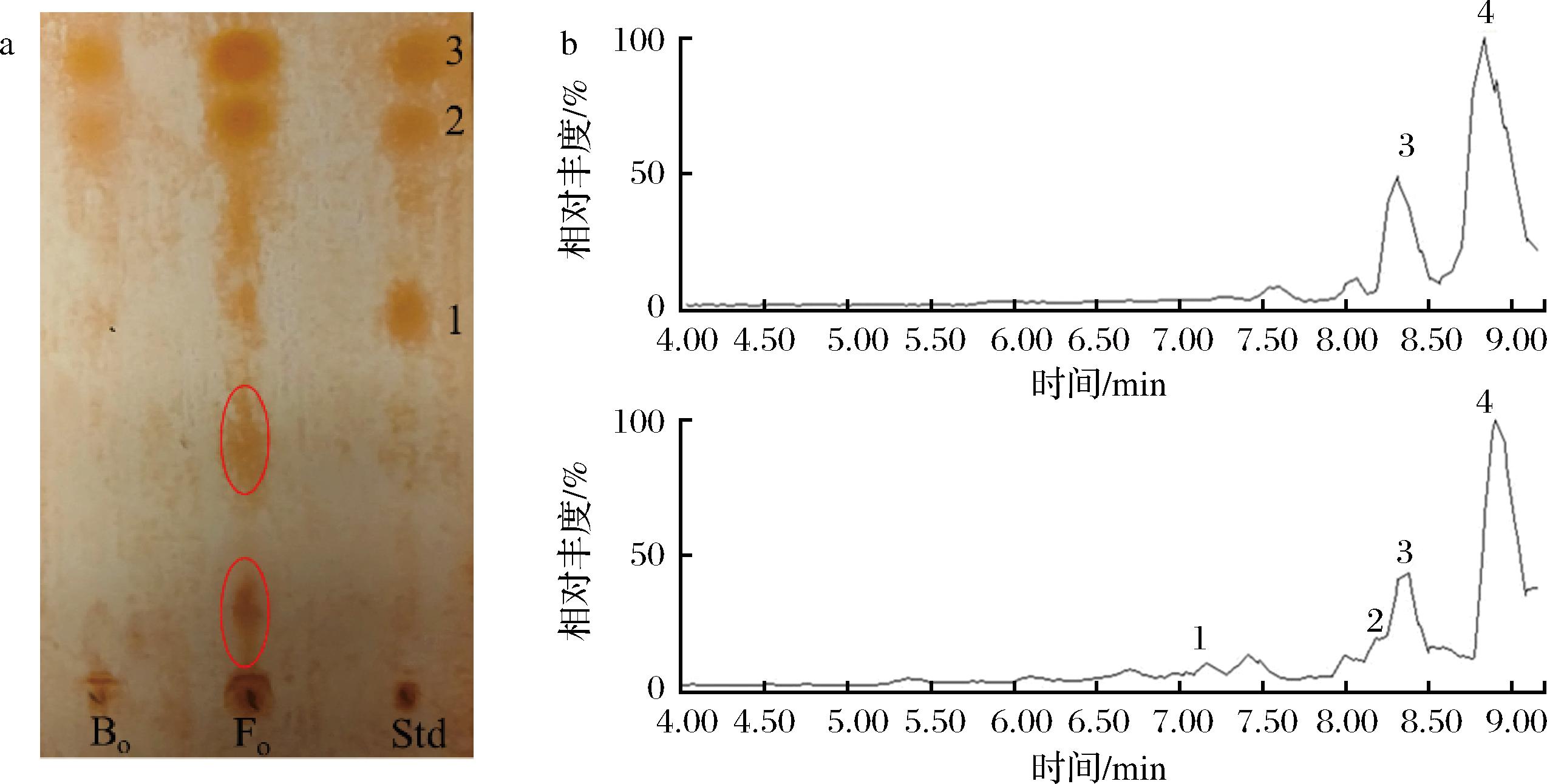
a-TLC图;b-总离子流图
图2 发酵前后油相TLC图及总离子流图
Fig.2 The TLC profiles of the oil phase before and after fermentation and TOF/MS total ion chromatograms.
2.2 FPN对HaCaT细胞存活率的影响
如图3-a所示,Fm和Bm在不同浓度下均与对照组之间存在显著性差异,特别是当样品浓度在2 mg/mL时,细胞存活率降至80%左右。对比Fm与Bm的毒性,在浓度低于2 mg/mL时,两者毒性接近,当浓度提升到20 mg/mL及以上时,Fm组的细胞存活率高于Bm组。对于Bw和Fw,Bw组在3 mg/mL的浓度下细胞存活率显著下降(P<0.001),而Fw组在1 mg/mL的浓度时就会使细胞存活率显著下降(P<0.001),当样品浓度大于0.5 mg/mL时,Fw组的细胞存活率低于Bw组(图3-b)。而在Bo和Fo的考察中,Bo和Fo组在浓度0.031 mg/mL及以上时显著降低细胞存活率,当样品浓度在0.016 mg/mL及以上时,Bo的毒性要高于Fo(图3-c)。
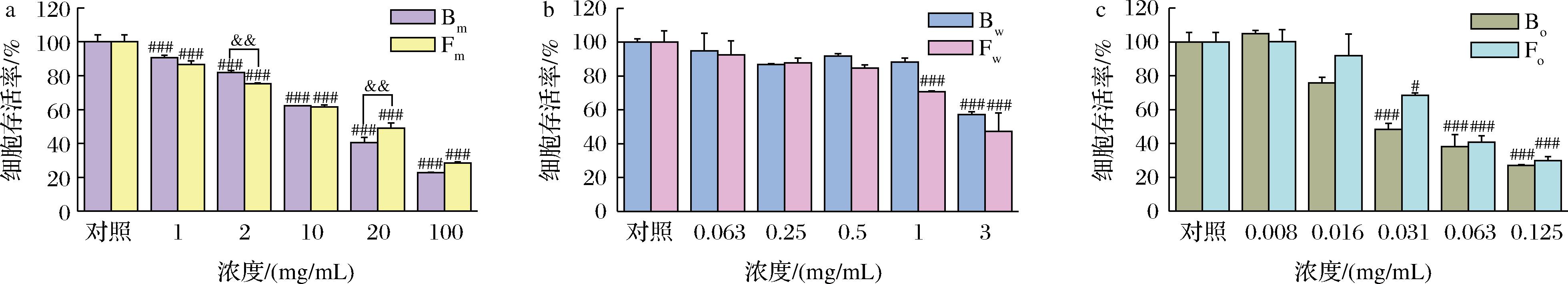
a-Bm和Fm;b-Bw和Fw;c-Bo和Fo
图3 不同浓度的FPN对HaCaT细胞存活率的影响
Fig.3 The cell viability of FPN contain different concentration on HaCaT cells
注:与对照组相比,#表示P<0.05,###表示P<0.001;与发酵前相比,&&表示P<0.01。
综上所述,莲子心经米曲霉发酵,发酵原液的毒性呈下降趋势,发酵水相的毒性提升,而发酵油相的毒性降低,且将分别选取Bm(2 mg/mL)、Fm(2 mg/mL)、Bw(0.25 mg/mL)、Fw(0.25 mg/mL)、Bo(0.016 mg/mL)和Fo(0.016 mg/mL)的浓度作为后续的细胞实验浓度。
2.3 FPN对TI诱导的HaCaT细胞氧化应激的影响
FPN处理对氧化应激参数的影响如图4所示。与对照组相比,TI刺激的模型组SOD活性、GSH含量和CAT活性分别显著降低74%、74%和78%,MDA水平显著升高380%(P<0.001),表明细胞中产生了氧化应激损伤。Bm、Fm和Fo组的SOD活性相比于模型组显著提升,Fo相比于Bo组的SOD活性显著提升62%(图4-a)。相较与模型组,Bm、Fm、Bw、Bo和Fo组的GSH含量显著增加。Fm相比于Bm组,Fo相比于Bo组,GSH含量分别增加19%和72%(图4-b)。相比于模型组,FPN可以引起细胞中CAT活性显著性升高。Fm相较于Bm组,CAT活性提升33%,Fo相较于Bo组,CAT活性提升164%(图4-c)。此外,相比与模型组,FPN样品均可引起细胞内MDA水平的下降,且Fo相比与Bo组,细胞内MDA水平显著下降45%(图4-d)。
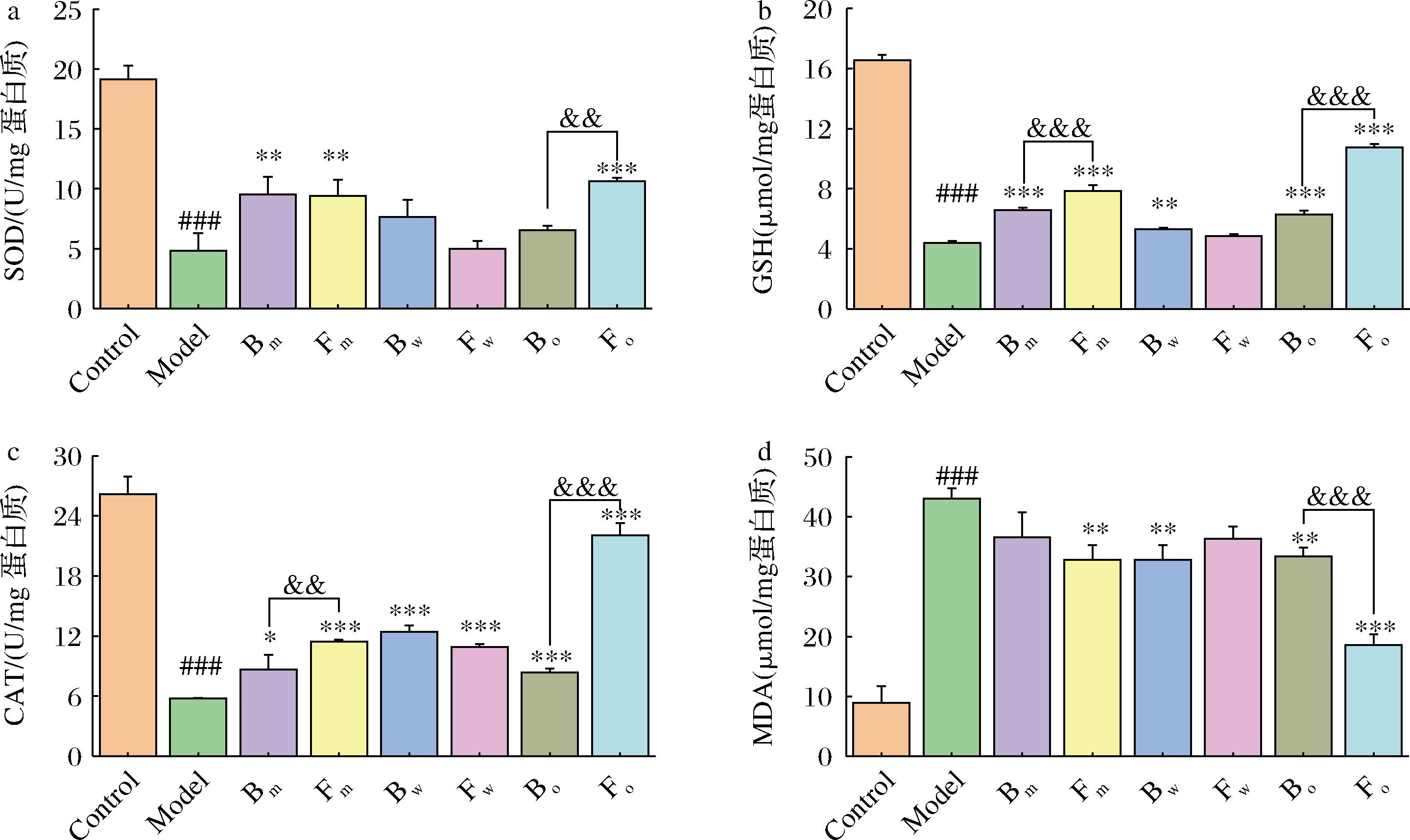
a-SOD;b-GSH;c-CAT;d-MDA
图4 FPN对HaCaT细胞氧化应激的影响
Fig.4 The impact of FPN in oxidative stress on HaCaT cells
注:与对照组相比,###表示P<0.001;与模型组相比,*表示P<0.05,**表示P<0.01,***表示P<0.001;与发酵前相比, &&表示P<0.01,&&&表示P<0.001。
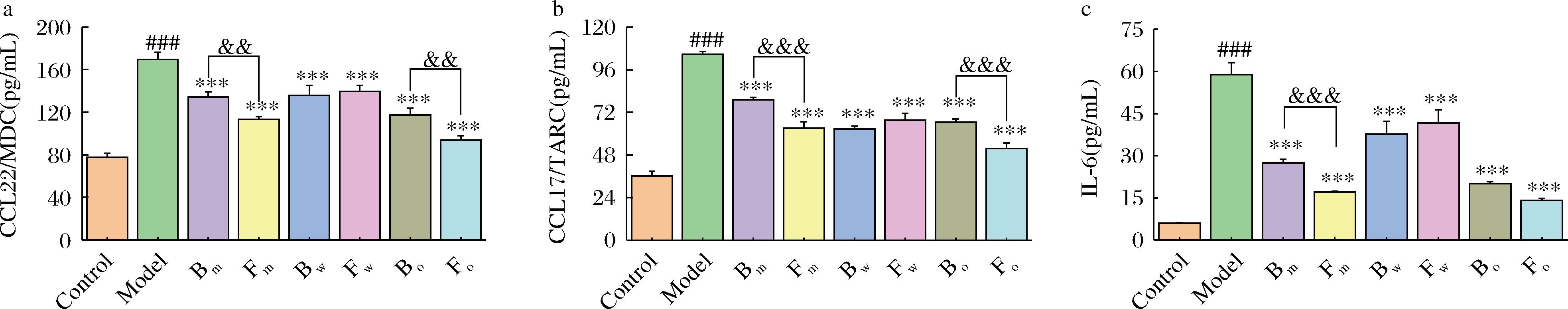
a-MDC;b-TARC;c-IL-6
图5 FPN对HaCaT细胞趋化和炎症因子水平的影响
Fig.5 The chemotaxis and inflammatory factor levels of FPN on HaCaT cell
注:与对照组相比,###表示P<0.001;与模型组相比,***表示P<0.001;与发酵前相比,&&表示P<0.01,&&&表示P<0.001。
2.4 FPN对TI诱导的HaCaT细胞趋化和炎症因子的影响
FPN对HaCaT细胞因子分泌的调控效果见图5。相较于对照组,TI刺激的HaCaT细胞中MDC、TARC和IL-6的分泌分别显著升高117%、190%和880%(P<0.001),表明TI刺激引发了HaCaT细胞中的炎症反应。在对MDC的分泌调控中,FPN样品组的MDC含量相比于模型组显著下降,Fm相比于Bm组显著下降16%,Fo相比与Bo显著下降20%(图5-a)。同样,与模型组相比,FPN样品使HaCaT细胞内的TARC释放显著减少。Fm相比于Bm组,TARC的含量显著下降20%,Fo相比与Bo组,TARC的含量显著下降22%(图5-b)。在炎症因子IL-6的分泌调控上,FPN样品组的分泌水平相比于模型组显著降低,Fm相比于Bm组,IL-6的含量显著降低38%(图5-c)。
3 结论
莲子心生物碱在肝脏中主要经过CYP2D1和CYP3A1的催化发生苄基和喹啉环上的去甲基化[17],然而在体外缺少相应的酶。本研究采用微生物发酵的方法,选用米曲霉作为发酵菌种,莲子心中的甲基莲心碱和异莲心碱被分解成分子量更小的生物碱。随后,对发酵培养基与发酵液进行处理及富集,将其应用于后续AD效果上的研究。
通过研究FPN对HaCaT细胞细胞活力的影响,观察到Fm相比与Bm表现出更低的细胞毒性,Fo的细胞毒性小于Bo,这表明经发酵产生的小分子生物碱具有更低的毒性。而Fw的毒性高于Bw。可能是在发酵过程中代谢产物的积累[18]所引起的。这一发现为理解生物碱对细胞的影响提供了重要线索,并为其在潜在应用中的安全性提供了支持。
TNF-α和IFN-γ协同作用下可诱导HaCaT细胞产生炎症因子(IL-6、IL-8和IL-1β)和趋化因子(TARC和MDC),因此TI刺激HaCaT细胞模型常被用作特应性皮炎的体外模型[19]。氧化应激和炎症相互依存[20],多数疾病的发生中伴随着炎症和氧化应激,例如AD[21]、心血管疾病[22]和糖尿病[23]等。此研究表明,FPN能有效缓解细胞的氧化应激损伤,同时抑制细胞炎症因子和趋化因子的释放,进而实现对细胞炎症的抑制效果,这表明米曲霉发酵液在治疗AD上具有潜在价值。而且FPN中的Fo表现出最佳的抑制效果,这表明发酵后含有小分子生物碱的组分具有优异的抗炎效果。同样,WENG等[24]也发现了类似的结论,armepavine可以通过抑制TNF-α引起的HSC-T6细胞中NF-κB通路活化而起到抗炎效果。
综上,本研究选择米曲霉进行莲子心发酵,成功实现了对其特征性生物碱成分的转化。同时建立了TNF-α/IFN-γ双炎症因子刺激的AD体外细胞模型,发现FPN均可以缓解细胞氧化应激和抑制细胞炎症,且含有小分子苄基异喹啉生物碱的Fo表现出更强的负调控作用。这一研究为中药发酵原料的产品开发提供了新思路,并为其在新剂型,新功效的多方面应用提供参考。
[1] QIN N, MIN Q, HU W.Review on the chemical constituents and bioactivities of Nelumbinis Plumula[J].Journal of Microwave Chemistry, 2018, 2:63-69.
[2] 国家药典委员会. 中华人民共和国药典[M]. 2020年版. 北京: 中国医药科技出版社, 2020. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People′s Republic of China[M]. 2020 ed. Beijing: China Medical Science Press, 2020.
[3] SUN H, SONG H Y, DENG X B, et al.Transcriptome-wide characterization of alkaloids and chlorophyll biosynthesis in lotus plumule[J].Frontiers in Plant Science, 2022, 13:885503.
[4] MENG X L, ZHENG L C, LIU J, et al.Inhibitory effects of three bisbenzylisoquinoline alkaloids on lipopolysaccharide-induced microglial activation[J].RSC Advances, 2017, 7(30):18347-18357.
[5] 蓝秋梅, 覃再嫩, 郑立.甲基莲心碱对脂多糖诱导大鼠软骨细胞炎症的保护作用研究[J].广西医科大学学报, 2020, 37(2):187-191. LAN Q M, QIN Z N, ZHENG L.Protective effect of neferine on lipopolysaccharide-induced chondrocyte inflammation in rats[J].Journal of Guangxi Medical University, 2020, 37(2):187-191.
[6] WANG H Y, YANG Y H, ZHANG X, et al.Liensinine attenuates inflammation and oxidative stress in spleen tissue in an LPS-induced mouse sepsis model[J].Journal of Zhejiang University-Science B, 2023, 24(2):185-190.
[7] YANG C C, HUNG Y L, KO W C, et al.Effect of neferine on DNCB-induced atopic dermatitis in HaCaT cells and BALB/c mice[J].International Journal of Molecular Sciences, 2021, 22(15):8237.
[8] 林敏婷, 张超, 唐思丽, 等.LC/MS/MS鉴定莲子心生物碱在Caco-2细胞中的代谢产物[J].中药材, 2015, 38(12):2531-2534. LIN M T, ZHANG C, TANG S L, et al.Metabolites identification for alkaloids from Nelumbinis Plumula in Caco-2 cells by LC/MS/MS[J].Journal of Chinese Medicinal Materials, 2015, 38(12):2531-2534.
[9] 韩栋年. 莲心总碱在大鼠体内代谢产物鉴定及药代动力学研究[D].沈阳:辽宁大学, 2018. HAN D N.Identification of metabolites and pharmacokinetics of total alkaloids of louts plumule in rats[D].Shenyang:Liaoning University, 2018.
[10] HUNAEFI D, RIEDEL H, AKUMO D N, et al.Effect of lactic acid bacteria fermentation on rosmarinic acid and antioxidant properties of in vitro shoot culture of Orthosiphon aristatus as a model study[J].Food Biotechnology, 2013, 27(2):152-177.
[11] 曹艺, 谭周进, 夏伯候, 等.10种微生物对含马兜铃酸A中药材的生物减毒研究[J].中国中药杂志, 2015, 40(10):1939-1944. CAO Y, TAN Z J, XIA B H, et al.Research on biological detoxification of Chinese medicine containing aristolochic acid A by ten microorganisms[J].China Journal of Chinese Materia Medica, 2015, 40(10):1939-1944.
[12] SHIU P H T, LI J J, ZHENG C W, et al.Amauroderma rugosum extract suppresses inflammatory responses in tumor necrosis factor alpha/interferon gamma-induced HaCaT keratinocytes[J].Molecules, 2022, 27(19):6533.
[13] ZHANG X Y, LIU Z J, XU B, et al.Neferine, an alkaloid ingredient in lotus seed embryo, inhibits proliferation of human osteosarcoma cells by promoting p38 MAPK-mediated p21 stabilization[J].European Journal of Pharmacology, 2012, 677(1-3):47-54.
[14] ZHOU M G, JIANG M, YING X H, et al.Identification and comparison of anti-inflammatory ingredients from different organs of lotus Nelumbo by UPLC/Q-TOF and PCA coupled with a NF-κB reporter gene assay[J].PLoS One, 2013, 8(11):e81971.
[15] MUKHERJEE P K, MUKHERJEE D, MAJI A K, et al.The sacred lotus (Nelumbo nucifera)-phytochemical and therapeutic profile[J].Journal of Pharmacy and Pharmacology, 2010, 61(4):407-422.
[16] TOMITA M, FURUKAWA H, YANG T H, et al.On the alkaloids of Nelumbo nucifera gaertn.VIII.studies on the alkaloids of loti embryo.(1).Structure of isoliensinine, a new biscoclaurine type alkaloid[J].Chemical &Pharmaceutical Bulletin, 1965, 13(1):39-43.
[17] 黄颖, 赵立波, 李帅, 等.甲基莲心碱在大鼠肝脏中的代谢产物及其途径[J].药学学报, 2007, 10:1034-1040. HUANG Y, ZHAO L B, LI S, et al.Metabolic products and pathway of neferine in rat liver [J].Acta Pharmaceutica Sinica, 2007, 10:1034-1040.
[18] 孙莉, 胡文康, 付彬, 等.米曲霉次生代谢产物真菌毒素研究进展[J].中国调味品, 2019, 44(1):169-172. SUN L, HU W K, FU B, et al.Research progress on mycotoxins of secondary metabolites of Aspergillus oryzae[J].China Condiment, 2019, 44(1):169-172.
[19] OH J H, KIM S H, KWON O K, et al.Purpurin suppresses atopic dermatitis via TNF-α/IFN-γ-induced inflammation in HaCaT cells[J].International Journal of Immunopathology and Pharmacology, 2022, 36:3946320221111135.
[20] LIU Q M, LYU H M, WEN Z M, et al.Isoliquiritigenin activates nuclear factor erythroid-2 related factor 2 to suppress the Nod-like receptor protein 3 inflammasome and inhibits the NF-κB pathway in macrophages and in acute lung injury[J].Frontiers in Immunology, 2017, 8:1518.
[21] BERTINO L, GUARNERI F, CANNAV S P, et al.Oxidative stress and atopic dermatitis[J].Antioxidants, 2020, 9(3):196.
S P, et al.Oxidative stress and atopic dermatitis[J].Antioxidants, 2020, 9(3):196.
[22] BROWN D I, GRIENDLING K K.Regulation of signal transduction by reactive oxygen species in the cardiovascular system[J].Circulation Research, 2015, 116(3):531-549.
[23] TANGVARASITTICHAI S.Oxidative stress, insulin resistance, dyslipidemia and type 2 diabetes mellitus[J].World Journal of Diabetes, 2015, 6(3):456-480.
[24] WENG T C, SHEN C C, CHIU Y T, et al.Inhibitory effects of armepavine against hepatic fibrosis in rats[J].Journal of Biomedical Science, 2009, 16(1):78.