传统上制作干酪所使用的凝乳酶主要从小牛或小羊等反刍动物的皱胃中提取。凝乳酶不仅能促使牛乳凝结,而且在干酪成熟中发挥重要作用[1]。随着干酪消费的不断增长,寻求不同来源凝乳酶满足干酪产业的发展已成为我国乳制品行业发展的新挑战[2]。通常大多数植物来源的凝乳酶被证明不适用于干酪的生产,这类凝乳酶因具有较强的蛋白水解能力而导致干酪产量下降,并在干酪成熟过程中产生苦味和质地缺陷[3];同时酶的生产可能受到植物栽培和气候变化等因素的限制。微生物来源的凝乳酶具有来源广泛、易于获得、生产成本低等优点,这使得微生物凝乳酶成为最具潜力的凝乳酶制剂[4]。
不同微生物来源凝乳酶的蛋白水解特性差异较大,其在干酪成熟过程中对乳蛋白的水解程度不同,导致干酪的品质特性不同[5]。ZHAO等[6]研究发现,与利用商业凝乳酶制作的切达干酪相比,利用从传统发酵米酒中分离出的微生物凝乳酶所制作的切达干酪水分含量更低,且在成熟60~90 d后干酪变得更柔软,挥发性化合物浓度更高。利用解淀粉芽孢杆菌GSBa-1凝乳酶制备切达干酪和马苏里拉干酪,其在干酪成熟过程中的适度蛋白水解,使干酪保持质构和功能特性[7]。用芽孢杆菌spp.P45凝乳酶生产的藜麦粉奶油干酪,具有高保水性[8]。微生物凝乳酶的蛋白水解活性不仅影响干酪的理化特性,而且通过酶解乳蛋白释放不同的生物活性肽[9]。MUSHTAQ等[10]研究发现使用细菌凝乳酶制作的干酪其抗氧化能力和金属离子螯合能力显著优于使用动物凝乳酶和植物凝乳酶制作的干酪,这与微生物凝乳酶水解蛋白释放的活性肽有关。
本研究前期从中国传统酒曲中筛选得到1株高产凝乳酶的细菌菌株,经鉴定命名为贝莱斯芽孢杆菌(Bacillus velezensis)YH-1(CGMCC No.25636),该菌株产的凝乳酶的比酶活为5 762.724 SU/mg,经LC-MS/MS鉴定,确定该酶为一种金属蛋白酶,该酶通过裂解κ-酪蛋白中Lys 21-Ile 22和Tyr 30-Val 31处的肽键导致牛乳凝固[11]。拟利用贝莱斯芽孢杆菌YH-1发酵制备的凝乳酶应用于切达干酪加工,研究干酪成熟过程中各项理化指标、游离氨基酸含量和挥发性风味物质等,以及干酪生物活性包括抗氧化活性、降血糖活性和金属螯合能力的变化,目的在于进一步研究不同微生物来源凝乳酶应用于干酪加工的潜力。
1 材料与方法
1.1 材料与试剂
新鲜牛奶(脂肪3.2%,蛋白质3.06%,乳糖4.33%),北京三胖奶牛场;商品发酵剂(R-704)和凝乳酶(Stamix 1150),科汉森有限公司;氯化钠和氯化钙均为食品级。
1.2 贝莱斯芽孢杆菌YH-1凝乳酶的制备
制备方法参考ZHAO等[12],略有修改。将贝莱斯芽孢杆菌YH-1在YPD培养基中30 ℃培养48 h,离心(10 000×g, 4 ℃, 30 min),收集上清液。在4 ℃条件下向粗酶液中缓慢加入(NH4)2SO4使其饱和度达到60%。在低温条件下(4 ℃)静置12 h后离心(10 000×g,30 min)取上清液,对上清液进行盐析处理,收集沉淀后用Tris-HCl缓冲液(50 mmol/L,pH=6.8)溶解,在4 ℃冰箱里透析48 h(透析袋8 000~14 000 Da),每8 h换一次水,冷冻干燥得到粗酶。将粗酶溶解于Tris-HCl缓冲液(50 mmol/L,pH=6.8)中,然后通过DEAE-FF阴离子交换柱纯化凝乳酶,上样量为5 mL,再用含NaCl的Tris-HCl缓冲液梯度洗脱(0~1 mol/L),流速为3 mL/min,最后收集具有高蛋白酶活性的馏分,经脱盐、超滤后制备纯化凝乳酶。
1.3 仪器与设备
干酪加工实验设备,自制;7090A-7000型气相色谱-质谱联用分析仪,美国Aglient公司;CR21GⅢ冷冻离心机,日本Hitachi公司;CT3型质构仪,美国Brookfield公司;Kjeltec8100型凯氏定氮仪,美国FOSS公司。
1.4 实验方法
1.4.1 切达干酪制作工艺
切达干酪制作参考WANG等[13]的方法,略有修改。利用同批次的生牛乳制作3组干酪,每组制作3个平行样品。分别使用混合酶[YH-1凝乳酶30%(质量分数)和商品酶70%(质量分数),干酪B]和YH-1凝乳酶(干酪C)制作的切达干酪作为实验组,以商品酶制作的干酪(干酪A)作为对照组。
工艺流程如下:
原料乳→巴氏杀菌(65 ℃,30 min)→32 ℃加入发酵剂(1.5%)→32 ℃发酵30 min→加入凝乳酶(10 000 SU/L)及CaCl2(0.005 g/100 mL)→32 ℃凝固45 min→切割,静置5 min,39 ℃排乳清(pH=6.1~6.2)→保持凝块温度在36 ℃,至pH=5.2~5.3,15 min翻一次面→入模挤压成型→盐水(20% NaCl)浸泡20 min→擦干表面水分,压模过夜→真空包装→4 ℃成熟12周
1.4.2 切达干酪理化指标
干酪得率计算方法如公式(1)所示:
干酪得率![]()
(1)
依据GB 5009.3—2016测定干酪水分含量;根据GB 5009.6—2016的方法测定干酪脂肪含量;根据AOAC 920.123 (2001) 凯氏定氮法测定干酪蛋白质含量;干酪盐含量参照邱婷等[14]方法测定。pH值测定方法如下:将6 g样品溶解在6 mL的温水中(45 ℃),孵育30 min后离心(6 000×g,10 min),去除脂肪,取下层溶液进行测定。
1.4.3 切达干酪微生物指标测定
将5 g干酪溶解在45 mL的无菌水中,磁力搅拌1 h后用无菌生理盐水梯度稀释,稀释后的样品溶液涂布在M17固体培养基上,培养48 h后进行计数。
1.4.4 pH 4.6可溶性氮与12%三氯乙酸(trichloroacetic acid,TCA)可溶性氮含量的测定
根据GUO等[15]方法,稍微改动。将20 g干酪溶解在40 mL的无菌水中,调节溶液pH至4.6后进行孵育(40 ℃,1 h),离心(6 000×g,10 min)后取出下层溶液,定容至100 mL,取出10 mL放入凯氏定氮消化管中测定样品的氮含量。
取上述pH 4.6可溶性氮溶液,加入10 mL的TCA(12%),混匀后室温静置1 h,离心(6 000×g,10 min)取10 mL溶液进行消化测定。
1.4.5 干酪质构的测定
用质构分析仪测定干酪样品的质构参数。测试前将样品在25 ℃下放置30 min。质地剖面分析(texture profile analysis,TPA)参数为:探头型号TA3/100,下降速度5.0 mm/s,测试速度1.0 mm/s,形变百分量50%,触发力0.2 N,间隔时间0 s。
1.4.6 干酪挥发性风味物质的测定
参照王亚东等[16]方法。用GC-MS法测定干酪风味。将5 g磨碎后的干酪加到30 mL萃取瓶中,在50 ℃的水浴锅中平衡20 min,固相微萃取40 ℃吸附40 min后插入进样口解析(250 ℃,10 min)。
1.4.7 干酪游离氨基酸含量的测定
依据ZHAO等[6]方法处理样品:在样品中加入800 μL乙腈水(体积分数为50%),振荡后超声30 min再静置60 min,离心(12 000×g,10 min)取上清液过0.22 μmol/L滤膜后上机检测和用50%乙腈水稀释50倍上机检测。
UPLC-Qtrap-MS方法:色谱柱 (BEH Amide Column, 1.7 μm, 2.1 mm×100 mm)柱温40 ℃,流速0.25 mL/min;流动相:A-水(0.1%甲酸),B-乙腈(0.1%甲酸);运行12 min,进样4 μL。
质谱条件:ESI离子源;气帘气35 arb;碰撞气7 arb;离子喷雾电压4 500 V;离子源温度450 ℃;离子源气体55 arb;离子源气体55 arb。
1.4.8 干酪生物活性的测定
1.4.8.1 对α-葡萄糖苷酶的抑制作用
参照AYYASH等[17]方法,制备不同成熟期干酪的多肽样品(按上述1.4.4节方法得到的pH 4.6可溶性蛋白溶液,过0.22 μm滤膜)测试多肽样品对α-葡萄糖苷酶的抑制率。
1.4.8.2 抗氧化活性的测定
分别对干酪不同成熟阶段取样制备的多肽样品测定其DPPH自由基清除率和ABTS阳离子自由基清除能力。
DPPH自由基清除率参考FAN等[18]方法。
采用ABTS测定试剂盒测定多肽样品对ABTS阳离子自由基的清除能力,ABTS阳离子自由基吸光度测定波长为734 nm或405 nm。
1.4.8.3 金属铁离子螯合能力的测定
按MIAO等[19]方法将样品溶解于pH 6.5的乙酸-乙酸钠缓冲液,取250 μL样品,加入25 mmol/L的硫酸亚铁溶液20 μL,37 ℃水浴30 min,取出后加入2.5 mmol/L 的菲啰嗪溶液15 μL 进行混合,10 000 r/min离心10 min,于562 nm处测定其吸光度。用无离子水作为空白对照。铁离子的螯合能力计算如公式(2)所示:
铁离子螯合能力![]()
(2)
式中:B0为对照组的吸光度(使用水代替样品);B1为样品的吸光度。
1.5 数据处理
每个干酪样品至少3次平行实验,结果用x±s表示,采用方差分析检验各样本间的显著性差异,P<0.05,差异显著,采用Origin 2020作图。
2 结果与分析
2.1 干酪的理化指标
由表1可知,干酪A和干酪B的得率、总蛋白含量以及氯化钠含量之间没有显著差别(P>0.05),而干酪C的得率和脂肪含量略低于干酪A,蛋白质含量高于干酪A,这可能是由于YH-1凝乳酶水解蛋白质后,蛋白网络被破坏,部分脂肪流失,干酪的得率也随之下降[20]。
表1 切达干酪的得率及主要组成成分比较
Table 1 Comparison of the yield and main components of Cheddar cheeses
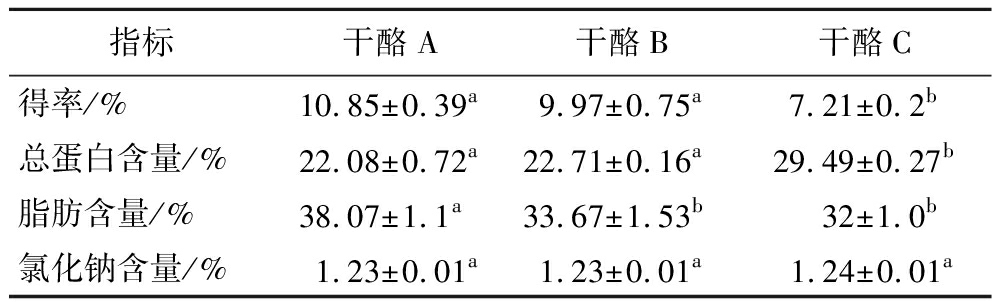
指标干酪A干酪B干酪C得率/%10.85±0.39a9.97±0.75a7.21±0.2b总蛋白含量/%22.08±0.72a22.71±0.16a29.49±0.27b脂肪含量/%38.07±1.1a33.67±1.53b 32±1.0b氯化钠含量/%1.23±0.01a1.23±0.01a 1.24±0.01a
注:同行字母不同表示差异显著(P<0.05)。
2.2 切达干酪成熟过程中的pH、水分及微生物变化
如图1-A可知,在成熟期间干酪整体的pH值呈下降趋势,这可能是由于贮藏期内干酪中酪蛋白水解产生大量游离的氨基和羧基,导致质子释放到周围的介质中,使pH值降低。另外,成熟期间脂肪分解所产生的游离脂肪酸同样会使干酪pH值降低[21]。干酪C的pH值始终低于干酪A和干酪B,可能是因为YH-1凝乳酶的蛋白水解作用可以增强干酪中乳酸菌的代谢活动,其产酸能力增加。如图1-B可知,干酪C的水分含量在成熟期内显著低于(P<0.05)干酪A和干酪B。在成熟前期,3组干酪的水分含量有上升的趋势,且在第8周水分含量最高,可能是因为干酪中残留的蛋白酶破坏了蛋白质的网状结构,使干酪中的弱结合水转变为游离水[22]。由于干酪C的pH较低且接近酪蛋白的等电点,这促进了干酪中蛋白质与蛋白质的相互作用,进一步使蛋白质基质的持水能力降低,从而导致奶酪的水分含量下降[23]。图1-C结果表明,3组干酪的活菌数均呈先上升后下降的趋势。前3周乳酸菌数量明显增加,这可能是由于干酪中的乳酸菌在干酪成熟初期可以利用乳糖进行生长繁殖。在干酪成熟后期,B组的活菌数显著高于(P<0.05)A组和C组,可能是因为混合凝乳酶的水解产物更有利于乳酸菌的生长。
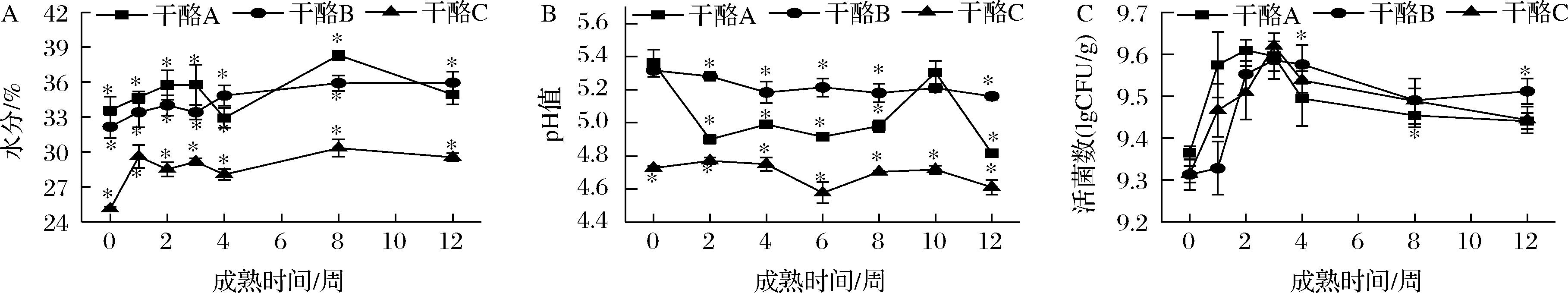
A-pH值;B-水分含量;C-活菌数
图1 切达干酪成熟过程中pH值、水分含量和活菌数变化
Fig.1 Changes of pH, moisture content, and viable bacterial count in Cheddar cheeses during ripening
注:*表示同一时间差异显著(P<0.05)(下同)。
2.3 pH 4.6可溶性氮及12%TCA可溶性氮的变化
干酪蛋白的初级水解可以用pH 4.6可溶性氮质量分数来表示,pH 4.6可溶性氮含量越高,表明实验干酪的初级蛋白水解水平较高[24]。由图2-A可知,在成熟期间,所有实验组干酪的pH 4.6可溶性氮含量总体呈上升趋势,在第8周时,干酪C的pH 4.6可溶性氮含量开始迅速增加,显著高于(P<0.05)干酪A和干酪B。在第12周,干酪A、干酪B和干酪C的pH 4.6可溶性氮质量分数分别为24.8%、23.45%和25.9%。该结果表明YH-1凝乳酶对切达干酪乳蛋白的分解能力较强。12%TCA可溶性氮反映干酪蛋白的二次水解,可代表游离氨基酸和小分子肽(2~20个残基)的含量[25]。另外,12%TCA可溶性氮的增加与凝乳酶水解蛋白能力有关,凝乳酶水解蛋白能力越高,干酪在成熟过程中会产生更多的12%TCA可溶性氮[26]。3组干酪的12%TCA可溶性氮在0~12周呈上升趋势,干酪A由3.45%上升至7.15%,干酪B由3.4%上升至7.8%,干酪C由3.65%上升至7.2%,且在第12周B组干酪的12%TCA可溶性氮含量显著高于(P<0.05)A组和C组。该结果表明混合凝乳酶对干酪的蛋白水解作用产生更多的游离氨基酸和小分子肽。

A-pH 4.6可溶性氮;B-12%TCA可溶性氮
图2 切达干酪成熟过程中pH 4.6可溶性氮和12%TCA 可溶性氮含量变化
Fig.2 Changes of the contents of pH 4.6-soluble nitrogen and 12%TCA-soluble nitrogen in Cheddar cheeses during ripening
2.4 切达干酪成熟过程中质构的变化
在成熟期间,干酪C的硬度、弹性、咀嚼性和胶着性总体上低于干酪A和干酪B,且在整个成熟期内干酪C的硬度都显著高于(P<0.05)干酪A和干酪B,可能是因为干酪C脂肪和水分含量较低造成的(见表1)。LI等[27]研究发现低脂干酪的硬度、胶黏度和咀嚼性高于全脂干酪,因为脂肪可以作为一种柔软的填充物镶嵌入酪蛋白网络中[28]。在成熟过程中,由于酪蛋白的不断水解,3组干酪的硬度、咀嚼性和胶着性呈现下降趋势(图3)。由于干酪中蛋白酶的作用,干酪中总酪蛋白组分和酪蛋白单体组分(αs1-酪蛋白、β-酪蛋白和αs2-酪蛋白)含量不断下降,酪蛋白网络结构坍塌,干酪的硬度、内聚性与弹性随之降低。通过相关性分析发现随着酪蛋白和大片段肽键的断裂,蛋白质网络结构逐渐减弱,质构特性也随之改变,其质构特性与可溶性肽和完整酪蛋白随时间的变化趋势相似[29]。另外,实验结果表明混合凝乳酶干酪的质构特性与商品凝乳酶干酪没有显著性差异(P>0.05)。
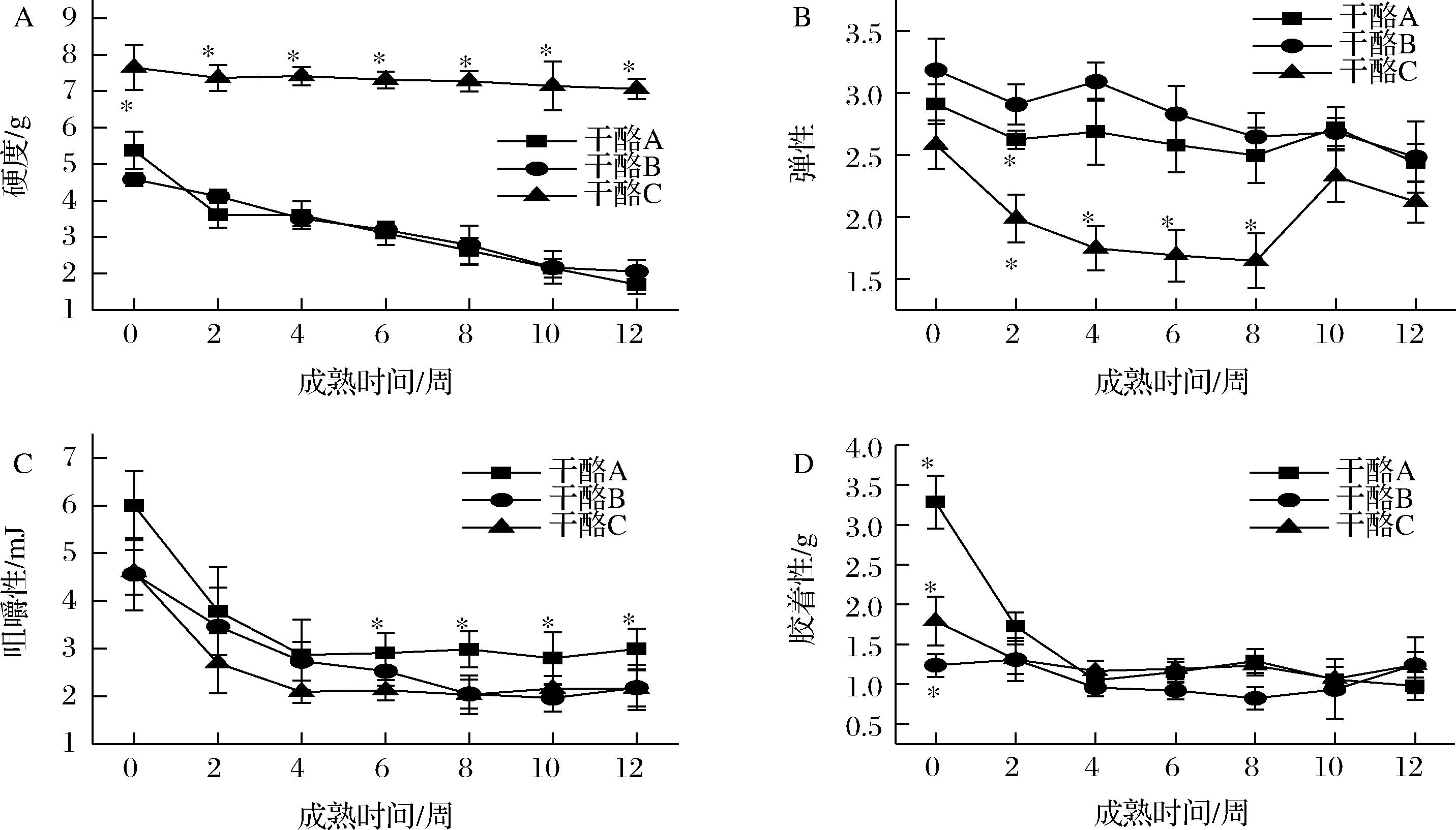
A-硬度;B-弹性;C-咀嚼性;D-胶着性
图3 切达干酪成熟过程中硬度、弹性、咀嚼性和胶着性的变化
Fig.3 Changes of hardness, springiness, cohesiveness, chewiness, and gumminess of Cheddar cheeses during ripening
2.5 游离氨基酸含量的变化
在干酪成熟过程中,游离氨基酸含量与残留凝乳酶的活性有关。残留的凝乳酶会继续水解干酪中的酪蛋白,产生小分子的肽,并进一步水解生成氨基酸。从表2可知,成熟12周干酪的游离氨基酸含量均高于新鲜干酪,说明干酪在成熟过程中蛋白质深度水解作用加强。3组干酪中,干酪B中的游离氨基酸含量相对较高,其次是干酪C,干酪A中的相对较少。在8种人体必需氨基酸中,干酪B的缬氨酸、亮氨酸、赖氨酸、组氨酸、苯丙氨酸的含量最多,干酪C的苏氨酸、甲硫氨酸、色氨酸和异亮氨酸含量最多;在一些非必需氨基酸中,干酪B的脯氨酸、酪氨酸和谷氨酸含量最多,干酪C的丝氨酸、丙氨酸和天门冬氨酸含量最多。实验结果表明,用YH-1凝乳酶和混合凝乳酶制成的干酪,相比于对照组能产生更多的游离氨基酸。游离氨基酸对干酪的滋味和香味都有促进作用[30]。
表2 切达干酪成熟过程中游离氨基酸的变化 单位:ng/mg
Table 2 Changes of free amino acids in Cheddar cheeses during ripening
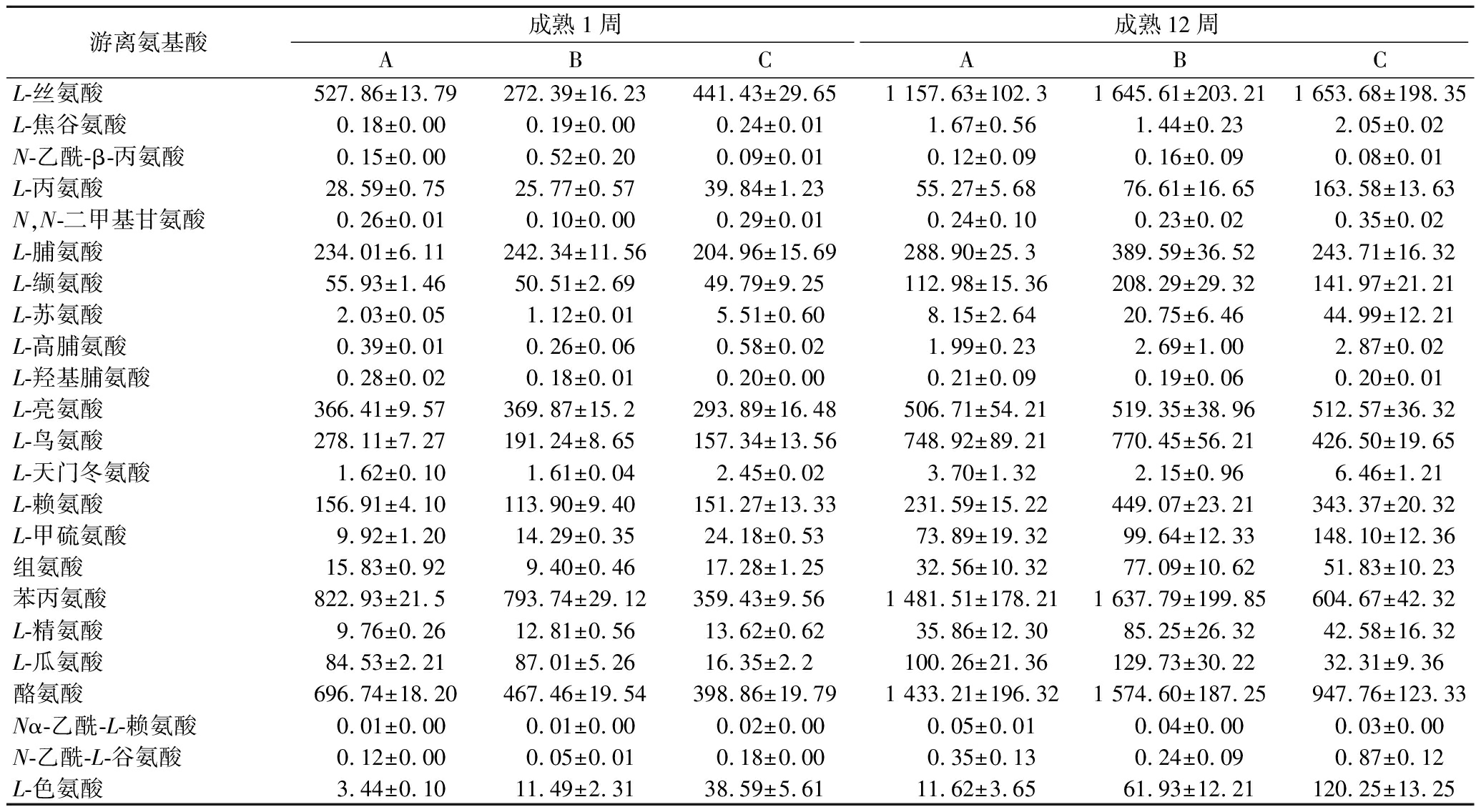
游离氨基酸成熟1周成熟12周ABCABCL-丝氨酸527.86±13.79272.39±16.23441.43±29.651 157.63±102.31 645.61±203.211 653.68±198.35L-焦谷氨酸0.18±0.000.19±0.000.24±0.011.67±0.561.44±0.232.05±0.02N-乙酰-β-丙氨酸0.15±0.000.52±0.200.09±0.010.12±0.090.16±0.090.08±0.01L-丙氨酸28.59±0.7525.77±0.5739.84±1.2355.27±5.6876.61±16.65163.58±13.63N,N-二甲基甘氨酸0.26±0.010.10±0.000.29±0.010.24±0.100.23±0.020.35±0.02L-脯氨酸234.01±6.11242.34±11.56204.96±15.69288.90±25.3389.59±36.52243.71±16.32L-缬氨酸55.93±1.4650.51±2.6949.79±9.25112.98±15.36208.29±29.32141.97±21.21L-苏氨酸2.03±0.051.12±0.015.51±0.608.15±2.6420.75±6.4644.99±12.21L-高脯氨酸0.39±0.010.26±0.060.58±0.021.99±0.232.69±1.002.87±0.02L-羟基脯氨酸0.28±0.020.18±0.010.20±0.000.21±0.090.19±0.060.20±0.01L-亮氨酸366.41±9.57369.87±15.2293.89±16.48506.71±54.21519.35±38.96512.57±36.32L-鸟氨酸278.11±7.27191.24±8.65157.34±13.56748.92±89.21770.45±56.21426.50±19.65L-天门冬氨酸1.62±0.101.61±0.042.45±0.023.70±1.322.15±0.966.46±1.21L-赖氨酸156.91±4.10113.90±9.40151.27±13.33231.59±15.22449.07±23.21343.37±20.32L-甲硫氨酸9.92±1.2014.29±0.3524.18±0.5373.89±19.3299.64±12.33148.10±12.36组氨酸15.83±0.929.40±0.4617.28±1.2532.56±10.3277.09±10.6251.83±10.23苯丙氨酸822.93±21.5793.74±29.12359.43±9.561 481.51±178.211 637.79±199.85604.67±42.32L-精氨酸9.76±0.2612.81±0.5613.62±0.6235.86±12.3085.25±26.3242.58±16.32L-瓜氨酸84.53±2.2187.01±5.2616.35±2.2100.26±21.36129.73±30.2232.31±9.36酪氨酸696.74±18.20467.46±19.54398.86±19.791 433.21±196.321 574.60±187.25947.76±123.33Nα-乙酰-L-赖氨酸0.01±0.000.01±0.000.02±0.000.05±0.010.04±0.000.03±0.00N-乙酰-L-谷氨酸0.12±0.000.05±0.010.18±0.000.35±0.130.24±0.090.87±0.12L-色氨酸3.44±0.1011.49±2.3138.59±5.6111.62±3.6561.93±12.21120.25±13.25
2.6 切达干酪成熟前后的风味变化
对3组切达干酪不同成熟时期的挥发性风味物质进行了SPME-GC-MS分析。3组干酪共检测出39种风味物质,其中11种醇类、6种酮类、12种酸类、4种酯类、其他类6种。随着成熟期的延长,风味化合物种类无明显差别,附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.036210)显示了3组干酪在1、4、8、12周时挥发性风味物质质量比的变化。
醇类化合物是组成干酪中风味物质的重要成员,主要通过氨基酸代谢、甲基酮还原、乳糖代谢和亚油酸、亚麻酸降解等生化反应生成[31]。其中乙醇是3组干酪醇类风味物质的主要成分,3组干酪在成熟期内的乙醇含量呈现略微减少的趋势,可能是由于贮存期内干酪中发生醇解和酯化反应,降低了乙醇的含量[32]。RICHOUX等[33]研究发现,乙醇限制了瑞士奶酪中乙酯的合成,在干酪中添加400 μg/g的乙醇后,乙醇与奶酪中的酸类物质发生酯化反应,生成乙酯等风味物质,证明了乙醇在干酪中含量的降低有利于其风味物质的增加。
酮类化合物的感知阈值低,可赋予干酪水果香味、花香味和霉味,主要通过多不饱和脂肪酸氧化、热降解、氨基酸降解和微生物代谢产生[34]。3组干酪中均检出3-羟基-2-丁酮、2-庚酮、2-壬酮、2-十一酮、2-十三酮和2,3-丁二酮。其中3-羟基-2-丁酮由柠檬酸代谢生成,赋予干酪奶油香味,在整个成熟期间的含量:B干酪>C干酪>A干酪;由干酪中乳酸菌代谢生成的2-壬酮赋予了干酪水果味;由亚油酸氧化后生成的2-壬酮使干酪具有奶油味和桃香味等[16]。
脂肪酸类化合物不仅是干酪中主要的风味物质,也是酯类、醛类和甲基酮类等其他风味物质的前体物质,因此对干酪的风味的形成有着重要的作用[31]。其中辛酸、己酸、乙酸和癸酸在3组干酪中含量较高,这些短链的脂肪酸类化合物阈值较低,在较高的浓度情况下会产生令人不悦的风味,如酸败、哈喇等味道[35]。第4、8、12周,干酪B和C的乙酸、丁酸和辛酸的含量均高于干酪A,说明混合凝乳酶对于干酪酸类风味化合物的贡献较大。
酯类化合物是奶酪中常见的挥发性化合物,赋予干酪令人愉快的水果味,其风味可以降低因游离脂肪酸含量较高而产生的腐臭气味。酯类化合物可以通过不同的反应形成,包括酯化反应和酯交换[32]。成熟过程中,3组干酪酯类化合物检出含量较低,其中干酪B和C中共检出4种酯类,干酪A中检测出3种酯类。干酪A在第0周时酯类物质含量较高,随着成熟期的延长,干酪B和C的含量均高于干酪A。
2.7 干酪成熟过程中挥发性风味物质的聚类分析
对不同凝乳酶干酪不同成熟期挥发性风味物质的含量变化进行热图分析,如图4所示。不同凝乳酶制作的干酪风味物质存在差异。第1周的干酪A未和其他组别的干酪归为一类,说明成熟初期干酪A的风味物质与其他干酪差别较大。随着成熟时间的延长,干酪A(成熟4、8和12周)与干酪B(成熟1周)可聚为一类;成熟1、4和8周的干酪C可聚为一类;干酪B(成熟4、8和12周)与干酪C(成熟12周)可聚为一类。结果表明,分别用YH-1凝乳酶与商业凝乳酶所制作的切达干酪在风味成分上存在差异,而用2种混合凝乳酶所制作的干酪B在不同成熟时期可以分别与干酪A与干酪C聚类,说明YH-1凝乳酶有着部分代替商业凝乳酶制作切达干酪的潜力。
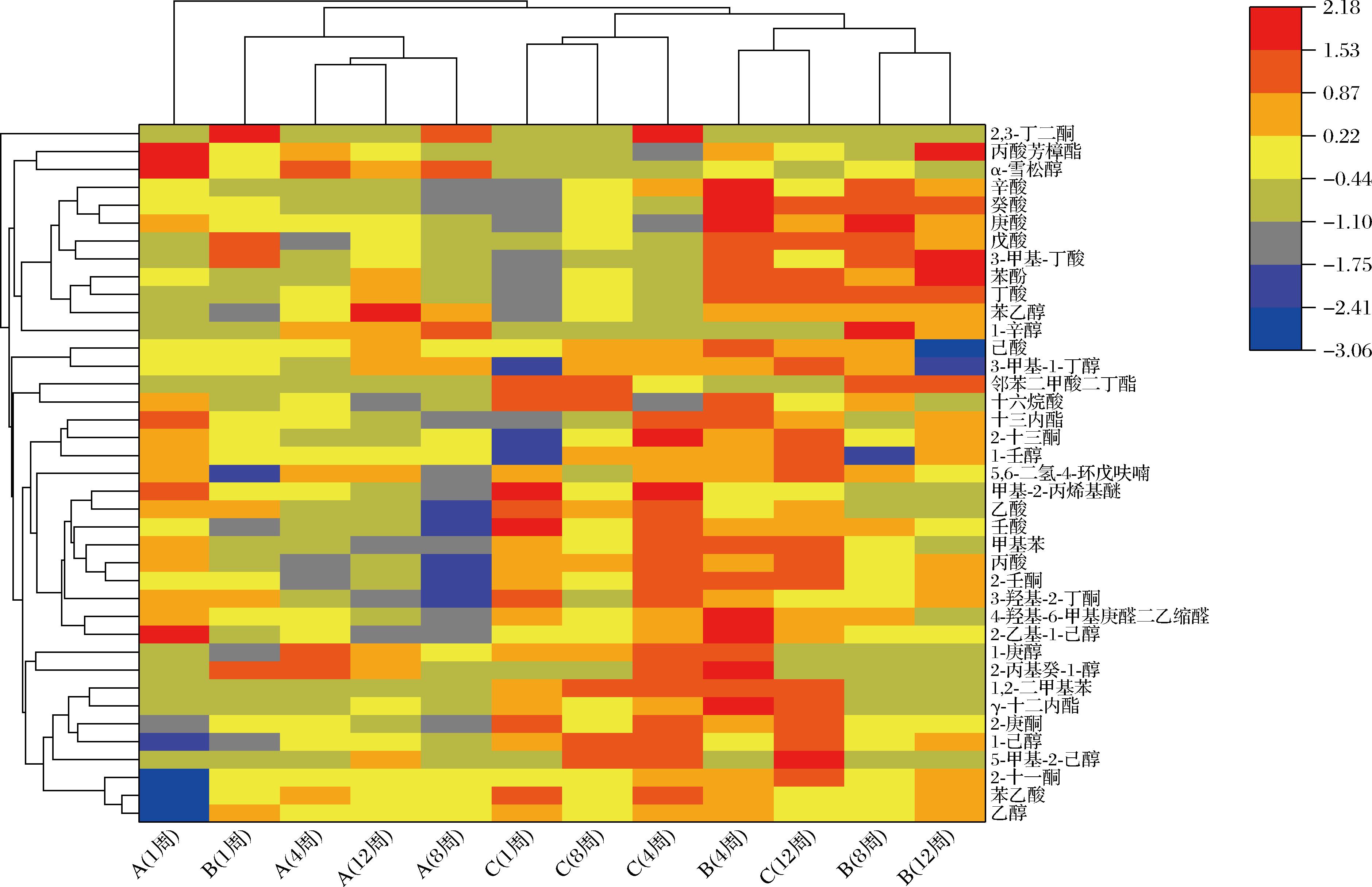
图4 切达干酪成熟过程中风味物质的热图分析
Fig.4 Heat map analysis of flavor substances in Cheddar cheeses during ripening
2.8 切达干酪成熟过程中生物活性的变化
3组干酪在成熟过程中生物活性的变化如图5所示。对α-葡萄糖苷酶活性的抑制作用归因于蛋白酶水解产生的生物活性肽,抑制α-葡萄糖苷酶被认为是通过减少碳水化合物水解来控制糖尿病的有效方法[36]。α-葡萄糖苷酶的抑制率(图5-A)随着成熟期的延长而逐渐升高,抑制率逐渐上升至60%以上,3组干酪的变化趋势一致,无显著性差别(P>0.05),由此说明YH-1凝乳酶不会影响干酪的降血糖活性。
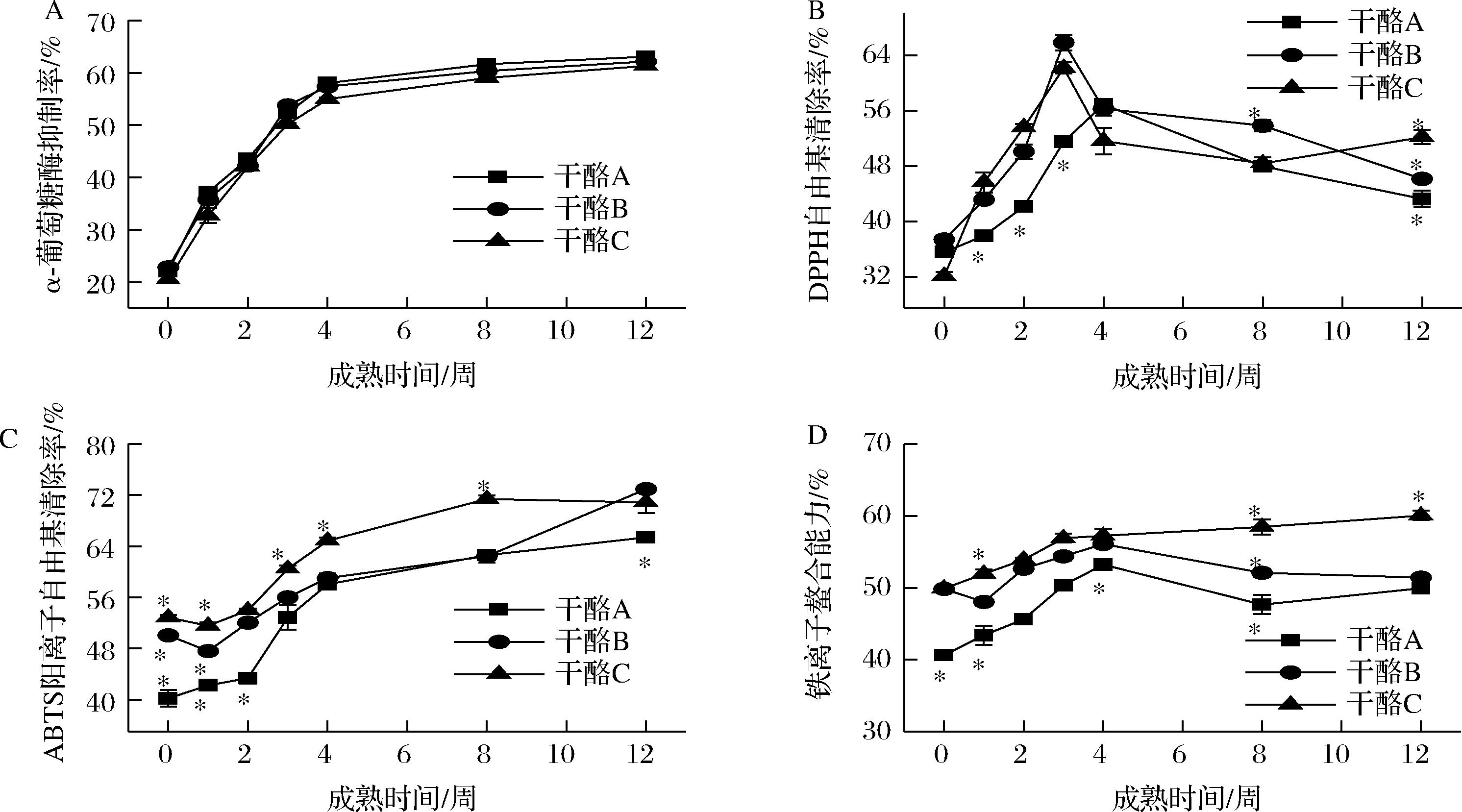
图5 切达干酪成熟过程中的生物活性变化
Fig.5 Bioactivity changes of Cheddar cheeses during ripening
干酪B和C的DPPH自由基清除率(图5-B)在第3周达到最大,分别为65.78%和62.12%,之后有所下降,干酪A在第四周达到最大,为56.86%,然后开始下降;3组干酪的ABTS阳离子自由基清除率(图5-C)均处于上升趋势,干酪C的ABTS阳离子自由基清除率在前8周显著高于(P<0.05)A组,在第8周达到最大,为71.39%,A、B两组在第12周达到最大,分别为65.36%和72.91%,说明干酪的成熟期以及不同的凝乳酶都会影响干酪的抗氧化活性,且YH-1凝乳酶组和混合凝乳酶组干酪的抗氧化活性优于商品酶组干酪。AYYASH等[17]研究了用牛奶和骆驼奶所制的干酪在成熟期间抗氧化活性的变化,发现在干酪在成熟第28天时,干酪的DPPH自由基清除率和ABTS阳离子自由基清除率显著增加。赵笑等[7]研究发现对于DPPH自由基和ABTS阳离子自由基的清除率,细菌凝乳酶制作的干酪显著优于对照组干酪,尤其是在干酪成熟的第4~8周,DPPH自由基和ABTS阳离子自由基的清除率最高分别为16.49%和78.38%。
干酪成熟过程中产生的多肽或氨基酸通过螯合作用,能够提高铁的生物利用率和吸收率[19]。如图5-D所示,干酪A和B的铁离子螯合能力均在第4周达到最大,分别为53.24%和56.11%,干酪C则在第12周达到最大,显著高于(P<0.05)干酪A和干酪B,为60.06%。TIMON等[37]发现用微生物蛋白酶制作的干酪的抗氧化能力和金属螯合能力显著高于用动、植物蛋白酶制作的干酪,这与本实验的结果相似。因此,用YH-1凝乳酶制作的切达干酪能有效地提高干酪的抗氧化能力和铁离子螯合能力。
3 结论
本研究利用贝莱斯芽孢杆菌YH-1凝乳酶及其部分代替商品凝乳酶制备切达干酪,比较了添加不同凝乳酶切达干酪的成熟特性及生物活性的差异。结果表明,与商品凝乳酶制备的干酪相比,利用YH-1凝乳酶制备的切达干酪具有更高的蛋白含量、更低的水分含量和pH值,干酪硬度增加。YH-1凝乳酶对切达干酪具有更强的蛋白水解作用,使干酪成熟过程中产生更多的游离氨基酸和挥发性风味物质,并且可以提高干酪抗氧化和螯合铁离子的生物活性。此外,在成熟期内,混合凝乳酶干酪与商品凝乳酶干酪在理化和质构指标上相似,但前者游离氨基酸和挥发性风味物质以及生物活性更高。因此,为改善切达干酪的品质特性,同时提高干酪的挥发性风味物质含量和生物活性,可使用贝莱斯芽孢杆菌YH-1凝乳酶部分代替商品凝乳酶生产切达干酪。本研究为微生物凝乳酶在切达干酪中的应用提供了技术依据。
[1] TABET R, MECHAI A, BRANES Z, et al.Effect of vegetable coagulant and lamb rennet on physicochemical composition, fatty acid profile and lipid quality indices of a traditional fresh cheese (Jben)[J].Biocatalysis and Agricultural Biotechnology, 2023, 47:102609.
[2] LIU X F, WU Y F, GUAN R F, et al.Advances in research on calf rennet substitutes and their effects on cheese quality[J].Food Research International, 2021, 149:110704.
[3] SALEHI M, AGHAMAALI M R, SAJEDI R H, et al.Purification and characterization of a milk-clotting aspartic protease from Withania coagulans fruit[J].International Journal of Biological Macromolecules, 2017, 98:847-854.
[4] WEHAIDY H R, ABDEL-NABY M A, SHOUSHA W G, et al.Improving the catalytic, kinetic and thermodynamic properties of Bacillus subtilis KU710517 milk clotting enzyme via conjugation with polyethylene glycol[J].International Journal of Biological Macromolecules, 2018, 111:296-301.
[5] WEHAIDY H R, ABDEL WAHAB W A, KHOLIF A M M, et al.Statistical optimization of B.subtilis MK775302 milk clotting enzyme production using agro-industrial residues, enzyme characterization and application in cheese manufacture[J].Biocatalysis and Agricultural Biotechnology, 2020, 25:101589.
[6] ZHAO X, ZHENG Z, ZHANG J, et al.Change of proteolysis and sensory profile during ripening of Cheddar-style cheese as influenced by a microbial rennet from rice wine[J].Food Science and Nutrition, 2019, 7(4):1540-1550.
[7] 赵笑, 蔡淼, 杨智杰, 等.解淀粉芽孢杆菌GSBa-1凝乳酶对切达干酪成熟过程中蛋白水解及生物活性的影响[J].食品科学, 2020, 41(22):103-111. ZHAO X, CAI M, YANG Z J, et al.Proteolysis and bioactivity of Cheddar cheese as in uenced by milk-clotting enzyme from Bacillus amyloliquefaciens GSBa-1[J].Food Science, 2020, 41(22):103-111.
uenced by milk-clotting enzyme from Bacillus amyloliquefaciens GSBa-1[J].Food Science, 2020, 41(22):103-111.
[8] LEMES A C, PAV N Y, LAZZARONI S, et al.A new milk-clotting enzyme produced by Bacillus sp.P45 applied in cream cheese development[J].LWT-Food Science and Technology, 2016, 66:217-224.
N Y, LAZZARONI S, et al.A new milk-clotting enzyme produced by Bacillus sp.P45 applied in cream cheese development[J].LWT-Food Science and Technology, 2016, 66:217-224.
[9] BIELECKA M, CICHOSZ G, CZECZOT H.Antioxidant, antimicrobial and anticarcinogenic activities of bovine milk proteins and their hydrolysates-A review[J].International Dairy Journal, 2022, 127:105208.
[10] MUSHTAQ M, GANI A, MASOODI F A, et al.Himalayan cheese (Kalari/Kradi)-Effect of different probiotic strains on oxidative stability, microbiological, sensory and nutraceutical properties during storage[J].LWT-Food Science and Technology, 2016, 67:74-81.
[11] 王艺会. 贝莱斯芽孢杆菌凝乳酶的酶学表征及对干酪成熟特性的影响 [D].北京:北京工商大学, 2023. WANG Yihui.Enzymatic characterization of milk-clotting enzyme from Bacillus velezensis and its effect on cheese maturation characteristics [D].Beijing:Beijing Technology and Business University, 2023.
[12] ZHAO X, CAI M, YANG Z J, et al.Purification and characterization of a novel milk-clotting enzyme produced by Bacillus amyloliquefaciens GSBa-1[J].European Food Research and Technology, 2019, 245(11):2447-2457.
[13] WANG J, WU T, FANG X B, et al.Manufacture of low-fat Cheddar cheese by exopolysaccharide-producing Lactobacillus plantarum JLK0142 and its functional properties[J].Journal of Dairy Science, 2019, 102(5):3825-3838.
[14] 邱婷, 张忠明, 张卫兵, 等.原料乳冷藏时间对牦牛乳硬质干酪理化指标的影响[J].食品与发酵工业, 2023, 49(2):146-151. QIU T, ZHANG Z M, ZHANG W B, et al.Effects of cold storage time of raw milk on physical and chemical indexes of yak milk hard cheese[J].Food and Fermentation Industries, 2023, 49(2):146-151.
[15] GUO M Y, SHENG Z Y, WANG P J, et al.Effects of refrigerated storage on the functional properties of processed cheese analogue with stretchability and its mechanisms[J].International Dairy Journal, 2023, 137, 105504.
[16] 王亚东, 韩颢颖, 韩兆盛, 等.新鲜乳扇贮存期间关键香气组分变化分析[J].食品科学, 2022, 43(24):202-209. WANG Y D, HAN H Y, HAN Z S, et al.Changes in key aroma components of fresh milk fan during storage[J].Food Science, 2022, 43(24):202-209.
[17] AYYASH M, ABDALLA A, ALAMERI M, et al.Biological activities of the bioaccessible compounds after in vitro digestion of low-fat Akawi cheese made from blends of bovine and camel milk[J].Journal of Dairy Science, 2021, 104(9):9450-9464.
[18] FAN Y T, YI J, ZHANG Y Z, et al.Physicochemical stability and in vitro bioaccessibility of β-carotene nanoemulsions stabilized with whey protein-dextran conjugates[J].Food Hydrocolloids, 2017, 63:256-264.
[19] MIAO J Y, LIAO W W, PAN Z Y, et al.Isolation and identification of iron-chelating peptides from casein hydrolysates[J].Food &Function, 2019, 10(5):2372-2381.
[20] JOHNSON M E, CHEN C M, JAEGGI J J.Effect of rennet coagulation time on composition, yield, and quality of reduced-fat cheddar cheese[J].Journal of Dairy Science, 2001, 84(5):1027-1033.
[21] SMITH J R, HINDMARSH J P, CARR A J, et al.Molecular drivers of structural development in Mozzarella cheese[J].Journal of Food Engineering, 2017, 214:257-265.
[22] MØLLER K K, RATTRAY F P, HØIER E, et al.Manufacture and biochemical characteristics during ripening of Cheddar cheese with variable NaCl and equal moisture content[J].Dairy Science &Technology, 2012, 92(5):515-540.
[23] PASTORINO A J, HANSEN C L, MCMAHON D J.Effect of pH on the chemical composition and structure-function relationships of cheddar cheese[J].Journal of Dairy Science, 2003, 86(9):2751-2760.
[24] MCCARTHY C M, WILKINSON M G, GUINEE T P.Effect of coagulant type and level on the properties of half-salt, half-fat Cheddar cheese made with or without adjunct starter:Improving texture and functionality[J].International Dairy Journal, 2017, 75:30-40.
[25] ZHANG X X, HAO X Y, WANG H X, et al.The effects of Lactobacillus plantarum combined with inulin on the physicochemical properties and sensory acceptance of low-fat Cheddar cheese during ripening[J].International Dairy Journal, 2021, 115:104947.
[26] DUAN C C, LI S Y, ZHAO Z J, et al.Proteolytic activity of Lactobacillus plantarum strains in Cheddar cheese as adjunct cultures[J].Journal of Food Protection, 2019, 82(12):2108-2118.
[27] LI H J, YU H M, LIU Y, et al.The use of of inulin, maltitol and lecithin as fat replacers and plasticizers in a model reduced-fat mozzarella cheese-like product[J].Journal of the Science of Food and Agriculture, 2019, 99(12):5 586-5 593.
[28] WANG W Z, JIA R, HUI Y Y, et al.Utilization of two plant polysaccharides to improve fresh goat milk cheese:Texture, rheological properties, and microstructure characterization[J].Journal of Dairy Science, 2023, 106(6):3 900-3 917.
[29] CAI H F, BIJL E, SCHOLTEN E, et al.Effect of plasmin on casein hydrolysis and textural properties of rennet-induced model cheeses[J].Food Research International, 2023, 165:112421.
[30] REIS LIMA M J, SANTOS A O, FALC O S, et al.Serra da Estrela cheese’s free amino acids profiles by UPLC-DAD-MS/MS and their application for cheese origin assessment[J].Food Research International, 2019, 126:108729.
O S, et al.Serra da Estrela cheese’s free amino acids profiles by UPLC-DAD-MS/MS and their application for cheese origin assessment[J].Food Research International, 2019, 126:108729.
[31] MURTAZA M A, UR-REHMAN S, ANJUM F M, et al.Cheddar cheese ripening and flavor characterization:A review[J].Critical Reviews in Food Science and Nutrition, 2014, 54(10):1309-1321.
[32] LIU S Q, HOLLAND R, CROW V L.Esters and their biosynthesis in fermented dairy products:a review[J].International Dairy Journal, 2004, 14(11):923-945.
[33] RICHOUX R, MAILLARD M B, KERJEAN J R, et al.Enhancement of ethyl ester and flavour formation in Swiss cheese by ethanol addition[J].International Dairy Journal, 2008, 18(12):1140-1145.
[34] 程晶晶, 陈会民, 罗洁, 等.不同成熟期切达干酪的组分及特征风味物质的解析[J].食品与发酵工业, 2020, 46(15):231-237. CHENG J J, CHEN H M, LUO J, et al.Analysis of components and characteristic flavor substances of cheddar cheese at different maturation stages[J].Food and Fermentation Industries, 2020,46(15):231-237.
[35] 李露, 王蓓, 王绒雪, 等.奶疙瘩特征风味组分研究[J].中国食品学报, 2018, 18(9):297-302. LI L, WANG B, WANG R X, et al.Study on characteristic aroma components of kurut[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(9):297-302.
[36] AYYASH M, AL-DHAHERI A S, AL MAHADIN S, et al. In vitro investigation of anticancer, antihypertensive, antidiabetic, and antioxidant activities of camel milk fermented with camel milk probiotic:A comparative study with fermented bovine milk[J].Journal of Dairy Science, 2018, 101(2):900-911.
[37] TIM N M L, ANDRÉS A I, OTTE J, et al.Antioxidant peptides (<3 kDa) identified on hard cow milk cheese with rennet from different origin[J].Food Research International, 2019, 120:643-649.
N M L, ANDRÉS A I, OTTE J, et al.Antioxidant peptides (<3 kDa) identified on hard cow milk cheese with rennet from different origin[J].Food Research International, 2019, 120:643-649.