冷鲜肉是指对屠宰后的畜禽胴体进行迅速冷却处理,让屠宰后的胴体温度(以后腿为测量点)在24 h内降至0~4 ℃,期间要严格遵循卫生标准,并且在之后的排酸、分割及零售过程中一直维持在0~4 ℃条件下的鲜肉[1]。因冷鲜肉含有丰富的水分、蛋白质、脂质、含氮浸出物及维生素等营养物质[2],深受人们喜爱。但在贮藏和销售过程中,冷鲜肉容易出现汁液流失现象,导致冷鲜肉极易受到微生物污染而腐败[3]。因此,如何在冷鲜肉贮存销售期间抑制微生物的生长繁殖,延长冷鲜肉的货架期成为人们关注的热点。
近年来,人们对绿色、安全、无毒的保鲜剂的关注越来越高。百里香酚是一种单帖酚类植物精油,该化合物已在欧盟(European Union, EU)香料列表中注册,并被美国食品和药物管理局(Food and Drug Administration, FDA)列为一般公认的安全(generally recognized as safe, GRAS)[4-6]。它具有广谱的抑菌性和抗氧化特性[7-8],但由于其挥发性、强烈的气味和疏水性等缺陷限制了其在食品中的应用[9]。目前,通过静电纺丝技术对精油进行包埋,可以提高精油的稳定性,改善其疏水性,掩盖感官属性并可以达到可控释放的效果。WANG等[10]制备紫苏醛、百里香酚、ε-聚赖氨酸负载明胶/玉米蛋白纳米纤维膜,对冷藏鸡胸肉保鲜效果的评价,延缓了鸡胸肉的生化变化,对延长冷藏鸡胸肉的保质期有显著的效果。但其只能通过百里香酚单一的方式抑菌。基于此研究背景,本研究通过静电纺丝技术制备了一种单向输水抑菌垫。通过调整表面纳米孔径大小,重点调控上、中层表面纳米孔径大小,形成梯度孔径实现单向输水,可以吸收汁液流失,减少微生物的再繁殖,同时将精油包埋到纤维膜中,达到缓释的效果。并将其应用于冷鲜马肉的保鲜中评价其保鲜效果,从而延长冷鲜马肉的货架期。所制备的抑菌垫为冷鲜肉抑菌保鲜提供了一种新型手段和思路,有利于为冷鲜肉产业的发展,可有效延长冷鲜肉的货架期并提升贮藏期肉品品质。
1 材料与方法
1.1 材料与试剂
百里香酚(thymol,99%)、N,N-二甲基甲酰胺(N,N-dimethylformamide, DMF),上海麦克林生化科技有限公司;聚乳酸(polylactic acid, PLA,Mw=100 000 g/mol)、聚乙烯醇(polyvinyl alcohol, PVA)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone, PVP),美国Nature Works公司;二氯甲烷、硫代巴比妥酸、无水乙醇、氧化镁、硼酸、均为分析纯,国药集团化学试剂有限公司;正己烷,天津市鑫铂特化工有限公司;平板计数琼脂、营养肉汤,广东环凯微生物科技有限公司;马肉,农贸市场。
1.2 仪器与设备
TL-F6静电纺丝机,深圳通力微纳科技有限公司;IR Affinity-1傅里叶变换红外光谱仪,岛津企业管理(中国)有限公司;U-2910紫外可见分光光度计,日本日立公司;TM 4000 Plus扫描电子显微镜,日本株式会社日立高新技术那珂事业所;HARKE-SPCA接触角测定仪,北京哈科试验仪器厂。
1.3 实验方法
1.3.1 纤维膜的制备
1.3.1.1 上层PLA/thymol纤维膜的制备
将一定量的聚乳酸颗粒溶解于二氯甲烷、DMF的混合物(二氯甲烷与DMF的体积比为9∶1)中得到12%(质量分数)的溶液,搅拌溶解。之后,将百里香酚(10、30、50 g/L)分别加入到上述溶液中,充分混合后得到静电纺丝溶液。同时,制备纯聚乳酸溶液作为对照样品。
将纺丝溶液添加到体积为20 mL注射器中,安装到静电纺丝机上。其纺丝参数为:正极电压为+20 kV,流速为1 mL/h,针尖距不锈钢板的垂直距离为15 cm,湿度和温度为20%和25 ℃。得到10、30、50 g/L PLA/Thymol纤维膜,将得到的纤维膜在室温下干燥24 h。
1.3.1.2 中间层PVA/PVP纤维膜的制备
a)交联PVA纤维膜的制备
称取一定量的PVA粉末,加入蒸馏水,搅拌(60 ℃)直至溶解。得到质量分数为12%(质量分数)的PVA纺丝溶液,静置消泡后进行静电纺丝[温度(20±2) ℃,湿度(25±2)%],电压为20 kV,推进速度0.5 mL/h,接收距离为15 cm。
向上一步配制好的PVA纺丝溶液内加入质量分数为5%(质量分数)的戊二醛(glutaraldehyde, GA)水溶液,使得GA与PVA发生原位交联。用PVA/GA纺丝溶液进行静电纺丝。将得到的纤维膜置于盛有盐酸的烧杯上方,进行盐酸熏蒸催化,得到交联PVA纤维膜。
b)交联PVA/PVP纤维膜的制备
称取一定质量的PVP粉末溶于适量蒸馏水中,配制为12%(质量分数)的PVP溶液。将其加入到1.3.1.2节中PVA纺丝溶液中,制得PVA与PVP不同体积比(9∶1、8∶2、7∶3)的混合纺丝液,静置后纺丝,通过扫描电镜观察纤维形貌。最终确定PVA与PVP体积比,然后向纺丝溶液中加入5%(质量分数)GA溶液进行原位交联并用盐酸熏蒸催化处理。
1.3.1.3 单向输水抑菌垫的制备
单向输水抑菌垫是由3层组成的:上层为PLA/thymol纤维膜,中间层为交联PVA/PVP纤维膜,底层为纸纤维膜。底层纸纤维膜作为接收,通过静电纺丝先将中间层纺丝,再将上层纺丝,最后形成单向输水抑菌垫。
1.3.2 上层PLA/thymol纤维膜在不同食品模拟液中的释放效果测定和傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)测定
释放效果测定:参考GB 31604.1—2015《食品安全国家标准 食品接触材料及制品迁移试验通则》进行。测量溶液在278 nm处的吸光度来确定thymol的释放量(注意:保持溶液的恒定体积)。10%(体积分数)乙醇中,thymol的线性方程为:y=4.489 3x+0.005 5,R2=0.999 3。50%(体积分数)的乙醇中,thymol的线性方程为:y=5.228 4x+0.016,R2=0.999。正己烷中,thymol的线性方程为:y=6.761 1x+0.017 7,R2=0.999。释放的thymol累积量的计算如公式(1)和公式(2)所示:
Qn=CnV+V1(C1+C2+C3+…+Cn-1)
(1)
(2)
式中:第n次取样时thymol累计释放量为Qn,μL;第n次取样时溶液的含量为Cn,μL/mL;溶液的体积为V,mL;每次取样量为V1,mL;累计释放率为q,%;总负载量为Q0,μL。
FTIR:thymol、PLA膜和PLA/thymol纤维膜通过衰减全反射IRSpirit-T进行分析。光谱采集波段范围为500~4 000 cm-1。每个样品的光谱是通过3次扫描的平均值得到的,分辨率为4 cm-1。
1.3.3 单向输水抑菌垫的结构表征及性能研究
1.3.3.1 扫描电子显微镜(scanning electron microscope, SEM)测定
将待测样品在真空下进行喷金处理(Hummer 6.2溅射系统)。将样品剪成相同的尺寸,固定于导电胶上。用TM-4000型扫描电镜下观察纤维的微观结构。
1.3.3.2 单向输水抑菌垫的单向输水性能测定
将抑菌垫剪成5 cm×1 cm的长方形,固定于玻璃板上,通过水接触角(water contact angle, WCA)系统(Data physics,OCAESr)收集了单向水传递的效果[11]。将2 μL纯水滴在抑菌垫表面,立即拍照记录。
1.3.3.3 单向输水抑菌垫的抑菌性能测定
采用琼脂扩散法评价单向输水抑菌垫对革兰氏阴性大肠杆菌和革兰氏阳性金黄色葡萄球菌的抑菌性能,该方法通过测量抑制区的直径来分析抑菌效果[12]。简而言之,在无菌条件下,将200 μL的微生物悬浮液(1×104 CFU/mL))均匀地涂在营养琼脂平板上。然后,将准备好的纤维膜切成直径为10 mm的圆片,用紫外线照射灭菌30 min,放在接种的营养琼脂的顶部中心,在37 ℃下培养24 h,24 h后观察实验结果,测量抑菌圈直径以确定抗菌活性。
1.3.4 单向输水抑菌垫对冷鲜马肉的保鲜实验
1.3.4.1 样品处理
将冷鲜马肉放入无菌生物安全柜中紫外照射30 min去除表面杂菌,去除冷鲜肉中的脂肪和结缔组织,将肉样切分成大小相同的小肉块(25±0.1) g。将抑菌垫按照表1进行分组并放置于肉样的底部(其中上层纤维膜靠近肉),其中抑菌垫大小均为5 cm×5 cm。均采用托盘包装并贮存在4 ℃冰箱中,不同时间间隔测定冷鲜马肉的品质变化。
表1 马肉样品的分组
Table 1 Grouping of horse meat samples

组别处理方式空白组不放置抑菌垫,直接放在托盘上对照组使用无thymol的抑菌垫实验组使用thymol质量浓度为50 g/L的抑菌垫
1.3.4.2 汁液流失的测定
在贮存和分析冷鲜肉样品之前,对样品进行称重以确定渗出物损失的潜在变化。通过计算样品的初始重量和最终重量之间的差异,计算出渗出液损失的百分比。渗出液损失的计算如公式(3)所示:
(3)
式中:渗出物损失为w,%;肉样的初始质量为M1,g;肉样最终质量为M2,g。
1.3.4.3 挥发性盐基氮(total volatile basic nitrogen, TVB-N)值测定
TVB-N值测定参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》的方法执行。
1.3.4.4 菌落总数的测定
参考GB 4789.2—2022的方法,选用平板计数法测定肉样的菌落总数,每个样品测定3次取平均值。
1.4 统计分析
采用Origin 9.65进行绘图分析和SPSS(Version 26.0)软件对数据进行分析。所有实验至少进行3次。结果值以均数±标准差表示。
2 结果与分析
2.1 上层PLA/thymol纤维膜的表征
通过傅里叶红外光谱法对PLA纤维膜和含有不同浓度thymol的PLA/thymol纤维膜进行结构分析,确定thymol是否包埋到了纤维膜中(图1)。如图1中的b所示,百里香酚的特征峰位于1 250~1 750 cm-1[13],苯酚基团的C—O拉伸和C—C拉伸分别在1 622 cm-1和1 250 cm-1处产生特征峰。而对于PLA谱图(图1中的a)显示了主、仲碳的拉伸,1 750 cm-1(C![]() O拉伸)和1 183 cm-1(C—O拉伸)1 450 cm-1(C—H变形和振动)[14],在2 996 cm-1和2 935 cm-1(主、仲碳拉伸)处显示了特征峰。与PLA相比,PLA/thymol纤维膜的光谱图出现蓝移特征峰(1 750~1 745 cm-1,1 450~943 cm-1,1 183~1 177 cm-1)(图1中的c)[15]。此外,还发现PLA/thymol纤维膜中出现了与百里香酚相关的峰,这表明百里香酚被成功的包埋到了纤维膜中。
O拉伸)和1 183 cm-1(C—O拉伸)1 450 cm-1(C—H变形和振动)[14],在2 996 cm-1和2 935 cm-1(主、仲碳拉伸)处显示了特征峰。与PLA相比,PLA/thymol纤维膜的光谱图出现蓝移特征峰(1 750~1 745 cm-1,1 450~943 cm-1,1 183~1 177 cm-1)(图1中的c)[15]。此外,还发现PLA/thymol纤维膜中出现了与百里香酚相关的峰,这表明百里香酚被成功的包埋到了纤维膜中。
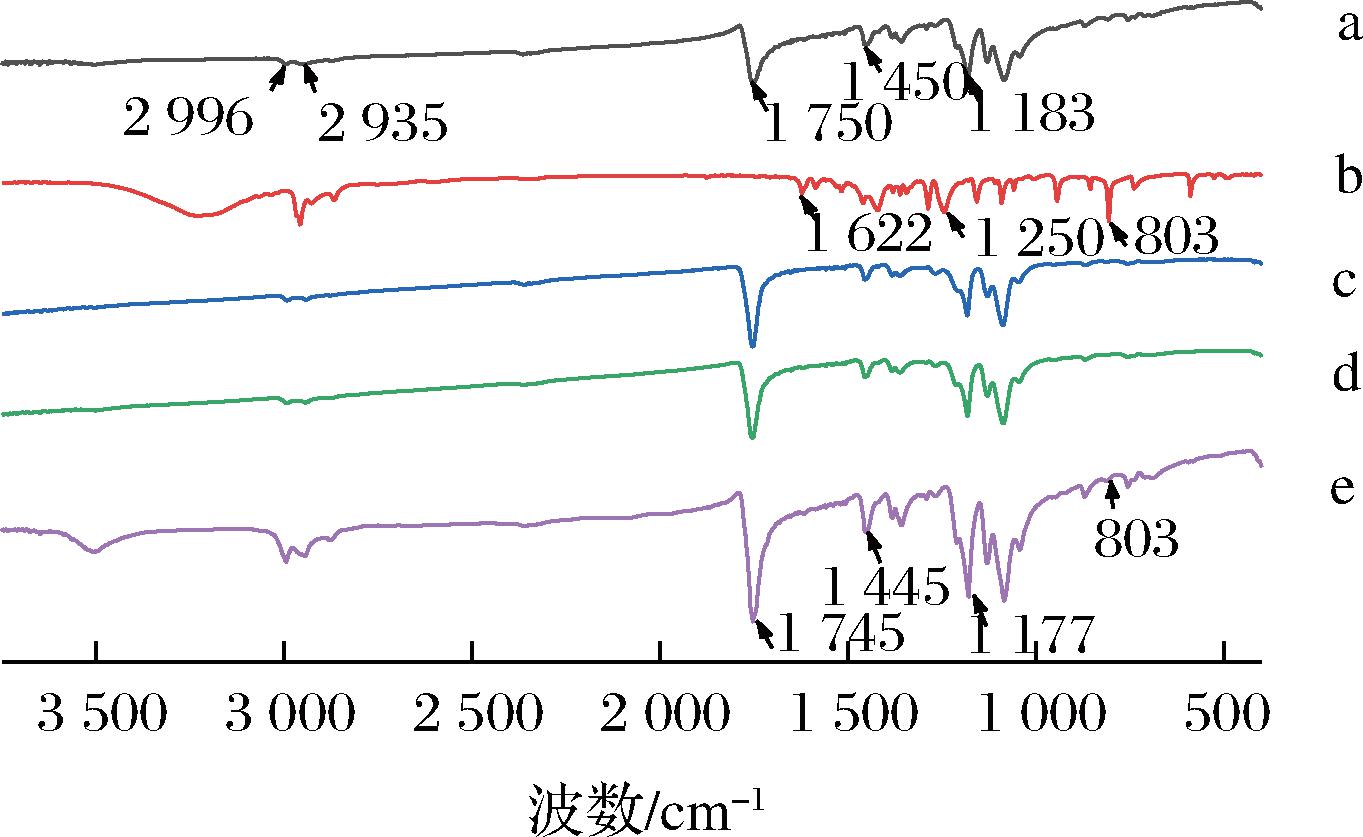
a-PLA纤维膜,b-百里香酚,c-PLA/10 g/L thymol纤维膜, d-PLA/30 g/L thymol纤维膜,e-PLA/50 g/L thymol纤维膜
图1 静电纺丝纤维膜的FTIR光谱图
Fig.1 FTIR of the electrospun fiber membranes
PLA/50 g/L thymol纤维膜在各种食品模拟物中的释放效果如图2所示。由于食品模拟物不同的特性,thymol的释放率有明显的差异[16]。测试了3种类型的食品模拟物,分别是高水活性食品模拟物[10%(体积分数)乙醇溶液]、高酒精含量食品模拟物[50%(体积分数)乙醇溶液]和油脂类食品模拟物(正己烷)[17]。如图2所示,thymol的积累率将随着时间的延长而增加。相比之下,thymol在50%乙醇中的迁移速度最快,而在正己烷中的延长速度最慢,这表明它在正己烷溶液中具有缓释作用。图2表明,纤维膜对油脂类食品模拟物的效果更持久,达到缓释的效果,因此可能会延长冷鲜马肉的货架期。
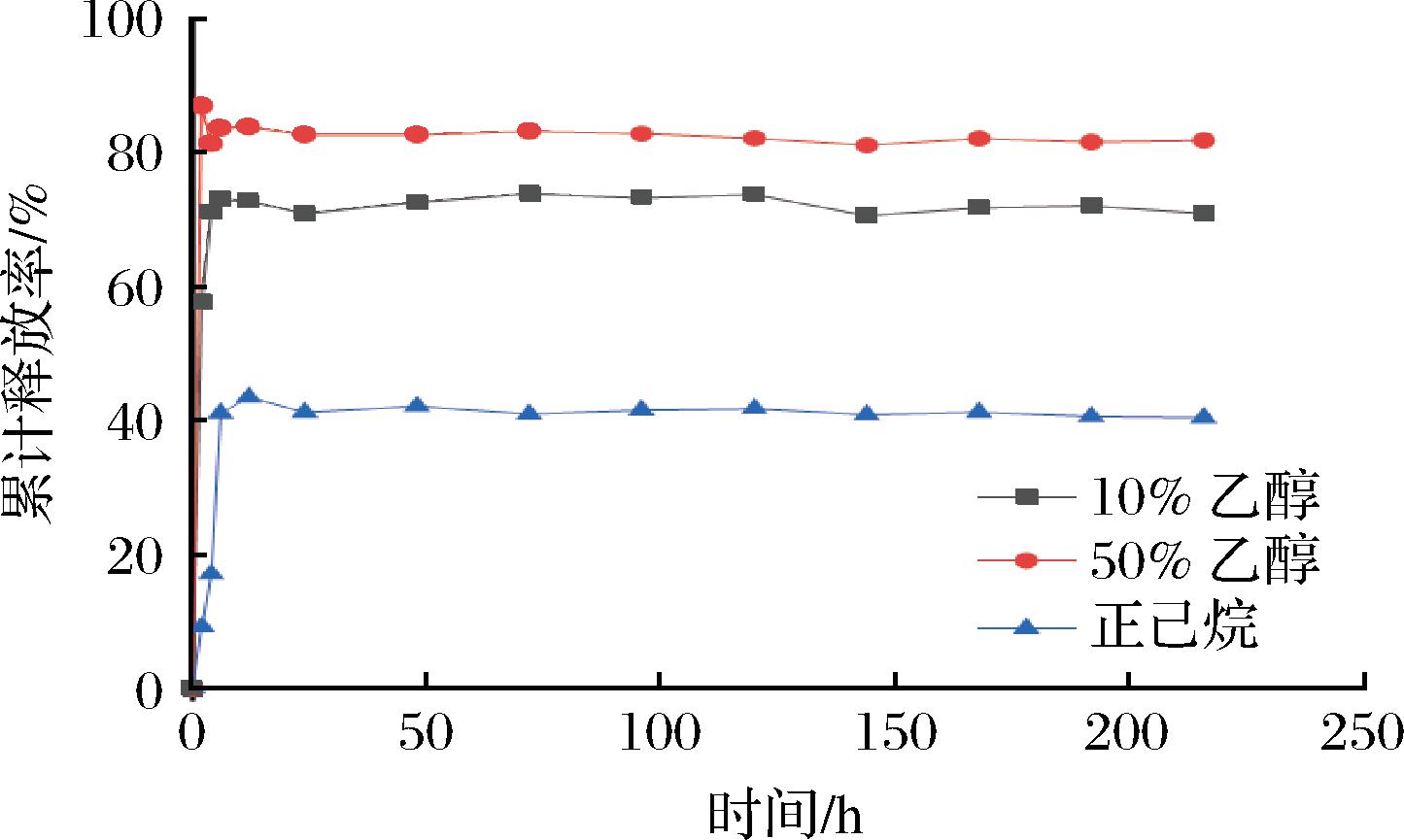
图2 PLA/5%Thymol纤维膜在不同食品模拟剂下的 百里香酚累积释放率
Fig.2 Cumulative release rate of thymol from PLA/50 g/L thymol fiber membranes at different food simulants
2.2 单向输水抑菌垫表征
2.2.1 形貌分析
图3是单向输水抑菌垫各层组成及其整体的扫描电子显微镜图像。其中,图3-a为上层PLA/thymol纤维膜,图3-b为中间层交联PVA/PVP纤维膜,图3-c为底层纸纤维膜,图3-d为单向输水抑菌垫的截面结构。可以看出,单向输水抑菌垫的3层结构紧密相连。各层的微观形貌在组成单向输水抑菌垫前后,其形貌不发生改变,因为单向输水抑菌垫的组成过程属于物理性的,对各层的结构不会改变。

A-PLA/thymol纤维膜;b-PVA/PVP纤维膜;c-纸纤维膜; d-截面结构
图3 单向输水抑菌垫的SEM图像
Fig.3 SEM image of bacteriostatic pad for one-way water delivery
2.2.2 单向输水性能
两侧具有非对称润湿性的膜可以实现水的定向传输[18]。当液滴位于疏水侧时,受到2个相反的力,即PLA膜在疏水侧的水的排斥力(hydrophobic pressure,HF)和水的静水压力(hydrostatic pressure, HP)[19]。当HF小于HP时,液滴穿过疏水层并与亲水层接触。然后液滴受到来自亲水性PVA纤维的毛细管力(capillary pressure, CF)并立即扩散到吸收层中(图4-a)。图4-b是水接触角图,表明水滴在疏水性PLA纤维上停留了一段时间,然后相对迅速地被吸收到亲水层中。结果与上述理论一致。
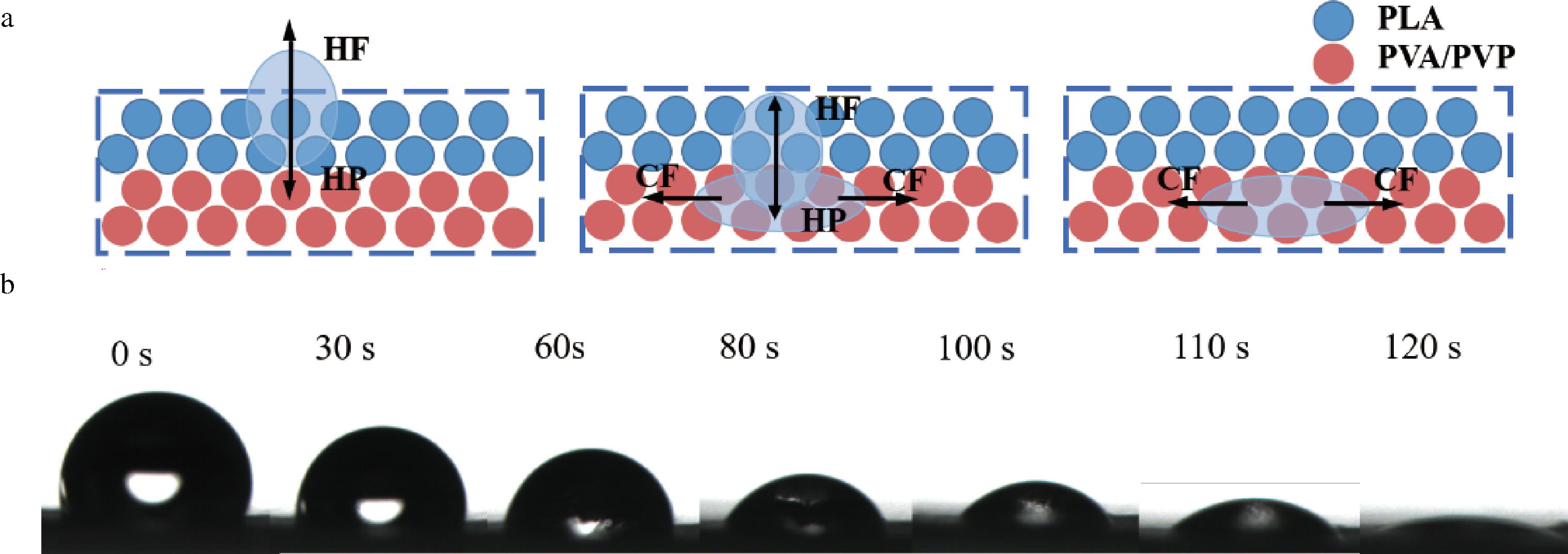
a-单向输水的机理;b-纳米纤维膜正向动态渗透过程
图4 单向输水的机理及纳米纤维膜正向动态渗透过程
Fig.4 One-way water transport mechanism and forward dynamic permeation process of nanofiber membrane
2.2.3 抗菌性能
采用琼脂扩散法对所得抑菌垫的抗菌性能评价。使用大肠杆菌和金黄色葡萄球菌作为代表,表2为单向输水抑菌垫对所测不同菌落的抑制效果,PLA纤维膜没有明显的抑菌效果。随着thymol浓度的增加,抑菌活性也在增加。该抑菌垫对大肠杆菌的抑菌直径从(15.19±0.65) mm增加到了(24.70±0.21) mm,对金黄色葡萄球菌的抑菌直径从(15.68±0.25) mm增加到了(24.32±0.72) mm。
表2 不同浓度的thymol抑菌垫抑菌圈直径 单位:mm
Table 2 Diameter of inhibition zone of thymol inhibition pad at different concentrations
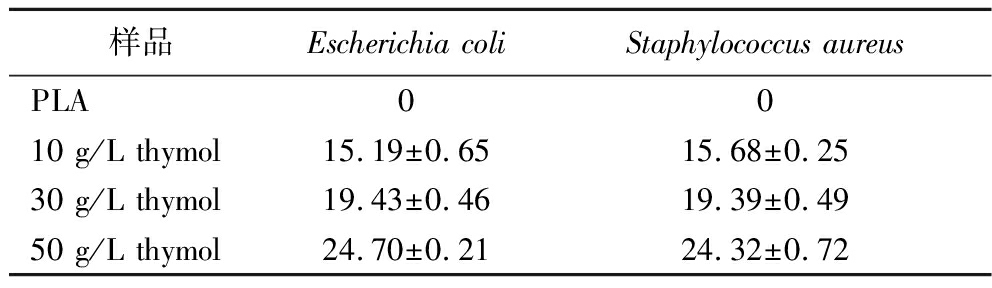
样品Escherichia coliStaphylococcus aureusPLA0010 g/L thymol15.19±0.6515.68±0.2530 g/L thymol19.43±0.4619.39±0.4950 g/L thymol24.70±0.2124.32±0.72
百里香酚本身具有很强的抗菌,使用静电纺丝包埋后在依然保留了抗菌活性,与ANAYA-CASTRO等[20]研究结果一致。百里香酚表现优异的抗菌性是因为其酚羟基能与细菌细胞膜作用,而破坏了细胞膜结构[21]。
2.3 单向输水抑菌垫对冷鲜马肉贮藏期间理化性质的影响
2.3.1 冷鲜马肉的汁液流失率变化
如图5-a所示,冷鲜马肉汁液流失率变化情况。随着贮藏时间的延长,冷鲜马肉的汁液流失率呈上升趋势。第6天后,实验组对马肉汁液的吸收量显著低于对照组(P<0.05)。空白组和对照组在贮藏的第12天分别达到了7.6%和7.4%,而实验组在贮藏的第18天汁液流失率才达到6.2%。出现这种现象的原因是,汁液流失主要是蛋白质分解,肌肉结构松散,持水能力减弱[22-23],实验组中由于thymol的存在,更大程度地抑制了微生物的繁殖,蛋白质分解也减少,从而减少了汁液流失。
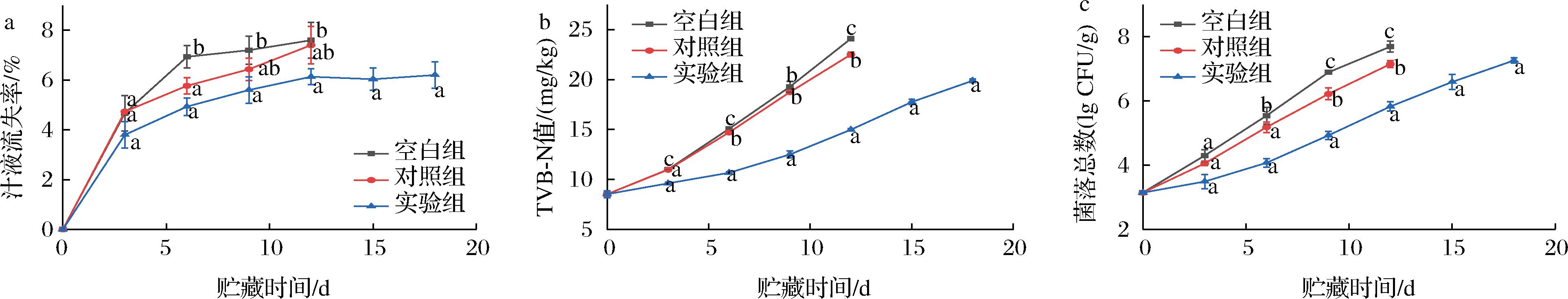
a-汁液流失率;b-TVB-N值;c-菌落总数
图5 单向输水抑菌垫对冷鲜马肉贮藏期间理化性质的影响
Fig.5 Influence of antibacterial pad with unidirectional water infusion on physicochemical properties of chilled fresh horse meat during storage
注:图中不同的小写字母表示不同组别间的显著差异(P<0.05)。
2.3.2 冷鲜马肉的TVB-N值变化
TVB-N是反映肉中蛋白质和胺类降解的重要生物标志物[8]。GB 2707—2016《食品安全国家标准 鲜(冻)畜、禽产品》明确规定了TVB-N的限值为15 mg/100 g。如图5-b所示,3组样品的TVB-N值均随着贮藏时间的延长而逐渐升高。在贮藏期的第9天,空白组和对照组的TVB-N值已经超过了15 mg/100 g的限值,并且显著高于此时的实验组(P<0.05)。在第15天时,实验组的TVB-N值为(17.75±0.27) mg/100 g,超出了限值。其原因可能是单向输水抑菌垫中的抑菌物质百里香酚和单向输水作用抑制了肉样中微生物的繁殖,从而降低了TVB-N值。
2.3.3 冷鲜马肉的菌落总数变化
菌落总数是反映冷鲜肉在贮藏期间品质变化的重要指标[24]。粮农组织建议所有肉类和肉制品的可接受微生物限量为7 lg CFU/g[25]。如图5-c所示,是冷鲜马肉在4 ℃的贮藏期内菌落总数变化。在贮藏期的0~6 d内,3组的菌落总数值从初始的(3.14±0.04) lg CFU/g缓慢上升,在第6天以后上升趋势加快。在第12天时,空白组和对照组的菌落总数值都超过了7.0 lg CFU/g,实验组的最低[(5.83±0.15) lg CFU/g]。从菌落总数值来看,空白组和对照组在第12天就超出了限值,而实验组在第18天才超出限值。因此,可以得出这样的结论,单向输水抑菌垫可以在一定程度上延缓微生物繁殖,加入thymol的后达到双重抑菌的效果。
3 结论
本研究通过静电纺丝技术成功制备了单向输水抑菌垫。扫描电镜图和傅里叶红外光谱表明,纤维膜形态分布均匀,百里香酚也成功被包埋。由于百里香酚是强挥发性活性物质,所以通过纤维膜进行包埋,百里香酚在不同的食品模拟物中具有缓释作用,尤其是在油脂类的食品模拟物中累积释放率为40.43%,起到缓释作用。通过体外抑菌实验表明,单向输水抑菌垫对革兰氏阳性和革兰氏阴性细菌都有明显的抑制作用。将该垫用于贮藏冷鲜马肉的保鲜中,在4 ℃下,可以将马肉货架期延长6 d。单向输水抑菌垫不仅可以通过单向输水作用控制汁液流失率,而且可以缓慢地释放天然抑菌剂,达到良好的抑菌作用,从而延长冷鲜肉的货架期,为冷鲜肉贮藏过程中易腐败变质的问题提供了新思路。
[1] 郇延军, 许伟, 赵雅娟, 等.冷鲜肉品质评价指标的探讨[J].食品科学, 2012, 33(21):107-110. HUAN Y J, XU W, ZHAO Y J, et al.Potential biochemical parameters for quality evaluation of chilled fresh pork[J].Food Science, 2012, 33(21):107-110.
[2] SONG W L, DU Y F, YANG C X,et al.Development of PVA/EVA-based bilayer active film and its application to mutton[J].LWT, 2020, 133:110109.
[3] ZHANG Y, ZHOU L B, ZHANG C, et al.Preparation and characterization of curdlan/polyvinyl alcohol/ thyme essential oil blending film and its application to chilled meat preservation[J].Carbohydrate Polymers, 2020, 247:116670.
[4] 刘松奇, 向慧, 吴京京, 等. 静电溶吹制备明胶/玉米醇溶蛋白/百里香酚纳米纤维及其表征[J]. 食品科学, 2023,44(12): 50-59. LIU S Q, XIANG H, WU J J, et al. Fabrication and characterization of gelatin/zein/thymol nanofibers by electro-blown spinning[J]. Food Science, 2023,44(12): 50-59.
[5] ZHANG Y B, ZHANG Y, ZHU Z, et al.Encapsulation of thymol in biodegradable nanofiber via coaxial eletrospinning and applications in fruit preservation[J].Journal of Agricultural and Food Chemistry, 2019, 67(6):1736-1741.
[6] VAFANIA B, FATHI M, SOLEIMANIAN-ZAD S.Nanoencapsulation of thyme essential oil in chitosan-gelatin nanofibers by nozzle-less electrospinning and their application to reduce nitrite in sausages[J].Food and Bioproducts Processing, 2019, 116:240-248.
[7] MARCHESE A, ORHAN I E, DAGLIA M, et al.Antibacterial and antifungal activities of thymol:A brief review of the literature[J].Food Chemistry, 2016, 210:402-414.
[8] DAI J M, HU W, YANG H Y, et al.Controlled release and antibacterial properties of PEO/casein nanofibers loaded with thymol/β-cyclodextrin inclusion complexes in beef preservation[J].Food Chemistry, 2022, 382:132369.
[9] GUO Q, DU G G, JIA H, et al.Essential oils encapsulated by biopolymers as antimicrobials in fruits and vegetables:A review[J].Food Bioscience, 2021, 44(PtA):101367.
[10] WANG D B, SUN J Y, LI J L, et al.Preparation and characterization of gelatin/zein nanofiber films loaded with perillaldehyde, thymol, or ε-polylysine and evaluation of their effects on the preservation of chilled chicken breast[J].Food Chemistry, 2022, 373(PtA):131439.
[11] JIAO X Y, XIE J X DU H Y, et al.Antibacterial smart absorbent pad with Janus structure for meat preservation[J].Food Packaging and Shelf Life, 2023, 37:101066.
[12] LOGIN C C, B LDEA I, TIPERCIUC B, et al.A novel thiazolyl schiff base:Antibacterial and antifungal effects and in vitro oxidative stress modulation on human endothelial cells[J].Oxidative Medicine and Cellular Longevity, 2019, 2019:1607903.
LDEA I, TIPERCIUC B, et al.A novel thiazolyl schiff base:Antibacterial and antifungal effects and in vitro oxidative stress modulation on human endothelial cells[J].Oxidative Medicine and Cellular Longevity, 2019, 2019:1607903.
[13] ZHU Z, MIN T T, ZHANG X J, et al.Microencapsulation of thymol in poly(lactide-co-glycolide) (PLGA):Physical and antibacterial properties[J].Materials, 2019, 12(7):1133.
[14] WANG D B, SUN Z L, SUN J Y, et al.Preparation and characterization of polylactic acid nanofiber films loading Perilla essential oil for antibacterial packaging of chilled chicken[J].International Journal of Biological Macromolecules, 2021, 192:379-388.
[15] MIN T T, SUN X L, YUAN Z P, et al.Novel antimicrobial packaging film based on porous poly (lactic acid) nanofiber and polymeric coating for humidity-controlled release of thyme essential oil[J].LWT, 2021, 135:110034.
[16] TAWAKKAL I S M A, CRAN M J, BIGGER S W.Release of thymol from poly(lactic acid)-based antimicrobial films containing kenaf fibres as natural filler[J].LWT-Food Science and Technology, 2016, 66:629-637.
[17] ZHOU Z M, LIU Y L, LIU Z J, et al.Sustained-release antibacterial pads based on nonwovens polyethylene terephthalate modified by β-cyclodextrin embedded with cinnamaldehyde for cold fresh pork preservation[J].Food Packaging and Shelf Life, 2020, 26:100554.
[18] SHAO Z G, WANG Q F, CHEN J Y, et al.Directional water transport Janus composite nanofiber membranes for comfortable bioprotection[J].Langmuir, 2022, 38(1):309-319.
[19] WANG L X, ZHOU B K, BI Z J, et al.Fabrication of breathable Janus membranes with gradient unidirectional permeability by micro-imprinting[J].Separation and Purification Technology, 2022, 299:121661.
[20] ANAYA-CASTRO M A, AYALA-ZAVALA J F, MU OZ-CASTELLANOS L, et al.β-Cyclodextrin inclusion complexes containing clove (Eugenia caryophyllata) and Mexican oregano (Lippia berlandieri) essential oils:Preparation, physicochemical and antimicrobial characterization[J].Food Packaging and Shelf Life, 2017, 14(Part B):96-101.
OZ-CASTELLANOS L, et al.β-Cyclodextrin inclusion complexes containing clove (Eugenia caryophyllata) and Mexican oregano (Lippia berlandieri) essential oils:Preparation, physicochemical and antimicrobial characterization[J].Food Packaging and Shelf Life, 2017, 14(Part B):96-101.
[21] JAYASENA D D, JO C.Essential oils as potential antimicrobial agents in meat and meat products:A review[J].Trends in Food Science &Technology, 2013, 34(2):96-108.
[22] LI J G, MA X Y, ZHANG J W, et al.Insight into the mechanism of the quality improvement of porcine after ultrasound‐assisted immersion freezing[J].International Journal of Food Science and Technology, 2022, 57(8):5068-5077.
[23] 陈韬, 崔薇, 邱燕, 等.猪肉持水性与宰后肌肉组织结构变化的关系[J].食品科技, 2011, 36(4):90-94. CHEN T, CUI W, QIU Y, et al.The relationship of water holding capacity and muscle tissue changes during postmortem[J].Food Science and Technology, 2011, 36(4):90-94.
[24] LIU T, LIU L.Fabrication and characterization of chitosan nanoemulsions loading thymol or thyme essential oil for the preservation of refrigerated pork[J].International Journal of Biological Macromolecules, 2020, 162:1509-1515.
[25] CHANDRA MOHAN C, RADHA KRISHNAN K, BABUSKIN S, et al.Active compound diffusivity of particle size reduced S.aromaticum and C.cassia fused starch edible films and the shelf life of mutton (Capra aegagrus hircus) meat[J].Meat Science, 2017, 128:47-59.