酒精被公认为大多数工业化国家慢性肝病的常见致病因素。肝脏是酒精代谢的重要器官,也是酒精损害的主要靶器官[1]。酒精性肝病(alcoholic liver disease,ALD)已经逐渐成为全球广泛流行的慢性肝病,主要特征是肝细胞代谢受损、氧化应激和肝损伤[2]。在ALD疾病进程初期,脂质会在乙醇的诱导下进入肝细胞中并逐渐积累,形成脂肪肝,此时若仍持续摄入酒精,则可能进一步发展为肝纤维化甚至肝硬化。目前,我国酒精性肝病已经上升成为仅次于病毒性肝炎的第二大肝脏疾病,然而迄今为止尚无安全有效治疗ALD的临床用药[3]。如何有效防治ALD是临床医学迫切需要解决的问题。因此,寻找酒精性肝病防治措施具有十分重要的意义。
近几年,一些研究揭示了肠道微生物群失调与ALD发病机制之间的重要关系[4]。酒精摄入不仅导致肠道微生物群失调,还会破坏肠道屏障功能,使肠道通透性升高,进而增加脂多糖(lipopolysaccharides,LPS)向门静脉循环的泄漏,引起炎症反应和肝损伤[5]。此外,氧化应激是酒精性肝细胞损伤和肝脏脂肪堆积的主要因素之一。酒精代谢中产生大量活性氧(reactive oxygen species,ROS),其会直接损伤肝细胞,还能氧化脂质、蛋白质和核酸等多种生物分子,并干扰抗氧化酶活性和细胞乙醇氧化系统[6-7]。
乳酸菌(lactic acid bacteria,LAB)广泛存在于自然界中,是发酵工业中不可缺少的微生物,在肠道内发挥着至关重要的作用。1994年,NANJI等[8]最早发现乳酸菌具有缓解酒精性肝损伤的潜力,这引起了国内外研究者广泛的关注。多项研究表明鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG,LGG)可以通过恢复肠道屏障功能和黏膜免疫系统[9],缓解氧化应激及降低炎症反应[10],维持肠道菌群平衡和提高肠道短链脂肪酸[11],从而改善酒精引起的肝脏脂肪变性和损伤。此外,短双歧杆菌ATCC15700[12]在慢性酒精肝损伤小鼠体内能恢复肠道微生物群和肠道通透性,降低内毒素血症,进而抑制酒精性肝脏病的发展。植物乳杆菌[13]可以通过增加机体抗氧化特性,减少酒精性肝损伤。
本研究从传统发酵食品中分离得到的乳酸菌,从抗氧化特性、改善肠道屏障功能方面,进行改善酒精性肝病乳酸菌体外评价。并建立慢性酒精性肝损伤模型,进一步验证菌株体内缓解酒精性肝损伤功效,为酒精性肝损伤的防治提供了潜在的干预措施。
1 材料与方法
1.1 材料与试剂
发酵黏液乳杆菌WHH2438:分离自新疆奶疙瘩样品,经鉴定其属于发酵粘液乳杆菌(Limosilactobacillus fermentum)。C57BL/6 J雄性无特定病原体动物(specific pathogen free,SPF)级小黑鼠(体质量18~22 g,6~8周龄),浙江省中医药大学动物实验中心;人结直肠腺癌细胞HT-29,中国科学院上海生命科学研究院细胞资源中心;猪小肠上皮细胞IPEC,中国科学院上海生命科学研究院细胞资源中心;鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)GG,杭州娃哈哈集团有限公司菌种资源库。
DPPH、胰酶、牛胆盐(生化试剂),Sigma-Aldrich(中国)有限公司;无水乙醇、水杨酸、H2O2,中国医药集团有限公司;细菌/细胞总脱氧核糖核酸(deoxyribo nucleic acid,DNA)提取试剂盒,北京天根生化科技有限公司;DMEM培养基、胎牛血清,赛默飞世尔科技(中国)有限公司;MRS培养基,英国Oxoid生物试剂有限公司。
1.2 仪器与设备
Baker Type B2 SterilGARD Ⅲ生物安全柜、DU800紫外分光光度计,美国贝克曼公司;Mastercycler® nexus GX2 PCR扩增仪、5810 R离心机,德国Eppendorf公司;Delta 320 pH计、JA2003 N电子天平,瑞士梅特勒-托利多公司;DNP-111电热恒温培养箱,上海海向仪器设备厂;DF-101S集热式恒温加热磁力搅拌器,巩水市英谷硲予华仪器厂;MX-S漩涡振荡器,大龙兴创实验仪器(北京)有限公司;MLS-3780高压蒸汽灭菌锅,日本三洋株式会社;OLYMPUS BX61光学显微镜,日本奥林巴斯株式会社。
1.3 实验方法
1.3.1 菌株分离纯化与鉴定
取新疆奶疙瘩样品,筛网过滤后,取1 mL加入9 mL无菌生理盐水中,然后10倍梯度稀释,各取10-1、10-3、10-5稀释度100 μL分别涂布于固体MRS培养基平板上,于37 ℃厌氧培养48 h。根据形态特征挑选典型菌落,挑取单个菌落划线分离2~3次,反复划线获得纯菌株,编号,进行革兰氏染色,镜检。
取适量对数生长期的菌株纯培养物,利用细菌基因组DNA快速抽提试剂盒提取菌体DNA,采用细菌16S片段通用引物27F(5′-AGTCTCTGATCATGC-3′)和1492R(5′-AAGGAGGTGCTCCAGCC-3′)进行16S rDNA片段的扩增。
聚合酶链式反应(polymerase chain reaction,PCR)扩增反应体系:模板DNA 1 μL,引物(10 mmol/L)各1 μL,2×Taq PCR Master Mix 25 μL,用ddH2O补到50 μL。扩增程序:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。
PCR产物送至上海生工生物工程有限公司进行测序,将测序结果采用DNAMAN软件双向拼接后,通过NCBI中的BLAST功能进行序列相似性比对分析[14]。
1.3.2 清除DPPH自由基的能力
本发明菌株发酵粘液乳杆菌WHH2438和对照商业菌株鼠李糖乳杆菌GG(LGG)经二代活化后,取对数生长末期菌液,4 000 r/min离心10 min,弃上清液,获得菌泥,PBS(pH=7.4)洗涤2次后重悬,用分光光度计将菌悬液OD600值调至0.5±0.1。在反应体系中加入待测益生菌的菌悬液1 mL,再加入1 mL 0.1 mmol/L DPPH的无水乙醇溶液,充分混匀后,室温下避光振荡反应30 min,然后经过6 000 r/min离心10 min,取上清液,测定517 nm处的吸光度。以等体积的生理盐水代替样品溶液作为对照组,并用等体积的生理盐水和无水乙醇的混合液作为空白调零。DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
1.3.3 清除羟自由基的能力
菌株经二代活化后,取对数生长末期菌液,4 000 r/min离心10 min,弃上清液,获得菌泥,PBS(pH=7.4)洗涤2次后重悬,用分光光度计将菌悬液OD600调至0.5±0.1。在反应体系中加入待测益生菌的菌悬液1 mL,再加入1 mL生理盐水和1 mL FeSO4(3 mmol/L)。混匀后加入1 mL H2O2(3 mmol/L),室温静置10 min后加入1 mL水杨酸(3 mmol/L,无水乙醇溶解),混匀,37 ℃水浴20 min,离心取上清液测定510 nm处的吸光值。以等体积的生理盐水代替样品溶液作为对照组,并用等体积的生理盐水和无水乙醇的混合液作为空白调零。
羟自由基清除率的计算如公式(2)所示:
羟自由基清除率![]()
(2)
式中:Ap为菌液的OD510值,As为菌悬液换成0.9%的生理盐水的OD510值。
1.3.4 抑制酒精损伤肠细胞能力
HT29细胞的培养:从-80 ℃低温冰箱中取出HT-29细胞进行复苏,复苏后的HT-29细胞传至第3代,采用0.25%(质量分数)的胰酶(含0.02%EDTA,2500 BAEE units/mL)消化后1 000 r/min离心5 min,加入5 mL含10%(体积分数)胎牛血清的DMEM培养基(含青霉素100 U/mL,链霉素100 μg/mL)进行重悬(直至细胞呈单细胞悬液),取适量细胞用血球细胞计数板计数,根据计数结果,用含10%胎牛血清的DMEM培养基(含青霉素100 U/mL,链霉素100 μg/mL)将细胞悬液浓度稀释到1×105 cells/mL,取200 μL接种于96孔细胞培养板中,于37 ℃,5%(体积分数)CO2培养1 d。
益生菌对抑制乙醇损伤肠细胞能力方法:取对数生长末期菌液,4 000 r/min离心10 min,弃上清液,获得菌泥,PBS(pH=7.4)洗涤2次后用DMEM培养基重悬,用分光光度计将菌悬液OD600值调至1,以DMEM培养基为对照,以含10%(体积分数)酒精DMEM培养基为处理组,于37 ℃、含5% CO2的培养箱中孵育30 min后清洗1次,之后用MTT法测定活性。
1.3.5 肠屏障保护能力
IPEC单层细胞的培养:从-80 ℃低温冰箱中取出IPEC细胞进行复苏,复苏后的IPEC细胞传至第三代,采用0.25%(质量分数)的胰酶(含0.02%EDTA,2 500 BAEE units/mL)消化后1 000 r/min离心5 min,加入5 mL含10%(体积分数)胎牛血清的DMEM培养基(含青霉素100 U/mL,链霉素100 μg/mL)进行重悬(直至细胞呈单细胞悬液),取适量细胞用血球细胞计数板计数,根据计数结果,用含10%胎牛血清的DMEM培养基(含青霉素100 U/mL,链霉素100 μg/mL)将细胞悬浮,取200 μL接种于Transwell小室中,于37 ℃,5% CO2培养7 d以上。
益生菌菌株的活化:分别将200 μL的甘油种子液接种于10 mL液体MRS培养基中,在37 ℃恒温培养箱中,经活化培养后,收集菌液。每株菌取出3 mL菌液,测定菌液OD600,用空白培养基进行适当稀释,调整至OD600值为0.90±0.10。剩余菌液取5 mL在室温下4 000 r/min离心10 min收集菌体,用5 mL含10%胎牛血清的DMEM完全培养基中培养(不加双抗)重悬,并根据之前的稀释倍数,将菌液OD统一稀释至0.900。
益生菌保护肠屏障实验:以DMEM培养基为空白,以含2.5%(体积分数)酒精和益生菌的DMEM培养基为处理组,仅含2.5%酒精DMEM培养基为对照组于37 ℃,含5% CO2的培养箱中孵育30 min、1 h、2 h、3 h,用电阻仪测定细胞屏障通透性。
1.3.6 缓解酒精性肝损伤功能动物剂量效价实验
本动物实验所有程序均按照中国浙江省《浙江省实验动物管理办法》的要求进行。该研究方案由杭州娃哈哈集团有限公司动物管理和伦理委员会讨论通过并批准(批准文号WHH2021101401)。
本实验采取随机分组设计,将健康的雄性C57BL/6 J小鼠(8周龄,23~24 g),72只,食用普通饲料适应7 d后,随机分为6组,对照组12只,模型组12只,各益生菌处理组12只。动物饲养保持环境温度为(21±2) ℃,湿度为30%~70%,12 h光照交替,自由饮水,摄入饲料需人为控制。每3 d换1次垫料。液体饲料购自江苏南通特洛菲饲料科技有限公司,酒精液体饲料的酒精含量为4%(质量分数)。
分组及处理方式如表1所示。
表1 菌株缓解酒精性肝损伤功能实验的分组及处理方式
Table 1 Group and treatment of experiment
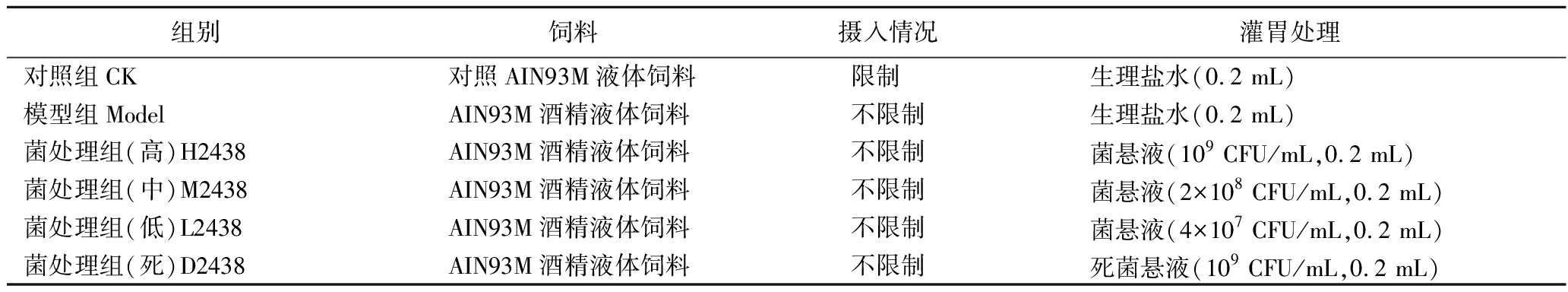
组别饲料摄入情况灌胃处理对照组CK对照AIN93M液体饲料限制 生理盐水(0.2 mL)模型组ModelAIN93M酒精液体饲料不限制生理盐水(0.2 mL)菌处理组(高)H2438AIN93M酒精液体饲料不限制菌悬液(109 CFU/mL,0.2 mL)菌处理组(中)M2438AIN93M酒精液体饲料不限制菌悬液(2×108 CFU/mL,0.2 mL)菌处理组(低)L2438AIN93M酒精液体饲料不限制菌悬液(4×107 CFU/mL,0.2 mL)菌处理组(死)D2438AIN93M酒精液体饲料不限制死菌悬液(109 CFU/mL,0.2 mL)
整个实验周期为7周,第1周为适应期,酒精含量(质量分数)从0、1.6%、2.4%、3.2%上升到4%,之后持续6周后,过夜禁食后进行眼眶取血获取血液样本,取肝脏并称重,血液样本取出后,静置30 min,4 ℃,4 000 r/min离心15 min,取血清。小鼠血清谷草转氨酶(glutamic oxalacetic transaminase,GOT)、谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、肝脏甘油三酯(triglycerides,TG)、谷胱甘肽(glutathione,GSH)含量的测定,严格按照相应试剂盒(北京普利莱基因技术有限公司)说明书的具体操作步骤进行。
1.3.7 菌株生物学特性研究
1.3.7.1 耐酸性实验:
取一定量菌液,4 000 r/min离心10 min后弃上清液。加入相同体积pH=2.5的MRS溶液,吹打混匀后,在37 ℃环境下孵育,用稀释涂布计数法测定0 h及孵育2、4 h后菌数的变化。
1.3.7.2 耐胆盐性实验
取一定量菌液,4 000 r/min离心10 min后弃上清液。加入相同体积的含0.3%(质量分数)胆盐的MRS溶液,吹打混匀后,在37 ℃环境下孵育,用稀释涂布计数法测定0 h及孵育4、8 h后菌数的变化。
1.3.7.3 黏附性实验
菌株培养至对数末期后收集菌液。4 000 r/min离心10 min后,用含10%胎牛血清的DMEM完全培养基重悬,并调整菌液菌数为2×108 CFU/mL。HT29细胞培养后,采用胰酶(含0.02% EDTA,2 500 BAEE units/mL)进行消化,用含10%胎牛血清的DMEM培养基(含青霉素100 U/mL,链霉素100 μg/mL)进行重悬。经细胞计数后,将细胞悬液浓度调整至1×106 cells/mL,接种于已放置细胞爬片的12孔细胞培养板中,37 ℃,5% CO2培养24 h。加入受试菌菌悬液1 mL,37 ℃条件下于CO2培养箱中孵育2 h。孵育结束后,经PBS洗涤3次、甲醇固定后,取出细胞爬片。经革兰氏染色后,用中性树脂封片,光学显微镜下进行观察,每个片子随机选取10个视野计数,每株菌3个重复。
1.3.8 菌株生长曲线
将200 μL的甘油种子液接种于10 mL液体MRS培养基中,37 ℃培养24 h后再将活化的种子液以100 μL接种到10 mL MRS培养基中,分别在0、2、4、6、8、12、14、16、18、20、22、24 h检测菌悬液的OD600 值。
1.4 统计分析
测定指标均表示至少为3次平行实验的平均值±标准偏差。显著性分析采用SPSS 17.0(IBM公司,美国)软件中的Duncan′s多重比较检验法进行分析,显著水平设置为0.05。
2 结果与分析
2.1 菌株分离纯化与鉴定
采用稀释涂布平板法从新疆奶疙瘩样品中分离得到白色圆形菌落的乳酸菌疑似菌株(图1),经革兰氏染色后,为革兰氏阳性菌。经16S DNA鉴定,为发酵粘液乳杆菌,在卫生部2010年颁布的《可用于食品的菌种名单》中。
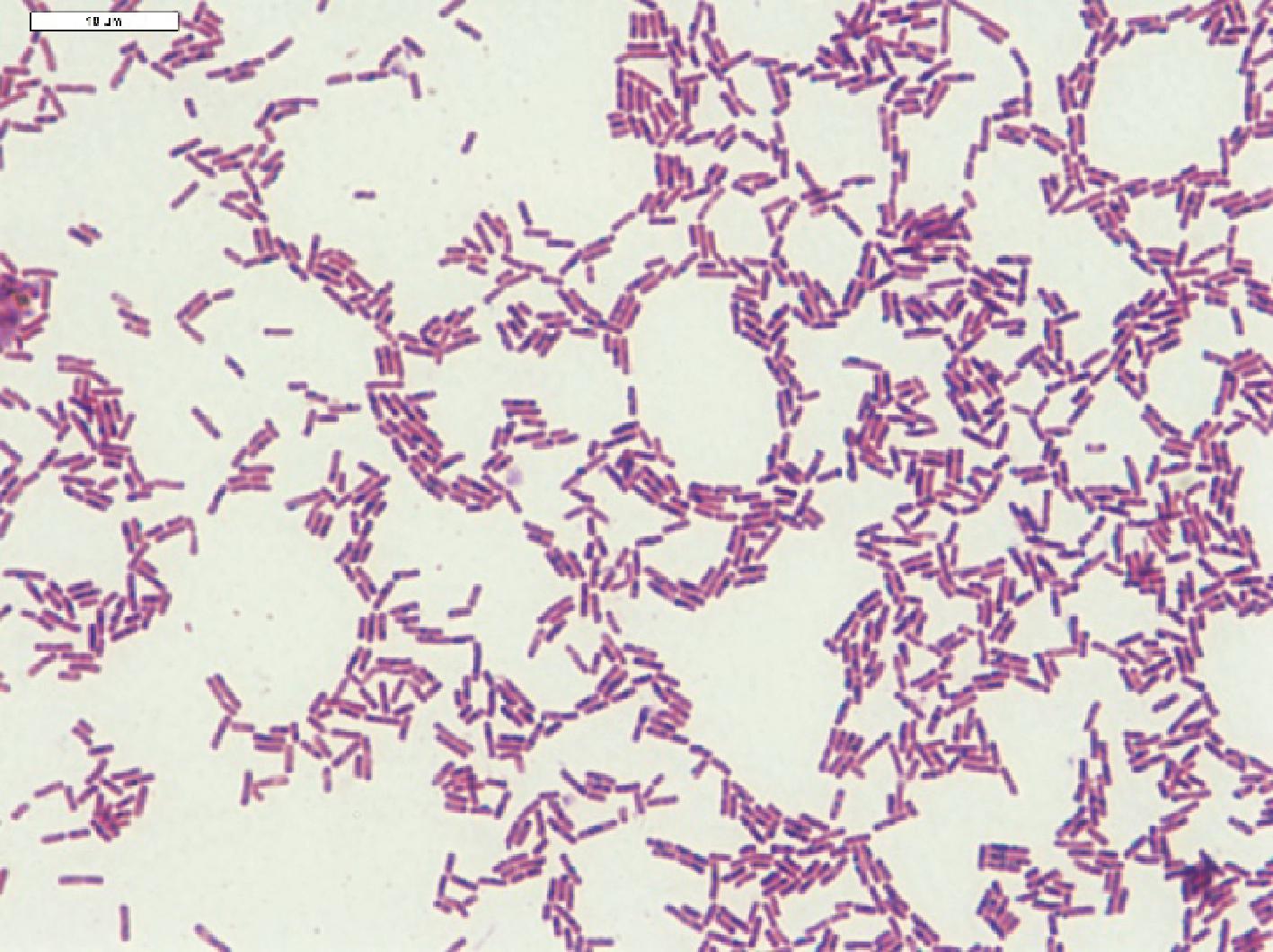
图1 发酵粘液乳杆菌的菌株外观特性
Fig.1 Gram staining and bacterial colony of Limosilactobacillus fermentun
2.2 清除DPPH自由基的能力
DPPH自由基是一种很稳定的人工合成的以氮为中心的自由基,DPPH法是一种极为常见的用于筛选和评价抗氧化效果的有效方法[15]。结果如表2所示,菌株发酵粘液乳杆菌WHH2438菌体相比鼠李糖乳杆菌GG对DPPH自由基有更高的清除效果。
表2 不同菌株对DPPH自由基清除的效果
Table 2 Effects of different bacterial strains on DPPH radical scavenging

菌株 清除率/%对照商业菌LGG24±1.52发酵粘液乳杆菌243852±2.55∗∗∗
注:“***”表示与模型组相比具有显著性差异(P<0.001)(下同)。
2.3 清除羟自由基的能力
羟自由基是活泼性最强、氧化性最大的自由基,对DNA、蛋白质和脂类有较强的结合能力,是引起体内氧化损伤的主要因素[16],所得结果如表3所示,菌株WHH2438的羟自由基清除率为55%,显著优于商业菌株LGG,说明WHH2438在抗氧化能力方面有更优秀的性能。
表3 不同菌株对羟自由基的清除效果
Table 3 Effects of different bacterial strains on hydroxyl radical scavenging

菌株 清除率/%对照商业菌LGG37±3.52发酵粘液乳杆菌243855±4.21∗∗∗
2.4 抑制酒精损伤肠细胞能力
酒精主要由人的胃肠道吸收进入肝脏循环,其中75%~80%由小肠吸收,因此长期饮酒对肠道负担极大,易产生不良影响,损伤肠道黏膜,增加肠穿孔和肠道慢性炎的风险。由表4可知,在发酵粘液乳杆菌WHH2438的存在下,酒精对人结直肠腺癌细胞HT-29的损失明显减弱,细胞存活率上升至(52.50±3.65)%,远高于无益生菌保护的模型组(18±0.61)%,也优于对照商业菌LGG处理的细胞存活率(31.53±4.15)%。
表4 不同菌株抑制酒精损伤肠细胞的能力
Table 4 Ability of different bacterial strains to inhibit alcohol-induced intestinal cell damage

菌株 细胞存活率/%发酵粘液乳杆菌243852.50±3.65a对照商业菌LGG31.53±4.15b模型/不加菌18.46±0.61c
注:a、b、c表示不同组间差异显著(P<0.05)(下同)。
2.5 肠屏障保护功能的能力
肠道中存在阴性革兰氏菌比如大肠杆菌等,能产生对人体产生炎症的脂多糖LPS,通过肠道屏障进入血液抵达肝脏,对肝脏造成炎症损伤。而长期的饮酒会导致肠屏障受到破坏,进一步使肝脏承受更大的炎症损伤。由表5可知,3 h后,发酵粘液乳杆菌2438处理的猪小肠上皮细胞IPEC肠屏障损失率(16.62±2.61)%,远低于无益生菌保护的模型组损失率(44.05±3.25)%,也低于对照商业菌LGG处理的屏障损失率(24.44±3.17)%。
表5 不同菌株的肠屏障保护功能能力
Table 5 Intestinal barrier protective capacity of different bacterial strains
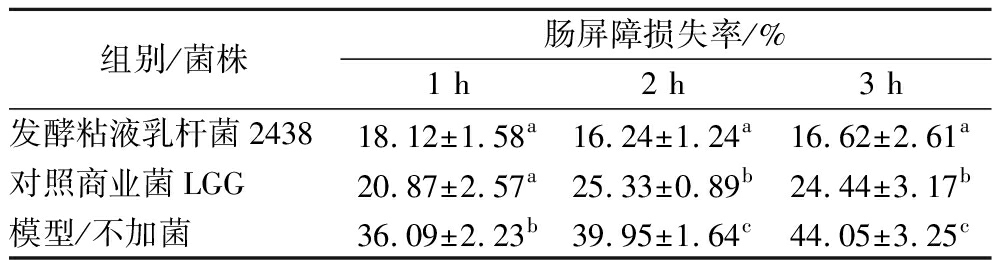
组别/菌株肠屏障损失率/%1 h2 h3 h发酵粘液乳杆菌243818.12±1.58a16.24±1.24a16.62±2.61a对照商业菌LGG20.87±2.57a25.33±0.89b24.44±3.17b模型/不加菌36.09±2.23b39.95±1.64c44.05±3.25c
2.6 缓解酒精性肝损伤功能动物剂量效价实验
本实验的慢性酒精性肝损伤造模方式为目前较为流行的液体酒精饲料喂养法。由表6可知,模型小鼠在肝体比、血清指标、肝脏指标均与对照组有显著的差异(P<0.01),说明模型小鼠的慢性酒精性肝损伤症状明显,模型成立。在益生菌处理组方面,高剂量组和灭活菌组小鼠的肝体比与模型组有显著性差异(P<0.05)。血液指标方面,高剂量组和灭活菌组的谷丙转氨酶和谷草转氨酶有明显的下降,接近对照组水平,相比模型组均有显著性的差异(P<0.05)。肝脏指标方面,高剂量组和死菌组的肝脏指标甘油三脂和还原型谷胱甘肽有显著性下降(P<0.05),说明高剂量组和死菌组有较好的缓解酒精性肝损伤功能。图2的肝脏HE染色切片中也可观察到高剂量组和死菌组的小鼠肝脏中的脂肪颗粒明显比模型小鼠的少很多。
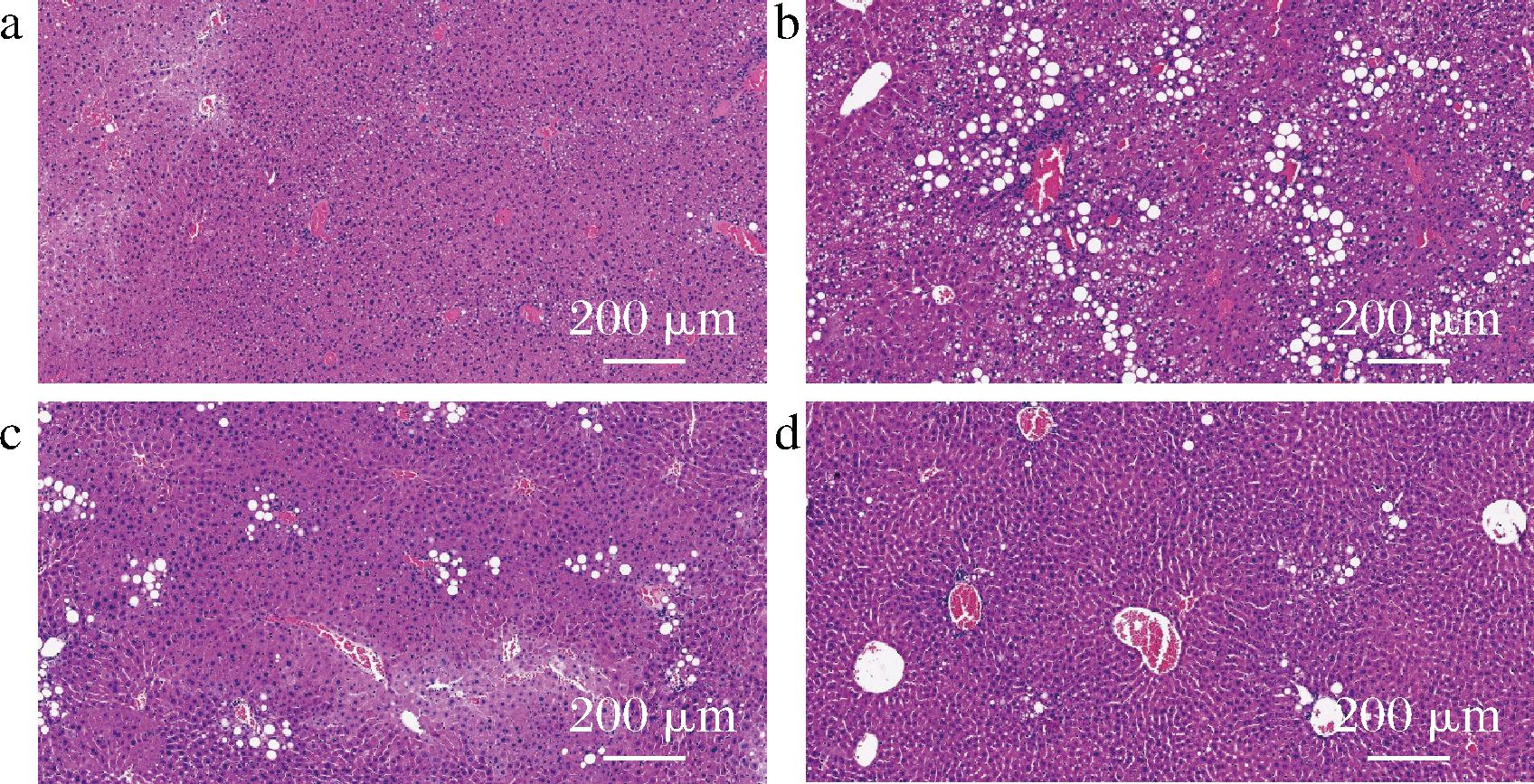
a-对照组;b-模型组;c-H2438;d-D2438
图2 肝脏组织HE染色切片图(×200)
Fig.2 Histological section of liver tissue stained with Hematoxylin and Eosin (H&E) (×200)
表6 动物实验结果
Table 6 Result of animal experiment

组别 肝体比/%血清谷草转氨酶/U血清谷丙转氨酶/U肝脏甘油三酯/(μmol/g)肝脏还原型谷胱甘肽/(μmol/g)对照组3.73±0.28a41.78±4.69a17.17±8.48a32.54±7.74a28.83±2.17a模型组5.68±0.40c83.88±21.16c104.03±35.75c52.25±6.04c37.93±4.97bL24385.27±0.30bc54.81±14.82ab79.59±36.16c45.84±18.49ab38.18±6.06bM24385.58±0.81c64.06±6.08b74.39±23.71bc61.46±21.33c33.30±5.07abH24384.94±0.20b52.86±11.86a40.17±12.44a37.12±6.27ab30.20±4.11aD24384.74±0.59b45.49±10.51ab47.28±14.22ab38.57±9.84ab31.68±3.17a
注:表中a、b、c表示不同组间差异显著(P<0.05),a和ab表示2组之间没有显著性差异(P<0.05),其他字母类同。
2.7 菌株生物学特性研究
2.7.1 菌株酸和胆盐耐受性
胃液pH的大小根据饮食结构不同而波动很大,通常pH为3左右,空腹食用酸性食品可达1.5,食用碱性食品可达4~5,且食物尤其是流食通过胃的时间 相对较短,一般是0~4 h[17]。益生菌被食入后菌体必须通过恶劣的胃液,同时要抵抗来自胰腺的胆汁盐,因此能够抵抗较强的酸性环境是益生菌能在肠道中存活和发挥作用的先决条件。由表7可知,在pH 2.5的酸性环境下孵育4 h后,WHH2438菌数降低0.27数量级,与对照菌LGG相当,其菌数降低了0.3数量级。在0.3%胆盐环境下孵育8 h后,WHH2438菌数降低2.27数量级,优于对照菌LGG,表现出较好的胆盐耐受性。说明菌株WHH2438具有较好的酸和胆盐耐受性,能够在胃肠道严苛的环境下长时间保持较高活性。
表7 WHH2438菌株的酸及胆盐耐受性
Table 7 The acid and salt bile tolerant of the strain WHH2438
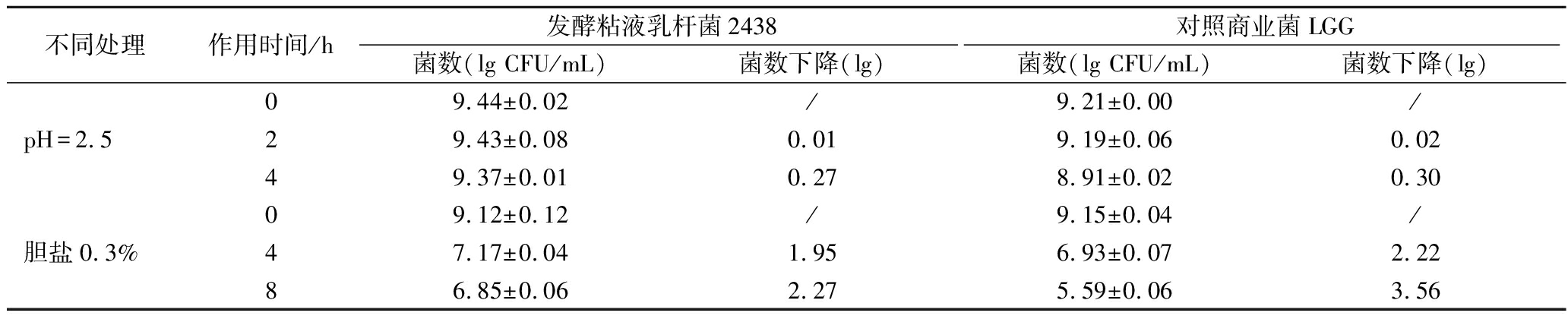
不同处理作用时间/h发酵粘液乳杆菌2438对照商业菌LGG菌数(lg CFU/mL)菌数下降(lg)菌数(lg CFU/mL)菌数下降(lg)09.44±0.02/9.21±0.00/pH=2.529.43±0.080.019.19±0.060.0249.37±0.010.278.91±0.020.3009.12±0.12/9.15±0.04/胆盐0.3%47.17±0.041.956.93±0.072.2286.85±0.062.275.59±0.063.56
2.7.2 菌株黏附性
优秀黏附性的乳酸菌能够黏附肠黏液上层及肠上皮细胞,不易随着肠道蠕动和肠内容物的冲击而消除,有助于其在肠道的长期定植[18]。此外,乳酸菌定植肠道后还能抑制病原菌定植,维持肠道菌群平衡,增强与肠道细胞之间的信号转导和提高机体的免疫力[19]。因而乳酸菌黏附性是评价其作为益生菌的重要标准,菌株WHH2438对人结直肠腺癌细胞HT-29表面的黏附性,结果见表8和图3。由表8可知,菌株WHH2438表现出高黏附能力,每个细胞表面可黏附(7.01±0.65)个菌,显著高于LGG菌株(3.75±0.30,P<0.001),是LGG的1.87倍,说明WHH2438菌株能够黏附于肠道黏膜上皮细胞表面,显示出较高的肠道定植活性。
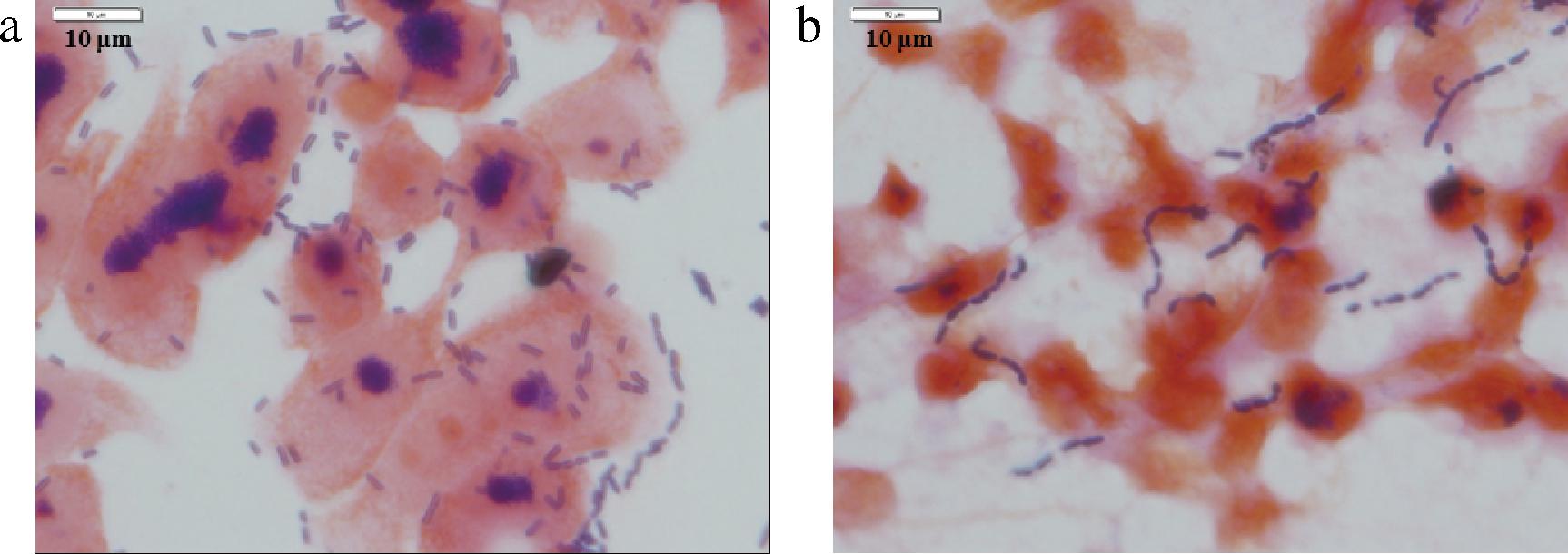
a-发酵粘液乳杆菌2438;b-商业菌LGG
图3 菌株黏附HT-29细胞图(×1 000)
Fig.3 The adhesion of strains to HT-29 cells (×1 000)
表8 不同菌株的黏附性
Table 8 Adhesion ability of different bacterial strains

菌株 黏附率(菌数/细胞数)发酵粘液乳杆菌24387.01±0.65∗∗∗对照商业菌LGG3.75±0.30
2.7.3 菌株生长曲线
细菌生长曲线反映了单细胞微生物在一定环境条件下于液体培养时所表现出的群体生长规律。由图4可知,菌株WHH2438在经历前2~3 h的迟缓期后,菌悬液OD600快速增长,大概在8~10 h间达到峰值进入稳定期。
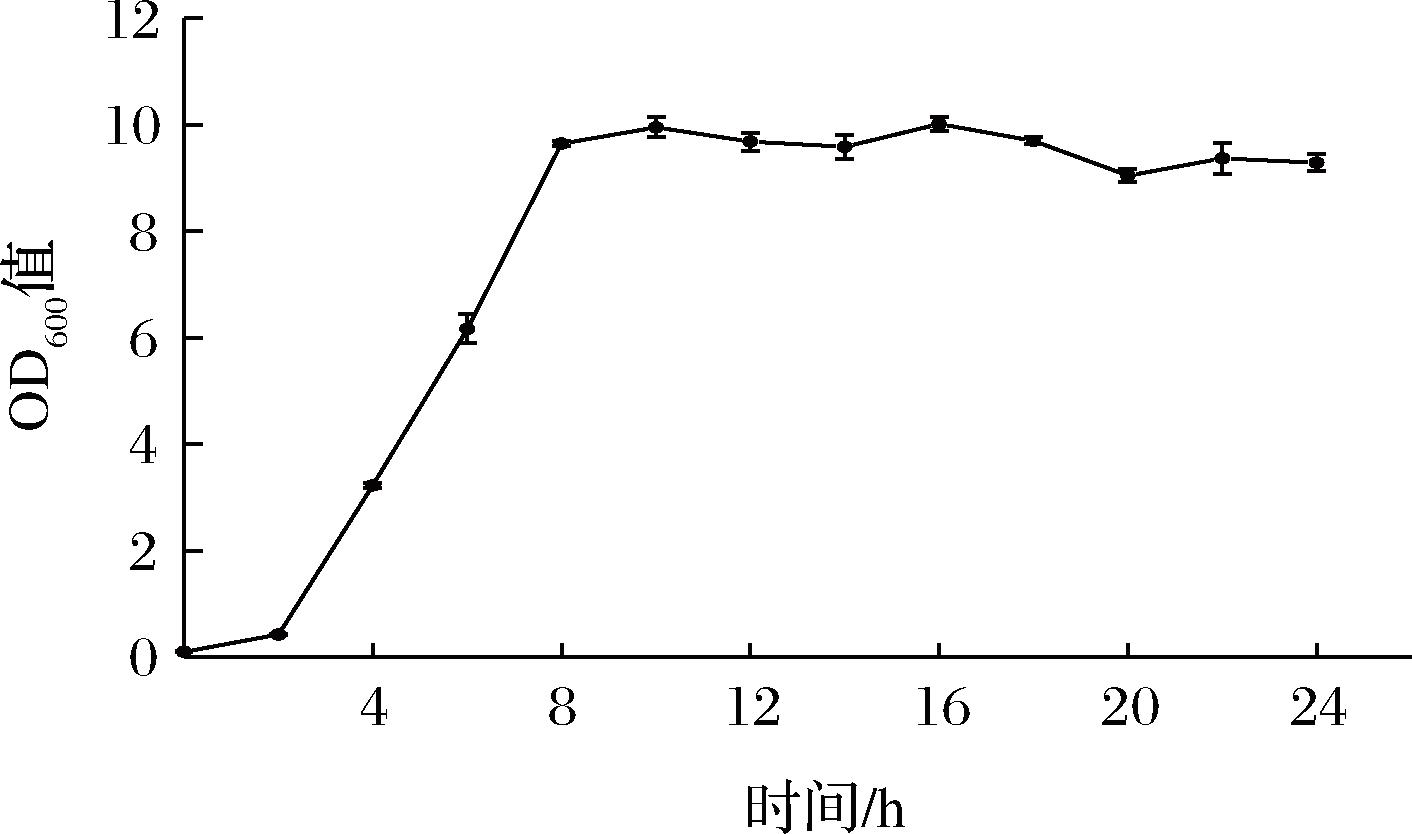
图4 菌株生长曲线
Fig.4 Growth curve of the strain
3 讨论
酒精性肝损伤是由于长期大量饮酒所致的肝脏疾病,乙醇代谢过程中产生的乙醛和自由基对肝脏造成严重的氧化损伤和后续的炎症反应,过多的酒精摄入会导致脂肪肝,积年累月之下,会诱发肝纤维化、肝硬化,甚至最后演化成肝癌。已有研究[20]表明在大鼠酒精性肝损伤模型中,乳酸菌能够降低自由基对肝脏的氧化损伤作用,降低炎症因子的产生,改善肠道菌群平衡,降低肠道黏膜的损伤,最终起到保护肝脏的作用,而乳酸菌正是健康个体肠道菌群的重要组成部分,其在护肝功能方面存在一定的潜力。有文献报道[21],LGG通过减弱肝脏氧化应激、调节肝脏炎症水平、调节肠道屏障等途径,减缓小鼠慢性酒精性肝损伤。本研究以LGG作为阳性菌株对照,对WHH2438进行了抗氧化能力、抑制酒精损伤肠道的能力、肠屏障保护能力以及菌株耐酸、耐胆盐、黏附性等基础特性的相关体外研究。在抗氧化方面,WHH2438的清除DPPH自由基和羟自由基的能力均显著强于LGG。在保护肠道方面,通过进行酒精浓度的调试,建立了相关酒精损伤肠细胞模型和酒精损伤肠屏障模型。从这2个细胞实验结果发现,WHH2438在抑制酒精损伤肠细胞和保护肠屏障方面均有优秀的能力。
本次体内动物功效评价是以C57BL/6 J小黑鼠为实验对象,以食用含酒精液体饲料为造模方法,为期6周的动物实验。该造模优点在于酒精摄取更接近真实,导致小鼠形成慢性酒精性肝损伤。与对照小鼠相比,模型小鼠的肝体比有了明显的上升,说明肝脏有肥大现象,从解剖观察来看,模型小鼠肝脏肥大且有偏白的颗粒,说明有脂肪颗粒堆积现象。从血液指标来看,模型小鼠的谷丙转氨酶和谷草转氨酶有明显上升现象,由于这2种酶主要存在于肝脏细胞中,当血清中这2种酶上升,说明肝脏有了明显的损伤现象。模型小鼠的肝脏指标还原型谷胱氨肽升高,说明机体为了抑制乙醇代谢产生的氧化损伤,应激性地提高了还原型谷胱氨肽水平。因此,模型小鼠的慢性酒精性肝损伤的症状明显,模型较为成功。菌处理组方面,高剂量处理组和菌灭活组均有比较好的缓解酒精性肝损伤功能。高剂量组和灭活菌组的肝体比相比模型组有显著性的下降,血清指标也接近对照组水平。且高剂量组和灭活菌组的肝脏指标中的还原型谷胱氨肽和甘油三酯水平也趋于正常。
乳酸菌在肠道健康中扮演着重要角色,它对胃肠道的耐受性是其发挥生理功能的基本前提。发酵粘液乳杆菌WHH2438不仅具有良好的缓解慢性酒精性肝损伤的功效,并且具有良好的耐酸耐胆盐特性,更有效地进入肠道发挥其益生功效。同时其菌体灭活后依旧有相应功能,有更丰富的产品形式和应用范围。
4 结论
该研究从新疆奶疙瘩样品中分离、筛选、鉴定乳酸菌,并以商业菌株LGG为对照菌株,进行一系列体外功效评价,之后建立慢性酒精性肝损伤小鼠模型,通过血液、肝脏、肝体比等指标的检测,验证菌株缓解酒精性肝损伤的功效,并对优选菌株的耐受性和黏附性、生长曲线进行研究。研究发现,从新疆奶疙瘩样品中分离鉴定出的发酵粘液乳杆菌WHH2438具有优良的抗氧化能力,在酒精破坏肠屏障方面,也有很好的缓解效果。通过进行体内动物剂量效价实验,发现WHH2438高剂量组和灭活组能降低小鼠血清中谷丙转氨酶和谷草转氨酶酶活,降低酒精对肝脏的氧化损伤,具有良好的缓解慢性酒精性肝损伤的功效。对WHH2438进一步研究发现,其具有优良的耐酸、耐胆盐、高黏附性等特性,可顺利进入和定植于肠道,发挥其益生功能。
[1] BARAK A J, BECKENHAUER H C, TUMA D J.Methionine synthase:A possible prime site of the ethanolic lesion in liver[J].Alcohol, 2002, 26(2):65-67.
[2] LOUVET A, MATHURIN P.Alcoholic liver disease:Mechanisms of injury and targeted treatment[J].Nature Reviews Gastroenterology &Hepatology, 2015, 12(4):231-242.
[3] 韩春婵, 蒋永生, 左伟, 等.益生菌对酒精性肝损伤保护作用的研究进展[J].现代实用医学, 2018, 30(3):418-420. HAN C C, JIANG Y S, ZUO W, et al.Research progress on the protective effect of probiotics on alcoholic liver injury[J].Modern Practical Medicine, 2018, 30(3):418-420.
[4] LI F Y, MCCLAIN C J, FENG W K.Microbiome dysbiosis and alcoholic liver disease[J].Liver Research, 2019, 3(3-4):218-226.
[5] KOURKOUMPETIS T, SOOD G.Pathogenesis of alcoholic liver disease:An update[J].Clinics in Liver Disease, 2019, 23(1):71-80.
[6] CEDERBAUM A I.Alcohol metabolism[J].Clinics in Liver Disease, 2012, 16(4):667-685.
[7] CENI E, MELLO T, GALLI A.Pathogenesis of alcoholic liver disease:Role of oxidative metabolism[J].World Journal of Gastroenterology, 2014, 20(47):17756-17772.
[8] NANJI A A, KHETTRY U, SADRZADEH S M H.Lactobacillus feeding reduces endotoxemia and severity of experimental alcoholic liver (disease)[J].Experimental Biology and Medicine, 1994, 205(3):243-247.
[9] MIYAUCHI E, MORITA H, TANABE S.Lactobacillus rhamnosus alleviates intestinal barrier dysfunction in part by increasing expression of zonula occludens-1 and myosin light-chain kinase in vivo[J].Journal of Dairy Science, 2009, 92(6):2400-2408.
[10] SHI X, WEI X L, YIN X M, et al.Hepatic and fecal metabolomic analysis of the effects of Lactobacillus rhamnosus GG on alcoholic fatty liver disease in mice[J].Journal of Proteome Research, 2015, 14(2):1174-1182.
[11] BULL-OTTERSON L, FENG W K, KIRPICH I, et al.Metagenomic analyses of alcohol induced pathogenic alterations in the intestinal microbiome and the effect of Lactobacillus rhamnosus GG treatment[J].PLoS one, 2013, 8(1):e53028.
[12] TIAN X Z, LI R, JIANG Y M, et al.Bifidobacterium breve ATCC15700 pretreatment prevents alcoholic liver disease through modulating gut microbiota in mice exposed to chronic alcohol intake[J].Journal of Functional Foods, 2020, 72:104045.
[13] GAN Y, TONG J, ZHOU X R, et al.Hepatoprotective effect of Lactobacillus plantarum HFY09 on ethanol-induced liver injury in mice[J].Frontiers in Nutrition, 2021, 8:684588.
[14] 陈丽娥, 孙盛, 俞赟霞, 等.西北传统食品中乳酸菌的分离及提高免疫力菌株的筛选[J].中国乳品工业, 2019, 47(10):15-19;33. CHEN L E, SUN S, YU Y X, et al.Immune-enhancing strains identified from traditional food in northwest China[J].China Dairy Industry, 2019, 47(10):15-19;33.
[15] KULLISAAR T, ZILMER M, MIKELSAAR M, et al.Two antioxidative lactobacilli strains as promising probiotics[J].International Journal of Food Microbiology, 2002, 72(3):215-224.
[16] 白明, 孟祥晨.益生菌抗氧化活性及菌体抗氧化相关成分的分析[J].食品与发酵工业, 2009, 35(5):6-11. BAI M, MENG X C.Antioxidative activity of probiotics and their internal correlative antioxidative components[J].Food and Fermentation Industries, 2009, 35(5):6-11.
[17] 熊涛, 刘妍妍, 黄涛, 等.副干酪乳杆菌NCU622耐酸耐胆盐及其黏附性能[J].食品科学, 2015, 36(5):93-98. XIONG T, LIU Y Y, HUANG T, et al.Acid, bile tolerance and adhesion properties of Lactobacillus paracasei NCU622[J].Food Science, 2015, 36(5):93-98.
[18] 胡爱华, 敖晓琳, 陈岑, 等.乳酸菌耐酸耐胆盐机制的研究进展[J].食品工业科技, 2015, 36(8):380-383;389. HU A H, AO X L, CHEN C, et al.Research progress on mechanism of lactic acid bacteria acid and bile salt resistance[J].Science and Technology of Food Industry, 2015, 36(8):380-383;389.
[19] 张英春, 张兰威, 马微.乳酸菌对免疫系统功能的调节作用[J].食品研究与开发, 2003, 24(5):80-82. ZHANG Y C, ZHANG L W, MA W.The regulatory effect of lactic acid bacteria on immune system function[J].Food Research and Development, 2003, 24(5):80-82.
[20] 李慧臻, 史佳鹭, 占萌, 等.乳酸菌缓解酒精性肝病的研究进展[J].食品科学, 2020, 41(7):306-314. LI H Z, SHI J L, ZHAN M, et al.Recent advances in applying lactic acid bacteria for alleviating alcoholic liver disease[J].Food Science, 2020, 41(7):306-314.
[21] ZHANG M, WANG C L, WANG C H, et al.Enhanced AMPK phosphorylation contributes to the beneficial effects of Lactobacillus rhamnosus GG supernatant on chronic-alcohol-induced fatty liver disease[J].The Journal of Nutritional Biochemistry, 2015, 26(4):337-344.