绣球菌又名花椰菜菇、花茸,是一种名贵的食药用菌,营养丰富,味道鲜美,广叶绣球菌(Sparassis latifolia)隶属于担子菌门(Basidiomycota)、蘑菇纲(Agaricomycetes)、多孔菌目(Polyporales)、绣球菌科(Sparassidaceae)、绣球菌属(Sparassis)(Index Fungorum-Names Record),是我国及东亚地区主要的野生和栽培种[1],属于中低温型食用菌,在偏酸性条件下适宜生长,子实体生长发育阶段对光照的需求高于其他食用菌,因此又有“阳光蘑菇”之称[2]。多糖是绣球菌中重要的生物活性成分,以β-葡聚糖为主,占子实体干质量的40%,在食药用菌中位于前列[3]。天然的β-葡聚糖主要有2种存在形式:β-(1→3)-葡聚糖和β-(1→6)-葡聚糖,前者具有广泛的生物学活性。绣球菌富含β-(1→3)-葡聚糖,具有抗氧化性[4]、免疫调节[5]、抗肿瘤[6]、抗菌[7]等功效,开发利用价值极高。目前,广叶绣球菌主要是以人工培育获得子实体食用为目的,多糖的开发利用不足。人工培育子实体需要严格的、特定的条件如光照等,从接种到收获子实体需要约120 d[8],生长周期长、成本高,因此,通过液体发酵培养绣球菌是高效获取多糖的重要途径。绣球菌子实体冻干品中提取的多糖分子质量高达400 kDa,具有溶解困难、黏度大等特点,不利于其提取及活性的发挥[9]。研究发现,多糖的分子质量差异受菌株、不同培养方式[10]、培养条件[11]及提取工艺[12]的影响。分子质量较低的绣球菌多糖具有更好的水溶性和生物活性,能够暴露出更多的还原性末端,提高其抗氧化能力[13]。
绣球菌液体发酵获取低分子质量多糖的研究不多,发酵菌丝体与多糖产量的动态变化规律尚不明确,提取工艺还不完善。本课题组前期通过复合筛选综合评定初步获得一产低分子质量多糖(25 641 Da)的广叶绣球菌发酵菌株XQJ-1[14],为了增加多糖产量,更好的研究多糖结构与活性,本研究对其发酵条件,培养时间、培养基成分(碳源种类及含量、氮源种类及含量及培养基pH)进行优化,通过响应面法优化绣球菌胞内多糖的提取工艺(提取时间、提取次数、液料比、提取温度),以提高绣球菌菌丝体干重,增加胞内多糖的产量和提取效率,为相关研究及绣球菌低分子质量多糖的深度开发提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
绣球菌XQJ-1,本实验室筛选分离获得,经ITS rDNA分子与形态鉴定为广叶绣球菌[14]。
1.1.2 培养基
PDA固体培养基(g/L):马铃薯200,葡萄糖20,琼脂20,pH自然,121 ℃灭菌20 min;
种子液培养基(g/L):葡萄糖200,酵母粉6,KH2PO4 1,MgSO4 1,维生素B1 0.1,pH 4.0,121 ℃灭菌20 min;
基础培养基(g/L):马铃薯200,葡萄糖20,蛋白胨5,KH2PO4 1,MgSO4 1,维生素B1 0.1,121 ℃灭菌20 min。
1.2 仪器与设备
752型紫外可见分光光度计,上海舜宇横平科学仪器有限公司;SIGMA 1-14离心机,希格玛贸易有限公司;DHG 9626A烘箱,上海精宏实验设备有限公司;TG16A-WS离心机,上海卢湘仪离心机仪器有限公司;HZC-250全温振荡培养箱,苏州培英实验设备有限公司;SPX-250生化培养箱,上海龙跃仪器设备有限公司。
1.3 实验方法
1.3.1 液体菌株的制备及初始培养
用接种针在绣球菌XQJ-1菌株斜面上挑取一小块菌株接种到PDA平板培养基上,26 ℃避光培养8 d,待菌丝体铺满培养基,取1.0 cm2菌块置于100 mL液体菌种培养基的250 mL三角瓶中,26 ℃、150 r/min培养6 d,获得液体菌种;以10%(体积分数)的接种量将液体菌种接种于装液量为100 mL/250 mL发酵培养基的三角瓶中,26 ℃、150 r/min培养20 d,获得菌体发酵液。
1.3.2 绣球菌XQJ-1生物量测定
用无菌纱布过滤收集菌丝体,40 ℃烘干24 h至恒质量,用分析天平称重,保留2位小数。将绣球菌XQJ-1菌丝体研磨成粉末备用。
1.3.3 胞内多糖测定
采用热浸法提取胞内多糖,参照游雄等[15]的方法稍作改动。菌丝体粉末以10 mL/g的液料比,加入蒸馏水,95 ℃浸提2次后合并浸提液。浸提液浓缩至原体积的1/4后,加入4倍体积的无水乙醇,在4 ℃醇沉过夜后离心收集沉淀,冷冻干燥,得到粗多糖。配制1 mg/mL粗多糖溶液。采用苯酚-硫酸法绘制葡萄糖标准曲线[16],吸取上述粗多糖溶液2 mL,加入1 mL 5%(体积分数)的苯酚混合,室温静置10 min后,加入浓硫酸5 mL,30 ℃水浴30 min,于紫外分光光度计490 nm处测定吸光度,根据标准曲线计算多糖含量。
1.3.4 培养天数对胞内多糖的影响
按上述1.3.1节的方法培养绣球菌XQJ-1,从第10天开始测定其胞内多糖及菌丝体生物量,共测量至第21天。
1.3.5 培养基成分对胞内多糖的影响
在1.1.2节基础培养基的条件下,按上述1.3.1节的方法培养绣球菌XQJ-1,采用单因素-验证的方法分别考察不同碳源及含量(10、15、20、25、30 g/L)、不同氮源及含量(2、5、8、11、14 g/L)及初始pH值(3、4、5、6)(表1),不同单因素对绣球菌XQJ-1液体发酵胞内多糖及菌丝体干重的影响,每组实验设3个重复。
表1 绣球菌XQJ-1产胞内多糖的条件优化
Table 1 Optimization of intracellular polysaccharide production conditions of Sparassis latifolia XQJ-1

因素 水平碳源可溶性淀粉、葡萄糖、蔗糖氮源牛肉膏、蛋白胨、酵母粉初始pH值3、4、5、6
1.3.6 响应面优化液体发酵绣球菌XQJ-1胞内多糖的提取方法
按1.3.2节方法获得绣球菌XQJ-1菌丝体粉末,采用1.3.3节中的热浸法对其菌丝体多糖进行提取,设置不同的提取次数、提取温度及料液比,其他条件不变。
通过单因素试验确定提取绣球菌XQJ-1胞内多糖的最优水平,采用Design-Expert 8.0.6软件,以液料比、提取时间、提取温度3个因素设计三因素三水平的响应面试验,一共17组方案点,每组设置3个重复,试验因素的水平如表2所示。
表2 Box-Behnken design 实验因素水平
Table 2 Box-Behnken design experimental factors and level

水平因素提取时间/h液料比(mL∶g)提取温度/℃-12207502.53085134095
按1.3.3节的方法计算多糖含量,多糖得率的计算如公式(1)所示:
多糖得率![]()
(1)
1.3.7 数据分析
每组实验3个重复,采用SPSS Statistics 17.0进行方差分析,Origin 9.1绘图软件处理实验数据并绘制图表,数据多重比较采用Tukey法。
2 结果与分析
2.1 培养时间对液体发酵绣球菌XQJ-1产胞内多糖的影响
绣球菌液体发酵21 d,定时取样测定菌丝体干重及胞内多糖的含量。如图1所示,绣球菌XQJ-1生长周期较长,前10 d为生长的迟滞期,大量合成细胞分裂所需要的酶类、ATP及其他细胞成分,菌体生长缓慢;第10~16天进入对数期,菌丝体生物量快速增加;17~18 d时为稳定期,此后由于养分消耗及代谢产物的积累,菌丝体生长停滞甚至出现自溶现象,菌丝体干重逐渐下降。随着菌丝体生物量的变化,胞内多糖也表现先增长后降低的趋势,在16 d达到最大值,随着培养基营养物质的不足,胞内多糖的自我消耗增多,产量不断下降。综合菌丝体干重与胞内多糖的含量变化,第17天收集菌丝体干重最高,且胞内多糖与16 d相比并无显著差异,故选择第17天为液体培养绣球菌XQJ-1的最佳时间。
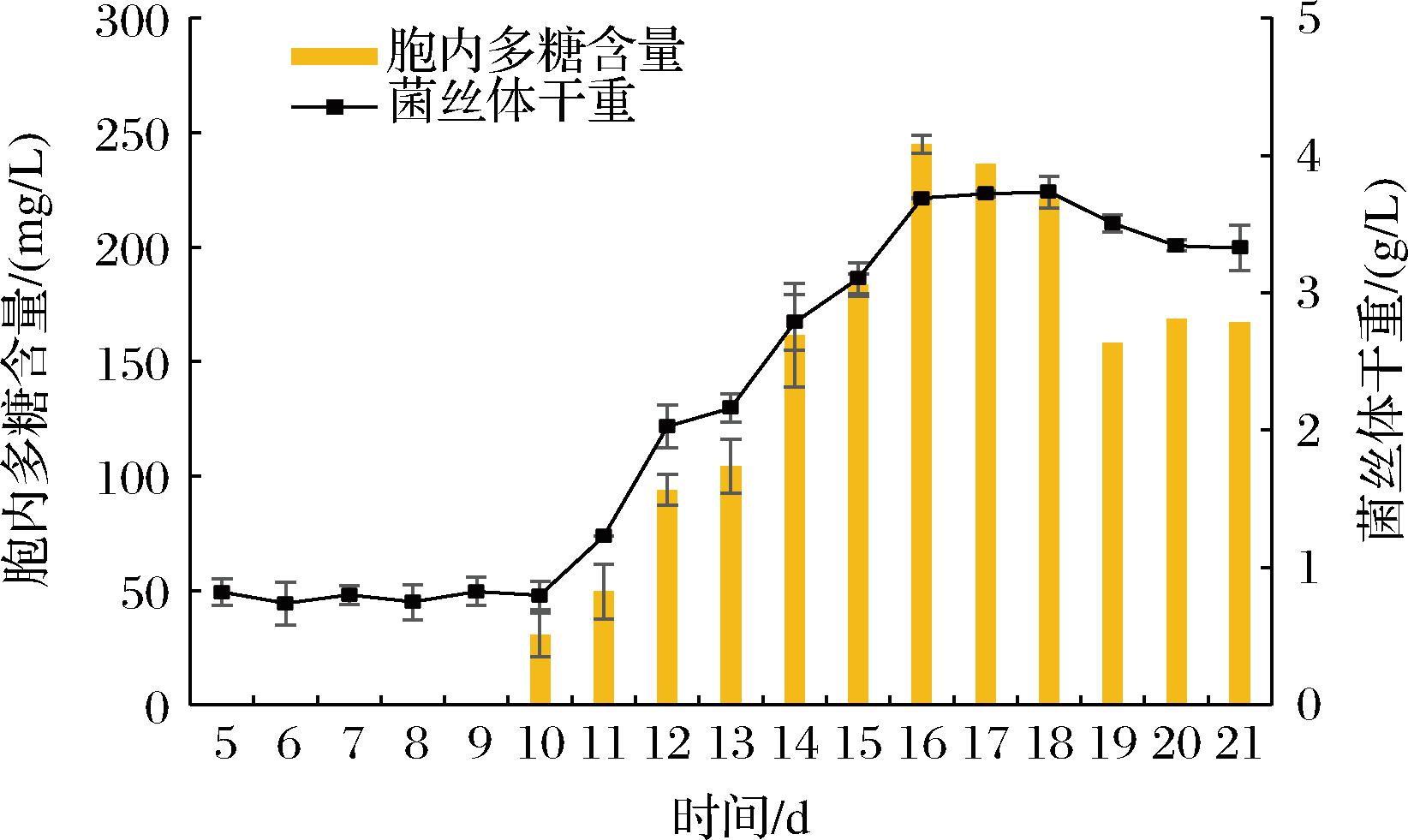
图1 绣球菌XQJ-1液体培养过程中菌丝体干重与 胞内多糖变化情况
Fig.1 Changes of mycelium dry weight and intracellular polysaccharide in liquid culture of Sparassis latifolia XQJ-1
2.2 培养基成分对液体发酵绣球菌XQJ-1产胞内多糖的影响
2.2.1 碳源种类对绣球菌XQJ-1产胞内多糖的影响
分别以葡萄糖、蔗糖、可溶性淀粉为碳源制作培养基,培养基的其他成分保持不变,26 ℃、150 r/min振荡培养17 d。由图2可知,当可溶性淀粉质量浓度为15~25 g/L时,绣球菌菌丝体干重显著高于葡萄糖、蔗糖不同浓度组(P<0.05),因此可溶性淀粉较适合菌丝体的生长。当可溶性淀粉用量为15 g/L时,菌丝体多糖达最大产量为350.78 mg/L。综合考虑多糖产量及成本,后续验证实验中选择15 g/L的可溶性淀粉为培养基的碳源。
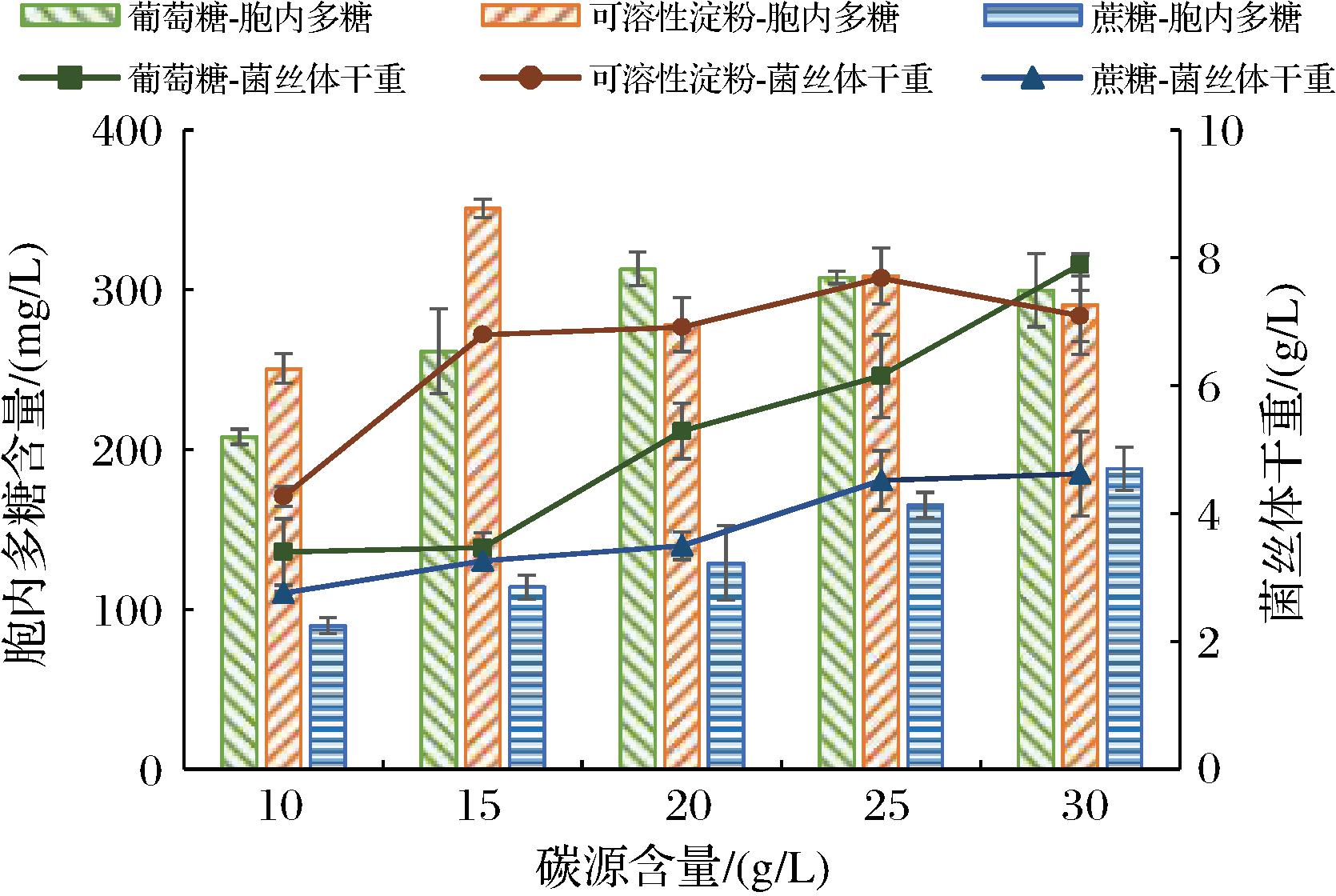
图2 碳源种类及含量对绣球菌XQJ-1液体培养过程中 菌丝体干重与胞内多糖的影响
Fig.2 Effects of carbon source type and content on mycelium dry weight and intracellular polysaccharide in liquid culture of Sparassis latifolia XQJ-1
2.2.2 氮源种类对绣球菌XQJ-1产胞内多糖的影响
在基础培养基中分别选择蛋白胨、酵母粉、牛肉膏为氮源,其他成分保持不变,26 ℃、150 r/min振荡培养17 d。由图3可知,分别以5 g/L和8 g/L的牛肉膏为氮源时,绣球菌菌丝体多糖产量均较高且无显著差异(P>0.05),而选用8 g/L的牛肉膏做氮源时,菌丝体生物量显著高于其他组(P<0.05),因此将8 g/L的牛肉膏作为筛选的氮源。

图3 氮源种类及含量对绣球菌XQJ-1液体培养过程中 菌丝体干重与胞内多糖的影响
Fig.3 Effects of nitrogen source type and content on mycelium dry weight and intracellular polysaccharide in liquid culture of Sparassis latifolia XQJ-1
2.2.3 初始pH对绣球菌XQJ-1产胞内多糖的影响
将培养基的pH值分别调至3、4、5、6,于26 ℃、150 r/min振荡培养17 d。由图4可知,随着pH值的升高,菌丝体干重呈现先增大后减小的趋势,在pH值为5时,有最大干重6.0 g/L,当pH值从3升至5时,菌丝体产量呈上升趋势,但变化幅度不大;当pH值继续增加时,菌丝体产量急剧下降,pH值为7时基本不生长,所以未做检测。胞内多糖也呈现先增加再减少的变化趋势,在初始pH值为5时,胞内多糖产量最高,达到432.65 mg/L,因此选择初始pH值为5进行后续实验。
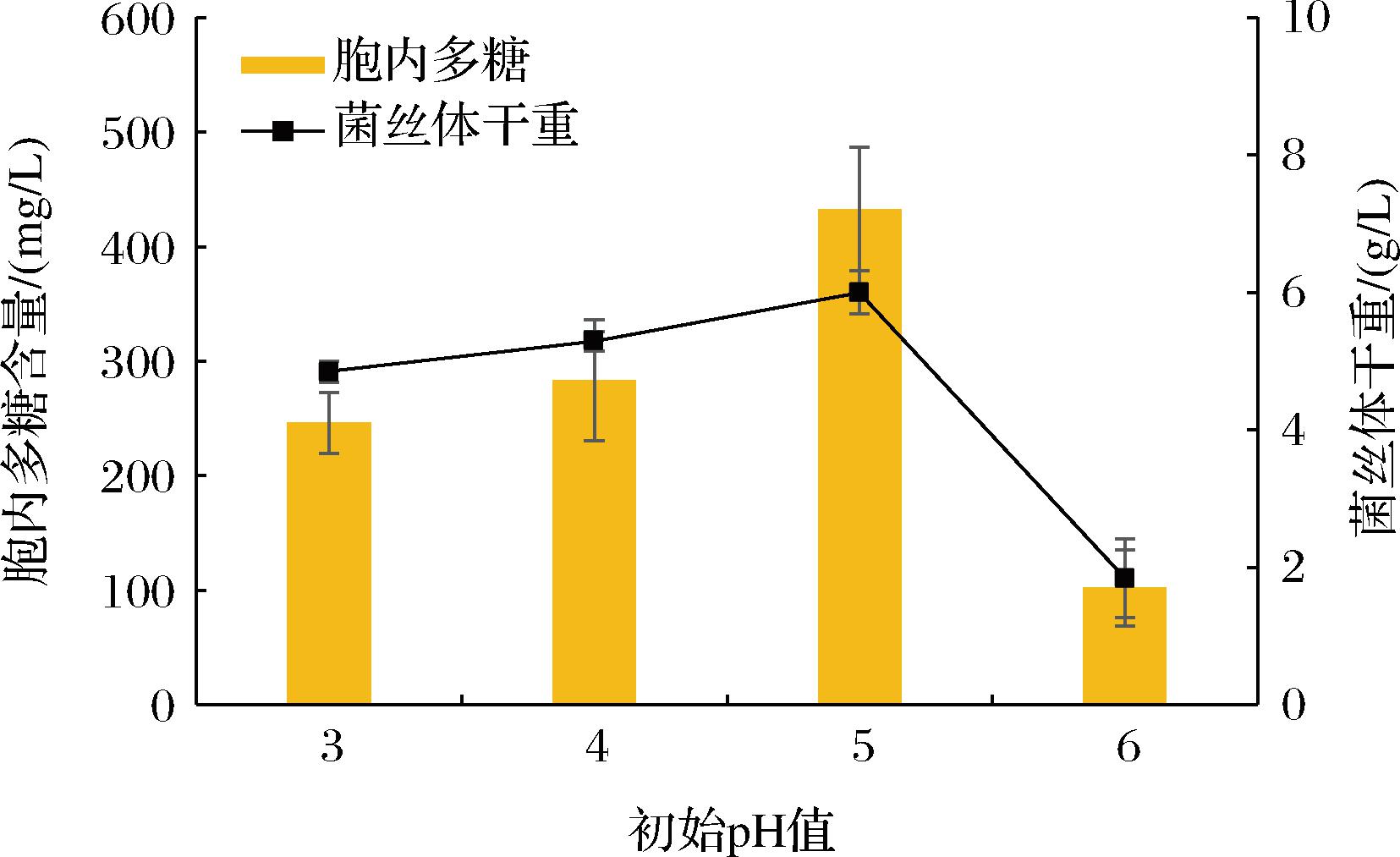
图4 不同初始pH值的培养基对绣球菌XQJ-1液体培养 过程中菌丝体干重与胞内多糖的影响
Fig.4 Effects of different initial pH medium on mycelium dry weight and intracellular polysaccharide in the liquid culture of Sparassis latifolia XQJ-1
综合以上单因素试验结果,优化后的培养基组成(g/L)为:马铃薯200,可溶性淀粉15,牛肉膏8、KH2PO4 1,MgSO4 1,维生素B1 0.1,初始pH值为5。
2.2.4 液体培养绣球菌XQJ-1最适方法验证
按照单因素优化的最适培养基组成,对绣球菌XQJ-1进行液体发酵培养,培养至第17天收集菌丝体,经检测菌丝体干重为(6.03±0.25) g/L,胞内多糖为(433.25±37.46) mg/L,符合实验预期,可以看出该方法重复性较好,可用于后续大批量发酵实验,为绣球菌的产业化发酵培养提供了理论基础。
2.3 响应面优化液体发酵绣球菌XQJ-1胞内多糖的提取方法
2.3.1 提取胞内多糖单因素试验
提取次数:由图5-a可知,随着提取次数的增加,绣球菌菌丝体多糖的得率逐渐增加,但超过2次后得率并无显著性增加(P>0.05),且浸提多次操作繁琐,耗时较长,因此确定在后续实验中浸提次数为2次。提取时间:由图5-b可知,随着浸提时间的增加,绣球菌菌丝体多糖的得率先上升再下降,说明提取时间过长或过短都不利于多糖的提取和释放,提取时间为2.5 h时,多糖得率最大,因此确定2.5 h为最佳提取时间。液料比:由图5-c可知,液料比(mL∶g)从10∶1上升到30∶1的过程中,绣球菌菌丝体多糖得率显著上升,进一步提高液料比后则呈下降趋势,因此确定30∶1为最佳液料比。提取温度:由图5-d可知,随着提取温度升高,多糖得率整体也呈现先上升再下降的趋势,在85 ℃多糖得率最大,因此确定85 ℃为最佳提取温度。
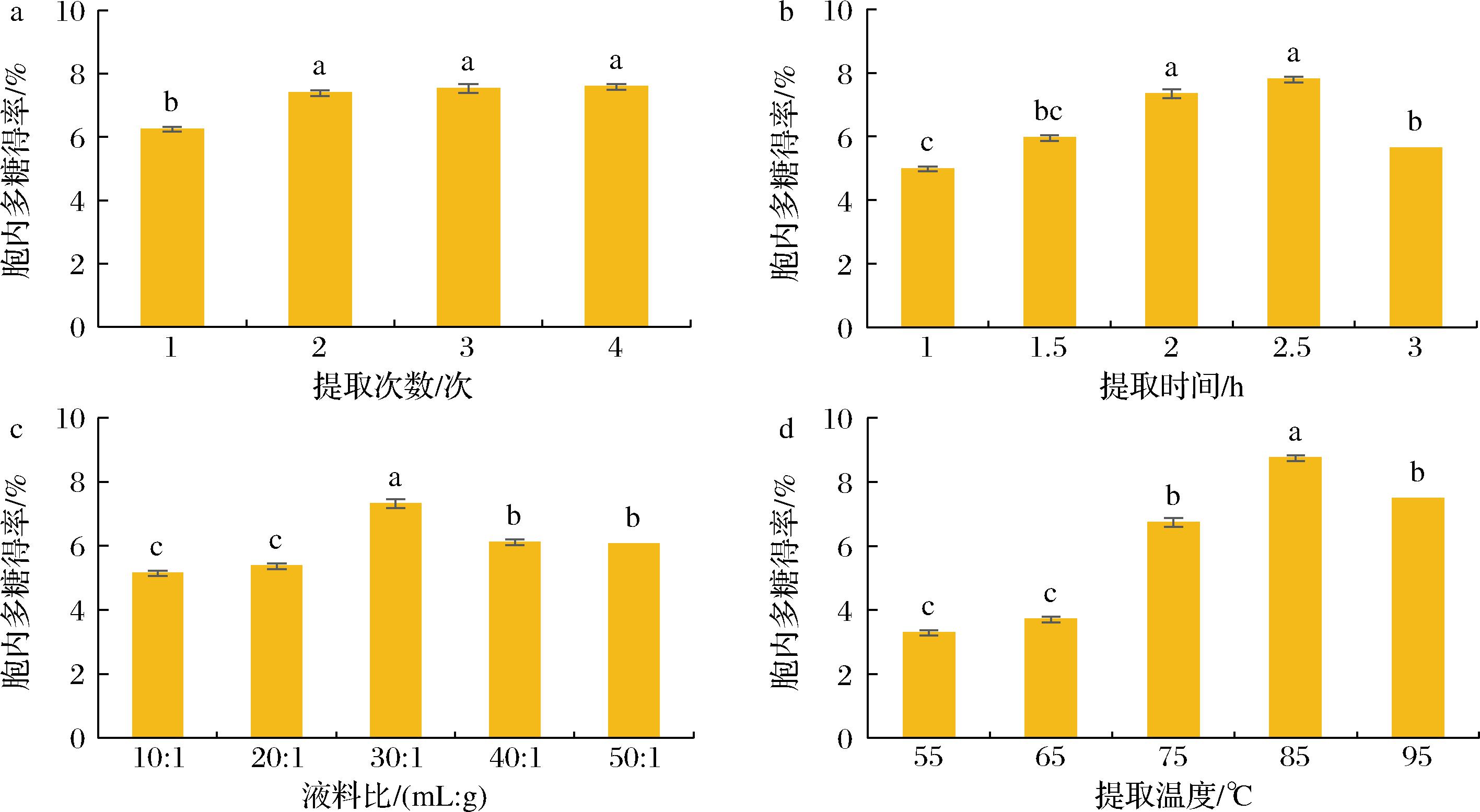
a-提取次数;b-提取时间;c-液料比;d-提取温度
图5 热浸法不同提取条件对多糖得率的影响
Fig.5 Effects of different extraction conditions on the yield of polysaccharide by hot dipping method
注:不同小写字母表示P<0.05时具有显著差异。
2.3.2 响应面法试验设计及结果
在2.3.1节的单因素试验结果的基础上,采用Box-Behnken design中心组合试验原理设计试验,结果见表3。对标中的数据进行多元回归拟合,得到多糖得率与各因素关系为:Y=8.81-0.45A+0.2B+0.75C-0.037AB+0.35AC-0.03BC-0.83A2-0.93B2-0.96C2。
表3 响应面试验设计方案及结果
Table 3 Response surface experimental design and results
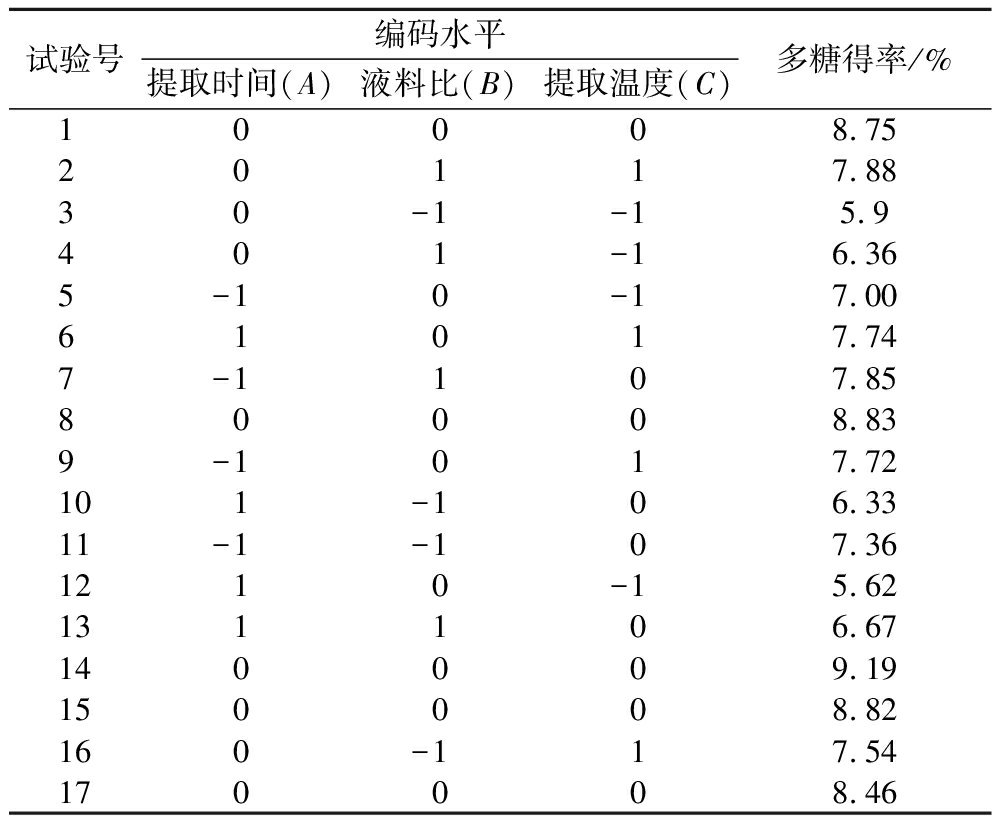
试验号编码水平提取时间(A)液料比(B)提取温度(C)多糖得率/%10008.7520117.8830-1-15.9401-16.365-10-17.0061017.747-1107.8580008.839-1017.72101-106.3311-1-107.361210-15.62131106.67140009.19150008.82160-117.54170008.46
由表4的方差分析结果可得:R2=0.980 2,说明所得回归方程模型极显著(P<0.01),并且模型的失拟项检验不显著(F>0.05),说明该回归方程能够较好反应实际试验情况,可以利用该模型对多糖提取的最佳条件进行预测分析。通过比较回归系数,在一次项中,提取时间A与提取温度C达到极显著水平(P<0.01),液料比B达到显著水平(P<0.05),得到各因素对绣球菌菌丝体多糖得率的顺序为:提取温度C>提取时间A>液料比B。在平方项中,A2、B2及C2的回归系数均极显著(P<0.01),说明提取时间A、液料比B及提取温度C与绣球菌菌丝体多糖得率之间存在着明显的二次关系。在交互项中,只有提取时间与提取温度的交互项AC的回归系数达到显著水平(P<0.05),表明提取时间与提取温度的交互作用对绣球菌菌丝体多糖得率有显著影响。
表4 回归方程的方差分析
Table 4 Analysis of variance of regression model
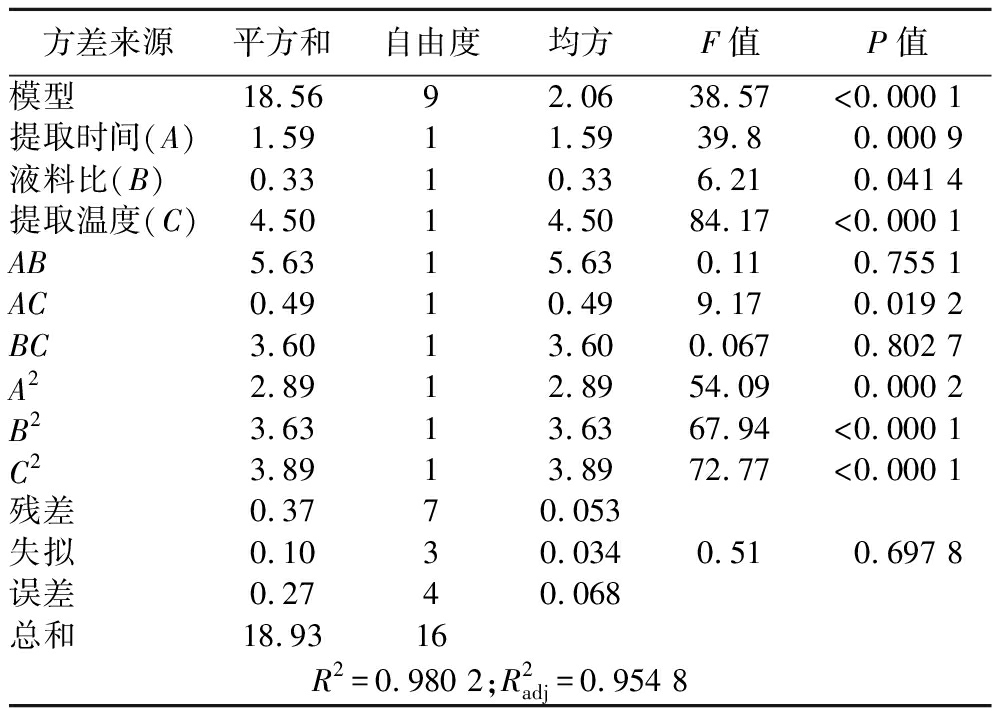
方差来源平方和自由度均方F值P值模型 18.5692.0638.57<0.000 1提取时间(A)1.5911.5939.80.000 9液料比(B)0.3310.336.210.041 4提取温度(C)4.5014.5084.17<0.000 1AB5.6315.630.110.755 1AC0.4910.499.170.019 2BC3.6013.600.0670.802 7A22.8912.8954.090.000 2B23.6313.6367.94<0.000 1C23.8913.8972.77<0.000 1残差 0.3770.053失拟 0.1030.0340.510.697 8误差 0.2740.068总和 18.9316R2=0.980 2;R2adj=0.954 8
3D响应面图(图6)的拟合曲面为凸形,说明多糖存在最大得率,进一步对方程求解,得到的最优提取条件为:提取时间2.4 h,液料比为31.08∶1(mL∶g),温度88.53 ℃,预测得率9.0%。为便于实际操作,将得到的最优条件进行校正,校正后的最优条件为:提取时间2.4 h,液料比31∶1(mL∶g),温度89 ℃。采用校正后的条件进行重复验证实验,实际得率(8.82±0.15)%,与模型预测值偏差2%,说明模型具有良好的拟合性和重复性。
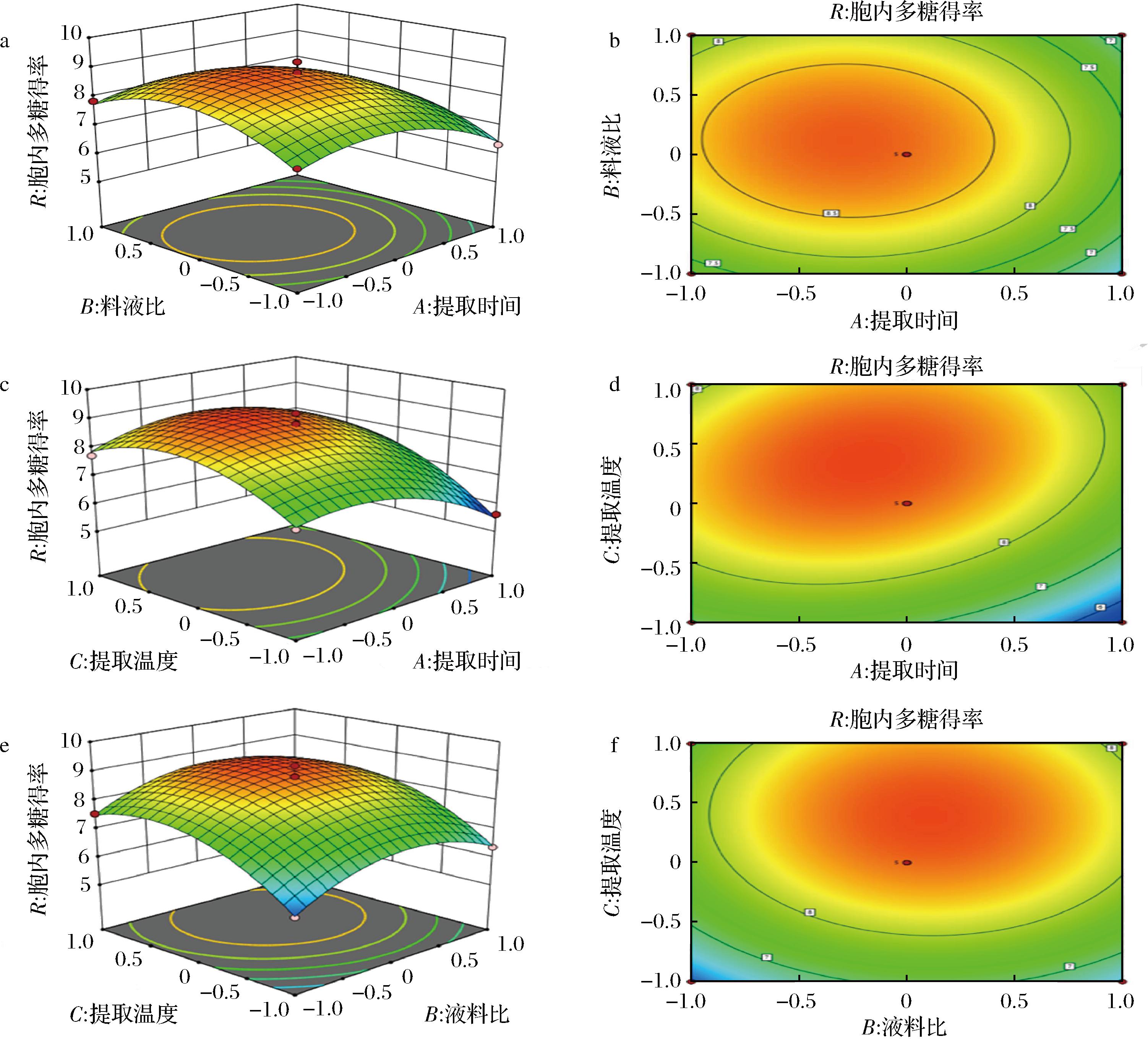
a、c、e为响应面3D图:a-提取时间和液料比;c-提取时间和提取温度;e-液料比和提取温度; b、d、f为响应面等高线图:b-提取时间和液料比;d-提取时间和提取温度;f-液料比和提取温度
图6 各因素间交互作用的响应面3D图及响应面等高线图
Fig.6 Response surface 3D map and response surface contour map of interaction among various factors
3 讨论
目前对液体发酵培养广叶绣球菌及胞内低分子质量多糖的获取研究还不充分,丰富液体发酵广叶绣球菌方法,提高菌丝体干重、胞内多糖的产量和提取效率是非常必要的。本研究发现,广叶绣球菌XQJ-1菌丝体干重与胞内多糖积累趋于同步动态变化,说明协同分析二者的产量和质量十分重要。研究发现绣球菌液体摇瓶发酵通常在15 d达到较高的菌体生物量[17],与本研究(17 d)相近。实验显示绣球菌对碳源利用范围较为广泛,可以较好的利用单糖、二糖和多糖等。以菌丝体干重和菌丝体多糖为指标,本研究筛选得到的最佳碳源是可溶性淀粉,与游雄等[15]的研究结果一致,说明绣球菌对于可溶性淀粉类大分子多糖有更好的利用能力。氮源筛选结果显示,绣球菌对不同氮源的利用效率依次为牛肉膏、蛋白胨、酵母粉。但氮源需求可能因绣球菌来源菌种不同及培养条件差异而发生变化,根据目前已有的研究可以发现绣球菌更倾向于利用成分复杂有机氮源,其中的核苷酸、维生素矿物质元素等可有效促进绣球菌的生长[9-10]。pH会引起微生物细胞膜的通透性和培养基成分的离子状态变化,进而影响胞外酶的活性及菌体生长,调控代谢通路,本研究发现绣球菌生长的最适pH值为5,与KUROSUMI等[18]优化得到绣球菌液体培养的最适条件为pH=5的结果一致,当pH值超过5,绣球菌菌丝体及胞内多糖产量急剧下降,pH值为7时甚至停止生长,说明偏酸性条件有利于菌丝体生物量及多糖的积累。研究表明pH=5时,多糖合成过程中关键酶磷酸葡萄糖变位酶(phosphoglucomutase,PGM)和UDPG焦磷酸化酶(UDP-glucosepyro phosphosphprylase,UGPase)活性最高,有利于多糖的合成[19]。
天然多糖的提取方法包括顺序提取、酸碱提取、酶辅助提取、超声提取等方法,由于酸、碱会造成糖苷键的断裂,而酶解处理又会引入其他蛋白,超声波对多糖的降解程度高,通常这些方法得到的多糖为高分子质量多糖[20-23],本研究则通过热水提醇提取多糖的方法对提取次数、提取时间、液料比、提取温度的响应面工艺优化,发现提取次数为2时,能使多糖最大限度地溶解于热水中,提高低分子质量多糖提取效率。广叶绣球菌XQJ-1多糖提取率随提取时间先增加后降低,ZHANG等[24]的结论中表明提取的时间越长产量越低。液料比对多糖的提取具有一定的影响,液料比的增加促进水向细胞内扩散,利于多糖的溶出,但过高的液料比会导致胞内的杂质易于溶出,不利于多糖提取。崔丽霞等[25]采用响应面法对绣球菌子实体多糖的提取方法进行了优化,在液料比为38.8∶1(mL∶g)的条件下沸水浴提取3 h多糖得率可达9.9%,与本研究的液料比为31∶1(mL∶g)相近。此外,影响多糖溶解度的因素还有提取温度,随着温度的升高,分子运动加快,多糖溶解度上升,但温度过高时,多糖结构易被破坏,造成多糖分解流失,影响其生物活性[26]。本研究通过Box-Behnken设计实验进一步对绣球菌菌丝体多糖的提取方法进行优化,在单因素试验过程中发现当温度超过85 ℃、提取时间超过2.5 h后,菌丝体多糖的得率出现下降趋势,表明温度过高或提取时间过长可能会造成多糖的降解,从而造成得率的下降。在单因素优化中,液料比在30∶1(mL∶g)时有最大多糖得率,说明液料比过高或过低也不利于多糖的提取。在响应面实验中,只有提取时间和提取温度表现出了较好的交互作用,而液料比与其他因素的交互作用不明显,拟合曲面均为凸形说明存在最大值。
目前,对广叶绣球菌多糖的研究一般集中在高分子质量多糖组分上[6],然而由于其黏度高,水溶性差,结构构象复杂,很难通过屏障黏附到细胞表面受体或穿透细胞膜,导致其生物活性有限[27-28]。某些低分子质量多糖,特别是10~100 kDa的多糖,已被证明具有较强的生物活性,如抗氧化能力和抗肿瘤等[29-30]。DUAN等[4]从绣球菌发酵液、菌丝体、子实体中采用碱水提法和热水浸提法提取6种低分子质量多糖,分子质量相似并集中在(30~50 kDa),具有显著的抗氧化能力。此外,通过不同的解聚手段获得的相对低分子质量广叶绣球菌多糖表现出更高的抗氧化活性,尤其在还原力方面,由于低分子质量多糖暴露的还原性末端多,因而比高分子质量多糖的还原性强[10]。同时低分子质量多糖更容易黏附到细胞表面受体或者穿透细胞膜,从而表现出更显著的活性,对研究多糖的药理活性尤为重要。因此,在本研究中,通过对其培养条件及提取工艺进行优化,在最佳培养条件下,采用热水浸提法获得较高广叶绣球菌XQJ-1菌丝体干重、胞内多糖含量及提取效率,并经过对多糖主要组分进行初步鉴定,获得分子质量为25 641 Da的低分子质量多糖,并具有显著的抗结肠癌的能力[14]。
4 结论
本研究对液体发酵的广叶绣球菌的低分子质量多糖培养条件及提取工艺进行优化。单因素优化培养条件,验证结果显示:液体发酵培养基碳源为15 g/L可溶性淀粉,氮源为8 g/L牛肉膏,pH值为5,发酵17 d时,广叶绣球菌XQJ-1的菌丝体干重为(6.03±0.25) g/L,胞内多糖达(433.25±37.46) mg/L,处于较高的优化水平;响应面法对XQJ-1胞内多糖的提取优化表明,提取次数2次,提取时间2.4 h,液料比31∶1(mL∶g),温度89 ℃时,胞内多糖得率为(8.82±0.15)%,较优化前(6.24%)提高了41.3%,达到较高的提取效率。为广叶绣球菌进一步开发利用提供参考。
[1] DAI Y C, WANG Z, BINDER M, et al.Phylogeny and a new species of Sparassis (Polyporales, Basidiomycota):Evidence from mitochondrial atp6, nuclear rDNA and rpb2 genes[J].Mycologia, 2006, 98(4):584-592.
[2] 王斌, 桑亚姣, 张腾霄, 等.绣球菌化学成分、人工栽培和液体发酵研究进展[J].黑龙江八一农垦大学学报, 2022, 34(4):59-64. WANG B, SANG Y J, ZHANG T X, et al.Advances on chemical components, artificial cultivation and liquid fermentation of Sparassis crispa[J].Journal of Heilongjiang Bayi Agricultural Land Reclamation University, 2022, 34(4):59-64.
[3] 廉添添, 杨涛, 孙军德, 等.人工栽培绣球菌的鉴定及其子实体β-葡聚糖含量的酶法测定[J].菌物学报, 2014, 33(2):254-261. LIAN T T, YANG T, SNN J D, et al.Molecular identification of cultivated Sparassis species and determination of β-glucan content of the fruiting body by using enzymatic method[J].Mycosystema, 2014, 33(2):254-261.
[4] DUAN G L, YU X B.Isolation, purification, characterization, and antioxidant activity of low-molecular-weight polysaccharides from Sparassis latifolia[J].International Journal of Biological Macromolecules, 2019, 137:1112-1120.
[5] OHNO N, NAMEDA S, HARADA T, et al.Immunomodulating activity of a β-glucan preparation, SCG, extracted from a culinary-medicinal mushroom, Sparassis crispa Wulf.:Fr.(Aphyllophoromycetideae), and application to cancer patients[J].International Journal of Medicinal Mushroom, 2003, 5(4):359-368.
[6] OHNO N, MIURA N N, NAKAJIMA M, et al.Antitumor 1, 3-β-glucan from cultured fruit body of Sparassis crispa[J].Biological &Pharmaceutical Bulletin,2000, 23(7):866-872.
[7] NIAZI A R, IJAZ H.Proximate analysis and in vitro biological activities of cauliflower mushroom, Sparassis crispa (Agaricomycetes), from Pakistan[J].International Journal of Medicinal Mushroom, 2021, 23(2):79-84.
[8] 林衍铨, 马璐, 江晓凌, 等.绣球菌栽培条件优化[J].食用菌学报, 2012, 19(4):35-37. LIN Y Q, MA L, JIANG X L, et al.Optimization of selected growth parameters for Sparassis crispa[J].Acta Edulis Fungi, 2012, 19(4):35-37.
[9] 张迪, 王宏雨, 林衍铨.绣球菌多糖超声波修饰条件的响应面优化[J].中国食用菌, 2018, 37(2):47-50;55. ZHANG D, WANG H Y, LIN Y Q.Response surface optimization of ultrasonic modified conditions of polysaccharide from Sparassis latifolia[J].Edible Fungi of China, 2018, 37(2):47-50;55.
[10] WU L R, SUN H Q, HAO Y L, et al.Chemical structure and inhibition on α-glucosidase of the polysaccharides from Cordyceps militaris with different developmental stages[J].International Journal of Biological Macromolecules, 2020, 148:722-736.
[11] ZENG P J, LI J, CHEN Y L, et al.The structures and biological functions of polysaccharides from traditional Chinese herbs[J].Progress in Molecular Biology and Translational Science, 2019, 163:423-444.
[12] SUN Y J, HOU S T, SONG S, et al.Impact of acidic, water and alkaline extraction on structural features, antioxidant activities of Laminaria japonica polysaccharides[J].International Journal of Biological Macromolecules, 2018, 112:985-995.
[13] ZHANG Z F, SONG T T, CAI W M, et al.Effects of different depolymerisation methods on the physicochemical and antioxidant properties of polysaccharides derived from Sparassis latifolia[J].Process Biochemistry, 2021, 110:110-117.
[14] 高苏. 绣球菌发酵多糖的结构和活性分析[D].北京:北京林业大学, 2021. GAO S.Structure and activity analysis of polysaccharide from Sparassis latifolia fermentation[D].Beijing:Beijing Forestry Univercity, 2021.
[15] 游雄, 钱秀萍, 吴丽燕, 等.绣球菌的诱变育种和深层发酵工艺的初步研究[J].中国食用菌, 2006, 25(3):41-45. YOU X, QIAN X P, WU L Y, et al.The primary study of induced mutation breeding and submerged liquid fermentation of Sparassis crispa[J].Edible Fungi of China, 2006, 25(3):41-45.
[16] 刘朋肖, 魏薇, 刘警鞠, 等. 蛹虫草液体发酵产多糖的条件优化[J]. 菌物研究, 2023, 21(4):304-311. LIU P X, WEI W, LIU J J, et al. The optimistic conditions of Cordyceps militaris polysaccharide production in liquid fermentation[J]. Journal of Fungal Research, 2023, 21(4):304-311.
[17] MA L, LIN Y Q, YANG C, et al.Production of liquid spawn of an edible mushroom, Sparassis latifolia by submerged fermentation and mycelial growth on pine wood sawdust[J].Scientia Horticulturae, 2016, 209:22-30.
[18] KUROSUMI A, KOBAYASI F, MTUI G, et al.Development of optimal culture method of Sparassis crispa mycelia and a new extraction method of antineoplastic constituent[J].Biochemical Engineering Journal, 2006, 30(1):109-113.
[19] 谈梦飞, 高谦, 王建梓, 等.pH值对普鲁兰多糖发酵的影响及其机理分析[J].食品研究与开发, 2018, 39(5):89-94. TAN M F, GAO Q, WANG J Z, et al.Mechanism analysis and influence of pH on Pullulan fermentation[J].Food Research and Development, 2018, 39(5):89-94.
[20] ROZI P, ABUDUWAILI A, MUTAILIFU P, et al.Sequential extraction, characterization and antioxidant activity of polysaccharides from Fritillaria pallidiflora Schrenk[J].International Journal of Biological Macromolecules, 2019, 131:97-106.
[21] LEE J H, KIM H H, KO J Y, et al.Rapid preparation of functional polysaccharides from Pyropia yezoensis by microwave-assistant rapid enzyme digest system[J].Carbohydrate Polymers, 2016, 153:512-517.
[22] CHO Y J, GETACHEW A T, SARAVANA P S, et al.Optimization and characterization of polysaccharides extraction from Giant African snail (Achatina fulica) using pressurized hot water extraction (PHWE)[J].Bioactive Carbohydrates and Dietary Fibre, 2019, 18:100179.
[23] JIN M L, ZHAO K, HUANG Q S, et al.Isolation, structure and bioactivities of the polysaccharides from Angelica sinensis (Oliv.) Diels:A review[J].Carbohydrate Polymer, 2012, 89(3):713-722.
[24] ZHANG Z F, LYU G Y, JIANG X, et al.Extraction optimization and biological properties of a polysaccharide isolated from Gleoestereum incarnatum[J].Carbohydrate Polymer, 2015, 117:185-191.
[25] 崔丽霞, 张莹, 郑义.绣球菌多糖的提取工艺优化及其抗氧化作用[J].食品工业, 2013, 34(6):24-28. CUI L X, ZHANG Y, ZHENG Y.Optimization of extraction and antioxidant activities of polysaccharides from Sparassis crispa[J].The Food Industry, 2013, 34(6):24-28.
[26] 罗巅辉, 张泽彤.亚高山绣球菌多糖的提取优化、结构表征和抗炎作用[J].天然产物研究与开发, 2022, 34(7):1110-1118. LUO D H, ZHANG Z T.Extraction optimization, structure characterization and anti-inflammatory activity of polysaccharides from Sparassis subalpina[J].Natural Product Research and Development, 2022, 34(7):1 110-1 118.
[27] SUN L Q, WANG C H, SHI Q J, et al.Preparation of different molecular weight polysaccharides from Porphyridium cruentum and their antioxidant activitiea[J].International Journal of Biological Macromolecules, 2009, 45(1):42-47.
[28] LIU W, WANG H Y, PANG X B, et al.Characterization and antioxidant activity of two low-molecular-weight polysaccharides purified from the fruiting bodies of Ganoderma lucidum[J].International Journal of Biological Macromolecules, 2010, 46(4):451-457.
[29] LIU C, DAI K Y, JI H Y, et al.Structural characterization of a low molecular weight Bletilla striata polysaccharide and antitumor activity on H22 tumor-bearing mice[J].International Journal of Biological Macromolecules, 2022, 205:553-562.
[30] DONG X D, LIU Y N, YU S S, et al.Extraction, optimization, and biological activities of a low molecular weight polysaccharide from Platycodon grandiflorus[J].Industrial Crops and Products, 2021, 165:113427.