幽门螺杆菌(Helicobacter pylori)是一种常见的革兰氏阴性致病细菌。作为一种在世界范围内传播的感染菌,H.pylori感染了世界上约50%的人口[1]。H.pylori的广泛传播与其传播途径密不可分,H.pylori可通过口口、粪口和胃口途径在人与人之间传播[2]。H.pylori可以适应胃中恶劣的酸性环境,并可与宿主细胞受体相互作用以定殖胃黏膜[3];定殖后,H.pylori通过形成生物膜、干扰宿主代谢途径、诱导神经免疫串扰及扰乱胃屏障稳态等方式来提高其在胃内的生存能力,实现长久、稳定的定殖[4]。H.pylori与许多胃肠道疾病的发展密切相关,几乎所有H.pylori感染者都有不同程度的胃炎,随着时间的推移,胃炎则可能会发展为更严重的症状。研究表明,25%~30%的H.pylori感染者会由普通的感染发展为消化不良、消化性溃疡甚至是胃癌等胃肠道疾病[5]。
根除H.pylori感染具有重要意义。目前常见的H.pylori治疗方式是三联疗法和四联疗法,这2种疗法的H.pylori医学根除成功率可以达到70%~95%[6]。然而,由于抗生素耐药性的增加,这一比率一直在下降,且因为抗生素耐药性,药物治疗不能被长期使用。此外,药物治疗存在着严重的副作用,如抗生素治疗(特别是反复、长期使用抗生素)会严重扰乱肠道微生态环境。因此,需要更加有效、温和的治疗方案来控制H.pylori。
益生菌是对人体健康有益的微生物。大量基础和临床研究证明,益生菌是根除H.pylori和减少药物副作用的替代或辅助治疗方法[7]。后生元是对宿主健康有益的无生命微生物或其成分[8]。研究表明,后生元具有调节免疫、抗炎、抗氧化和抗癌等作用,使用后生元来治疗和预防疾病是一种新颖、有效的策略[9]。在益生菌根除H.pylori的报道中,有研究表明来自于益生菌的后生元发挥了重要的抗H.pylori作用[10]。同时,相比于益生菌,后生元作为非活成分,对人体具有更高的安全性[11]。使用后生元根除H.pylori感染可能是一种非常好的H.pylori治疗方案。
卷曲乳杆菌CCFM1118已经被证实具有缓解H.pylori感染的作用[12],本研究对来自卷曲乳杆菌CCFM1118的后生元——1118-Inactivated Bacteria(CCFM1118-IB)进行体外及临床测评,评价其对H.pylori感染的保护作用。
1.1.1 菌株与细胞
卷曲乳杆菌CCFM1118,江南大学食品学院食品生物技术中心菌种保藏库。细胞试验所采用的细胞为人胃腺癌(AGS)细胞,中国科学院上海细胞库。H.pylori菌株为国际常用的H.pylori研究用菌株H.pylori SS1。
1.1.2 主要试剂
F-12液体培养基、胎牛血清、胰酶,美国Gibco公司;苯酚红、尿素,国药集团化学试剂公司;脑心浸出液肉汤(brain-heart infusion, BHI)培养基、哥伦比亚血琼脂基础培养基,青岛海博生物技术有限公司;细胞白介素-8(interleukin-8,IL-8)、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA检测试剂盒及无菌脱纤维绵羊血,南京森贝伽公司;PGⅠ及PGⅡ ELISA检测试剂盒,上海酶联生物科技有限公司;超薄琼脂糖凝胶纯化回收试剂盒、细菌基因组提取试剂盒,北京天根生化科技有限公司。
1.1.3 仪器与设备
EL204分析天平、FE20 pH计,上海梅特勒-托利多公司;MULTISCAN GO全波长多功能自动酶标仪、i160三气培养箱,美国Thermo fisher公司;SW-CJ-1FD超净工作台,苏州安泰公司;GRP-9080恒温恒湿培养箱、DK-8D电热恒温水浴锅,上海森信公司;TOMY SX-700全自动高压灭菌锅,上海鼎谦生物公司。
1.2.1 实验菌体的制备与细胞培养
卷曲乳杆菌CCFM1118在MRS培养基中活化3代。将乳杆菌菌液离心得菌体用于后续实验。体外实验所用的后生元为乳杆菌菌体热杀灭所得,热杀灭条件65 ℃,30 min。在含有体积分数5%胎牛血清的BHI培养基中培养H.pylor,活化3代后,将H.pylori菌液离心,得到H.pylori菌体用于后续实验;H.pylori培养均是在三气培养箱中按85% N2、10% CO2、5% O2(均为体积分数)及37 ℃条件培养。
取冷冻的AGS细胞解冻(37 ℃,1 min),解冻后用4 mL F-12完全培养基[V(F-12培养基)∶V(胎牛血清)∶V(双抗)=89∶10∶1]重悬,1 000×g离心5 min,弃上清液,将细胞沉淀用F-12完全培养基重悬,37 ℃,5% CO2条件下培养。当细胞贴壁率达到80%面积比时,用0.25%的胰酶消化液消化(37 ℃,5 min),按1份培养好的细胞均等分为3份传代。
1.2.2 菌株共聚集能力测定
菌株共聚集实验参考HOLZ等[13]的方法进行:将乳杆菌与H.pylori分别用无菌PBS洗涤2次,人工胃液重悬,调整菌体终浓度至1×109 CFU/mL,取等体积乳杆菌菌悬液和H.pylori菌悬液混匀,置于37 ℃孵育2 h。同时做只有乳杆菌或只有H.pylori的对照。从最上层吸取200 μL液体,测定OD600nm。乳杆菌与H.pylori的共聚集能力的计算如公式(1)所示,相对共聚集能力为2株菌株共聚集能力之比。
共聚集能力![]()
(1)
1.2.3 细胞黏附实验
参考张美怡等[14]的方法进行:将AGS细胞接种于96孔板中培养(2×104个细胞/孔),待细胞贴壁后用无菌PBS洗涤3次,加入F-12培养基重悬的H.pylori菌悬液共培养2 h;之后再以无菌PBS洗涤3次,加入F-12培养基重悬的乳杆菌菌悬液共培养,2 h后洗涤3次,加入200 μL尿素酶指示剂培养3 h;培养完成后测定体系OD550nm。
1.2.4 抑菌圈实验
对张美怡等[14]的方法做一定调整:取活化后的CCFM1118培养液,离心分离上清液及菌体沉淀,其中上清液再以0.22 μm的无菌滤膜过滤备用。将活化后的H.pylori菌悬液浓度调整为108 CFU/mL,取100 μL涂布在含有体积分数7.5%无菌脱纤维绵羊血的哥伦比亚血平板上,放上并轻压牛津杯,加入150 μL乳杆菌发酵上清液,以MRS培养基为阴性对照,培养96 h,测定抑菌圈直径。同时取离心后的乳杆菌沉淀,生理盐水重悬(菌体浓度为109 CFU/mL),热杀灭,以上清液相同的方式做菌体抑菌效果,生理盐水为对照。实验以一株具有抑制H.pylori生长效果的益生菌鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG,LGG)为阳性对照[14]。
1.3.1 试验设计及干预
本研究的临床试验于上海长海医院进行,临床伦理批号CHEC2021-099,所有受试者均在研究开始前已签署知情同意书。招募人员为入组一个月内(实验正式开始前)经过13C尿素呼气实验(urea breath test,UBT)诊断为H.pylori感染,且未进行过H.pylori根除治疗的患者。受试者不可存在其他胃肠道疾病且参与期间不服用益生菌相关食品。实验设计为双盲型、随机对照实验。实验共招募符合条件的受试者55名,通过计算机产生的随机数字序列随机分为2组,益生菌服用组35人,安慰剂组20人。
本研究所使用的益生菌菌粉产品规格为2 g每袋,其中卷曲乳杆菌CCFM1118为灭活菌,菌数为5×109 CFU/袋;益生菌服用方式为温水(水温≤37 ℃)冲服,1条/次,2次/d,干预30 d。安慰剂采用麦芽糊精。
1.3.2 样品采集与检测
入组受试者在实验开始前一天登记及结束后一天复查。在登记及复查时,由长海医院相关人员对受试者进行13C-UBT检测,并采集受试者血清、粪便样本。
1.3.2.1 13C-UBT呼气值分析
分析益生菌产品干预前后的呼气值变化,超基准值(delta over baseline,DOB)、降低率的计算如公式(2)、公式(3)所示:
变化值(ΔDOB)=受试后呼气值-受试前呼气值
(2)
变化率![]()
(3)
1.3.2.2 血清生化指标及细胞因子的检测
血清样品用于测定IL-6、IL-8、TNF-α、PGⅠ及PGⅡ,检测方法参照试剂盒说明书。同时取80 μL血清加入120 μL无菌生理盐水稀释2.5倍,由BS-480全自动生化分析仪检测血清谷草转氨酶(aspartate aminotransferase,AST)、C反应蛋白、碱性磷酸酶及谷丙转氨酶(alanine aminotransferase,ALT)的酶活力或水平。
1.3.2.3 肠道菌群测定
菌群测序方法参考张华月[15]的方法:称取粪便样品,按试剂盒说明书方法提取粪便中细菌总DNA并进行16S rDNA的V3~V4区扩增。00分离扩增产物并回收、纯化。测量样品的DNA浓度,等量混合,构建文库,利用Illumina Miseq进行高通量测序。使用QIIME 2分析下机数据。根据DADA2法去噪去嵌合,利用最小样品深度计算样品多样性,并对样品中的物种进行分类注释。
数据采用SPSS 26.0和GraphPad Prism 9.5进行分析,计量数据表示为“平均值±标准误差”,采用单因素方差分析(One-way ANOVA)或者t检验进行差异性比较,采用GraphPad Prism 9.5绘图。*、**、***及****分别代表P小于0.05、0.01、0.001及0.000 1。
2.1.1 CCFM1118-IB与H.pylori之间的共聚集
本项实验采用一具有抗幽门功效的益生菌菌株罗伊氏乳杆菌DSM17648[13, 16](死菌)作为阳性对照,以其共聚集能力为标准进行菌株共聚集能力评价,结果如图1-a。卷曲乳杆菌CCFM1118活菌、CCFM1118-IB与罗伊氏乳杆菌DSM17648的H.pylori共聚集能力存在显著差异,CCFM1118-IB的共聚集能力为DSM17648的45%左右;并且卷曲乳杆菌CCFM1118与1118-IB相比较,两者的H.pylori共聚集能力并无显著差异。结果表明,卷曲乳杆菌CCFM1118与1118-IB具备一定的与H.pylori共聚集的能力。

a-CCFM1118-IB与H.pylori的共聚集能力;b-CCFM1118-IB干预对H.pylori细胞黏附能力的影响
图1 CCFM1118-IB干预对幽门螺杆菌的影响
Fig.1 Effect of CCFM1118-IB intervention on H. pylori
注:*表示P<0.05、**表示P<0.01、***表示P<0.001、****表示P<0.000 1(下同)。
2.1.2 CCFM1118-IB对H.pylori黏附AGS细胞的影响
H.pylori通过黏附细胞发挥致病作用,本研究以H.pylori黏附AGS细胞的能力为指标,评价来自卷曲乳杆菌CCFM1118的后生元缓解H.pylori感染的能力。如图1-b所示,经CCFM1118-IB处理后,H.pylori对AGS细胞的黏附率并无显著变化,证明CCFM1118-IB不具备抑制H.pylori黏附细胞的作用。
2.1.3 CCFM1118-IB对H.pylori的生长抑制作用
取菌株发酵上清液及CCFM1118-IB分别进行抑菌实验,实验结果见表1。发酵上清液抑菌圈直径达13.63 mm,抑菌效果明显;CCFM1118-IB同样出现了抑菌圈,但是与上清液相比,抑菌圈较小,抑菌圈直径在12.25 mm左右。结果表明,CCFM1118-IB对H.pylori具有生长抑制作用。
表1 CCFM1118-IB对幽门螺杆菌的抑菌效果
Table 1 Bacteriostatic effect of CCFM1118-IB against Helicobacter pylori
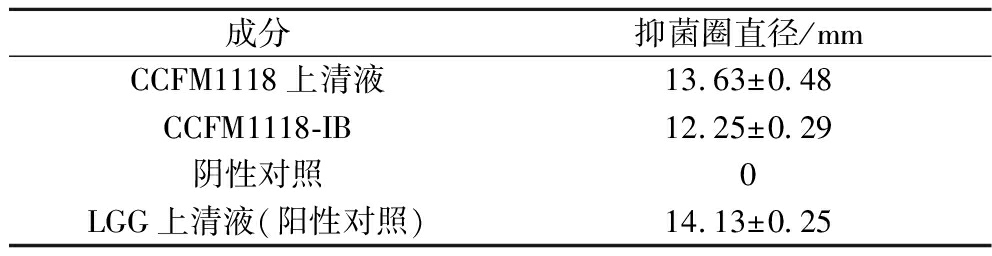
成分抑菌圈直径/mmCCFM1118上清液13.63±0.48CCFM1118-IB12.25±0.29阴性对照0LGG上清液(阳性对照)14.13±0.25
2.2.1 CCFM1118-IB对受试者H.pylori定殖量的影响
本实验共招募55人,排除失联、未按要求完成实验者,最终40人符合要求。以符合要求的40名感染者的数据进行统计分析,结果如表2、图2所示。安慰剂组(Placebo)12个人中在干预前后均为H.pylori阳性,4人存在DOB值降低的情况(比例33.33%)。CCFM1118-IB组中,28个人中有2个人转为H.pylori阴性,19人存在DOB值降低的情况,降低率67.86%,显著高于安慰剂组。进一步分析患者DOB值的变化情况,发现,尽管安慰剂组存在降低的情况,但是降低数值并不是很高,相反,CCFM1118-IB受试组的DOB值降低较为明显。实验结果表明,CCFM1118-IB可降低H.pylori感染者体内H.pylori的载量。
表2 CCFM1118-IB对幽门螺杆菌的根除作用
Table 2 Effectiveness of CCFM1118-IB in the eradication of H. pylori

组别N阴性n阳性n转阴率/%降低n降低率/%Placebo120120433.33CCFM1118-IB282267.141967.86
注:降低、升高指13C尿素呼气实验呼气值的变化。此临床UBT检测为13C检测,在DOB值>4时认为H.pylori阳性。
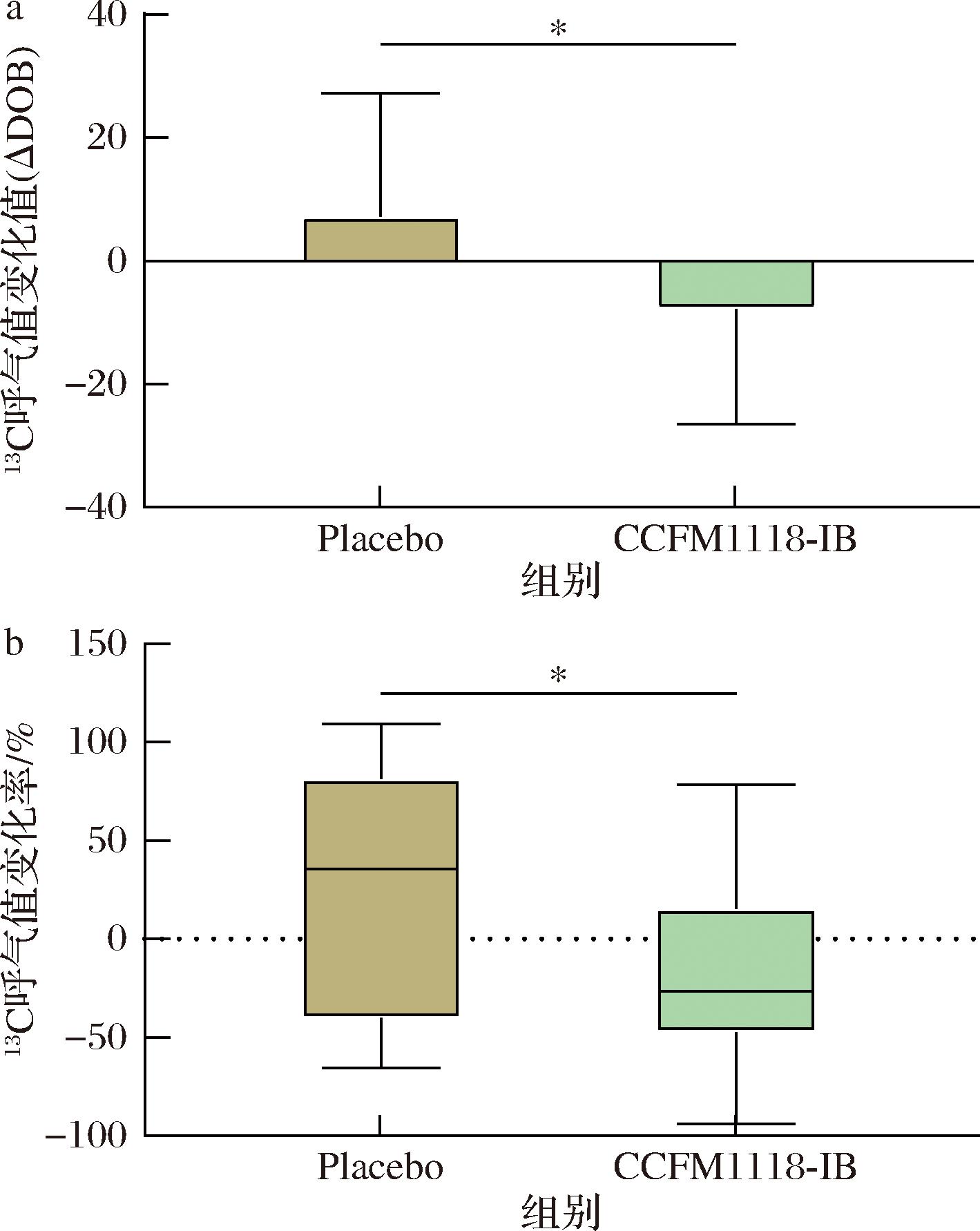
a-尿素呼气试验呼气值变化值;b-尿素呼气试验呼气值变化率
图2 CCFM1118-IB受试后患者DOB变化情况
Fig.2 Changes of DOB value in patients after CCFM1118-IB intervention
2.2.2 CCFM1118-IB对受试者血清PG的影响
PG可以在一定程度上反映胃黏膜的情况,CCFM1118-IB干预对患者血清PG的影响结果如表3所示。
表3 CCFM1118-IB对幽门螺杆菌感染者血清PG的影响
Table 3 Effect of CCFM1118-IB on serum PG in patients with H. pylori
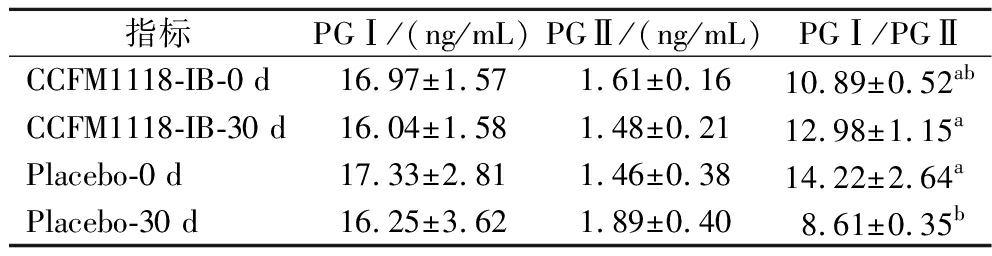
指标PGⅠ/(ng/mL)PGⅡ/(ng/mL)PGⅠ/PGⅡCCFM1118-IB-0 d16.97±1.571.61±0.1610.89±0.52abCCFM1118-IB-30 d16.04±1.581.48±0.2112.98±1.15aPlacebo-0 d17.33±2.811.46±0.3814.22±2.64aPlacebo-30 d16.25±3.621.89±0.408.61±0.35b
注:不同小写字母表示组间存在显著性差异(P<0.05),未标注则表示无显著性差异(下同)。
在本研究中,各组治疗前PG的基线水平无显著差异。受试者食用一个月的益生菌产品后,CCFM1118-IB干预组受试前后PGⅠ/PGⅡ比值并无显著差异,但安慰剂组受试前后的PGⅠ/PGⅡ比值却显著下降。
2.2.3 CCFM1118-IB对受试者血清细胞因子水平的影响
CCFM1118-IB对H.pylori感染者血清炎症因子的影响如表4所示。治疗前,两组的IL-8、IL-6及TNF-α血清含量均在相似的水平,组间差异无统计学意义。CCFM1118-IB干预一个月后,无论是干预前后对比还是CCFM1118-IB干预组与安慰剂组相比,各组间均不存在显著差异。
表4 CCFM1118-IB对幽门螺杆菌感染者血清细胞因子的影响 单位:ng/L
Table 4 Effect of CCFM1118-IB on serum cytokines in patients with H. pylori
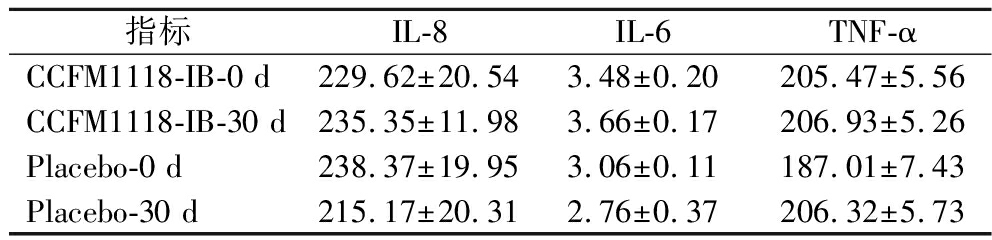
指标IL-8IL-6TNF-αCCFM1118-IB-0 d229.62±20.543.48±0.20205.47±5.56CCFM1118-IB-30 d235.35±11.983.66±0.17206.93±5.26Placebo-0 d238.37±19.953.06±0.11187.01±7.43Placebo-30 d215.17±20.312.76±0.37206.32±5.73
2.2.4 CCFM1118-IB对受试者部分血清生化指标的影响
血清生化是反映机体状态的一项基础指标。本研究分析了受试者部分血清生化指标,结果见表5。无论是干预前后还是CCFM1118-IB干预与否,H.pylori感染者的各项血清生化指标均未发生显著变化。
表5 CCFM1118-IB对幽门螺杆菌感染者血清生化的影响
Table 5 Effect of CCFM1118-IB on blood biochemistry in patients with H. pylori
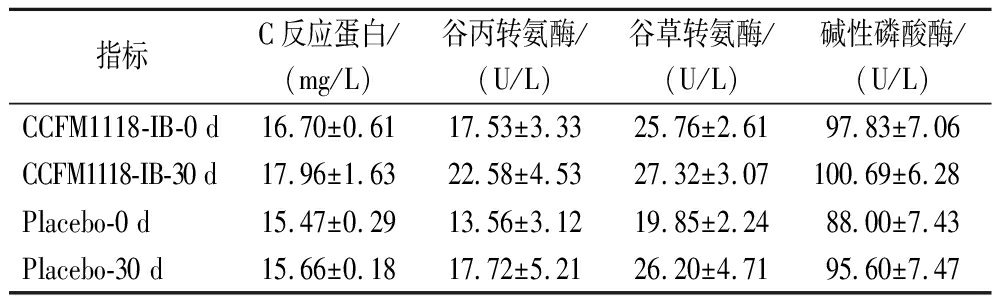
指标C反应蛋白/(mg/L)谷丙转氨酶/(U/L)谷草转氨酶/(U/L)碱性磷酸酶/(U/L)CCFM1118-IB-0 d16.70±0.6117.53±3.3325.76±2.6197.83±7.06CCFM1118-IB-30 d17.96±1.6322.58±4.5327.32±3.07100.69±6.28Placebo-0 d15.47±0.2913.56±3.1219.85±2.2488.00±7.43Placebo-30 d15.66±0.1817.72±5.2126.20±4.7195.60±7.47
2.2.5 CCFM1118-IB对受试者肠道菌群的影响
肠道微生物对维持健康具有重要作用。本研究分析了CCFM1118-IB对患者肠道菌群的影响。本研究以Shannon指数、Chao1指数及Pielou指数来表征CCFM1118-IB干预后受试者肠道菌群的α多样性,以主坐标分析(principal co-ordinates analysis,PCoA)来表征β多样性,结果如图3-a、图3-b所示。CCFM1118-IB干预并没有对H.pylori感染者的肠道菌群多样性造成显著的影响。门水平上,2组的主要菌门均为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)及变形菌门(Proteobacteria)(图3-c),且2组的菌群在门水平上没有显著差异(P>0.05,图3-d)。在属水平上进一步分析两组的肠道菌群,发现安慰剂组与CCFM1118-IB组的肠道菌群都以经黏液真杆菌属(Blautia)、粪肠杆菌属(Faecalibacterium)、真杆菌属(Eubacterium)及双歧杆菌属(Bifidobacterium)为优势菌属(图4-a);通过线性判别分析(linear discriminant analysis effect size,LEfSe)发现(LDA评分≥3.0,P<0.05),两组间一共有11个显著差异属,其中Bacteroides、Ruminococcaceae UCG-002及Clostridium sensu stricto 1在CCFM1118-IB组为优势属,而Bacillus、Catenibacterium、Holdemanella、Gemella、Tyzzerella 4、Vagococcus及Granulicatella则对安慰剂组具有显著影响(图4-b、图4-c)。
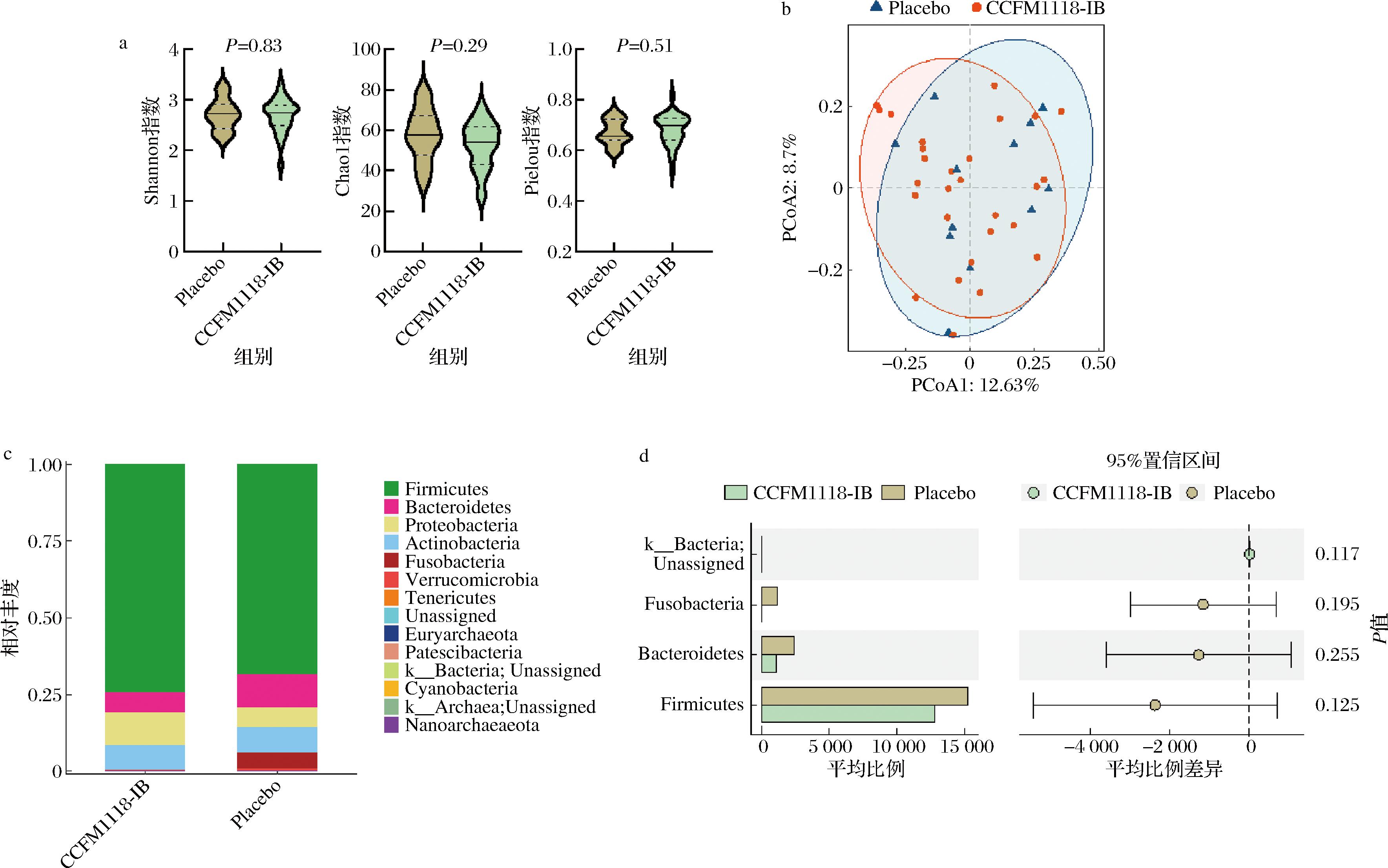
a-菌群的α多样性表示,分别为Shannon指数、Chao 1指数及Pielou指数;b-菌群的β多样性表示,PCoA图;c-菌群的门水平丰度柱状图;d-两组间的门水平差异
图3 CCFM1118-IB对幽门螺杆菌感染者肠道菌群的影响
Fig.3 Effect of CCFM1118-IB on gut microbiota of patients with H. pylori

a-属水平丰度饼状图;b-物种分类学分枝图;c-显著差异物种LDA值分布柱状图
图4 CCFM1118-IB对幽门螺杆菌感染者肠道菌群属水平的影响
Fig.4 Effect of CCFM1118-IB on the genus level of gut microbiota of patients with H. pylori
同时,本研究对肠道菌群进行了PICRUSt2功能预测。通过LEfSe分析发现,有9条KEGG通路在CCFM1118干预前后发生了显著变化(图5,LDA评分≥2,P<0.05)。在这些变化的通路中,安慰剂组主要涉及蔗糖降解、磷壁酸的生物合成、葡萄球菌肽聚糖生物合成及乳糖和半乳糖降解通路,而CCFM1118-IB主要涉及戊二酰CoA的降解、丙酮酸发酵成丙酸、硫酸软骨素降解(细菌类)、不完全还原的三羧酸循环及丙酮酸发酵成丙酮的通路。

图5 CCFM1118-IB对幽门螺杆菌感染者肠道菌群功能的影响
Fig.5 Effect of CCFM1118-IB on gut microbiota function of patients with H. pylori
本研究分析了卷曲乳杆菌CCFM1118制备的后生元CCFM1118-IB对H.pylori感染的缓解作用。研究的临床结果显示,尽管CCFM1118-IB不能有效的促进H.pylori感染者转阴,但是CCFM1118-IB展现出了良好的降低H.pylori感染者体内的H.pylori载量的作用,具备缓解H.pylori感染的功效。
益生菌具有缓解H.pylori感染的作用已被大量的研究报道所证实。益生菌改善H.pylori感染的潜在作用机制主要包括以下3方面:1)益生菌有助于增强胃部的屏障效应而抵御H.pylori感染[17]。2)益生菌可以分泌抗菌物质抑制H.pylori生长,如乳酸、短链脂肪酸(short-chain fatty acid,SCFA)和细菌素[18]。3)益生菌可干扰H.pylori的定殖[7]。研究分析了CCFM1118-IB缓解H.pylori感染的作用机制。分析CCFM1118-IB对H.pylori定殖的影响,发现CCFM1118-IB具备与H.pylori共聚集的能力,但不具备抑制H.pylori与AGS细胞黏附的能力。H.pylori在胃黏膜细胞上的黏附需要受体,一旦乳杆菌优先结合这些受体(如黏蛋白、糖蛋白或糖脂等),H.pylori的定殖就将受到很大的阻碍;而结合黏附受体一般需要活菌来发挥作用,CCFM1118-IB作为灭活菌体,可能无法与黏附受体结合而不具备抑制黏附的作用。H.pylori最初进入体内时是具有活性的游离状态,依靠自身的鞭毛在胃黏膜表面进行游动,如果在该阶段补充具有聚集H.pylori能力的益生菌,则可以对H.pylori进行精准的“捕捉”并形成可以排出体外的聚集体,从而可达到降低H.pylori感染的目的。共聚集作用主要与菌体上的物质相关,如细胞壁所含有的磷壁酸、蛋白质等[19];且热处理只会降低菌株之间的共聚集,不会使共聚集效果完全消失[20]。本研究所使用的CCFM1118-IB为65 ℃处理,处理后的共聚集能力并未发生显著变化。此外,本研究也分析了卷曲乳杆菌CCFM1118相关的抑菌效果,发现CCFM1118发酵上清液及CCFM1118-IB均可以抑制H.pylori的生长,但是CCFM1118-IB的抑菌效果相对较弱。这个现象表明,卷曲乳杆菌CCFM1118可能代谢产生有机酸、细菌素等物质而对H.pylori产生生长抑制作用;而CCFM1118-IB是仅剩余了死菌体的混合物,其中可能包含了细菌素之类的物质而具有抑制H.pylori生长的作用。
本研究的临床试验分析了H.pylori感染者的血清PG变化。PG由泌酸腺的细胞合成,胃黏膜分泌的PG是血清PG的唯一来源。胃部的不同病变阶段血清PG含量不同,故PG可以反映胃黏膜分泌功能的强弱及胃底和胃体的黏膜状态。临床数据显示,H.pylori感染的胃炎患者PGⅠ和PGⅡ在黏膜免疫的情况下升高,而PGⅡ升高更多,故PGⅠ/PGⅡ的比值会下降。本研究的结果显示,在不加干预的情况下,患者的PGⅠ/PGⅡ出现下降,但CCFM1118-IB干预则会阻止PGⅠ/PGⅡ下降。这表明,如果不加干预,H.pylori可能会持续损伤感染者的胃黏膜,而CCFM1118-IB干预可缓解这种损伤作用。
除了以上阐述的非免疫作用外,一些益生菌还可以减少H.pylori感染引起的宿主炎症反应[21]。H.pylori感染后定殖在胃部,其会通过毒力因子释放细胞毒素刺激机体产生免疫反应,IL-8和TNF-α等炎症因子则在H.pylori相关的胃炎的发展进程中起到了十分重要的作用。益生菌可以抑制促炎因子的表达,改善胃中的炎症反应。在本研究中,CCFM1118-IB干预并没有显著影响H.pylori感染者的血清IL-6、IL-8及TNF-α水平。证明CCFM1118-IB可能并不具备缓解H.pylori诱导的炎症反应的作用。本研究也发现,在CCFM1118-IB的干预下,感染者的生化指标并没有显著的差异,这表明CCFM1118-IB不会影响受试者的基本生理状况。
肠道菌群是人体的一个重要组成部分,其可能受到各种因素的影响,包括宿主生活方式、抗生素的使用和H.pylori感染等[22]。研究证明,H.pylori的感染和根除与肠道微生物之间存在相互作用,并影响相关疾病的发生、发展,如H.pylori感染和根除治疗都可能导致肠道微生物群紊乱,从而促进胃癌和肿瘤的发生[23]。本研究发现,CCFM1118-IB干预后患者的肠道菌群多样性并没有发生显著变化。进一步分析发现,CCFM1118-IB干预组与安慰剂组的肠道菌群在门水平上不存在显著差异。这些结果表明,CCFM1118-IB根除H.pylori不会显著干扰肠道微生物的组成和结构,这也与其他研究的结果一致[24]。与抗生素治疗相比,益生菌产品治疗H.pylori感染一个突出的优点是可以避免肠道菌群的损伤、减少治疗副作用,本研究的临床结果也反映出了这一点——CCFM1118-IB在干预过程中没有对肠道菌群造成过大的损伤,从而可能避免了肠道菌群波动过大而带来的副作用。尽管肠道菌群多样性没有显著的变化,但是CCFM1118-IB还是改变了一些肠道菌群菌属的丰度。FROST等[25]发现,H.pylori感染者和对照组之间,部分肠道微生物的相对丰度存在差异,如拟杆菌属。在本研究中,拟杆菌属的丰度在CCFM1118-IB干预组有所提高,证明了CCFM1118-IB可能逆转了H.pylori造成的拟杆菌属减少。拟杆菌是人体肠道中SCFAs的主要产生者,其产生的乙酸、丙酸等SCFAs对维持肠道内稳态具有重要作用。CCFM1118-IB的干预也显著改变了瘤胃球菌科的一个菌属(Ruminococcaceae UCG-002)的相对丰度;瘤胃球菌科是一种重要的丁酸产生菌家族,丁酸盐则在维持肠道内环境平衡方面具有核心作用。这表明,CCFM1118-IB可能通过调控肠道菌群来调节肠道中SCFAs的产生,进而产生不同的益生作用。这也得到了PICRUSt2功能预测分析结果的证明。功能预测分析发现,CCFM1118-IB干预显著增强了丙酮酸发酵成丙酸这一代谢通路,表明CCFM1118-IB可能会影响肠道中SCFAs的产生。本研究的结果表明,CCFM1118-IB可能会调节肠道菌群中的某些菌属、菌科并影响肠道菌的代谢进而对H.pylori感染产生作用。
本研究证实,来自卷曲乳杆菌CCFM1118的后生元CCFM1118-IB具备与H.pylori形成聚集体、抑制H.pylori生长的能力,但是无法抑制H.pylori对细胞的黏附。通过临床研究进一步分析CCFM1118-IB在H.pylori感染上的作用,发现CCFM1118-IB可以降低患者的H.pylori载量、减轻H.pylori对胃黏膜的损伤,并且CCFM1118-IB可能通过调节特定肠道菌、影响肠道菌的代谢来对H.pylori感染产生有益作用;而且在具备缓解H.pylori感染作用的同时,CCFM1118-IB并不会显著影响患者的正常生理状况及肠道菌群多样性。本研究的发现可以为卷曲乳杆菌CCFM1118的应用及H.pylori的益生菌治疗提供一定的理论指导。
[1] HOOI J K Y, LAI W Y, NG W K, et al.Global prevalence of Helicobacter pylori infection:Systematic review and meta-analysis[J].Gastroenterology, 2017, 153(2):420-429.
[2] QUAGLIA N C, DAMBROSIO A.Helicobacter pylori:A foodborne pathogen?[J].World Journal of Gastroenterology, 2018, 24(31):3472-3487.
[3] GONCIARZ W, WALENCKA M, MORAN A P, et al.Upregulation of MUC5AC production and deposition of LEWIS determinants by HELICOBACTER PYLORI facilitate gastric tissue colonization and the maintenance of infection[J].Journal of Biomedical Science, 2019, 26(1):23.
[4] LIANG B, YUAN Y, PENG X J, et al.Current and future perspectives for Helicobacter pylori treatment and management:From antibiotics to probiotics[J].Frontiers in Cellular and Infection Microbiology, 2022, 12:1042070.
[5] LIU L P, ZHAO Y X, FAN G R, et al.Helicobacter pylori infection enhances heparanase leading to cell proliferation via mitogen-activated protein kinase signalling in human gastric cancer cells[J].Molecular Medicine Reports, 2018, 18(6):5733-5741.
[6] FOCK K M, KATELARIS P, SUGANO K, et al.Second Asia-Pacific Consensus Guidelines for Helicobacter pylori infection[J].Journal of Gastroenterology and Hepatology, 2009, 24(10):1587-1600.
[7] QURESHI N, LI P, GU Q.Probiotic therapy in Helicobacter pylori infection:A potential strategy against a serious pathogen?[J].Applied Microbiology and Biotechnology, 2019, 103(4):1573-1588.
[8] MARCO M L, SANDERS M E, G NZLE M, et al.The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on fermented foods[J].Nature Reviews Gastroenterology &Hepatology, 2021, 18:196-208.
NZLE M, et al.The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on fermented foods[J].Nature Reviews Gastroenterology &Hepatology, 2021, 18:196-208.
[9] ![]() J, MARZEC A, RUSZCZY
J, MARZEC A, RUSZCZY SKI M, et al.Postbiotics-a step beyond pre- and probiotics[J].Nutrients, 2020, 12(8):2189.
SKI M, et al.Postbiotics-a step beyond pre- and probiotics[J].Nutrients, 2020, 12(8):2189.
[10] HU J F, TIAN X Q, WEI T, et al.Anti- Helicobacter pylori activity of a Lactobacillus sp.PW-7 exopolysaccharide[J].Foods, 2021, 10(10):2453.
[11] DORON S, SNYDMAN D R.Risk and safety of probiotics[J].Clinical Infectious Diseases:an Official Publication of the Infectious Diseases Society of America, 2015, 60(Suppl 2):S129-S134.
[12] WANG S M, ZHANG M Y, YU L L, et al.Evaluation of the potential protective effects of Lactobacillus strains against Helicobacter pylori infection:A randomized, double-blinded, placebo-controlled trial[J].The Canadian Journal of Infectious Diseases &Medical Microbiology=Journal Canadien Des Maladies Infectieuses et De La Microbiologie Medicale, 2022, 2022:6432750.
[13] HOLZ C, BUSJAHN A, MEHLING H, et al.Significant reduction in Helicobacter pylori load in humans with non-viable Lactobacillus reuteri DSM17648:A pilot study[J].Probiotics and Antimicrobial Proteins, 2015, 7(2):91-100.
[14] 张美怡, 翟齐啸, 赵建新, 等.鼠李糖乳杆菌JS-SZ-2-1抗幽门螺杆菌感染的临床效果评价[J].食品与发酵工业, 2020, 46(23):29-34.
ZHANG M Y, ZHAI Q X, ZHAO J X, et al.Clinical efficacy evaluation of Lactobacillus rhamnosus JS-SZ-2-1 against Helicobacter pylori infection[J].Food and Fermentation Industries, 2020, 46(23):29-34.
[15] 张华月. 具有幽门螺杆菌共聚集能力乳杆菌的筛选及临床功效评价[D].无锡:江南大学, 2022.
ZHANG H Y.Screening and clinical functional evaluation of Lactobacillus with co-aggregation ability of Helicobacter pylori[D].Wuxi:Jiangnan University, 2022.
[16] MEHLING H, BUSJAHN A.Non-viable Lactobacillus reuteri DSMZ 17648 (PylopassTM) as a new approach to Helicobacter pylori control in humans[J].Nutrients, 2013, 5(8):3062-3073.
[17] SUEZ J, ZMORA N, SEGAL E, et al.The pros, cons, and many unknowns of probiotics[J].Nature Medicine, 2019, 25(5):716-729.
[18] HOMAN M.Are probiotics useful in Helicobacter pylori eradication?[J].World Journal of Gastroenterology, 2015, 21(37):10644.
[19] 李露露, 王钧豪, 叶亚明, 等.乳杆菌与幽门螺杆菌共聚集的特性研究[J].食品与发酵工业, 2022, 48(21):1-8.
LI L L, WANG J H, YE Y M, et al.Characterization of Lactobacillus co-aggregation with Helicobacter pylori[J].Food and Fermentation Industries, 2022, 48(21):1-8.
[20] EKMEKCI H, ASLIM B, OZTURK S.Characterization of vaginal lactobacilli coaggregation ability with Escherichia coli[J].Microbiology and Immunology, 2009, 53(2):59-65.
[21] JI J F, YANG H.Using probiotics as supplementation for Helicobacter pylori antibiotic therapy[J].International Journal of Molecular Sciences, 2020, 21(3):1136.
[22] ZHANG S Y, SHI D, LI M R, et al.The relationship between gastric microbiota and gastric disease[J].Scandinavian Journal of Gastroenterology, 2019, 54(4):391-396.
[23] GUO Y, ZHANG Y, GERHARD M, et al.Effect of Helicobacter pylori on gastrointestinal microbiota:A population-based study in Linqu, a high-risk area of gastric cancer[J].Gut, 2020, 69(9):1598-1607.
[24] DU L J, CHEN B R, CHENG F L, et al.Effects of Helicobacter pylori therapy on gut microbiota:A systematic review and meta-analysis[J].Digestive Diseases, 2024, 42(1):102-112.
[25] FROST F, KACPROWSKI T, RÜHLEMANN M, et al.Helicobacter pylori infection associates with fecal microbiota composition and diversity[J].Scientific Reports, 2019, 9(1):20100.