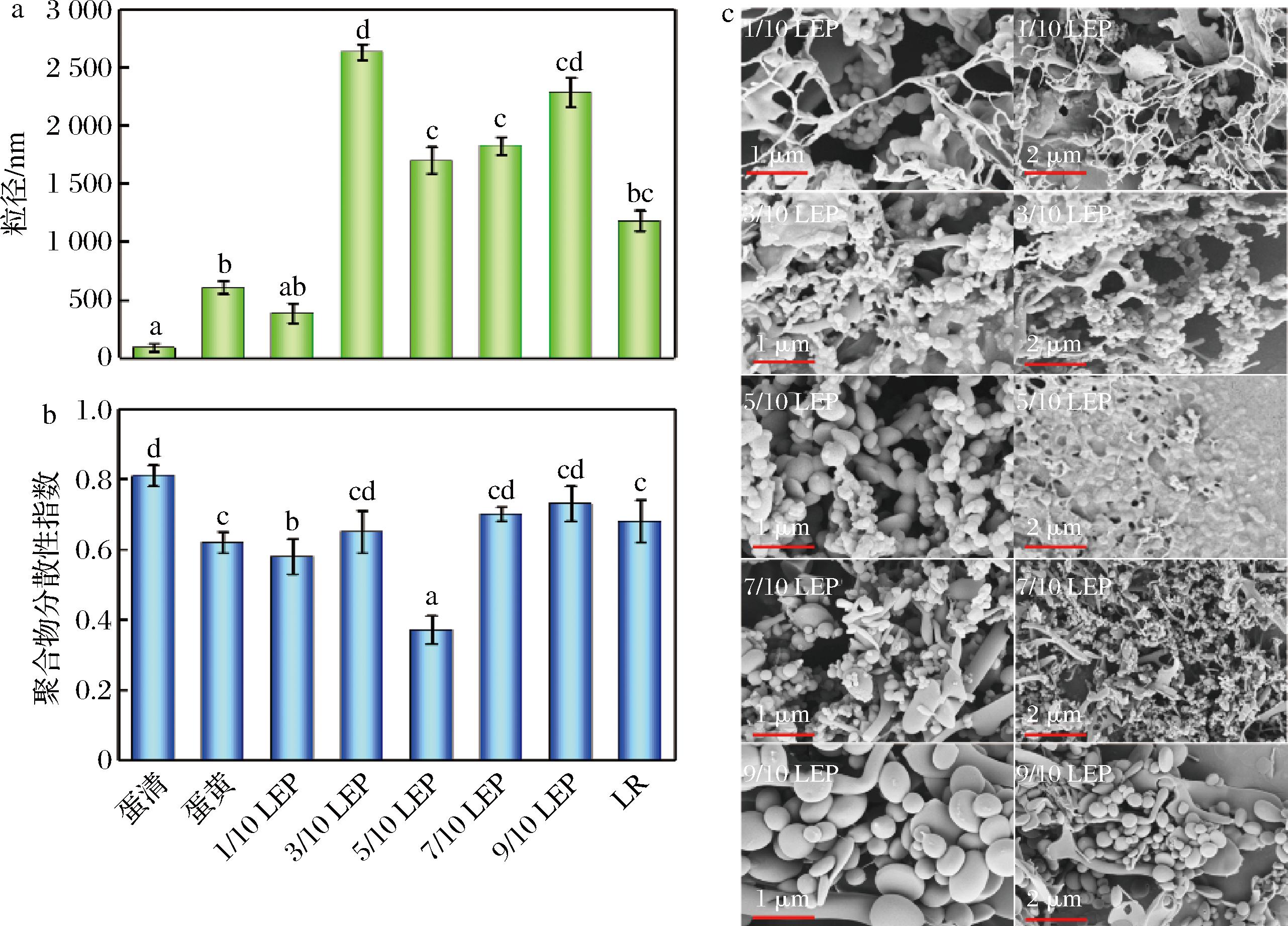
a-粒径;b-聚合物分散性指数;c-LEP的扫描电镜图
图1 LEP的粒径、聚合物分散性指数、扫描电镜图
Fig.1 Particle size, PDI and SEM of LEP
注:不同小写字母代表差异显著(P<0.05)(下同)。
益生菌是一种食用后可恢复或维持宿主体内的微生物种群、功能、组成和营养平衡的微生物,可产生各种分解食物成分的酶,因此益生菌食品被归类为功能性食品[1]。益生菌对人体有多种有益功效,如抗癌、降低胆固醇、抗高血压、调节免疫、治疗肠道疾病等[2]。罗伊氏乳杆菌(Lactobacillus reuteri,LR)是一种革兰氏阳性、存在于单个或多个簇中的兼性厌氧、专性异质发酵乳酸菌,LR的有益特性主要表现在两个方面:1)LR可以黏附在肠道内部,从而减少其他有害细菌的定植;2)LR能产生细菌素(Reuterin),有害细菌在含有细菌素的环境中会被抑制,从而降低对人体的损害[3-4]。
益生菌只能在适宜的条件下储存,并且只有在胃肠道条件下存活,才能发挥其作用。因此,对益生菌进行封装常被用于提高其在加工、储存过程中和胃肠道条件下的生存能力,从而确保益生菌输送到胃肠道的目标位点并发挥作用[5]。然而,现有的大多数益生菌食品都需要加热才能食用,但加热处理会导致益生菌活性降低,影响其发挥作用。
食品3D打印技术是一种新兴的食品加工技术,融合了数字技术、食品加工技术等多种技术。它具有可定制、营养价值高、安全等优点。能够方便快捷地生产出满足不同人群需求的食品。因此,3D打印技术在食品开发领域具有很大的研究潜力。目前使用的3D食品打印技术大多基于材料挤压,即食品原料通过喷嘴,按特定图型沉积在目标板上。该技术可实现连续打印,适用于液体或低黏度材料的食品制备。但挤压式3D打印技术对食品原料要求严格,原料一般需要满足一定的流变性能,能够顺利挤出的同时并保持一定形状;另一方面,打印速度、打印温度、填充率、喷嘴直径等打印参数对打印效果也有较大影响[6]。
根据现有的研究表明,在益生菌食品领域,对LR的封装研究以及3D打印后可直接食用的饼干研究较少。因此本研究制备了一种含有罗伊氏乳杆菌的益生菌饼干,用蛋清将LR进行封装,制备LR封装颗粒(LR-encapsulated particle,LEP),将其添加到熟小麦粉中制备益生菌饼干面团。对LEP的粒径、聚合物分散性指数(polymer dispersion index,PDI)、扫描电镜(scanning electron microscope,SEM)、封装效率(encapsulated efficiency,EE)和模拟唾液、模拟胃液、模拟肠液中LR的存活数量进行了检测分析。并对饼干面团的傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)、流变和质构特性进行表征,最后验证了饼干面团的3D打印适应性,对益生菌3D打印食品的开发有一定参考价值。
小麦粉,益海嘉里食品有限公司;无菌鸡蛋,四川盛迪乐村生态食品有限公司;Lactobacillus reuteri CICC 6132,中国工业微生物菌种收集与管理中心。其余试剂均为分析纯,购自雅安市万科试剂有限公司。
Nano-ZS Zetasizer分析仪,英国马尔文仪器有限公司;SU 8010扫描电子显微镜,日本日立有限公司;Nicolet 6700 傅立叶红外光谱仪,美国Thermo Nicolet分析仪器公司;Discovery HR-2仪器流变仪,美国 TA仪器公司;TA.XT Express C物性分析仪,英国Stable Micro Systems公司;3D打印系统,成都绿芯科技有限公司。
1.3.1 菌种活化及菌悬液的制备
将Lactobacillus reuteri CICC 6132的二级纯化培养液以2%的接种量接种于无菌MRS液体培养基中,在37 ℃恒温培养箱培养36 h后,6 000 r/min离心20 min后收集细菌细胞。细菌细胞用无菌生理盐水洗涤两次,再次离心得到菌泥。使用前,将0.1 g菌泥加入适量的无菌生理盐水中制备得到细菌悬浮液。
1.3.2 LEP及饼干面团的制备
LEP的制备方法:首先,将细菌悬浮液与一定质量的无菌鸡蛋的蛋清在低速恒定磁力搅拌下逐滴地混合。混合体系中菌悬液与蛋清的质量比分别为1∶10、3∶10、5∶10、7∶10、9∶10。在室温下搅拌15 min后,6 000 r/min离心20 min得到沉淀物,冷冻干燥24 h,制备得到不同比例的LEP粉末(1/10-LEP,3/10-LEP,5/10-LEP,7/10-LEP,9/10-LEP)。使用前,将干燥的LEP粉末溶解在5 mL无菌饮用水中制备得到LEP分散液。
饼干面团的制备:将小麦粉加入不粘锅中,小火翻炒10 min至微焦,得到可生食的熟小麦粉。用分离器将无菌鸡蛋的蛋清与蛋黄分离,然后将具有完整膜的蛋黄在滤纸上滚动,去除残留的蛋清。刺破蛋黄蛋白膜后,收集蛋黄供后续使用。取蛋黄30 g密封在塑料袋中(密封前挤出塑料袋中的空气),然后在80 ℃的恒温水浴下10 min,得到煮熟的蛋黄。最后,将30 g煮熟的蛋黄和80 g的熟小麦粉用无菌玻璃棒混合后,分别加入5种不同比例的LEP分散液和25 mL无菌饮用水,充分混合,得到5种不同比例的可直接食用的饼干面团(1/10-面团,3/10-面团,5/10-面团,7/10-面团,9/10-面团)。同时以相同步骤制备不添加LEP分散液的纯小麦粉面团,作为对照。该过程完成后,面团在4 ℃进行保存,以备使用。
1.3.3 模拟唾液、模拟胃液和模拟肠液消化后LR的存活数量测定
模拟唾液消化是根据DING等[7]描述的方法进行了修改,将100.0 mg黏蛋白、15.0 mg KCl、12.0 mg NaCl、7.5 mg α-淀粉酶溶解于50.0 mL蒸馏水中制备模拟唾液。在10 mL模拟唾液中分别加入0.2 g LEP粉末和游离细胞悬液,在37 ℃孵育50 r/min持续搅拌3 min以模拟唾液消化。将10 mL模拟唾液与100.0 mg胃蛋白酶加入到50.0 mL蒸馏水中充分混合,再加入0.1 mol/L HCl溶液调节pH值至3.0制备模拟胃液。然后将含有LEP和模拟唾液的混合液,加入到制备好的10 mL模拟胃液中,放在搅拌器上,在37 ℃下,以50 r/min的速度搅拌3 h以模拟胃液消化。按照SANDOVAL-CASTILLA等[8]描述的方法模拟肠道消化,将4.0 mg/mL胆汁提取物、2.0 mg/mL胰蛋白酶和1.0 mg/mL脂肪酶置于0.1 mol/L PBS缓冲溶液中,加入0.1 mol/L NaOH溶液调节pH为8.0。将模拟胃液消化后的混合液,加入制备好的10 mL模拟肠液中。在摇床中37 ℃恒温孵育3 h以模拟肠道消化。被封装细胞和游离细胞的存活数量均以每毫升中菌落形成单位(colony forming unit,CFU)的常用对数值(即lg)来计算。
1.3.4 LR在LEP中的封装效率测定
为测定LEP的封装效率,将0.1 g LEP溶解在无菌生理盐水溶液中,2 500 r/min离心15 min。梯度稀释后,接种于MRS琼脂平板上,在37 ℃下孵育48 h。测定CFU,计算LEP中的活菌数。以游离LR为对照,使用公式(1)计算封装效率EE值[9]。
EE=C/C0×10
(1)
式中:C,LEP中被封装LR数量的常用对数值;C0,游离LR数量的常用对数值。
1.3.5 LEP粒径的测定
将干燥的LEP粉末用蒸馏水稀释至一定浓度,使用Nano-ZS Zetasizer分析仪对其粒径大小及其分布进行表征。
1.3.6 LEP的扫描电镜分析
将所有样品进行冷冻干燥后黏在样品平台上,在20 mA电流下进行喷金处理,时间为120 s。分别在200×和2 000×放大倍率下拍摄样品的SEM图像。
1.3.7 饼干面团及LEP的傅里叶红外光谱的测定
将饼干面团、LEP分别磨成粉末状(1 mg)与KBr粉末(100 mg)混合,在分辨率为4 cm-1的情况下,在500~4 000 cm-1处进行64次扫描,记录光谱。
1.3.8 饼干面团的质构特性测定
使用物性分析仪P/0.5探头测试3D打印产品的硬度、黏附性、弹性、黏性。
1.3.9 饼干面团的流变特性测定
平板直径为40 mm,两平行板间隙设置为1 050 μm,温度设定为25 ℃。在应变0.4%时,分析了0.1~100 rad/s的动态振荡频率[10],并记录了存储模量G′、损失模量G″和正切损耗角tanδ。
1.3.10 饼干面团的3D打印适应性测定
3D打印系统由给料机、带气泵的挤出系统和X-Y-Z定位装置组成。使用直径(d)分别为0.5、1、1.5 mm的喷嘴来验证饼干面团的3D打印适应性,打印速度设置为10、15、20 mm/s,气泵压力设置为300、350、450 kPa。当压力设置为300、350、420 kPa时,打印速度恒定为15 mm/s,使用直径为1 mm的喷嘴打印圆形饼干;打印速度设置为10、15、20 mm/s,压力恒定为350 kPa,使用直径为1 mm的喷嘴打印五角星形饼干;当喷嘴的直径设置为0.5、1、1.5 mm时,打印速度恒定为15 mm/s,压力恒定为350 kPa,打印方形饼干。
1.3.11 统计分析
实验数据采用SPSS 22.0统计分析,所有数据均以平均值±标准差表示,每项实验至少3次平行重复。通过单因素方差分析(ANOVA)进行分析,P<0.05为差异显著,有统计学意义,使用Origin 2021软件绘图。
LEP的粒径、PDI及微观结构如图1所示。

a-粒径;b-聚合物分散性指数;c-LEP的扫描电镜图
图1 LEP的粒径、聚合物分散性指数、扫描电镜图
Fig.1 Particle size, PDI and SEM of LEP
注:不同小写字母代表差异显著(P<0.05)(下同)。
1/10-LEP的粒径明显小于其他比例的LEP,这可能是LR的数量较少,使得难以被封装。粒径大小通常由微观结构之间的各种相互作用(如静电力、疏水力)决定。当LEP比例为3/10时,粒径突然增大,这可能是由于体系中的电子束通过静电相互作用吸附在LR的表面,形成了细菌-蛋白质的核壳结构,导致LEP平均粒径显著增大(P<0.05)。微观结构之间的静电相互作用可以改变蛋白质分子的表面电荷,使得封装颗粒之间的紧密度发生变化,从而减小封装颗粒的粒径。在图1-c中可以验证这一点,5/10-LEP和7/10-LEP的结构比3/10-LEP更小、更松散[11]。此外,随着LR数量的增加,每个细菌上吸附蛋清的量减少,导致粒径减小。当LR数量进一步增加时,细菌之间相互聚集,出现多个细菌被封装在一起的情况。粒径分布的均匀性可以用PDI来表征,PDI值越小,粒径分布越均匀。LEP的PDI值在(0.37±0.04)~(0.81±0.03),说明LEP的分散性不佳。5/10-LEP的PDI最小(0.37±0.04),此时粒径分布最均匀。不同尺寸下LEP的SEM图像如图1-c所示。LEP表面相对光滑,主要形状为球形,但也有部分呈椭圆形。1/10-LEP的SEM图像中,出现了除LEP以外的絮凝物,这可能是因为LR数量过少时,蛋清之间相互聚集形成絮凝物。随着LR数量的增加,LEP的数量增加而絮凝物数量减少,证明蛋清成功实现了对LR的封装。
LEP的封装效率如图2-a所示。LEP的封装效率在(70.3±1.21)%~(83.5±1.25)%变化,总体上封装效果较好。当菌悬液与蛋清添加比例为1∶10时,封装效率较高的原因可能是体系中LR较少,LR被蛋清封装较为完全。当菌悬液与蛋清添加比例为3∶10时,封装效率最低,这可能是因为LR的部分聚集导致蛋清不能完全将其包裹,蛋清之间形成了较大空隙,从而降低了蛋清对LR的保护作用[12]。另外,过量的蛋清具有一定的黏度,使得LR难以分散,从而导致封装效率的下降。随着LR数量的不断增加,LR的封装效率先增大后减小,说明在一定范围内蛋清能将LR进行封装。但是随着LR的不断增加使得体系中蛋清的相对含量越来越少,更多的LR不能被封装,导致封装效率下降。也可能是随着LR浓度的逐渐增加,LR在封装颗粒表面和溶液中形成沉淀[13]。此外,封装后的LR的活菌数量较高,说明蛋清与LR的相容性较好,蛋清封装LR后不会破坏LR的结构而影响其活性。
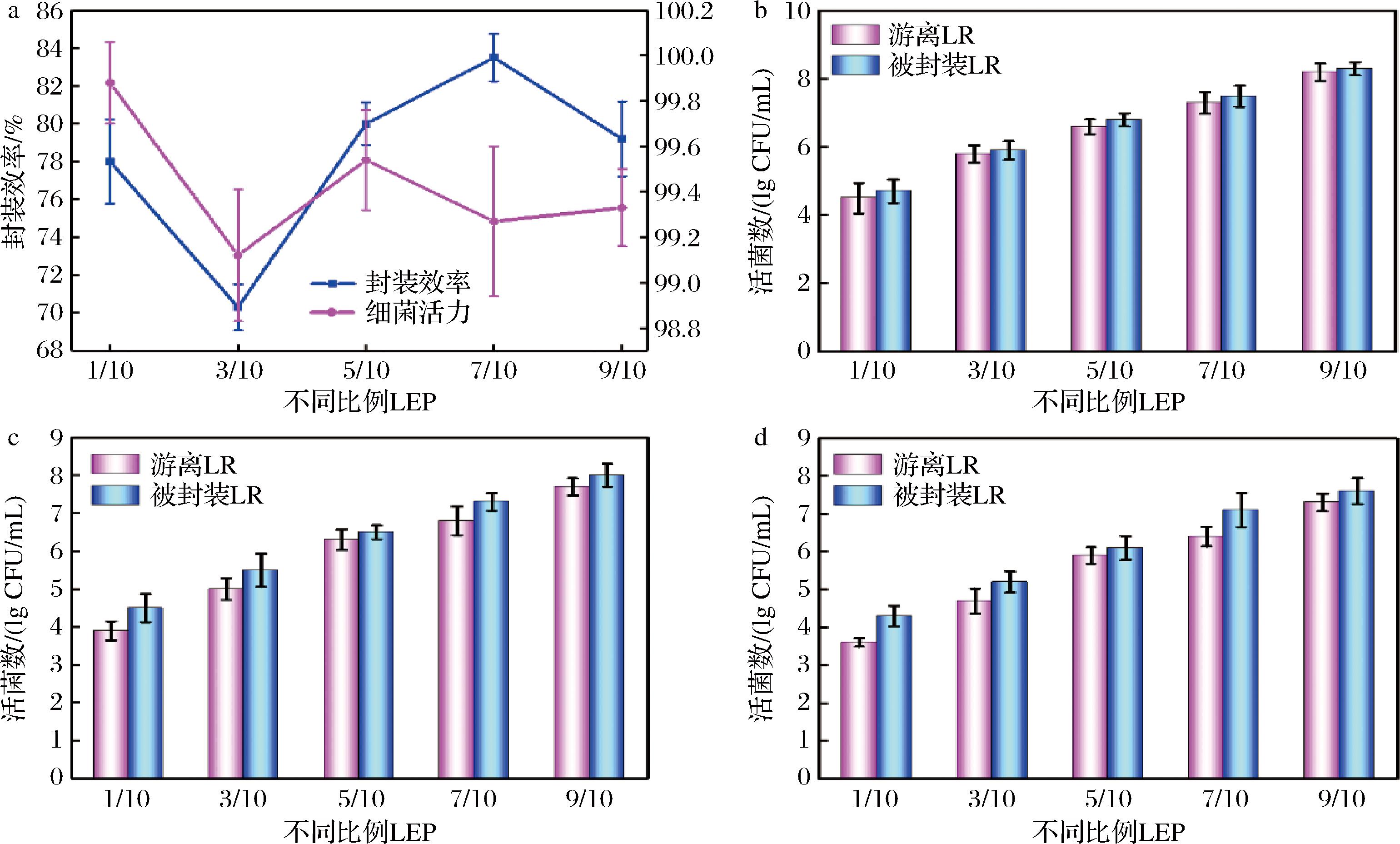
a-LEP的封装效率;b-模拟唾液中LR的存活数;c-模拟胃液中LR的存活数;d-模拟肠液中LR的存活数
图2 LEP的封装效率以及不同模拟环境下LR的存活数
Fig.2 Encapsulated efficiency of LEP and survival of LR in different simulated environments
LR消化过程中存活数的变化如图2-b~图2-d所示。模拟唾液消化3 min后,游离LR和LEP中LR活力无明显差异。这可能是因为唾液的pH值为6.5~7,此pH下并不影响LR生存。唾液消化后的游离LR和LEP置于模拟胃液消化3 h后,游离LR和被封装LR的存活数量均有所减少,但被封装LR的减少数量小于游离LR。其中,3/10组游离LR的存活数量由(5.8±0.25) lg CFU/mL下降至(5±0.29) lg CFU/mL,是游离LR组中下降最多的组。巧合的是,3/10组LEP中LR存活数由(5.9±0.27) lg CFU/mL下降至(5.5±0.44) lg CFU/mL,也是被封装LR中活菌数量下降最大的组,这可能与LR本身的生存能力相对较低有关。对LR进行封装能够使LR在酸性条件下具有更好的稳定性,并且在保持高活力的同时,延缓LR在胃中的释放,从而顺利到达肠道。有研究表明,被封装的益生菌能更好地到达肠道[14-15]。与模拟胃液消化后相似,模拟肠液中游离LR和被封装LR的存活数量进一步降低。被封装LR存活数量略高于游离LR,下降的幅度低于游离LR。这一现象可能有两个原因。首先,被封装的LR可以应对系统中分子运动造成的热损伤,具有更强的热缓冲能力。其次,蛋清在酸性条件下可能发生变性,这使得LEP的结构变得更加致密,从而更好地保护LR。益生菌在肠道内的生存能力是评价其能否发挥作用的标准之一。因此,模拟唾液、胃液和肠液消化是评价益生菌功能的重要指标[16]。目前有研究表明,益生菌若要发挥其作用,需要在肠道中存活至少106 CFU/mL或106 CFU/g的活菌细胞[17-18]。由图2-d可知,5/10-LEP,7/10-LEP以及9/10-LEP中的LR在模拟肠液消化后,仍能维持高于106 CFU/mL的活菌数,表明被封装LR可以在肠道中发挥益生菌作用。然而,只有两组游离LR(7/10,9/10)的活菌数维持在106 CFU/mL以上,由此可以判断蛋清封装后的LR能够更好地定殖于肠道,发挥其益生菌功能。
5/10-面团、7/10-面团及LEP的FTIR如图3所示。
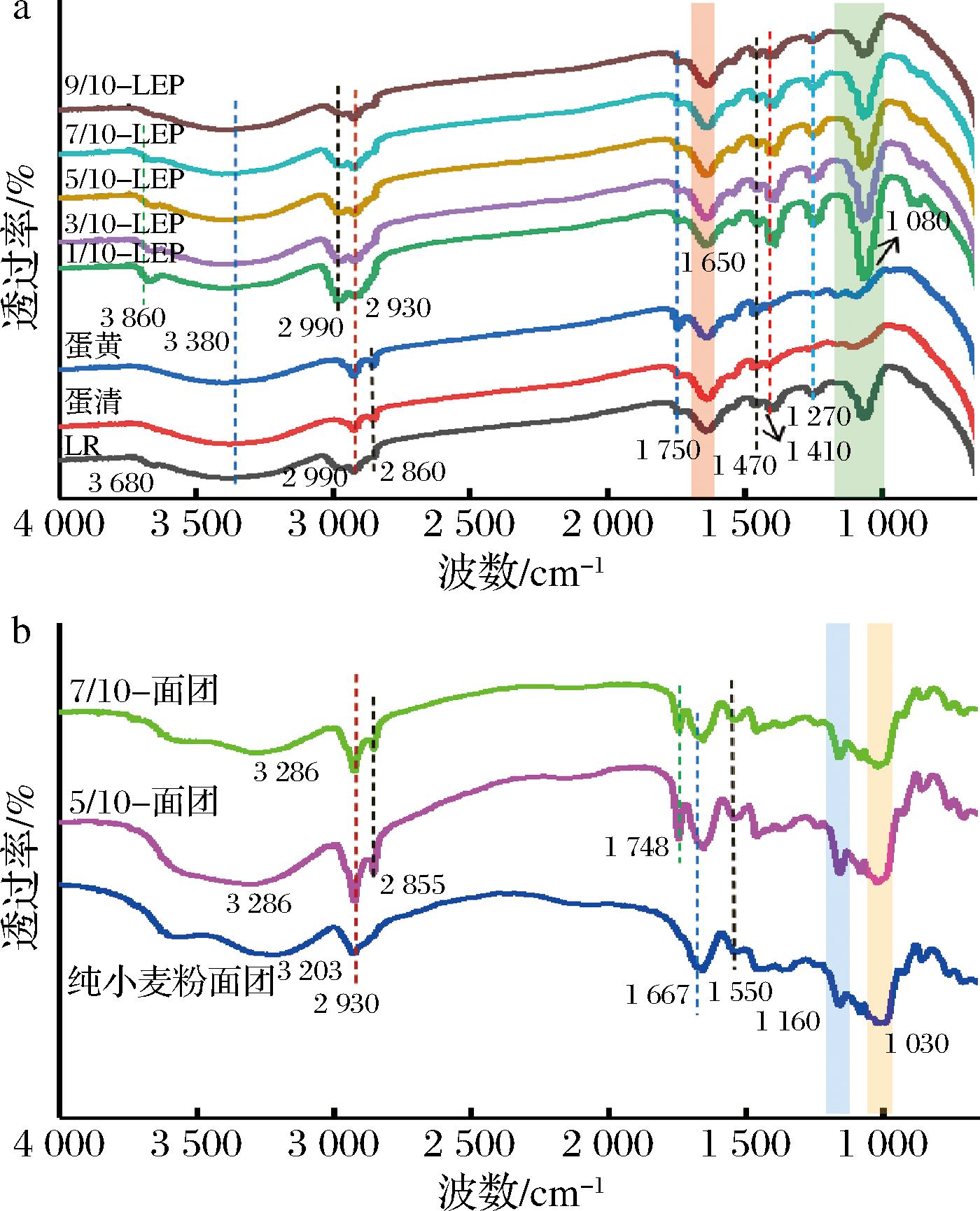
a-LEP红外光谱;b-饼干面团红外光谱
图3 LR、LEP、饼干面团(5/10-面团、7/10-面团)的FTIR
Fig.3 The FTIR spectra of LR, LEP, cookie dough (5/10-dough, 7/10-dough)
在图3-a中,与LEP的FTIR相比,蛋清和蛋黄的光谱中缺少位于3 680 cm-1的O—H拉伸带,这是由于蛋清封装LR后在3 680 cm-1处产生了新的特征峰[19]。在3 250~3 650 cm-1范围内吸收带变宽可能是由于N—H和O—H的拉伸振动以及分子内氢键的作用[20]。此外,所有LEP的FTIR均在2 800~3 600 cm-1范围内处出现吸收带,这可能是LEP中含有一定的水分引起的。在图3-b中,小麦粉和5/10-面团、7/10-面团的光谱中2 930和2 855 cm-1处的弱吸收峰分别是由多糖亚甲基的不对称和对称C—H振动引起的[21]。而1 550和1 030 cm-1处的吸收峰则是分别由C![]() O的不对称伸缩振动和C—O的伸缩振动引起的[22-23]。由图3-b可知,在纯小麦粉面团中加入LEP后,出现了一些新的吸收峰,如1 748、2 855 cm-1,说明LEP加入面团后形成了新的化学键,LEP成功与面团结合。
O的不对称伸缩振动和C—O的伸缩振动引起的[22-23]。由图3-b可知,在纯小麦粉面团中加入LEP后,出现了一些新的吸收峰,如1 748、2 855 cm-1,说明LEP加入面团后形成了新的化学键,LEP成功与面团结合。
食品的黏度、储存模量、损失模量等流变性能是评价材料打印性能的重要参数。食品材料的黏度是3D打印的关键因素[24]。适合基于挤压的3D打印的材料应该具有适中的黏度,黏度不能过高以允许通过打印喷嘴,但也不能过低以支持逐层沉积、保持形状[25]。从图4-a可以看出,随着剪切速率的增大,饼干面团的表观黏度减小。此外,LEP的数量增加也会使得饼干面团的表观黏度降低,这是因为作为LEP壁材的蛋清具有良好的吸水性。当蛋清吸收水分时,LR会同时利用其中的水分,从而导致面团的黏度降低。饼干面团的损失模量G″影响其挤压行为,而储存模量G′决定其支撑三维结构的能力[26]。从图4-c可以看出,5种比例的面团G′均大于小麦粉,说明LEP的加入使得饼干面团具有了更高的机械强度。当面团中LEP的比例为5/10时,G′和G″均达到最大值,说明该比例的面团经过挤压和打印后能良好地保持自身形状。这可能是因为5/10-面团中添加的蛋清量和LEP的封装效率恰到好处,LEP分散均匀在面团中形成了致密的三维网状结构。G″为黏性响应,是应力与应变的比率,用于动态振荡频率分析。G″/G′(tanδ)>1主要表现黏性特性,<1则表现弹性特性。由图4-b可知,所有比例的面团tanδ均小于1,含有 LEP的饼干面团均为黏弹性半固体,固体性能好、流动性差。在0.1~10 Hz的扫描范围内,饼干面团的tanδ随扫描频率的增加呈现先减小后增大的趋势。在高频范围内,饼干面团损失模量比例增大,导致系统结构不稳定,使得面团易从打印喷嘴处挤出。
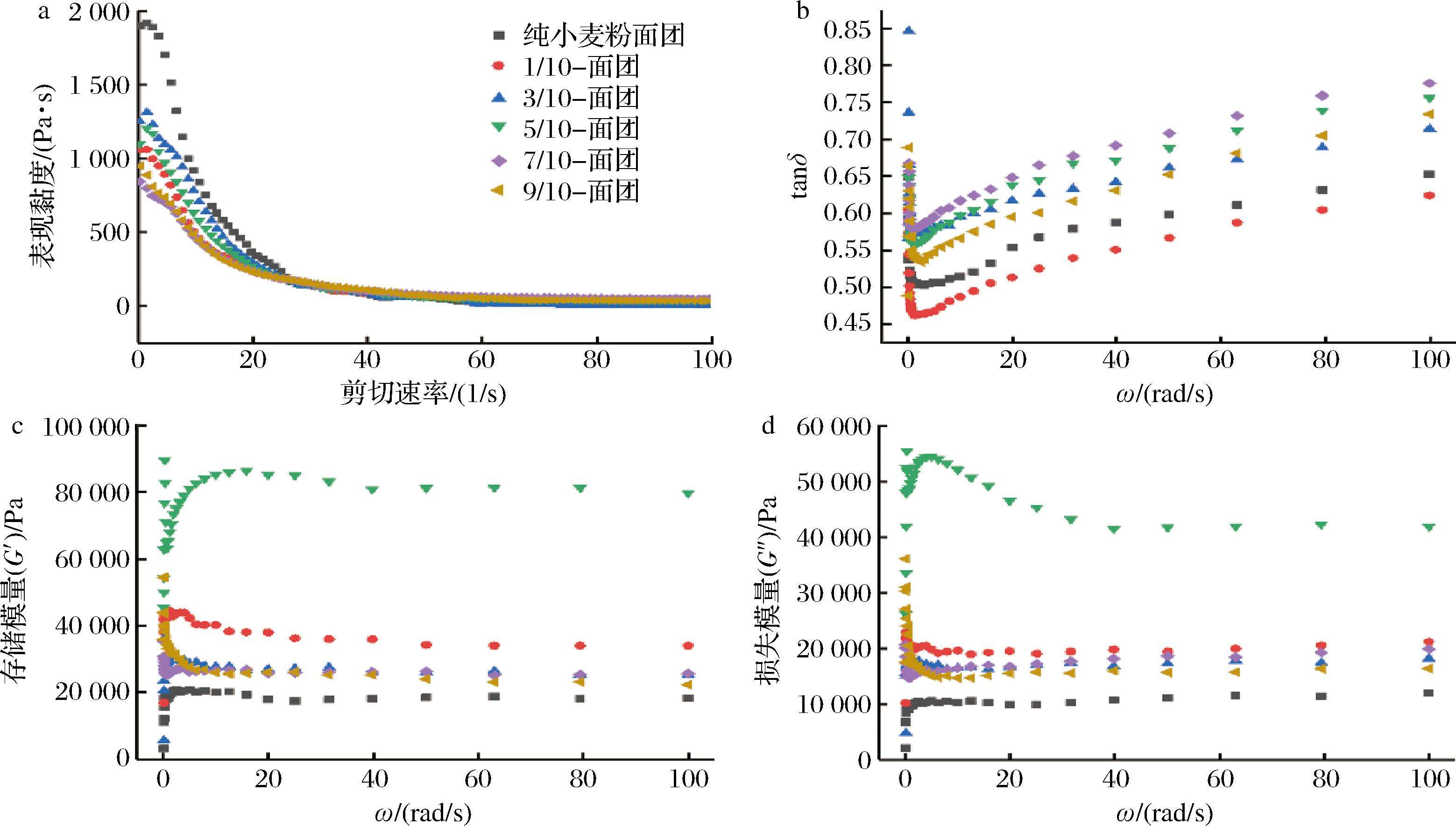
a-表观黏度;b-tanδ;c-储存模量;d-损失模量
图4 添加不同比例LEP的饼干面团的流变特性
Fig.4 Rheological behavior of cookie dough with different proportions of LEP
从图5可以看出,不同比例饼干面团之间的质构特性存在一定差异。与纯小麦粉面团相比,5/10、7/10、9/10面团的硬度和黏性显著提高(P<0.05),分别为114.61±3.91、120.43±0.86、116.82±2.15和72.04±2.63、73.77±2.9、71.61±1.94。黏附性也呈现出相同的趋势,这可能与面团中的蛋白质含量有关。而饼干面团的硬度与制作过程中添加的水量有关,纯小麦粉制成的面团可能含有更多的水分,而添加了LEP的面团可能会失去部分水分。这与面团流变特性形成的原因是一致的,都是因为LEP壁材蛋清的吸水性较好,而且LR也会利用面团的水分,导致其中的水分变少。面团的弹性是由小麦粉中蛋白质含量决定的,蛋白质分子之间相互作用形成三维网状结构。蛋白质含量高,则三维网状结构更稳定、更有弹性。由图5-b可知,添加LEP后面团的弹性变化不大。而所有面团的弹性均较大,这是由于小麦粉中的麦谷蛋白亚基之间交联从而形成了聚合物,麦谷蛋白之间形成了稳定的网状结构,从而提高了面团的弹性。
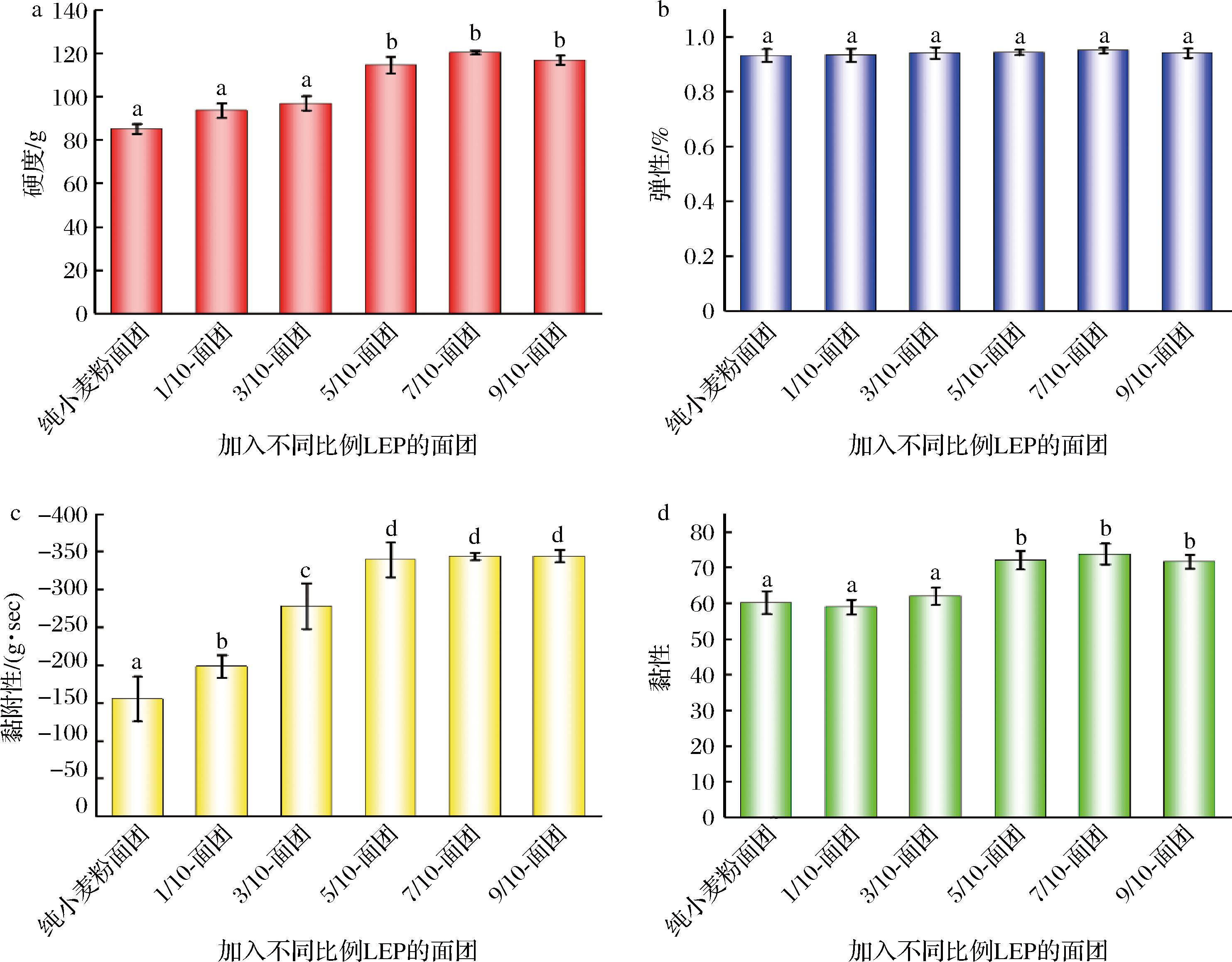
a-硬度;b-弹性;c-黏附性;d-黏性
图5 不同比例饼干面团的质构特性
Fig.5 The texture distribution analysis results of cookie dough adding different ratios of LEP

a-圆形饼干;b-五角星形饼干;c-方形饼干
图6 不同打印参数下饼干的外观
Fig.6 Appearances of cookie under different parameters
根据前面的性能分析,选择5/10-面团,7/10-面团和9/10-面团进行3D打印,研究压力、打印速度和喷嘴直径对打印饼干外观的影响,以打印的饼干外观来验证其3D打印适应性。从外观上看,在适当的打印参数下,3D打印制备的饼干纹理清晰。原料的3D打印适应性直接决定了是否能进行3D打印,以及打印出来的食物形状是否能随着时间推移而保持。从图6可以看出,3种比例的饼干面团均在15 mm/s,350 kPa,使用直径(d)为1 mm的喷嘴的打印条件下,打印质量最好。如图6-a所示,当压力相对过小时,压力不足以将面团推出喷嘴外,导致在打印过程中产生了不均匀的部分,其中包括杂乱的线条和明显的断点。当压力较高时,饼干面团可以快速从喷嘴中挤出,但会造成纹理弯曲和堆积,导致饼干变形严重。从图6-b可以看出,当打印速度太慢或太快时,挤出的面团无法跟随设置的轨迹,则会导致弯曲、缠绕堆积、断点等问题。如图6-c所示,喷嘴直径为1 mm时的表面结构最为光滑,喷嘴直径的大小直接影响打印饼干的精度和表面粗糙度。喷嘴直径越小,打印饼干的表面精度越高,打印所需时间越长。在气压恒定的条件下,喷嘴直径越小,面团在挤压时受到的压力越大,在这种情况下,内部结构的完整性就无法保证。然而,较大直径的喷嘴则会导致打印饼干的表面相对粗糙。这是因为从喷嘴挤出的大量面团破坏了预先设置的模型形状,导致打印的质量较差。因此,在适当的打印条件下,3种比例(5∶10,7∶10,9∶10)面团的3D打印适应性均良好,得到的3D打印饼干均表现出良好的外观。
本研究制备了罗伊氏乳杆菌封装颗粒LEP,将其加入到小麦粉中制备益生菌饼干面团,分析其物料特性及3D打印适应性。测量结果表明,LEP的粒径较小。LEP的封装效率较高,说明LR的封装效果良好、LR存活率高。3种不同比例(5∶10、7∶10、9∶10)LEP中的LR在模拟唾液、模拟胃液和模拟肠液的环境中均能维持高于106 CFU/mL的活菌数,表明被封装的LR可在肠道中发挥益生菌作用。当LEP中菌液与蛋清的添加量为5∶10加入到面团中时,面团的G′和G″均达到最大值,说明该比例LEP面团具有较高的机械强度,也说明该比例面团经过打印后能够良好地保持自身形状。在适宜的打印条件下,添加3种不同比例LEP(5∶10,7∶10,9∶10)的面团均表现出良好的3D打印适应性。
[1] AMARA A A, SHIBL A.Role of Probiotics in health improvement, infection control and disease treatment and management[J].Saudi Pharmaceutical Journal:SPJ:the Official Publication of the Saudi Pharmaceutical Society, 2015, 23(2):107-114.
[2] MARCO M L, SANDERS M E, G NZLE M, et al.The international scientific association for probiotics and prebiotics (ISAPP) consensus statement on fermented foods[J].Nature Reviews.Gastroenterology &Hepatology, 2021, 18(3):196-208.
NZLE M, et al.The international scientific association for probiotics and prebiotics (ISAPP) consensus statement on fermented foods[J].Nature Reviews.Gastroenterology &Hepatology, 2021, 18(3):196-208.
[3] ORTIZ-RIVERA Y, S NCHEZ-VEGA R, GUTIÉRREZ-MÉNDEZ N, et al.Production of reuterin in a fermented milk product by Lactobacillus reuteri:Inhibition of pathogens, spoilage microorganisms, and lactic acid bacteria[J].Journal of Dairy Science, 2017, 100(6):4258-4268.
NCHEZ-VEGA R, GUTIÉRREZ-MÉNDEZ N, et al.Production of reuterin in a fermented milk product by Lactobacillus reuteri:Inhibition of pathogens, spoilage microorganisms, and lactic acid bacteria[J].Journal of Dairy Science, 2017, 100(6):4258-4268.
[4] BAKHSHI M, SALARI S, ALMANI P G N, et al.Evaluation of the antifungal activity of Lactobacillus reuteri against Candida species[J].Gene Reports, 2021, 25:101369.
[5] ZAM W.Microencapsulation:A prospective to protect probiotics[J].Current Nutrition &Food Science, 2020, 16(6):891-899.
[6] ALAIN L B, CHIEREGATO M B, PATRICIA L B.3D printing of foods:Recent developments, future perspectives and challenges[J].Current Opinion in Food Science, 2020, 35:54-64.
[7] DING Y, YAN Y M, PENG Y J, et al.In vitro digestion under simulated saliva, gastric and small intestinal conditions and fermentation by human gut microbiota of polysaccharides from the fruits of Lycium barbarum[J].International Journal of Biological Macromolecules, 2019, 125:751-760.
[8] SANDOVAL-CASTILLA O, LOBATO-CALLEROS C, GARC A-GALINDO H S, et al.Textural properties of alginate-pectin beads and survivability of entrapped Lb.casei in simulated gastrointestinal conditions and in yoghurt[J].Food Research International, 2010, 43(1):111-117.
A-GALINDO H S, et al.Textural properties of alginate-pectin beads and survivability of entrapped Lb.casei in simulated gastrointestinal conditions and in yoghurt[J].Food Research International, 2010, 43(1):111-117.
[9] AHMAD ASHWAR B, GANI A, GANI A, et al.Production of RS4 from rice starch and its utilization as an encapsulating agent for targeted delivery of probiotics[J].Food Chemistry, 2018, 239:287-294.
[10] WANG L, ZHANG M, BHANDARI B, et al.Investigation on fish surimi gel as promising food material for 3D printing[J].Journal of Food Engineering, 2018, 220:101-108.
[11] QIN X S, GAO Q Y, LUO Z G.Enhancing the storage and gastrointestinal passage viability of probiotic powder (Lactobacillus plantarum) through encapsulation with Pickering high internal phase emulsions stabilized with WPI-EGCG covalent conjugate nanoparticles[J].Food Hydrocolloids, 2021, 116:106658.
[12] YOHA K S, MOSES J A, ANANDHARAMAKRISHNAN C.Conductive hydro drying through refractance window drying:An alternative technique for drying of Lactobacillus plantarum (NCIM 2083)[J].Drying Technology, 2020, 38(5-6):610-620.
[13] YOHA K S, MOSES J A, ANANDHARAMAKRISHNAN C.Effect of encapsulation methods on the physicochemical properties and the stability of Lactobacillus plantarum (NCIM 2083) in synbiotic powders and in-vitro digestion conditions[J].Journal of Food Engineering, 2020, 283:110033.
[14] NUALKAEKUL S, LENTON D, COOK M T, et al.Chitosan coated alginate beads for the survival of microencapsulated Lactobacillus plantarum in pomegranate juice[J].Carbohydrate Polymers, 2012, 90(3):1281-1287.
[15] CASSANI L, GOMEZ-ZAVAGLIA A, SIMAL-GANDARA J.Technological strategies ensuring the safe arrival of beneficial microorganisms to the gut:From food processing and storage to their passage through the gastrointestinal tract[J].Food Research International, 2020, 129:108852.
[16] GARC A-CANO I, ROCHA-MENDOZA D, ORTEGA-ANAYA J, et al.Lactic acid bacteria isolated from dairy products as potential producers of lipolytic, proteolytic and antibacterial proteins[J].Applied Microbiology and Biotechnology, 2019, 103(13):5243-5257.
A-CANO I, ROCHA-MENDOZA D, ORTEGA-ANAYA J, et al.Lactic acid bacteria isolated from dairy products as potential producers of lipolytic, proteolytic and antibacterial proteins[J].Applied Microbiology and Biotechnology, 2019, 103(13):5243-5257.
[17] DEVI S M, AISHWARYA S, HALAMI P M.Discrimination and divergence among Lactobacillus plantarum-group (LPG) isolates with reference to their probiotic functionalities from vegetable origin[J].Systematic and Applied Microbiology, 2016, 39(8):562-570.
[18] MANI-L PEZ E, PALOU E, L
PEZ E, PALOU E, L PEZ-MALO A.Probiotic viability and storage stability of yogurts and fermented milks prepared with several mixtures of lactic acid bacteria[J].Journal of Dairy Science, 2014, 97(5):2578-2590.
PEZ-MALO A.Probiotic viability and storage stability of yogurts and fermented milks prepared with several mixtures of lactic acid bacteria[J].Journal of Dairy Science, 2014, 97(5):2578-2590.
[19] BOCK J E, DAMODARAN S.Bran-induced changes in water structure and gluten conformation in model gluten dough studied by Fourier transform infrared spectroscopy[J].Food Hydrocolloids, 2013, 31(2):146-155.
[20] YANG T, YAN H L, TANG C H.Wet media planetary ball milling remarkably improves functional and cholesterol-binding properties of okara[J].Food Hydrocolloids, 2021, 111:106386.
[21] FAN X J, CHANG H D, LIN Y N, et al.Effects of ultrasound-assisted enzyme hydrolysis on the microstructure and physicochemical properties of okara fibers[J].Ultrasonics Sonochemistry, 2020, 69:105247.
[22] CHEN B F, CAI Y J, LIU T X, et al.Improvements in physicochemical and emulsifying properties of insoluble soybean fiber by physical-chemical treatments[J].Food Hydrocolloids, 2019, 93:167-175.
[23] LIN D R, LONG X M, HUANG Y C, et al.Effects of microbial fermentation and microwave treatment on the composition, structural characteristics, and functional properties of modified okara dietary fiber[J].LWT, 2020, 123:109059.
[24] LE TOHIC C, O’SULLIVAN J J, DRAPALA K P, et al.Effect of 3D printing on the structure and textural properties of processed cheese[J].Journal of Food Engineering, 2018, 220:56-64.
[25] LILLE M, NURMELA A, NORDLUND E, et al.Applicability of protein and fiber-rich food materials in extrusion-based 3D printing[J].Journal of Food Engineering, 2018, 220:20-27.
[26] RUESCHHOFF L, COSTAKIS W, MICHIE M, et al.Additive manufacturing of dense ceramic parts via direct ink writing of aqueous alumina suspensions[J].International Journal of Applied Ceramic Technology, 2016, 13(5):821-830.