表1 引物序列
Table 1 Primer sequences

免疫系统能够提高机体免疫力、抵御外界病原体攻击,其功能主要是通过免疫细胞和免疫分子来发挥作用[1-2]。巨噬细胞是常见的免疫细胞,也是免疫系统中抵御病原体入侵的第一道防线,在先天免疫和炎症反应中具有重要的作用[3]。此外,巨噬细胞具有抗原呈递、募集与趋化等多种功能,不仅可以直接吞噬和杀死病原体,还能够刺激NO、白细胞介素(interleukin, IL)、干扰素(interferon, IFN)、肿瘤坏死因子(tumor necrosis factor, TNF)等细胞因子的分泌,进而调节机体的免疫与炎症反应[4]。因此,常用巨噬细胞及其相关因子来进行体外免疫活性的研究。
多糖是一类结构复杂的天然大分子物质,具有减缓肿瘤和炎症发生、抵抗病毒侵入、降血糖、缓解疲劳、免疫调节等多种生物活性[5]。免疫调节作为多糖最显著的生物活性之一,受到越来越多的学者的关注[6]。临床上,香菇多糖能够改善肿瘤微环境的免疫反应,用于抗肿瘤的辅助治疗;灵芝多糖主要用于神经官能症、多发性肌炎、皮肌炎等因免疫功能紊乱所致的各种疾病的治疗[7]。此外,还有很多处于非临床研究的多糖或多糖组分也具有显著的免疫调节活性。例如,欧李多糖组分CHPP-2和阿魏侧耳胞外多糖组分PFEPw-1均能够刺激RAW264.7细胞分泌细胞因子,增强免疫活性[8-9];再如,地黄硒多糖能够提高小鼠脾脏和胸腺的功能、促进小鼠脾脏淋巴细胞增殖和Th1型淋巴细胞中IL-2、IFN-γ的分泌,表现出较强的免疫增强活性[10]。且多糖具有无毒、易降解等优势,其被认为是理想的免疫调节剂候选物质[11]。
树莓(Rubus idaeus L.)是一种常见的经济型浆果,因其果实中含有丰富的生理活性物质而被誉为“黄金水果”[12]。研究表明在膳食中添加树莓,能够起到抗肥胖、防止肝及内脏脂肪堆积和调节脂类代谢的作用[13]。多糖作为树莓中重要的天然大分子,近年来得到了广泛的研究。ZHANG等[14]发现树莓粗多糖能够通过抑制脂多糖引起的RAW264.7细胞增殖以及降低炎症因子IL-6和TNF-α的mRNA表达来发挥抗炎作用;此外,树莓粗多糖还能够通过促进炎症因子和趋化因子的表达和分泌来激活巨噬细胞,调节免疫反应[15]。前期研究发现,树莓粗多糖能够增加荷瘤小鼠的细胞免疫反应,进而发挥抗肿瘤的作用[16]。随着研究的深入,具有显著生理活性的多糖组分不断从树莓中分离纯化出来。如树莓多糖RCP-II,能够清除大量的DPPH自由基、羟自由基和氧自由基,显示出较强的抗氧化活性[17];红树莓多糖组分RCP-Ⅰ能够降低大鼠血清中的甘油三酯、总胆固醇和低密度脂蛋白胆固醇的含量,升高高密度脂蛋白胆固醇的含量,进而起到预防高血脂症的作用[12]。前期研究表明,从树莓果肉中分离纯化获得的酸性多糖RPP-2a能够刺激RAW264.7细胞中TNF-α、IL-1β、IL-6和NO的分泌,促进TNF-α、IL-1β、IL-6的mRNA表达,表现出较强的免疫增强活性[18]。
本研究采用DEAE-Sepharose Fast Flow和Sephadex G-200对树莓粗多糖进行分离纯化获得多糖组分RPP-5,并进一步分析RPP-5的结构特征及其在RAW264.7细胞中的免疫调节作用,为其进一步开发和利用提供理论参考和实践依据。
树莓冷冻果,青海树莓农业产业化有限公司(青海湟源);RAW264.7细胞,中国科学院细胞库;RAW264.7细胞专用培养基、1640培养基、青-链霉素混合液(P/S)、胰蛋白酶、胎牛血清(fetal bovine serum,FBS),武汉普诺赛生命科技有限公司;PBS,青海莱茵尔生物科技有限责任公司;TNF-α、IL-6、IL-1β酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒,武汉博士德生物工程有限公司;CCK-8试剂盒,武汉伊莱瑞特生物科技股份有限公司;总RNA提取试剂盒、cDNA第一链合成预混试剂、SuperReal彩色荧光定量预混试剂,天根生化科技有限公司;引物,金唯智生物科技有限公司;三氟乙酸,NaCl,北京伊诺凯科技有限公司;硼氢化钠、高氯酸,上海西格玛奥德里奇贸易有限公司;乙酸乙酯,北京沃凯生物科技有限公司;醋酐、NaOH、乙酸酐,上海沪试实验器材股份有限公司;乙酸,中国赛默飞世尔科技有限公司;甲醇,德国默克公司;二甲基亚砜、NaH、碘甲烷,中国阿达玛斯试剂公司;甲基化试剂盒,扬州博睿糖生物技术有限公司;NO测定试剂盒,武汉生物技术有限公司。
Multiskan MK3酶标仪、D-37520离心机,上海赛默飞世尔科技公司;BSZ-100自动收集器、BRT105-104-102串联凝胶、多糖凝胶纯化系统,扬州博睿糖生物技术有限公司;UGC-24M氮吹仪,力辰科技有限公司;MS7-H550-Pro磁力搅拌器,无锡德凡仪器有限公司;GCMS-QP2010气相质谱联用仪、RID-10A FRC-10A高效液相色谱仪,日本岛津公司;Sephadex G-200葡聚糖凝胶,美国通用电气公司;RI-502SHODEX示差折光检测器,日本昭和电工集团;HF100三气培养箱,上海力申科学仪器有限公司。
1.3.1 树莓粗多糖的提取
采用超声波辅助法提取树莓粗多糖。于电热恒温鼓风干燥箱中(温度55 ℃)除去树莓冷冻果水分后用高速万能粉碎机粉碎(22 000 r/min,1~2 s)并过80目筛,获得树莓果粉。按照1∶4(g∶mL)的料液比向果粉中加入体积分数80%乙醇脱脂。之后60 ℃加热回流除去树莓果粉中的色素、单糖和寡糖,之后以1∶5(g∶mL)的料液比加入双蒸水于60 ℃下超声波提取1 h,离心弃上清液,浸提后收集提取液。采用Sevag法除蛋白,重复操作4~5次充分除去蛋白。将除去蛋白的提取液在60 ℃下进行旋转蒸发,浓缩至原来体积的1/4后加入4倍体积95%乙醇,低温醇沉过夜后离心取沉淀物,冷冻干燥至粉末状即得树莓粗多糖。
1.3.2 RPP-5的分离纯化
配制100 mg/mL的树莓粗多糖溶液,采用DEAE Sepharose Fast Flow色谱柱(7.5 cm×60 cm)对其进行极性分离,分别使用0、0.2、0.4、0.8、1.5 mol/L的NaCl溶液洗脱,流速为5 mL/min,收集洗脱液。采用苯酚-硫酸法测定多糖含量,合并馏分,经浓缩、透析和冷冻干燥后获得多糖样品。将经DEAE Sepharose Fast Flow色谱柱纯化后的多糖配制成100 mg/mL的多糖溶液,经微孔滤膜过滤后采用多糖凝胶纯化系统按照分子质量差异进一步纯化,洗脱剂为蒸馏水,流速为0.5 mL/min。采用Sephadex G-200葡聚糖凝胶层析柱(2.6 cm×60 cm)进行多糖纯化,通过博睿糖生物技术有限公司特制的多糖凝胶纯化系统结合示差检测器(RI-502 SHODEX)对多糖进行在线监测,并收集对称峰溶液,最后经冷冻干燥后的样品即为树莓多糖组分RPP-5。
1.3.3 RPP-5的含量及其分子质量测定
配制1 mg/mL的RPP-5溶液,取0.2 mL RPP-5溶液加入1 mL乙醇,于4 ℃静置1 h后,8 000 r/min离心5 min,弃上清液后加入80%乙醇,离心留沉淀。之后加入2 mL蒸馏水,沸水浴加热使沉淀溶解后,将该溶液作为多糖检测液,取该溶液100 μL,依次加入50 μL试剂一、250 μL浓硫酸,沸水浴20 min后,488 nm处测定吸光度,按照多糖含量试剂盒说明书计算多糖含量。采用高效凝胶渗透色谱法测定树莓多糖组分的分子质量。配制多糖溶液,将过滤后的多糖溶液加入到进样小瓶中。使用装有BRT105-104-102系列色谱柱(8 mm×300 mm)和RI-502示差折光检测器的LC-10A高效液相色谱系统测定RPP-5的分子质量。
1.3.4 单糖组成分析
通过GC-MS分析RPP-5的单糖组成。分别取2 mg RPP-5和单糖标准品,于120 ℃条件下加入三氟乙酸水解,冷却至室温后经旋转蒸发仪蒸干除去剩余的三氟乙酸,在残基中加入双蒸水、硼氢化钠和冰醋酸将其还原中和,经旋蒸、烘干后加入乙酸酐,100 ℃反应1 h,冷却后加入甲苯,减压浓缩蒸干。重复以上步骤4~5次,除去多余的醋酐,获得乙酰化衍生产物。使用配备有CarboPacTMPA-20分析柱(3 mm×150 mm)和脉冲电流检测器Dionex ICS-5000系统测定乙酰化衍生产物。首先用等度NaOH(250 mmol/L)洗脱10 min,之后用含有50 mmol/L NaOH的醋酸钠(500 mmol/L)继续洗脱30 min。将洗脱温度、进样量和流速分别设置为30 ℃、5 μL和0.3 mL/min。最后,对比RPP-5与各单糖标准品的保留时间和峰面积,分析并计算RPP-5的单糖组成和物质的量比。
1.3.5 傅里叶红外光谱分析
精确称取RPP-5 2 mg和KBr 200 mg,制成粉末后,采用傅里叶变换红外光谱仪在4 000~400 cm-1范围内进行分析。
1.3.6 甲基化分析
称量RPP-5样品(2~3 mg)置于玻璃反应瓶中,加入无水DMSO、甲基化试剂A液,经超声波溶解后再加入甲基化试剂B液,并对其进行水浴后加入超纯水加入终止甲基化反应,获得甲基化产物。取甲基化后的多糖同1.3.4节的方法进行乙酰化处理,使用配备有RXI-5 SIL MS色谱柱(30 m×0.25 mm×0.25 μm)的GC-MS仪器检测乙酰化衍生产物,经GC-MS测定后与标准质谱图库进行比对。条件如下:初始柱温120 ℃,升温速度3 ℃/min,H2流速1 mL/min,检测器温度到达250 ℃,5 min后进行分析。
1.3.7 树莓多糖组分免疫调节活性研究
1.3.7.1 细胞培养
采用RAW264.7细胞专用培养基(含体积分数15% FBS)培养RAW264.7细胞,三气培养箱温度为37 ℃,CO2浓度为5%。当细胞密度为80%以上时,将RAW264.7细胞(1×104个/孔)接种到96孔板中。
1.3.7.2 细胞活力测定
接种至96孔板中的细胞于三气培养箱中继续孵育12 h后,加入不同质量浓度的RPP-5溶液(0、20、40、80、160 μg/mL)及阳性对照脂多糖(lipopolysaccharide,LPS)溶液(5 μg/mL),以加入0 μg/mL多糖溶液的RAW264.7细胞作为空白对照组,每个浓度设置6个复孔,继续于37 ℃、5% CO2的三气培养箱中培养24 h后,每孔加入10 μL CCK-8,于三气培养箱中孵育1 h,450 nm处测定吸光值。
1.3.7.3 NO的含量测定
RAW264.7细胞培养及处理同1.3.7.2节,收集RAW264.7细胞培养液,按照NO测定试剂盒说明书操作测定RAW264.7细胞中NO的含量。
1.3.7.4 IL-6、IL-1β和TNF-α的含量测定
RAW264.7细胞培养及处理同1.3.7.2节,收集RAW264.7细胞培养液,按照ELISA检测试剂盒测定试剂盒说明书操作,分别测定RAW264.7细胞中IL-1β、IL-6和TNF-α的含量。
1.3.7.5 IL-6、IL-1β和TNF-α mRNA表达量的测定
将RAW264.7细胞(2×106个/孔)接种至6孔板中,于三气培养箱中培养12 h后,将培养基更换为5 μg/mL的LPS和不同浓度的RPP-5溶液,每个浓度设置3个复孔,继续培养24 h。使用总RNA提取试剂盒提取RAW264.7细胞中的总RNA,之后使用cDNA第一链合成预混试剂将mRNA逆转录为cDNA,将cDNA作为第一链为合成模板,进行Real-time PCR扩增,根据2-△△Ct相对定量法计算目的基因的相对表达量。引物序列见表1。
表1 引物序列
Table 1 Primer sequences

数据用SPSS 26.0软件进行统计学分析,实验数据以平均值±标准偏差形式表示,采用ANOVA单因素方差分析进行组间比较。P<0.05表示数据之间存在显著差异;P<0.01表示数据之间存在极显著差异。
如图1-a所示,在DEAE-Sepharose Fast Flow层析柱上分别以0、0.2、0.4、0.8、1.5 mol/L的NaCl作为洗脱液进行洗脱,出现了5个洗脱峰,说明树莓粗多糖中含有5个不同极性的组分,分别命名为组分1(0 mol/L NaCl)、组分2(0.2 mol/L NaCl)、组分3(0.4 mol/L NaCl)、组分4(0.8 mol/L NaCl)和组分5(1.5 mol/L NaCl)。其中除了组分1为中性多糖外,其余组分均为酸性多糖。将1.5 mol/L NaCl洗脱下来的组分5在Sephadex G-200凝胶层析柱进一步纯化,在洗脱时间为149~169 min时获得一个单一对称峰,说明该多糖组分具有较好的分子质量均一性,将其命名为RPP-5(图1-b)。

a-树莓粗多糖的DEAE-Sepharose Fast Flow色谱洗脱曲线;b-RPP-5的Sephadex G-200柱洗脱曲线
图1 树莓多糖组分的分离纯化
Fig.1 Isolation and purification of raspberry polysaccharide
经测定,RPP-5的糖含量为99.8%。由图2可知,在洗脱时间为42~44 min时获得一个单一对称峰(洗脱时间46~49 min时为溶剂峰)进一步证实了RPP-5为分子质量均一的多糖组分。根据标准曲线方程计算得RPP-5的重均分子质量、数均分子质量和峰位分子质量分别为7 598、6 183、7 492 Da。
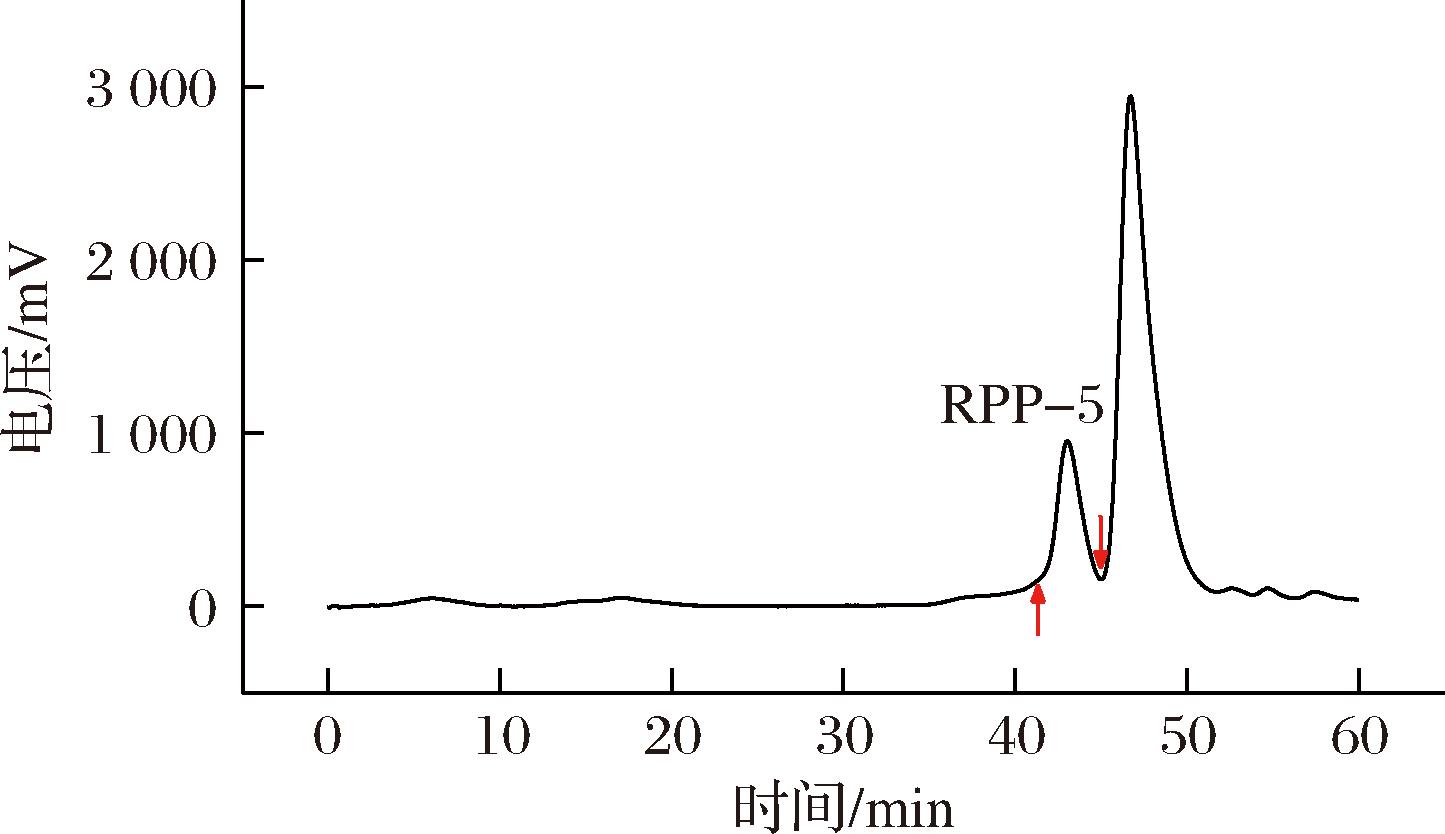
图2 RPP-5分子质量测定
Fig.2 Molecular weight determination of RPP-5
如图3所示,根据保留时间和峰面积得知,RPP-5中存在6种单糖,分别为阿拉伯糖、葡萄糖、半乳糖、鼠李糖、木糖和甘露糖,物质的量比为44.5∶21.7∶15.9∶8.8∶5.0∶4.1。其中,阿拉伯糖的含量最高,其次是葡萄糖和半乳糖。
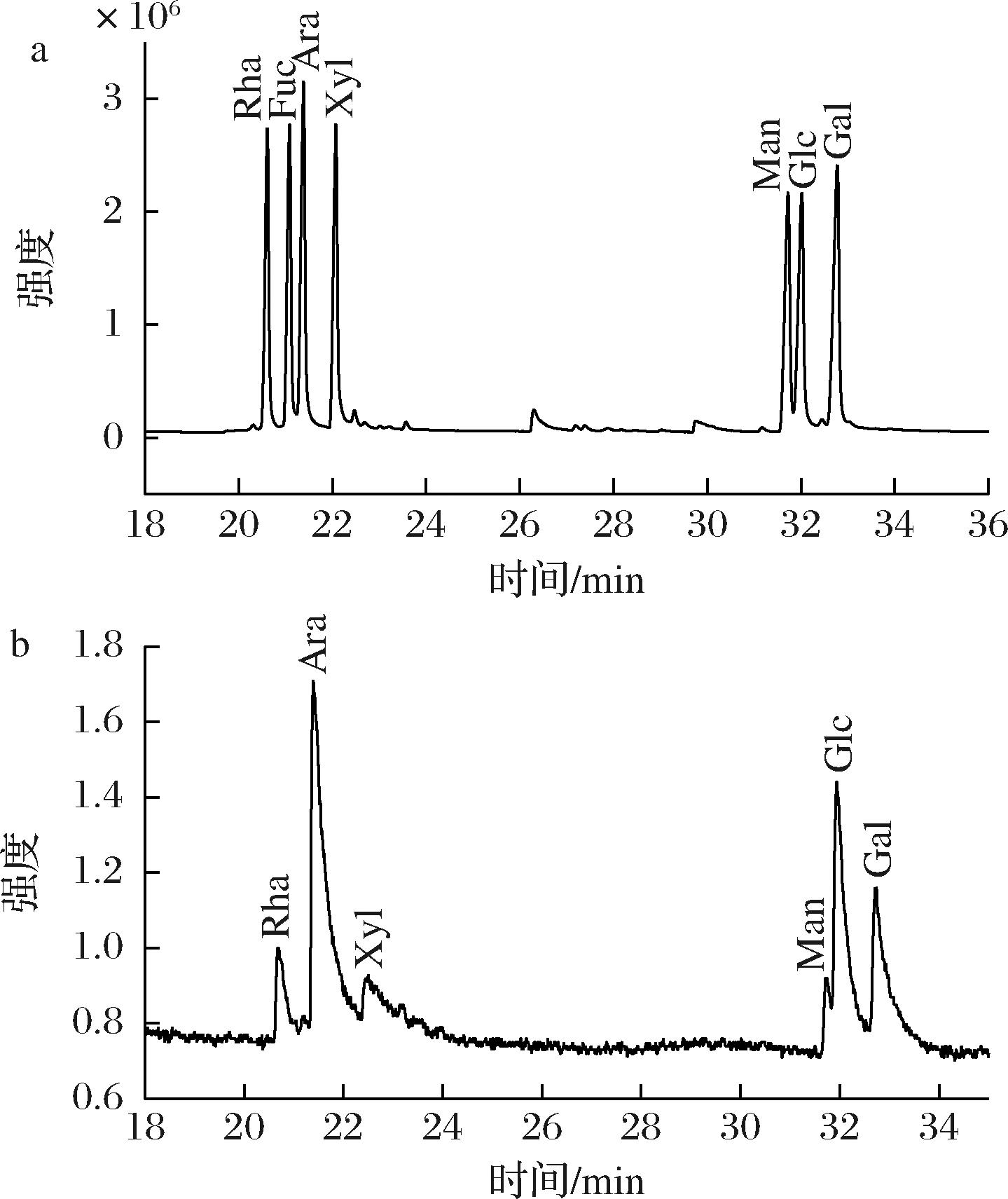
a-混合单糖标准物的GC-MS图谱;b-RPP-5的GC-MS图谱
图3 RPP-5的单糖组成
Fig.3 Mixed monosaccharide standard and monosaccharide profile of RPP-5
结果如图4所示,吸收带在3 600~3 200 cm-1是—OH的伸缩振动吸收峰,这个区域的吸收峰是糖类的特征峰[19]。具体如下:3 409 cm-1是O—H的伸缩振动吸收峰,是糖类的特征峰[20]。1 631 cm-1处存在结合水的特征吸收峰[21]。1 415 cm-1和1 137 cm-1处的吸收峰均是由C—O伸缩振动所致[22-23]。在873 cm-1处有一个吸收峰,可能为端基差向异构C—H以外的C—H变角振动[24]。
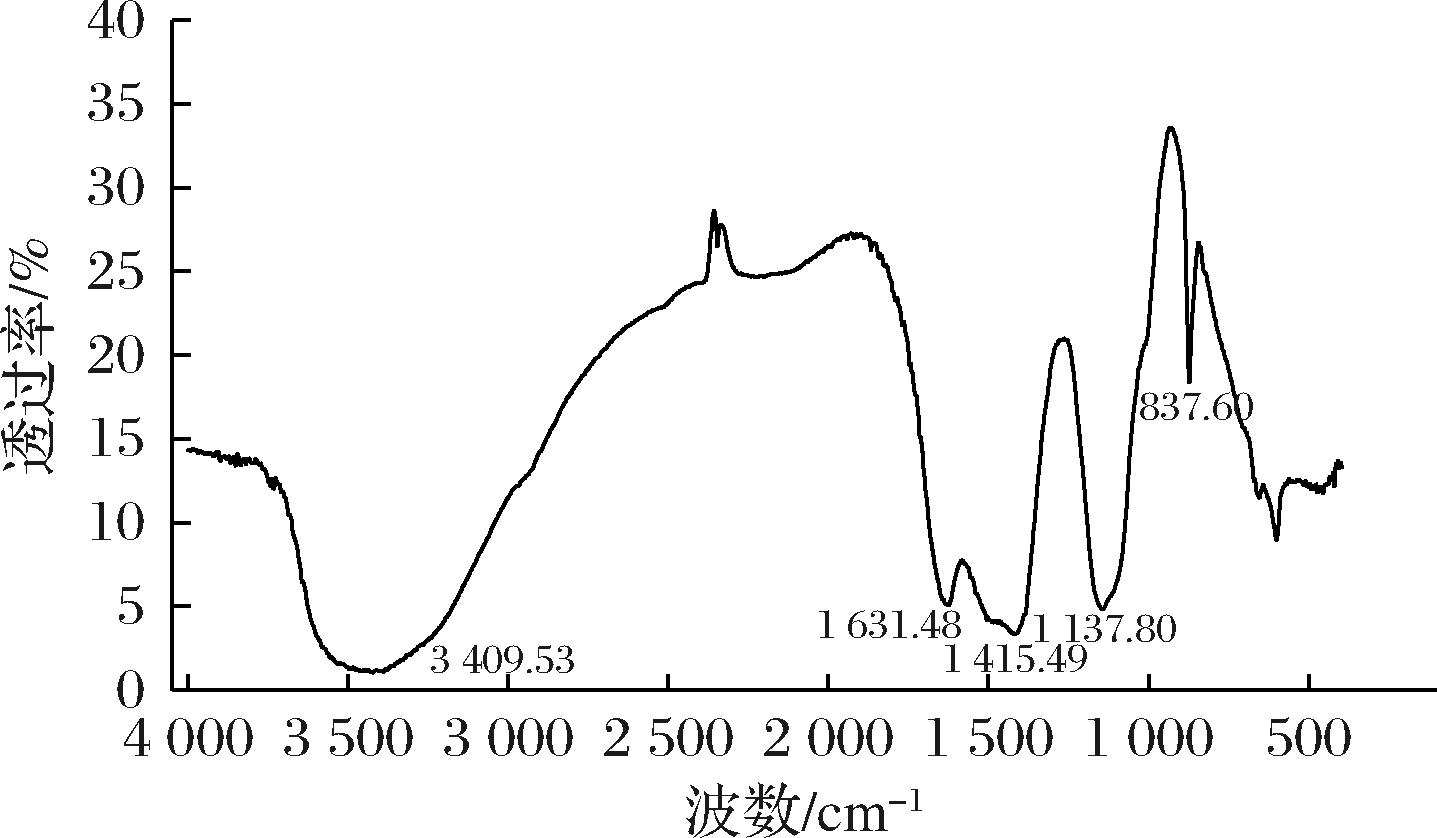
图4 RPP-5的红外光谱图
Fig.4 FT-IR spectrum of RPP-5
如图5所示,RPP-5的GC-MS图谱中出现12个峰,与标准质谱图库进行比对后可知,存在1→3、1→4、1→5、1→4,6和1→3,4,6等糖苷键连接类型。其中葡萄糖和半乳糖都表现出3种乙酰化衍生产物,分别为2,3,6-Me3-Glcp、2,3-Me2-Glcp、2-Me1-Glcp和2,3,4,6-Me4-Galp、2,3,6-Me3-Galp、2,3,4-Me3-Galp,其连接方式分别为→4)-Glcp-(1→、→4,6)-Glcp-(1→、→3,4,6)-Glcp-(1→和Galp-(1→、→4)-Galp-(1→、→6)-Galp-(1→;阿拉伯糖表现出4种乙酰化衍生产物,即2,3,5-Me3-Araf、2,3-Me2-Araf、2,3,4-Me3-Arap和2,4-Me2-Arap,其连接方式分别为Araf-(1→、→5)-Araf-(1→、Arap-(1→和→3)-Arap-(1→;而木糖和甘露糖各自表现出一种乙酰化衍生产物,即2,3-Me2-Xylp和2,3,4,6-Me4-Manp,其连接方式分别为→4)-Xylp-(1→和Manp-(1→。根据峰面积计算连接方式含量可知,→4)-Galp-(1→的含量为26.27%,含量最高,其次是→4)-Xylp-(1→、Araf-(1→和→4,6)-Glcp-(1→,含量分别为16.50%、11.38%和10.41%,其他连接方式的含量均小于10%(表2)。以上结果说明,RPP-5是一种具有多支链结构的杂多糖,推测其主链主要由→4)-Galp-(1→和→4)-Xylp-(1→组成,其支链中可能含有Araf-(1→、Galp-(1→、Arap-(1→、Manp-(1→、→3)-Arap-(1→、→6)-Galp-(1→、→3,4,6)-Glcp-(1→等残基。
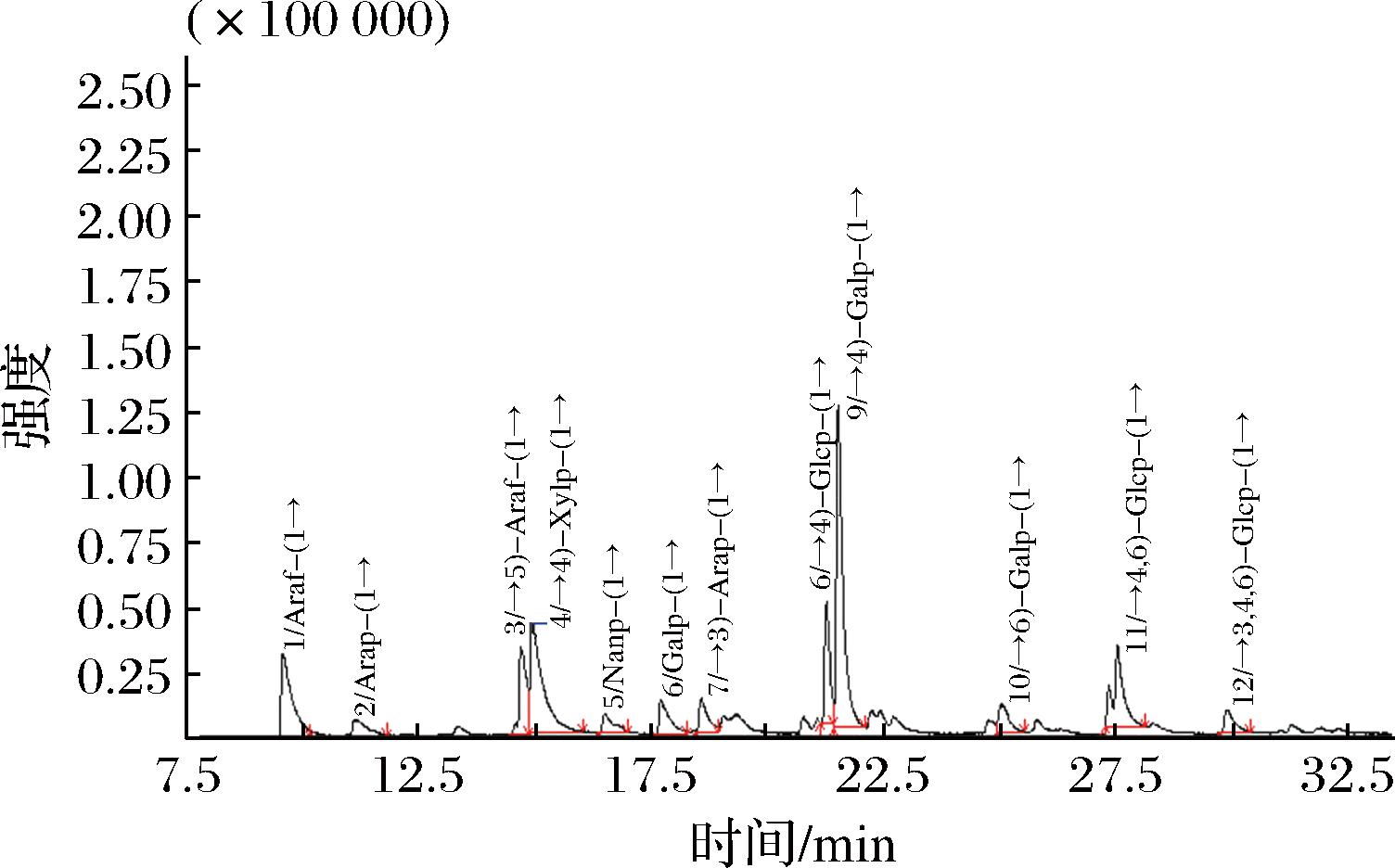
图5 RPP-5的GC-MS图谱
Fig.5 GC-MS pattern of RPP-5
表2 RPP-5的GC-MS分析
Table 2 GC-MS analysis of RPP-5

保留时间/min多糖甲基化糖醇乙酰酯质荷比(m/z)占比/%连接方式0.5772,3,5-Me3-Araf43,71,87,101,117,129,145,16111.38Araf-(1→11.1412,3,4-Me3-Arap43,89,101,117,131,1612.74Arap-(1→14.7002,3-Me2-Araf43,87,99,101,117,129,161,173,1898.07→5)-Araf-(1→14.9442,3-Me2-Xylp43,87,101,117,129,161,18916.50→4)-Xylp-(1→16.5112,3,4,6-Me4-Manp43,71,87,101,117,129,145,161,2052.57Manp-(1→17.7112,3,4,6-Me4-Galp43,71,87,101,117,129,145,161,2054.35Galp-(1→18.5762,4-Me2-Arap43,85,99,117,127,159,2013.50→3)-Arap-(1→21.2822,3,6-Me3-Glcp43,71,87,99,101,113,117,129,131,161,173,2337.84→4)-Glcp-(1→21.5252,3,6-Me3-Galp43,71,87,99,101,113,117,129,131,161,173,23326.27→4)-Galp-(1→25.0342,3,4-Me3-Galp43,87,99,101,117,129,161,173,189,2333.49→6)-Galp-(1→27.5432,3-Me2-Glcp43,85,99,101,117,127,142,201,26110.41→4,6)-Glcp-(1→29.8922-Me1-Glcp43,87,98,117,129,159,1892.88→3,4,6)-Glcp-(1→
2.6.1 RPP-5对RAW264.7细胞活力的影响
如图6所示,与空白对照组相比,经质量浓度为20~160 μg/mL的RPP-5处理之后,RAW264.7细胞活力极显著升高(P<0.01)。
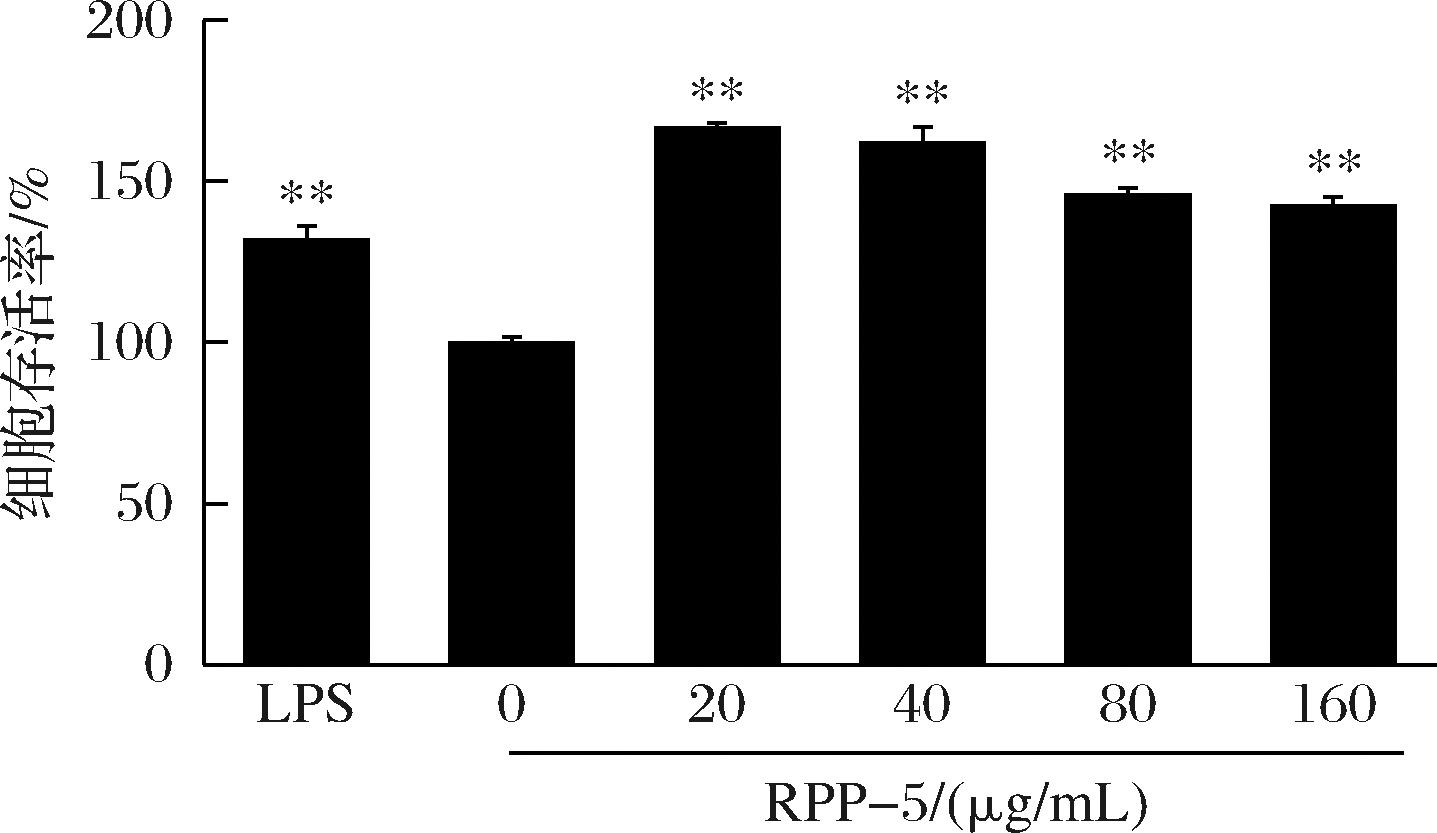
图6 RPP-5对RAW264.7细胞活力的影响
Fig.6 Effects of RPP-5 on the viability of RAW264.7 cells
注:与空白对照组相比,**P<0.01,*P<0.05(下同)。
2.6.2 RPP-5对RAW264.7细胞中NO含量的影响
如图7所示,与空白对照组相比,经质量浓度为20~160 μg/mL的RPP-5处理后,NO的含量极显著升高(P<0.01),且呈现明显的剂量依赖效应。
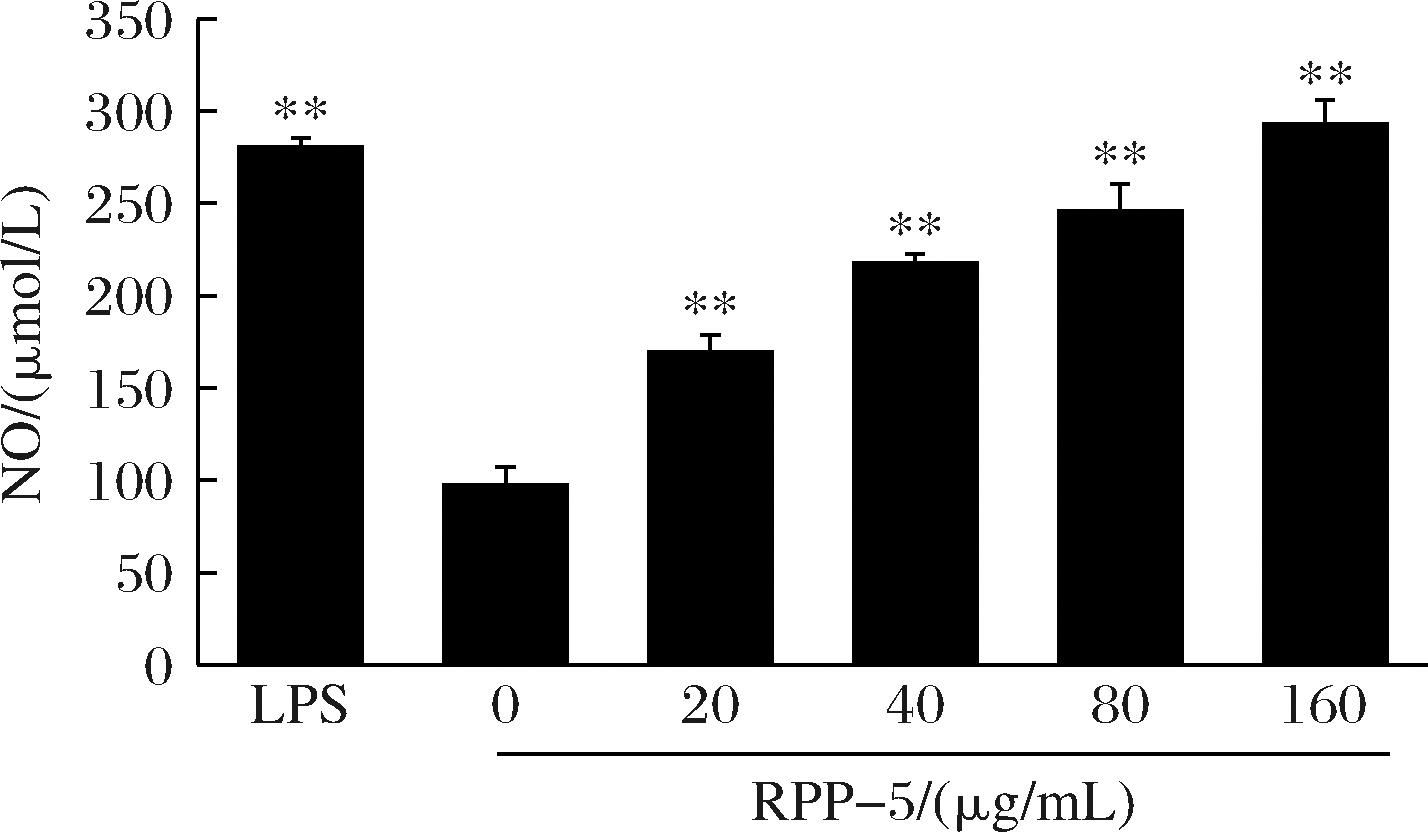
图7 RPP-5对RAW264.7细胞中NO的影响
Fig.7 Effects of RPP-5 on NO in RAW264.7 cells
2.6.3 RPP-5对RAW264.7细胞培养液中IL-6、IL-1β和TNF-α含量的影响
如图8-a所示,与空白对照组相比,经质量浓度为20~160 μg/mL的RPP-5处理后,IL-6的含量极显著上升且呈现剂量依赖性(P<0.01)。图8-b显示,与空白对照组RAW264.7细胞相比,经40~160 μg/mL的RPP-5处理后,IL-1β的含量明显升高(P<0.01,P<0.05);图8-c结果表明,与空白对照组RAW264.7细胞相比,经20~160 μg/mL的RPP-5处理后,TNF-α的含量极显著升高(P<0.01)。

a-IL-6;b-IL-1β;c-TNF-α
图8 RPP-5对RAW264.7细胞培养液中IL-6、IL-1β和TNF-α的影响
Fig.8 Effects of RPP-5 on IL-6, IL-1β and TNF-α in RAW264.7 culture broth
2.6.4 RPP-5对RAW264.7细胞中IL-6、IL-1β和TNF-α mRNA表达量的影响
如图9-a与9-b所示,与空白对照组相比,经浓度为20~160 μg/mL的RPP-5处理后,RAW264.7细胞中IL-6和IL-1β mRNA的表达量均极显著增加(P<0.01);图9-c显示,经40~160 μg/mL的RPP-5处理时,能够极显著升高RAW264.7细胞中TNF-α mRNA的表达量(P<0.01)。当RPP-5质量浓度为160 μg/mL时,IL-6、IL-1β和TNF-α mRNA的表达量均为最高。
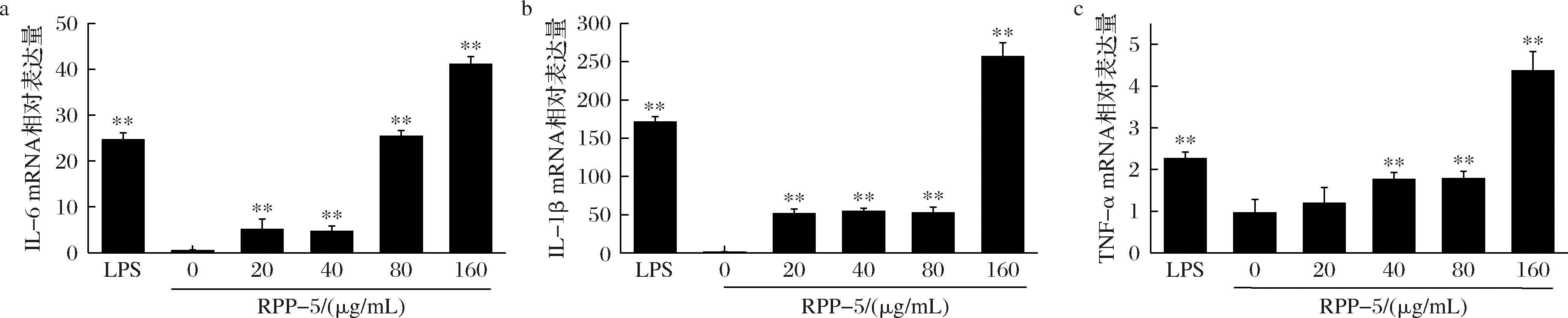
a-IL-6;b-IL-1β;c-TNF-α
图9 RPP-5对RAW264.7细胞中IL-6、IL-1β和TNF-α mRNA表达的影响
Fig.9 The effect of RPP-5 on the mRNA expression of IL-6, IL-1β and TNF-α in RAW264.7 cells
本研究利用超声波辅助提取树莓粗多糖,然后采用DEAE-Sepharose Fast Flow层析柱和Sephadex G-200凝胶层析柱对树莓粗多糖分别根据极性和分子质量进行分离,最终获得酸性多糖组分RPP-5。研究发现RPP-5的峰位分子质量、重均分子质量和数均分子质量分别为7 492、7 598、6 183 Da,由阿拉伯糖、葡萄糖、半乳糖、鼠李糖、木糖和甘露糖组成,物质的量比为44.5∶21.7∶5.9∶8.8∶5∶4.1,存在→4)-Glcp-(1→、→4,6)-Glcp-(1→、→3,4,6)-Glcp-(1→、Galp-(1→、→4)-Galp-(1→、→6)-Galp-(1→、Araf-(1→、→5)-Araf-(1→、Arap-(1→、→3)-Arap-(1→、→4)-Xylp-(1→、Manp-(1→等12种单糖连接方式,根据多糖的连接类型和占比,推测其主链主要由→4)-Galp-(1→和→4)-Xylp-(1→组成,其支链中可能含有Araf-(1→、Galp-(1→、Arap-(1→、Manp-(1→、→3)-Arap-(1→、→6)-Galp-(1→、→3,4,6)-Glcp-(1→等残基。与之前报道的树莓多糖组分的结构相比,RPP-5在单糖组成、物质的量比、分子质量和连接方式上均有不同。例如,通过水提取并使用DEAE-A52纤维素柱层析和Sephadex G-100凝胶柱从树莓根中分离出分子质量为7 900 Da的酸性杂多糖RAPS-1,由葡萄糖、半乳糖和葡萄糖醛酸组成,相对物质的量比为6.2∶1.0∶1.2,骨架由→4)-Glcp-(1→残基构成,分支主要包括Galp-(1→和GlcAp-(1→残基[25]。YU等[17]采用复合酶法从树莓果实中提取粗多糖,利用大孔树脂D4020和Sephadex G-100进行连续纯化,得到一种水溶性树莓多糖组分RCP-II。RCP-II由物质的量比为1∶0.55∶1.19∶0.52∶0.44∶1.90的半乳糖醛酸、鼠李糖、阿拉伯糖、木糖、葡萄糖和半乳糖组成,平均分子质量约为4 013 Da。还有研究人员从树莓中提取获得多糖组分RP,其分子质量为837 820 Da,主要由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖组成,其中半乳糖醛酸和阿拉伯糖含量最高,其主链上有大量的1→2糖苷键[26]。此外,WU等[27]采用酶提取的果胶多糖RPE50%3主要含有50%的→4)-GalpA-(1→,16%的→5)-Araf-(1和→3)-Araf-(1→,18%的→4)-Galp-(1→和→6)-GalpA-(1→;而酸提取的树莓果胶多糖RPE50%-3比RPA50%-3含有更多的阿拉伯聚糖侧链,表现出更好的免疫增强作用。造成RPP-5与其他树莓多糖结构不同的原因可能有树莓的品种差别、树莓生长环境差异、提取部位以及提取方法的不同、分离方法差异等。
巨噬细胞是机体主要的免疫效应细胞,能够维持机体的免疫、监视和炎症反应[28]。巨噬细胞的活力是评估其免疫调节能力的重要参数之一。愈来愈多的科学研究表明,各种天然多糖能够刺激巨噬细胞中NO、TNF-α和IL-6和IL-1β的产生,从而刺激免疫反应[29]。NO是参与巨噬细胞免疫刺激的重要物质之一,有着增强巨噬细胞细胞的免疫调节活性的作用[30]。IL-6是促进免疫细胞的分化来诱导适应性免疫反应的关键细胞因子。IL-1β也被认为是关键的炎症介质之一,多糖能够通过调节IL-1β的分泌来增强免疫活性[31]。TNF-α是一种由巨噬细胞产生的促炎细胞因子,能够进一步促进该细胞的活性[32]。本研究中,RPP-5能够增强RAW264.7细胞的活力,升高细胞中NO的含量,促进细胞中IL-6、IL-1β和TNF-α的分泌及其mRNA的表达。以上结果表明,RPP-5具有显著的免疫增强活性,可用作天然免疫增强剂用于功能性食品、保健品及药品等的开发中。
多糖的分子质量、单糖组成以及糖苷键的类型与其生物活性密切相关。低分子质量多糖具有较为简单的结构,在通过细胞屏障时因其阻碍较小,进而在发挥免疫调节活性时具备一定的优势[33]。分子质量较高的多糖尽管结构较为复杂,但其与受体和蛋白的连接位点较多,也具有较强的免疫活性[34]。RPP-5的重均分子质量为7 598 Da,有利于其免疫增强活性的发挥。除分子质量外,单糖组成也是影响多糖免疫活性的重要因素之一。研究表明,半乳糖、阿拉伯糖、木糖和甘露糖的含量与巨噬细胞免疫活性的增强呈正相关[35]。金樱子果实多糖,因其半乳糖、阿拉伯糖、木糖和甘露糖占单糖总量的86.7%,能够激活巨噬细胞RAW264.7细胞分泌免疫细胞因子进而表现出极强的免疫增强活性[36]。龙葵多糖经水提取和碱提取分别获得SNLWP-1、SNLWP-2、SNLAP-1和SNLAP-2四种多糖亚组分,SNLWP-1中半乳糖和阿拉伯糖作为主要糖成分;SNLAP-1和SNLAP-2均富含木糖、半乳糖和阿拉伯糖;SNLWP-2富含葡萄糖。研究发现,富含半乳糖、阿拉伯糖和木糖的多糖亚组分能够升高H22型小鼠血清中IL-2和IFN-γ的水平,通过增加免疫反应来实现抗肿瘤作用[37]。此外,多糖的免疫活性还与其连接方式对关。例如,罗望子多糖TKP-2-1中1,4,6-Glcp的含量为37%、1,4-Galp的含量为10.9%,具有较强的免疫刺激活性[33]。黄芪总多糖中存在APS-I和APS-Ⅱ两种分子质量不同的多糖组分,APS-Ⅱ中单糖的主要连接方式为1→2,4-Glcp和1→4,6-Glcp,与黄芪多糖APS-I相比具有更强的免疫增强活性[38]。可见,1,4,6-Glcp、1,4-Galp、1→2,4-Glcp这些单糖连接方式的含量可能与免疫增强作用呈正相关。本研究中,RPP-5由阿拉伯糖、葡萄糖、半乳糖、鼠李糖、木糖和甘露糖组成,其中阿拉伯糖、葡萄糖、半乳糖和木糖占总糖含量的82.15%,存在12种单糖连接方式,其中→4)-Galp-(1→的含量最高,为26.27%,→4,6)-Glcp-(1→的含量为10.41%。由此可见RPP-5具有较强的免疫增强活性,这也与免疫调节活性结果相互印证。
综上,RPP-5分子质量为7 598 Da,由物质的量比为44.5∶21.7∶5.9∶8.8∶5∶4.1的阿拉伯糖、葡萄糖、半乳糖、鼠李糖、木糖和甘露糖6种单糖组成,存在→4)-Glcp-(1→、→4,6)-Glcp-(1→、→3,4,6)-Glcp-(1→、Galp-(1→、→4)-Galp-(1→、→6)-Galp-(1→、Araf-(1→、→5)-Araf-(1→、Arap-(1→、→3)-Arap-(1→、→4)-Xylp-(1→、Manp-(1→等12种单糖连接方式。RPP-5能增强RAW264.7细胞的存活率,升高RAW264.7细胞中的NO含量,促进细胞中IL-6、TNF-α和IL-1β的分泌及其mRNA的表达,显示出较强的免疫增强活性,具有进一步开发为免疫调节剂的潜力。但RPP-5调节免疫的作用机制还有待进行进一步地深入研究。
[1] 伍芳芳. 猴头菇多糖的结构表征、免疫调节活性及其机理研究[D].广州:华南理工大学, 2018.
WU F F.Structural characterization, immunomodulatory activities and underlying mechanism of Hericium erinaceus polysaccharide[D].Guangzhou:South China University of Technology, 2018.
[2] 董洲. 野葛根多糖的提取、分离纯化、结构鉴定及对小鼠巨噬细胞RAW264.7的免疫调节活性研究[D].广州:华南理工大学, 2018.
DONG Z.Extraction, isolation, purification, structural characterization and immunomodulatory activity in RAW264.7 cells of the polysaccharides from Pueraria lobate (Willd.) Ohwi root[D].Guangzhou:South China University of Technology, 2018.
[3] CORDEIRO CAILLOT A R, DE LACERDA BEZERRA I, PALHARES L C G F, et al.Structural characterization of blackberry wine polysaccharides and immunomodulatory effects on LPS-activated RAW 264.7 macrophages[J].Food Chemistry, 2018, 257:143-149.
[4] GUO W W, ZHANG Q X, DU Y, et al.Immunomodulatory activity of polysaccharides from Brassica rapa by activating Akt/NF-κB signaling[J].Chinese Herbal Medicines, 2022, 14(1):90-96.
[5] KAKAR M U, KAKAR I U, MEHBOOB M Z, et al.A review on polysaccharides from Artemisia sphaerocephala Krasch seeds, their extraction, modification, structure, and applications[J].Carbohydrate Polymers, 2021, 252:117113.
[6] 阿荣. 燕麦醪糟多糖的分离纯化、结构鉴定及其免疫活性的研究[D].呼和浩特:内蒙古农业大学, 2019.
A R.The studies on the purification, structure identification and its’s immunity activity of polysaccharides isolated from oat Lao-chao[D].Hohhot:Inner Mongolia Agricultural University, 2019.
[7] 白天凯, 田静, 闫滨.7种国内上市多糖药物临床应用及作用机制研究进展[J].世界科学技术-中医药现代化, 2021, 23(10):3670-3680.
BAI T K, TIAN J, YAN B.Research progress of clinical application and mechanism of action of seven domestic listed polysaccharide drugs[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2021, 23(10):3670-3680.
[8] 冯荦荦, 王锐, 董兆斌, 等.欧李多糖的制备、结构表征及免疫调节活性研究[J].天然产物研究与开发, 2022, 34(5):739-749.
FENG L L, WANG R, DONG Z B, et al.Preparation, structure characterization and immunoregulatory activity of Cerasus humilis polysaccharide[J].Natural Product Research and Development, 2022, 34(5):739-749.
[9] 王晶, 乔洁, 裴新云, 等.阿魏侧耳胞外多糖分离纯化及其免疫活性研究[J].食品与发酵工业, 2021, 47(18):127-134.
WANG J, QIAO J, PEI X Y, et al.Purification and immunomodulation activity of exopolysaccharides from Pleurotus ferulae Lanzi[J].Food and Fermentation Industries, 2021, 47(18):127-134.
[10] 刘思美, 赵鹏, 张婷婷, 等.地黄硒多糖的合成、表征及免疫活性分析[J].中国中药杂志, 2022, 47(11):2938-2946.
LIU S M, ZHAO P, ZHANG T T, et al.Synthesis, characterization, and immunological activity of Rehmannia glutinosa seleno-polysaccharides[J].China Journal of Chinese Materia Medica, 2022, 47(11):2938-2946.
[11] XU G Y, LIAO A M, HUANG J H, et al.Evaluation of structural, functional, and anti-oxidant potential of differentially extracted polysaccharides from potatoes peels[J].International Journal of Biological Macromolecules, 2019, 129:778-785.
[12] 吴媛媛. 红树莓多糖分离纯化及降血糖作用研究初探[D].哈尔滨:哈尔滨商业大学, 2018.
WU Y Y.Separation purification and hypolipidemic preliminary exploration effect of polysaccharides from red raspberry[D].Harbin:Harbin University of Commerce, 2018.
[13] 孙玉珍, 方毅, 于晓红, 等.红树莓生物活性成分及药理作用研究进展[J].中医药学报, 2017, 45(5):106-109.
SUN Y Z, FANG Y, YU X H, et al.Research progress on bioactive components and pharmacological effects of raspberry[J].Acta Chinese Medicine and Pharmacology, 2017, 45(5):106-109.
[14] ZHANG T T, LU C L, JIANG J G, et al.Bioactivities and extraction optimization of crude polysaccharides from the fruits and leaves of Rubus chingii Hu[J].Carbohydrate Polymers, 2015, 130:307-315.
[15] XU W, ZHAO M, FU X Y, et al.Molecular mechanisms underlying macrophage immunomodulatory activity of Rubus chingii Hu polysaccharides[J].International Journal of Biological Macromolecules, 2021, 185:907-916.
[16] YANG Y J, XU H M, SUO Y R.Raspberry pulp polysaccharides inhibit tumor growth via immunopotentiation and enhance docetaxel chemotherapy against malignant melanoma in vivo[J].Food &Function, 2015, 6(9):3022-3034.
[17] YU Z Y, LIU L, XU Y Q, et al.Characterization and biological activities of a novel polysaccharide isolated from raspberry (Rubus idaeus L.) fruits[J].Carbohydrate Polymers, 2015, 132:180-186.
[18] YANG Y J, YIN X X, ZHANG D J, et al.Isolation, structural characterization and macrophage activation activity of an acidic polysaccharide from raspberry pulp[J].Molecules, 2022, 27(5):1674.
[19] TABARSA M, YOU S G, ABEDI M, et al.The activation of RAW264.7 murine macrophage and natural killer cells by glucomannogalactan polysaccharides from Tornabea scutellifera[J].Carbohydrate Polymers, 2019, 219:368-377.
[20] WANG H M, WANG X L, LI Y, et al.Structural properties and in vitro and in vivo immunomodulatory activity of an Arabinofuranan from the fruits of Akebia quinata[J].Carbohydrate Polymers, 2021, 256:117521.
[21] ZENG Y J, YANG H R, WU X L, et al.Structure and immunomodulatory activity of polysaccharides from Fusarium solani DO7 by solid-state fermentation[J].International Journal of Biological Macromolecules, 2019, 137:568-575.
[22] ZHOU Y, WANG S C, FENG W S, et al.Structural characterization and immunomodulatory activities of two polysaccharides from Rehmanniae Radix Praeparata[J].International Journal of Biological Macromolecules, 2021, 186:385-395.
[23] ZHOU W T, ZHAO Y, YAN Y M, et al.Antioxidant and immunomodulatory activities in vitro of polysaccharides from bee collected pollen of Chinese wolfberry[J].International Journal of Biological Macromolecules, 2020, 163:190-199.
[24] 刘晓飞, 马京求, 侯艳, 等.发芽糙米多糖的结构解析及降糖活性分析[J].中国食品学报, 2021, 21(8):265-274.
LIU X F, MA J Q, HOU Y, et al.Structure analysis and hypoglycemic activity of germinated brown rice polysaccharides[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(8):265-274.
[25] SAHRAGARD N, JAHANBIN K.Structural elucidation of the main water-soluble polysaccharide from Rubus anatolicus roots[J].Carbohydrate Polymers, 2017, 175:610-617.
[26] KE H H, BAO T, CHEN W.Polysaccharide from Rubus chingii Hu affords protection against palmitic acid-induced lipotoxicity in human hepatocytes[J].International Journal of Biological Macromolecules, 2019, 133:1063-1071.
[27] WU D M, CHEN S G, YE X Q, et al.Enzyme-extracted raspberry pectin exhibits a high-branched structure and enhanced anti-inflammatory properties than hot acid-extracted pectin[J].Food Chemistry, 2022, 383:132387.
[28] QIN L, CHEN S, XIE L M, et al.Mechanisms of RAW264.7 macrophages immunomodulation mediated by polysaccharide from mung bean skin based on RNA-seq analysis[J].Food Research International, 2022, 154:111017.
[29] HUO J Y, WU J H, ZHAO M M, et al.Immunomodulatory activity of a novel polysaccharide extracted from Huangshui on THP-1 cells through NO production and increased IL-6 and TNF-α expression[J].Food Chemistry, 2020, 330:127257.
[30] YUE H, XU Q Q, BIAN G Y, et al.Structure characterization and immunomodulatory activity of a new neutral polysaccharide SMP-0b from Solanum muricatum[J].International Journal of Biological Macromolecules, 2020, 155:853-860.
[31] XIE L M, HUANG Z B, MENG H, et al.Immunomodulation effect of polysaccharides from liquid fermentation of Monascus purpureus 40269 via membrane TLR-4 to activate the MAPK and NF-κB signaling pathways[J].International Journal of Biological Macromolecules, 2022, 201:480-491.
[32] PAN Q T, SUN Y L, LI X Y, et al.Extraction, structural characterization, and antioxidant and immunomodulatory activities of a polysaccharide from Notarchus leachii freeri eggs[J].Bioorganic Chemistry, 2021, 116:105275.
[33] SUN Y, ZHANG Z P, CHENG L, et al.Polysaccharides confer benefits in immune regulation and multiple sclerosis by interacting with gut microbiota[J].Food Research International, 2021, 149:110675.
[34] MENG X, LIANG H B, LUO L X.Antitumor polysaccharides from mushrooms:A review on the structural characteristics, antitumor mechanisms and immunomodulating activities[J].Carbohydrate Research, 2016, 424:30-41.
[35] LO T C T, JIANG Y H, CHAO A L J, et al.Use of statistical methods to find the polysaccharide structural characteristics and the relationships between monosaccharide composition ratio and macrophage stimulatory activity of regionally different strains of Lentinula edodes[J].Analytica Chimica Acta, 2007, 584(1):50-56.
[36] ZHAN Q P, WANG Q, LIN R G, et al.Structural characterization and immunomodulatory activity of a novel acid polysaccharide isolated from the pulp of Rosa laevigata Michx fruit[J].International Journal of Biological Macromolecules, 2020, 145:1080-1090.
[37] DING X, ZHU F S, GAO S G.Purification, antitumour and immunomodulatory activity of water-extractable and alkali-extractable polysaccharides from Solanum nigrum L[J].Food Chemistry, 2012, 131(2):677-684.
[38] 崔连杰. 黄芪活性多糖APS-II免疫调控机制及其酶解寡糖片段的结构和活性研究[D].太原:山西大学, 2021.
CUI L J.Immunoregulatory mechanism of APS-II, an active polysaccharide from Astragalus membranaceus, and study on the structure and activity of its enzymatic oligosaccharide fragment[D].Taiyuan:Shanxi University, 2021.