红米米糠非淀粉多糖的提取纯化与结构表征
李雪超,赵建伟*,周星,金征宇
(江南大学 食品学院,江苏 无锡,214122)
摘 要 红米是我国产量最大的有色米,具有抗氧化、抗炎等功能,但其水溶性多糖资源并未被开发利用。该文以红米米糠为原料,脱脂后利用热水提取,经脱色、除蛋白、醇沉、透析制得红米米糠非淀粉多糖(non-starch polysaccharides from red rice bran, RRBP)。利用DEAE-52 Cellulose和Sephadex G-200分离纯化得到不同的部分,其中比例最大的为RRBP4组分。通过高效液相色谱、傅里叶红外光谱与完全酸水解、部分酸水解、β-消除、I2-KI实验、刚果红实验等方法对RRBP4的分子质量、单糖组成、主链与侧链、糖苷键、分支程度与三螺旋构象进行分析。结果表明,RRBP4的相对分子质量为1.65×105 Da,由甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖和阿拉伯糖组成,其摩尔比例为0.29∶1.93∶0.35∶1.41∶0.50∶1.00∶5.58∶1.67∶2.56,是一种以半乳糖为主的酸性杂聚糖。RRBP4中有62.40%的多糖集中于侧链,是一种高度支化的多糖。RRBP4是以α-糖苷键为主且含有氨基酸的多糖,同时具有三螺旋结构。红米米糠非淀粉多糖的结构分析能够为开发其在食品工业中的应用提供科学基础数据。
关键词 红米米糠;多糖;提取;纯化;结构
DOI:10.13995/j.cnki.11-1802/ts.035706
引用格式:李雪超,赵建伟,周星,等.红米米糠非淀粉多糖的提取纯化与结构表征[J].食品与发酵工业,2024,50(9):157-163.LI Xuechao, ZHAO Jianwei, ZHOU Xing, et al.Extraction, purification, and structure characterization of non-starch polysaccharides from red rice bran[J].Food and Fermentation Industries,2024,50(9):157-163.
第一作者:硕士研究生(赵建伟副教授为通信作者,E-mail:zhaojw@jiangnan.edu.cn)
收稿日期:2023-04-03,改回日期:2023-04-20
红米是我国产量最大的有色米[1]。红米中维生素和黄酮的含量分别是普通糙米的14.23倍和5.58倍[2],且含有普通糙米中缺乏的维生素C与硒元素[3-4]。《本草纲目》中记载红米可以健脾利胃、活血祛瘀[5],现代科学也对红米的抗氧化[6-7]、抗癌[8]、降血糖[9]、预防肥胖[10]等生理活性进行报道。目前对于红米生理活性物质的报道集中在多酚上,多糖也是一类重要的生理活性物质,具有抗氧化[11]、抗菌[12]、降血脂[13]和抗癌[14]等生理活性。红米中富含纤维素、淀粉、半纤维素等多糖资源,纤维素和半纤维素集中分布于米糠中,淀粉集中分布于胚乳中。半纤维素等多糖存在可以溶于水的部分,但目前并未将水溶性多糖划分到具体的多糖分类中。目前以水为介质发挥多种生理功能的水溶性多糖被广泛研究,但是对于水溶性的红米米糠非淀粉多糖的提取纯化及结构分析缺乏相关研究。红米米糠非淀粉多糖的提取纯化与结构分析有利于充分利用红米的营养价值,促进红米高附加值产品的开发,为其在食品、化妆品和生物医药等领域的应用提供科学依据。
1 材料与方法
1.1 材料与试剂
实验材料:井冈山红糙米(2022年新稻),井冈山市新城红米米业加工厂。
实验试剂:无水乙醇、三氯甲烷、正丁醇、NaOH、三氟乙酸、盐酸、碘、KI、KBr、果糖、间苯二酚、乙腈、甲醇,国药集团化学试剂有限公司;葡萄糖醛酸、葡萄糖、半乳糖、甘露糖,北京百灵威科技有限公司;刚果红试剂,北京伊诺凯科技有限公司;DEAE-52 Cellulose、Sephadex G-200,上海源叶生物科技有限公司;鼠李糖、岩藻糖、核糖、木糖、半乳糖醛酸,上海麦克林生化科技股份有限公司;大孔吸附树脂AB-8,东鸿化工有限公司;葡聚糖标品,Sigma-Aldrich公司;其中乙腈、甲醇为HPLC级,其余为分析纯。
1.2 仪器与设备
JGMJ8098精米研磨机,上海嘉定粮油仪器有限公司;AX244ZH/E电子天平,奥豪斯仪器(常州)有限公司;HHS-21-6水浴锅、GZX-9146MBE电热鼓风干燥箱,上海博迅实业有限公司医疗设备厂;RW20 digital数显顶置式搅拌器,德国IKA集团;SHZ-95B型循环水式多用真空泵,予华仪器有限责任公司;L4-5KR台式低速冷冻离心机,湖南可成仪器设备有限公司;SCIENTZ-18N冷冻干燥机,宁波新芝生物科技股份有限公司;Waters e2695型高效液相色谱仪,美国Waters公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;UV-1800紫外光谱仪,日本岛津公司;DF-101S集热式恒温加热磁力搅拌器,郑州科泰实验设备有限公司;XD-DCY-24SL氮吹仪,上海析谱仪器有限公司;IS10傅里叶红外光谱,美国Nicolet公司;M5酶标仪,赛默飞世尔(上海)仪器有限公司。
1.3 实验方法
1.3.1 红米米糠非淀粉多糖的提取与除杂
将红米米糠∶乙醇以1∶30的料液比混合,乙醇浸提2次后烘干并粉碎。将红米米糠与60 ℃的热水以1∶50的料液比混合,60 ℃下以150 r/min转速提取5 h。提取结束后3 220×g离心24 min后留存上清液。将500 g活化后的大孔吸附树脂AB-8投入红米米糠多糖提取液中,利用顶置式搅拌器以245 r/min转速搅拌脱色2 h。再生大孔吸附树脂AB-8后,重复上述步骤直至将多糖溶液由酱红色脱色至无色。将V(三氯甲烷)∶V(正丁醇)=4∶1的比例配制Sevag试剂,将红米米糠多糖溶液旋蒸浓缩后,加入体积为红米米糠多糖水溶液1/5的Sevag试剂,利用顶置式搅拌器在600 r/min下搅拌除蛋白30 min,将混合液转入分液漏斗中静置10 min分层,放出下层混有蛋白沉淀的有机相溶液,上清液重复除蛋白直至无蛋白质沉淀产生。将上清液旋蒸浓缩后,加入4倍体积乙醇在4 ℃下沉淀24 h,3 220×g离心24 min后将沉淀复溶,在3 500 Da透析袋中透析72 h,得到除杂后的红米米糠非淀粉多糖(non-starch polysaccharides from red rice bran, RRBP)。
1.3.2 红米米糠非淀粉多糖分离纯化
将透析液旋蒸浓缩后,过0.8 μm水系膜,上样后分别用超纯水、0.1、0.2、0.4、0.8、1.0、1.2 mol/L的NaCl溶液各200 mL洗脱DEAE-52 Cellulose层析柱,用10 mL离心管以9 mL/管盛接上样液和洗脱液,根据苯酚硫酸法测定各管中性糖含量,即200 μL洗脱液与100 μL 5%苯酚溶液混合,加入700 μL硫酸后,在40 ℃下水浴30 min,在490 nm下测定吸光值,以洗脱管数为横坐标,吸光值为纵坐标绘制洗脱曲线。将相同洗脱峰的洗脱液进行合并、旋蒸浓缩,1 000 Da透析各组分浓缩液。利用超纯水洗脱Sephadex G-200分离RRBP4组分,根据苯酚硫酸法测定各管中性糖含量并收集单一组分,旋蒸浓缩后冻干。
1.3.3 分子质量分布
将RRBP4溶于超纯水中配成10 g/L的溶液,过0.22 μm水系膜后测定多糖的分子质量分布。通过Waters高效液相系统搭配示差检测器进行测定,具体条件为色谱柱:UltrahydrogeTM Liniear(6 μm,7.8 mm×300 mm);流动相:0.1 mol/L NaNO3;流速:0.5 mL/min;柱温:40 ℃;检测器:RI;将葡萄糖、Dextran T-5、Dextran T-10、Dextran T-150、Dextran T-300、Dextran T-2000配制成10 g/L的水溶液,按照上述条件制作分子质量标准曲线。
1.3.4 单糖组成
取20 mg多糖组分于水解管中,加入8 mL 2 mol/L三氟乙酸(trifluoroacetic acid, TFA)溶液,充分摇匀后氮吹封管,置于110 ℃油浴锅中水解6 h。70 ℃下氮吹至干,加入甲醇反复氮吹至pH为中性,用500 μL超纯水溶解水解产物。在500 μL标准品或样品中加入300 μL 0.3 mol/L NaOH溶液,1 250 μL 0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone, PMP)甲醇溶液,置于70 ℃水浴锅中反应1 h。加入2.5 mL氯仿涡旋混合后吸弃下层有机相,重复3次。过0.22 μm水系膜后用高效液相色谱测定单糖组成。并以0.125、0.25、0.5、1、2 mg/mL单糖标品溶液进行PMP衍生化后根据下列条件测定,以单糖浓度为横坐标,峰面积为纵坐标绘制标准曲线。
高效液相色谱条件:色谱柱XBridgeTM C18(5 μm,4.6 mm×250 mm);流动相为乙腈∶0.05 mol/L磷酸缓冲液(pH 6.8)=18∶82;紫外检测器波长245 nm;柱温30 ℃;流速1 mL/min;样品洗脱时间45 min;进样量20 μL。
1.3.5 部分酸水解
根据MENG等[15]的方法并进行修改,取50 mg RRBP4于水解管中,加入8 mL 0.1 mol/L TFA溶液,氮吹封管,置于100 ℃油浴锅中水解1 h。利用3 500 Da透析袋在蒸馏水中透析48 h。将外部的透析液55 ℃旋蒸浓缩至5 mL后,70 ℃水浴氮吹至干,记为R4-0.1-3.5kDa-out。将透析袋内部的多糖溶液旋蒸浓缩至5 mL后水浴氮吹至干,加入8 mL 0.5 mol/L TFA,混匀后氮吹封管,在100 ℃下水解1 h。将水解液置于3 500 Da透析袋中透析48 h,透析外液是蒸馏水。透析袋外的部分是多糖的侧链,记为R4-0.5-3.5kDa-out,透析袋内的部分是多糖的主链,记为R4-0.5-3.5kDa-in。按照1.3.4节将各部分完全酸水解并测定单糖组成。
1.3.6 红外光谱
将干燥的KBr粉末与干燥的RRBP4以100∶1的质量比混合研磨,压片后利用傅里叶红外光谱仪在4 000~400 cm-1下进行扫描。
1.3.7 β-消除反应
在8 mg的RRBP4中加入4 mL超纯水和4 mL 0.2 mol/L NaOH溶液,混合均匀,置于45 ℃水浴环境下中反应30 min,在190~400 nm下测定紫外光谱扫描。
1.3.8 I2-KI实验
根据WU等[16]的方法,取5 mg的RRBP4多糖样品,配制成1 mg/mL的溶液,加入800 μL I2-KI试剂(0.2 g/L碘+2 g/L KI),涡旋混合均匀后,静置10 min,在300~700 nm下进行紫外光谱扫描。
1.3.9 刚果红实验
通过刚果红实验对多糖三螺旋结构进行测定,将5 mg RRBP4在2.0 mL超纯水中溶解,加入2.0 mL 80 μmol/L的刚果红试剂,逐滴加入4 mol/L NaOH溶液,使体系中NaOH浓度为0、0.1、0.2、0.3、0.4、0.5 mol/L,混合均匀后分别在400~600 nm下进行紫外光谱扫描。
1.3.10 数据分析
每组实验至少做3次平行,使用SPSS 26.0对数据进行统计分析,实验数据以平均值±标准差表示。通过方差分析(ANOVA)和Tukey检验在95%显著性水平上评估结果的统计显著性。
2 结果与分析
2.1 红米米糠非淀粉多糖分离纯化
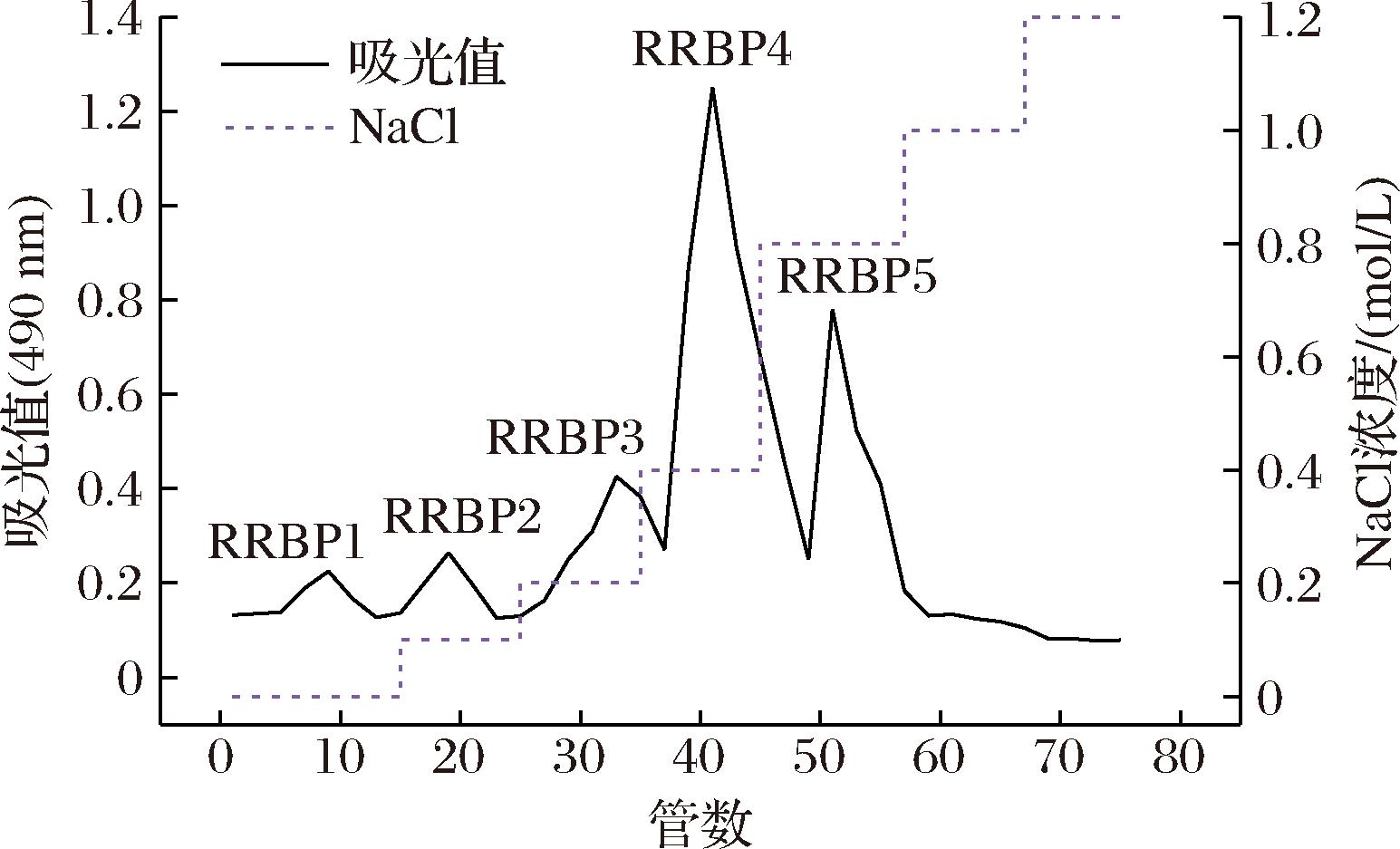
由图1和表1可知,RRBP经DEAE-52 Cellulose分离后得到5个峰,分别命名为RRBP1、RRBP2、RRBP3、RRBP4和RRBP5,各组分分别由超纯水、0.1、0.2、0.4、0.8 mol/L NaCl溶液洗脱制得,而在利用1.0 mol/L和1.2 mol/L的NaCl溶液洗脱时无新的峰出现。RRBP1为中性多糖,分布在水洗脱液中[17],占RRBP的7.39%,RRBP2、RRBP3、RRBP4和RRBP5为酸性多糖,可由NaCl溶液洗脱下来,RRBP中酸性多糖占比为92.61%。其中RRBP4占比最大,为46.07%,故选择此组分为后续实验的实验对象。
表1 DEAE-52 Cellulose分离RRBP后各组分占比
Table 1 The proportion of each component after the isolation of RRBP by DEAE-52 Cellulose
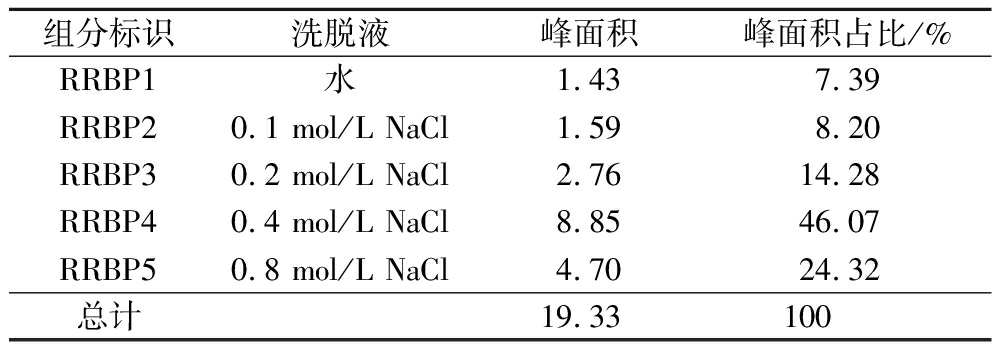
组分标识洗脱液峰面积峰面积占比/%RRBP1水1.437.39RRBP20.1 mol/L NaCl1.598.20RRBP30.2 mol/L NaCl2.7614.28RRBP40.4 mol/L NaCl8.8546.07RRBP50.8 mol/L NaCl4.7024.32总计19.33100
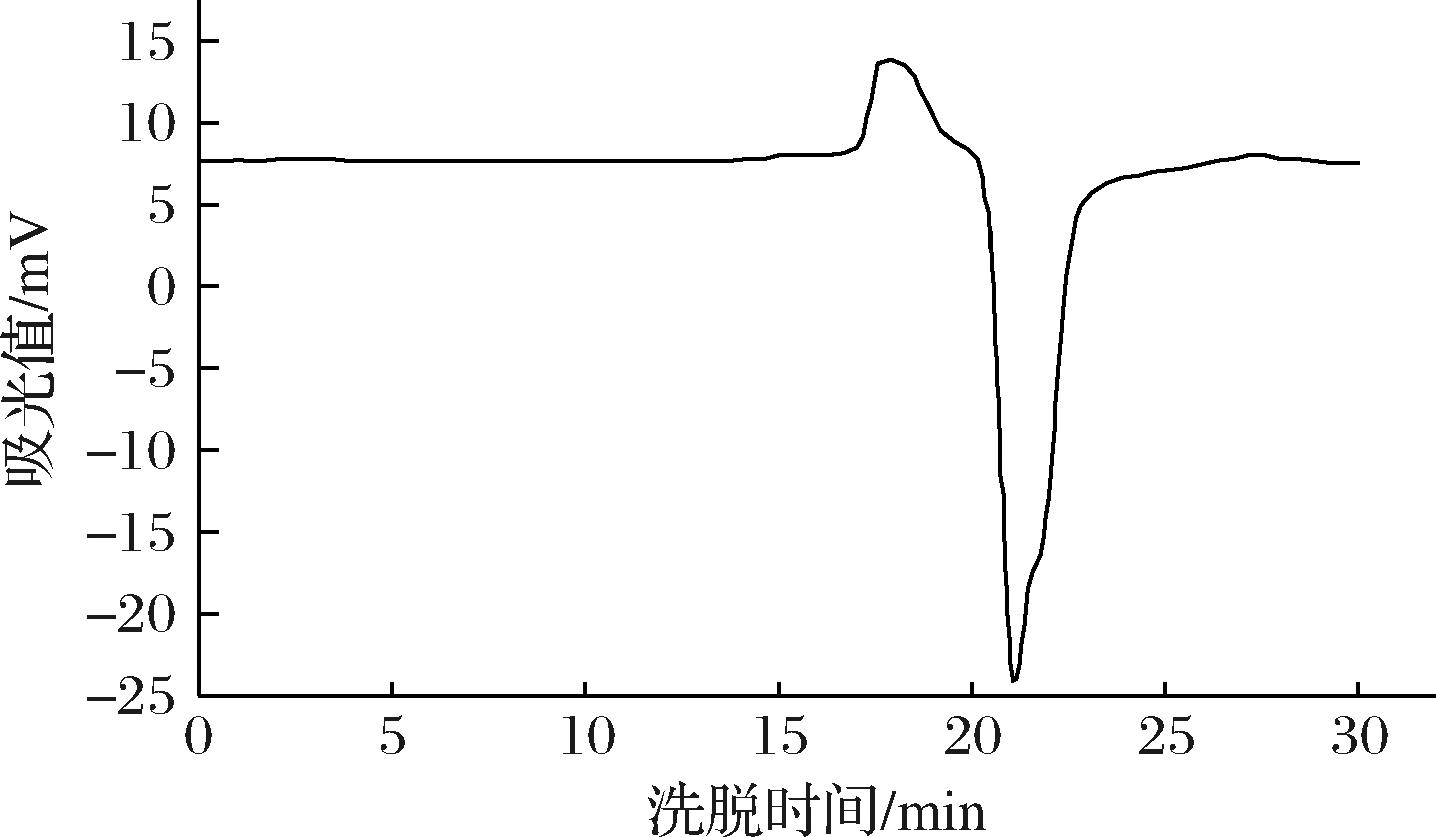
用Sephadex G-200分离RRBP4组分(图2),得到单一且具有一定对称性的峰。
2.2 分子质量分布
由图3可知,RRBP4的洗脱峰均为单峰且峰型较窄,说明分子质量比较集中,与Sephadex G-200的单个洗脱峰结论相同。
RRBP4的重均分子质量为1.65×105 Da,在Sephadex G-200的分离范围内,也说明葡聚糖凝胶的型号选择正确。张潇艳[18]利用微波辅助提取法制得的米糠多糖重均分子质量为1.21×105 Da。ZHA等[19]利用热水提取米糠多糖并用乙醇分级沉淀,得到分子质量为1.2×105~6.3×105 Da、3.4×104~7.4×104 Da、5.3×103~2.3×104 Da的3个组分。米糠多糖的分子质量集中在104~105 Da,相比于细菌的胞外多糖等超大分子多糖,具有更小的分子质量,在一定范围内分子质量低的多糖组分在治疗中可以更好的跨过生物屏障,促进多糖发挥其生理功能。
2.3 单糖组成
表2为各单糖标品的标准方程,各单糖的“浓度-峰面积”标准曲线的线性关系较好。根据图4可知,RRBP4由甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖和阿拉伯糖组成,其摩尔比例为0.29∶1.93∶0.35∶1.41∶0.50∶1.00∶5.58∶1.67∶2.56。RRBP4中糖醛酸摩尔分数为12.48%,所以RRBP4是由9种单糖组成的以半乳糖为主的酸性杂聚糖。ZHA等[19]利用热水提取的米糠多糖中含有葡萄糖、甘露糖、半乳糖、核糖、阿拉伯糖,是以葡萄糖为主的中性杂多糖。相比之下,RRBP4具有更多的单糖组成,并富含糖醛酸。
表2 各单糖标品的出峰时间及“浓度-峰面积”标准方程
Table 2 Peak time and “concentration-peak area” standard equation of each monosaccharide
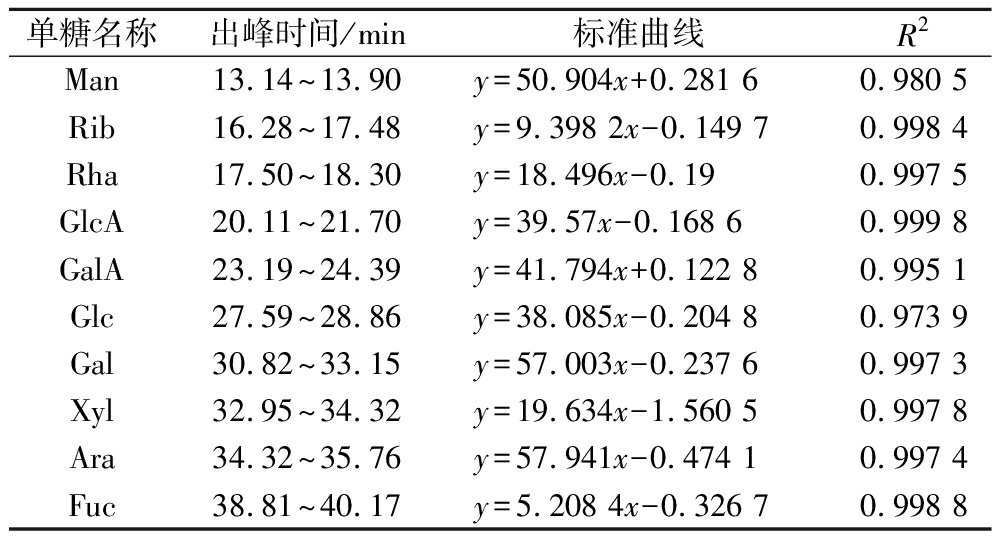
单糖名称出峰时间/min标准曲线R2Man13.14~13.90y=50.904x+0.281 60.980 5Rib16.28~17.48y=9.398 2x-0.149 70.998 4Rha17.50~18.30y=18.496x-0.190.997 5GlcA20.11~21.70y=39.57x-0.168 60.999 8GalA23.19~24.39y=41.794x+0.122 80.995 1Glc27.59~28.86y=38.085x-0.204 80.973 9Gal30.82~33.15y=57.003x-0.237 60.997 3Xyl32.95~34.32y=19.634x-1.560 50.997 8Ara34.32~35.76y=57.941x-0.474 10.997 4Fuc38.81~40.17y=5.208 4x-0.326 70.998 8
2.4 部分酸水解
经过0.1 mol/L TFA水解后,多糖中的末端部分被水解下来,主链和侧链部分存在于透析袋中,第一次水解的透析外液,即R4-0.1-3.5kDa-out的单糖组成及比例为多糖末端的单糖组成[20]。经过0.5 mol/L TFA水解后,侧链部分被水解下来,留存于透析袋内部的是多糖主链的部分[15]。
表3为RRBP4部分酸水解后各部分单糖组成及比例,RRBP4中末端单糖组成种类较少,是以木糖为主并含有少量半乳糖醛酸和阿拉伯糖的多糖末端。在侧链中以半乳糖为主,说明RRBP4侧链主要由半乳糖构成,相比多糖末端和主链,侧链中单糖种类最丰富,含有RRBP4的全部单糖组成。主链以阿拉伯糖为骨架,但是不含有半乳糖醛酸。在所有单糖组成中,只有甘露糖和阿拉伯糖在主链中的含量高于侧链,其余的单糖更多的分布在侧链,多糖侧链含有62.40%的单糖,而主链含有28.36%的单糖,表明RRBP4是一种高度支化的多糖。
表3 部分酸水解后各部分单糖组成及比例
Table 3 Composition and proportion of monosaccharides in each part after partial acid hydrolysis
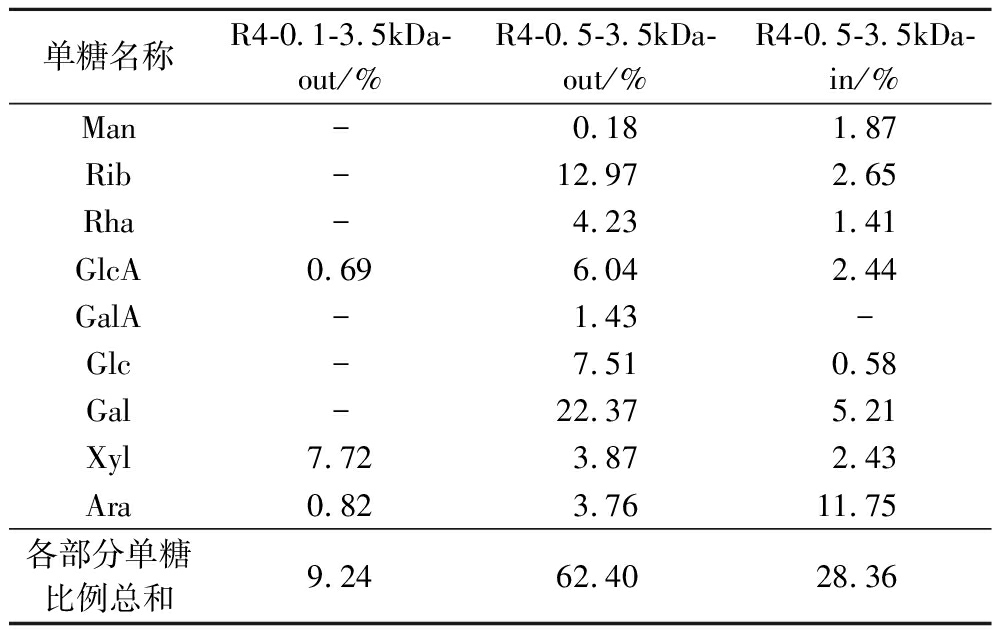
单糖名称R4-0.1-3.5kDa-out/%R4-0.5-3.5kDa-out/%R4-0.5-3.5kDa-in/%Man-0.181.87Rib-12.972.65Rha-4.231.41GlcA0.696.042.44GalA-1.43-Glc-7.510.58Gal-22.375.21Xyl7.723.872.43Ara0.823.7611.75各部分单糖比例总和9.2462.4028.36
注:表中为单糖的摩尔分数。
2.5 红外光谱
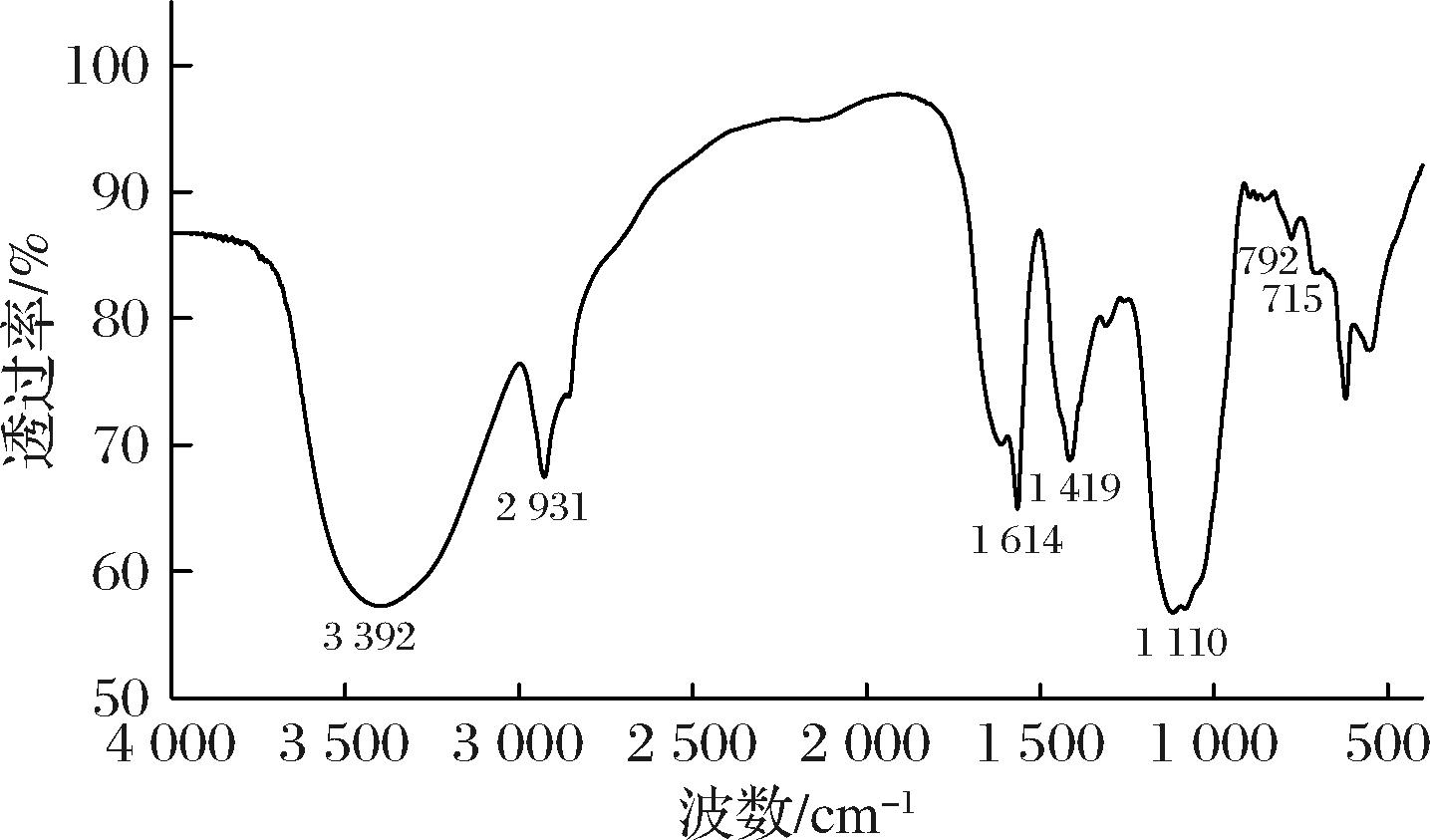
由图5可知,RRBP4在3 600~3 200 cm-1的吸收峰强且宽,此峰为—OH特征吸收峰,说明RRBP4是含有分子内氢键和分子间氢键的多聚物。在2 950~2 850 cm-1为C—H伸缩振动,—OH和C—H的吸收峰也是多糖的特征吸收峰。—COO—反对称拉伸产生的峰在1 630~1 600 cm-1,对称拉伸产生的峰在1 400 cm-1[21],并且1 630~1 600 cm-1、1 400 cm-1和1 100 cm-1均为羧基的特征峰,表明组分中含有糖醛酸[22],与单糖组成结果相符。RRBP4中α-糖苷键吸收峰在792 cm-1,与叶振泉[23]研究结果相似,可能是由于多糖中富含氢键,使分子中电子云密度平均化,伸缩振动频率降低,吸收波长向低波数移动。
2.6 β-消除反应
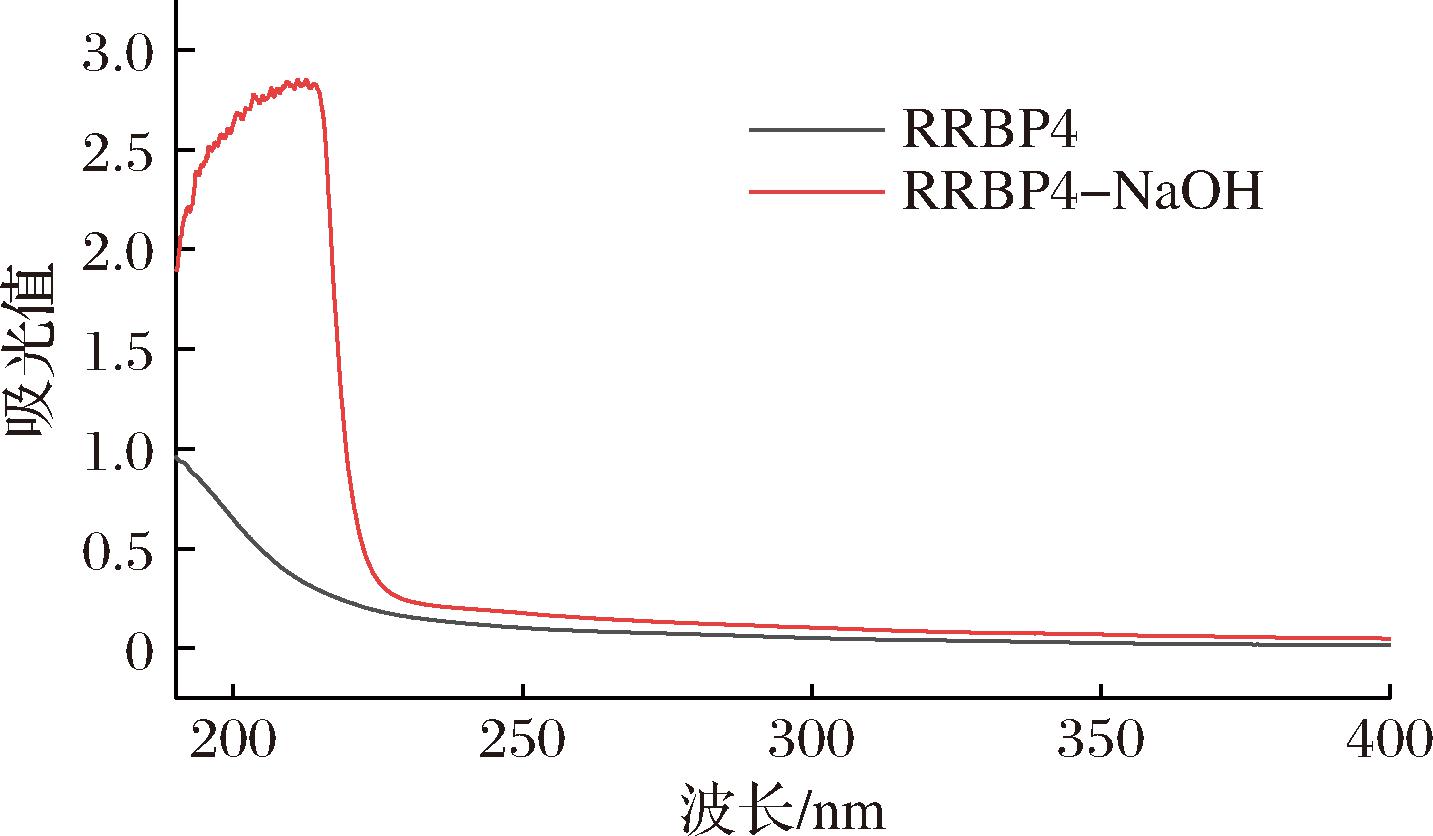
图6是RRBP4经NaOH处理前后紫外扫描光谱,RRBP4利用碱溶液孵育后,会导致最大吸收波长(λmax)变大,说明RRBP4中存在O-糖肽键,是一种含有氨基酸的多糖,这与YAMAGISHI等[24]阐述米糠多糖是蛋白聚糖的结论一致。多糖可以与蛋白质的丝氨酸和苏氨酸β-位羟基之间形成O-糖肽键,在碱性条件下可以发生β-消去反应,而N-糖肽键在碱性条件下依旧可以保持稳定。RRBP4的紫外光谱图在260、276和280 nm处无峰,说明不含核酸、红米色素和蛋白质,即蛋白质、色素等杂质脱除效果较好。
2.7 I2-KI实验
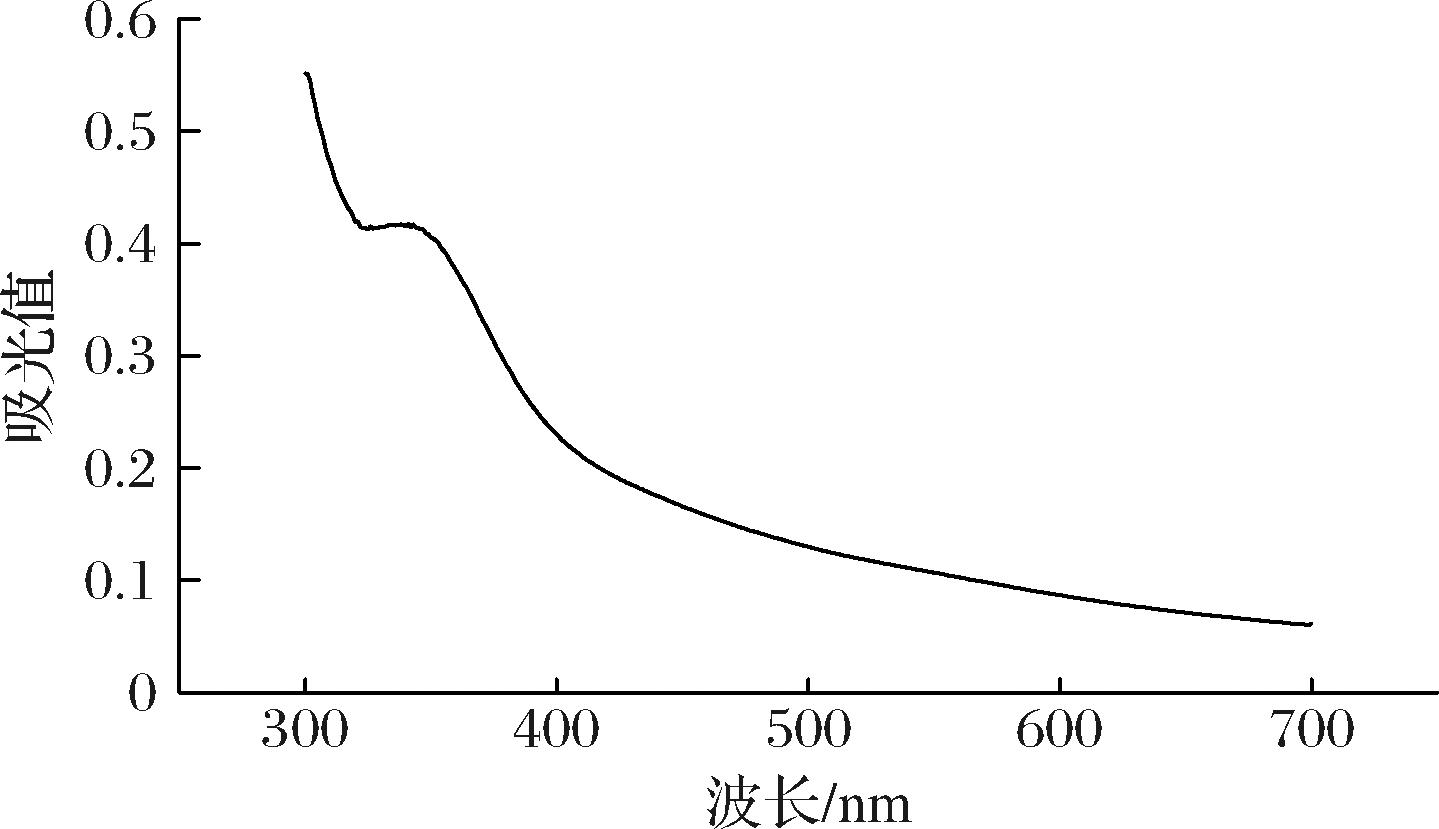
由图7可知,RRBP4与KI试剂混合反应后,在300~700 nm范围内最大吸收峰位于343 nm,在565 nm没有吸收峰,说明多糖样品中存在长侧链或者高度支化[25-26],这也与单糖部分酸水解的结果相符,进一步佐证RRBP4的分支化程度较高。反应后的溶液依旧是I2-KI的颜色,不具有淀粉的特征显色反应,在紫外光谱中也并未检测出其他峰,说明多糖样品中不含淀粉[27]。
2.8 刚果红实验
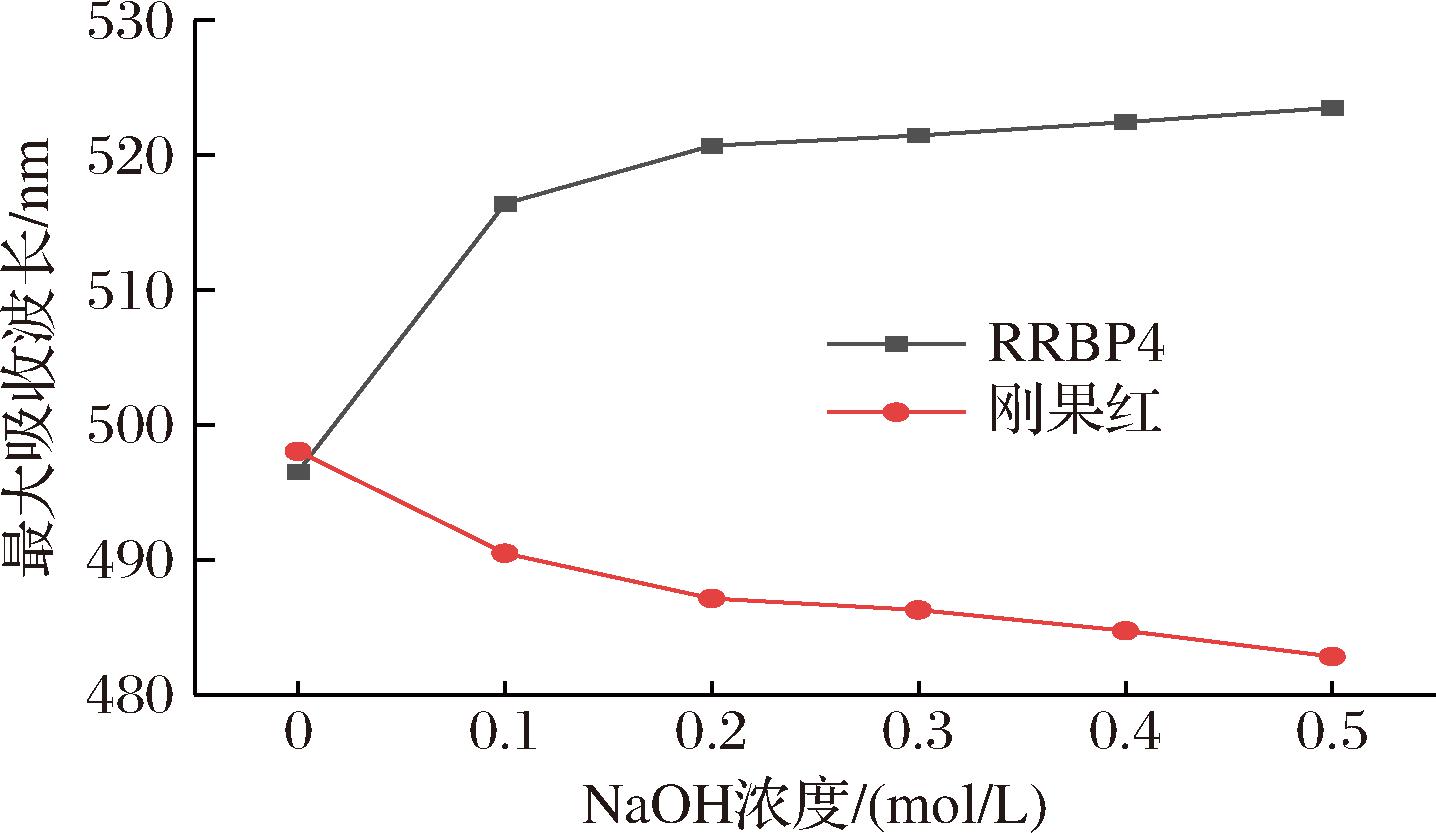
根据图8可知,随着NaOH溶液浓度增加,多糖-刚果红溶液持续发生红移,最大吸收波长(λmax)逐渐变大,溶液也变成蓝紫色。在各NaOH溶液浓度下,多糖-刚果红溶液最大吸收波长相比于刚果红溶液相差20 nm以上[28],说明RRBP4具有三螺旋结构。紫薯多糖在0.1 mol/L NaOH溶液中λmax达到最大[29],在0.1~0.4 mol/L NaOH溶液浓度范围内λmax逐渐减小,多糖的三螺旋构象逐渐解构。RRBP4和溶剂的分子间氢键和分子相互作用使得多糖的3条链结合在一起,多糖侧链的存在可以使多糖的三螺旋结构更加稳定,所以在0.5 mol/L的NaOH溶液浓度下,RRBP4多糖组分依旧可以保持三螺旋构象。
3 结论
采用60 ℃热水提取5 h得到的RRBP,经过DEAE-52 Cellulose和Sephadex G-200分离纯化后得到RRBP4组分。结构分析结果表明,RRBP4的重均分子质量为1.65×105 Da。RRBP4由甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖和阿拉伯糖组成,其摩尔比例为0.29∶1.93∶0.35∶1.41∶0.50∶1.00∶5.58∶1.67∶2.56,是一种含有氨基酸的酸性杂聚糖。RRBP4多糖链末端以木糖为主;侧链以半乳糖为主,并含有62.40%的单糖,是一种高度分支的多糖;主链以阿拉伯糖为基本骨架。RRBP4含有α-糖苷键,富含分子内及分子间氢键,且具有三螺旋构象。对红米米糠非淀粉多糖的提取纯化及其中组分RRBP4的结构进行分析,为进一步开发红米米糠水溶性多糖的功能奠定基础。
参考文献
[1] 李文绍, 许鸿江, 廖荣周.红米稻开发前景及其遗传育种研究进展[J].福建农业科技, 2013(4):10-13.
LI W S, XU H J, LIAO R Z.Development prospect of red rice and research progress in its genetic breeding[J].Fujian Agricultural Science and Technology, 2013(4):10-13.
[2] 郝艳萍, 李军辉, 朱克庆.红米的超微加工及其开发利用[J].粮食加工, 2020, 45(4):40-43.
HAO Y P, LI J H, ZHU K Q.Ultrafine processing and utilization of red rice[J].Grain Processing, 2020, 45(4):40-43.
[3] 岳玉峰, 李广和, 姜洪涛.色稻的研究与开发[J].北方水稻, 2009, 39(2):78-80.
YUE Y F, LI G H, JIANG H T.Study on color rice and development[J].North Rice, 2009, 39(2):78-80.
[4] 裘凌沧, 潘军, 段彬伍.有色米及白米矿质元素营养特征[J].中国水稻科学, 1993, 7(2):95-100.
QIU L C, PAN J, DUAN B W.The mineral nutrient component and characteristics of color and white brown rice[J].Chinese Journal of Rice Science, 1993, 7(2):95-100.
[5] 黎毛毛, 余丽琴, 付军如, 等.江西红米稻种资源主要农艺性状及营养特性分析与评价[J].植物遗传资源学报, 2008, 9(4):480-484.
LI M M, YU L Q, FU J R, et al.Analysis and evaluation of agronomic traits and nutritious elements of red rice germplasm resources in Jiangxi Province[J].Journal of Plant Genetic Resources, 2008, 9(4):480-484.
[6] LAOKULDILOK T, SHOEMAKER C F, JONGKAEWWATTANA S, et al.Antioxidants and antioxidant activity of several pigmented rice brans[J].Journal of Agricultural and Food Chemistry, 2011, 59(1):193-199.
[7] HU Z Q, TANG X Z, LIU J F, et al.Effect of parboiling on phytochemical content, antioxidant activity and physicochemical properties of germinated red rice[J].Food Chemistry, 2017, 214:285-292.
[8] PINTHA K, YODKEEREE S, PITCHAKARN P, et al.Anti-invasive activity against cancer cells of phytochemicals in red jasmine rice (Oryza sativa L.)[J].Asian Pacific Journal of Cancer Prevention:APJCP, 2014, 15(11):4601-4607.
[9] PREMAKUMARA G A S, ABEYSEKERA W K S M, RATNASOORIYA W D, et al.Antioxidant, anti-amylase and anti-glycation potential of brans of some Sri Lankan traditional and improved rice (Oryza sativa L.) varieties[J].Journal of Cereal Science, 2013, 58(3):451-456.
[10] CALLCOTT E T, SANTHAKUMAR A B, STRAPPE P, et al.Polyphenols from Australian-grown pigmented red and purple rice inhibit adipocyte differentiation[J].Journal of Cereal Science, 2018, 81:140-146.
[11] CHEN F, HUANG S Y, HUANG G L.Preparation, activity, and antioxidant mechanism of rice bran polysaccharide[J].Food &Function, 2021, 12(2):834-839.
[12] SURIN S, SEESURIYACHAN P, THAKEOW P, et al.Antioxidant and antimicrobial properties of polysaccharides from rice brans[J].Chiang Mai Journal of Science, 2018, 45(3):1372-1382.
[13] NORMAND F L, ORY R L, MOD R R.Binding of bile acids and trace minerals by soluble hemicelluloses of rice[J].Food Technology, 1987, 2(2):86-90.
[14] HAN W F, LI J T, DING Y Q, et al.Structural features, antitumor and antioxidant activities of rice bran polysaccharides using different extraction methods[J].Journal of Food Science, 2017, 82(10):2403-2410.
[15] MENG F C, LI Q, QI Y N, et al.Characterization and immunoregulatory activity of two polysaccharides from the root of Ilex asprella[J].Carbohydrate Polymers, 2018, 197:9-16.
[16] WU C Z, ZHAO M M, BU X Y, et al.Preparation, characterization, antioxidant and antiglycation activities of selenized polysaccharides from blackcurrant[J].RSC Advances, 2020, 10(54):32616-32627.
[17] 野津, 张文森, 王知斌, 等.DEAE-52在中药多糖分离纯化中的应用[J].化学工程师, 2019, 33(11):43-45;22.
YE J, ZHANG W S, WANG Z B, et al.Application of DEAE-52 in the separation and purification of polysaccharides from Traditional Chinese Medicine[J].Chemical Engineer, 2019, 33(11):43-45;22.
[18] 张潇艳. 米糠多糖的提取、纯化及结构研究[D].无锡:江南大学, 2008.
ZHANG X Y.Study on the extraction, purification and structure of polysaccharide from rice bran[D].Wuxi:Jiangnan University, 2008.
[19] ZHA X Q, WANG J H, YANG X F, et al.Antioxidant properties of polysaccharide fractions with different molecular mass extracted with hot-water from rice bran[J].Carbohydrate Polymers, 2009, 78(3):570-575.
[20] 原菲. 银杏多糖的提取分离、结构鉴定及活性测定[D].广州:暨南大学, 2010.
YUAN F.Structure characterization and activity studies of a novel polysaccharide isolated from Ginkgo biloba[D].Guangzhou:Jinan University, 2010.
[21] SZYMANSKA-CHARGOT M, ZDUNEK A.Use of FT-IR spectra and PCA to the bulk characterization of cell wall residues of fruits and vegetables along a fraction process[J].Food Biophysics, 2013, 8(1):29-42.
[22] COIMBRA M A, BARROS A, BARROS M, et al.Multivariate analysis of uronic acid and neutral sugars in whole pectic samples by FT-IR spectroscopy[J].Carbohydrate Polymers, 1998, 37(3):241-248.
[23] 叶振泉. 骆驼刺多糖的提取、分离纯化和结构鉴定[D].广州:广东药科大学, 2021.
YE Z Q.Extraction, isolation, purification and structural identification of polysaccharides from Alhagi sparsifolia[D].Guangzhou:Guangdong Pharmaceutical University, 2021.
[24] YAMAGISHI T, MATSUDA K, WATANABE T.Isolation and partial characterization of proteoglycans from rice bran[J].Carbohydrate Research, 1975, 43(2):321-333.
[25] GONG Y F, MA Y X, CHEUNG P C K, et al.Structural characteristics and anti-inflammatory activity of UV/H2O2-treated algal sulfated polysaccharide from Gracilaria lemaneiformis[J].Food and Chemical Toxicology, 2021, 152:112157.
[26] MOHAMMED J K, ALI MAHDI A, AHMED M I, et al.Preparation, deproteinization, characterization, and antioxidant activity of polysaccharide from Medemia argun fruit[J].International Journal of Biological Macromolecules, 2020, 155:919-926.
[27] SUN M Z, LI Y M, WANG T X, et al.Isolation, fine structure and morphology studies of galactomannan from endosperm of Gleditsia japonica var.delavayi[J].Carbohydrate Polymers, 2018, 184:127-134.
[28] PALACIOS I, GARC A-LAFUENTE A, GUILLAM
A-LAFUENTE A, GUILLAM N E, et al.Novel isolation of water-soluble polysaccharides from the fruiting bodies of Pleurotus ostreatus mushrooms[J].Carbohydrate Research, 2012, 358:72-77.
N E, et al.Novel isolation of water-soluble polysaccharides from the fruiting bodies of Pleurotus ostreatus mushrooms[J].Carbohydrate Research, 2012, 358:72-77.
[29] YANG W J, HUANG G L.Preparation and properties of purple sweet potato polysaccharide[J].Journal of Food Measurement and Characterization, 2022, https://doi.org/10.1007/s11694-022-01718-2.
Extraction, purification, and structure characterization of non-starch polysaccharides from red rice bran
LI Xuechao, ZHAO Jianwei*, ZHOU Xing, JIN Zhengyu
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
ABSTRACT Red rice is the largest yield of colored rice in China, with biological activities such as antioxidant and anti-inflammatory.But its water-soluble polysaccharide resources have not been exploited.Non-starch polysaccharides from red rice bran were prepared from red rice bran as raw material, by extracting with hot water, decoloring, deproteinizing, alcohol precipitation, and dialysis.Different fractions of extractive polysaccharides were isolated and purified using DEAE-52 Cellulose and Sephadex G-200, with the largest proportion being the RRBP4 component.Molecular weight, monosaccharide composition, main and side chains, glycosidic bonds, branching degree, and triple helix conformation of RRBP4 were identified by using HPLC, FT-IR, complete acid hydrolysis, partial acid hydrolysis, β-elimination, I2-KI experiment, and Congo red test methods.Result showed that the relative molecular weight of RRBP4 was 1.65×105 Da.RRBP4 was composed of mannose, ribose, rhamnose, galacturonic acid, glucuronic acid, glucose, galactose, xylose, and arabinose, the mole ratio of them was 0.29∶1.93∶0.35∶1.41∶0.50∶1.00∶5.58∶1.67∶2.56.RRBP4 was an acidic heteroglycan dominated by galactose.There were 62.40% polysaccharides located in the side chain, which was a highly branched polysaccharide.RRBP4 was a polysaccharide with α-glycosidic bonds and amino acids and had a triple helix structure.The structural analysis of water-soluble non-starch polysaccharides from red rice bran provided a scientific essential data for the development of their application in the food industry.
Key words red rice bran;polysaccharides;extraction;purification;structure





 A-LAFUENTE A, GUILLAM
A-LAFUENTE A, GUILLAM N E, et al.Novel isolation of water-soluble polysaccharides from the fruiting bodies of
N E, et al.Novel isolation of water-soluble polysaccharides from the fruiting bodies of