山楂(Crataegus pinnatifida Bge.)隶属于蔷薇科山楂属,药食两用,具有很高的营养价值。其膳食纤维含量在水果中名列前茅,并且可溶性膳食纤维(water-soluble dietary fiber,SDF)含量较高,属于高质量膳食纤维。山楂富含多酚,具有降血脂、抗衰老、抗癌、抗疲劳等多种药理作用[1-2]。目前,工业上提取多酚产生大量果渣废弃物,通常作为废料处理[3]。山楂果渣中膳食纤维未充分开发利用,造成大量资源浪费、企业效益低和农民收入低等问题。
膳食纤维作为第七大营养素[4],它在预防和缓解便秘、高血糖、直肠癌和高血压等方面发挥着重要作用[5-6]。特别是SDF能显著影响碳水化合物和脂质的代谢,还能吸附重金属离子和胆固醇,引起了医学界、食品工业甚至广大公众的关注[7-8]。目前国内外制备SDF的主要方法有热水提法、化学法、酶法、发酵法和联合法。其中最常用的化学法易操作、适合大规模生产,但需要经过酸碱和高热的处理,得到的SDF存在品质、色泽较差,持水力和膨胀力下降等问题[9-10]。酶法具有条件温和、样品纯度高等特点。发酵法成本低、提取率高,但需要的环境条件复杂,难以控制[11]。因此,寻找和开发具有SDF提取率高,功能特性好的技术成为亟待解决的关键问题。
微波技术作为一种现代高新技术在食品中的应用越来越广泛。它作为一种波能,可以使加工后的溶剂经历偶极子旋转,迅速均匀地提高溶剂温度,增加化合物的溶解度。微波辅助处理还可以增加细胞内压力,使细胞壁破裂,露出内容物,有利于增加提取率和提高SDF功能特性[12-14]。例如,微波处理方竹笋膳食纤维,既增强了水合性,又提高了抗氧化性能[15]。因此,微波技术在SDF提取上有应用潜力。多技术联合法能够有效弥补单一提取方法的缺点,是较为完善的提取方法。目前还没有关于微波联合酶法提取山楂膳食纤维的研究。碱法提取具有操作简单、易于控制,是提取SDF最广泛使用的方法之一。酶法提取是通过酶促反应去除原料中非膳食纤维成分,提取物SDF具有较高纯度。因此本实验研究采用微波酶法、酶法和碱法3种方法制备山楂SDF,并比较SDF的理化特性、抗氧化及体外调节糖脂的功能特性,以筛选出制备高质量山楂果渣SDF的最优方法,延长山楂深加工产业链,促进山楂产业的高质量发展。
1.1.1 仪器与设备
ICS5000离子色谱仪、Nicolet5700傅里叶红外光谱仪,美国Thermo Fisher Nicolet公司;UGC-24M氮吹仪,上海力辰仪器科技有限公司;SU-8010扫描电子显微镜、UV-2910紫外分光光度计、Dmax.2500v pc型X-射线衍射仪,日本Hitachi公司;ARC254差示扫描量热仪,德国耐驰仪器制造有限公司;TDZ5-WS型台式离心机,长沙湘仪离心机仪器有限公司;WD900B型微波炉,顺德市格兰仕电器实业有限公司;LGJ.30D真空冷冻干燥机,北京四环科学仪器厂有限公司。
1.1.2 试剂与材料
无水乙醇,天津永晟精细化工有限公司;α-淀粉酶(10万 U/g)、糖化酶(10万 U/g)、中性蛋白酶(15万U/g)、纤维素酶(10万 U/g)、牛磺胆酸钠、甘氨胆酸钠,上海源叶生物科技有限公司;DPPH、抗坏血酸等试剂,美国Sigma公司;浓硫酸、浓盐酸,福晨(天津)化学试剂有限公司;冰醋酸,天津市凯通化学试剂有限公司;NaOH,天津欧博凯化工有限公司。
山楂:摘自中国承德兴隆县,2020年10月采摘,全熟。
1.2.1 山楂果渣膳食纤维提取
1.2.1.1 山楂果渣制备
山楂果渣取自提取多酚后的果渣,具体操作为:山楂果去核,山楂∶水=1∶2(g∶mL)打浆。山楂果浆与75%酸化乙醇按体积比1∶3在45 ℃恒温水浴提取2 h,静置抽滤,滤渣在45 ℃烘箱烘干8 h,粉碎后过筛得到干燥的山楂果渣。
1.2.1.2 山楂膳食纤维提取
微波辅助酶法制备SDF(microwave-enzymatic extraction of soluble dietary fiber,MSDF):经响应面优化后的最佳提取方法为1.0 g山楂果渣加入10 mL蒸馏水,微波功率480 W处理3 min。静置降温至45 ℃,加入α-淀粉酶0.1%、纤维素酶0.5%、中性蛋白酶0.6%(均为质量分数),在pH 4.5的条件下恒温酶解120 min。95 ℃高温蒸煮灭酶10 min,抽滤取上清液。向滤液中加入4倍体积无水乙醇,静置醇沉12 h。在4 000 r/min离心15 min取沉淀,冷冻干燥后为MSDF。
酶法制备SDF(enzymatic extraction of soluble dietary fiber,ESDF):同上述微波酶辅助法,但不进行微波处理。
碱法制备SDF(alkaline extraction of soluble dietary fiber,NSDF):参考许祯毅等[16]的方法。1.0 g SDF样品,加入30 mL 50 g/L NaOH溶液,水浴60 min后趁热抽滤取上清液,待滤液冷却至25 ℃后用3 mol/L的HCl溶液调节滤液的pH值至4.5,过滤。按照微波辅助酶法离心,干燥得到NSDF。
1.2.2 SDF结构测定
1.2.2.1 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)
将SDF样品与KBr混合,在玛瑙研钵中研磨。真空压片,置于光路中扫描,扫描范围为4 000~400 cm-1,得到红外光谱。
1.2.2.2 外貌形态观察
使用扫描电镜观察改性前后膳食纤维微观结构的变化。用离子喷金80 s,在100~10 000倍的扫描电镜下拍摄。
1.2.2.3 X-射线衍射(X-ray diffraction,XRD)
工作电压30 kV,工作电流20 mA,衍射角度2°~80°,分辨率0.02°,扫描速率10 ℃/min,扫描范围3°~90°,波数为500~4 000 cm-1,获得XRD谱图[17]。
1.2.2.4 热重分析(thermogravimetry analysis,TGA)
参照KHATKAR等[18]的方法,取5 mg SDF样品置于热重分析仪中,在N2环境,升温速度5 ℃/min条件下,得到SDF样品在50~600 ℃的TGA曲线。
1.2.3 SDF成分组成分析
1.2.3.1 SDF单糖组成分析
采用高效阴离子交换色谱测定SDF单糖组成。
(1)标准溶液的配制和计算方法
取9种单糖标准品(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸、葡萄糖醛酸)配成标准母液溶液。取各单糖标准溶液精密配制浓度标准品作为混标。根据绝对定量方法,测定不同单糖质量,根据单糖摩尔质量计算出摩尔比。
(2)SDF样品准备
精密称量5 mg SDF样品置于安瓿瓶中,加入3 mol/L三氟乙酸2 mL,120 ℃水解3 h。准确吸取酸水解溶液转移至管中N2吹干,加入5 mL水涡旋混匀,吸取50 μL加入950 μL去离子水,12 000 r/min离心5 min。取上清液进行成分分析。
(3)色谱柱为DionexCarbopacTM PA20(3 mm×150 mm);流动相A:H2O;B:15 mmol/L过氧乙酸钠;15 mmol/L NaOH+100 mmol/L过氧乙酸钠;流速0.3 mL/min;进样量5 μL;柱温30 ℃;检测器为电化学检测器。
1.2.3.2 总酚、花色苷测定
福林-酚法测定SDF样品总酚含量;pH示差法测定SDF样品花色苷含量。
1.2.3.3 基本成分检测
SDF纯度、蛋白质、脂肪、水分和灰分含量分别参照以下标准测定:GB/T 5009.88—2016《食品中膳食纤维的测定》、GB 5009.5—2016《食品中蛋白质的测定》、GB 5009.6—2016《食品中脂肪的测定》、GB 5009.3—2016《食品中水分的测定》和GB 5009.4—2016《食品中灰分的测定》。
1.2.4 SDF 理化性质测定
1.2.4.1 持水力
向刻度试管中准确称取质量为1.0 g的干SDF样品,加入10 mL的蒸馏水后将刻度试管放置于4 ℃冰箱1 h。4 000 r/min离心15 min,将其沉淀转移到的表面皿中,称取其质量[19]。根据公式(1)计算持水力。
持水力![]()
(1)
式中:m1,干SDF样品质量,g;m2,表面皿质量,g;m3,表面皿与SDF样品质量,g。
1.2.4.2 持油力
向刻度试管中准确称取质量为1.0 g的干SDF样品,添加10 mL玉米油并充分混合将混合物置于(22±1) ℃恒温箱1 h。4 000 r/min离心15 min后,称量弃上层油后的SDF样品量[19]。根据公式(2)计算持油力。
持油力![]()
(2)
式中:m1,干SDF样品质量,g;m2,弃去油层SDF样品质量,g。
1.2.4.3 吸水膨胀力
称取SDF样品1.0 g于10 mL刻度试管中,测定干样体积。加入10 mL蒸馏水,搅拌均匀,室温下静置24 h。测定膨胀后体积。根据公式(3)计算吸水膨胀力。
吸水膨胀力![]()
(3)
式中:V0,干SDF样品体积,mL;V1,膨胀后体积,mL;m,干SDF样品质量,g。
1.2.4.4 溶解性
将1.0 g SDF样品溶解30 mL蒸馏水中,并在25 ℃下摇床振荡6 h。4 000 r/min离心悬浮液,舍去上清液,在105 ℃烘干至恒重。根据公式(4)计算溶解性[20]。
溶解性![]()
(4)
式中:m1,SDF样品残渣烘至恒质量,g;m0,SDF样品干质量,g。
1.2.4.5 阳离子交换能力
称取1.0 g SDF样品浸没于装有0.10 mol/L HCl溶液的锥形瓶中,37 ℃振荡24 h后过滤,收集滤渣。用蒸馏水不断冲洗滤渣直至用100 g/L AgNO3检测不到Cl-为止,最后干燥至恒重。0.1 g恒重SDF样品置于装有100 mL 50 g/L NaCl溶液的锥形瓶中,充分振荡混合均匀,用NaOH溶液(0.01 mol/L)缓慢滴定,5 min后酚酞指示剂不变色即为滴定终点,同时用纯水替代HCl溶液做空白试验[21]。根据公式(5)计算阳离子交换能力。
阳离子交换能力![]()
(5)
式中,m,SDF样品质量,g;V1,试样消耗NaOH的体积,mL;V2,空白消耗NaOH的体积,mL;c,NaOH浓度,mol/L。
1.2.5 抗氧化能力测定
1.2.5.1 自由基清除能力
在试管中加入3 mL不同浓度SDF样品和3 mL DPPH乙醇溶液(200 μmol/L),避光30 min,测定517 nm处的吸光度值。3 mL无水乙醇代替DPPH乙醇溶液作为空白组,测定吸光度值。对照组用3 mL蒸馏水代替SDF样品,测定吸光值。根据公式(6)计算清除率,维生素C作为阳性对照。
DPPH自由基清除率![]()
(6)
式中:A1,SDF样品上清液的吸光度;A2,空白上清液的吸光度;A3,对照组上清液的吸光度。
1.2.5.2 羟自由基(·OH)清除能力
在SDF样品组试管中加入0.4 mL 2 mmol/L水杨酸、1 mL 0.15 mmol/L FeSO4、0.2 mL SDF样品溶液、1 mL 6 mmol/L H2O2和0.4 mL蒸馏水。对照组用蒸馏水代替水杨酸,空白组用蒸馏水代替SDF样品溶液。以上3组试管37 ℃恒温水浴1 h,取出冷却,用蒸馏水调零,在510 nm处测吸光值。照公式(7)计算清除率,维生素C作为阳性对照。
·OH清除率![]()
(7)
式中:A1,SDF样品上清液的吸光度;A2,对照组上清液的吸光度;A3,空白组上清液的吸光度。
1.2.6 体外降血糖活性
1.2.6.1 葡萄糖吸附力测定
参考WANG等[22]的方法,将1.0 g SDF样品加入100 mL 100 mmol/L葡萄糖溶液中,37 ℃水浴振荡6 h。5 000 r/min离心15 min,取上清液,测定540 nm上清液中葡萄糖含量。葡萄糖吸附力按公式(8)计算。
葡萄糖吸收能力![]()
(8)
式中:m,干SDF样品质量,g;n,原始葡萄糖含量,mmol;n2,吸附后葡萄糖含量,mmol。
1.2.6.2 α-淀粉酶抑制能力测定
将1.0 g SDF样品和4.0 mg α-淀粉酶加入到40 mL玉米淀粉溶液中,将溶液在37 ℃水浴振荡酶解1 h,然后加入0.1 mol/L NaOH溶液80 mL终止酶解反应。5 000 r/min离心20 min,取上清液,用DNA法测定葡萄糖含量。以相同条件下未添加SDF样品的玉米淀粉溶液为对照[23]。根据公式(9)计算。
α-淀粉酶抑制能力![]()
(9)
式中:ρ1,添加膳食纤维样本酶解液中的葡萄糖含量,mg/mL;ρ2,未添加膳食纤维样本酶解液中的葡萄糖含量,mg/mL。
1.2.7 体外降血脂活性
1.2.7.1 胆固醇吸附能力
取鲜鸡蛋蛋黄,用9倍蒸馏水稀释搅拌至完全乳化,分别调节pH值至2和7,采用邻苯二甲酸法测定记录胆固醇含量。取1.0 g SDF样品与分别与不同pH值的25 mL稀释蛋黄液混合,37 ℃连续水浴振荡2 h。取4 mL样液,加入16 mL无水乙醇,5 000 r/min离心20 min,取上清液,测定波长550 nm处上清液中胆固醇含量[24]。根据公式(10)计算。
胆固醇的吸附量![]()
(10)
式中:m,干SDF样品质量,g;W1,原始胆固醇含量,mg;W2,上清液胆固醇含量,mg。
1.2.7.2 胆酸盐吸收能力
(1)胆酸盐标准曲线的绘制
参考于美汇等[25]的方法有改动。配制浓度为0.03、0.06、0.12、0.18、0.24、0.30 mmol/L的甘氨胆酸钠,0.05、0.10、0.15、0.20、0.25、0.30 mmol/L的牛磺胆酸钠标准溶液。得到标准曲线方程为甘氨胆酸钠:Y=0.380 7X+0.022 8,R2=0.996 1和牛磺胆酸钠:Y=0.234 2X+0.009,R2=0.999 2。
(2)胆酸盐结合
参考于美汇等[25]的方法,分别移取3 mL 10 mg/mL SDF样品溶液于100 mL具塞锥形瓶中,加入3 mL 10 mg/mL胃蛋白酶和1 mL 0.01 mol/L 的HCl溶液,37 ℃恒温振荡消化1 h;加入0.1 mol/L的NaOH溶液调节pH值至6.3,随后加入4 mL 10 mg/mL胰蛋白酶,37 ℃恒温振荡消化1 h,每个SDF样品中加入4 mL 0.4 mmol/L甘氨胆酸钠和0.5 mmol/L牛磺胆酸钠,37 ℃恒温振荡1 h后,4 000 r/min离心20 min,取上清液,387 nm波长处测定吸光度。甘氨胆酸钠和牛磺胆酸钠结合率按公式(11)、公式(12)计算。
甘氨胆酸钠结合率![]()
(11)
式中:n1,甘氨胆酸钠加入量,μmol;n2,甘氨胆酸钠剩余量,μmol。
牛磺胆酸钠结合率![]()
(12)
式中:n3,牛磺胆酸钠加入量,μmol;n4,牛磺胆酸钠剩余量,μmol。
1.2.8 数据统计与分析
所有实验重复3次,实验结果表示为平均值±标准偏差。采用SPSS 26.0软件进行数据处理,平均数之间的差异通过单因素方差分析(ANOVA),P<0.05为显著性差异,采用Origin 9.0作图。
由图1可知3种提取方式的膳食纤维在感官上有很大差别。MSDF和ESDF颜色较浅,而NSDF颜色极深,这可能是因为碱法提取过程中,强碱使山楂果渣中膳食纤维可溶性色素或者蛋白质发生褐变,产生深色物质。从状态上看MSDF外观更加蓬松,表明微波酶解提取SDF具有良好的外观。

图1 三种提取方式的SDF外观对比
Fig.1 Comparison of SDF appearance among three extraction methods
为进一步确定3种提取方式对SDF结构和热特性的影响,采用FTIR、XRD、扫描电镜、TGA等方法进行分析。
2.2.1 山楂SDF的FT-IR分析
如图2所示,3 421 cm-1处有宽而强的羟基伸缩振动峰吸收峰,说明山楂果渣SDF具有较多缔合状态的氢键,2 930 cm-1处为糖类甲基的C—H伸缩振动峰,1 609 cm-1处为C![]() O(CHO—)伸缩振动峰,1 330 cm-1处和1 238 cm-1处分别对应C
O(CHO—)伸缩振动峰,1 330 cm-1处和1 238 cm-1处分别对应C![]() O(—COO)和C—O(—COO)伸缩振动峰,这些吸收峰证明山楂果渣SDF具有膳食多糖特征,MSDF和ESDF在1 744 cm-1处存在衍射峰,说明两种方法提取的SDF分子中含有酯基。3种SDF在1 500~1 600 cm-1之间存在衍射峰,可能是芳香环,推测SDF样品中可能存在多酚类物质。结果表明微波法处理使山楂果渣SDF基团数量有所增加,但未产生新的官能团,这一结果与刘学成等[26]研究一致。
O(—COO)和C—O(—COO)伸缩振动峰,这些吸收峰证明山楂果渣SDF具有膳食多糖特征,MSDF和ESDF在1 744 cm-1处存在衍射峰,说明两种方法提取的SDF分子中含有酯基。3种SDF在1 500~1 600 cm-1之间存在衍射峰,可能是芳香环,推测SDF样品中可能存在多酚类物质。结果表明微波法处理使山楂果渣SDF基团数量有所增加,但未产生新的官能团,这一结果与刘学成等[26]研究一致。
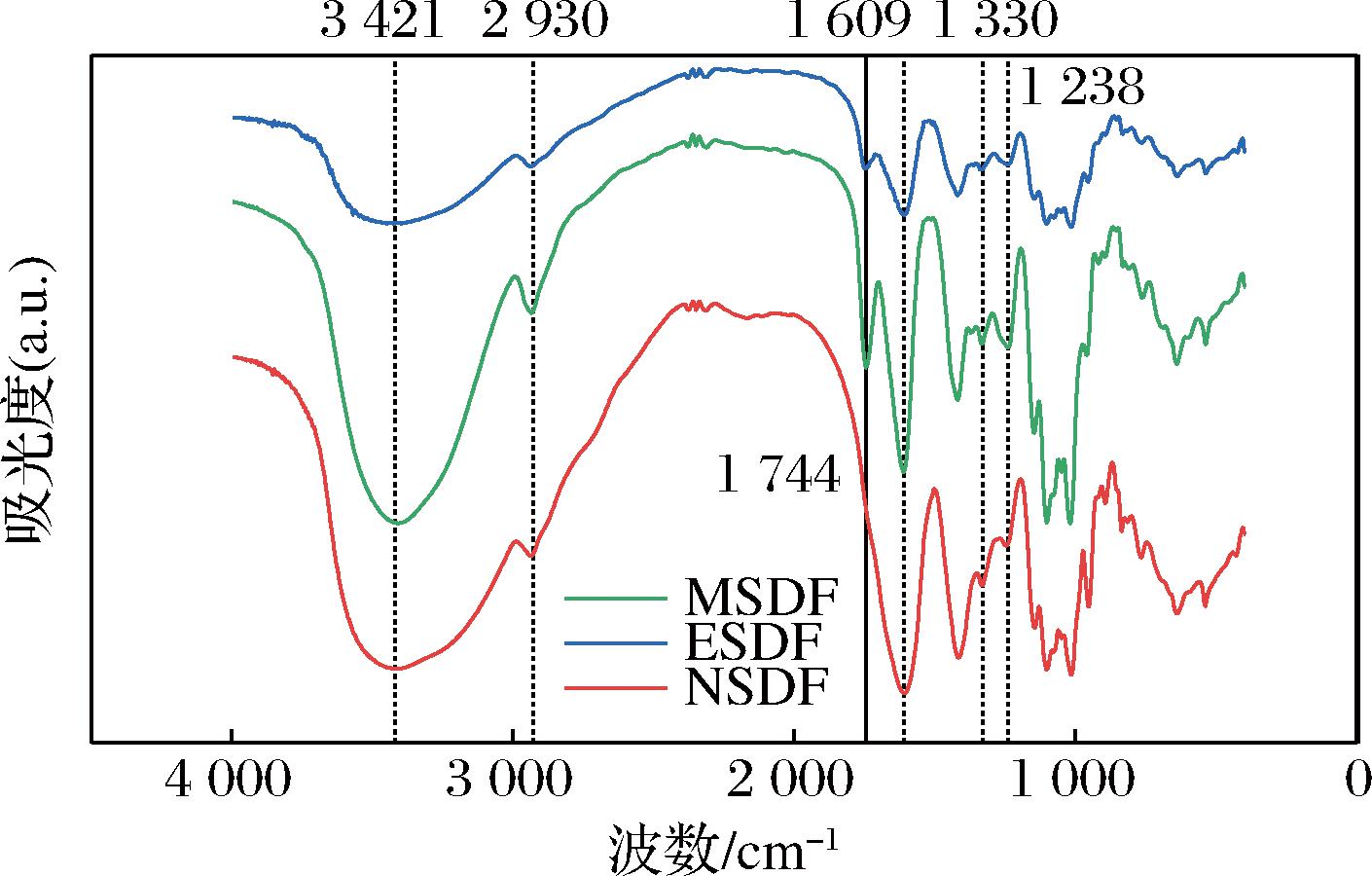
图2 不同提取方式下SDF的FT-IR图
Fig.2 FT-IR diagram of SDF under different extraction methods
2.2.2 山楂SDF微观结构分析
在图2基础上进一步分析SDF的微观结构。如图3所示,ESDF表面光滑,结构紧凑。经NaOH溶液提取的NSDF颗粒表面不均匀,形成断层结构。SDF经微波酶解,也形成断层结构,表面有大量小颗粒,形成雪花状,与前人研究结果一致[27]。造成这种现象的原因是微波引起SDF内部局部过热,细胞内的蒸气压迅速上升,局部水蒸气使细胞壁破裂,导致比表面积增加,形状松散多孔。MSDF这些松散的结构有利于扩大SDF颗粒的表面积,对提高SDF的持水能力和溶胀比具有积极作用。

a-MSDF;b-ESDF;c-NSDF
图3 不同提取方式SDF微观结构图(5 000×)
Fig.3 Microstructure of SDF with different extraction methods (5 000×)
2.2.3 山楂SDF晶体结构分析
SDF晶体结构可影响其持水性和持油性,因此测定其结晶性可以推测其功能特性。3种提取方式对SDF晶体结构的影响见图4。
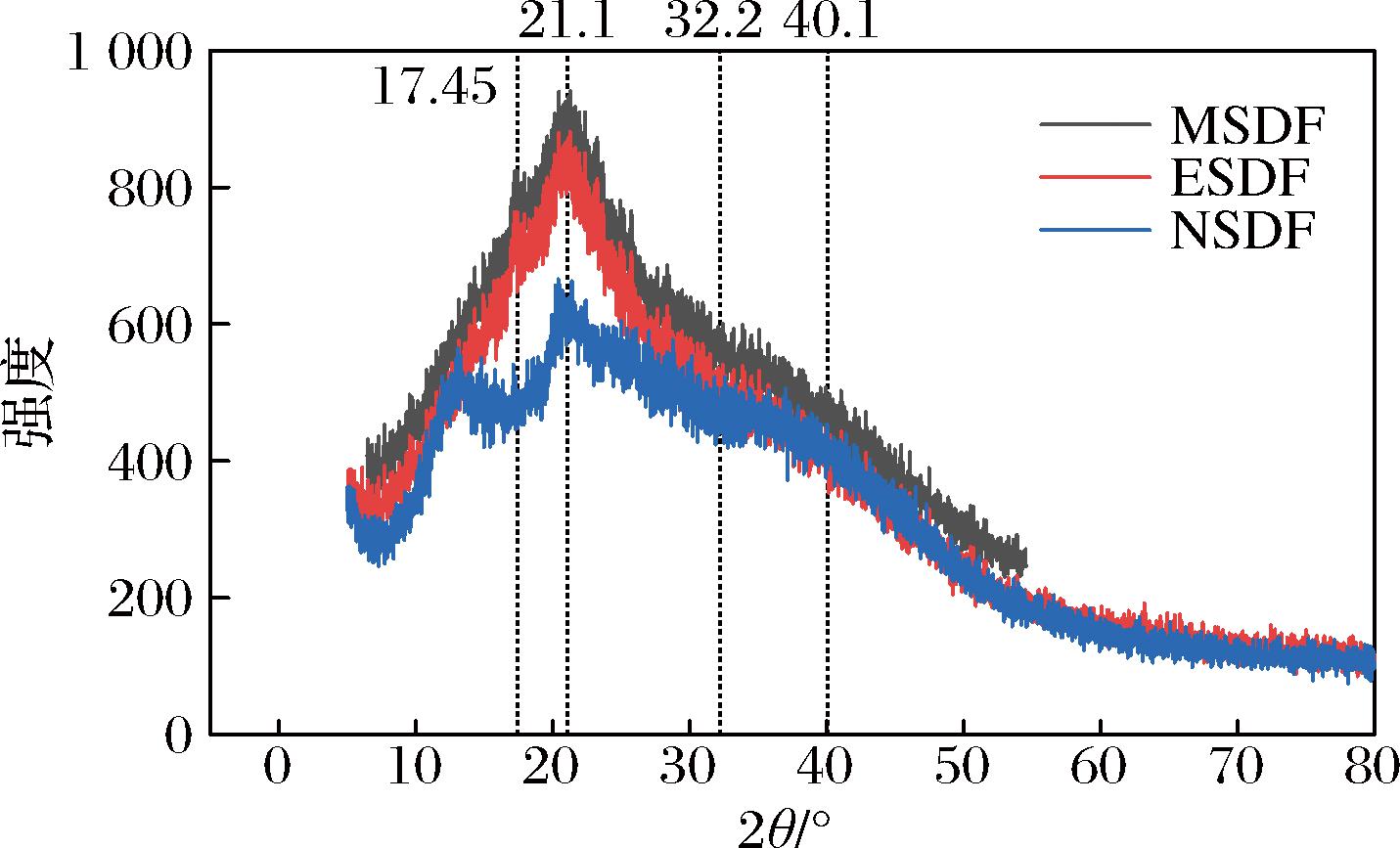
图4 不同提取方式SDF的XRD图
Fig.4 XRD patterns of SDF with different extraction methods
MSDF和ESDF在2θ=17.45°、21.1°、32.2°和40.1°处出现明显的衍射峰,NSDF与前两种提取方法的SDF不同是13.12°处有一个大的衍射峰。3种方法在21.1°处为主衍射峰,与天然纤维素I一致结晶结构是结晶区与无定形区共存的状态。微波后SDF的衍射峰形状没有发生显著变化,微波没有改变SDF的晶型。NSDF结晶区的峰高以及峰面积均有所下降,说明相对结晶度均有不同程度的降低。这可能是因为NaOH溶液处理在一定程度上破坏了SDF的结晶区域,结晶区转变为非晶区,进而导致结晶度略有下降,NSDF的分子间作用力减弱,可以呈现更松散的形态,有利于SDF的水合性能[28]。这一结果与王司琪等[29]研究的玉耳膳食纤维结果一致。
2.2.4 山楂SDF热特性分析
TGA是研究材料热降解的有效方式,分析热重可以了解SDF在食品加工中的稳定性。在加热条件下,SDF失重可分为3个阶段:干燥阶段、碳化阶段和燃烧阶段(图5)。在第一阶段,在30~200 ℃有一个小的损失,主要反应可能是SDF样品脱水。第二阶段,在200~300 ℃发生严重失重,过程包括聚糖环脱水和细胞壁细胞骨架分解。第三阶段为500~600 ℃,在此温度下,SDF几乎分解。NSDF最终的残余重量高于其他两种方法的原因可能是,NSDF中含有不被碳化的化学物质。微波前后SDF在热学性质曲线中未观察到明显差异,这说明微波处理未对山楂果渣SDF的热稳定性产生显著影响。

图5 不同提取方式SDF热重图
Fig.5 SDF thermogravimetric graph with different extraction methods
2.3.1 SDF单糖成分组成分析
单糖组成如表1和图6所示,3种SDF含有9种单糖,包括岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸、葡萄糖醛酸。其中半乳糖醛酸是MSDF和ESDF中的主要单糖,含量分别高达306.07和298.38 μg/mg,MSDF略高于ESDF。可能是微波处理导致多糖链部分断裂,小幅度增加了半乳糖醛酸含量。半乳糖醛酸是由α-1,4糖苷键线性连接在一起的多聚物,也是果胶中的主要单糖,半乳糖醛酸的大量存在表明果胶可能是SDF的重要成分。MSDF和ESDF中葡萄糖、阿拉伯糖、半乳糖和木糖浓度较高,4种糖总含量分别为202.7和196.93 μg/mg,说明半纤维素聚合物也是山楂果渣SDF的主要成分之一。NSDF中葡萄糖含量最高,其次是半乳糖醛酸和阿拉伯糖,这表明半纤维素和纤维素等非果胶多糖与NSDF一起提取。KEREH等[30]证明含糖醛酸的物质可以提高鸡蛋的抗氧化性,表明糖醛酸的含量越高,其清除自由基的能力越强。本研究3种方法得到的SDF均存在具有抗氧化能力的半乳糖醛酸,其中MSDF含量最高。MA等[31]的研究表明,低聚半乳糖醛酸在小鼠抗UVB辐射中有较好的抗氧化作用,这可能是SDF具有抗氧化作用的原因之一。
表1 不同提取方式的山楂果渣SDF单糖成分 单位:μg/mg
Table 1 Composition and content of SDF monosaccharide in hawthorn pomace with different extraction methods

样品岩藻糖鼠李糖阿拉伯糖半乳糖葡萄糖木糖甘露糖半乳糖醛酸葡萄糖醛酸MSDF2.07±0.08a24.67±1.02b113.22±3.12a39.45±1.13a42.83±1.32b7.20±0.23a3.12±0.16b306.07±6.35a1.55±0.05aESDF1.88±0.05b26.77±1.22a117.35±3.52a37.98±1.21a35.71±1.47c5.89±0.34b3.66±0.12a298.38±6.82a1.61±0.06aNSDF0.87±0.02c8.90±0.33c34.15±1.01b15.90±0.61b64.71±1.65 a2.56±0.11c2.97±0.08c41.96±1.02b1.05±0.03b
注:表中同列上标不同小写字母表示组间差异显著(P<0.05)(下同)。

1-岩藻糖;2-鼠李糖;3-阿拉伯糖;4-半乳糖;5-葡萄糖;6-木糖;7-甘露糖;8-半乳糖醛酸;9-葡萄糖醛酸
a-MSDF色谱图;b-ESDF色谱图;c-NSDF色谱图
图6 不同提取山楂果渣SDF单糖组成高效阴离子交换色谱谱图
Fig.6 High-performance anion exchange chromatogram of monosaccharide composition of SDF from different extracted hawthorn pomace
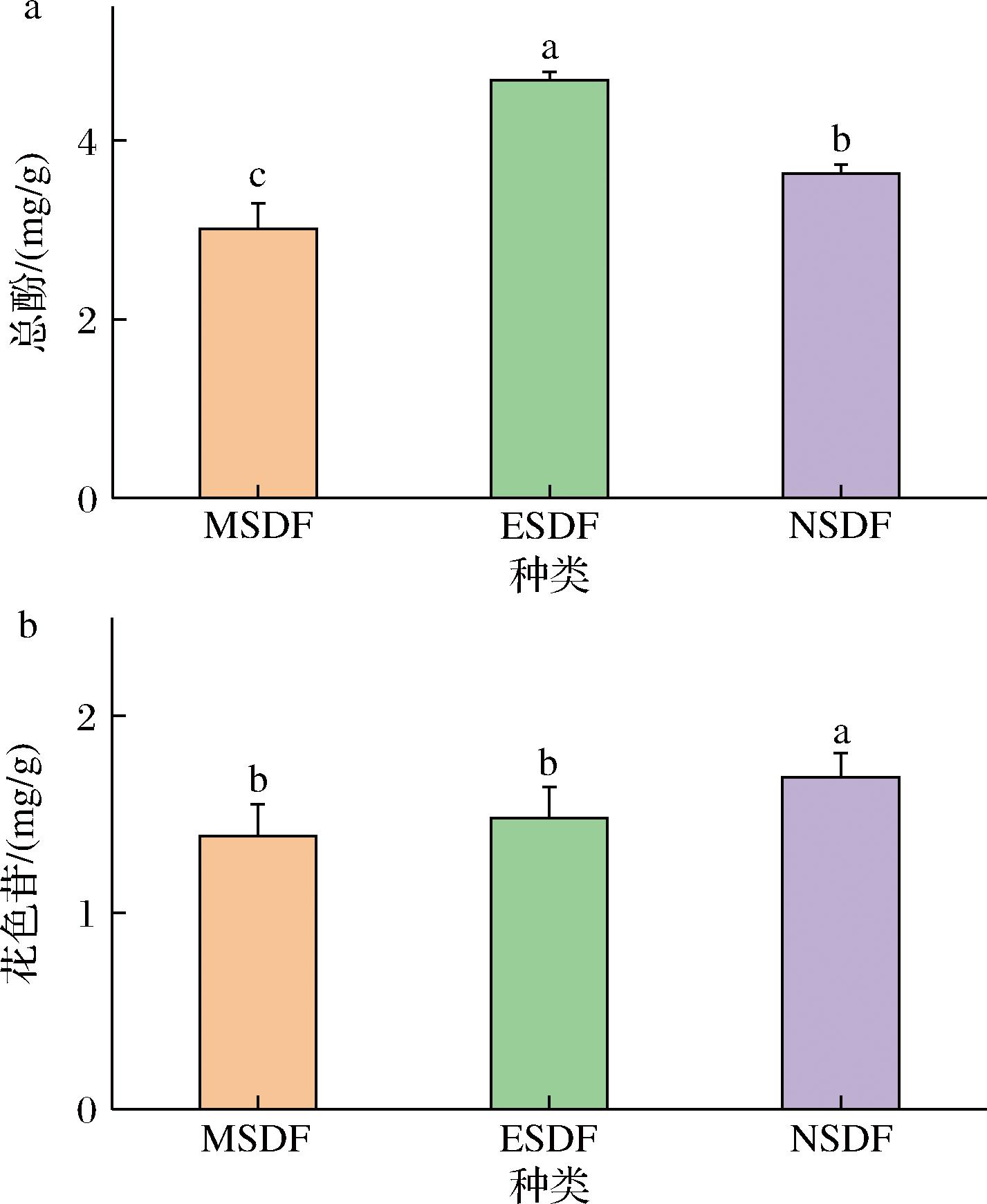
2.3.2 SDF总酚和花色苷含量分析
如图7所示,3种方法的SDF中均含有微量的总酚、花色苷。总酚含量ESDF中含量高于MSDF和NSDF(P<0.05)(图7-a),推测原因可能是微波加热和强碱使得酚类物质分解。如图7-b所示,NSDF中花色苷含量显著高于其他两种提取方式的SDF(P<0.05),其他两种提取方法的SDF中花色苷含量差别不大(P>0.05)。
a-总酚含量;b-花色苷含量
图7 不同提取方式SDF总酚、花色苷含量
Fig.7 Content of total phenols and anthocyanins of SDF extracted by different methods
注:小写字母不同表示差异显著(P<0.05)(下同)。
2.3.3 基本成分分析
由表2可知,3种提取方式提取均获得高纯度SDF样品,酶法和微波酶法纯度高于碱法。表明采用酶法或微波酶法提取SDF具有纯度好的优点。
表2 三种方法SDF主要成分含量
Table 2 Content of main components of SDF in three methods

样品蛋白质/%脂肪/%水分/%灰分/%纯度/%MSDF3.43±0.02b3.31±0.21b3.48±0.14b4.29±0.19c85.45±0.36aESDF3.25±0.09c3.14±0.15c3.46±0.11b4.31±0.11b85.84±0.47aNSDF4.90±0.31a4.76±0.11a3.52±0.25a5.12±0.20a81.68±0.34b
由表3可知,MSDF持水力为2.69 g/g,分别高于ESDF 64.02%、NSDF 20.09%,持油力为0.51 g/g分别高于ESDF 4.08%、NSDF 24.39%,吸水膨胀力6.67 mL/g高于ESDF 15.80%、NSDF 10.07%(P<0.05)。溶解性大小在一定程度上反映SDF分子质量大小,溶解度越高,分子质量越小,由溶解度结果可知,3种方法山楂果渣SDF在25 ℃时的溶解性均大于50%,且MSDF溶解性最高。由此推测3种方法提取的SDF都是低分子质量物质。膳食纤维阳离子交换能力具有降血压、排毒的功效,表3看出MSDF阳离子交换能力高于ESDF 122.22%,高于NSDF 90.17%,显著高于其他两种方法的SDF(P<0.05),原因可能是微波使得SDF的羧基、羟基、氨基等侧链基团暴露出来从而提高阳离子交换能力。
表3 不同提取方式的山楂果渣 SDF 功能特性
Table 3 Functional properties of hawthorn pomace SDF with different extraction methods

样品持水力/(g/g)持油力/(g/g)吸水膨胀力/(mL/g)阳离子交换能力/(mmol/g)溶解性/%MSDF2.69±0.09a0.51±0.03a6.67±0.23a35.60±0.35a78.84±1.40aESDF1.64±0.11c0.49±0.01b5.76±0.24c16.02±0.14c72.15±2.6bNSDF2.24±0.06b0.41±0.01c6.06±0.12b18.72±0.13b59.90±1.38c
注:列内不同字母的平均值±SD(n=3)在5%水平上有显著差异。
维生素C具有良好的DPPH自由基清除活性,以维生素C为对照验证SDF的DPPH自由基清除能力。由图8-a可知,3种提取方式SDF都具有较好的DPPH自由基清除能力,清除率随着SDF浓度增加而增强。MSDF的清除能力最强,半抑制浓度(half inhibitory concentration,IC50)为0.07 mg/mL,ESDF的清除能力IC50为0.08 mg/mL,NSDF清除率IC50为0.31 mg/mL,NSDF的DPPH自由基清除能力最弱,可能原因是NSDF的半乳糖醛酸含量较低。由图8-b可知,3种SDF对·OH清除效果明显,其清除能力随SDF浓度的增大而增强。其中ESDF的清除效果最强,IC50为1.23 mg/mL,MSDF清除率IC50略高于ESDF。

a-DPPH自由基清除能力;b-·OH清除能力
图8 不同提取方式SDF抗氧化能力
Fig.8 Antioxidative capacity of SDF in different extraction methods
如图9所示,3种方法的SDF都具有较好的α-淀粉酶的抑制能力,而MSDF葡萄糖吸收能力高于ESDF 30.31%,高于NSDF 16.50%(P<0.05)。研究证明,增加SDF的颗粒粒径、孔隙和水合性能可以有效增加其葡萄糖吸收能力[32]。MSDF的葡萄糖吸收能力显著高于ESDF,与前文所述的结果一致。如图10所示,3种方法均具有良好的甘氨酸钠结合能力,且NSDF稍高于其他两种方法。MSDF牛磺胆酸钠结合率分别高于ESDF 63.77%,NSDF 23.40%(P<0.05)。不同提取方式SDF对胆固醇的吸附能力存在显著差异(P<0.05),当pH=7时,其大小顺序为MSDF>NSDF>ESDF,MSDF比ESDF高28.45%,当pH=2时,其大小顺序为NSDF>MSDF>ESDF。两种pH值下的ESDF吸收能力显著低于其他两种方法(P<0.05)。酸度和碱度对SDF吸附胆固醇的能力有很大影响,模拟小肠的pH=7环境中对胆固醇的吸附能力高于模拟胃pH=2酸性条件,表明山楂果渣SDF主要作用于肠道。比表面积的增加和电荷密度的变化是增加SDF胆固醇吸收能力、胆酸钠结合能力一大重要因素。微波法制备的MSDF结构蓬松,增加了比表面积,这可能是胆固醇吸收能力与胆酸钠结合能力显著高于ESDF的原因。

a-α-淀粉酶抑制能力;b-葡萄糖吸收能力
图9 不同提取方式SDF体外降血糖活性
Fig.9 Hypoglycemic activity of SDF in vitro with different extraction methods
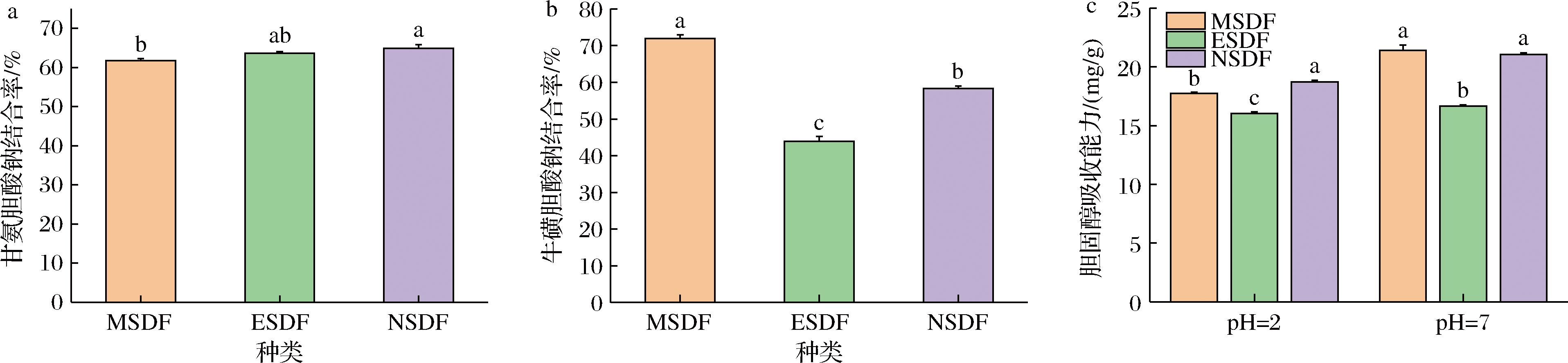
a-甘氨酸钠结合率;b-牛磺胆酸钠结合率;c-胆固醇吸收能力
图10 不同提取方式SDF体外降血脂活性
Fig.10 In vitro blood lipid-lowering activity of SDF with different extraction methods
本研究以山楂果渣为原料提SDF,验证了3种提取方式对SDF的理化、结构和功能特性的影响。与其他两种方式相比较,微波酶解法提取的SDF具有纯度高、条件温和、SDF功能特性较好等特点,开发价值较高。MSDF与ESDF以半乳糖醛酸和阿拉伯糖为主,NSDF葡萄糖含量最高。MSDF的持水力、持油力等理化性质良好,优于ESDF和NSDF;并且MSDF结构呈现雪花状疏松、多孔。3种方法山楂果渣SDF均具有抑制α-淀粉酶,葡萄糖吸收的能力,对胆固醇和胆酸钠表现出了较高的吸附性能,且MSDF在3种方法中表现最佳,具备开发功能性食品的潜力,但其体内功能作用和机制还需进一步研究。
微波酶解法提取山楂果渣SDF具有开发意义,且山楂果渣SDF具有作为预防肥胖、高血糖、高血脂等慢性疾病的功能食品原料来源的潜力。既可以提高山楂农副产品的利用率,又能减轻副产物的环境污染,延长山楂深加工的产业链。
[1] QIAO A M, WANG Y H, XIANG L M, et al.Novel triterpenoids isolated from hawthorn berries functioned as antioxidant and antiproliferative activities[J].Journal of Functional Foods, 2015, 13:308-313.
[2] VENSKUTONIS P R.Phytochemical composition and bioactivities of hawthorn (Crataegus spp.):Review of recent research advances[J].Journal of Food Bioactives, 2018, 4:69-87.
[3] 潘广彦. 山楂加工副产物综合利用技术研究[D].泰安:山东农业大学, 2012.
PAN G Y.Comprehensive utilization of hawthorn processing by-products[D].Tai’an:Shandong Agricultural University, 2012.
[4] ANDERSON J W, BAIRD P, DAVIS R H Jr, et al.Health benefits of dietary fiber[J].Nutrition Reviews, 2009, 67(4):188-205.
[5] CAO P Q, LI X P, OUYANG J, et al.The protective effects of yellow tea extract against loperamide-induced constipation in mice[J].Food &Function, 2021, 12(12):5621-5636.
[6] 孙永杰, 冯佳乐, 张兴华, 等.响应面法优化藜麦麸皮中可溶性膳食纤维提取工艺[J].食品工业, 2020, 41(12):37-39.
SUN Y J, FENG J L, ZHANG X H, et al.Optimization of extracting soluble dietary fiber from quinoa bran by response surface method[J].The Food Industry, 2020, 41(12):37-39.
[7] ZHAO Y S, JAYACHANDRAN M, XU B J.In vivo antioxidant and anti-inflammatory effects of soluble dietary fiber konjac glucomannan in type-2 diabetic rats[J].International Journal of Biological Macromolecules, 2020, 159:1186-1196.
[8] 朱仁威, 徐田辉, 黄亮, 等.洋蓟膳食纤维中可溶性膳食纤维提取工艺优化[J].食品工业科技, 2022, 43(23):176-182.
ZHU R W, XU T H, HUANG L, et al.Optimization of extraction process of soluble dietary fiber from artichoke dietary fiber[J].Science and Technology of Food Industry, 2022, 43(23):176-182.
[9] 丁政宇, 张士凯, 何子杨, 等.响应面优化黄精渣不溶性膳食纤维酶法提取工艺及其结构表征[J].食品工业科技, 2021, 42(20):157-163.
DING Z Y, ZHANG S K, HE Z Y, et al.Optimization of enzymatic extraction process of insoluble dietary fiber from Polygonatum sibiricum residue by response surface methodology and its characterization[J].Science and Technology of Food Industry, 2021, 42(20):157-163.
[10] 仝文玲, 郭玉如, 徐建国.碱法和酶法提取方法对胡麻渣可溶性膳食纤维理化性质的影响[J].食品研究与开发, 2019, 40(23):93-97.
TONG W L, GUO Y R, XU J G.Effects of alkali and enzyme extraction methods on physicochemical properties of soluble dietary fiber from flax residue[J].Food Research and Development, 2019, 40(23):93-97.
[11] 陈如寿, 郑旭煦, 殷钟意, 等.竹笋甾醇和膳食纤维的制取方法研究进展[J].竹子研究汇刊, 2011, 30(3):62-65;70.
CHEN R S, ZHENG X X, YIN Z Y, et al.Reviews on methods of extracting sterol and dietary fiber from bamboo shoots[J].Journal of Bamboo Research, 2011, 30(3):62-65;70.
[12] 罗舜菁, 谢靓, 熊绍百, 等.微波对膳食纤维结构和功能特性的影响[J].食品与机械, 2021, 37(6):30-35.
LUO S J, XIE L, XIONG S B, et al.Effects of microwave on the structural and functional properties of dietary fibers from different sources[J].Food &Machinery, 2021, 37(6):30-35.
[13] AMINI N, HARITOS V S, TANKSALE A.Microwave assisted pretreatment of eucalyptus sawdust enhances enzymatic saccharification and maximizes fermentable sugar yield[J].Renewable Energy, 2018, 127:653-660.
[14] GAN J P, XIE L, PENG G Y, et al.Systematic review on modification methods of dietary fiber[J].Food Hydrocolloids, 2021, 119:106872.
[15] 任雨离, 刘玉凌, 何翠, 等.微波和微粉碎改性对方竹笋膳食纤维性能和结构的影响[J].食品与发酵工业, 2017, 43(8):145-150.
REN Y L, LIU Y L, HE C, et al.Changes of fresh chimonobambusa dietary fiber in properties and structure modified by microwave and fine grinding[J].Food and Fermentation Industries, 2017, 43(8):145-150.
[16] 许祯毅, 李力, 姜咸彪, 等.响应面法优化碱法提取啤酒糟中可溶性膳食纤维的工艺研究[J].食品研究与开发, 2021, 42(17):75-80.
XU Z Y, LI L, JIANG X B, et al.Study on the optimal alkaline extraction of soluble dietary fiber from beer grains by response surface method[J].Food Research and Development, 2021, 42(17):75-80.
[17] SEGAL L, CREELY J J, MARTIN A E Jr, et al.An empirical method for estimating the degree of crystallinity of native cellulose using the X-ray diffractometer[J].Textile Research Journal, 1959, 29(10):786-794.
[18] KHATKAR B S, BARAK S, MUDGIL D.Effects of gliadin addition on the rheological, microscopic and thermal characteristics of wheat gluten[J].International Journal of Biological Macromolecules, 2013, 53:38-41.
[19] WANG L, XU H G, YUAN F, et al.Preparation and physicochemical properties of soluble dietary fiber from orange peel assisted by steam explosion and dilute acid soaking[J].Food Chemistry, 2015, 185:90-98.
[20] ROBERTSON J A, DE MONREDON F D, DYSSELER P, et al.Hydration properties of dietary fibre and resistant starch:A European collaborative study[J].LWT-Food Science and Technology, 2000, 33(2):72-79.
[21] 王娟, 魏春红, 王维浩, 等.物理改性对小米水溶性膳食纤维的结构表征及硒化能力的影响[J].中国粮油学报, 2021, 36(5):35-42.
WANG J, WEI C H, WANG W H, et al.Effects of physical modification on structural characterization and selenization ability of millet water-soluble dietary fiber[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(5):35-42.
[22] WANG C H, MA Y L, ZHU D Y, et al.Physicochemical and functional properties of dietary fiber from bamboo shoots (Phyllostachys praecox)[J].Emirates Journal of Food and Agriculture, 2017, 29(7):509-517.
[23] QI J, LI Y, MASAMBA K G, et al.The effect of chemical treatment on the in vitro hypoglycemic properties of rice bran insoluble dietary fiber[J].Food Hydrocolloids, 2016, 52:699-706.
[24] 郭娅, 过利敏, 周玉岩, 等.改性方式对红花籽粕可溶性膳食纤维理化性质和吸附特性的影响[J].中国酿造, 2022, 41(5):137-142.
GUO Y, GUO l M, ZHOU Y Y, et al.Effects of modification methods on physicochemical properties and adsorption of soluble dietary fiber from safflower seed meal[J].China Brewing, 2022, 41(5):137-142.
[25] 于美汇, 赵鑫, 尹红力, 等.碱提醇沉黑木耳多糖体外和体内降血脂功能[J].食品科学, 2017, 38(1):232-237.
YU M H, ZHAO X, YIN H L, et al. In vitro and in vivo hypolipidemic effect of Auricularia auricular polysaccharides[J].Food Science, 2017, 38(1):232-237.
[26] 刘学成, 王文亮, 弓志青, 等.金针菇膳食纤维改性、理化性质及抗氧化、降血脂活性[J].食品科学, 2021, 42(23):90-98.
LIU X C, WANG W L, GONG Z Q, et al.Modification, physicochemical properties and lipid-lowering and antioxidant activity of dietary fiber from Flammulina velutipes[J].Food Science, 2021, 42(23):90-98.
[27] DENG M,LIN Y S, DONG L H, et al.Physicochemical and functional properties of dietary fiber from pummelo (Citrus grandis L.Osbeck) and grapefruit (Citrus paradisi Mcfad) cultivars[J].Food Bioscience, 2021, 40:100890.
[28] HUA M, LU J X, QU D, et al.Structure, physicochemical properties and adsorption function of insoluble dietary fiber from ginseng residue:A potential functional ingredient[J].Food Chemistry, 2019, 286:522-529.
[29] 王司琪, 王佳佳, 李泊铮, 等.提取方法对玉木耳膳食纤维结构特征和功能特性的影响[J].食品科学, 2022, 43(24):93-101.
WANG S Q, WANG J J, LI B Z, et al.Effects of extraction methods on the structural and functional characteristics of dietary fiber from Auricularia cornea var.Li[J].Food Science, 2022, 43(24):93-101.
[30] KEREH V G, UNTU I M, NAJOAN M, et al.Extraction of uronic acid from Sargassum crassifolium and its feeding effects on the immunity of Lohman chicken eggs[C].IOP Conference Series:Earth and Environmental Science, 2021, 788(1):012047.
[31] 刘素稳, 吴瞻邑, 由璐, 等.山楂果胶低聚半乳糖醛酸提取物对中波紫外线辐射 HaCaT 细胞氧化损伤和光老化的保护作用[J].食品科学, 2018, 39(21):210-218.
LIU S W, WU Z Y, YOU L, et al.Protective effect of hawthorn pectin oligogalacturonide extract against ultraviolet B-induced oxidative damage and photoaging in HaCaT cells[J].Food Science, 2018, 39(21):210-218.
[32] MA M M, MU T H.Modification of deoiled cumin dietary fiber with laccase and cellulase under high hydrostatic pressure[J].Carbohydrate Polymers, 2016, 136:87-94.