食用酵母提取物通过上调Nrf-2改善皮肤衰老模型小鼠抗氧化水平
付少委1,2,秦修远1,2*,张卓然1,2,李明亮1,2,冯志远1,2,栾金玲3,任玮1,2,程倩3*
1(中国食品发酵工业研究院有限公司,北京,100015)2(北京市蛋白功能肽技术研究中心,北京,100015)3(酵母功能湖北省重点实验室 宜昌市营养健康食品工程技术研究中心,湖北 宜昌,443003)
摘 要 酵母提取物是一种天然安全的活性物质,作为抗氧化剂在食品工业中具有广泛应用。探究食用酵母提取物对皮肤抗衰老的功效作用。该研究采用D-半乳糖诱导构建皮肤衰老动物模型,利用不同剂量的酵母提取物进行干预,雄性ICR小鼠随机分为对照组(Control)、模型组(Model)、阳性组(GSH)、酵母提取物低剂量组(LYE)、酵母提取物中剂量组(MYE)、酵母提取物高剂量组(HYE),每组12只,连续处理70 d,每周进行称重。末次灌胃后禁食12 h,称重,随后对小鼠进行眼眶取血用于氧化应激指标检测,收集小鼠皮肤组织用于形态学观察,免疫蛋白印迹法检测皮肤组织Nrf-2蛋白的表达量。酵母提取物实验组小鼠皮肤组织表皮层增厚情况有明显改善,血清中的谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性和丙二醛(malondialdehyde,MDA)含量随着酵母提取物剂量的增加,抗氧化水平也进一步提高,逐渐趋于空白组水平,并通过上调Nrf-2蛋白来减轻衰老导致的氧化应激反应。该研究得出食用酵母提取物主要是从减轻抗氧化应激途径来实现抗衰老作用,同时也得出了具有改善效果的最佳服用量。
关键词 酵母提取物;抗衰老;抗氧化;Nrf-2
DOI:10.13995/j.cnki.11-1802/ts.036398
引用格式:付少委,秦修远,张卓然,等.食用酵母提取物通过上调Nrf-2改善皮肤衰老模型小鼠抗氧化水平[J].食品与发酵工业,2024,50(9):17-22.FU Shaowei, QIN Xiuyuan, ZHANG Zhuoran, et al.Edible yeast extract improves antioxidant levels through up regulation of Nrf-2 in skin aging model mice[J].Food and Fermentation Industries,2024,50(9):17-22.
第一作者:硕士,助理工程师(秦修远工程师和程倩工程师为共同通信作者,E-mail:betterqxy@163.com;chqian001@163.com)
基金项目:安琪纽特营养基金项目(AF2021004);中轻集团科技创新基金项目(ZQ2022JC-QN09);宁夏回族自治区重点研发计划项目(2021BEG02027)
收稿日期:2023-06-07,改回日期:2023-07-03
衰老是生命过程中的一种自然现象[1]。随着生物体的不断衰老[2],机体不仅会产生各种组织器官疾病[3],皮肤也会加速、加重老化,出现皮肤胶原流失、弹性下降、肤色暗沉等现象[4],严重影响生产建设核心人群的生活和工作体验。根据第一财经商业数据中心(CBN Data)与聚划算、强生联合发布的《健康生活消费趋势报告》显示,抗衰老产品已成为天猫等电商平台食品、化妆品、保健品等快消品中最热门的搜索词汇之一,且对消费人群的调查显示,全年龄段消费者对抗衰老产品均具有强烈需求。
长期人口干预研究、实验室调查和动物研究表明,皮肤老化受到内源性因素调控和外源性因素影响。内源性老化主要受到内在因素基因组和激素等调控[2],而外源性老化与外在环境紫外线和环境污染等因素均相关。同时,组织及细胞内部的炎症、氧化及糖化反应也会对细胞和组织造成不同程度的损伤[5]。晚期体内糖基化终末产物(advanced glycosylation end products,AGEs)累积会消耗细胞天然存在的等抗氧化成分,产生更多的活性氧(reactive oxygen species,ROS);此外,糖基化也可与细胞表面受体结合,被激活后触发细胞NF-κB信号通路,引发炎症反应和原有细胞因子的表达[6]。随着各项研究的报道,人们逐渐认识到营养膳食因素与皮肤之间的关系[7],在饮食模式更健康的人群中,面部细纹和皱纹更少[8-9],或是皮肤色素变化更少[10],皮肤萎缩和干燥情况更少[11]。因此,寻找有效预防皮肤衰老发展的营养干预方式,对于延缓炎症和氧化等途径引起的衰老具有十分重要的现实意义。
酵母提取物是一种天然安全的活性物质,作为天然调味料或者油类食品的抗氧化剂在食品工业中有广泛应用[12]。随着研究的不断深入,酵母提取物因独特的功效[13],已作为一种新型的化妆品原料,应用于高档化妆品中。酵母提取物中富含氨基酸、多肽及维生素等营养物质,氨基酸是人体必需的物质,可以被皮肤轻松吸收,有助于保湿和修复皮肤屏障,改善皮肤状态;多肽可以促进角质细胞的新陈代谢,让皮肤变得更加光滑有弹性,并能抑制黑色素的产生。此外,酵母提取物中还含有维生素A、C、E等成分,这些成分具有抗衰老、抗氧化和美白等作用。有研究表明酵母提取物可以通过抑制或竞争的形式降低多酚氧化酶的活性,减少黑色素的形成,并可以抑制B16黑素瘤细胞中黑素的形成,但对其增殖无显著抑制作用[14]。成纤维细胞可以不断产生胶原蛋白、透明质酸、弹性纤维等支撑皮肤年轻态的物质,令皮肤看起来光滑有弹性,而来源于米酒酵母提取物有促进成纤维HS68细胞增殖的功效[15]。研究表明酵母提取物表现出的多种活性多数都与其含有的谷胱甘肽(glutathione,GSH)相关[16]。GSH是一种重要的抗氧化剂,由L-谷氨酸、L-半胱氨酸、甘氨酸经肽键缩合而成,是广泛存在于动植物、微生物体内的同时具有谷氨酸基和巯基的小分子活性三肽,其结构中的半胱氨酸残基含有一个活泼的巯基,具有强亲核特性,可以对抗活性氧、结合亲电子物质或其他氧化代谢产物,具有清除自由基、增强抗氧化物酶活性、提高机体抗氧化防御能力等重要生理功能[17-19]。GSH有利于皮肤美容和抗衰老,机体补充GSH(250 mg/d)能够积极影响皮肤性能,在口服GSH 12周期间,受试者皮肤黑色素指数、紫外斑(皮肤色素)、局部位置皱纹数量等衰老指标均低于安慰剂组,且皮肤弹性增加的趋势也更优[20-21]。
鲜有关于食用酵母提取物有助于改善皮肤衰老的研究报道。因此,本研究以D-半乳糖诱导建立衰老动物实验模型,将不同剂量的酵母提取物喂养小鼠一段时间后,称量体重监测小鼠生长营养情况,并利用苏木精-伊红(hematoxylin-eosin,HE)染色技术,考察血清和皮肤组织中的氧化应激相关指标,利用Western Blot检测氧化应激调控蛋白的相对含量,探究食用酵母提取物对衰老小鼠皮肤老化抗氧化水平的改善作用,为酵母提取物在皮肤抗衰老、美容等功能方向的研究提供理论依据。
1 材料与方法
1.1 材料与试剂
酵母提取物FHG-1(利用高谷胱甘肽酵母进行发酵、洗涤、高压均质破壁、酶解、分离、浓缩以及干燥得到样品),安琪纽特股份有限公司;雄性ICR小鼠[SCXK(京)2019-0010;NO.110324220100569744],斯贝福(北京)生物技术有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒,南京建成生物工程研究所;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),默克公司;NRF-2 Polyclonal Antibody,Proteintech中国公司。
1.2 仪器与设备
酶标仪,美国贝克曼;Millipore Elix 15纯水仪,默克化工有限公司;ST2100实验室pH计,奥豪斯仪器(常州)有限公司;EL104电子天平,梅特勒-托利多仪器(上海)有限公司;80-2离心沉淀器,江苏省金坛市医疗仪器厂;79-1磁力加热搅拌器,国华电器有限公司;WB-10L1恒温水浴锅,德国Memmert公司。
1.3 实验方法
1.3.1 构建小鼠皮肤衰老模型和实验分组
采用D-半乳糖颈背部皮下注射法致小鼠皮肤衰老模型。雄性ICR小鼠,体重(25±5) g,随机分为对照组(Control)、模型组(Model)、阳性组(GSH)、酵母提取物低剂量组(LYE)、酵母提取物中剂量组(MYE)、酵母提取物高剂量组(HYE),除对照组和模型组每组24只外,其余各组12只。适应性培养3 d后,对照组每天灌胃生理盐水0.2 mL/只,连续70 d,从灌胃第29天起,每天于颈背部皮下注射无菌生理盐水0.2 mL/只,连续42 d。模型组每天灌胃生理盐水0.2 mL/只,连续70 d,从灌胃第29天起,每天于颈背部皮下注射1 000 mg/kg无菌D-半乳糖0.2 mL/只,连续42 d。GSH:每天灌胃20 mg/kg还原型谷胱甘肽0.2 mL/只,连续70 d,从灌胃第29天起,每天于颈背部皮下注射1 000 mg/kg无菌D-半乳糖0.2 mL/只,连续42 d。LYE组:每天灌胃85 mg/kg酵母提取物0.2 mL/只,连续70 d,从灌胃第29天起,每天于颈背部皮下注射1 000 mg/kg无菌D-半乳糖0.2 mL/只,连续42 d。MYE组:每天灌胃170 mg/kg酵母提取物0.2 mL/只,连续70 d,从灌胃第29天起,每天于颈背部皮下注射1 000 mg/kg无菌D-半乳糖0.2 mL/只,连续42 d。HYE组:每天灌胃340 mg/kg酵母提取物0.2 mL/只,连续70 d,从灌胃第29天起,每天于颈背部皮下注射1 000 mg/kg无菌D-半乳糖0.2 mL/只,连续42 d。每周称量1次体重。从第71天起,取小鼠粪便,以异氟烷麻醉小鼠,采用眼球摘除放血法处死小鼠,取眼眶血及皮肤组织。剂量选择[22]设置依据为人(以60 kg计)每日摄入GSH的梯度为50、100、200 mg,将GSH折算酵母提取物为417、834、1 668 mg,即对应低剂量、中剂量、高剂量。采用动物实验与人剂量换算公式(1),得到小鼠灌胃剂量为85、170、340 mg/kg。
HED(mg/kg)=Animal does (mg/kg)×Animal Km/Human Km
(1)
1.3.2 小鼠体重监测
每周对各组饲养的小鼠进行称重,记录数据进行分析。
1.3.3 皮肤组织形态学观察
小鼠皮肤固定:将取下的新鲜小鼠皮肤组织置于体积分数4%多聚甲醛固定液中固定,注意存放的EP管中不留空气。石蜡切片制作:流水冲洗固定的组织,分别经体积分数70%、80%、90%各级乙醇溶液各脱水30 min,再分别经95%、100%乙醇各脱水2次,20 min/次。取出脱水的组织置于V(乙醇)∶V(二甲苯)=1∶1的混合液15 min,之后再浸入二甲苯两次,15 min/次直至组织呈现透明状态。取出透明的组织放入V(二甲苯)∶V(石蜡)=1∶1的混合液15 min,之后再浸入石蜡2次,60 min/次。透蜡后,将组织置于事先备好的纯石蜡蜡模,进行包埋,待凝固后用切片机切片。脱蜡复水:将完整的石蜡切片浸入二甲苯中2次,每次20 min,之后用无水乙醇浸润2次,每次5 min。再用75%乙醇溶液脱蜡5 min后,用蒸馏水浸润。HE染色:切片置于苏木精染色5 min,蒸馏水洗净多余染液,10 g/L盐水溶液分化10 s,继续蒸馏水漂洗,以体积分数0.6%氨水浸泡至返蓝,蒸馏水流动冲洗数10 s。再将切片置于体积分数85%乙醇和95%乙醇溶液中依次脱水,放入伊红染液中染色5 min。脱水封片:经HE染色切片放入无水乙醇中脱水3次,每次5 min,再放入正丁醇中5 min,再放入二甲苯中2次,每次5 min直至透明。将切片稍晾干,以中性树胶封片。
1.3.4 抗氧化指标检测
利用试剂盒取小鼠血液样本检测血清GSH-Px、MDA、SOD情况。
1.3.5 小鼠皮肤组织调控蛋白的表达
将小鼠皮肤组织在RIPA裂解液中彻底均质,4 ℃低温离心获得总蛋白,测定蛋白质浓度后,加入蛋白质上样缓冲液,高温水浴5 min变性蛋白质。用100 g/L SDS-PAGE对20 μg蛋白质进行取样,并转移到PVDF上,使用50 g/L脱脂乳粉封闭2 h。洗净PVDF膜,4 ℃下一抗孵育过夜,洗净后,二抗孵育2 h,通过强化化学发光检测系统最终显示蛋白质条带,并使用Image J图像分析软件进行蛋白相对定量分析。
1.4 数据分析
利用Origin 2023进行数据分析,结果均以平均值±标准差表示,组间比较采用ANOVA 单因素分析,P>0.05为无显著性差异,P≤0.05为差异性显著,P≤0.01为差异性极显著。
2 结果与分析
2.1 小鼠体重变化情况
如表1所示,经过4周喂养和6周造模,各组小鼠体重均有增加,模型组与空白组无显著性差异,阳性组和酵母组与模型组无显著性差异。但与空白组相比,模型组小鼠体重有下降,而经GSH或不同剂量的酵母提取物灌胃,小鼠体重较模型组均有增加,并且随着酵母提取物的剂量增加而呈剂量依赖,这说明利用不同剂量的酵母提取物可以改善小鼠营养生长情况。
表1 小鼠10周体重变化统计表 单位:g
Table 1 Statistical table of body weight changes of mice in 10 weeks
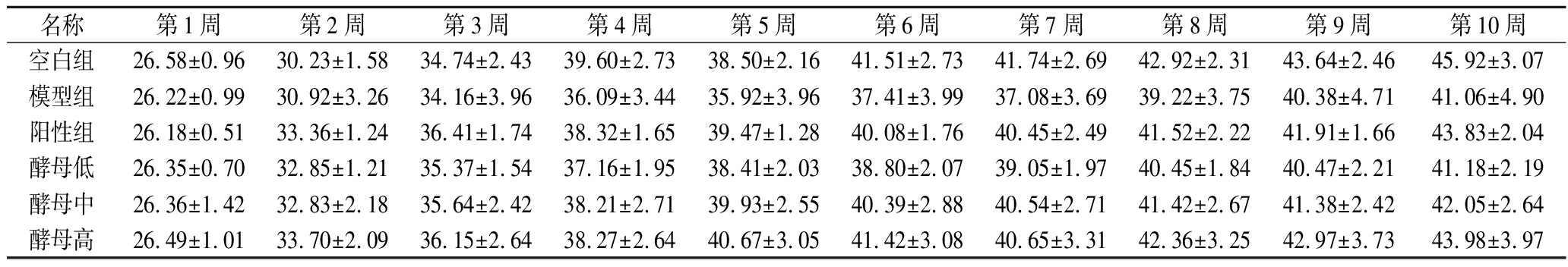
名称第1周第2周第3周第4周第5周第6周第7周第8周第9周第10周空白组26.58±0.9630.23±1.5834.74±2.4339.60±2.7338.50±2.1641.51±2.7341.74±2.6942.92±2.3143.64±2.4645.92±3.07模型组26.22±0.9930.92±3.2634.16±3.9636.09±3.4435.92±3.9637.41±3.9937.08±3.6939.22±3.7540.38±4.7141.06±4.90阳性组26.18±0.5133.36±1.2436.41±1.7438.32±1.6539.47±1.2840.08±1.7640.45±2.4941.52±2.2241.91±1.6643.83±2.04酵母低26.35±0.7032.85±1.2135.37±1.5437.16±1.9538.41±2.0338.80±2.0739.05±1.9740.45±1.8440.47±2.2141.18±2.19酵母中26.36±1.4232.83±2.1835.64±2.4238.21±2.7139.93±2.5540.39±2.8840.54±2.7141.42±2.6741.38±2.4242.05±2.64酵母高26.49±1.0133.70±2.0936.15±2.6438.27±2.6440.67±3.0541.42±3.0840.65±3.3142.36±3.2542.97±3.7343.98±3.97
2.2 皮肤组织形态学观察结果
如图1所示小鼠皮肤组织切片HE染色结果与空白组相比,模型组表皮层增厚明显,棘层肥厚,真皮组织增厚,真皮乳头减少,与表皮的连接紧密性下降,毛囊数量下降,皮脂腺分布异常,弹力纤维断裂明显,胶原纤维等结缔组织增生明显;阳性组与空白组较为接近。经过不同剂量的酵母提取物灌胃后,小鼠皮肤组织表皮层增厚情况有明显改善。低剂量的酵母提取物灌胃组真皮层较模型组有恢复,但弹力纤维仍断裂或流失明显,皮脂腺异常情况较严重,中剂量酵母提取物组与阳性组接近,高剂量组皮脂腺虽然分布较少,但弹力纤维和胶原纤维恢复情况与阳性组接近。
2.3 小鼠血液抗氧化指标检测结果
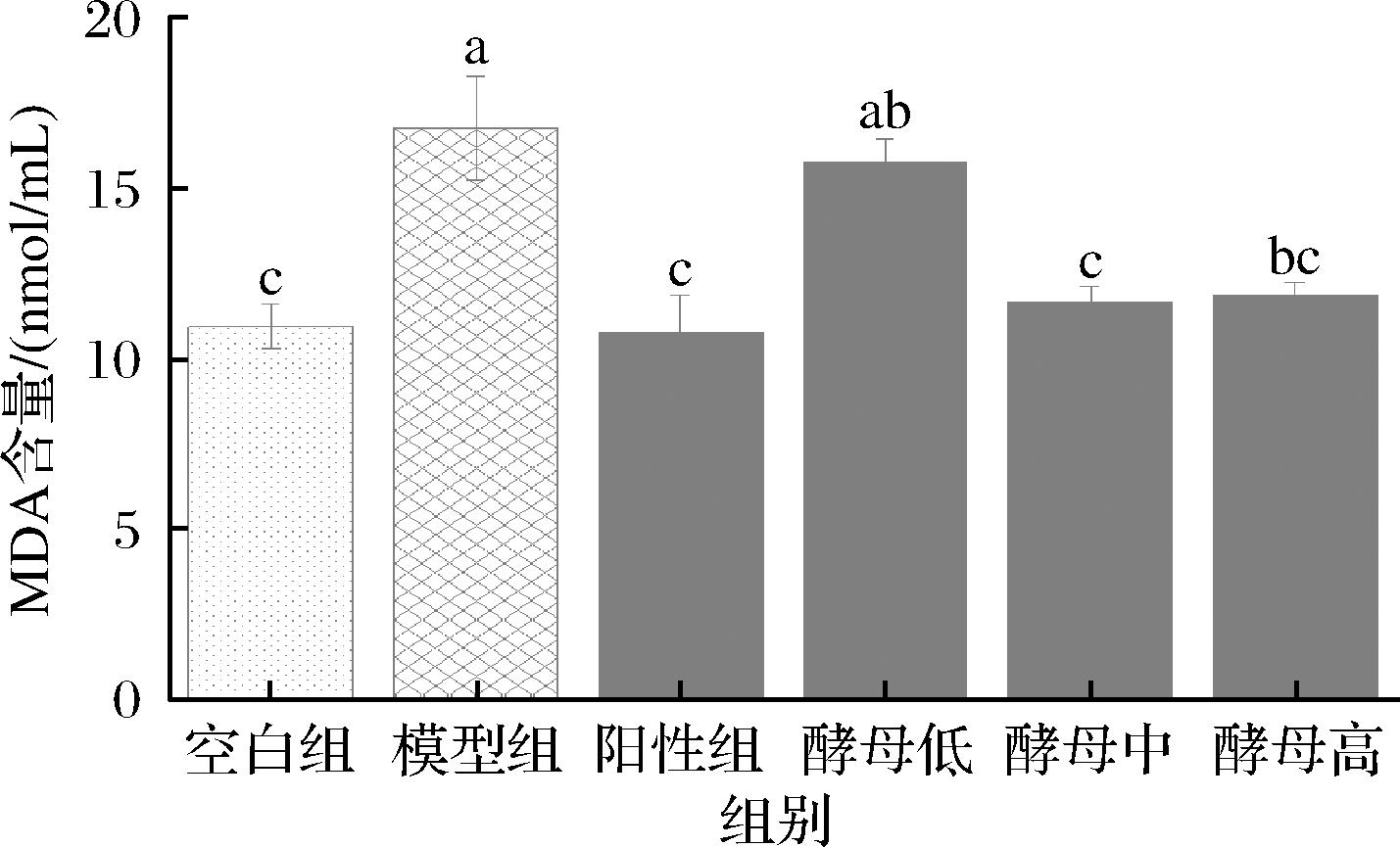
MDA含量、SOD以及GSH-Px是反映机体抗氧化能力的重要参数。如图2~图4所示,经过D-半乳糖诱导的模型组小鼠,与空白组相比其血清MDA积累量显著增加,GSH-Px活性升高,尽管SOD活性变化不显著,但与空白组相比也有提升的作用。MDA是脂质过氧化反应中产生的过氧化物,在体内新陈代谢中起到重要作用,其含量的变化反映了机体组织细胞受自由基攻击的严重程度[23],被视为细胞过氧化损伤程度的标志物[24]。图2结果表明,D-半乳糖引起小鼠血清产生氧化应激,致使MDA释放,而灌胃GSH的阳性组能够将MDA含量下降到空白组水平,灌胃不同剂量的酵母提取物对产生氧化应激反应的小鼠有不同程度的影响。在低剂量条件下,小鼠血清MDA含量与模型组相比相差不大,说明灌胃低剂量的酵母提取物对小鼠的氧化应激反应未起到明显的调节作用,而当剂量提高一倍(中剂量)时,MDA含量下降至与空白组同等水平,剂量再提高结果和中剂量相差不大,说明灌胃中剂量的酵母提取物是小鼠调节氧化应激反应时最合适的营养补给。
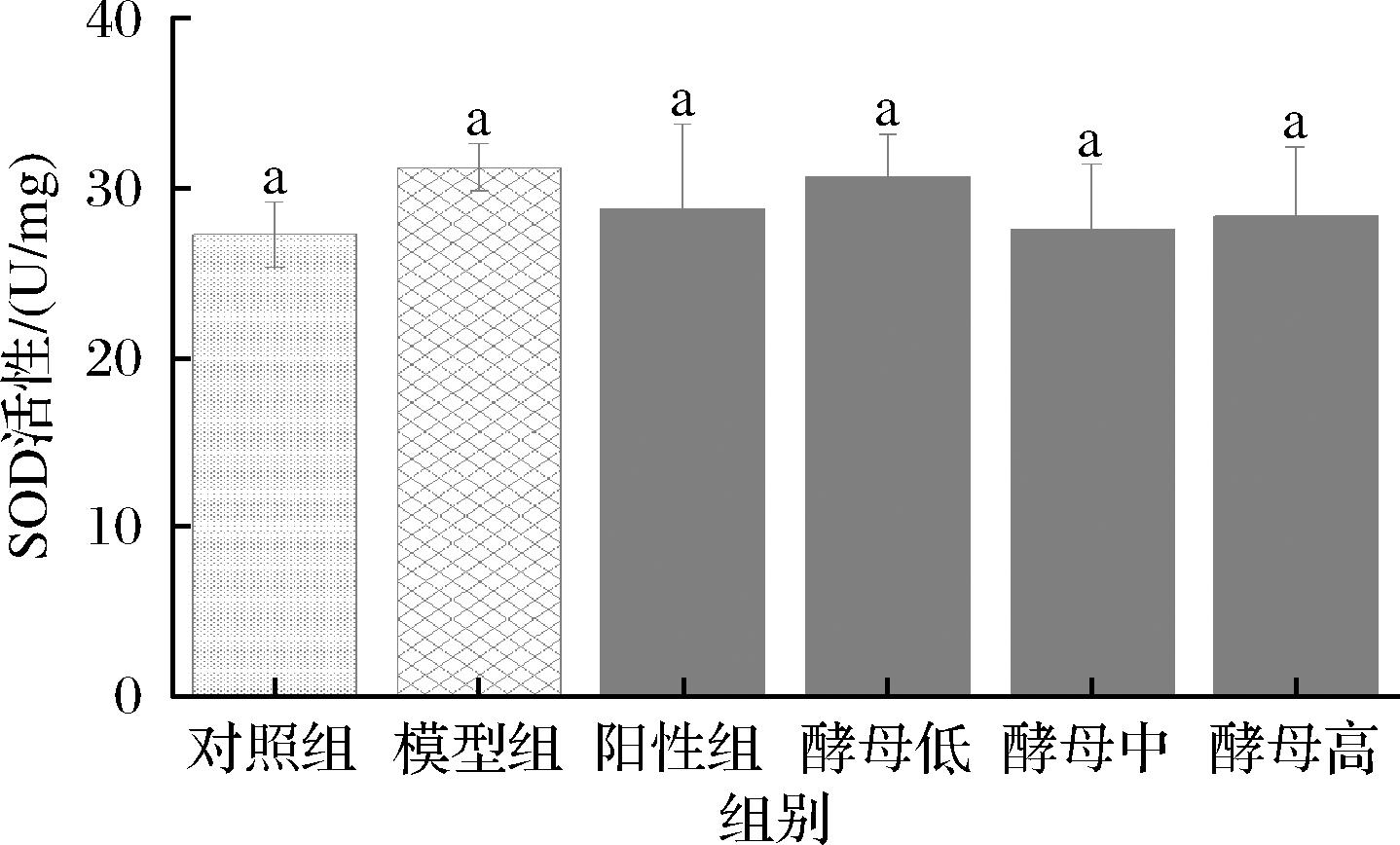
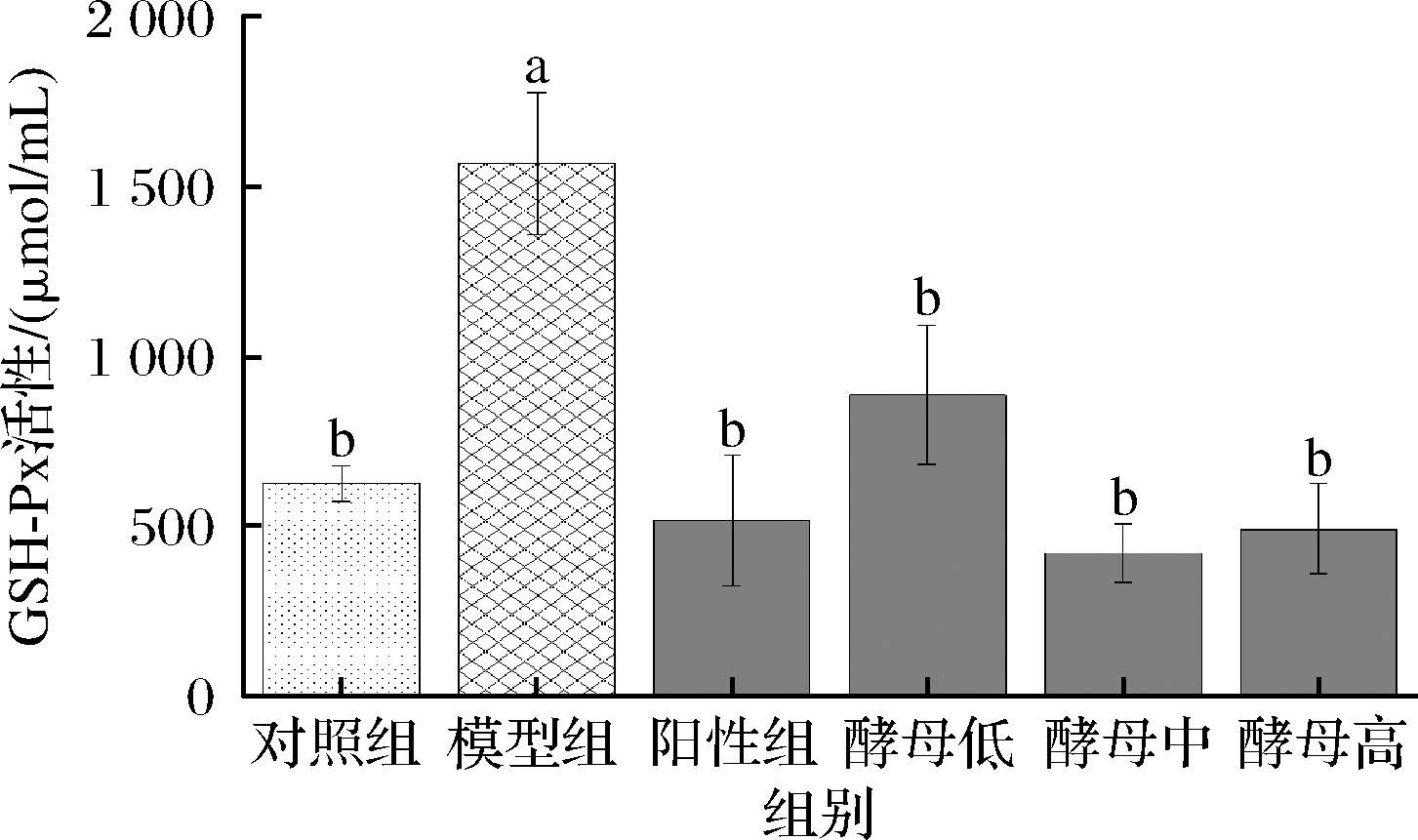
如图3和图4所示,机体清除自由基的抗氧化酶主要有SOD、GSH-Px等,这些酶构成了细胞内的防御系统,可以通过一系列连锁反应来协调自由基的清除。抗氧化酶的活性水平对于维持超氧自由基和H2O2的稳定状态具有重要作用,SOD能够催化活性高的O2-变为超氧阴离子或者H2O2[25],GSH-Px可以分解H2O2和有机过氧化物(ROOH),这些是清除自由基的关键,并且能够催化过氧化物与GSH反应,从而起到保护作用[26]。与空白组相比,模型组的SOD活性有增强的效果,但无显著性差异;GSH-Px活性显著升高,表明D-半乳糖的摄入激活了小鼠机体酶抗氧化防御系统,主要以GSH-Px来防御氧化应激。灌胃GSH及酵母提取物能够有效调节小鼠机体抗氧化防御系统,特别是当灌胃剂量达到中剂量时,GSH-Px活性可恢复到空白组水平,并且当剂量再升高时,效果与中剂量无明显差异。各实验组的SOD活性尽管无显著性差异,但变化趋势与GSH-Px活性一致。
2.4 Western Blot蛋白定量结果
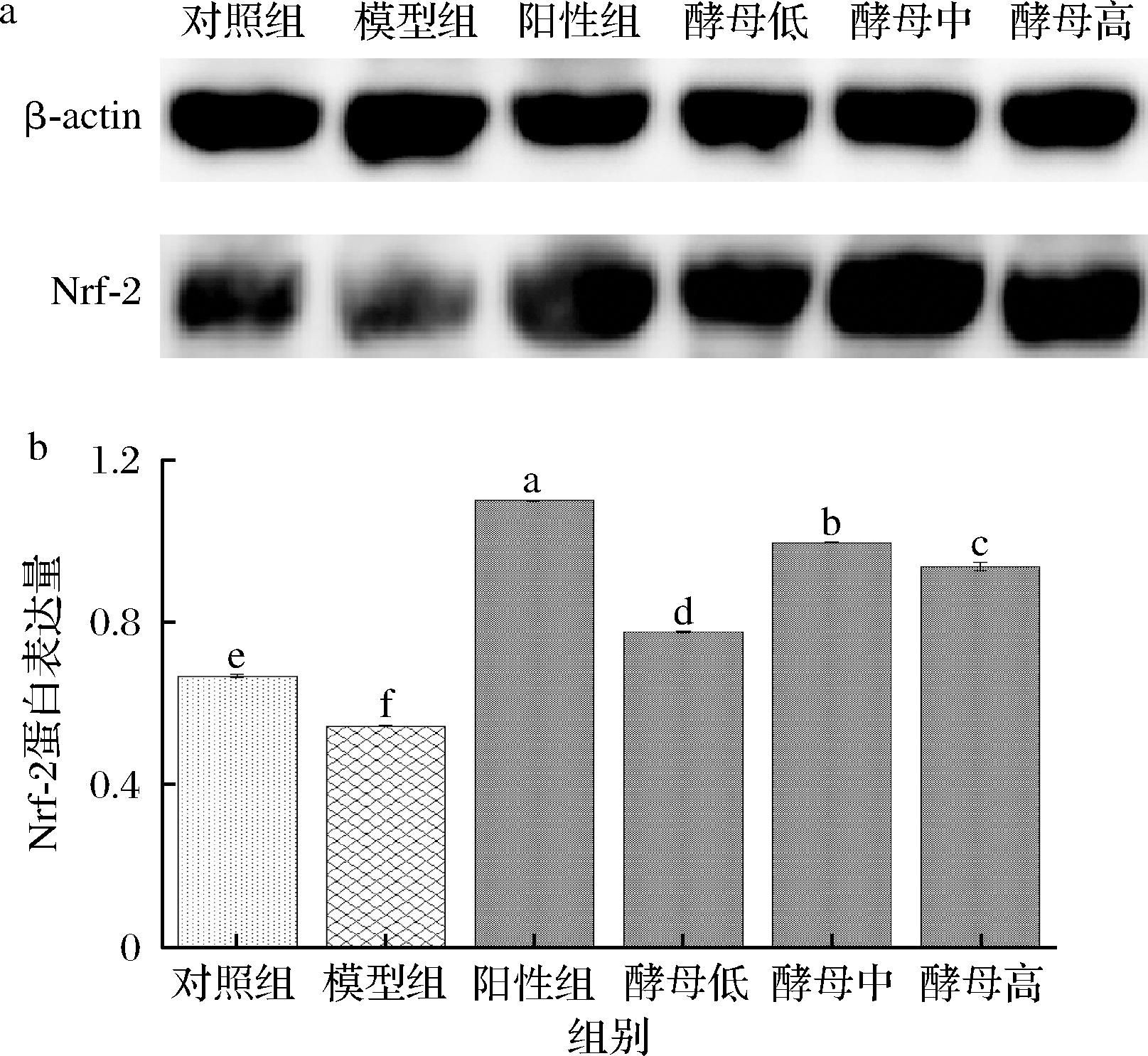
核因子红血球相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)作为细胞感受氧化还原状态的关键转录调控因子,是细胞抗氧化系统中的关键调控蛋白[27],外界的损伤因素能够激活Nrf-2并使之转位进入细胞核,进而启动多种抗氧化酶的转录、增强局部组织的抗氧化能力,有助于减轻外界损伤因素所造成的氧化应激反应程度[28-29]。当机体处于氧化应激状态时,可以通过活化特异的转录调控因子Nrf-2来实现对机体的保护;当机体受到氧化应激刺激时,亲电物质诱导一种肌动蛋白结合蛋白发生构象变化而释放Nrf-2或者通过诱导信号调节通路激活Nrf-2,进而启动编码抗氧化应激蛋白的基因转录来保护机体免受氧化损伤[30]。如图5所示,与空白组相比,模型组Nrf-2蛋白显著降低,阳性组和灌胃不同剂量酵母提取物组的Nrf-2蛋白含量显著提升,其中中剂量的Nrf-2蛋白的含量较高,进一步说明中剂量的酵母提取物在应对氧化应激损伤时,发挥重要的作用,同时也证实酵母提取物可以帮助机体上调Nrf-2蛋白来实现对机体的保护,免受氧化损伤,进一步发挥抗衰老的作用。李萌茹[31]利用黄岑叶提取物调节Nrf-2信号通路来调节相关蛋白的表达,Nrf-2是参与氧化还原反应的敏感转录因子,也是反映细胞发生氧化应激的关键指标之一,参与调节细胞抗氧化防御系统,处于抗氧化应激的中心地位,从Nrf-2信号通路着手进一步探究黄岑叶提取物的抗衰老作用机制。
3 结论
本研究采用D-半乳糖诱导建立皮肤衰老动物模型,以GSH作为阳性对照,利用不同剂量的酵母提取物进行干预后,检测小鼠血液和皮肤组织。HE染色结果表明灌胃酵母提取物的小鼠皮肤组织表皮层增厚情况有明显改善;酵母提取物实验组小鼠抗氧化酶效果有明显提升,血清中的GSH-Px活性和MDA含量随着酵母提取物剂量的增加,抗氧化水平也进一步提高,逐渐趋于空白组水平,在中剂量时可达到阳性组的水平;通过Nrf-2蛋白相对定量可知酵母提取物是通过上调Nrf-2蛋白来减轻衰老所造成的氧化应激反应。综上,食用酵母提取物主要是从减轻抗氧化应激途径进一步实现抗衰老作用,主要是从降低MDA等过氧化物和提升机体GSH-Px酶活性等抗氧化防御系统实现,中剂量(170 mg/kg)酵母提取物具有较好的抗氧化效果。
参考文献
[1] 罗光. 衰老与抗衰老[J].生理科学, 1985, 5(3):138-149.
LUO G.Aging and anti-aging[J].Basic &Clinical Medicine, 1985, 5(3):138-149.
[2] FARAGE M A, MILLER K W, ELSNER P, et al.Characteristics of the aging skin[J].Advances in Wound Care, 2013, 2(1):5-10.
[3] 马兴杰, 欧金磊, 王垚.细胞衰老与抗衰老药物senolytics的研究进展[J].中国细胞生物学学报, 2020, 42(10):1901-1908.
MA X J, OU J L, WANG Y.Current advances in cellular senescence and senolytics[J].Chinese Journal of Cell Biology, 2020, 42(10):1901-1908.
[4] 张腾江. 人类的衰老与抗衰老理论[J].中国医疗美容, 2013, 3(1):32-35.
ZHANG T J.Human aging and anti-aging theory[J].China Medical Cosmetology, 2013, 3(1):32-35.
[5] 陈菊萍, 陶佳, 徐剑丹, 等.皮肤老化与非酶翻译后修饰的相关研究进展[J].皮肤性病诊疗学杂志, 2019, 26(6):378-380.
CHEN J P, TAO J, XU J D, et al.Research progress of skin aging and non enzymatic post-translational modification[J].Journal of Diagnosis and Therapy on Dermato-Venereology, 2019, 26(6):378-380.
[6] BIERHAUS A, HUMPERT P M, MORCOS M, et al.Understanding RAGE, the receptor for advanced glycation end products[J].Journal of Molecular Medicine, 2005, 83(11):876-886.
[7] 张磊. 皮肤与饮食营养关系研究[J].现代商贸工业, 2010, 22(21):139-140.
ZHANG L.Study on the relationship between skin and diet nutrition[J].Modern Business Trade Industry, 2010, 22(21):139-140.
[8] MEKI S, JACOBS L C, HAMER M A, et al.A healthy diet in women is associated with less facial wrinkles in a large Dutch population-based cohort[J].Journal of the American Academy of Dermatology, 2019, 80(5):1358-1363.e2.
S, JACOBS L C, HAMER M A, et al.A healthy diet in women is associated with less facial wrinkles in a large Dutch population-based cohort[J].Journal of the American Academy of Dermatology, 2019, 80(5):1358-1363.e2.
[9] PURBA M B, KOURIS-BLAZOS A, WATTANAPENPAIBOON N, et al.Skin wrinkling:Can food make a difference?[J].Journal of the American College of Nutrition, 2001, 20(1):71-80.
[10] FUKUSHIMA Y, TAKAHASHI Y, HORI Y, et al.Skin photoprotection and consumption of coffee and polyphenols in healthy middle-aged Japanese females[J].International Journal of Dermatology, 2015, 54(4):410-418.
[11] COSGROVE M C, FRANCO O H, GRANGER S P, et al.Dietary nutrient intakes and skin-aging appearance among middle-aged American women[J].The American Journal of Clinical Nutrition, 2007, 86(4):1225-1231.
[12] 赵小敏, 赵云珊, 瞿欣.纯天然酵母提取物的皮肤美白功效[J].日用化学工业, 2011, 41(4):268-271;288.
ZHAO X M, ZHAO Y S, QU X.Whitening efficacy study for yeast extract[J].China Surfactant Detergent &Cosmetics, 2011, 41(4):268-271;288.
[13] GASPAR L R, CAMARGO F B, GIANETI M D, et al.Evaluation of dermatological effects of cosmetic formulations containing Saccharomyces cerevisiae extract and vitamins[J].Food and Chemical Toxicology, 2008, 46(11):3493-3500.
[14] 彭宁, 张海波, 张彦.酵母提取物对多酚氧化酶及黑素瘤细胞的抑制作用[J].香料香精化妆品, 2013(3):24-26.
PENG N, ZHANG H B, ZHANG Y.The inhibition effect of yeast extraction on polyphenol oxidase and melanoma cells[J].Flavour Fragrance Cosmetics, 2013(3):24-26.
[15] 廖峰, 李国光, 熊丽丹, 等.酵母提取物对成纤维细胞的作用及抑制黑素生成的研究[J].日用化学工业, 2016, 46(2):97-100.
LIAO F, LI G G, XIONG L D, et al.Effect of yeast extract on fibroblasts proliferation and melanin inhibition[J].China Surfactant Detergent &Cosmetics, 2016, 46(2):97-100.
[16] PERRICONE C, DE CAROLIS C, PERRICONE R.Glutathione:A key player in autoimmunity[J].Autoimmunity Reviews, 2009, 8(8):697-701.
[17] RIUS M, NIES A T, HUMMEL-EISENBEISS J, et al.Cotransport of reduced glutathione with bile salts by MRP4 (ABCC4) localized to the basolateral hepatocyte membrane[J].Hepatology, 2003, 38(2):374-384.
[18] 何梅, 占美, 柳汝明, 等.还原型谷胱甘肽治疗药物性肝病的系统评价[J].中国药房, 2010, 21(32):3049-3052.
HE M, ZHAN M, LIU R M, et al.Systematic review on reduced glutathione in the treatment of drug-induced liver disease[J].China Pharmacy, 2010, 21(32):3049-3052.
[19] 张成国, 孙国祥, 杨晓, 等.谷胱甘肽抑制氧化应激反应进展[J].科技创新与应用, 2021(11):50-55.
ZHANG C G, SUN G X, YANG X, et al.Progress of glutathione in inhibiting oxidative stress response[J].Technology Innovation and Application, 2021(11):50-55.
[20] WESCHAWALIT S, THONGTHIP S, PHUTRAKOOL P, et al.Glutathione and its antiaging and antimelanogenic effects[J].Clinical, Cosmetic and Investigational Dermatology, 2017, 10:147-153.
[21] ARJINPATHANA N, ASAWANONDA P.Glutathione as an oral whitening agent:A randomized, double-blind, placebo-controlled study[J].The Journal of Dermatological Treatment, 2012, 23(2):97-102.
[22] REAGAN-SHAW S, NIHAL M, AHMAD N.Dose translation from animal to human studies revisited[J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 2008, 22(3):659-661.
[23] LIU X R, WANG Y Y, FAN H R, et al.Preventive effects of β-cryptoxanthin against cadmium-induced oxidative stress in the rat testis[J].Asian Journal of Andrology, 2016, 18(6):920-924.
[24] KAMANLI A, NAZIRO LU M, AYDILEK N, et al.Plasma lipid peroxidation and antioxidant levels in patients with rheumatoid arthritis[J].Cell Biochemistry and Function, 2004, 22(1):53-57.
LU M, AYDILEK N, et al.Plasma lipid peroxidation and antioxidant levels in patients with rheumatoid arthritis[J].Cell Biochemistry and Function, 2004, 22(1):53-57.
[25] 陈珊, 程熠, 刘全.超氧化物歧化酶的生物学效应和在血管性疾病中的作用[J].中国老年学杂志, 2013, 33(4):981-984.
CHEN S, CHENG Y, LIU Q.Biological effects of superoxide dismutase and its role in vascular diseases[J].Chinese Journal of Gerontology, 2013, 33(4):981-984.
[26] 马万超, 罗贵民, 王宗睦, 等.谷胱甘肽过氧化物酶模拟物的合成及其催化机理研究[J].高等学校化学学报, 1993, 14(1):141-143.
MA W C, LUO G M, WANG Z M, et al.Studies on synthesis of glutathione peroxidase mimics and its catalytic mechanism[J].Chemical Research In Chinese Universities, 1993, 14(1):141-143.
[27] 刘远凤, 赵冬婷, 封少龙.人Nrf2蛋白的结构与功能分析[J].实用预防医学, 2021, 28(2):166-170.
LIU Y F, ZHAO D T, FENG S L.Structural and functional analysis of human Nrf2 protein[J].Practical Preventive Medicine, 2021, 28(2):166-170.
[28] KAVIAN N, MEHLAL S, JELJELI M, et al.The Nrf2-antioxidant response element signaling pathway controls fibrosis and autoimmunity in Scleroderma[J].Frontiers in Immunology, 2018, 9:1896.
[29] LU M C, JI J N, JIANG Y L, et al.An inhibitor of the Keap1-Nrf2 protein-protein interaction protects NCM460 colonic cells and alleviates experimental colitis[J].Scientific Reports, 2016, 6:26585.
[30] 乔丽杰, 王延让, 张明.Nrf2/HO-1通路在氧化损伤保护机制中研究进展[J].中国职业医学, 2013, 40(1):82-84.
QIAO L J, WANG Y R, ZHANG M.Research progress of Nrf2/HO-1 pathway in mechanism of oxidative damage and protection[J].China Occupational Medicine, 2013, 40(1):82-84.
[31] 李萌茹. 基于脑组织谷氨酸代谢通路和Nrf2信号通路的黄芩叶抗衰老作用机制研究[D].太原:山西大学, 2021.
LI M R.Study on anti-aging mechanism of Scutellaria baicalensis Georgi leaves based on glutamate metabolism pathway and Nrf2 signal pathway in brain tissue[D].Taiyuan:Shanxi University, 2021.
Edible yeast extract improves antioxidant levels through up regulation of Nrf-2 in skin aging model mice
FU Shaowei1,2, QIN Xiuyuan1,2*, ZHANG Zhuoran1,2, LI Mingliang1,2,FENG Zhiyuan1,2, LUAN Jinling3, REN Wei1,2, CHENG Qian3*
1(China National Research Institute of Foodand Fermentation Industries Co.Ltd., Beijing 100015, China)2(Beijing Engineering Research Center of Protein and Functional Peptides, Beijing 100015, China)3(Hubei Key Laboratory of Yeast Function, Yichang Engineering Technology Research Center of Nutrition and Health Food, Yichang 443003, China)
ABSTRACT Yeast extract is a natural and safe active substance that is widely used as an antioxidant in the food industry. To investigate the efficacy effect of edible yeast extract on anti-aging of skin.In this study, D-galactose was used to induce the construction of an animal model of skin aging, and different doses of yeast extract were used to intervene.Male ICR mice were randomly divided into control group (Control), model group (Model), positive group (GSH), low-dose group of yeast extract (LYE), medium-dose group of yeast extract (MYE), and high-dose group of yeast extract (HYE).Twelve animals in each group were treated for 70 consecutive days and weighed weekly.After the final gavage, the mice were fasted for 12 hours and weighed, followed by orbital blood sampling for oxidative stress indexes, and skin tissues were collected for morphological observation of skin tissues, and the expression of Nrf-2 protein in skin tissues was detected by immunoprotein blotting.The thickening of the epidermal layer of the skin tissue of mice in the experimental group of yeast extract showed significant improvement, and the serum GSH-Px enzyme activity and MDA content further increased with the increase of yeast extract dose, and the antioxidant level gradually converged to the level of the blank group, and attenuated the oxidative stress response caused by aging through up-regulation of Nrf-2 protein.This study concluded that the consumption of yeast extracts furthered the anti-aging effect mainly from the alleviation of antioxidant stress pathway, and also derived the optimal dosage with improved effects.
Key words yeast extract;anti-aging;antioxidant;Nrf-2


 S, JACOBS L C, HAMER M A, et al.A healthy diet in women is associated with less facial wrinkles in a large Dutch population-based cohort[J].Journal of the American Academy of Dermatology, 2019, 80(5):1358-1363.e2.
S, JACOBS L C, HAMER M A, et al.A healthy diet in women is associated with less facial wrinkles in a large Dutch population-based cohort[J].Journal of the American Academy of Dermatology, 2019, 80(5):1358-1363.e2. LU M, AYDILEK N, et al.Plasma lipid peroxidation and antioxidant levels in patients with rheumatoid arthritis[J].Cell Biochemistry and Function, 2004, 22(1):53-57.
LU M, AYDILEK N, et al.Plasma lipid peroxidation and antioxidant levels in patients with rheumatoid arthritis[J].Cell Biochemistry and Function, 2004, 22(1):53-57.