果胶是自然界中资源丰富的天然大分子物质,广泛存在于高等植物细胞壁中,是生物界中最复杂的大分子之一[1]。同时果胶作为一类复杂的大分子多糖,其结构一般由三部分组成,一是半乳糖醛酸(galacturonic acid, Gal A)以α-1,4糖苷键连接的直链多糖聚半乳糖醛酸区(homogalacturonan region, HG区);二是半乳糖醛酸与L-鼠李糖交替连接构成主链,再与由D-半乳糖、L-阿拉伯糖构成的支链共同组成鼠李糖半乳糖醛酸Ⅰ区(rhamnogalacturonan Ⅰregion, RGⅠ区);三是半乳糖醛酸以α-1,4 糖苷键连接的主链,和多种中性糖为支链组成鼠李糖半乳糖醛 Ⅱ 区(rhamnogalacturonan Ⅱregion, RGⅡ区)[2]。果胶可以在多种植物中提取,我国丰富的农作物也提供了丰富的果胶资源,现今我国的商业果胶主要来源于苹果皮渣、柑橘皮渣和甜菜浆[3]。随着食品加工种类多样化的发展,其他种类的副产品也可用于提取果胶,如菠萝皮渣果胶[4]、西瓜皮果胶[5]、芒果皮果胶[6]、马铃薯渣[7]和百香果皮[8]等。然而这些主要集中在实验室研究阶段,并没有投入工业生产,同时国内外豆腐柴果胶的研究较少,并且对其果胶多糖性质的研究没有深入。
豆腐柴,又称豆腐叶、臭黄荆、观音柴、腐婢等[9],是马鞭草科豆腐柴属的药食两用植物,属于多年生的落叶灌木。广泛分布于中国东部、中部和南部的山区,野生资源丰富,但对于其开发有限,经济价值未得到良好利用[10]。豆腐柴的嫩叶和枝条可以制作凝胶冻,又称“神仙豆腐”,说明豆腐柴中果胶含量丰富,并具备良好的果胶特性。
乳化技术是食品生产加工的关键技术之一,其原理是利用乳化剂降低界面张力来让两种互不相溶的液体(食品生产中大部分都为水和油)均一混合[11],形成水包油型或油包水型乳液,食品中典型的乳液体系有蛋黄酱、冰淇淋、人造奶油及软饮料等[12]。在食品工业生产中,乳化剂一般分为两种,一种是小分子表面活化剂,如蔗糖酯、卵磷脂、甘油酯和聚山梨醇酯等,另一种是大分子物质,常用的如蛋白质和一些多糖[13]。
而乳化剂因为其种类的不同,乳化能力与乳液性质都不尽相同,其中蛋白质和卵磷脂具备良好的乳化能力,制备的乳液粒径较小,但是受到酸碱和温度变化的影响较大,缺乏稳定性[14-15]。而果胶作为一种酸性阴离子多糖,不仅具有良好的乳化能力,还能形成比较稳定的乳液[16-17],目前用于乳化剂商用的果胶主要为柑橘果胶和苹果果胶,而一些研究又表明柑橘果胶的乳化特性优于苹果果胶[18],因此本研究选取柑橘果胶与豆腐柴果胶进行理化性质和乳化特性对比研究。
豆腐柴叶为重庆雄森实业有限公司提供。商品柑橘果胶,河南万邦实业有限公司;玉米油,金龙鱼非转基因玉米胚芽油;其他试剂无特殊说明均为国产分析纯。
KQ-300B超声清洗仪,昆山超声仪器有限公司;UV-2450紫外-可见光分光光度计,日本岛津公司;ALPH1-2/LD-Plus冷冻干燥机,德国CHRIST公司;Imark酶标仪,BIO-RAD公司;荧光倒置显微镜,日本Olympus公司。
1.3.1 豆腐柴果胶的提取
本文选取豆腐柴叶于60 ℃下烘干至恒重,粉碎机粉碎后过60目筛备用,称取豆腐柴粉末10 g,按料液比(1∶24,g∶mL)投入到pH=6柠檬酸缓冲溶液中,搅拌均匀后进行超声(强度300 Hz,时间70 min,温度90 ℃[19]),将超声完的混合物过滤,放入离心机以5 000 r/min离心15 min,取上清液通过旋转蒸发仪浓缩,浓缩后加入3倍体积的无水乙醇,4 ℃下静置过夜,取其沉淀,用无水乙醇洗涤2次,冷冻干燥后得到粗果胶。
1.3.2 豆腐柴果胶多糖的纯化
将豆腐柴粗果胶溶于蒸馏水,采用Sevag法除去豆腐柴粗果胶中的蛋白质等杂质,然后再用无水乙醇沉淀豆腐柴果胶并冷冻干燥。将去除蛋白质后的果胶配制成溶液后采用截留分子质量为8 000~14 000 Da的透析袋进行除盐,取其袋内物质配制一定浓度溶液进行紫外全光谱扫描,检验蛋白质和小分子杂质去除效率,冷冻干燥收集得到果胶样品,配制成10 mg/mL的溶液,过0.45 μm的滤膜后,用DEAE-52纤维素柱阴离子交换对豆腐柴果胶进行纯化,采用去离子水进行洗脱,流速为1 mL/min,每10 min收集1管。利用苯酚硫酸法在490 nm处测定洗脱液的多糖含量,合并高峰部分,浓缩、冷冻干燥得豆腐柴果胶多糖纯品[20]。
1.3.3 果胶多糖乳液制备
称量不同质量的豆腐柴果胶多糖和柑橘果胶,加入0.2 mg/mL叠氮钠去离子水,配制一定质量浓度(4、8、12、16、20 g/L)的果胶溶液,调节溶液pH值为3、5、7备用。然后将果胶溶液与玉米油按照油相不同体积分数(10%、20%、30%、40%、50%)混合。使用超声波细胞粉碎机进行均质(超声强度15 kHz,超声时间4 min,持续时间4 s,间隔时间4 s,强度30%,保护温度50 ℃)得到新鲜乳液[21],研究果胶质量浓度、pH值和油相体积分数对果胶乳化特性的影响。
1.3.4 果胶理化性质分析
1.3.4.1 果胶干燥减量测定
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》,取洁净玻璃称量瓶,干燥恒重后将果胶样品2~10 g置于称量瓶中,精密称量后置于101~105 ℃干燥箱中,干燥2~4 h后取出,干燥器中冷却0.5 h,精密称量后再重复干燥1 h直至两次称量后质量差<2 mg,即为达到恒重。按公式(1)计算干燥减量。
干燥减量![]()
(1)
式中:m1为称量瓶和样品质量,g;m2为干燥后称量瓶和样品质量,g;m3为称量瓶的质量,g。
1.3.4.2 果胶酸不溶灰分测定
参照GB 25533—2010《食品安全国家标准 食品添加剂 果胶》,称取果胶样品1~4 g,用小火缓慢加热至完全炭化,置于高温炉,于550~650 ℃下灼烧至恒重。将灼烧渣移入烧杯后加入20 mL HCl溶液,煮沸5 min,用恒重的砂芯漏斗过滤,再用热水洗涤至滤出物不含Cl-后在干燥箱中干燥至恒重。酸不溶灰分的含量按公式(2)计算。
(2)
式中:X1为酸不溶灰分,%,m1为试样的质量,g;m2为漏斗的质量,g;m3为漏斗加酸不溶灰分的质量,g。
1.3.4.3 果胶半乳糖醛酸含量测定
参照GB 25533—2010《食品安全国家标准 食品添加剂 果胶》,精确称取果胶样品5 g,加入100 mL HCl-乙醇溶液,搅拌10 min。用干燥至恒重(m0)的砂芯漏斗过滤,真空抽吸滤干后用HCl-乙醇溶液洗涤6次,再用乙醇冲洗至滤出物不含Cl-,最后用无水乙醇冲洗滤干,在105 ℃下干燥2 h,冷却后称重(m1)。
准确称取1/10干燥后样品,移入锥形瓶加入2 mL无水乙醇润湿,加入100 mL新煮沸并冷却的水,使试样完全溶解,加入5滴酚酞指示剂,用0.1 mol/L NaOH标准溶液滴定,滴定至粉红色30 s不褪色为终点,记录滴定消耗体积V1,加入20 mL 0.5 mol/L NaOH溶液,用力振摇后静置15 min,加入20.0 mL 0.5 mol/L HCl标准滴定溶液,振摇至粉红色消失,然后用0.1 mol/L NaOH标准滴定溶液滴定,用力振摇至弱粉红色30 s不褪色为终点,记录下所消耗的NaOH标准滴定溶液的体积V2(皂化滴定度)。半乳糖醛酸含量按公式(3)计算。
(3)
式中:X2为半乳糖醛酸含量,%,m为试样干燥并去灰分后的总质量的1/10,即(m1-m0)/10,mg。
1.3.4.4 果胶酯化度(degree of esterification,DE)的测定
取0.01 g样品,加入0.1 g NaCl,10 mL水,室温下搅拌1 h,加入两滴酚酞试剂,用0.1 mol/L的NaOH溶液滴定至溶液颜色变成粉红色且30 s不变色,即达终点,记录下使用的NaOH体积V1。随后向溶液中加入15 mL 0.25 mol/L NaOH,室温下搅拌30 min,加入15 mL 0.25 mol/L HCl溶液,充分混匀,再次用0.1 mol/L的NaOH溶液滴定至终点,记录下使用的NaOH体积V2。通过公式(4)计算得到酯化度。
(4)
1.3.5 果胶乳液乳化性质分析
1.3.5.1 果胶质量浓度对果胶乳液乳化性质的影响
取1.3.3节中配制的不同浓度果胶溶液在油相20%和pH 5.0条件下制备乳液。果胶的乳化活性(emulsifying activity,EA)与乳化稳定性(emulsion stability,ES)参照LIANG等[22]的方法并进行改进。将新制备的乳化液在3 000 r/min下离心5 min,EA为乳化层高度(HE1)与总液体高度(HW1)的比值,用公式(5)计算。
(5)
测定ES时,先将新制备的乳液在80 ℃下水浴加热30 min,然后在水中冷却15 min,再以3 000 r/min 离心5 min,ES为乳化层高度(HE2)与总液体高度(HW2)的比值,用公式(6)计算。
(6)
乳化液的乳析指数(creaming index,CI)测定参照AHSAN等[23]的方法改进后,取固定体积法新鲜制备的乳化液置于带刻度的试管中,盖上塞子后,在室温下贮藏。一段时间后乳化液出现分层现象,上层不透明的为乳脂层,下层透明为乳清层。乳化液总高度(Hw3),下层乳清层高度(HE3)。CI用公式(7)计算。
(7)
1.3.5.2 pH对果胶乳液乳化性质的影响
乳液制备条件为果胶质量浓度12 g/L,油相体积分数20%,并在加入玉米油之前调节pH值为3.0、5.0、7.0。乳化性质测定参照1.3.5.1节。
1.3.5.3 油相体积分数对果胶乳液乳化性质的影响
乳液制备条件为果胶质量浓度12 g/L,pH 5.0,油相体积分数分别为10%、20%、30%、40%和50%。乳化性质测定参照1.3.5.1节。
1.3.5.4 乳化液显微观察
乳液显微结构用倒置荧光显微镜进行观察测定,检测样品采用压片法制片,吸取10 μL新鲜乳液于干净载玻片上,盖玻片置于其上,放大倍数200×,用仪器配备的DP2-BSW采集样品图像。
除特殊说明外,所有实验数据均进行3组平行试验,测定2次以上。用Origin 2019b作图,Excel 2019计算数据,SPSS Statistics 26进行数据分析。
从表1中可以看出豆腐柴果胶多糖的色泽与组织状态均符合国标要求,酸不溶灰分明显低于商用柑橘果胶,实验所得豆腐柴果胶多糖纯度较好。其半乳糖醛酸含量为71.35%,高于65%,达到了商用果胶的要求。
表1 豆腐柴果胶多糖理化性质
Table 1 Physicochemical properties of pectin polysaccharide from Premna microphylla Turcz
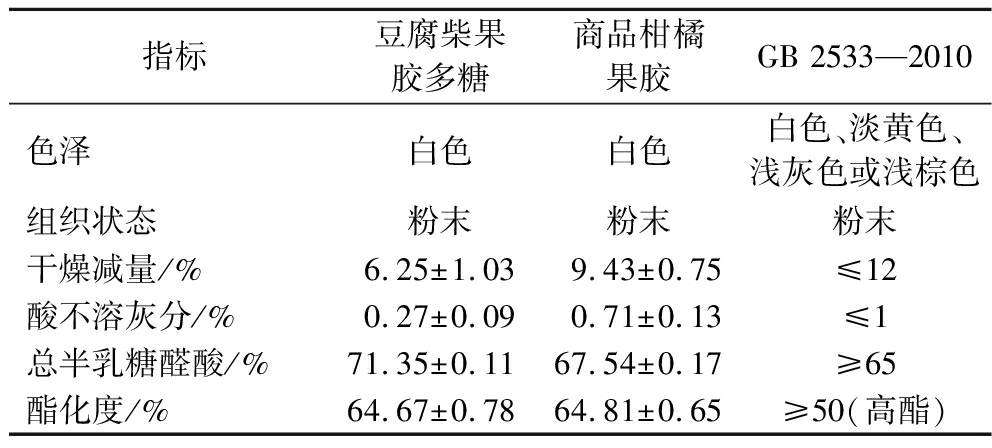
指标豆腐柴果胶多糖商品柑橘果胶GB 2533—2010色泽白色白色白色、淡黄色、浅灰色或浅棕色组织状态粉末粉末粉末干燥减量/%6.25±1.039.43±0.75≤12酸不溶灰分/%0.27±0.090.71±0.13≤1总半乳糖醛酸/%71.35±0.1167.54±0.17≥65酯化度/%64.67±0.7864.81±0.65≥50(高酯)
果胶酯化度是评价果胶性能的一项重要指标,也是影响果胶的凝胶速度和凝胶时间是重要因素。豆腐柴果胶多糖和商品柑橘果胶酯化度分别为64.67%和64.81%,两者较为接近,均属于高酯果胶。高酯果胶具有比低酯果胶更好的凝胶性能[24-25],为豆腐柴果胶多糖凝胶性能的研究提供基础。
由图1可知,油相体积在20%时EA较低,豆腐柴果胶多糖质量浓度为4~16 g/L时,EA由18.16%提高到45.43%,组间差异极显著,在16~20 g/L时,差异显著,乳化上升变慢可能是因为油相体积分数不足,难以有更多的油滴与果胶多糖分子结合,因此上升速度下降。商品柑橘果胶乳液则由10.17%提高到40.67%,组间差异极显著。豆腐柴果胶多糖浓度较低时,增加浓度可以更显著提高乳化液的EA,这可能是随着果胶浓度升高,降低界面张力并促进形成乳化颗粒与油滴分子结合,从而提高EA[26]。对比两种果胶可以看出,在质量浓度为4~20 g/L时,豆腐柴果胶多糖的乳化活性均优于柑橘果胶。
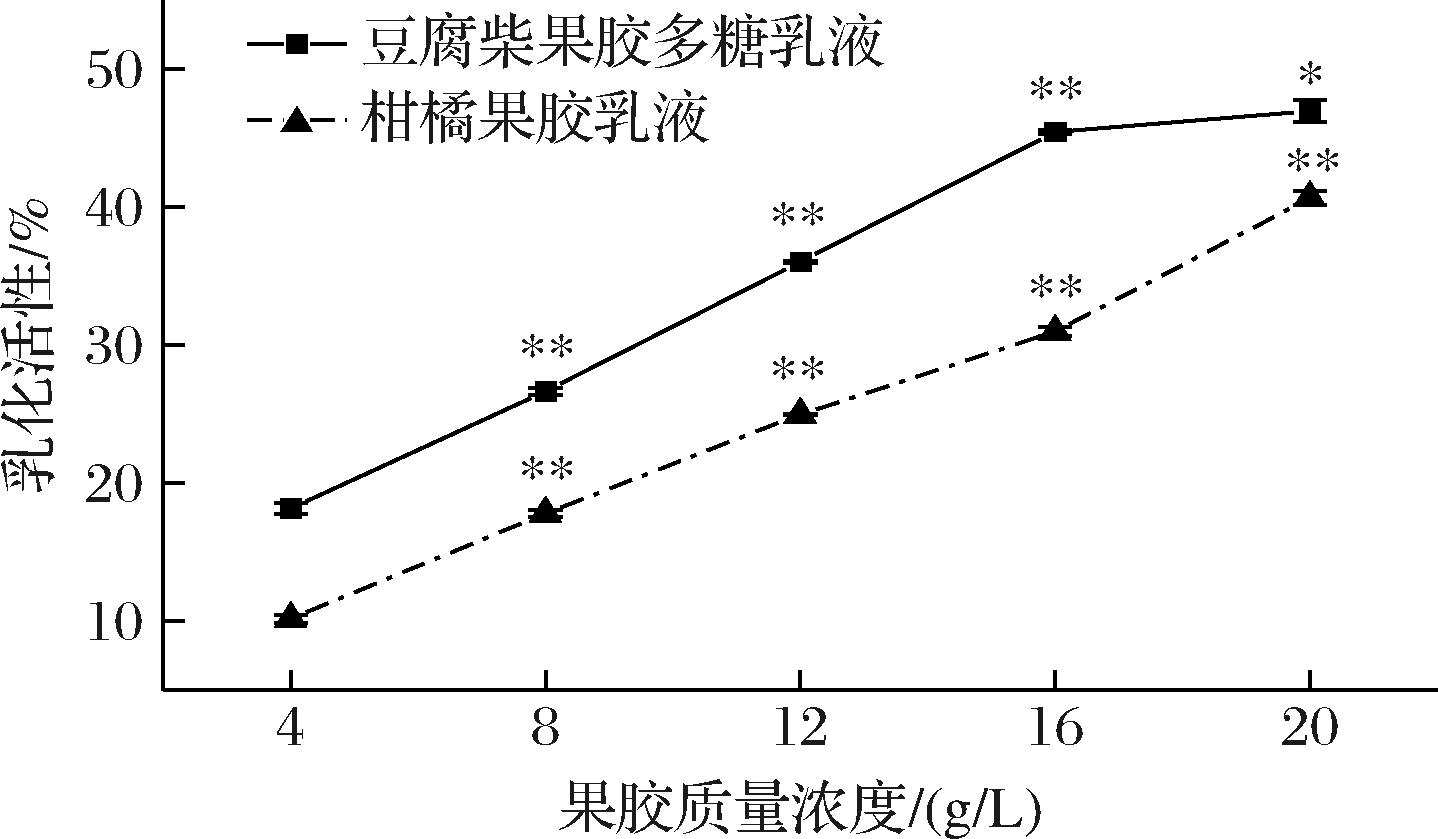
图1 果胶质量浓度对乳液乳化活性的影响
Fig.1 Influence of pectin concentration on emulsion emulsification activity
注:单因素方差分析和 Tukey 检验组间差异,*代表显著,**代表极显著(下同)。
乳液的ES与果胶质量浓度的关系如图2所示,豆腐柴果胶多糖配制的乳液在果胶多糖质量浓度为40 g/L时乳液体系直接被破坏,这可能是因为乳化颗粒的表面覆盖率低,油滴发生聚集破坏乳液乳化效果[27],在果胶浓度提高时,两种乳液ES均表现为极显著的上升。质量浓度大于8 g/L后,豆腐柴果胶多糖ES高于同水平下的柑橘果胶。
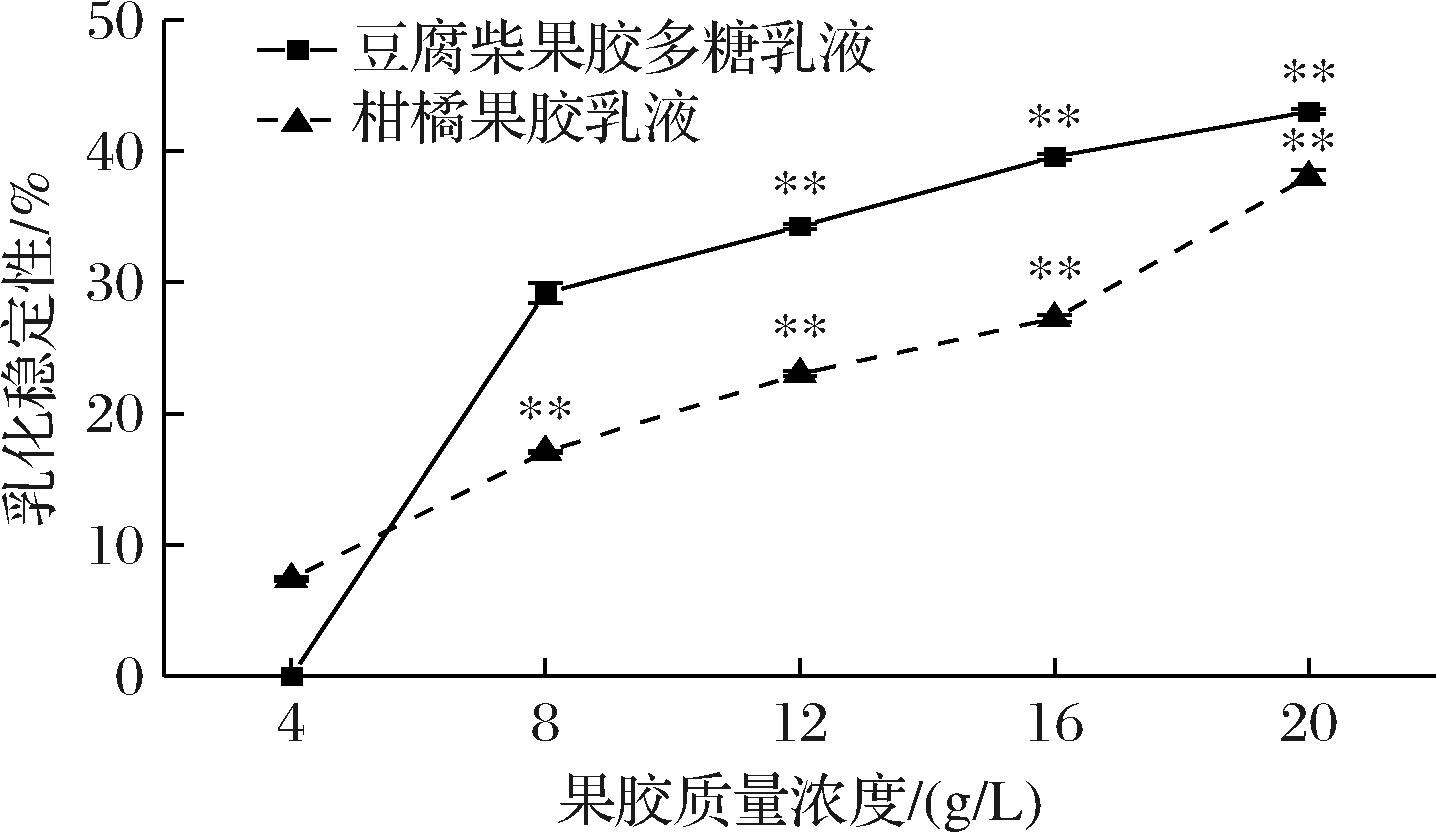
图2 果胶质量浓度对乳液乳化稳定性的影响
Fig.2 Influence of pectin concentration on emulsion stability
CI值可以表征乳化液中的乳滴聚集情况,CI值越大,乳析速度越快,乳化液越不稳定,也可以表明乳化液粒径越大。由图3可知,豆腐柴果胶多糖和商品柑橘果胶乳化液放置1 d后的CI分别为74.37%~70.13%和77.50%~73.77%,油相体积为20%时,乳化液稳定性较差,随着质量浓度的提高,CI不断降低,这可能是因为浓度的增加加大了液滴间的排斥力以及乳化液的黏度,从而降低乳滴聚集速度[28]。豆腐柴果胶多糖质量浓度对于乳化液的CI并无显著性影响,贮存1 d后与7 d后CI发生显著性变化。同等条件下,豆腐柴果胶多糖乳液的乳析稳定性高于柑橘果胶乳液。

图3 果胶质量浓度对乳液乳析指数的影响
Fig.3 Effect of pectin mass concentration on emulsion chromatography index
注:图中不同小写字母代表乳析指数的差异显著(P<0.05)(下同)。
不同质量浓度乳液的显微观察图如图4所示,图4-a~图4-c和图4-f~图4-h中存在较大乳滴,大小不一,说明乳液稳定性较差,图4-d、图4-e和图4-i、图4-j中大乳滴的数量明显下降,且分布更均匀[29],而乳化液的CI也表明质量浓度更高的乳液稳定性更好。相比于柑橘果胶乳液,豆腐柴果胶多糖的乳滴粒径更小,均一性更强,表明豆腐柴果胶多糖乳化特性优于柑橘果胶。
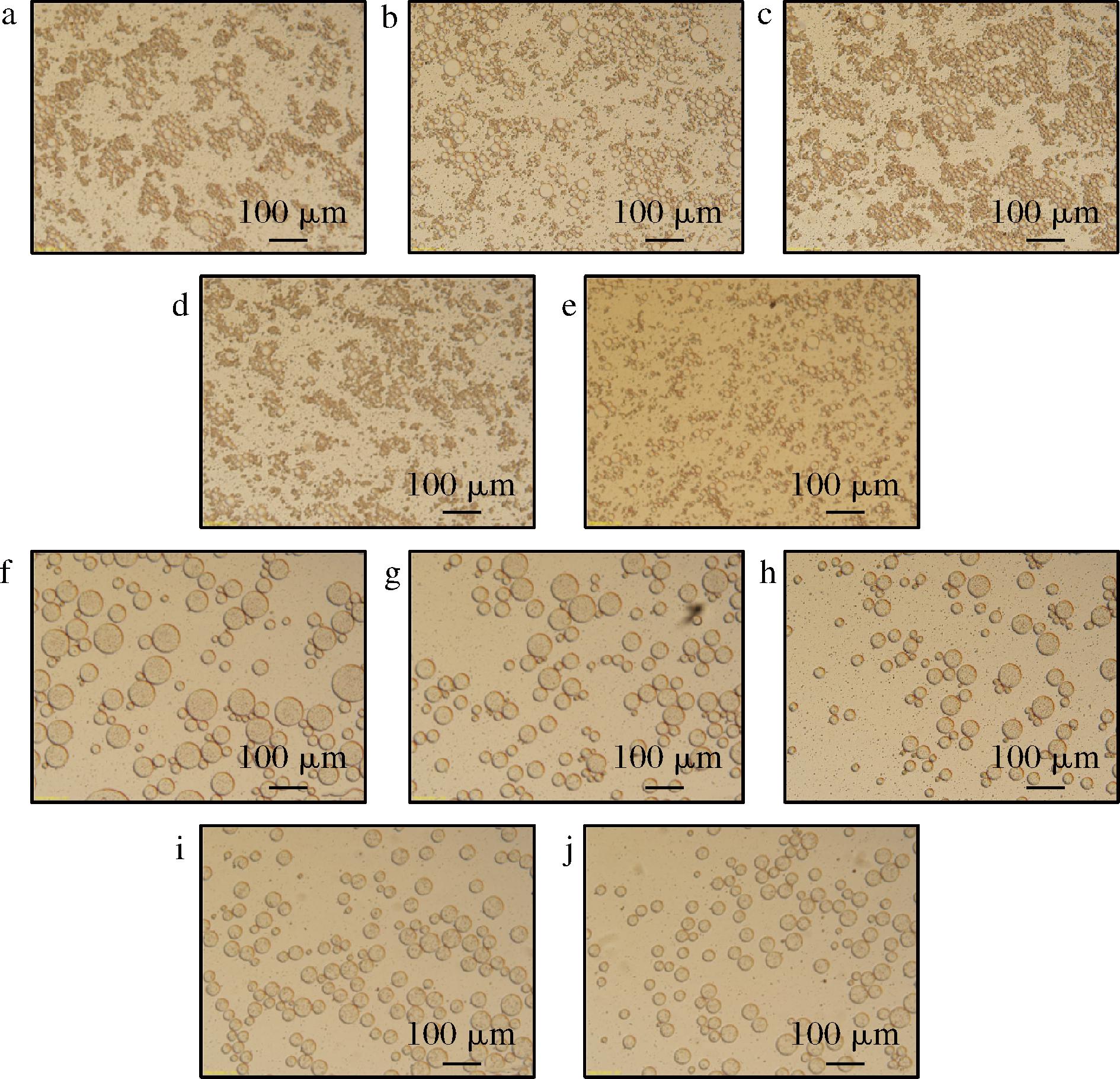
a~e-豆腐柴果胶多糖乳液;f~j-柑橘果胶乳液
图4 不同质量浓度的豆腐柴果胶多糖乳液、柑橘果胶乳液显微结构图
Fig.4 Microstructure of P. microphylla Turcz pectin polysaccharide emulsion and citrus pectin emulsion with different mass concentrations
不同pH下对乳化液EA的影响见图5,pH值由3增加到5时,豆腐柴果胶多糖乳液和商品柑橘果胶乳液的的EA均为先增高后降低,在pH 5时具有最高EA,分别为36.50%和24.56%,且豆腐柴果胶多糖乳化液的EA在pH 改变时差异不显著。两种不同果胶乳化液之间的EA差异显著,豆腐柴果胶多糖乳化液EA高于柑橘果胶。
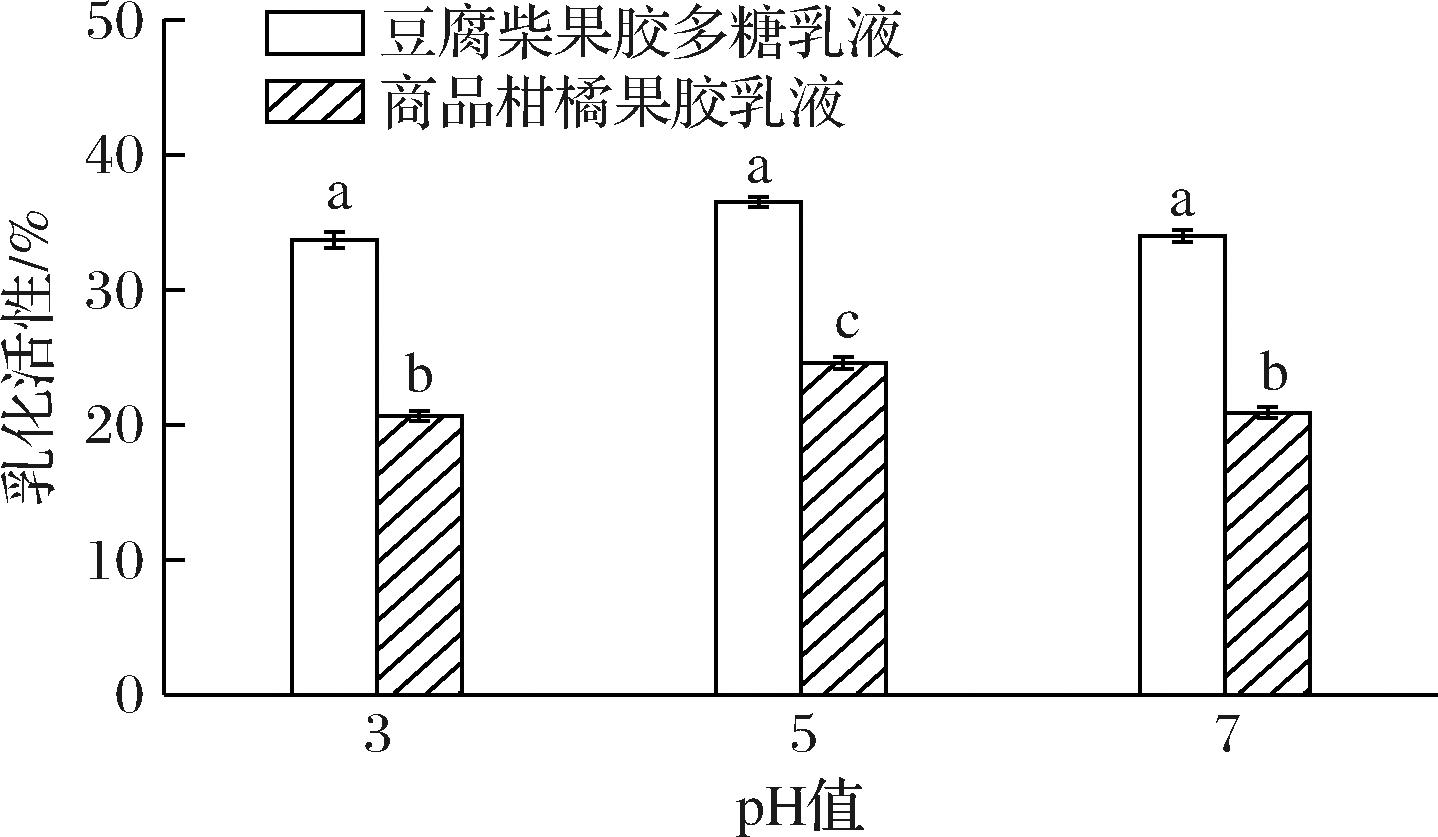
图5 pH对乳液乳化活性的影响
Fig.5 Effect of pH on emulsion activity
不同pH下对乳化液ES的影响见图6,pH值由3增加到5时,豆腐柴果胶多糖乳液和商品柑橘果胶乳液的ES均为先增高后降低,在pH 5时具有最高ES,分别为33.49%和22.76%,pH 7时ES最低,为26.02%和19.46%。豆腐柴果胶多糖ES在pH改变时有显著性差异变化,这可能是因为豆腐柴果胶果糖分子中的羧基会在酸性条件下释放H+,使果胶分子带上负电荷,使得其吸附油滴的能力改变,且在pH 5时,吸附效果最好。
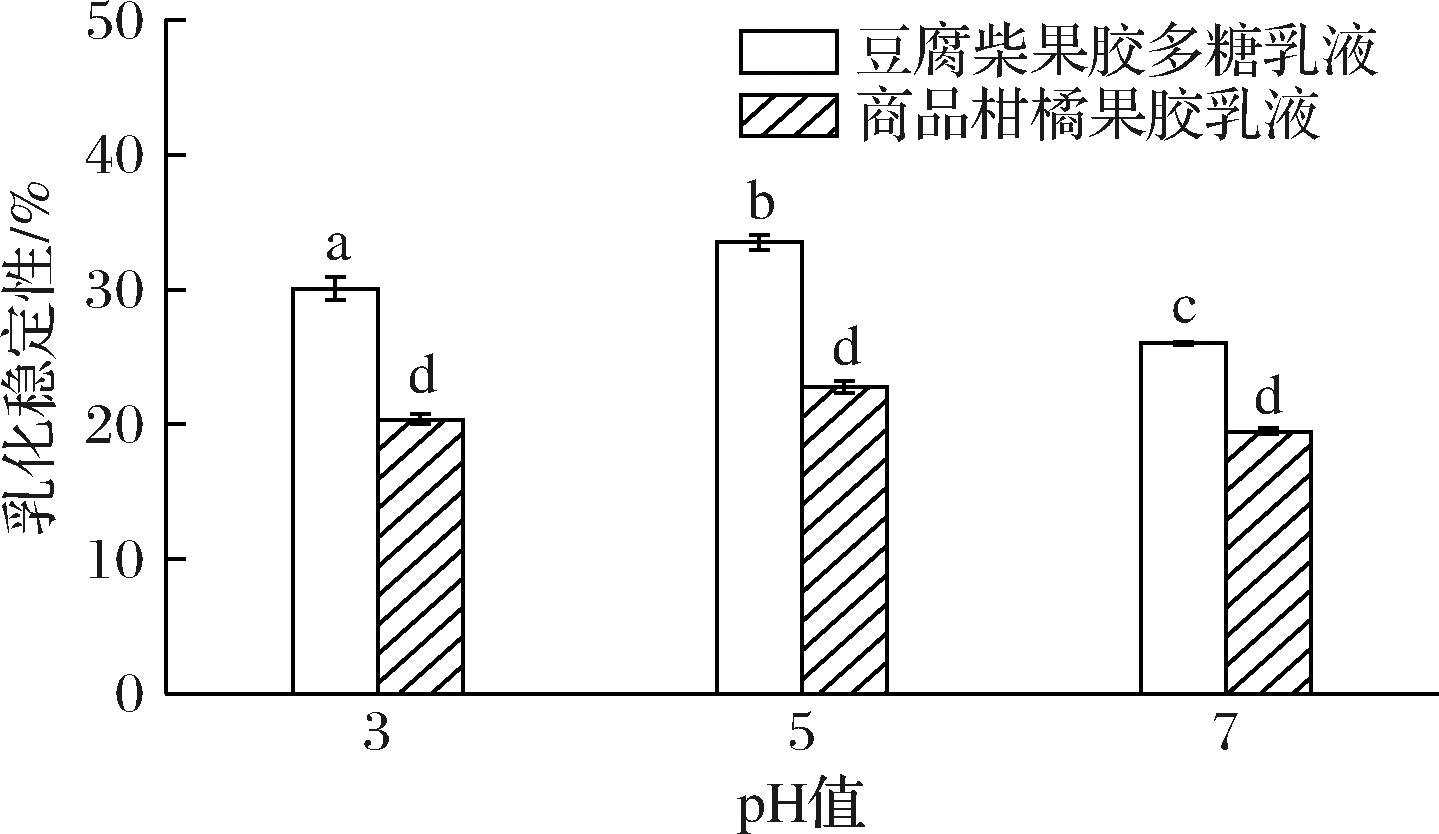
图6 pH对乳液乳化稳定性的影响
Fig.6 Influence of pH on emulsion stability
图7是不同pH值乳化液的CI,贮存1 d后的乳液出现明显的乳析现象,pH 5时CI最小,豆腐柴果胶多糖和柑橘果胶乳液分别为71.69%和74.56%,pH 7时CI最大,为73.13%和76.35%。贮存7 d后与贮存1 d时的CI差异显著,不同果胶的乳化液CI差异显著,豆腐柴果胶多糖乳液的乳析稳定性强于柑橘果胶乳化液。
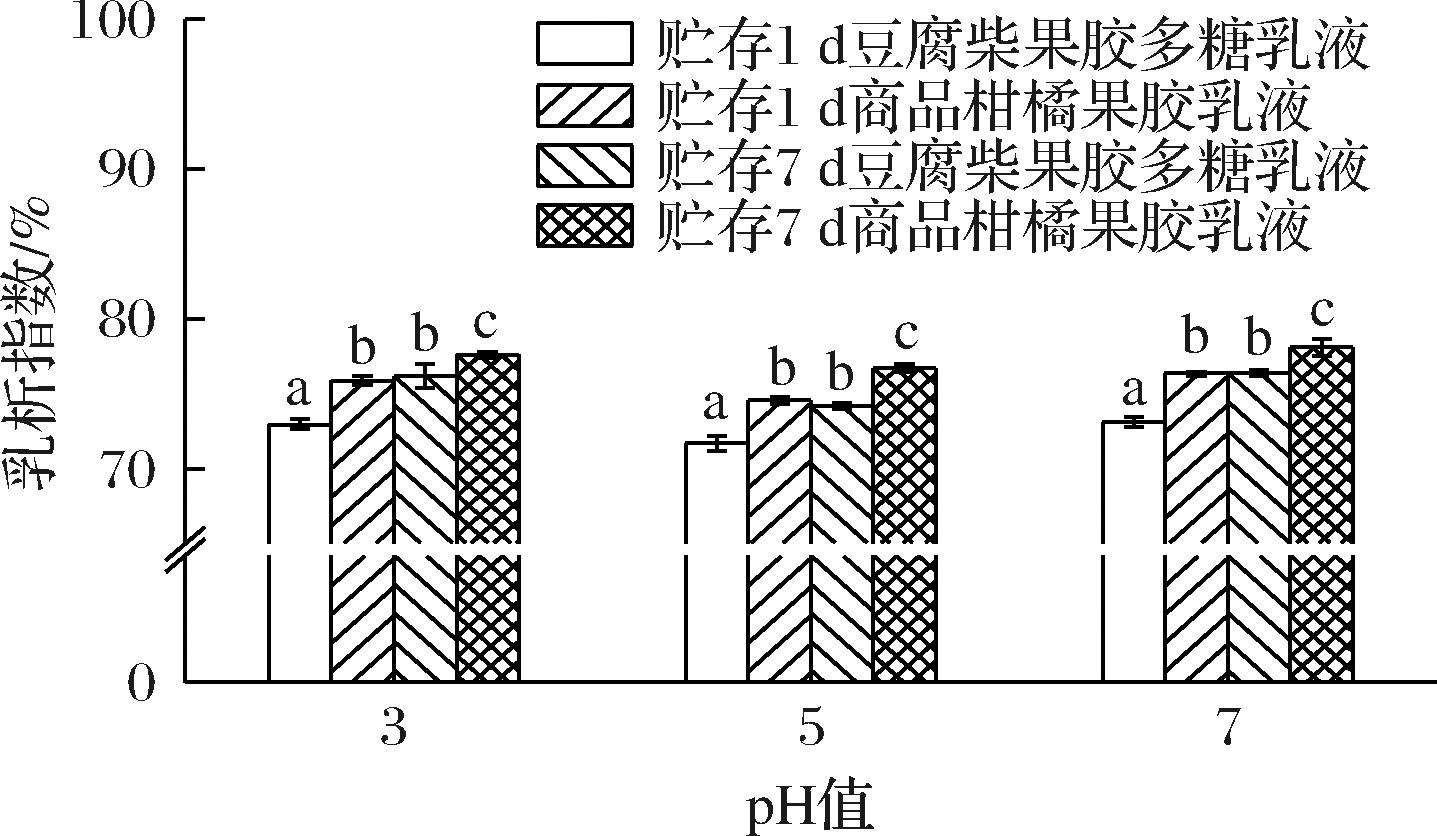
图7 pH对乳液乳析指数的影响
Fig.7 Influence of pH on emulsion chromatography index
不同pH下的乳液显微观察图见图8,pH对乳液粒径和均一性影响较小,豆腐柴果胶多糖乳液的均一性优于柑橘果胶乳液,pH 5时乳液乳化性更好,豆腐柴果胶多糖乳化特性优于柑橘果胶。

a~c-豆腐柴果胶多糖乳液;d~f-柑橘果胶乳液
图8 不同pH下豆腐柴果胶多糖乳液,柑橘果胶乳液显微结构图
Fig.8 Microstructure of P. microphylla Turcz pectin polysaccharide emulsion and citrus pectin emulsion with different pH values
注:由左至右分别为pH 3、5、7。
图9为不同油相体积分数乳化液的EA结果,在10%油相体积分数时,豆腐柴果胶多糖和柑橘果胶乳液的EA仅为11.1%和13.4%,而油相体积分数为50%时,EA上升到57.7%和48.6%。这说明改变油相体积分数会极显著影响乳液的EA。
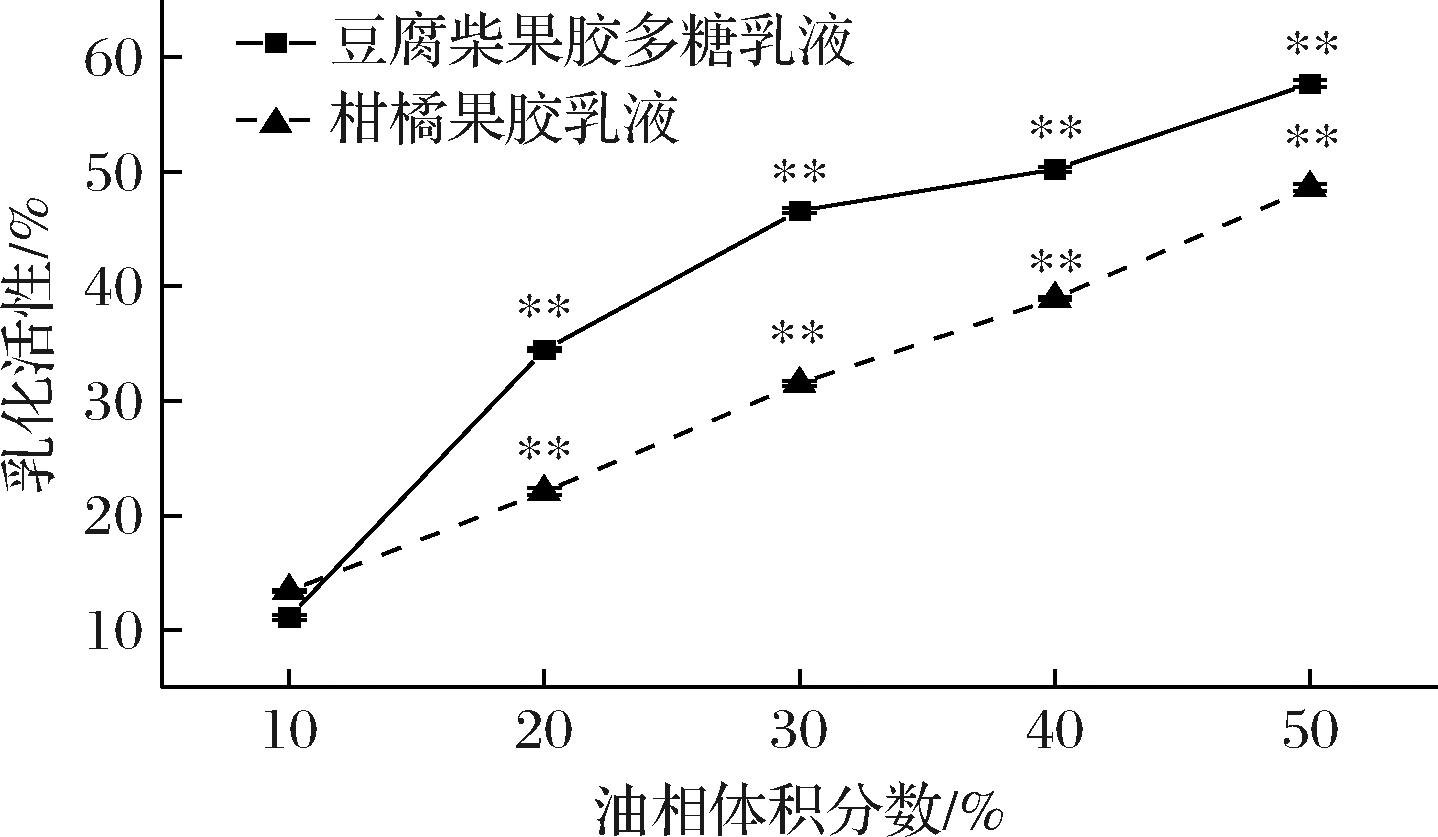
图9 油相体积分数对乳液乳化活性的影响
Fig.9 Influence of oil phase volume fraction on emulsion emulsification activity
图10为不同油相体积乳化液的ES结果,在油相体积为10%时,两种乳液的ES均为最低,分别为9.07%和13.64%,在50%油相体积分数时,乳化液的ES也为最高,油相体积分数会极显著的影响乳化稳定性。
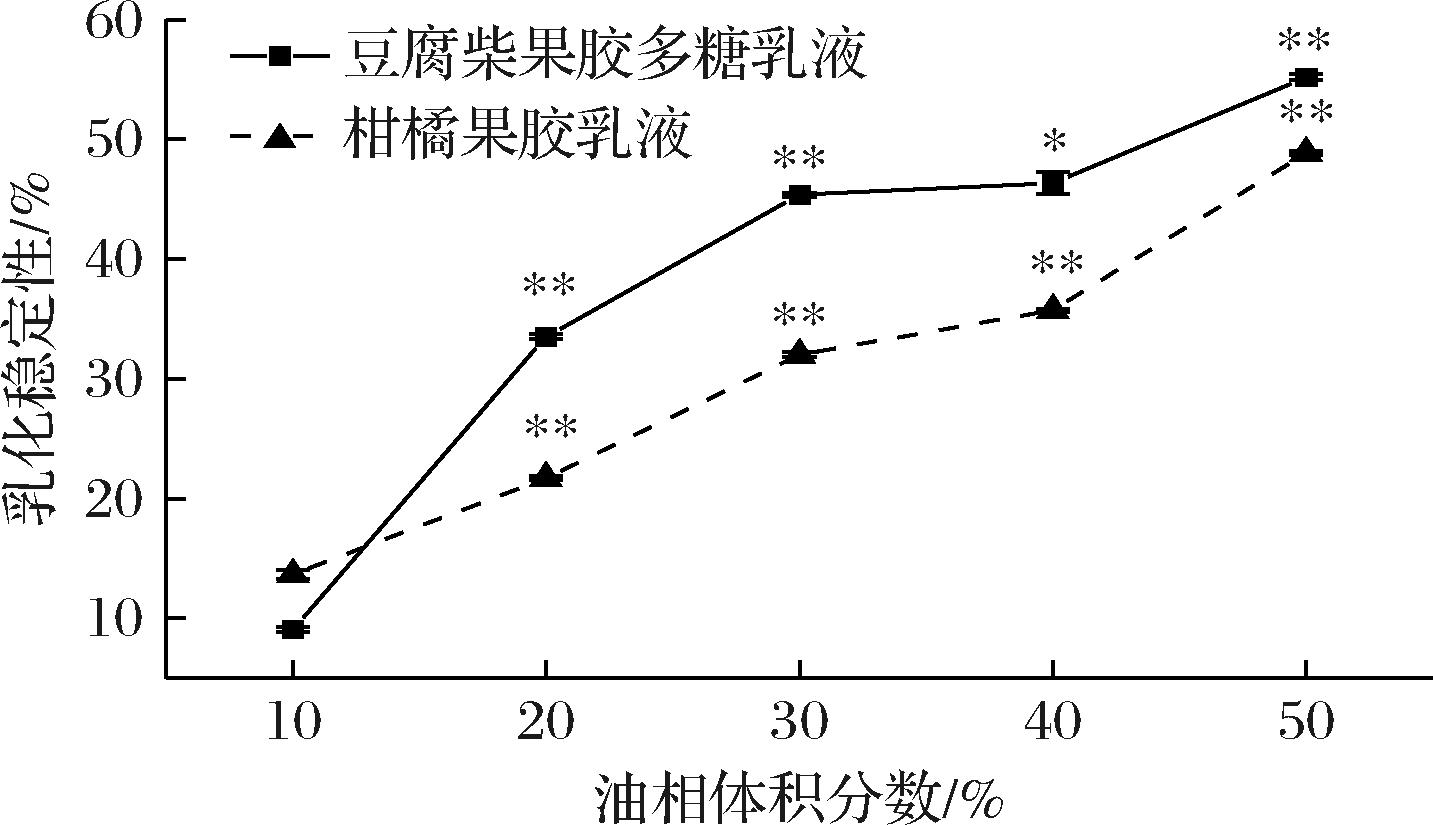
图10 油相体积分数对乳液乳化稳定性的影响
Fig.10 Influence of oil phase volume fraction on emulsion stability
图11为不同油相体积分数下的乳化液CI变化,可以看出在油相体积分数上升时乳液CI显著下降,10%油相体积分数时两种果胶的CI相近,超过30%时未出现乳析现象,这可能是由于高体积分数的油相会加大乳液体系的黏度,阻碍分子间的自由运动,减缓乳滴的聚集情况,从而提高乳析稳定性[30],表明油相体积分数对乳析指数具有显著影响。同时7 d后的CI也明显下降,说明较高油相体积分数的乳液体系具备更好的乳析稳定性,且豆腐柴果胶多糖的乳液体系的乳析稳定性高于柑橘果胶乳液体系。
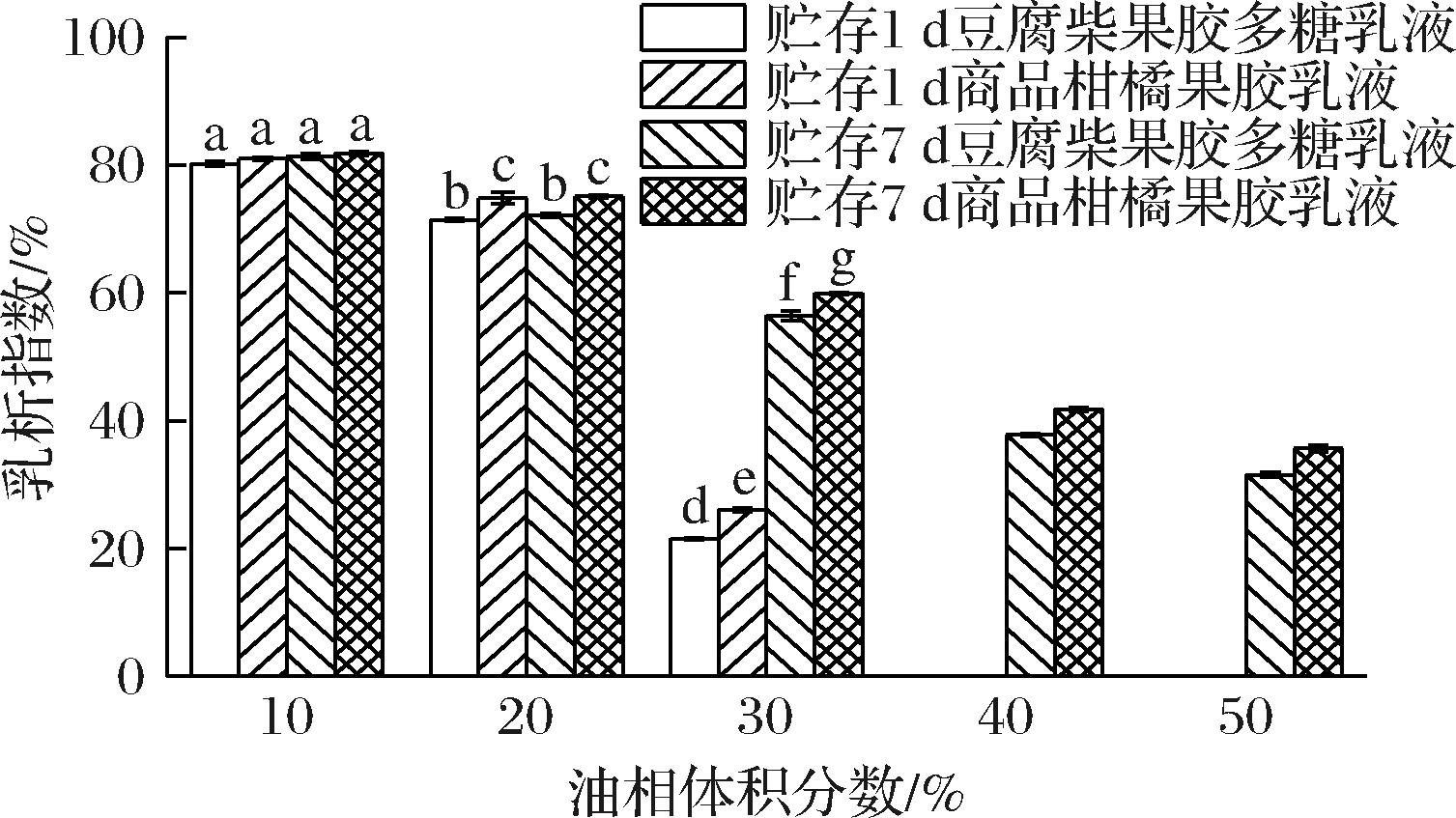
图11 油相体积分数对乳液乳析指数的影响
Fig.11 Effect of oil phase volume fraction on emulsion chromatography index
图12为不同油相体积分数下的两种乳液体系的显微结构图,油相体积分数增大时,乳液的粒径也增大,这是因为较高的油相体积分数会产生更多的油滴,增加果胶分子与油滴结合形成乳滴,提高乳液EA,同时更高的油相体积分数也会加大乳液的黏性从而提高ES和乳析稳定性[31]。
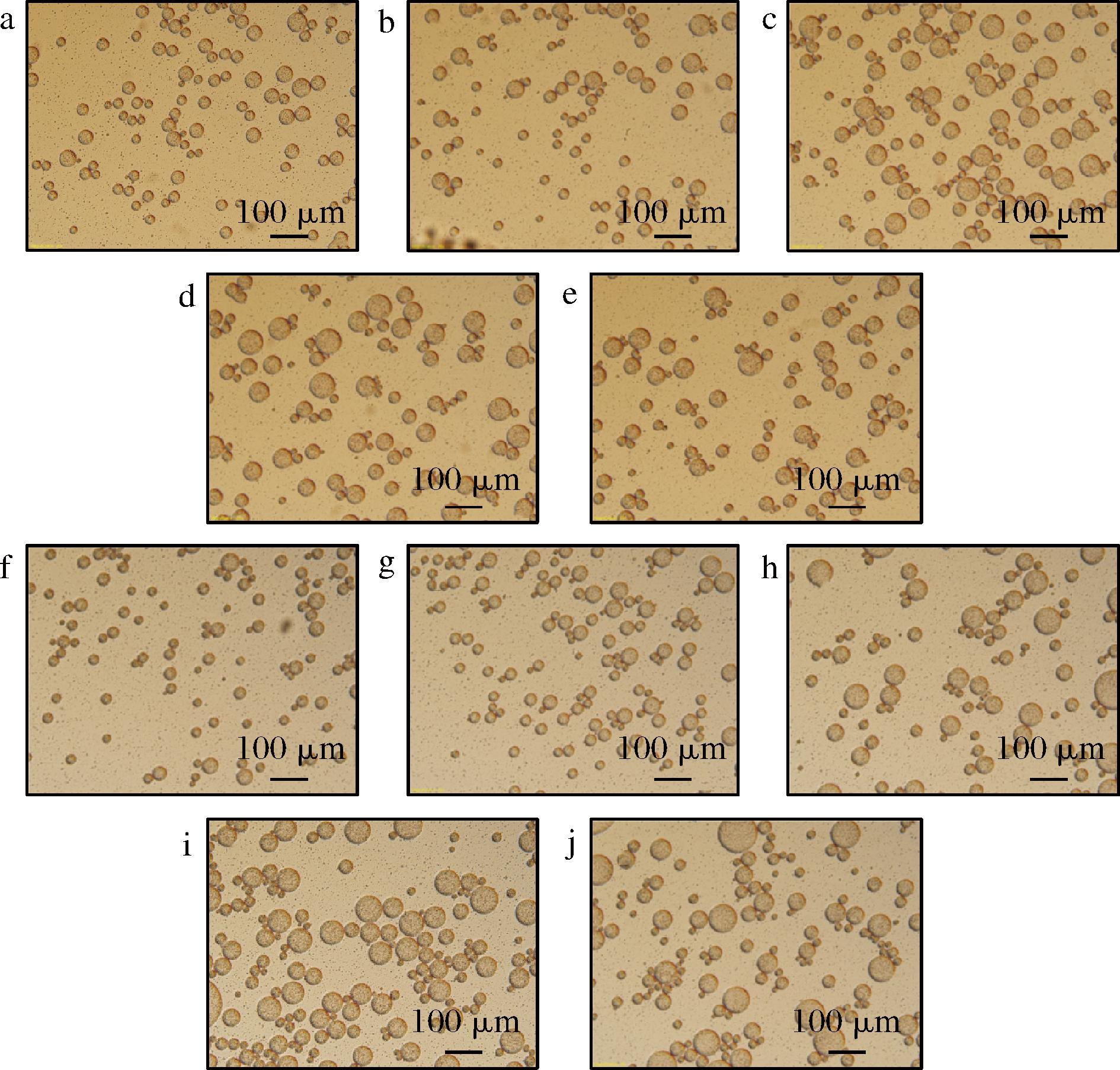
a~e-豆腐柴果胶多糖乳液;f~j-柑橘果胶乳液
图12 不同油相体积分数下豆腐柴果胶多糖乳液,柑橘果胶乳液显微结构图
Fig.12 Microstructures of P. microphylla Turcz pectin polysaccharide emulsion and citrus pectin emulsion with different oil phase volume fractions
本研究从豆腐柴叶中提取得到的豆腐柴果胶多糖的纯度较好,且各项指标均符合GB 25533—2010要求。将其制备的乳液体系与商品柑橘果胶乳液体系做对比,发现果胶质量浓度和油相体积分数对两种果胶的乳化活性和稳定性影响显著,pH对豆腐柴果胶多糖乳化稳定性影响显著,对乳化活性影响不显著,两种果胶的乳析指数主要受到油相体积分数的影响,同等水平下,两种果胶的乳化特性差异显著,豆腐柴果胶多糖的乳化特性更好。综合来看,豆腐柴果胶多糖整体比柑橘果胶具有更好的乳化活性、乳化稳定性和乳析稳定性。豆腐柴果胶多糖可开发作为一种新型的食品乳化剂,在未来具有广阔的开发前景。
[1] NOVOSEL’SKAYA I L, VOROPAEVA N L, SEMENOVA L N, et al.Trends in the science and applications of pectins[J].Chemistry of Natural Compounds, 2000, 36(1):1-10.
[2] MOHNEN D.Pectin structure and biosynthesis[J].Current Opinion in Plant Biology, 2008, 11(3):266-277.
[3] 张学杰, 郭科, 苏艳玲.果胶研究新进展[J].中国食品学报, 2010, 10(1):167-174.
ZHANG X J, GUO K, SU Y L.A review on the recent advance in pectin research[J].Journal of Chinese Institute of Food Science and Technology, 2010, 10(1):167-174.
[4] 冯静. 菠萝皮果胶的提取、理化性质及其多糖组成的研究[D].南昌:南昌大学, 2012.
FENG J.Extraction, characterization and polysaccharide composition of pectin from pineapple[Ananas comosus (L) Merr]rind[D].Nanchang:Nanchang University, 2012.
[5] 邹荣. 西瓜皮果胶提取及其性质的研究[D].广州:华南理工大学, 2014.
ZOU R.Study on extraction and characterization of watermelon rind pectin[D].Guangzhou:South China University of Technology, 2014.
[6] 邓卓丹. 不同品种芒果果皮中果胶提取及其性质研究[D].海口:海南大学, 2020.
DENG Z D.Study on the extraction and properties of pectin from different varieties of mango peel[D].Haikou:Hainan University, 2020.
[7] 万建华. 马铃薯渣果胶的提取及其性质的研究[D]. 无锡: 江南大学, 2008.
WAN J H. Study on the extraction and properties of pectin from potato residue[D]. Wuxi: Jiangnan University, 2008.
[8] 辛明, 李昌宝, 李杰民, 等.超声辅助柠檬酸提取百香果果皮高酯果胶及其理化性质分析[J].食品工业科技, 2021, 42(4):115-120.
XIN M, LI C B, LI J M, et al.Optimization of extraction technology of high methoxyl pectin from passion fruit peel by ultrasound assisted with citric acid extraction and its physicochemical properties[J].Science and Technology of Food Industry, 2021, 42(4):115-120.
[9] 王燕, 许锋, 张风霞, 等.豆腐柴研究进展[J].中国野生植物资源, 2007, 26(4):12-14.
WANG Y, XU F, ZHANG F X, et al.The advance on research of Premna microphylla[J].Chinese Wild Plant Resources, 2007, 26(4):12-14.
[10] 李兴武, 章黎黎.重庆市豆腐柴产业发展面临的困境及对策[J].乡村科技, 2022, 13(8):43-46.
LI X W, ZHANG L L.Difficulties and countermeasures of the development of tofu wood industry in Chongqing[J].Rural Science and Technology, 2022, 13(8):43-46
[11] XIAO J, ZHANG M, WANG W H, et al.Using Flammulina velutipes derived chitin-glucan nanofibrils to stabilize palm oil emulsion:A novel food grade Pickering emulsifier[J].International Journal of Biological Macromolecules, 2020, 164:4628-4637.
[12] 卫姣, 陈雨露, 高彦祥, 等.高内相乳液的制备及在食品中的应用[J].中国食品学报, 2022, 22(4):418-429.
WEI J, CHEN Y L, GAO Y X, et al.Preparation of high internal emulsion and its application in food[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(4):418-429.
[13] 梅新. 甘薯膳食纤维、果胶制备及物化特性研究[D].北京:中国农业科学院, 2010.
MEI X.Characterization of dietary fiber and pectin extraction from sweet potato[D].Beijing:Chinese Academy of Agricultural Sciences, 2010.
[14] MORELL P, L PEZ-GARC
PEZ-GARC A A, HERNANDO I, et al.Improving pea protein emulsifying capacity by glycosylation to prepare high-internal-phase emulsions[J].Foods, 2023, 12(4):870.
A A, HERNANDO I, et al.Improving pea protein emulsifying capacity by glycosylation to prepare high-internal-phase emulsions[J].Foods, 2023, 12(4):870.
[15] WANG M Z, YAN W Q, ZHOU Y L, et al.Progress in the application of lecithins in water-in-oil emulsions[J].Trends in Food Science &Technology, 2021, 118:388-398.
[16] JIA Y Y, DU J, LI K K, et al.Emulsification mechanism of persimmon pectin with promising emulsification capability and stability[J].Food Hydrocolloids, 2022, 131:107727.
[17] 郑梅霞, 朱育菁, 陈峥, 等.12种食品胶的乳化性能比较研究[J].食品工业, 2018, 39(4):188-190.
ZHENG M X, ZHU Y J, CHEN Z, et al.A comparative study of emulsion properties of 12 food gum[J].The Food Industry, 2018, 39(4):188-190.
[18] LI Z Q, XI J, CHEN H M, et al.Effect of glycosylation with apple pectin, citrus pectin, mango pectin and sugar beet pectin on the physicochemical, interfacial and emulsifying properties of coconut protein isolate[J].Food Research International, 2022, 156:111363.
[19] 王鑫颀, 潘信君, 左玉玲.超声波辅助酶法提取豆腐柴中果胶方法的研究[J].现代食品, 2019(8):107-110.
WANG X Q, PAN X J, ZUO Y L.A study on ultrasonic assisted extraction of pectin from Premna microphylla with pectinase[J].Modern Food, 2019(8):107-110.
[20] WANG L, ZHAO Z W, ZHAO H Q, et al.Pectin polysaccharide from Flos Magnoliae (Xin Yi, Magnolia biondii Pamp.flower buds):Hot-compressed water extraction, purification and partial structural characterization[J].Food Hydrocolloids, 2022, 122:107061.
[21] 李玉洁. 超声波辅助多糖制备O/W椰子油乳液及其负载叶黄素的研究[D].海口:海南大学, 2019.
LI Y J.Using polysaccharides with ultrasound treatment to prepare o/w coconut oil emulsions and its loading oil-soluble lutein[D].Haikou:Hainan University, 2019.
[22] LIANG R H, WANG L H, CHEN J, et al.Alkylated pectin:Synthesis, characterization, viscosity and emulsifying properties[J].Food Hydrocolloids, 2015, 50:65-73.
[23] AHSAN H M, ZHANG X Z, LI Y, et al.Surface modification of microcrystalline cellulose:Physicochemical characterization and applications in the stabilization of Pickering emulsions[J].International Journal of Biological Macromolecules, 2019, 132:1176-1184.
[24] 梁婉玲. 高酯果胶的结构及功能特性研究[D].广州:华南理工大学, 2021.
LIANG W L.Study on structure and functional properties of high ester pectin[D].Guangzhou:South China University of Technology, 2021.
[25] BESSON V, YAPO B M, KOFF K.Cinnamon apple pomace pectins:Physicochemical characteristics and gel-forming properties[J].Journal of Human Nutrition &Food Science, 2013, 1(3).DOI:10.1080/15583724.2011.615962.
[26] SUN J, LIU W Y, FENG M Q, et al.Characterization of olive oil emulsions stabilized by flaxseed gum[J].Journal of Food Engineering, 2019, 247:74-79.
[27] CAI X L, LI C J, TANG Q, et al.Assembling kaolinite nanotube at water/oil interface for enhancing Pickering emulsion stability[J].Applied Clay Science, 2019, 172:115-122.
[28] QAMAR S, BHANDARI B, PRAKASH S.Effect of different homogenisation methods and UHT processing on the stability of pea protein emulsion[J].Food Research International, 2019, 116:1374-1385.
[29] PORFIRI M C, CABEZAS D M, WAGNER J R.Comparative study of emulsifying properties in acidic condition of soluble polysaccharides fractions obtained from soy hull and defatted soy flour[J].Journal of Food Science and Technology, 2016, 53(2):956-967.
[30] NING F J, GE Z Z, QIU L, et al.Double-induced se-enriched peanut protein nanoparticles preparation, characterization and stabilized food-grade Pickering emulsions[J].Food Hydrocolloids, 2020, 99:105308.
[31] PIRIYAPRASARTH S, JUTTULAPA M, SRIAMORNSAK P.Stability of rice bran oil-in-water emulsions stabilized by pectin-zein complexes:Effect of composition and order of mixing[J].Food Hydrocolloids, 2016, 61:589-598.