表1 膜性质
Table 1 Membrane properties
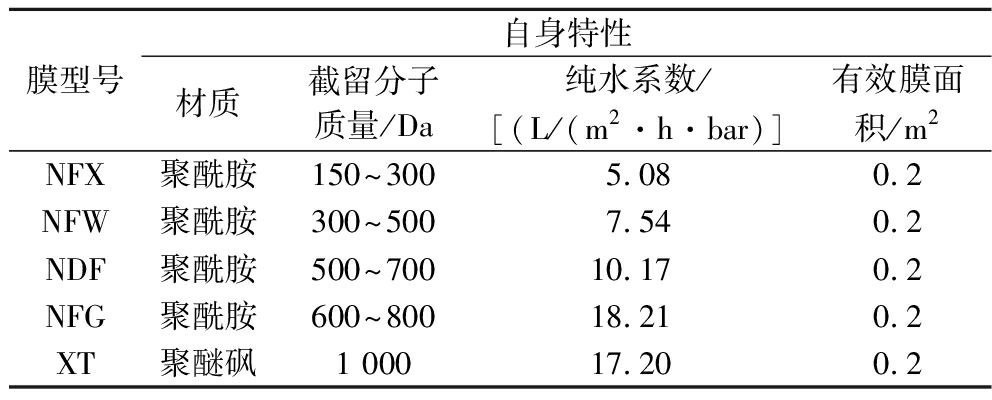
膜型号自身特性材质截留分子质量/Da纯水系数/[(L/(m2·h·bar)]有效膜面积/m2NFX聚酰胺150~3005.080.2NFW聚酰胺300~5007.540.2NDF聚酰胺500~70010.170.2NFG聚酰胺600~80018.210.2XT聚醚砜1 00017.200.2
麦芽四糖(maltotetraose, G4)是一种由4个α-D-吡喃葡萄糖单元以α-1,4-糖苷键连接而成的典型的直链麦芽低聚糖[1]。由于其黏度高[2]、热量低、保湿性能好、增稠作用强、能延缓淀粉老化[3]以及成膜能力好等特性,在食品和化妆品领域有着广泛的应用;此外由于其易于消化吸收,能促进人体对钙离子的吸收,改善肠道环境,并且不易被酵母利用等特点,也常应用于医药行业。因此,对于麦芽四糖的研究也受到了广泛的关注。
目前麦芽四糖主要通过酶法制备,其中包括淀粉液化、糖化、分离等步骤。KIMURA等[4]将麦芽四糖生成酶(EC 3.2.1.60)固定在大孔疏水树脂上实现了麦芽四糖的连续生产,并在1990年采用固定床型生物反应器完成了麦芽四糖的生产[5]。钱莹等[6]通过对糖化pH、温度等条件进行了优化,得到了纯度为52%的麦芽四糖,但并未给出优化后的具体操作条件。信成夫等[7]对糖化pH、温度、糖化程度进行了正交优化,得到了纯度为57%的麦芽四糖。事实上,纯度高于95%的麦芽四糖常用于标准品的定量分析,而纯度高于80%的麦芽四糖则在食品以及化妆品行业有着广泛的应用。目前市售的高纯度麦芽四糖一般用于定量分析的标准,通常是采用色谱法制得,但是该方法是间歇性的,并且效率很低,不适用于大规模生产。LI等[8]采用模拟移动床将麦芽四糖纯度提高至81%,但麦芽四糖的收率只有69%,此外该方法具有耗水量大等弊端。在纯化的策略中,膜分离法由于其节能、高效、环保、过程简单、无相变等优点[9-10],而被大家所看好。DE OLIVEIRA等[11]采用纳滤法从甘蔗水解液中回收低聚木糖;SCHMIDT等[12]以果糖、乳糖混合溶液为研究对象,探究了温度、压力和浓度对纳滤分离单糖与二糖的影响;BANDINI等[13]对采用纳滤法结晶母液中回收葡萄糖的可能性进行了研究。但目前采用膜分离法来提高麦芽四糖含量尚未见到报道。
本文旨在完成麦芽四糖的纯化,得到高纯度的产品,应用于科研等各个行业中。为此,本研究采用“超滤+纳滤“组合的膜分离法,尝试去除糖化副产物,将产品中麦芽四糖的纯度提升至80%以上。
麦芽四糖糖浆,实验室自制;葡萄糖(glucose,G1)、麦芽糖(maltose,G2)、麦芽三糖(maltoriose,G3)、麦芽四糖(G4)标准品,上海惠诚生物科技有限公司;醋酸钠、无水乙醇、HCl、NaOH等常规试剂,分析纯,国药集团化学试剂有限公司。实验所用膜均为1812型卷式膜,泰州星达膜科技有限公司,基本参数见表1。
表1 膜性质
Table 1 Membrane properties

膜型号自身特性材质截留分子质量/Da纯水系数/[(L/(m2·h·bar)]有效膜面积/m2NFX聚酰胺150~3005.080.2NFW聚酰胺300~5007.540.2NDF聚酰胺500~70010.170.2NFG聚酰胺600~80018.210.2XT聚醚砜1 00017.200.2
XK-1812膜分离设备,南京轩科环保科技有限公司;HH-602型水浴锅,常州金坛良友仪器有限公司;HPAEC-PAD配有脉冲电流检测器的高效阴离子交换色谱,美国Thermo Scientific有限公司。
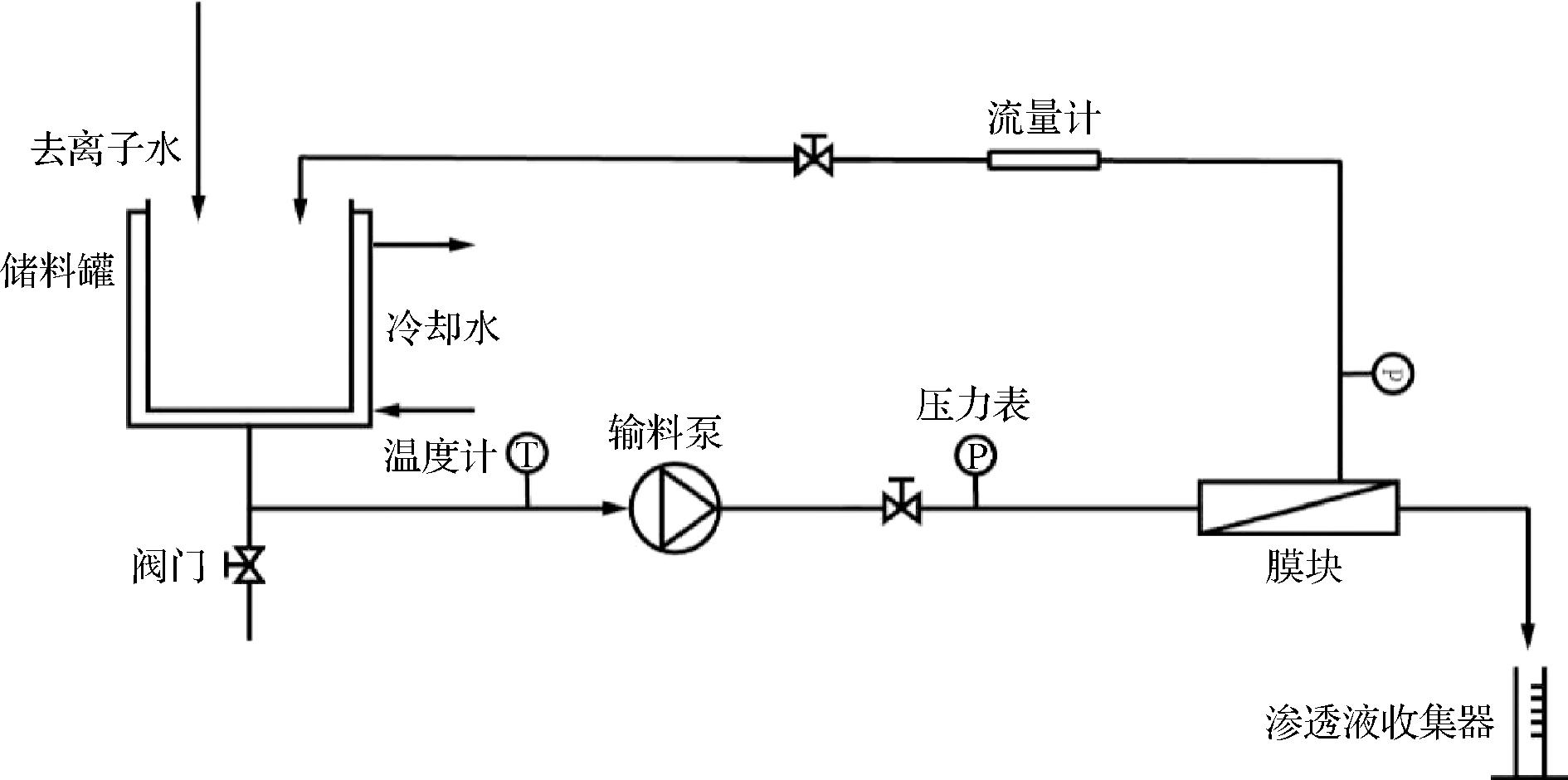
图1 膜分离系统示意图
Fig.1 Schematic diagram of membrane system
在进料质量浓度10 g/L,跨膜压差1.0 MPa,操作温度25 ℃的条件下,根据分离系数、渗透通量、各糖截留率等指标进行膜的筛选。在此基础上,对跨膜压差、温度、进料浓度等操作件进行优化,每次实验进料体积4 L。为确保系统稳定,每改变操作条件时,循环30 min系统稳定后测定渗透通量并取样分析。
间歇渗滤的进料体积为4 L,在进料质量浓度15 g/L,跨膜压差1.0 MPa,操作温度35 ℃的条件下,当截留液体积降到原始体积一半时,向截留液中加入去离子水恢复至原始体积,重复此过程5次。
取一定质量的麦芽四糖糖浆,稀释后取上清液并过0.22 μm水系膜,用HPAEC-PAD分析酶解产物中低聚糖组成[14-15]。
参照王宝石[16]的方法测定糊精分子质量分布特征。
膜分离操作过程中,料液循环30 min,待系统稳定后收集并计量1 min内的渗透液体积,按公式(1)计算膜通量(Jp):
(1)
式中:Jp,膜通量,L/(h·m2);Vp,渗透液体积,L;Am,有效过滤面积,0.2 m2;t,过滤时间,h。
按1.4节的方法检测料液与渗透液中G1、G2、G3、G4的质量浓度,按公式(2)计算截留率(R):
(2)
式中:ρf,进料液溶质浓度,g/L;ρp,渗透液溶质浓度,g/L。
分离系数在本实验中用于评估G4、G3两种物质的分离效率(α),其计算公式(3)为:
(3)
式中:p,渗透液,f,料液;ρG4、ρG3分别为G4、G3的质量浓度,g/L;RG3、RG4分别为G3、G4的截留率。
浓缩过程中的浓缩因子定义如公式(4)所示:
ɑ![]()
(4)
式中:V0,初始时进料体积,L;VR,浓缩结束时的进料体积,L。
纯度的计算如公式(5)所示:
(5)
式中:Pn,某一小分子糖的纯度,%;ρn,某一小分子糖的质量浓度,g/L;ρ,样品中G1-G4的总质量浓度,g/L。
实验结果均为3次实验的平均值,用平均值±标准偏差表示;采用Origin 2021、Excel软件处理数据和作图;用SPSS 20的单因素方差分析(ANOVA)和Student-Newman-Keuls 程序进行显著性分析(P<0.05)。
因麦芽四糖糖浆中除小分子糖外,仍然有大分子质量糊精的存在,这会给后续的纳滤操作带来很大影响。因此采用截留分子质量为1 000 Da的超滤膜(XT),在进料质量浓度10 g/L,跨膜压差0.6 MPa,操作温度25 ℃下对麦芽四糖糖浆进行预处理。表2所示为超滤前后各糖的纯度、小分子糖总浓度以及糊精分子质量分布的变化,可以看出超滤前后各糖纯度及小分子糖总浓度差异较小,说明此超滤膜做到了对小分子糖的回收,避免了操作过程中目标产物的损失,同时超滤后高分子质量聚集区的所占面积减少了72%,且重均分子质量从37.90 kDa下降到了10.08 kDa,表明超滤除去了大量的大分子质量糊精,为后续纳滤纯化麦芽四糖打下了基础。
表2 超滤前后的糊精分子质量分布、各糖纯度及小分子糖总浓度
Table 2 The molecular weight distribution of dextrin, the purity of each sugar and the total concentration of small molecular sugar before and after ultrafiltration were analyzed
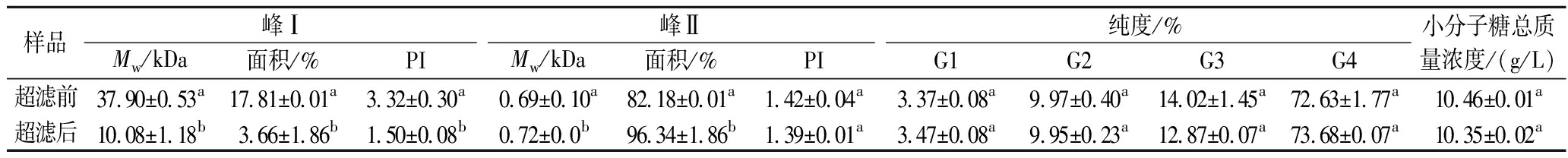
样品峰Ⅰ峰Ⅱ纯度/%Mw/kDa面积/%PIMw/kDa面积/%PIG1G2G3G4小分子糖总质量浓度/(g/L)超滤前37.90±0.53a17.81±0.01a3.32±0.30a0.69±0.10a82.18±0.01a1.42±0.04a3.37±0.08a9.97±0.40a14.02±1.45a72.63±1.77a10.46±0.01a超滤后10.08±1.18b3.66±1.86b1.50±0.08b0.72±0.0b96.34±1.86b1.39±0.01a3.47±0.08a9.95±0.23a12.87±0.07a73.68±0.07a10.35±0.02a
注:多聚分散性系数PI(polydispersity index)=Mw/Mn,反应组分分子质量均一性,其中同列不同字母上标表示的数据间差异显著(P<0.05)。
以小分子糖总质量浓度为10 g/L的麦芽四糖超滤渗透液为原料,在跨膜压差1.0 MPa,操作温度25 ℃下进行了各纳滤膜的筛选,结果如表3所示。随着纳滤膜截留分子质量的提高,其渗透通量也在不断上升。除膜NFG外,其他纳滤膜的G4截留率均保持在97%以上,有利于G4的回收,其中膜NFX较膜NFW、NDF,有最低的G2、G1截留率,最高的分离系数(G4/G3),更有利于完成G4与其他小分子糖的分离,达到提高麦芽四糖纯度的目标。因此在后续的研究中,选择膜NFX进行研究。
表3 各纳滤膜的分离性能
Table 3 Separation performance of each membrane
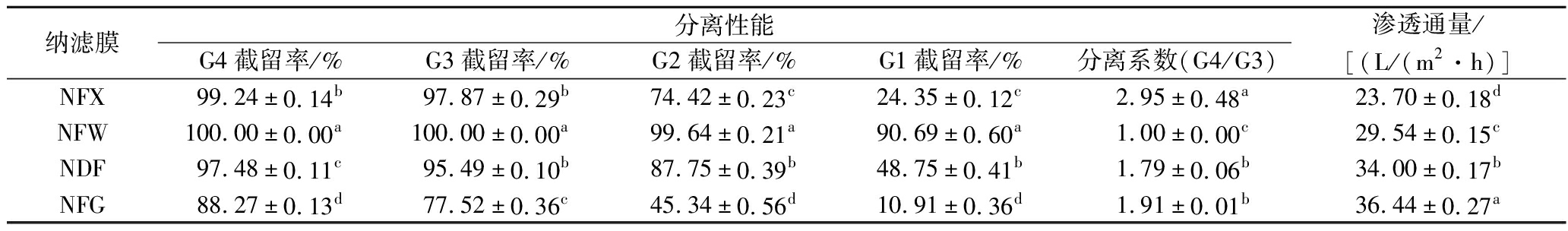
纳滤膜分离性能G4截留率/%G3截留率/%G2截留率/%G1截留率/%分离系数(G4/G3)渗透通量/[(L/(m2·h)]NFX99.24±0.14b97.87±0.29b74.42±0.23c24.35±0.12c2.95±0.48a23.70±0.18dNFW100.00±0.00a100.00±0.00a99.64±0.21a90.69±0.60a1.00±0.00c29.54±0.15cNDF97.48±0.11c95.49±0.10b87.75±0.39b48.75±0.41b1.79±0.06b34.00±0.17bNFG88.27±0.13d77.52±0.36c45.34±0.56d10.91±0.36d1.91±0.01b36.44±0.27a
注:同列不同字母上标数据存在显著性差异(P<0.05)。
在以压力为驱动力的纳滤过程中,跨膜压差是主要的传质驱动力,也是影响截留率、渗透通量、膜污染的重要因素。以小分子糖总质量浓度为10 g/L超滤渗透液为原料,在操作温度为25 ℃下,探究跨膜压差对膜NFX分离性能的影响。随着跨膜压差的增加,纳滤膜渗透通量的变化呈现先升高、在1.0 MPa后增长趋势变缓慢(图2-a)。这可以通过Darcy定律与串联阻力模型来解释,当跨膜压差较低时,传质阻力的变化较小,渗透通量随着传质推动力(跨膜压差)的增加而增加,当跨膜压差继续增加时,膜表面的污染以及浓差极化的加剧,传质阻力的变化程度强于跨膜压差的变化,导致渗透通量不再增加。
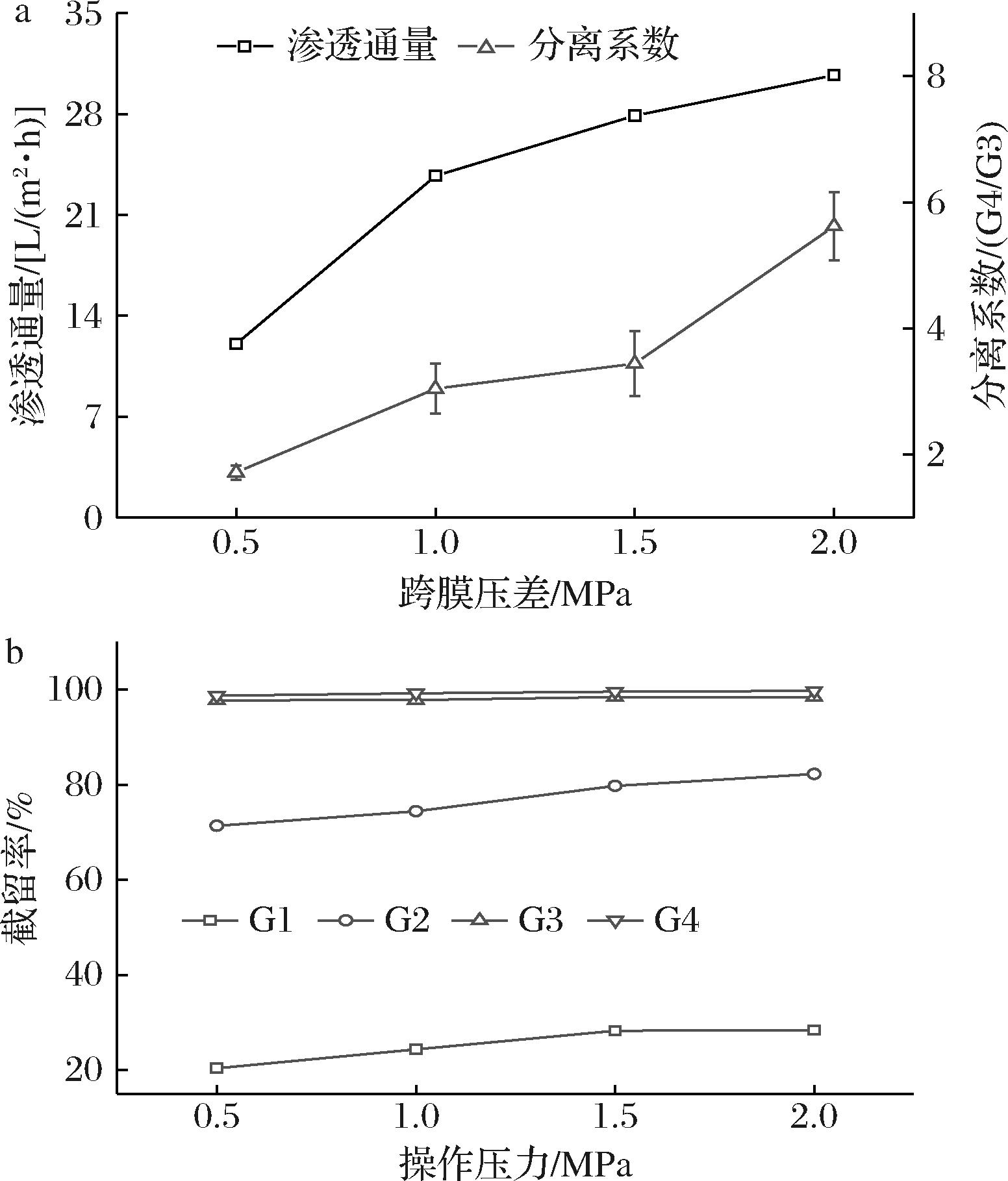
a-跨膜压差对渗透通量以及分离系数的影响;b-跨膜压差对各物质截留率的影响
图2 不同跨膜压差对膜分离性能的影响
Fig.2 Influence of transmembrane pressure on membrane separation performance
图2-b显示了在其他条件都相同时,跨膜压差对各小分子糖截留率的影响。膜NFX对G4、G3的截留率维持在较高水平,且随着跨膜压差的增加而缓慢增长,但G2、G1的截留率有较为明显的上升趋势。通常情况下,跨膜压差对纳滤过程的影响有2种竞争现象。一方面,压力的增加导致溶剂通量的增加,但溶质的传输受到空间效应和电效应的阻碍。因此,较高的溶剂渗透通量导致较低的渗透物浓度,从而造成截留率的增加;另一方面,跨膜压差的增加会将更多的溶质输送到膜表面,并导致更高的浓差极化效应,并且溶质在高浓度梯度下有通过膜输送的趋势。浓差极化甚至可通过降低电荷效应导致溶质截留率降低[17]。这两个过程将决定纳滤膜在不同跨膜压差下的最终截留率[18]。
在1.0 MPa下膜NFX的G4平均截留率为99.29%。继续增加跨膜压差,虽然能得到更高的渗透通量,分离系数(G4/G3)也会增加,但渗透通量的提升十分有限,而更高的跨膜压差会增加分离G2、G1的难度,也会增加运行成本。因此,在后续的实验中选择跨膜压差为1.0 MPa进行其他条件的探究。
以小分子糖总质量浓度为10 g/L超滤渗透液为原料,在1.0 MPa下,探究操作温度对膜NFX分离性能的影响。随着操作温度的不断升高,渗透通量也随之升高(图3-a)。TSURU等[19]对这种现象给出了3种解释:1)溶剂分子在较高温度下增加的热能,使得它们能够克服由于孔壁摩擦力在微孔中产生的能量势垒;2)由于亲水性空隙表面上的吸附水层变薄,导致有效孔径随着温度增加而增加;3)高温降低了料液黏度,从而导致渗透通量升高。
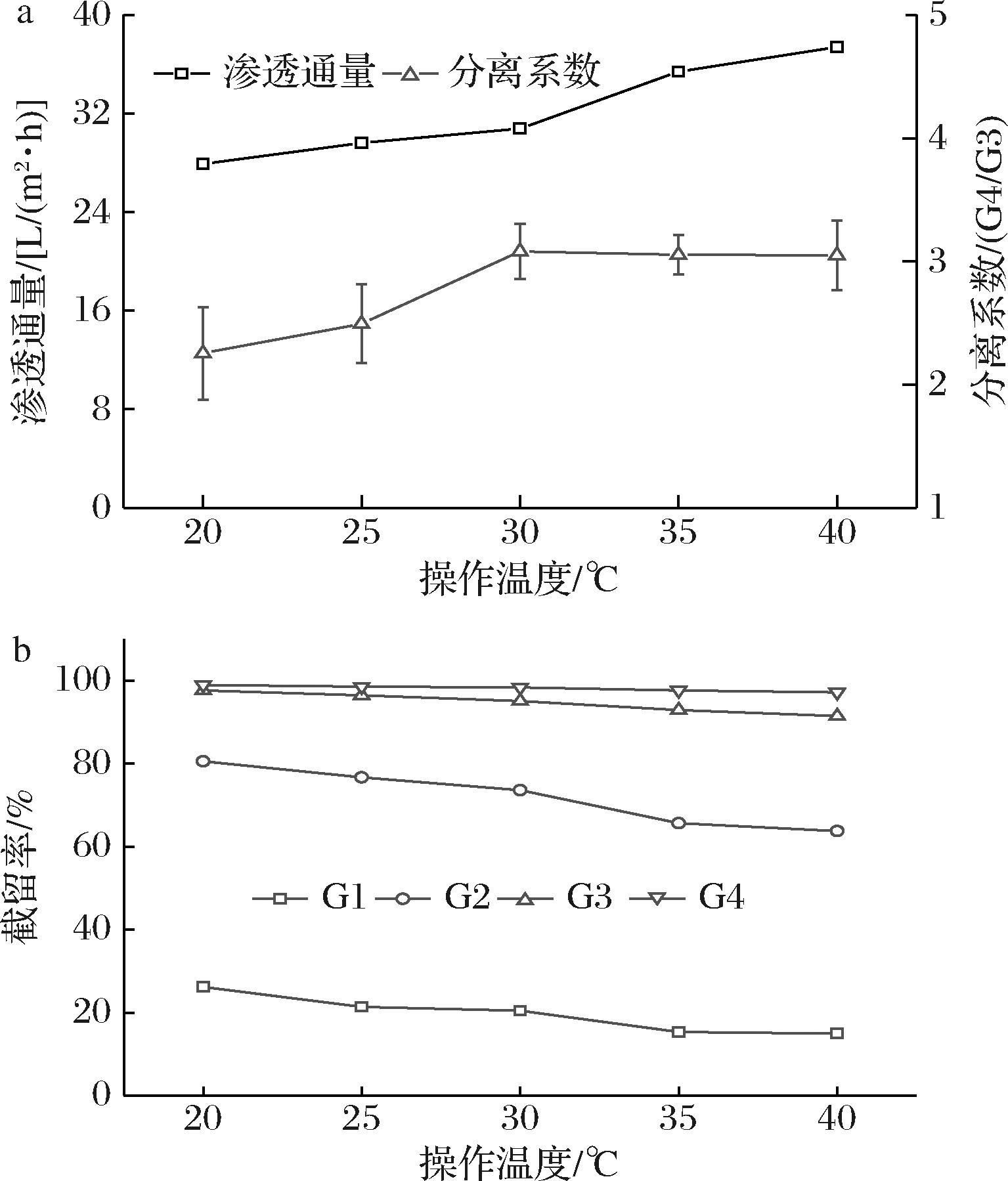
a-操作温度对各物质渗透通量和分离系数的影响;b-操作温度对各物质截留率的影响
图3 不同操作温度对膜分离性能的影响
Fig.3 Influence of temperature on membrane separation performance
如图3-b所示,随着操作温度的增加,G4截留率并没有明显变化,G3的截留率从97.67%下降到91.49%,G2 的截留率从80.53%下降到63.71%,G1的截留率从26.17%下降到14.91%。操作温度的增加,提高了G4与G3的分离系数(图3-b),进一步增强了膜NFX的分离性能。这是由于温度的升高加强了水与溶质的传质[20],同时也增强了溶质的扩散作用[21],并使得膜孔径热膨胀,加强了溶质通过膜的运输,最终导致G3、G2、G1,截留率下降,渗透通量增加。
由于当温度高于35 ℃时,G4与G3分离系数(图3-b)不再发生变化,且渗透通量的增加也较为缓慢,更高的操作温度也会导致纳滤膜使用寿命的衰减,因此选择35 ℃作为后续实验的操作温度。
在操作压力为1.0 MPa,操作温度为35 ℃下,探究进料浓度对纳滤膜NFX分离性能的影响。随着进料浓度的升高,渗透通量不断下降(图4-a)。这是由于进料浓度越大,在操作过程中越容易出现浓差极化现象[12],进而导致渗透通量的降低;此外,进料浓度的增加,也会增加溶液黏度并增厚动态膜[22],使得糖类物质附着在膜表面,进一步加剧膜污染,使得传质阻力升高。另外更高的进料浓度也会增加渗透压,降低膜分离的有效推动力最终导致渗透通量降低。因此,选择合适的进料浓度对麦芽四糖的分离纯化具有重要指导作用。
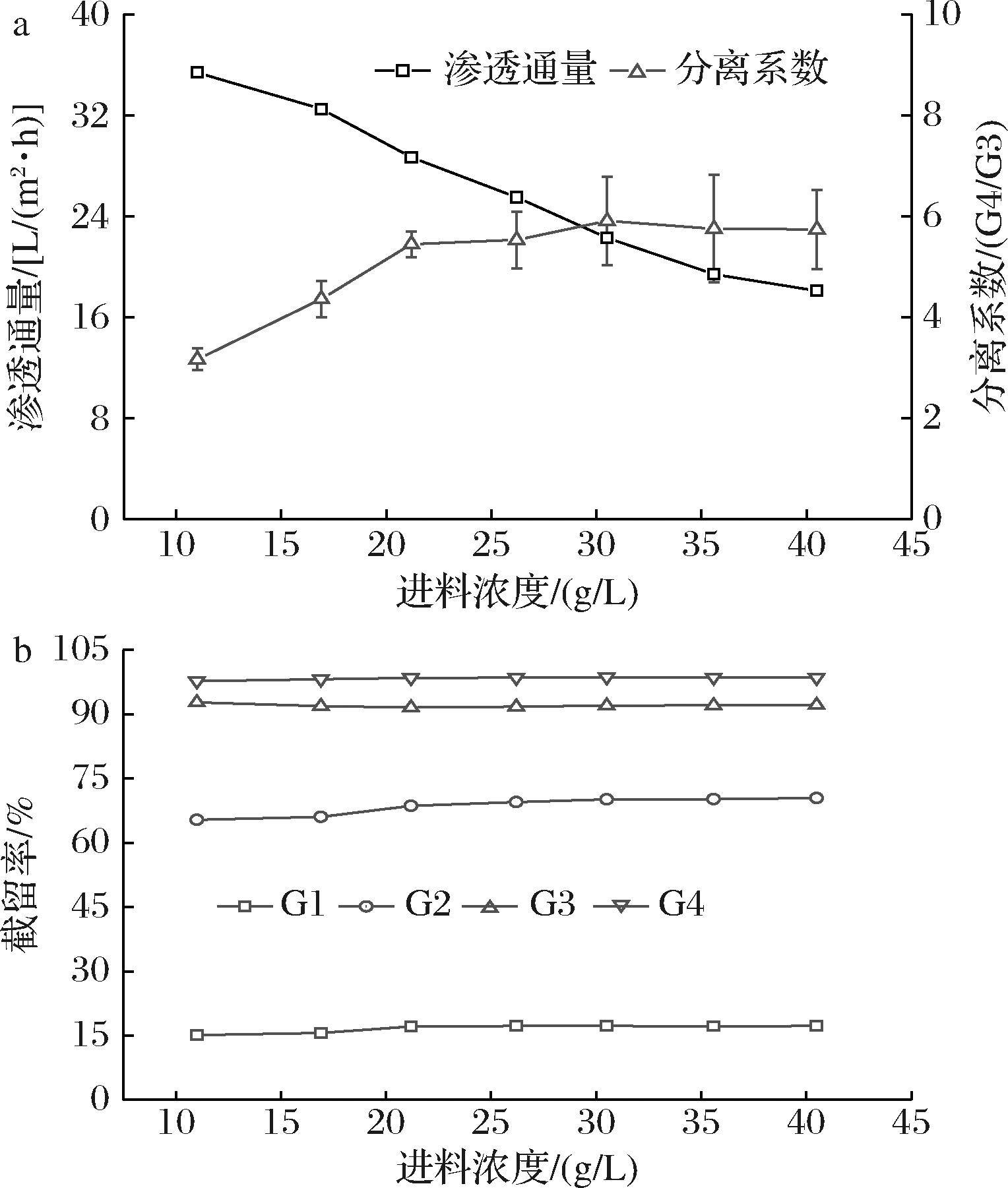
a-进料浓度对渗透通量以及分离系数的影响;b-进料浓度对各物质截留率的影响
图4 进料浓度对膜分离性能的影响
Fig.4 Effect of solute concentration in the feed on membrane separation performance
不同进料浓度下,各糖截留率的变化如图4-b所示。随着进料浓度的升高,G4、G3的截留率变化较小,其中G4的截留率逐渐接近99%,而G2、G1的截留率则呈现先增加后趋于平缓的趋势。同时随着进料浓度的增加,分离系数也不断增加。这是由于进料浓度增加,会增强浓差极化并导致动态膜加厚[23],最终导致各小分子糖的截留率都有不同程度的上升。在一些研究中,因为浓差极化作用占主导,出现了随着进料浓度的增加,溶质截留率降低的现象[12]。
在进料质量浓度低于15 g/L时,G1、G2的截留率增长较为缓慢,而当进料质量浓度高于15 g/L时,G1、G2截留率则出现了明显的上升趋势,分离难度上升,虽然分离系数一直处于增加的状态,但这主要是G4截留率高造成的。而当进料质量浓度高于15 g/L时,渗透通量的下降较为迅速,也将延长分离操作时间,增加了染菌的风险。因此在综合考虑下,选择进料质量浓度为15 g/L作为后续研究的初始进料浓度。
按照上述优化后的操作条件,纳滤至不产水时G4纯度由73.40%提高至78.20%,未能达到G4纯度80%的分离目标。因此后续采用间歇渗滤进一步提高G4的纯度。
在间歇渗滤过程中,每阶段浓缩后,加入纯水的进料溶液成为下一阶段的浓缩进料液。浓缩步骤采用膜NFX在错流下进行,其中进料质量浓度15 g/L,操作温度35 ℃,跨膜压差1.0 MPa,各阶段的浓缩因子为2。间歇渗滤过程中通量的变化如图5-a所示,整个过程分为5个阶段,总操作时间约1.72 h。在各浓缩阶段中,溶质浓度随着浓缩时间的延长而增加,造成浓差极化以及膜污染加剧[24],导致渗透通量随着操作时间的延长而减少。可以预见的是,在间歇渗滤期间对进料溶液的再稀释会对渗透通量有积极的影响。一旦进料溶液被再稀释,渗透通量就能增加到初始值甚至更高。在第一个浓缩阶段中,渗透通量由初始的32.54 L/(m2·h),在20 min后下降到26.22 L/(m2·h)。但在经过对第一阶段截留液加水稀释后,渗透通量恢复至35.29 L/(m2·h),说明渗滤过程中浓差极化的影响有限[25]。溶质浓度在间歇渗滤过程中的变化如图5-b所示,由于间歇渗率过程中除去了一些小分子低聚糖,溶质浓度随着每个阶段的间歇渗滤而降低。由于各物质的截留率不同,如图5-c所示,当进行到第四阶段时,葡萄糖已被基本去除,在第五阶段时G4回收率为92.15%。由图5-d可以看出,在第二阶段时G4纯度已经从最开始的73.54%提升至80.71%,达到了分离目标,在第五阶段时,G4纯度达到87.14%。
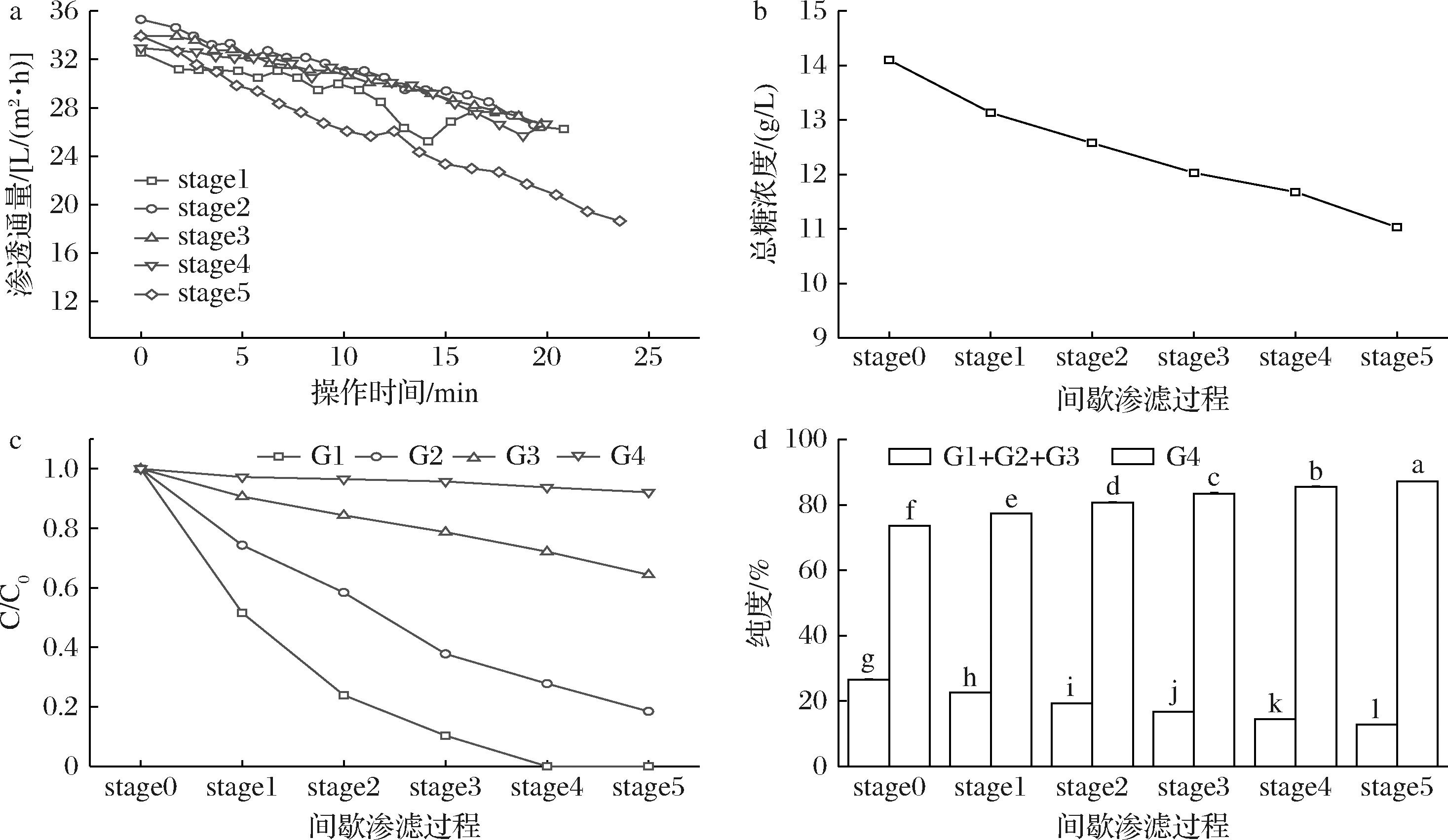
a-渗透通量;b-总糖浓度的变化;c-各低聚糖浓度占比的变化;d-G4纯度的变化
图5 间歇渗滤期间膜NFX的性能
Fig.5 Membrane performance of NFX during intermittent feed diafiltration
注:柱上不同字母表示数据之间存在显著性差异(P<0.05)。
本文采用“超滤+纳滤“组合膜分离的方法来提高G4的纯度。截留分子质量1 000 Da的超滤膜可以去除大分子质量糊精,同时回收小分子糖,适用于纳滤前的糖浆预处理;截留分子质量为150~300 Da的纳滤膜(NFX),对G4的截留率高,对其他小分子糖截留率较低,适用于提高G4纯度;在最优操作条件下纳滤后G4纯度由73.40%提升至78.20%;进一步经过浓缩因子为2的5个阶段的间歇渗滤,在第二阶段完成了将G4纯度从73.54%提升至80%的目标,并在第五阶段将G4纯度提升至87.14%,G4回收率达92.15%。由于G4与G3相对分子质量相近,膜分离虽然不能完成两者的绝对分离,但可以提高产品中麦芽四糖的比例,对进一步研究麦芽四糖的应用价值就有重要意义。
[1] PAN S H, DING N, REN J Y, et al.Maltooligosaccharide-forming amylase:Characteristics, preparation, and application[J].Biotechnology Advances, 2017, 35(5):619-632.
[2] 朱明, 吴嘉根.麦芽四糖的性质及在食品中的应用[J].冷饮与速冻食品工业, 1999, 5(4):23-24.
ZHU M, WU J G.The properties of maltotetraose and its application in food[J].Beverage &Fast Frozen Food Industry, 1999, 5(4):23-24.
[3] BAE W, LEE S H, YOO S H, et al.Utilization of a maltotetraose-producing amylase as a whole wheat bread improver:Dough rheology and baking performance[J].Journal of Food Science, 2014, 79(8):E1535-E1540.
[4] KIMURA T, OGATA M, YOSHIDA M, et al.Continuous production of maltotetraose using immobilized Pseudomonas stutzeri amylase[J].Biotechnology and Bioengineering, 1988, 32(5):669-676.
[5] KIMURA T, NAKAKUKI T.Maltotetraose, A new saccharide of tertiary property[J].Starch - Stärke, 1990, 42(4):151-157.
[6] 钱莹, 段钢.新型麦芽四糖酶及其应用[J].食品与生物技术学报, 2013, 32(1):100-104.
QIAN Y, DUAN G.Maltotetraose syrup production and process optimization[J].Journal of Food Science and Biotechnology, 2013, 32(1):100-104.
[7] 信成夫, 景文利, 于丽, 等.麦芽四糖生产工艺的研究[J].中国食品添加剂, 2016(10):149-153.
XIN C F, JING W L, YU L, et al.Study on maltotetraose production technology[J].China Food Additives, 2016(10):149-153.
[8] LI J C, BAN X F, GU Z B, et al.Preparation and antibacterial activity of a novel maltotetraose product[J].Process Biochemistry, 2021, 108:8-17.
[9] 李欢. 膜分离技术及其应用[J].化工管理, 2022(33):50-53.
LI H.Membrane separation technology and its application[J].Chemical Enterprise Management, 2022(33):50-53.
[10] 王华, 刘艳飞, 彭东明, 等.膜分离技术的研究进展及应用展望[J].应用化工, 2013, 42(3):532-534.
WANG H, LIU Y F, PENG D M, et al.The development of membrane separation technology and its application prospect[J].Applied Chemical Industry, 2013, 42(3):532-534.
[11] DE OLIVEIRA M G, FORTE M B S, FRANCO T T.A serial membrane-based process for fractionation of xylooligosaccharides from sugarcane straw hydrolysate[J].Separation and Purification Technology, 2021, 278:119285.
[12] SCHMIDT C M, MAIL NDER L K, HINRICHS J.Fractionation of mono- and disaccharides via nanofiltration:Influence of pressure, temperature and concentration[J].Separation and Purification Technology, 2019, 211:571-577.
NDER L K, HINRICHS J.Fractionation of mono- and disaccharides via nanofiltration:Influence of pressure, temperature and concentration[J].Separation and Purification Technology, 2019, 211:571-577.
[13] BANDINI S, NATALONI L.Nanofiltration for dextrose recovery from crystallization mother liquors:A feasibility study[J].Separation and Purification Technology, 2015, 139:53-62.
[14] ROUSSEL X, LANCELON-PIN C, VIKSØ-NIELSEN A, et al.Characterization of substrate and product specificity of the purified recombinant glycogen branching enzyme of Rhodothermus obamensis[J].Biochimica et Biophysica Acta, 2013, 1830(1):2167-2177.
[15] 陈殿宁, 李才明, 顾正彪, 等.玉米淀粉浓度对酶法制备直链麦芽低聚糖的影响[J].食品与发酵工业, 2019, 45(13):15-22.
CHEN D N, LI C M, GU Z B, et al.Effects of corn starch concentration on enzymatic preparation of linear malto-oligosaccharides[J].Food and Fermentation Industries, 2019, 45(13):15-22.
[16] 王宝石. 黑曲霉发酵生产柠檬酸的关键节点解析及对策[D].无锡:江南大学, 2017.
WANG B S.Analysis and strategies of key nodes in the production of citric acid fermented by Aspergillus niger[D].Wuxi:Jiangnan University, 2017.
[17] SEIDEL A, WAYPA J J, ELIMELECH M.Role of charge (donnan) exclusion in removal of arsenic from water by a negatively charged porous nanofiltration membrane[J].Environmental Engineering Science, 2001, 18(2):105-113.
[18] GHERASIM C V, CUHORKA J, MIKUL
 EK P.Analysis of lead(II) retention from single salt and binary aqueous solutions by a polyamide nanofiltration membrane:Experimental results and modelling[J].Journal of Membrane Science, 2013, 436:132-144.
EK P.Analysis of lead(II) retention from single salt and binary aqueous solutions by a polyamide nanofiltration membrane:Experimental results and modelling[J].Journal of Membrane Science, 2013, 436:132-144.
[19] TSURU T, IZUMI S, YOSHIOKA T, et al.Temperature effect on transport performance by inorganic nanofiltration membranes[J].AIChE Journal, 2000, 46(3):565-574.
[20] SNOW M J H, DE WINTER D, BUCKINGHAM R, et al.New techniques for extreme conditions:High temperature reverse osmosis and nanofiltration[J].Desalination, 1996, 105(1-2):57-61.
[21] NILSSON M, TR GÅRDH G, ÖSTERGREN K.Influence of temperature and cleaning on aromatic and semi-aromatic polyamide thin-film composite NF and RO membranes[J].Separation and Purification Technology, 2008, 62(3):717-726.
GÅRDH G, ÖSTERGREN K.Influence of temperature and cleaning on aromatic and semi-aromatic polyamide thin-film composite NF and RO membranes[J].Separation and Purification Technology, 2008, 62(3):717-726.
[22] YANG Q J, LUO J Q, GUO S W, et al.Threshold flux in concentration mode:Fouling control during clarification of molasses by ultrafiltration[J].Journal of Membrane Science, 2019, 586:130-139.
[23] ZURIAGA-AGUST E, ALVENTOSA-DELARA E, BARREDO-DAMAS S, et al.Performance of ceramic ultrafiltration membranes and fouling behavior of a dye-polysaccharide binary system[J].Water Research, 2014, 54:199-210.
E, ALVENTOSA-DELARA E, BARREDO-DAMAS S, et al.Performance of ceramic ultrafiltration membranes and fouling behavior of a dye-polysaccharide binary system[J].Water Research, 2014, 54:199-210.
[24] ARKELL A, KRAWCZYK H, THUVANDER J, et al.Evaluation of membrane performance and cost estimates during recovery of sodium hydroxide in a hemicellulose extraction process by nanofiltration[J].Separation and Purification Technology, 2013, 118:387-393.
[25] REN H F, FEI J J, SHI X C, et al.Continuous ultrafiltration membrane reactor coupled with nanofiltration for the enzymatic synthesis and purification of galactosyl-oligosaccharides[J].Separation and Purification Technology, 2015, 144:70-79.