表1 L9 (34)正交试验因素及水平设计表
Table 1 The design of factors and levels of L9 (34) orthogonal test
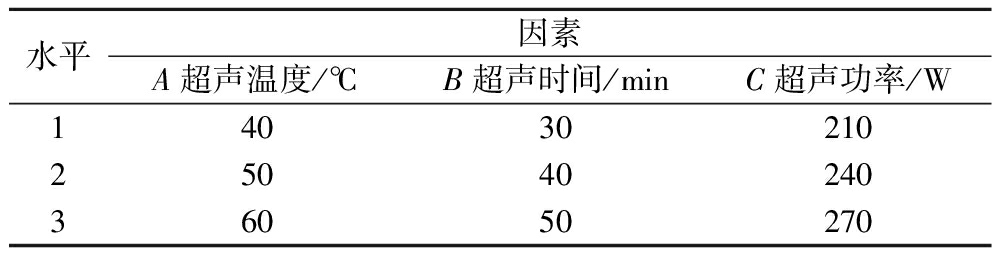
水平因素A超声温度/℃B超声时间/minC超声功率/W140302102504024036050270
香椿为楝科香椿属落叶乔木,已有2 300多年的栽培历史,是我国特有的集材、菜、药于一体的珍贵木本植物,在全国22个省区均有规模化种植[1-2]。香椿由于风味独特、营养价值高而深受消费者喜爱,是理想的绿色保健食品,具有很大的市场开发潜力[3-4]。但每年香椿嫩芽大量上市均集中在清明前后,一般在2周之后便开始木质化失去鲜食商品价值[5],香椿短暂的市场供给远远不能满足人们的需求,如何将可食性的香椿特征风味进行高效制备浓缩值得研究关注。
香椿中鉴定出的挥发性物质有100多种,其中大部分是含硫类、萜烯类、烃类、醛类、酮类及酚类等[6-7]。最新研究表明,顺式/反式-2-巯基-3,4-二甲基-2,3-二氢噻吩、(E,E)-, (E,Z)-和(Z,Z)-二-1-丙烯基二硫化物等含硫类化学组分是香椿特征风味的主要贡献者[8-9]。据BLOCK等[10]报道,硫醚类化合物化学性质极其不稳定,同时在80 ℃容易受温度的影响发生变化,且随着温度的升高而转变成噻吩失去其特征风味。目前从香辛植物中制备风味物质的方法主要有压榨法、水蒸气蒸馏法、溶剂萃取法等[11-12]。对于热敏性风味物质来说,溶剂萃取是较好的选择,但其后期过滤工艺操作麻烦,增加生产成本且易造成风味物质损失。
油脂具有脂类疏水基团,能将非极性或弱极性风味物质溶解,对风味物质具有一定的包埋作用,以食用油为油质载体,采用油脂萃取工艺,使得脂溶性的风味成分能够较好保留。鉴于此,结合香椿中含硫特征风味物质在高温下受热易分解,研究团队提出了双相液体萃取温度可独立调控、提取过程动静结合的水-油双相萃取技术[13]。本研究以冷冻干燥香椿为研究对象,借助超声波辅助手段,利用水-玉米油双相浸提技术制备香椿风味油,采用单因素试验和正交试验对其工艺条件进行优化,并对提取制备的香椿风味油的贮藏品质进行检测分析,以期为含硫类风味化合物的组分解析和体外稳定提供理论基础,同时为含硫化合物在风味形成、后期调香技术及商品化应用等方面提供重要的技术支撑。
干燥香椿:为保证样品的一致性,香椿(幼芽,长约10 cm)于2022年4月2日采自河南省登封市三一香椿示范基地,采摘当天低温运回实验室,分拣除杂后,完整的香椿枝条进行真空冷冻干燥。干燥结束后进行粉碎处理,碎粒长度为5~8 mm,备用。
玉米油,山东省长寿花食品股份有限公司;内标2-甲基-3-庚酮,德国DR公司;正构烷烃C6~C30(色谱纯),美国Supelco公司。
VFD-2000A真空冷冻干燥机,上海比朗仪器制造有限公司;SB-5200DTD型超声波清洗机,宁波新芝生物科技股份有限公司;8890A-5977B型GC-MS、HP-5MS石英毛细管色谱(30 m×0.25 mm×0.25 μm),美国Agilent公司;顶空固相微萃取装置[包括手持式手柄,50/30 μm二乙烯基苯/羧甲基/聚二甲基硅氧烷(DVB/CAR/PDMS)萃取头],美国Supelco公司。
1.3.1 超声辅助双相浸提香椿风味油样品制备
准确称取20 g香椿冻干粉置于双相浸提装置,为了能够更好地激发香椿风味,在大量试验基础上,按料液比1∶20(g∶mL)加水,室温静置30 min,再按料液比1∶10(g∶mL)添加玉米油,用封口膜封口。打开超声波开关,根据需要设置温度、时间、功率等超声条件。同时通过调节冷却水流速控制油相温度为20 ℃,浸提结束后,先用纱布进行粗过滤,再倒入分液漏斗。上层为油相,经过滤及除水后得到双相浸提油样,装到棕色顶空瓶中放在-30 ℃冰箱中用于下步分析。
1.3.2 单因素试验设计
按照1.3.1节的方法进行制备,利用单因素试验分别对超声温度、超声时间、超声功率3个因素进行梯度探讨。探究不同超声温度(30、40、50、60、70 ℃)、超声时间(20、30、40、50、60 min)、超声功率(150、180、210、240、270 W)对香椿风味油含硫类挥发性成分相对含量的影响。初定条件为超声温度50 ℃、超声时间40 min、超声功率210 W。
1.3.3 正交试验设计
在单因素试验结果基础上,以超声温度、超声时间、超声功率作为含硫类挥发性成分相对含量的考察因素,选取3个水平,采用L9(34)正交表设计试验,通过超声波辅助优化香椿风味油的制备工艺条件,得出含硫类挥发性成分的最大相对含量,最终确定最佳工艺条件,正交试验因素及水平设计如表1所示。
表1 L9 (34)正交试验因素及水平设计表
Table 1 The design of factors and levels of L9 (34) orthogonal test

水平因素A超声温度/℃B超声时间/minC超声功率/W140302102504024036050270
1.3.4 贮藏试验设计
利用1.3.3节确定的最优超声条件制备一批香椿风味油,按照200 g/瓶规格采用透明玻璃瓶包装,分别在4 ℃(277 K)、室温25 ℃(298 K)、40 ℃(313 K)、50 ℃(323 K)及60 ℃(333 K)温度条件下避光贮藏,分别每隔7 d进行酸价和过氧化值(peroxide value,POV)的测定,每隔14 d进行挥发性成分的测定。
1.3.5 检测分析方法
1.3.5.1 酸价测定
酸价的测定按照GB 5009.229—2016《食品中酸价的测定》中第一法 冷溶剂 指示剂滴定法,每间隔7 d测定1次,前后56 d共测定9次,并重复3次取平均值。
1.3.5.2 POV测定
POV的测定按照GB 5009.227—2016《食品中过氧化值的测定》中第一法 滴定法,每间隔7 d测定1次,前后56 d共测定9次,并重复3次取平均值。
1.3.5.3 挥发性成分检测分析
顶空固相微萃取:准确称取(5.00±0.001) g香椿风味油于20 mL固相微萃取顶空瓶中,密封后于40 ℃水浴中平衡15 min,插入经250 ℃老化后的50/30 μm DVB/CAR/PDMS萃取头,萃取40 min后取出萃取头,插入GC-MS进样口250 ℃解吸5 min,同时开始采集保留时间和色谱峰强度等相关数据。
GC条件:HP-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);载气He(纯度>99.999%),柱流速1 mL/min,无分流比;进样口温度250 ℃。程序升温:初温40 ℃,保持3 min;以2 ℃/min的速率升温至70 ℃,保持2 min;以5 ℃/min升至150 ℃,保持2 min,以10 ℃/min升至230 ℃。
MS条件:四极杆温度150 ℃,EI离子源温度230 ℃;辅助加热器温度250 ℃;扫描方式为全扫描,扫描范围m/z 40~800 u。
化合物定性与定量:将GC-MS检测到的挥发性成分的质谱图与GC-MS仪器内置的NIST17.LIB谱库中的质谱图进行比较,初步确定匹配度≥70%的化合物。在相同的色谱条件下分析同源系列的正构烷烃(C6~C30),计算出检测到的化合物的保留指数(retention index,RI),并将其与NIST数据库中同一毛细管柱的RI进行比较。将经过RI值比对后的峰作为确认,采用峰面积归一化法计算各组分的相对含量。
1.3.6 数据分析
试验数据采用Excel 2007软件进行初步处理,然后用SPSS 21.0软件进行数据显著性分析,最后采用Origin 8.6软件绘制图表。所有试验数据均以平均值±标准差计算,不同行小写字母表示样品差异显著(P<0.05)。每组实验至少重复3次。
如图1所示,随着温度的升高,含硫类挥发性成分的相对含量呈先增加后降低的趋势。在温度较低时,抑制了冻干香椿粉中含硫类挥发性成分的析出与扩散,导致其相对含量低。在50 ℃时,含硫类挥发性成分相对含量最高,为(73.19±0.56)%。当温度继续升高,加速了挥发性物质的散失,含硫类化合物热敏性强,易通过缩合反应、分子重排、热降解等反应形成衍生物[14]。综上考虑,选择50 ℃作为含硫类挥发性成分的最佳温度。
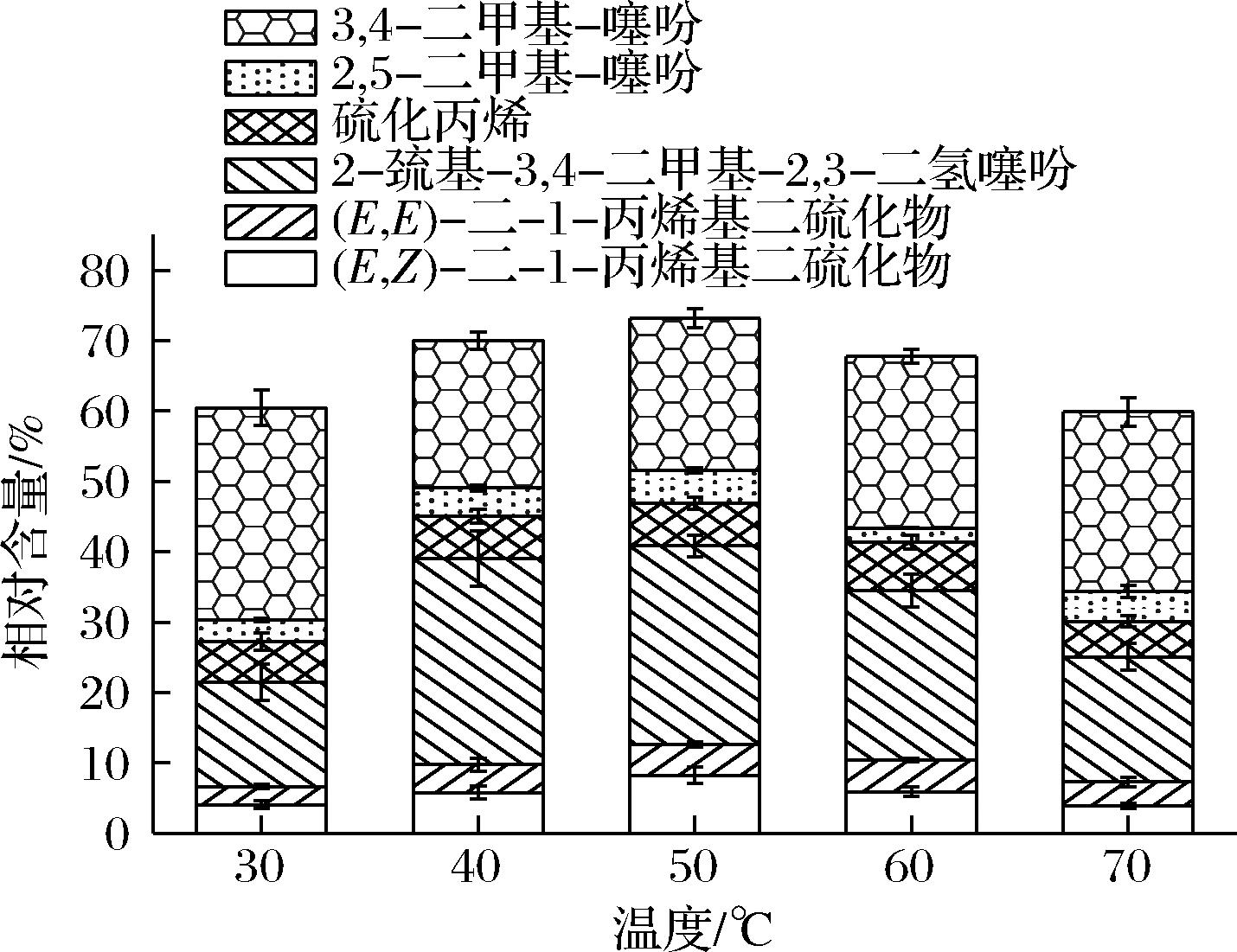
图1 超声温度对含硫类挥发性成分相对含量的影响
Fig.1 Effect of ultrasonic temperature on the relative contents of sulfur-containing volatile components
如图2所示,随着时间的延长,含硫类挥发性成分相对含量呈现先上升后下降的趋势,在超声时间为40 min时,含硫类挥发性成分相对含量达到最大值,为(73.39±0.76)%。当超声时间在20~40 min,由于超声时间过短,使含硫类挥发性成分不能充分溶解释放;当超声时间>40 min时,含硫类挥发性成分在长时间作用下发生分解散失使其相对含量降低。郭晓蕾等[15]采用超声波辅助萃取肉桂精油,超声时间和超声密度对肉桂精油提取率的影响规律,与本试验结果相符合。故综合考虑,确定超声提取最佳时间为40 min。
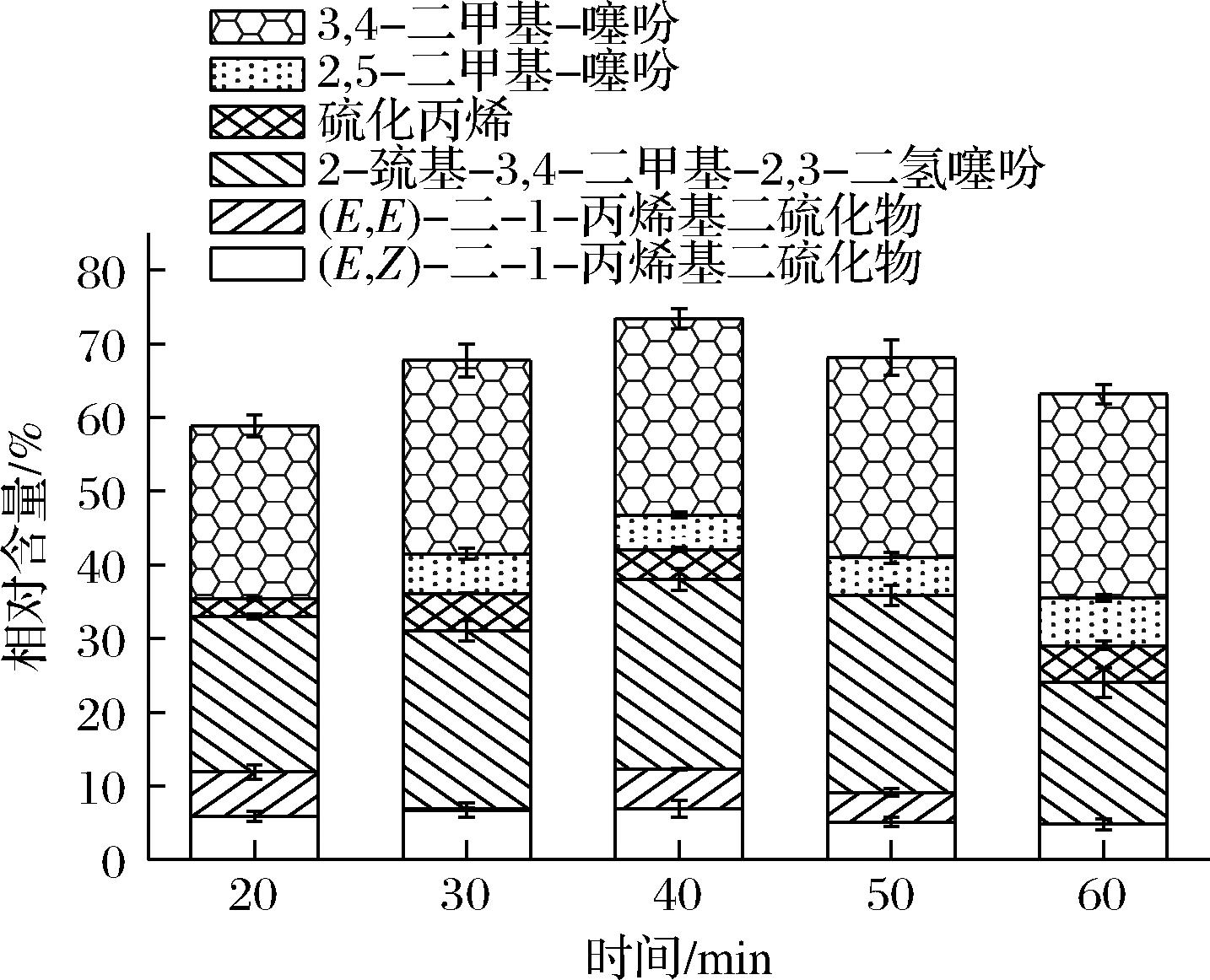
图2 超声时间对含硫类挥发性成分相对含量的影响
Fig.2 Effect of ultrasonic time on the relative contents of sulfur-containing volatile components
如图3所示,随着超声功率由150 W增加至240 W,含硫类挥发性成分相对含量呈上升趋势,这是因为香椿特征含硫风味化合物的形成是一种酶促反应[16],随着超声功率的增大,超声波的空化作用也增大,使细胞迅速破碎[17],增加了香椿风味酶的酶促反应,从而使含硫类挥发性成分相对含量增加。当功率为240 W时,相对含量达到最大(75.12±0.45)%,继续增大超声功率,相对含量出现下降趋势,可能由于超声功率过大,引起空化作用增强,风味酶结构遭到破坏,导致含硫类风味形成受阻[18]。综上,选取240 W作为超声提取最佳功率。
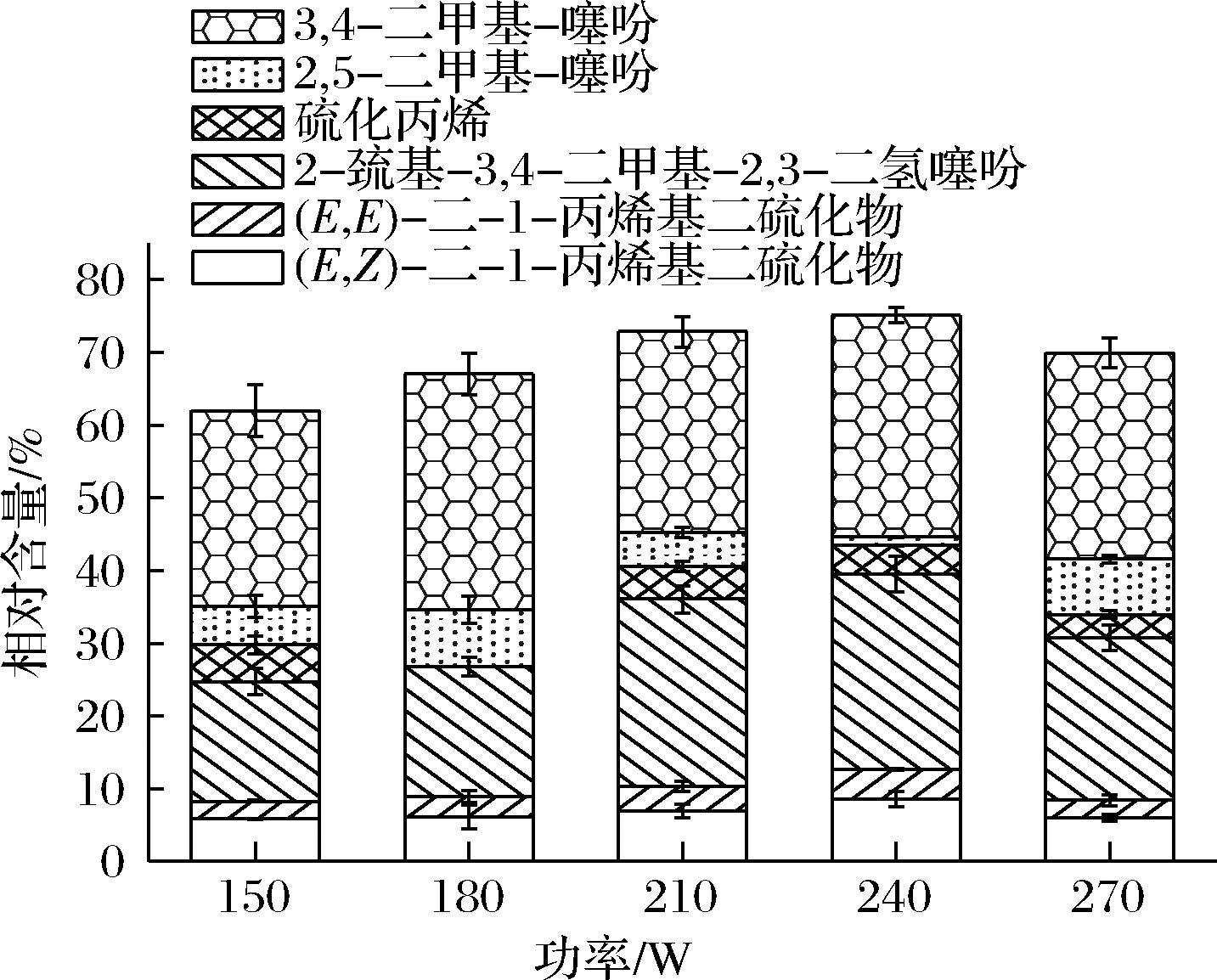
图3 超声功率对含硫类挥发性成分相对含量的影响
Fig.3 Effect of ultrasonic power on the relative contents of sulfur-containing volatile components
由表2直观分析可以看出,影响香椿风味油含硫类挥发性成分相对含量的因素主次顺序依次为A(超声温度)>B(超声时间)>C(超声功率)。由表3方差分析可知,超声温度对含硫类挥发性成分相对含量具有极显著影响(P<0.01);超声时间和超声功率对含硫类挥发性成分相对含量均有显著影响(P<0.05)。获得最高含硫类挥发性成分相对含量的理论最佳工艺条件组合为A2B3C2(M号),即提取温度50 ℃,提取时间50 min,提取功率240 W,香椿风味油中含硫类挥发性成分相对含量可能是最高的。为验证正交试验的预测结果,特将M号与正交试验表中含硫类挥发性成分相对含量较高的6号和4号进行了重复对比试验,试验结果是M号含硫类挥发性成分相对含量为(78.05±0.12)%,6号为(75.89±0.22)%,4号为(75.09±0.18)%,M号试验的含硫类挥发性成分相对含量确实是最高的,说明正交试验预测的准确性。因此,香椿风味油含硫类挥发性成分的最佳制备工艺确定为在50 ℃、240 W的条件下提取50 min,含硫类挥发性成分释放更完全。
表2 超声辅助提取正交试验结果
Table 2 Results of ultrasonic-assisted extraction orthogonal experiment
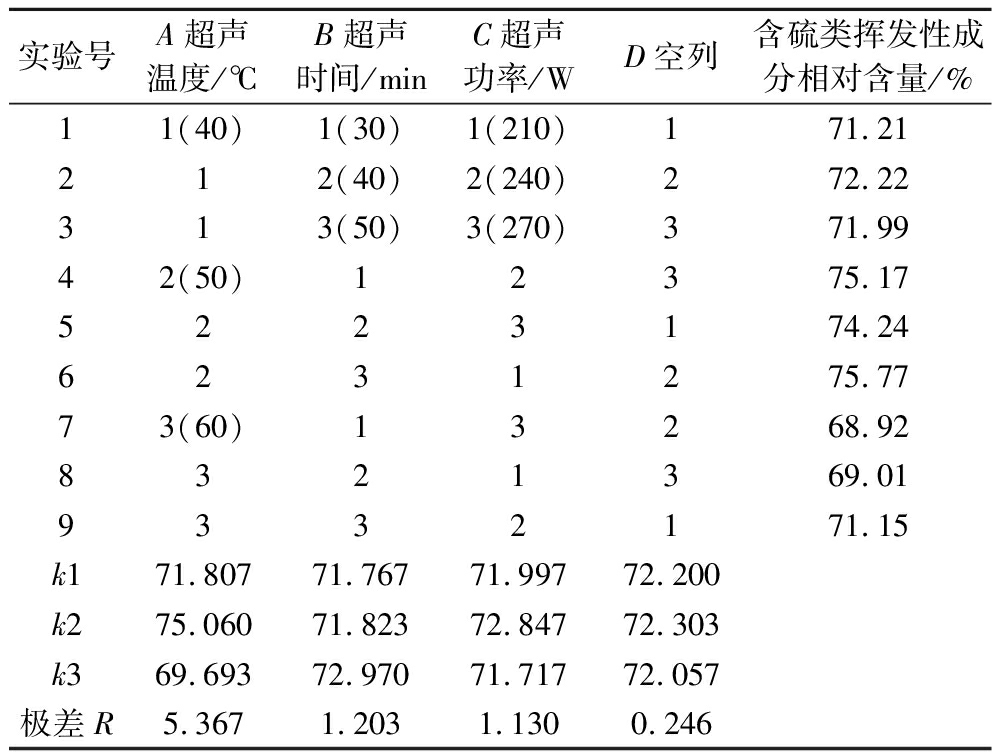
实验号A超声温度/℃B超声时间/minC超声功率/WD空列含硫类挥发性成分相对含量/%11(40)1(30)1(210)171.21212(40)2(240)272.22313(50)3(270)371.9942(50)12375.175223174.246231275.7773(60)13268.928321369.019332171.15k171.80771.76771.99772.200k275.06071.82372.84772.303k369.69372.97071.71772.057极差R5.3671.2031.1300.246
表3 正交试验结果方差分析
Table 3 Result of variance analysis
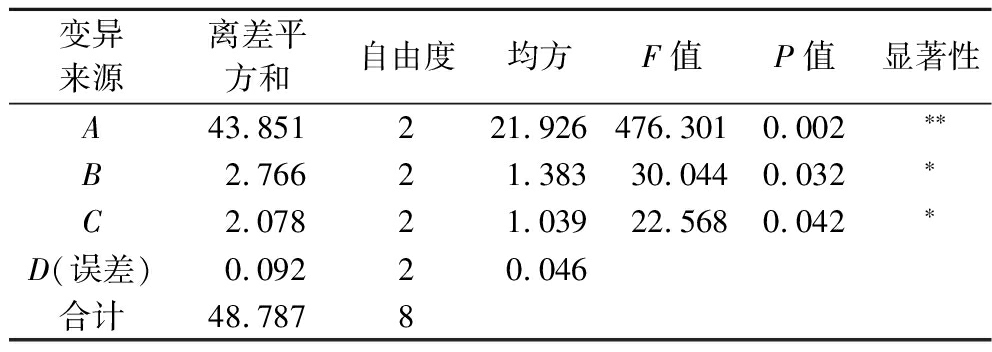
变异来源离差平方和自由度均方F值P值显著性A43.851221.926476.3010.002∗∗B2.76621.38330.0440.032∗C2.07821.03922.5680.042∗D(误差)0.09220.046合计48.7878
注:*代表差异显著(P<0.05),**代表差异极显著(P<0.01)。
2.5.1 香椿风味油在不同贮藏温度下酸价的变化
酸价是对化合物(例如脂肪酸)或混合物中游离羧酸基团数量的一个计量标准,是脂肪中游离脂肪酸含量的标志,酸价越小,说明油脂质量品质越好[19]。由图4可知,香椿风味油初始酸价只有(0.18±0.02) mg/g,在4、25、40、50、60 ℃条件下经过56 d的持续高温氧化后酸价分别升高到(0.26±0.01)、(0.30±0)、(0.56±0.02)、(1.08±0.03)、(1.17±0.07) mg/g。随着时间的延长,香椿风味油的酸价逐渐升高,尤其是在加热条件下,升高的速度更快。这可能是因为油脂在贮藏期间,在微生物、水和热的作用下发生缓慢水解反应,产生游离脂肪酸,在持续高温的影响下脂肪酶的活性提高,加速脂肪分解,从而积累游离脂肪酸,使酸价升高[20]。
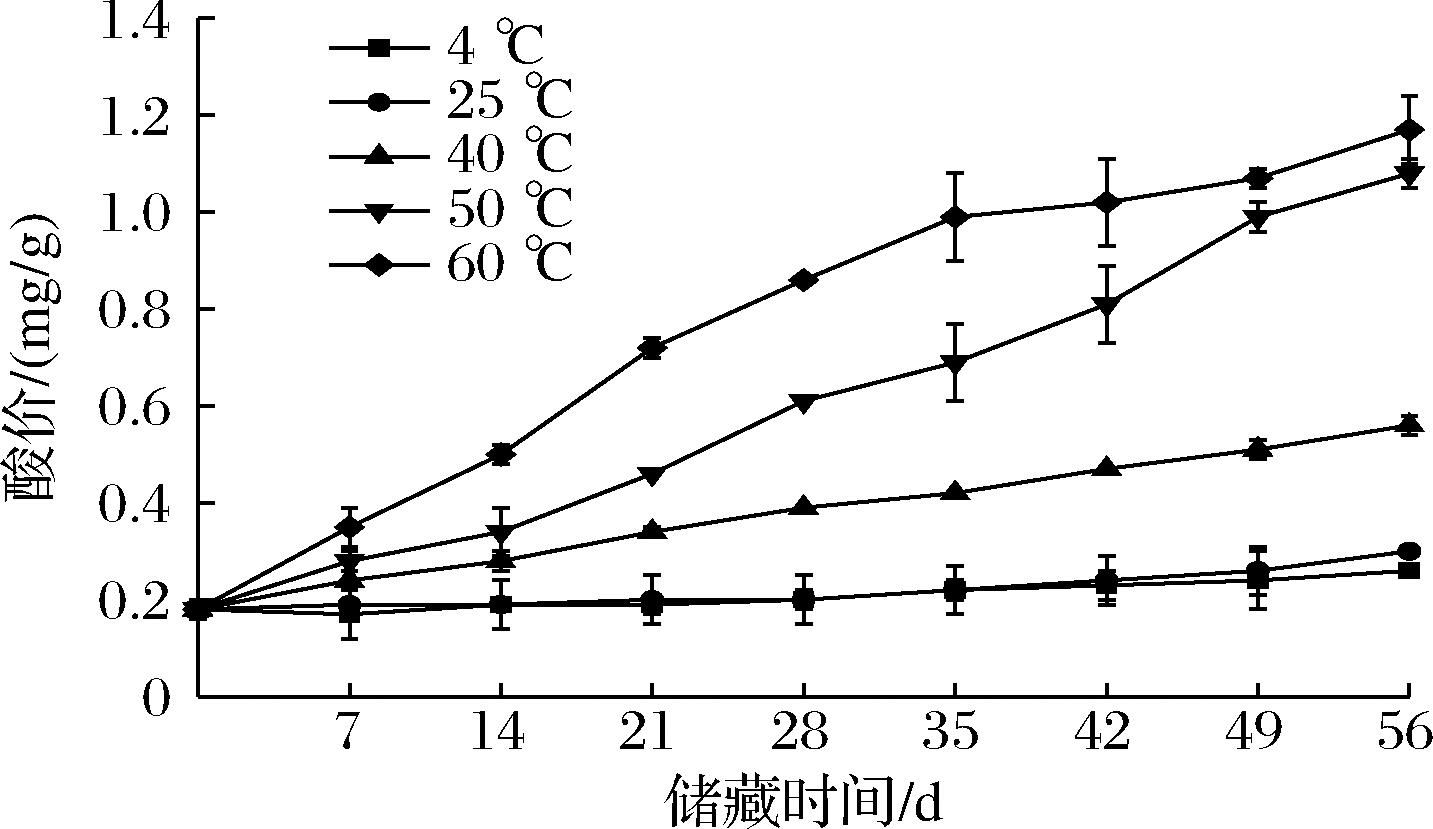
图4 香椿风味油在不同贮藏温度下酸价变化曲线
Fig.4 Acidity value of T. sinensis flavor oil at different storage temperatures
2.5.2 香椿风味油在不同贮藏温度下POV的变化
POV是衡量油脂酸败程度的指标,在贮藏过程中,油脂中不饱和脂肪酸被氧化形成活性很强的过氧化物,POV越大表示油脂的氧化酸败程度越严重[21]。由图5可知,香椿风味油在不同温度条件下POV随贮藏时间的延长而增加。温度是影响油脂氧化的一个关键因素,温度越高,香椿风味油的POV越高;低温条件下POV增加幅度较缓,高温条件下POV上升较快。例如,4 ℃条件下经56 d氧化后,POV从最初的(2.32±0.17) mmol/kg升高到(2.83±0.36) mmol/kg,而60 ℃时最终POV却高达(55.14±0.75) mmol/kg,已经严重超过了国标的规定范围,可能是因为浸提玉米油中含有不饱和脂肪酸,在高温与长时间接触空气的情况下,不饱和脂肪酸中的大量双键会不断发生氧化,待双键完全消耗才会终止氧化[22]。
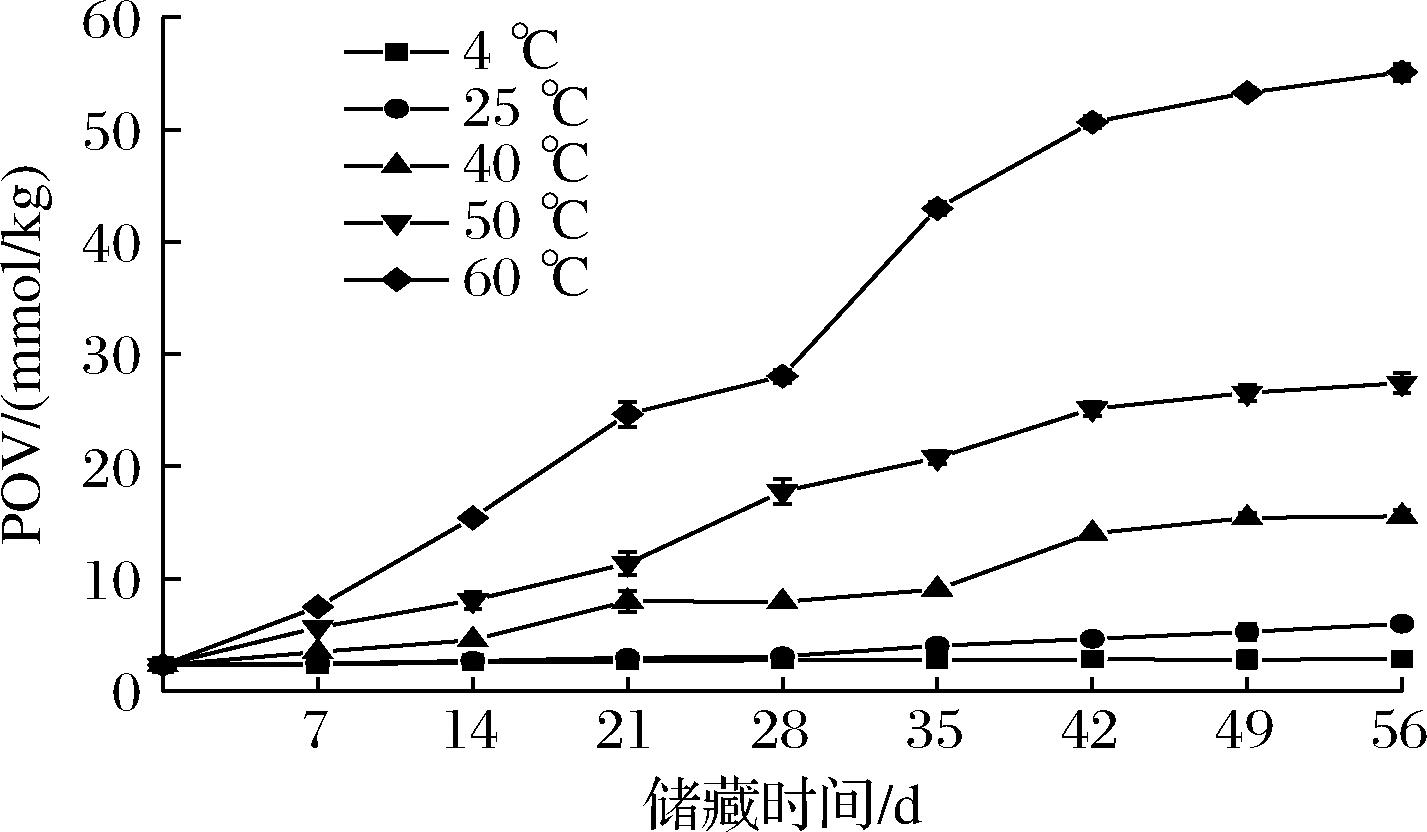
图5 香椿风味油在不同贮藏温度下POV变化曲线
Fig.5 POV of T. sinensis flavor oil at different storage temperatures
2.5.3 香椿风味油挥发性成分变化
基于贮藏过程中酸价和POV的变化情况,为了更加明显地看到香椿风味油的变化规律,本文重点比较分析香椿风味油在4、60 ℃贮藏条件下挥发性成分变化情况,并比较初始香椿风味油和第56天后挥发性成分的组成变化,结果如图6和表4所示。香椿风味油主要挥发性成分是含硫类物质和醛类物质,但对其特征风味起决定性作用的却是含硫类化合物。含硫类化合物具有较低的感知阈值和较高的气味强度,呈现类似于大蒜的辛辣、洋葱、硫磺等刺激性味道,不仅是香椿香味独特的重要贡献者,也是目前新鲜香椿中公认的重要挥发性物质[23-24]。而醛类物质作为脂肪分解或氧化产物,通常表现出脂肪香味,是油脂风味物质的主要构成部分,广泛存在于大豆油、玉米油等油脂中[25]。
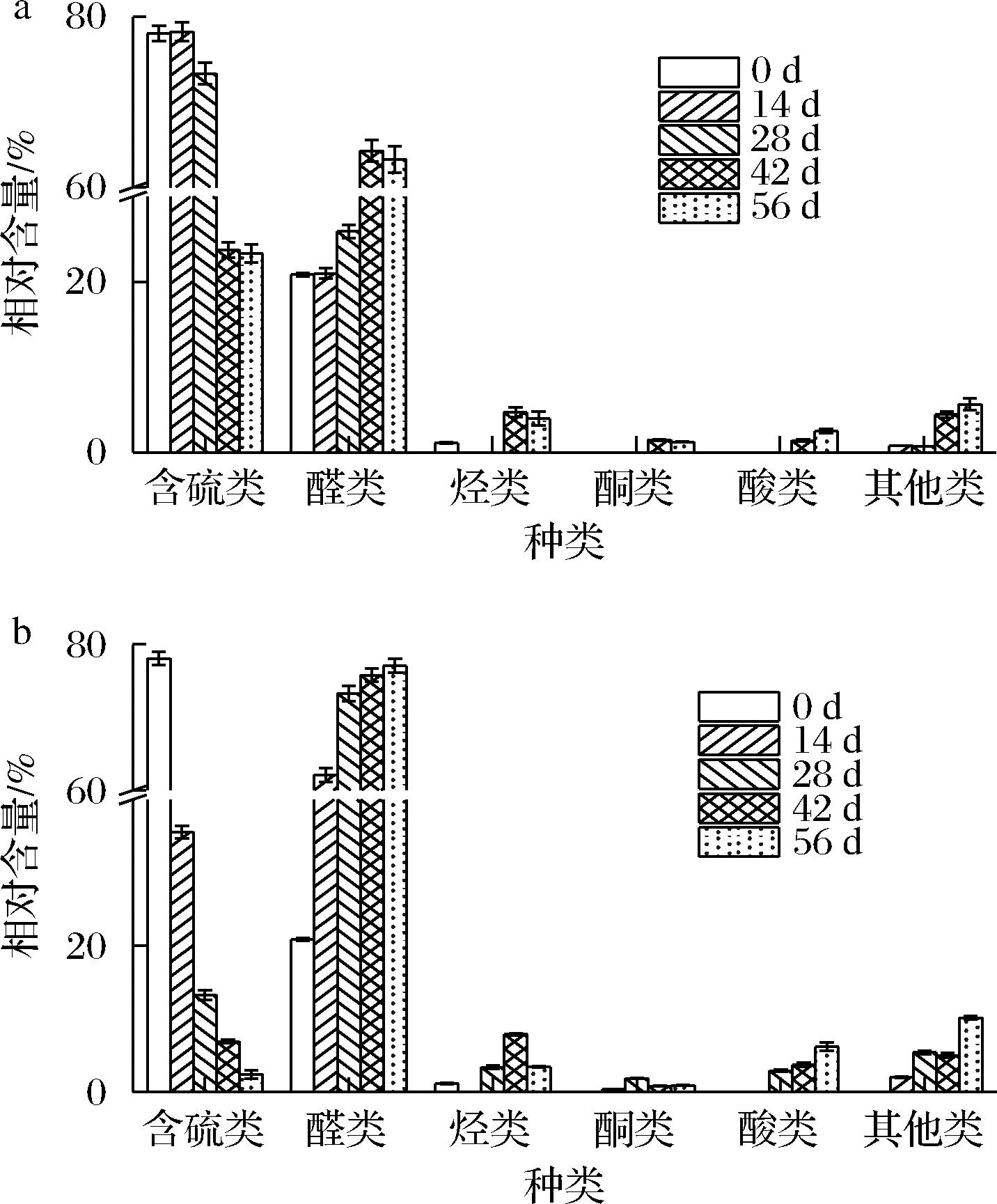
a-4 ℃;b-60 ℃
图6 香椿风味油4 ℃和60 ℃贮藏条件下 挥发性成分变化规律
Fig.6 Volatile components of T. sinensis flavor oil stored at 4 ℃ and 60 ℃
表4 香椿风味油挥发性成分组成
Table 4 The volatile components of T. sinensis flavor oil

保留时间/min挥发性成分化学式相对含量/%第0天4 ℃第56天60 ℃第56天RI计算值/参考值2.050硫化丙烯C3H6S14.22±1.14a1.02±0.00b-600/6065.780己醛C6H12O9.61±0.98b10.29±1.24a10.94±0.87a801/8018.0402-己烯醛C6H10O1.92±0.05a0.06±0.00c0.50±0.00b850/8508.184(E)-2-己烯醛C6H10O7.66±0.33a2.33±0.02b2.16±0.34b861/86510.4443,4-二甲基-噻吩C6H8S25.93±1.21a15.74±1.21b2.41±0.56c901/908
续表4

保留时间/min挥发性成分化学式相对含量/%第0天4 ℃第56天60 ℃第56天RI计算值/参考值13.766(E)-2-庚烯醛C7H12O1.65±0.23c13.96±0.36b16.70±1.21a954/95615.966己酸C6H12O2-1.95±0.24b5.67±0.58a989/98216.2892-正戊基呋喃C9H14O-4.98±0.75b9.56±0.57a994/99416.569(E,E)-2,4-庚二烯醛C7H10O--0.36±0.00999/99717.003辛醛C8H16O-0.66±0.06a1.13±0.08a1 004/1 00520.528丁苯C10H14-1.45±0.00a1.29±0.20a1 056/1 05820.876(E)-2-辛烯醛C8H14O-5.98±0.00b8.55±0.89a1 061/1 06321.8533,5-辛烷-2-酮C8H12O-0.34±0.00-1 076/1 07623.765壬醛C9H18O-4.93±0.25a6.22±0.00a1 105/1 10523.9693-丙基环己烯C9H161.12±0.12--1 110/-23.977(E,E)-2,4-辛二烯醛C8H12O--0.60±0.131 110/1 11524.207(E,E)-二-1-丙烯基二硫化物C6H10S23.15±0.24--1 115/1 12924.419(E,Z)-二-1-丙烯基二硫化物C6H10S212.51±0.88a1.60±0.07b-1 120/1 12424.7852-巯基-3,4-二甲基-2,3-二氢噻吩C6H10S222.23±1.56a4.96±0.51b-1 129/1 14926.152戊苯C11H16-1.88±0.36a1.64±0.00a1 158/1 16026.382(E)-2-壬烯醛C9H16O--3.36±0.641 163/1 15028.242癸醛C10H20O--0.38±0.011 206/1 20628.4962,4-壬二烯醛C9H14O--0.87±0.021 214/1 21328.514(E,E)-2,4-壬二烯醛C9H14O-0.84±0.05a1.73±0.15a1 214/1 21528.811反式-1-苯基-1-戊烯C11H14-0.36±0.00-1 222/-30.196(E)-2-癸烯醛C10H18O-4.82±0.00a5.84±0.59a1 262/1 26031.249(E,Z)-2,4-癸二烯醛C10H16O-5.61±0.69a4.67±0.21a1 293/1 29631.946(E,E)-2,4-癸二烯醛C10H16O-13.81±0.86a13.02±0.85a1 316/1 31733.1351-苯基-1-戊酮C11H14O-0.29±0.00a0.34±0.00a1 356/1 36433.178丁香酚C10H12O2-0.67±0.03a0.57±0.13a1 358/1 35836.0071-苯基-1-己酮C12H16O-0.62±0.06a0.53±0.05a1 459/-36.143辛苯C14H22-0.15±0.00a0.29±0.00a1 464/-40.994癸苯C16H26-0.56±0.01a0.49±0.00a1 955/1 96344.069正十六烷酸C16H32O2-0.14±0.00a0.18±0.05a1 677/-
由图6可知,在4、60 ℃贮藏条件下,香椿风味油中含硫类物质的相对含量随贮藏时间的延长呈下降趋势,醛类、烃类、酮类、酸类、其他类物质的相对含量呈上升趋势,尤其是醛类物质上升最为明显。由图4-a可知,在4 ℃贮藏条件下,前28 d内香椿风味油风味物质变化较小,主要以含硫类物质和醛类物质为主,相对含量分别维持在75%左右和20%左右;但后28 d含硫类物质相对含量降到23%左右,醛类物质相对含量上升到63%左右。由图4-b可知,在60 ℃贮藏条件下,香椿风味油中含硫类物质的相对含量下降趋势明显,由最初的(78.04±0.89)%下降到(2.41±0.56)%;而醛类物质相对含量呈现明显上升趋势,由最初的(20.84±0.22)%上升到(77.03±0.89)%;烃类、酮类、酸类、其他类物质相对含量也均增加。
由表4所示,在第0天时,香椿风味油中检测到的具有香椿特征香气的含硫类物质是(E,Z)-二-1-丙烯基二硫化物、(E,E)-二-1-丙烯基二硫化物、2-巯基-3,4-二甲基-2,3-二氢噻吩,相对含量合计高达(37.89±0.75)%;在4 ℃贮藏第56天时仅剩(6.56±0.28)%,而在60 ℃贮藏第56天时未检测到,可能因为香椿中2-巯基-3,4-二甲基-2,3-二氢噻吩、二(1-丙烯基)硫醚、二丙烯基硫醚等含硫类化合物易挥发、结构不稳定。在第0天时,香椿风味油中检测到的醛类物质主要是己醛(9.61±0.98)%和(E)-2-己烯醛(7.66±0.33)%,而在4 ℃和60 ℃贮藏第56天时,醛类物质主要是己醛、(E)-2-庚烯醛、(E,E)-2,4-癸二烯醛。随着贮藏时间的延长,香椿风味油还检测到酮类、酸类和呋喃类物质,这可能是因为油脂在贮藏过程中发生一系列氧化酸败反应,产生小分子的醛、酮、酸等挥发性物质[26],这与POV的变化趋势一致。
风味是食品感官质量的重要指标,是食品能否为消费者接受的主要因素之一,也是食品企业占领市场、创造高利润的竞争核心。但挥发性成分在加工及贮藏过程中易发生变化,研究原料及加工制品的挥发性成分对农产品的生产和应用具有一定的指导作用。综上所述,含硫类和醛类物质作为香椿风味油的主要挥发性成分,特别是含硫类物质对香椿风味油的风味品质起决定性作用。贮藏温度对香椿风味油挥发性成分影响显著,温度越高,含硫类物质显著下降,醛类物质显著上升,风味损失和转化严重。本试验主要是对香椿风味油在不同贮藏温度和时间下的挥发性成分进行检测分析,但关于如何抑制这种氧化酸败有待进一步研究。
通过单因素试验和正交试验优化可以得出影响香椿风味油含硫类挥发性成分相对含量的主次顺序为:超声温度>超声时间>超声功率,确定的最优工艺参数为超声温度50 ℃,超声时间50 min,超声功率240 W,利用此工艺生产的香椿风味油中含硫类挥发性成分的相对含量为(78.05±0.12)%。随着贮藏时间的延长,香椿风味油的酸价和POV逐渐升高,且贮藏温度越高,上升趋势越明显;含硫类和醛类物质作为香椿风味油的主要挥发性成分,尤其是含硫类物质对香椿风味油的风味品质起关键性作用,贮藏温度越高,含硫类物质显著下降,醛类物质显著上升,风味损失和转化严重。本实验不仅提供了一种高效制备香椿含硫类挥发性成分的加工方法,而且对香椿风味油贮藏过程中的品质变化进行检测分析,以期为含硫类物质在风味形成、后期调香技术及商品化应用等方面提供重要的技术支撑。
[1] EDMONDS J M, STANIFORTH M.Plate 348.Toona sinensis[J].Curtis’s Botanical Magazine, 1998, 15(3):186-193.
[2] YU W J, CHANG C C, KUO T F, et al.Toona sinensis Roem leaf extracts improve antioxidant activity in the liver of rats under oxidative stress[J].Food and Chemical Toxicology, 2012, 50(6):1860-1865.
[3] PENG W, LIU Y J, HU M B, et al.Toona sinensis:A comprehensive review on its traditional usages, phytochemisty, pharmacology and toxicology[J].Revista Brasileira De Farmacognosia, 2019, 29(1):111-124.
[4] LIAO J W, YEH J Y, LIN Y C, et al.Mutagenicity and safety evaluation of water extract of fermented Toona sinensis Roemor leaves[J].Journal of Food Science, 2009, 74(1):T7-T13.
[5] 王赵改, 陈丽娟, 张乐, 等.不同采收期红油香椿营养成分和抗氧化活性分析[J].食品科学, 2015, 36(4):158-163.
WANG Z G, CHEN L J, ZHANG L, et al.Nutritional components and antioxidant activity of Toona sinensis buds at different harvesting periods[J].Food Science, 2015, 36(4):158-163.
[6] MU R M, WANG X R, LIU S X, et al.Rapid determination of volatile compounds in Toona sinensis (A.Juss.) Roem.by MAE-HS-SPME followed by GC-MS[J].Chromatographia, 2007, 65(7):463-467.
[7] 史冠莹, 王晓敏, 赵守涣, 等.不同产地香椿嫩芽主要营养成分、活性物质及挥发性成分分析[J].食品工业科技, 2019, 40(3):207-215;223.
SHI G Y, WANG X M, ZHAO S H, et al.Analysis of main nutrients, active ingredients and volatile components of Toona sinensis buds from different regions[J].Science and Technology of Food Industry, 2019, 40(3):207-215;223.
[8] YANG W X, CADWALLADER K R, LIU Y P, et al.Characterization of typical potent odorants in raw and cooked Toona sinensis (A.Juss.) M.Roem.by instrumental-sensory analysis techniques[J].Food Chemistry, 2019, 282:153-163.
[9] LIU C J, ZHANG J, ZHOU Z K, et al.Analysis of volatile compounds and identification of characteristic aroma components of (A.Juss.) Roem using GC-MS and GC-O[J].Food and Nutrition Sciences, 2013, 4(3):305-314.
[10] BLOCK E, PUTMAN D, ZHAO S H.Allium chemistry:GC-MS analysis of thiosulfinates and related compounds from onion, leek, scallion, shallot, chive, and Chinese chive[J].Journal of Agricultural and Food Chemistry, 1992, 40(12):2431-2438.
[11] 任西营. 食品风味分析技术研究进展[J].中国食品添加剂, 2014(7):173-178.
REN X Y.The research progress of food flavor analysis techniques[J].China Food Additives, 2014(7):173-178.
[12] 谢诚, 欧昌荣, 汤海青, 等.食品中挥发性风味成分提取技术研究进展[J].核农学报, 2015, 29(12):2366-2374.
XIE C, OU C R, TANG H Q, et al.Progress on food volatile compounds extraction techniques[J].Journal of Nuclear Agricultural Sciences, 2015, 29(12):2366-2374.
[13] 王赵改, 徐志民, 蒋鹏飞, 等.一种基于双相浸提的叶菜类香辛植物调味油制备工艺.中国:CN111700124B[P].2023-05-16.
WANG Z G, XU Z M, JIANG P F, et al.A preparation process of spice plant flavoring oil from leaf vegetables based on two-phase extraction. China:CN111700124B[P].2023-05-16.
[14] ZHAI X T, GRANVOGL M.Characterization of the key aroma compounds in two differently dried Toona sinensis (A.Juss.) Roem.by means of the molecular sensory science concept[J].Journal of Agricultural and Food Chemistry, 2019, 67(35):9885-9894.
[15] 郭晓蕾, 陈刚.超声波辅助萃取肉桂精油的研究[J].现代食品科技, 2009, 25(12):1431-1433;1441.
GUO X L, CHEN G.Ultrasonic-assisted extraction of Cinamon oil[J].Modern Food Science and Technology, 2009, 25(12):1431-1433;1441.
[16] LI J X, EIDMAN K, GAN X W, et al.Identification of (S, S)-γ-glutamyl-(cis-S-L-propenyl) thioglycine, a naturally occurring norcysteine derivative, from the Chinese vegetable Toona sinensis[J].Journal of Agricultural and Food Chemistry, 2013, 61(31):7470-7476.
[17] 宋国胜, 胡松青, 李琳.超声波技术在食品科学中的应用与研究[J].现代食品科技, 2008, 24(6):609-612.
SONG G S, HU S Q, LI L.Researches and applications of ultrasonic technology in food industry[J].Modern Food Science and Technology, 2008, 24(6):609-612.
[18] WANG B, ATUNGULU G G, KHIR R, et al.Ultrasonic treatment effect on enzymolysis kinetics and activities of ACE-inhibitory peptides from oat-isolated protein[J].Food Biophysics, 2015, 10(3):244-252.
[19] ZHANG W L, LI N, FENG Y Y, et al.A unique quantitative method of acid value of edible oils and studying the impact of heating on edible oils by UV-Vis spectrometry[J].Food Chemistry, 2015, 185:326-332.
[20] 王旭, 赵月, 李婷婷, 等.天然抗氧化剂对玉米油稳定性的影响[J].食品科学, 2018, 39(16):7-12.
WANG X, ZHAO Y, LI T T, et al.Influence of natural antioxidants on the stability of corn oil[J].Food Science, 2018, 39(16):7-12.
[21] 唐瑞丽, 袁先雯, 冯燕玲, 等.食用大豆油储藏过程中品质变化的预测[J].食品科学, 2016, 37(18):256-261.
TANG R L, YUAN X W, FENG Y L, et al.Prediction of the quality changes of soybean oil during storage[J].Food Science, 2016, 37(18):256-261.
[22] 麻琳, 宋国辉, 孙强, 等.造粒对芝麻盐贮藏稳定性、风味的影响及其货架期预测模型的建立[J].食品工业科技, 2020, 41(20):26-32.
MA L, SONG G H, SUN Q, et al.Effect of granulation on the storage stability and flavour of sesame salt and establishment of shelf-life prediction model[J].Science and Technology of Food Industry, 2020, 41(20):26-32.
[23] WANG Z G, JIANG P F, ZHAO L L, et al.Concentrating sulphur-containing flavour from Toona sinensis shoots using corn oil with and without aqueous dispersion[J].International Journal of Food Science and Technology, 2022, 57(3):1644-1653.
[24] ZHAI X T, GRANVOGL M.Key odor-active compounds in raw green and red Toona sinensis (A.Juss.) Roem.and their changes during blanching[J].Journal of Agricultural and Food Chemistry, 2020, 68(27):7169-7183.
[25] 钟海雁, 黄永辉, 刘宁露, 等.油脂气味的研究进展[J].中国油脂, 2006, 31(7):12-15.
ZHONG H Y, HUANG Y H, LIU N L, et al.Study advance in odor of oils[J].China Oils and Fats, 2006, 31(7):12-15.
[26] 李文娟, 吴彦, 李从虎, 等.油脂热加工产生醛类的机理及影响因素研究进展[J].中国粮油学报, 2019, 34(8):139-146.
LI W J, WU Y, LI C H, et al.Research progress on the mechanism and influencing factors of aldehydes production in oil hot work[J].Journal of the Chinese Cereals and Oils Association, 2019, 34(8):139-146.