干腌火腿以其独特的质地和风味在世界各地广受欢迎,而干腌火腿在不同年份之间有明显的差异[1-2]。蛋白质降解是干腌火腿中非常重要的组成部分,现有研究表明,蛋白质的变化会对最终产品产生显著影响,其中NaCl含量、水分含量、pH值和温度是最突出的因素[3]。蛋白质降解是在内源酶(如组织蛋白酶、钙蛋白酶、二肽酶和三肽酶等)共同作用下[4],由内肽酶启动,导致蛋白质分解为蛋白质片段和多肽。这些多肽可被外肽酶进一步水解,产生更小的肽和游离氨基酸,这些小肽因其特殊的氨基酸排列顺序和部分特殊结构而呈现出一定的生物活性,例如血管紧张素转换酶抑制活性、抗氧化活性、抑菌活性、二肽基肽酶IV抑制活性等体内降压、降血糖或抗炎活性[5-10]。
抗菌肽(antimicrobial peptides, AMPs)是一类具有天然生物活性的多肽,自1972年,BOMAN等[11]通过诱导惜古比天蚕分离出的第一例抗菌肽-天蚕素(cecropins)开始,目前已经发现了3 000余种抗菌肽。抗菌肽来源广泛,主要包括动物源、植物源和微生物源这3种,而动物源抗菌肽主要源自昆虫、哺乳动物和海洋生物等 [12],在食品领域中,抗菌肽更多来自于牛奶[13]、虾[14]、辣椒籽[15]等,肉源的抗菌肽相对较少[16],并且大多存在于肉制品中[17-18]。郑锦晓[19]研究了3种中国传统干腌火腿中粗多肽抗菌活性,在宣威火腿中筛分出了抗菌肽并鉴定了其结构;CASTELLANO等[20]对西班牙干腌火腿进行提取分离,获得了一个对李斯特菌有效的抗菌肽RHGYM。研究者们大多数是通过抗菌活性逐步分离纯化,最终得到一个或多个具备优良性能的抗菌肽,较为单一。从火腿蛋白降解方面对抑菌性能进行分析不失是对火腿抗菌肽方面的补充,蔡音音通过此方法对鱼虾进行研究,并通过建构模型对抗菌肽进行预测[21]。本研究将以不同成熟期的西式干腌火腿作为研究对象,以蛋白降解指数和多肽氨基酸组成为因素,火腿粗肽的抑菌能力为指标,初步探究火腿蛋白降解与火腿粗肽抑菌能力的关系,为后续深入分析西式干腌火腿中抗菌肽性能与蛋白降解之间的关系提供理论基础。
干腌火腿,北京金美添公司,分别选取成熟时间为24月和30月火腿样品,从每个成熟期随机选取3条火腿,用无菌刀取其股二头肌(biceps femoris, BF)和半膜肌(semimembranosus, SM)部分各500 g,成熟期24月、30月对应的股二头肌和半膜肌样品分别记为24BF、24SM、30BF和30SM,真空封存4 ℃冷藏备用。
硫酸、Na2HPO4、NaH2PO4、甲醇、乙醇、消化片、盐酸、硼酸、三氯乙酸、异丙醇、邻苯二甲醛、十二烷基硫酸钠、四硼酸钠、β-巯基乙醇、胰酪蛋白胨,国药集团化学试剂有限公司;LB肉汤培养基、LB琼脂培养基、BHI肉汤培养基、琼脂,北京索莱宝公司。
1.2.1 水分含量与水分活度测定
水分活度测定:将去除表面氧化层的火腿样品取2 cm,切碎,平放在智能水分活度仪样品槽中进行分析。
水分含量测定:根据HARKOUSS等[3]的方法,将2~3 g样品在105 ℃的恒温箱中干燥至恒重。水分含量表示为水与总物质(TM)质量的比值,kgH2O/kgTM。
1.2.2 蛋白降解指数(proteolysis index, PI)的测定
总氮(total nitrogen, TN)测定:参考国标GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,称取火腿样品1.000 g至消化管中,再加入两片消化片和10 mL硫酸于消化炉进行消化。当消化炉温度达到420 ℃之后,继续消化1 h,冷却取出后采用自动凯氏定氮仪进行总氮含量的测定。
非蛋白氮(nonprotein nitrogen, NPN)测定:准确称取1 g火腿样品,加入质量分数15%的三氯乙酸(trichloroacetic acid,TCA)溶液溶解样品并定容至50.0 mL,混匀后静置20 min,过滤。吸取5.0 mL滤液,移入消化管中,消化及测定方法同总氮测定方法。PI的计算如公式(1)所示:
(1)
1.2.3 干腌火腿粗肽的提取
磷酸盐提取法:参考刑路娟[7]的实验方法,并略作修改:取干腌火腿样品50 g,组织捣碎后加入200 mL异丙醇,浸提2 h,纱布过滤,室温蒸发剩余异丙醇;加入200 mL pH=7.4磷酸缓冲液(0.02 mol/L),用无菌均质机600 r/min拍打4 min,于4 ℃静置1 h后,12 000×g离心20 min,取上清液过滤,再加入2倍体积乙醇溶液,4 ℃静置10 h后,12 000×g离心10 min,最后取上清液用0.45 μm滤膜过滤,旋蒸浓缩,冷冻干燥、称量,-20 ℃冰箱中保存。
盐酸提取法:参考CASTELLANO等[20]实验方法,并略作修改:取干腌火腿样品50 g,打碎后分别加入200 mL异丙醇,浸提2 h后纱布过滤,室温蒸发剩余异丙醇;加入200 mL 0.01 mol/L盐酸溶液,用无菌均质机,600 r/min拍打4 min,于4 ℃静置1 h后,12 000×g离心20 min,取上清液过滤,再加入2倍体积乙醇溶液,4 ℃静置10 h后,12 000×g离心10 min,最后取上清液用0.45 μm滤膜过滤,旋蒸浓缩,冷冻干燥、称量,-20 ℃冰箱中保存。
1.2.4 磷酸法提取实验条件优化
样品预处理条件相同,以乙醇添加量(1.5、2、2.5、3倍)和乙醇沉淀时间(4、10、20 h)为变量,以大肠杆菌抑菌率、单增李斯特菌抑菌率为评价指标进行单因素条件优化试验,得到较佳的干腌火腿粗肽提取工艺参数。
1.2.5 肽含量的测定
参考CHURCH等[22]的方法,并略作修改。配制质量浓度为1 mg/mL的粗肽液,取40 mg邻苯二甲醛溶于1.0 mL甲醇,依次加入25 mL 100 mmol/L硼砂,2.5 mL 20%(质量分数)十二烷基硫酸钠和100 μL β-巯基乙醇,用超纯水定容至50.0 mL,配制成邻苯二甲醛混合液;取100 μL待测样品与2.0 mL邻苯二甲醛混合液混合,在室温下反应2 min,用酶标仪测定其在340 nm下的吸光值。并以胰酪蛋白胨作为标准蛋白,配制等梯度浓度的溶液,测定其吸光值,绘制胰酪蛋白胨标准曲线后计算粗肽的含量。
1.2.6 大肠杆菌抑菌率测定
参考郑锦晓[19]的实验方法并略作修改。将菌种培养至对数生长期并用无菌生理盐水进行稀释,浓度调整为1×105 CFU/mL,按照1∶4(体积比),吸取细菌培养液100 μL至400 μL无菌PBS中,为对照组。实验管中分别加入100 μL细菌培养液,400 μL无菌多肽溶液,500 μL LB肉汤培养基,振荡培养(37 ℃,150 r/min,1 h)。随后对菌液进行梯度稀释,取1 mL菌液与20 mL的LB营养琼脂混匀,倾注在培养皿上,等待凝固后倒置37 ℃培养24 h,计算菌落总数。抑菌率的计算如公式(2)所示:
抑菌率![]()
(2)
式中:N1,对照管细菌菌落总数,CFU;N0,实验管细菌菌落总数,CFU。
1.2.7 单增李斯特菌抑菌率测定
参考郑锦晓[19]的实验方法并略作修改。将菌种培养至对数生长期并用无菌生理盐水进行稀释,浓度调整为1×105 CFU/mL,按照1∶4(体积比),吸取细菌培养液100 μL至400 μL无菌PBS中,为对照组。实验管中分别加入100 μL细菌培养液,400 μL无菌多肽溶液,500 μL BHI肉汤培养基,振荡培养(37 ℃,150 r/min,1 h)。随后对菌液进行梯度稀释,取1 mL菌液与20 mL的BHI营养琼脂混匀,倾注在培养皿上,等待凝固后倒置37 ℃培养24 h,计算菌落总数。抑菌率计算公式参考公式(2)。
1.2.8 西式干腌火腿粗肽的氨基酸组成分析
参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》的方法,称取50 mg肽样于水解管中,加入15 mL 6 mol/L盐酸后,放入-20 ℃冰箱冷冻20 min,重复抽真空-充入N2 3次后,在充N2状态下拧紧螺丝盖。将已封口的水解管放在(110±1) ℃的电热鼓风恒温箱内,水解22 h后,取出,冷却至室温后,将水解液过滤至50 mL容量瓶内,用少量超纯水多次冲洗水解管,水洗液移入同一50 mL容量瓶内,最后用超纯水定容至刻度,振荡混匀。准确吸取1.0 mL滤液移入试管中,用平行蒸发仪在50 ℃加热环境下减压干燥,干燥后残留物用1~2 mL水溶解,再减压干燥,最后蒸干。用1.0 mL pH 2.2、0.2 mol/L柠檬酸钠缓冲液溶解,振荡混匀,过0.22 μm滤膜后,转移至液相瓶,用氨基酸分析仪进行测定分析。
实验数据采用Excel进行处理,并采用Origin 2022b和SIMCA 14.1软件进行分析。所有实验均设置3个平行,结果用平均值±标准差表示。
由图1所示,不同成熟期的火腿样品的水分含量和水分活度较为接近。随着成熟时期不断延长,30月火腿样品的水分含量和水分活度与24月火腿样品没有明显差异(P>0.05),这是因为干腌火腿中的水分在盐渍阶段迅速降低后,在成熟阶段下降逐渐平缓导致的[23-24]。同时,在相同的成熟阶段,火腿的BF肌肉水水分活度显著大于SM肌肉(P<0.05),该结论与江玉霞[25]、RVIZ-RAM REZ等[26]的结果一致。分析该差异产生的原因,可能是由于SM表面没有皮下脂肪和猪皮的覆盖,直接暴露在空气中,导致水分下降速率高于BF。
REZ等[26]的结果一致。分析该差异产生的原因,可能是由于SM表面没有皮下脂肪和猪皮的覆盖,直接暴露在空气中,导致水分下降速率高于BF。
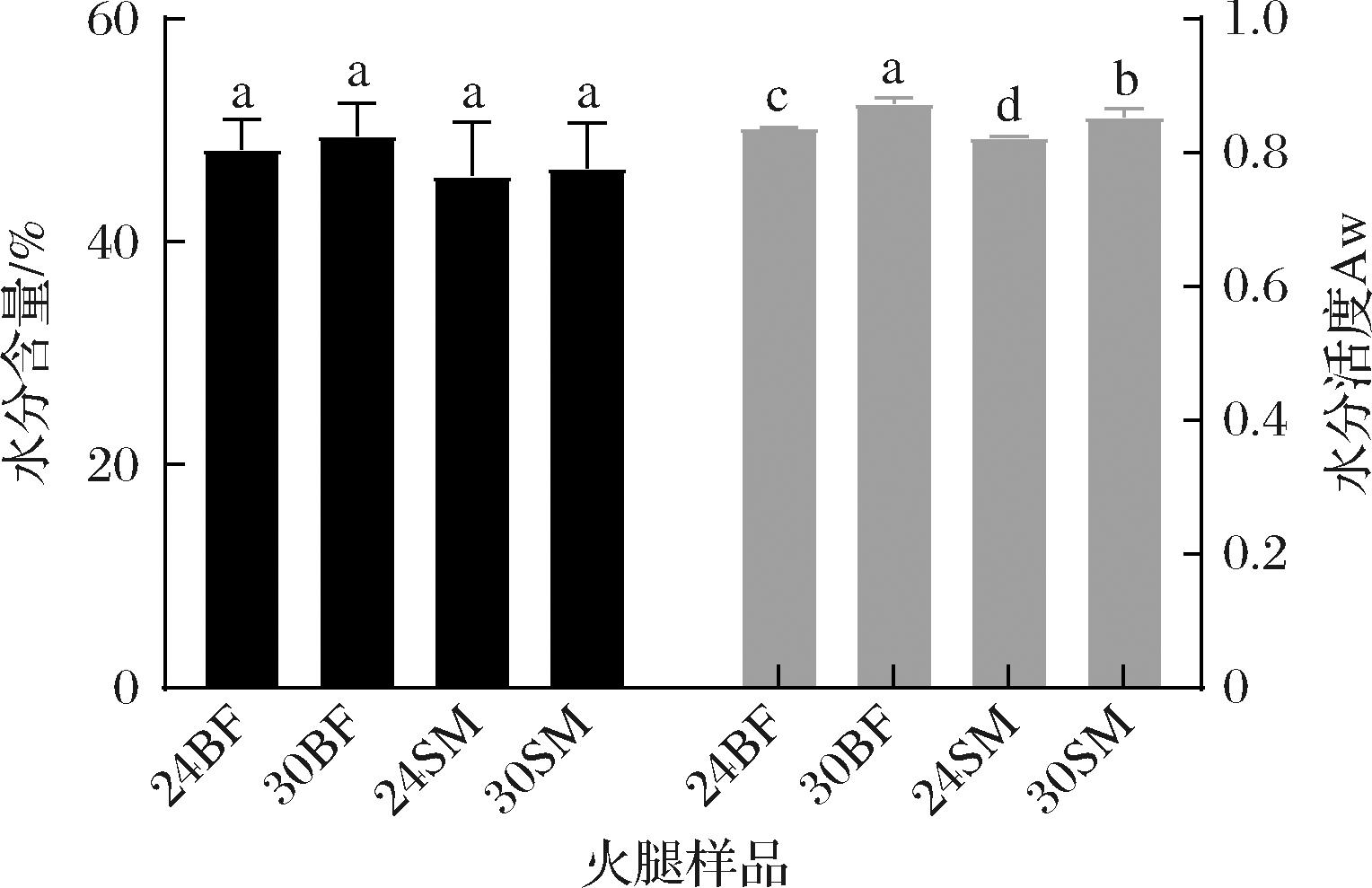
图1 不同成熟期干腌火腿的水分含量和水分活度
Fig.1 The moisture content and water activity of different ripen periods dry-cured ham
注:不同的小写字母表示显著性差异(P<0.05)(下同)。
由图2可知,火腿样品的PI随着成熟时期的增加变化的并不明显(P>0.05),这和HARKOUSS[3, 27]的结论相似,随着成熟时间的增加,火腿的PI值增加逐渐平缓。此外,图2中数据表明,所有时期的BF的PI值均高于SM(P<0.05)。这可能是因为BF肌肉中水分含量高于SM,内源蛋白酶的活性相对较高,从而导致BF肌肉的蛋白降解水平高于SM肌肉[3, 26-27]。
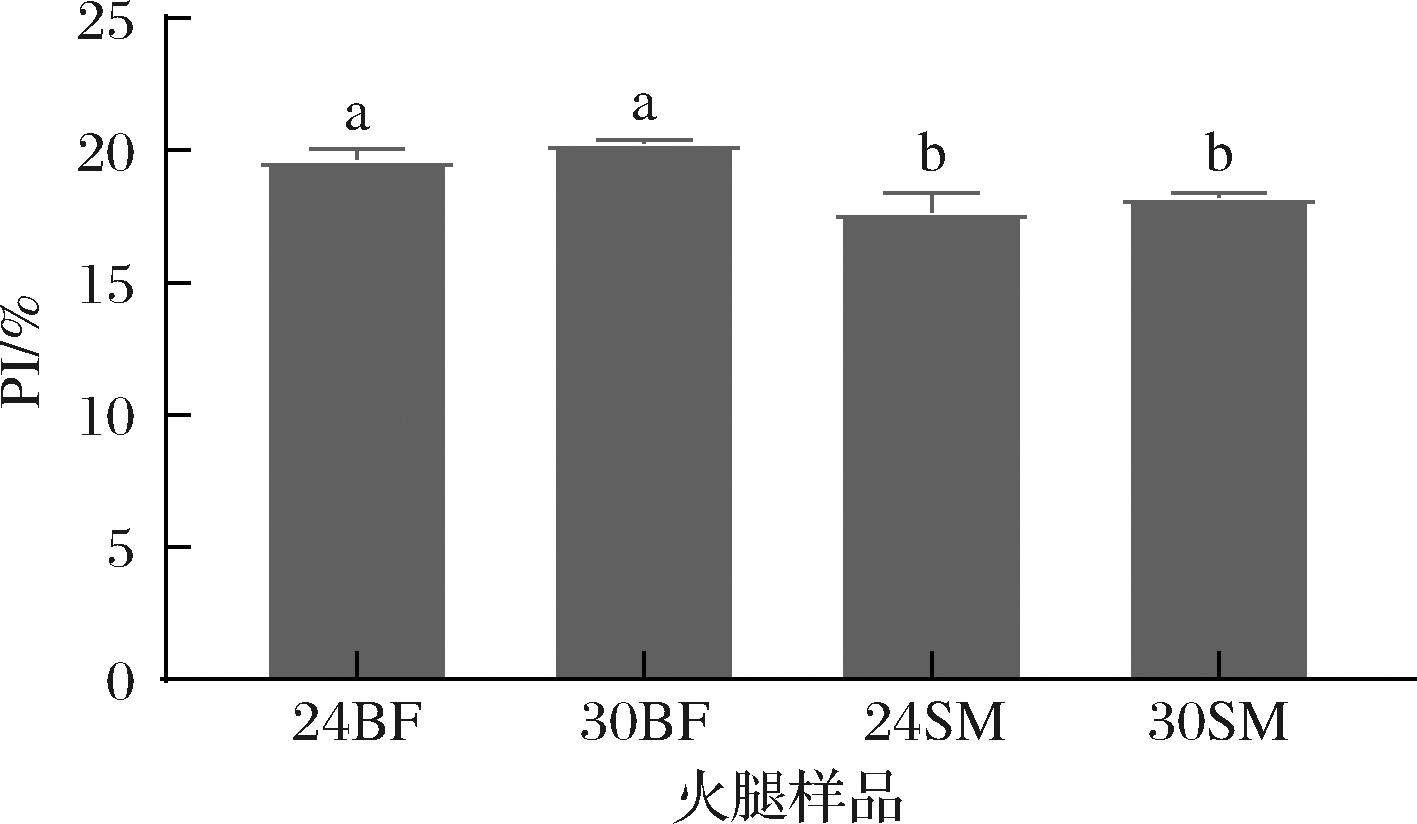
图2 不同成熟期干腌火腿的蛋白降解指数
Fig.2 The proteolysis index of different ripen periods dry-cured ham
2.3.1 不同乙醇添加量与乙醇沉淀时间对火腿粗肽抑菌率的影响
图3-a中的数据表明,粗肽提取过程中,随着乙醇用量的增加,粗肽的抑制率呈现先上升后下降的趋势,图3-b中乙醇的沉淀时间的影响亦是如此。分析该结果产生的原因,可能由于火腿粗肽的提取过程中,乙醇通过破坏大分子蛋白的水化膜,或者使蛋白质变性,从而降低蛋白质在水中的溶解度,引发蛋白质的聚集沉淀,达到除去大分子蛋白[28]的效果。但随着乙醇量和沉淀时间的逐渐增加,部分被包裹在大蛋白里面的生物活性肽,会随着蛋白的脱除而产生损失,因此采取一个适宜的提取方法有助于抗菌多肽的富集。综合分析得出,火腿粗肽提取的最佳条件是:2倍乙醇下沉淀10 h后再进行后续分析。
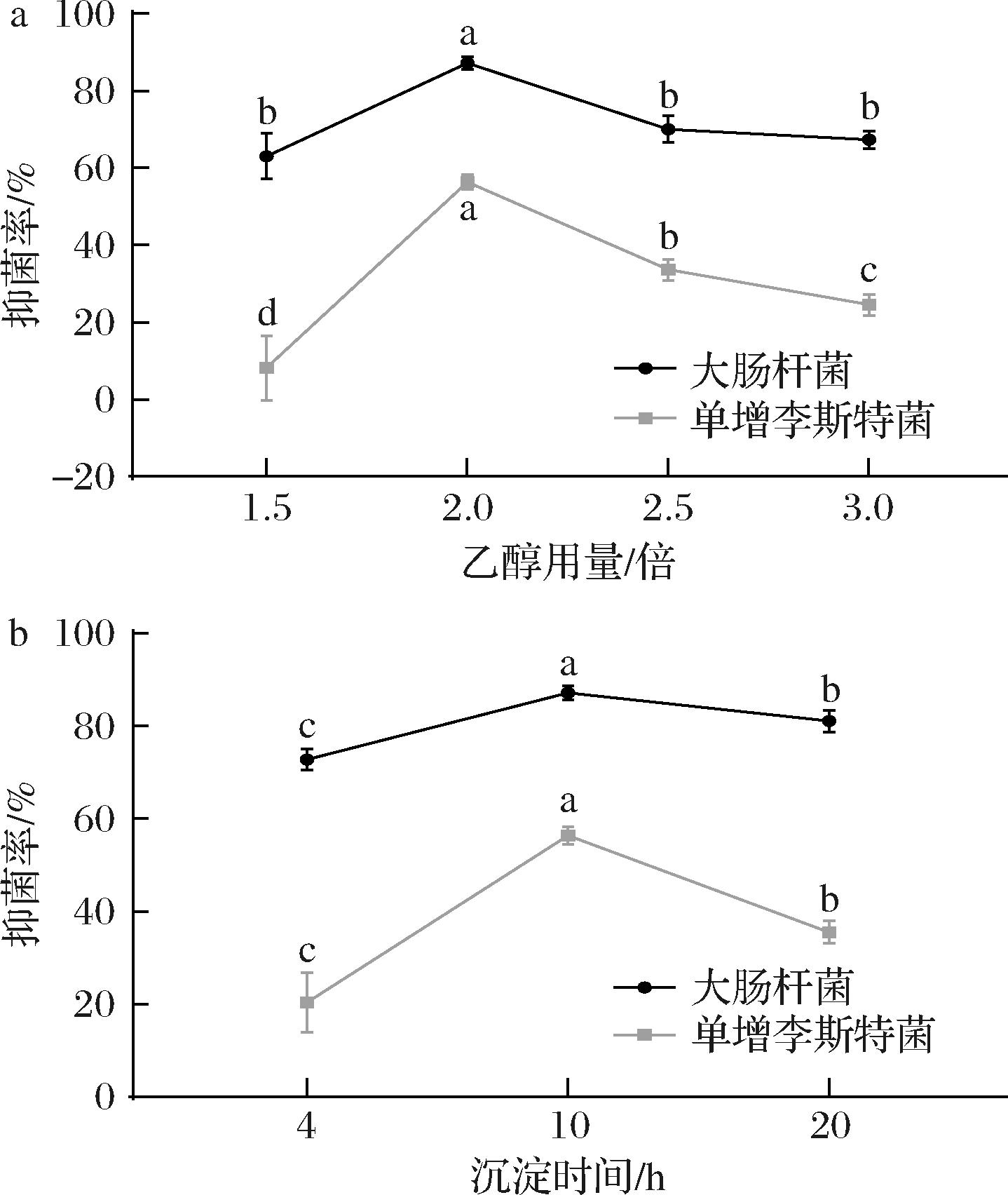
a-不同乙醇添加量;b-不同沉淀时间
图3 不同乙醇添加量和不同沉淀时间下火腿粗肽的抑菌能力
Fig.3 Antimicrobial activity of dry-cured ham crude peptides at different ethanol addition levels
2.3.2 火腿粗肽含量比较
综合2.2节蛋白降解程度分析,BF肌肉的PI值总体大于SM肌肉,降解程度更高,提取出来的肽含量更高,所以选用BF肌肉统一进行后续实验。不同成熟时期和提取方法提取出的粗肽液的肽含量对比如表1所示。盐酸提取法时,每100 g 30月、24月成熟期火腿分别能提取10.58 g和11.40 g粗肽,而采用磷酸提取法时,上述样品分别能提取8.82 g和9.06 g粗肽。对比2个成熟时期的火腿,发现两者的差异并不显著;对比相同成熟时期的肽粉,盐酸法粗肽的提取量显著大于磷酸法。采用邻苯二甲醛多肽含量测定得到肽含量分别为78.88%、72.15%、57.75%和60.82%,计算可得4种多肽的提取率。其中30月盐酸法提取出的粗肽略高于其他3种。综合分析得出,盐酸提取法的多肽提取率显著大于磷酸提取法,且30月成熟期的火腿多肽提取率显著大于24月成熟期火腿。
表1 不同成熟时期与提取方法的火腿粗肽的肽含量对比
Table 1 Comparison of peptide content in dry-cured ham from different ripen period and methods
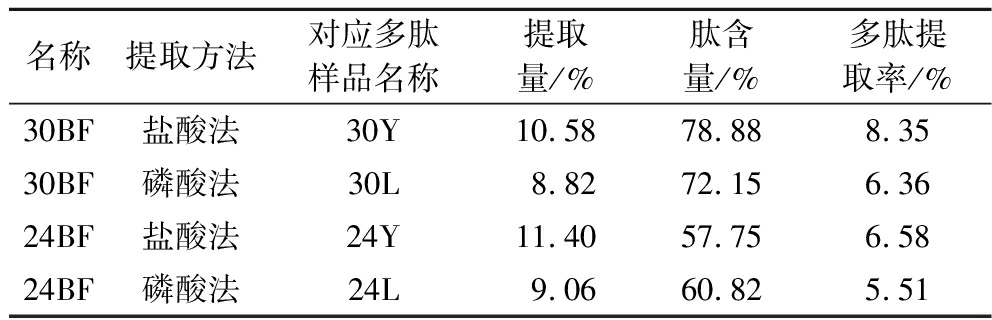
名称提取方法对应多肽样品名称提取量/%肽含量/%多肽提取率/%30BF盐酸法30Y10.5878.888.3530BF磷酸法30L8.8272.156.3624BF盐酸法24Y11.4057.756.5824BF磷酸法24L9.0660.825.51
2.3.3 火腿粗肽抑制大肠杆菌和单增李斯特菌能力比较
图4列出了不同成熟时期和不同提取方法条件下西式干腌火腿抑制大肠杆菌和单增李斯特菌的抑菌能力。从图4可以看出,30月火腿粗肽的抑制能力低于24月火腿粗肽,且磷酸法粗肽的抑菌能力显著高于盐酸法(P<0.05)。对比大肠杆菌和单增李斯特菌的抑制能力,粗肽对大肠杆菌的抑制率要远高于李斯特菌,这可能是因为大肠杆菌结构简单,多肽能破坏大肠杆菌的细胞结构,在细胞表面形成褶皱,破坏细胞完整性[29];而李斯特菌细胞壁较厚,不易破坏掉,所以抑制能力相对较弱[19]。
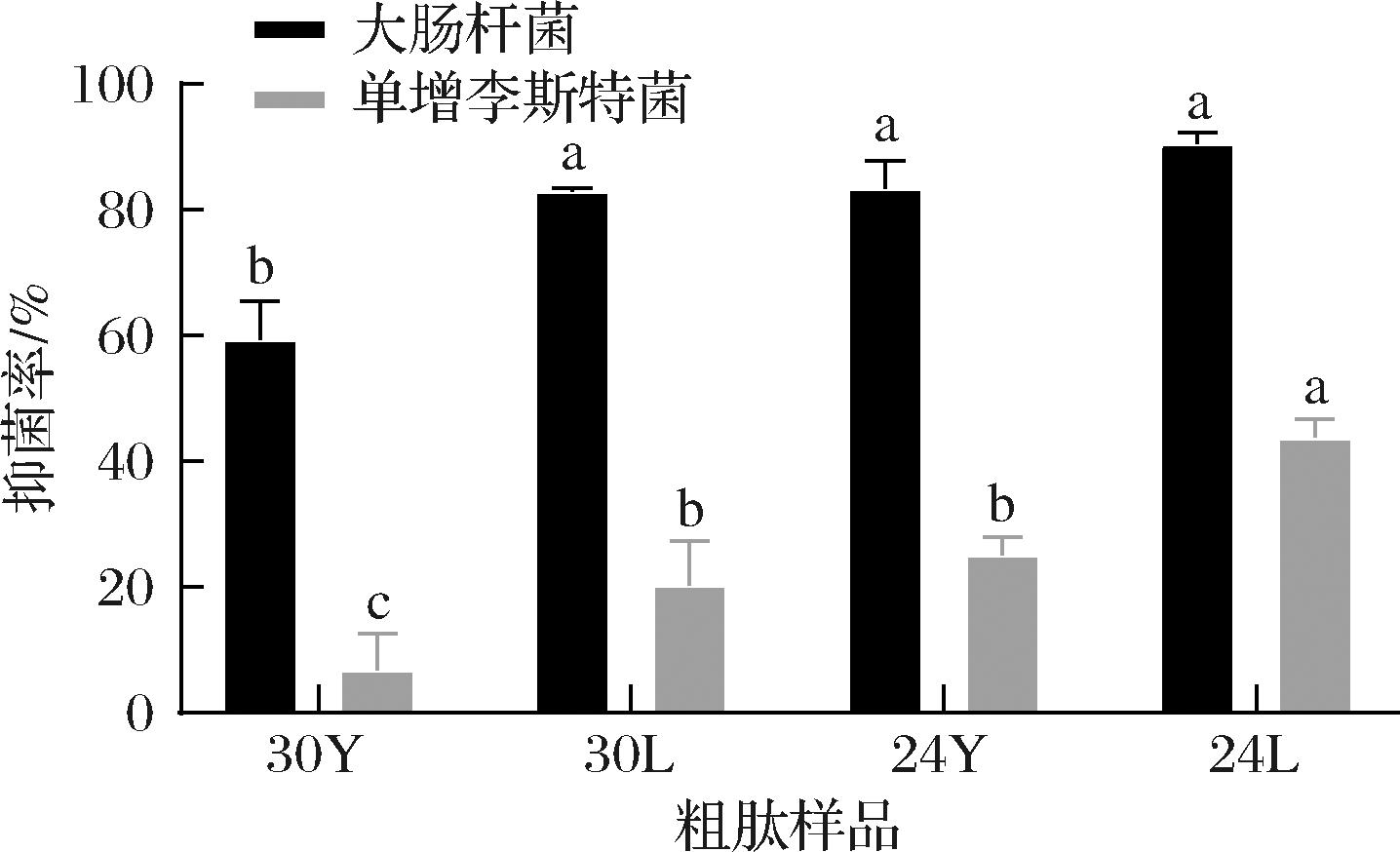
图4 不同成熟时期和方法下火腿粗肽的抑菌能力
Fig.4 The antimicrobial activity of ham crude peptide in different ripen period and method
2.4.1 火腿粗肽氨基酸组成分析
生物活性肽的功能与氨基酸的组成和排列相关[30]。在不同时期和提取方法下火腿粗肽的氨基酸组成如表2所示,磷酸法提取的多肽中谷氨酸的比例明显大于盐酸法,同时丙氨酸、缬氨酸、亮氨酸、赖氨酸、组氨酸和脯氨酸在火腿多肽的组成中占比较多,其中丙氨酸、缬氨酸和亮氨酸都是疏水性氨基酸,这可能是粗肽具有抑菌性的原因[31]。
表2 不同提取方法影响下不同成熟时期干腌火腿粗肽的氨基酸组成分析
Table 2 The amino acid composition analysis of different ripen periods dry-cured ham crude peptides in different methods
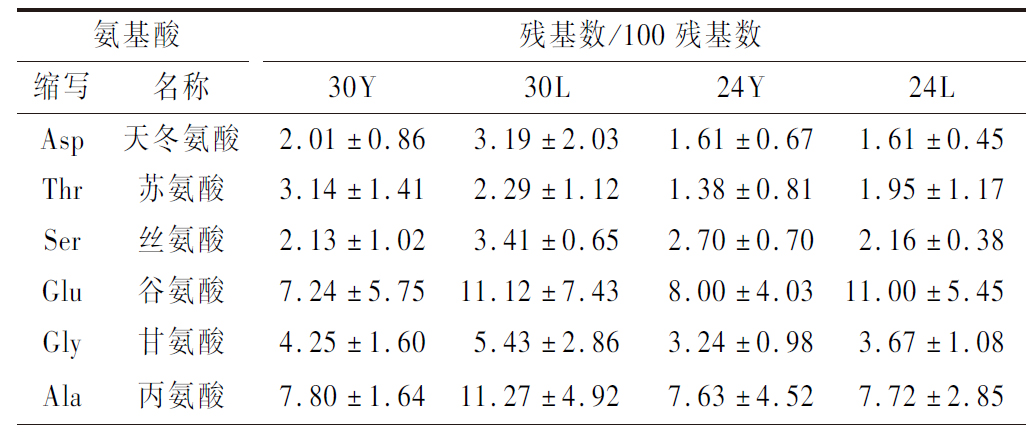
续表2
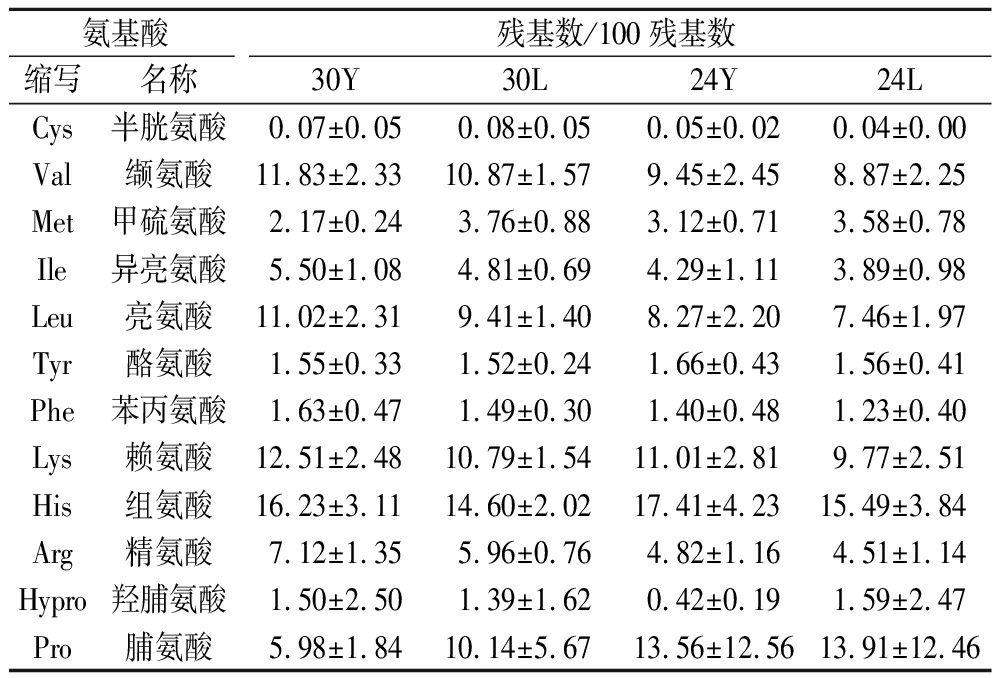
氨基酸残基数/100残基数缩写名称30Y30L24Y24LCys 半胱氨酸0.07±0.050.08±0.050.05±0.020.04±0.00Val 缬氨酸11.83±2.3310.87±1.579.45±2.458.87±2.25Met 甲硫氨酸2.17±0.243.76±0.883.12±0.713.58±0.78Ile 异亮氨酸5.50±1.084.81±0.694.29±1.113.89±0.98Leu 亮氨酸11.02±2.319.41±1.408.27±2.207.46±1.97Tyr 酪氨酸1.55±0.331.52±0.241.66±0.431.56±0.41Phe 苯丙氨酸1.63±0.471.49±0.301.40±0.481.23±0.40Lys 赖氨酸12.51±2.4810.79±1.5411.01±2.819.77±2.51His 组氨酸16.23±3.1114.60±2.0217.41±4.2315.49±3.84Arg 精氨酸7.12±1.355.96±0.764.82±1.164.51±1.14Hypro 羟脯氨酸1.50±2.501.39±1.620.42±0.191.59±2.47Pro 脯氨酸5.98±1.8410.14±5.6713.56±12.5613.91±12.46
2.4.2 多元线性回归分析与偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA)影响抑菌能力关键因子
为进一步分析干腌火腿蛋白降解与火腿粗肽抑菌能力之间的关系,对火腿的PI、氨基酸组成与抑菌能力做多元线性回归模型(multiple linear regression model, MLRM)分析。表3列出了多元线性回归方程的系数与P值,模型R2=0.991 78(P<0.01),回归效果良好。从表3可以看到,PI和组氨酸的回归系数达到显著水平(P<0.05),脯氨酸的回归系数达到较显著水平(0.05<P<0.1)。同时PI、组氨酸和脯氨酸的系数均为正,表明随着蛋白降解的增加,组氨酸和脯氨酸比例的变大,火腿粗肽的抑菌能力将会增强。
表3 多元线性回归方程的系数与相关性
Table 3 Coefficient and correlation of multiple linear regression equations
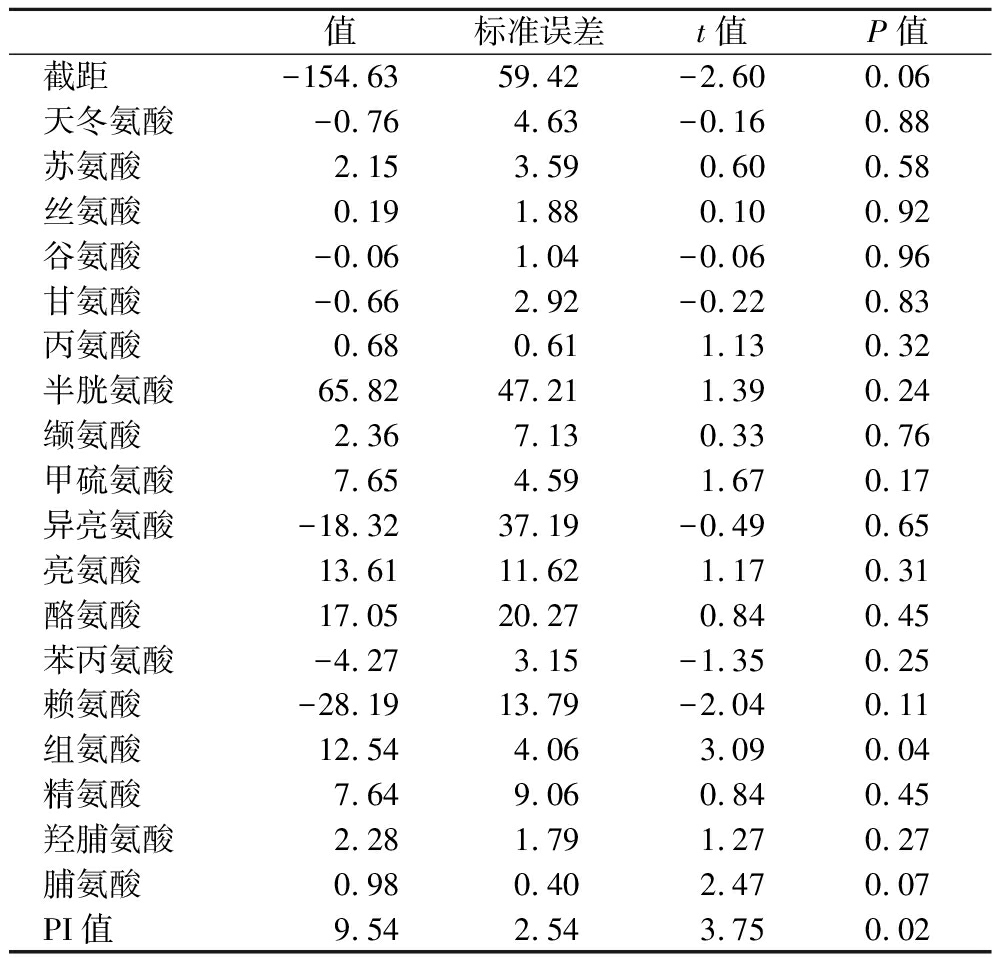
值标准误差t值P值截距-154.63 59.42 -2.60 0.06 天冬氨酸-0.76 4.63 -0.16 0.88 苏氨酸2.15 3.59 0.60 0.58 丝氨酸0.19 1.88 0.10 0.92 谷氨酸-0.06 1.04 -0.06 0.96 甘氨酸-0.66 2.92 -0.22 0.83 丙氨酸0.68 0.61 1.13 0.32 半胱氨酸65.82 47.21 1.39 0.24 缬氨酸2.36 7.13 0.33 0.76 甲硫氨酸7.65 4.59 1.67 0.17 异亮氨酸-18.32 37.19 -0.49 0.65 亮氨酸13.61 11.62 1.17 0.31 酪氨酸17.05 20.27 0.84 0.45 苯丙氨酸-4.27 3.15 -1.35 0.25 赖氨酸-28.19 13.79 -2.04 0.11 组氨酸12.54 4.06 3.09 0.04 精氨酸7.64 9.06 0.84 0.45 羟脯氨酸2.28 1.79 1.27 0.27 脯氨酸0.98 0.40 2.47 0.07 PI值9.54 2.54 3.75 0.02
PLS-DA是一种新的多元统计方法,能将多个自变量通过偏最小二乘回归降维成几个综合变量,并可以准确确定影响分组的关键变量[32],差异变量因子(variable importance for the projection, VIP)可以量化自变量与因变量相关的变量的重要性,其中VIP值>1表示重要变量,VIP<0.5视为不重要变量。PLS加载权重图(PLS-loadings)显示的是自变量X与因变量Y之间的关系,做出一条连接Y变量和原点的直线,并将其他X和Y变量投影在这条直线上。相互对立的变量是负相关的,与它们附近的变量是正相关的。图5和图6分别为PI值、氨基酸组成和抑菌能力的PLS-VIP图和PLS-loadings图。从图5可以看到,VIP>1的为苏氨酸、亮氨酸、异亮氨酸、半胱氨酸、酪氨酸、组氨酸、脯氨酸、精氨酸和PI值。从图6中可以得到,苏氨酸、谷氨酸、甘氨酸、丙氨酸、甲硫氨酸、酪氨酸、组氨酸、羟脯氨酸、脯氨酸和PI值与抑菌率正相关。综合分析上述结果,可以推出苏氨酸、酪氨酸、组氨酸、脯氨酸和PI值是抑菌能力的正相关重要变量。
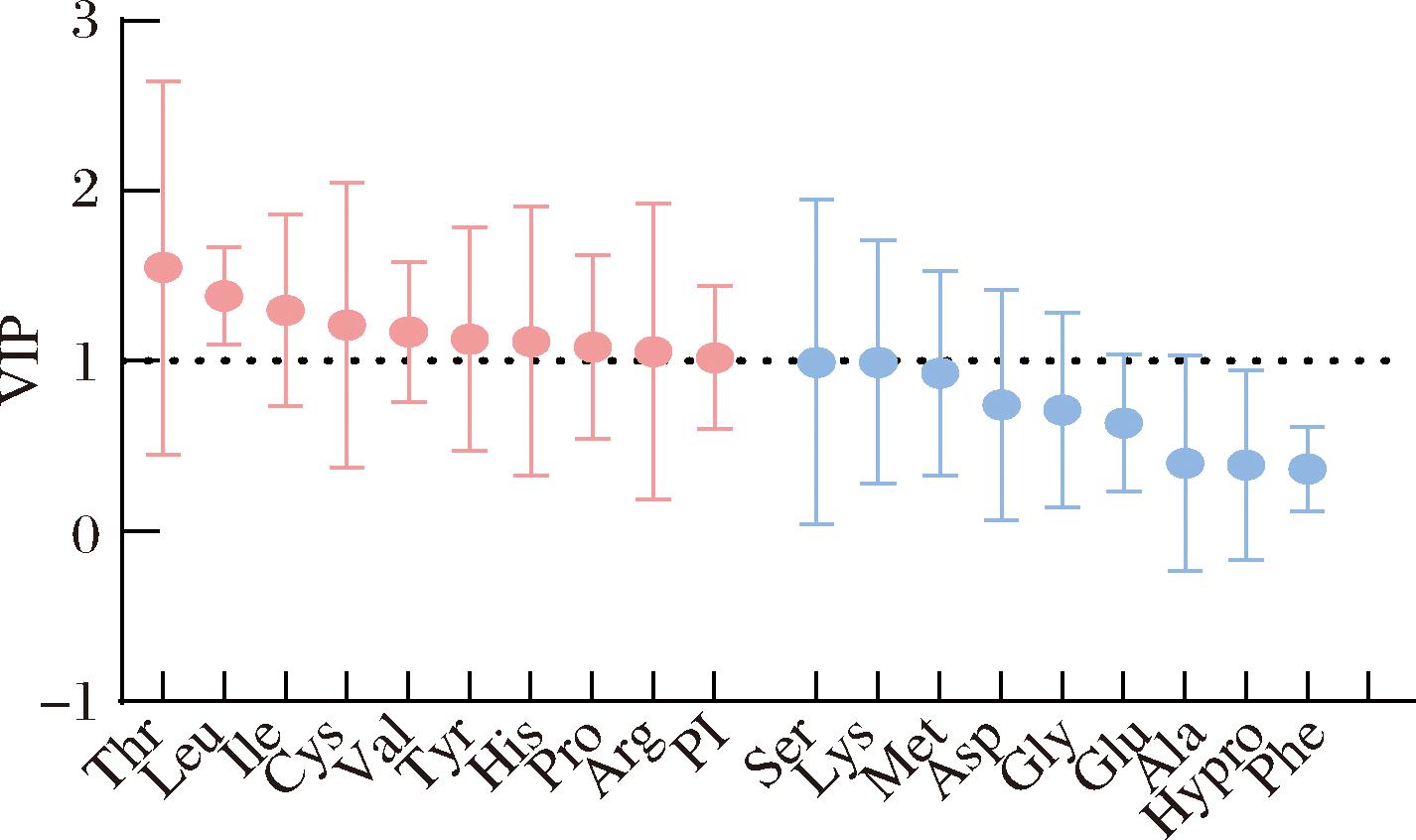
图5 根据PLS模型计算出PI值和氨基酸的VIP值
Fig.5 PI and VIP of amino acids were calculated from the PLS model
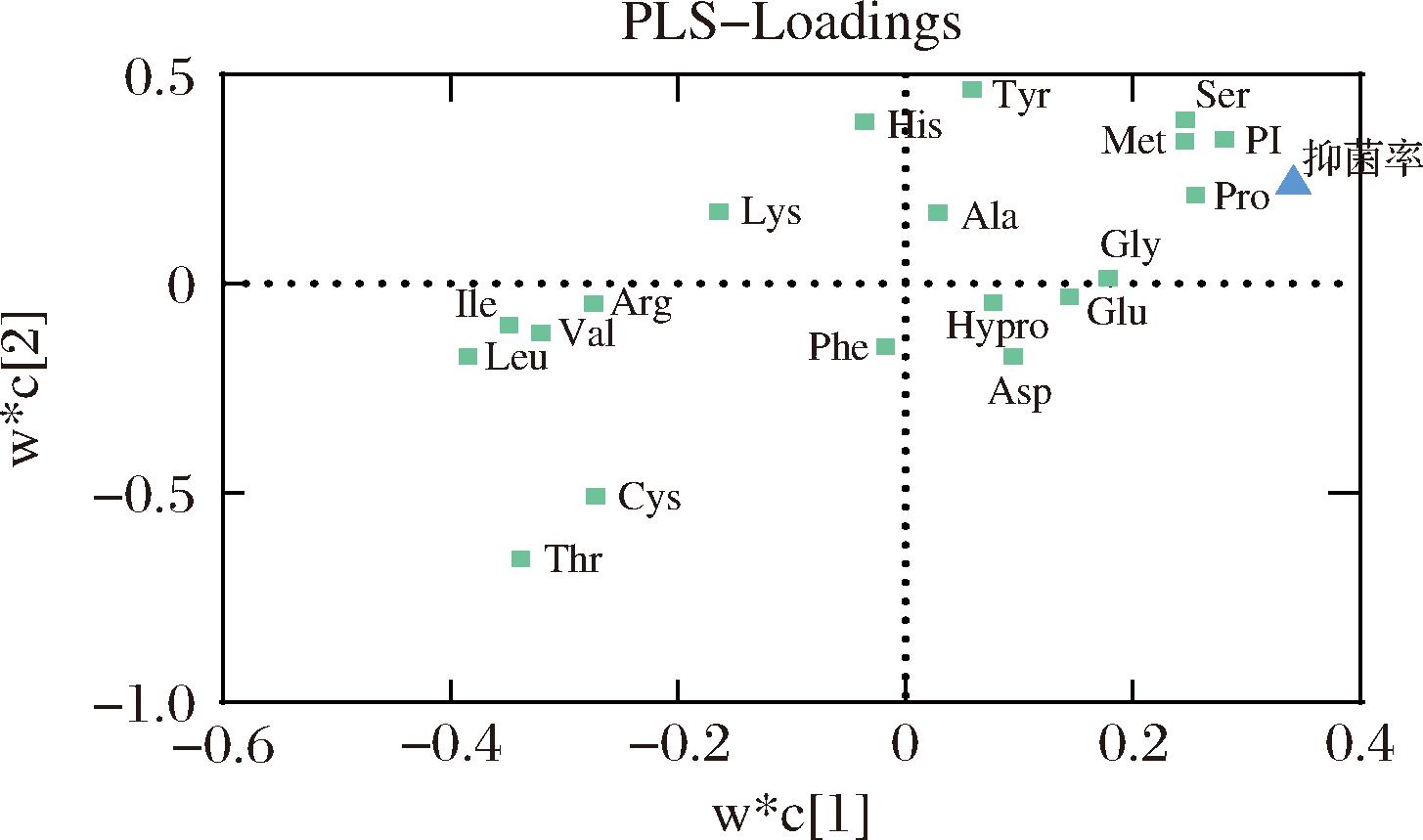
图6 根据PLS模型计算出自变量X(氨基酸和PI值)、 因变量Y(抑菌率)的加载权重图
Fig.6 The PLS-Loadings of PI and amino acids were calculated from the PLS regression model
进一步综合分析MLRM和PLS-DA结果,发现组氨酸、脯氨酸和蛋白降解指数对抑菌能力呈促进作用,其中组氨酸是碱性氨基酸,大多数抗菌肽的N端以组氨酸、赖氨酸和精氨酸这类碱性氨基酸作为开头[12, 33];脯氨酸是疏水性氨基酸,抗菌肽中含有大量疏水性和带正电荷的氨基酸[31],且抗菌肽中富含脯氨酸[12, 19, 34]。
本研究以不同成熟时期的西式干腌火腿作为研究对象,分别对水分含量、水分活度、PI进行分析,优化得到干腌火腿提取粗肽工艺中乙醇沉淀的条件:乙醇使用量2倍,沉淀时间10 h。通过对比不同时期和不同提取手段下火腿粗肽的抑菌能力,发现采用磷酸法提取24月成熟期火腿的粗肽抑菌能力最强。进一步结合多元回归分析和PLS-DA对粗肽的氨基酸组分、蛋白降解指数和抑菌能力进行分析,发现组氨酸、脯氨酸和蛋白降解程度对抑菌呈显著正相关,这可能跟抗菌肽中N端大多数为碱性氨基酸,其中含有大量疏水性氨基酸有关。该结果为深入分析西式干腌火腿中抗菌肽性能与蛋白降解之间的关系提供了理论基础。
[1] JURADO  , GARC
, GARC A C, TIM
A C, TIM N M L, et al.Effect of ripening time and rearing system on amino acid-related flavour compounds of Iberian ham[J].Meat Science, 2007, 75(4):585-594.
N M L, et al.Effect of ripening time and rearing system on amino acid-related flavour compounds of Iberian ham[J].Meat Science, 2007, 75(4):585-594.
[2] TOMAŽIN U,  KRLEP M, PREVOLNIK POV
KRLEP M, PREVOLNIK POV E M, et al.The effect of salting time and sex on chemical and textural properties of dry cured ham[J].Meat Science, 2020, 161:107990.
E M, et al.The effect of salting time and sex on chemical and textural properties of dry cured ham[J].Meat Science, 2020, 161:107990.
[3] HARKOUSS R, ASTRUC T, LEBERT A, et al.Quantitative study of the relationships among proteolysis, lipid oxidation, structure and texture throughout the dry-cured ham process[J].Food Chemistry, 2015, 166:522-530.
[4] ZHOU C Y, TANG C B, WANG C, et al.Insights into the evolution of myosin light chain isoforms and its effect on sensory defects of dry-cured ham[J].Food Chemistry, 2020, 315:126318.
[5] TOLDR F, GALLEGO M, REIG M, et al.Bioactive peptides generated in the processing of dry-cured ham[J].Food Chemistry, 2020, 321:126689.
F, GALLEGO M, REIG M, et al.Bioactive peptides generated in the processing of dry-cured ham[J].Food Chemistry, 2020, 321:126689.
[6] 左庆翔. 金华火腿降血压肽的特性研究及分离纯化[D].南京:南京农业大学, 2017.
ZUO Q X.Study of purification and antihypertensive ability of peptides extracted from Jinhua ham[D].Nanjing:Nanjing Agricultural University, 2017.
[7] 邢路娟. 宣威火腿中抗氧化肽的分离鉴定及抗氧化机理研究[D].南京:南京农业大学, 2019.
XING L J.Isolation, identification and antioxidant mechanism of antioxidant peptides from Xuanwei ham[D].Nanjing:Nanjing Agricultural University, 2019.
[8] 邹颖玲, 王桂瑛, 王雪峰, 等.火腿中生物活性肽的研究进展[J].食品研究与开发, 2020, 41(6):205-210.
ZOU Y L, WANG G Y, WANG X F, et al.Review of bioactive peptides derived from dry-cured ham[J].Food Research and Development, 2020, 41(6):205-210.
[9] 李平, 杨婷, 周辉, 等.干腌火腿中生物活性肽功能特性研究进展[J].食品科学, 2021, 42(11):278-283.
LI P, YANG T, ZHOU H, et al.Functional characteristics of bioactive peptides in dry-cured ham:A review[J].Food Science, 2021, 42(11):278-283.
[10] 邢路娟, 左庆翔, 郝月静, 等.金华火腿中生物活性肽的抗高血压活性研究[J].中国食品学报, 2023, 23(1):135-142.
XING L J, ZUO Q X, HAO Y J, et al.Studies on the antihypertensive activity of bioactive peptides in Jinhua dry-cured ham[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(1):135-142.
[11] BOMAN H G, NILSSON I, RASMUSON B.Inducible antibacterial defence system in Drosophila[J].Nature, 1972, 237(5352):232-235.
[12] 宋伟光. 棉籽蛋白抗菌肽分离鉴定、构效关系研究以及中试规模制备[D].无锡:江南大学, 2020.
SONG W G.A study on the fractionation and identification, structure-function relationships and the pilot-scale preparations of cottonseed protein antibacterial peptides[D].Wuxi:Jiangnan University, 2020.
[13] SINGH A, DUCHE R T, WANDHARE A G, et al.Milk-derived antimicrobial peptides:Overview, applications, and future perspectives[J].Probiotics and Antimicrobial Proteins, 2023, 15(1):44-62.
[14] 李芙蓉. 南极磷虾虾粉多肽的分离纯化及活性研究[D].上海:上海海洋大学, 2019.
LI F R.Isolation, purification and activity of polypeptide from Antarctic krill powder[D].Shanghai:Shanghai Ocean University, 2019.
[15] 韩玉竹, 李平兰, 何琴, 等.辣椒籽抗菌肽提取条件优化及分离纯化[J].食品科学, 2019, 40(24):258-264.
HAN Y Z, LI P L, HE Q, et al.Optimization of extraction conditions, separation and purification of antifungal peptides from hot pepper seeds[J].Food Science, 2019, 40(24):258-264.
[16] 王焙, 张登科, 史咏梅, 等.鲣鱼暗色肉抗菌肽的制备及分离纯化[J].食品与发酵工业, 2019, 45(19):104-111.
WANG B, ZHANG D K, SHI Y M, et al.Preparation and purification of antimicrobial peptides from dark meat of bonito[J].Food and Fermentation Industries, 2019, 45(19):104-111.
[17] 周天硕, 赵家圆, 孟彩云, 等.发酵肉制品中生物活性肽的研究进展[J].肉类研究, 2022, 36(12):67-71.
ZHOU T S, ZHAO J Y, MENG C Y, et al.Progress in research on bioactive peptides in fermented meat products[J].Meat Research, 2022, 36(12):67-71.
[18] MALHEIROS P S, JOZALA A F, PESSOA-JR A, et al.Immobilization of antimicrobial peptides from Lactobacillus sakei subsp.sakei 2a in bacterial cellulose:Structural and functional stabilization[J].Food Packaging and Shelf Life, 2018, 17:25-29.
[19] 郑锦晓. 宣威火腿抗菌肽的特性研究及分离纯化[D].南京:南京农业大学, 2018.
ZHENG J X.Study on characteristics, separation and purification of antimicrobial peptides from Xuanwei ham[D].Nanjing:Nanjing Agricultural University, 2018.
[20] CASTELLANO P, MORA L, ESCUDERO E, et al.Antilisterial peptides from Spanish dry-cured hams:Purification and identification[J].Food Microbiology, 2016, 59:133-141.
[21] 蔡音音. 基于氨基酸组成及其理化性质的鱼虾抗性多肽的识别和预测[D].厦门:厦门大学, 2018.
CAI Y Y.Resistance peptide identification from fish and penaeus based on amino acid composition and physicochemical properties[D].Xiamen:Xiamen University, 2018.
[22] CHURCH F C, SWAISGOOD H E, PORTER D H, et al.Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk Proteins1[J].Journal of Dairy Science, 1983, 66(6):1219-1227.
[23] HARKOUSS R, CHEVARIN C, DAUDIN J D, et al.Development of a multi-physical finite element-based model that predicts water and salt transfers, proteolysis and water activity during the salting and post-salting stages of the dry-cured ham process[J].Journal of Food Engineering, 2018, 218:69-79.
[24] 郭新. 羊肉火腿加工及贮藏期间风味形成与脂质代谢的研究[D].石河子:石河子大学, 2022.
GUO X.Study on flavor formation and lipid metabolism during processing and storage fo mutton ham[D].Shihezi:Shihezi University, 2022.
[25] 江玉霞. 金华火腿加工过程中蛋白质降解规律的研究[D].北京:中国农业大学, 2005.
JIANG Y X.Studies on changes of protein during the processing of Jinhua dry-cured ham[D].Beijing:China Agricultural University, 2005.
[26] RUIZ-RAM REZ J, ARNAU J, SERRA X, et al.Effect of pH24, NaCl content and proteolysis index on the relationship between water content and texture parameters in biceps femoris and semimembranosus muscles in dry-cured ham[J].Meat Science, 2006, 72(2):185-194.
REZ J, ARNAU J, SERRA X, et al.Effect of pH24, NaCl content and proteolysis index on the relationship between water content and texture parameters in biceps femoris and semimembranosus muscles in dry-cured ham[J].Meat Science, 2006, 72(2):185-194.
[27] HARKOUSS R, MIRADE P S, GATELLIER P.Development of a rapid, specific and efficient procedure for the determination of proteolytic activity in dry-cured ham:Definition of a new proteolysis index[J].Meat Science, 2012, 92(2):84-88.
[28] 忽晓平. 金华火腿多肽的提取及功能特性研究[D].郑州:河南农业大学, 2017.
HU X P.Research of extraction and properties of peptides from Jinhua ham[D].Zhengzhou:Henan Agricultural University, 2017.
[29] 孙秀秀. 大豆碱性多肽对大肠杆菌的抑菌机制及应用研究[D].济南:齐鲁工业大学, 2016.
SUN X X.Antimicrobial mechanism of glycinin basic peptide against E.coli and its application effect[D].Jinan:Qilu University of Technology, 2016.
[30]  ANL
ANL DERE ALO
DERE ALO LU H, ÖNER Z.Determination of antioxidant activity of bioactive peptide fractions obtained from yogurt[J].Journal of Dairy Science, 2011, 94(11):5305-5314.
LU H, ÖNER Z.Determination of antioxidant activity of bioactive peptide fractions obtained from yogurt[J].Journal of Dairy Science, 2011, 94(11):5305-5314.
[31] PANE K, DURANTE L, CRESCENZI O, et al.Antimicrobial potency of cationic antimicrobial peptides can be predicted from their amino acid composition:Application to the detection of “cryptic” antimicrobial peptides[J].Journal of Theoretical Biology, 2017, 419:254-265.
[32] WEI J P, WANG S Y, ZHANG Y X, et al.Characterization and screening of non-Saccharomyces yeasts used to produce fragrant cider[J].LWT, 2019, 107:191-198.
[33] 郑俏然. 酪蛋白酶解产物抑菌特性及其在冷却鸭肉保鲜中的应用研究[D].雅安:四川农业大学, 2009.
ZHENG Q R.Study on antibacterial characteristics of casein enzymatic hydrolysates and its application in preservation of chilled duck meat[D].Ya’an:Sichuan Agricultural University, 2009.
[34] 孙龙. 两种鞘翅目昆虫抗菌肽的分离纯化与活性研究[D].北京:中国林业科学研究院, 2012.
SUN L.Isolation, purification and activity of antimicrobial peptides from two coleoptera insects[D].Beijing:Chinese Academy of Forestry, 2012.