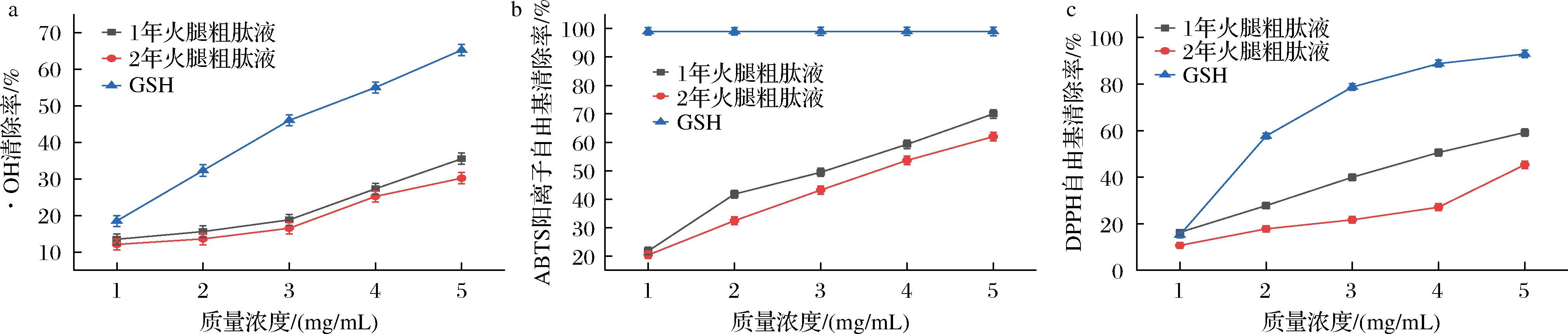
a-·OH清除率;b-ABTS阳离子自由基清除率;c-DPPH自由基清除率
图1 不同浓度粗肽抗氧化能力
Fig.1 Antioxidant capacity in different concentrations of the crude peptide
中国比较早的干腌制品是以金华火腿为代表的各种各样的火腿和香肠,属于低酸干腌肉制品[1]。干腌火腿加工过程比较复杂且时间久,其中活性肽大部分是源自肌动蛋白的降解。首先由内肽酶对蛋白质进行降解,之后结合外肽酶,在微生物酶与内源酶的共同作用下,蛋白质被分解为小分子肽和游离氨基酸[2]。这些多肽决定了干腌火腿的风味,并具有潜在的抗氧化和抗高血压活性[3]。多肽的抗氧化活性归因于许多特性的协同作用,包括螯合金属离子、淬氧和清除自由基的能力。此外,抗氧化肽由于无毒、高效等特点[4],近年来受到越来越多的关注,MORA等[5]研究表明,干腌火腿中的蛋白质水解受原料和加工参数(如盐含量、温度、湿度和成熟时间)的影响。因此,不同时期的干腌火腿发生不同的蛋白水解反应,形成不同的肽序列。
超氧化物歧化酶(superoxide dismutase,SOD)可以作用于超氧阴离子进行专一歧化反应。在人体内可以高效的清除超氧阴离子自由基,治疗一些由于自由基作用导致的炎症、自身免疫病。另外在抑制癌细胞方面也有一定的作用。SOD最早是由FRIDOVICH研究发现的[6],并将这种血球铜蛋白命名为超氧化物歧化酶。同时活性肽与SOD的结合也可以提升清除自由基能力。
通过凝胶层析色谱和nano-HPLC-MS/MS分离并鉴定出抗氧化性能较好的肽段(DHDGPDHW、FPPDVGD、PFGDTH),对其进行合成并测试抗氧化性。借助分子对接实验检测DHDGPDHW、FPPDVGD、PFGDTH与SOD的结合能力,预测活性肽抗氧化机制,为活性肽的功能化研究提供一定参考。
材料:1年和2年的金华火腿,购于江苏常州永辉超市。
试剂:谷胱甘肽(glutathione,GSH)、三氯乙酸、ABTS,北京百灵威科技有限公司;1,10-菲咯啉、DPPH、牛血清白蛋白,上海麦克林生化科技股份有限公司;HCl、NaH2PO4、H2O2、NaOH等,安耐吉化学有限公司。
HMS-901HS恒温水浴锅,博大精科实业有限公司;UPG-752紫外可见分光光度计,北京优普通用科技有限公司;M1416R台式高速离心机,深圳市瑞沃德生命科技有限公司;Labconco FreeZone 4.5 L真空冷冻干燥机,中科科尔仪器有限公司;PHSJ-3F pH计,上海雷磁仪器有限公司;JA1003精密电子天平,力辰邦西仪器科技有限公司;数显高速匀浆机,驰勒机械科技有限公司;Orbitrap Q-Exactive Plus质谱仪、质谱分析柱(Acclaim PepMap C18, 75 μm×25 cm);Hoffen-20-1傅里叶红外光谱仪,天津市嘉鑫海机械设备有限公司;玻璃层析柱(26 mm×1 m),上海宸乔生物科技有限公司。
1.3.1 粗肽的提取
根据郑锦晓等[7]的方法进行修改,采用盐酸提取法,将100 g肌肉切碎置于1 000 mL烧杯中加入500 mL 0.01 mol/L HCl溶液,再用匀浆机匀浆处理。匀浆后在10 000×g条件下离心15 min,然后将匀浆液用普通滤纸过滤,保留滤液,再加入3倍体积的乙醇沉淀上清液中的蛋白并过滤,滤液在低温下静置0.5 h,然后以4 000×g离心25 min。再用快速定性滤纸过滤,保留滤液,滤液再分别用0.45、0.22 μm滤膜进行过滤。取滤液在旋转蒸发器(45 ℃)下旋转蒸发除去乙醇,所得浓缩液冷冻后置于冷冻干燥机中干燥后得到粗肽,并储存在-20 ℃冰箱中保存备用。多肽含量测定及标准曲线建立参考文献[7]。
1.3.2 体外抗氧化活性研究
采用DPPH自由基清除法、ABTS阳离子自由基清除法、羟自由基(·OH)清除法,研究2个年份的火腿粗肽液在不同浓度下的抗氧化能力,对照组为同质量浓度的GSH。
DPPH自由基、·OH自由基、ABTS阳离子自由基清除作用参照文献[8-10]所述方法测定。
1.3.3 抗氧化性能的稳定性研究
1.3.3.1 NaCl含量对粗肽抗氧化活性的影响
准确配制6份3 mg/mL火腿粗肽液,向配制好的粗肽液中分别添加0.0%、2.0%、4.0%、6.0%、8.0%、10.0% (质量分数) NaCl,在100 ℃、标准大气压条件下加热20 min,冷却至室温,测定其抗氧化能力。
1.3.3.2 温度对粗肽抗氧化活性的影响
准确配制5份3 mg/mL火腿粗肽液,分别在25、40、55、70、85 ℃水浴2 h后,快速冷却至室温,测定其抗氧化能力。
1.3.3.3 pH对粗肽抗氧化活性的影响
准确配制5份3 mg/mL火腿粗肽液,pH值分别调节为3.0、5.0、7.0、9.0、11.0并编号,然后室温静置1 h,将各溶液pH值调至7.0,测定其抗氧化能力。
1.3.4 傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析
参照JING等[11]的方法,取不同年份火腿多肽提取物2 mg,置于KBr压片上,用FT-IR扫描仪进行全波段(400~4 000 cm-1)扫描。剪切酰胺I带(1 600~1 700 cm-1)的数据用Peakfit v4.12软件进行分析,先进行基线校正,去卷积后,计算多肽各二级结构含量,用Origin 8.0软件处理图形。
1.3.5 抗氧化肽分离鉴定
根据抗氧化实验结果,将1年份的金华火腿粗肽液进行分离纯化,用凝胶层析色谱(SephadexG-25)进行纯化[12]。蒸馏水经过45 μm滤膜过滤后作为洗脱液,调节流速0.5 mL/min,每管收集0.6 mL洗脱液,分别进行抗氧化性能测试。
Nano-HPLC-MS/MS分析:将样品经由配备在线钠喷离子源的LC-MS/MS分析。整套系统为串联EASY-nanoLC 1200的Q Exactive Plus质谱仪。共上样5 μL样品,以60 min的梯度分离样品,柱流量控制在300 nL/min,柱温40 ℃,电喷雾电压2 kV,梯度从2%的B相起始,在47 min以非线性梯度升高到35%,1 min内升高到100%,维持12 min。
1.3.6 分子对接
从PDB数据库下载SOD(PDB ID:2ADQ)蛋白结构;使用Pymol 2.3.0去除蛋白结晶水、原始配体等,将蛋白结构导入AutoDocktools(v1.5.6)进行加氢、计算电荷、分配电荷、指定原子类型并保存为“pdbqt”格式。使用POCASA 1.1预测蛋白结合位点,采用AutoDock Vina1.1.2进行对接。
1.3.7 数据分析与统计处理
实验中用Origin 2018绘图,分子对接部分采用Pymol 2.3.0进行处理,使用Microsoft Excel统计数据。
在0~10 mg/mL牛血清白蛋白与吸光度的线性关系良好,线性标准方程为y=0.052 3x+0.003 1;R2=0.999 3,计算得出1年火腿粗肽、2年火腿粗肽含量分别为1.48、1.13 mg/mL。
由图1可知,随着GSH和粗肽浓度的升高,对·OH、ABTS阳离子自由基、DPPH自由基的清除效果均成上升的趋势,经计算1年和2年火腿粗肽液对·OH清除率IC50值分别为7.335、8.717 mg/mL;对ABTS阳离子自由基清除率IC50值分别为2.773、3.528 mg/mL;对DPPH自由基清除率IC50值分别为3.901、6.303 mg/mL。当粗肽质量浓度为5 mg/mL时,1年和2年火腿粗肽液对·OH的清除效果分别为35.52%、30.02%;对ABTS阳离子自由基的清除效果分别为69.98%、61.98%;对DPPH自由基的清除效果分别为59.24%、45.34%。由此可见加工1年的金华火腿粗肽液的抗氧化能力明显高于加工2年的。这是由于多肽的抗氧化能力大多与氨基酸组成、分子质量大小有着密切联系,一般抗氧化肽是由2~20个氨基酸组成,研究发现肽的分子质量越小,就越容易被人的肠道吸收,更容易穿过肠道发挥抗氧化活性。但是加工的时间越久,小分子的肽会逐渐降解成游离氨基酸,所以2年火腿的抗氧化能力要略低于一年份火腿的抗氧化能力。

a-·OH清除率;b-ABTS阳离子自由基清除率;c-DPPH自由基清除率
图1 不同浓度粗肽抗氧化能力
Fig.1 Antioxidant capacity in different concentrations of the crude peptide
在干腌肉制品中,食盐的添加是必不可少的。食盐含量对抗氧化性的影响如图2所示,在测定的区间范围内,食盐含量对DPPH自由基和ABTS阳离子自由基清除率影响不是很大,但是当食盐质量分数高于6%时,对两种自由基的清除效率有所下降,这可能是离子强度影响到氧化反应。从图2-b中可以看出当温度高于60 ℃时,粗肽的抗氧化活性有明显下降的趋势。这可能是由于小分子的短肽虽然不能像大分子的蛋白质一样形成三四级结构,但是部分仍然具有二级结构,而二级结构对于抗氧化活性的保持具有重要作用。温度太高不仅会破坏多肽的二级结构,也会使一部分小肽失活,这样抗氧化成分就会受到影响,从而造成抗氧化活性的减弱。由图2-c可知,火腿粗肽液在中性和弱酸的条件下能较好的保持其抗氧化活性,可以将干腌火腿抗氧化肽开发成中性或者弱酸性产品。但是pH>7之后,肽活性急剧下降,受碱性条件影响较大。一般来说,碱性条件导致金华火腿粗肽液活性下降的因素有多种,可能是由于肽的化学结构发生消旋[13-14],也可能是氧化反应受到pH的影响,碱性条件促进其氧化。

a-NaCl对抗氧化活性的影响;b-温度对抗氧化活性的影响;c-pH对抗氧化活性的影响
图2 粗肽的抗稳定性能图
Fig.2 Chart of the anti-stabilizing properties of crude peptides
肽的二级结构对其发挥活性有重要作用。魏连会等[15]研究指出肽的构像和氨基酸序列可能对肽的抗氧化活性有很大的影响。对于肌肽及其相关含组氨酸二肽淬灭自由基能力的电子自旋共振研究,也得出了类似的结论。酰胺I带的特征吸收峰表示蛋白质分子间以及蛋白质分子内部形成的二级结构,因此主要利用酰胺I带(波长范围1 600~1 700 cm-1)分析蛋白质和多肽的二级结构。由图3可知,两个时期的多肽提取物在酰胺I带有吸收带,证明样品具有C![]() O伸缩振动,又因为两个年份的多肽提取物抗氧化效果不同,所以它们可能具有不同的二级结构。
O伸缩振动,又因为两个年份的多肽提取物抗氧化效果不同,所以它们可能具有不同的二级结构。

图3 不同年份的多肽提取物红外光谱图
Fig.3 Infrared spectra of peptide extracts in different years
2.5.1 粗肽的分离鉴定
凝胶过滤色谱纯化法是一种比较常见的纯化多肽的方法,操作简单,回收方便。主要是根据待分离组分的分子质量或者分子的形状进行分离,大的蛋白分子不能进入凝胶颗粒,从而先被洗脱,小分子进入凝胶颗粒,但是在凝胶中的保留时间也不一样,进而分离出分子质量不同的多肽。由表1可知,火腿粗肽经由SephadexG-25分离后得到了5个组分,其中组分B抗氧化性能最好。
表1 不同组分的抗氧化能力 单位:%
Table 1 Antioxidant capacity of different components

组分DPPH自由基清除率·OH清除率A25.3415.34B42.4528.33C34.2316.23D25.4620.32E24.3218.65
收集组分B,经过Nano LC-MS/MS共鉴定出1 276条不同的肽段,大部分肽段来自于参与各种类型细胞运动的肌动蛋白。通过与数据库比对,挑选得分>97且丰度最多的前31条肽进行研究。通过研究发现,表2中的小分子多肽以较高的丰度被检测到[16],并且被de novo检测认为可信,通过与MS谱图数据库对比是一些全新肽段,得分>97的。由质谱结合软件分析粗肽的氨基酸序列[17],得到活性高的氨基酸序列分别为:DHDGPDHW、FPPDVGD、PFGDTH。
表2 鉴定到的小分子多肽
Table 2 Identified small molecule polypeptides
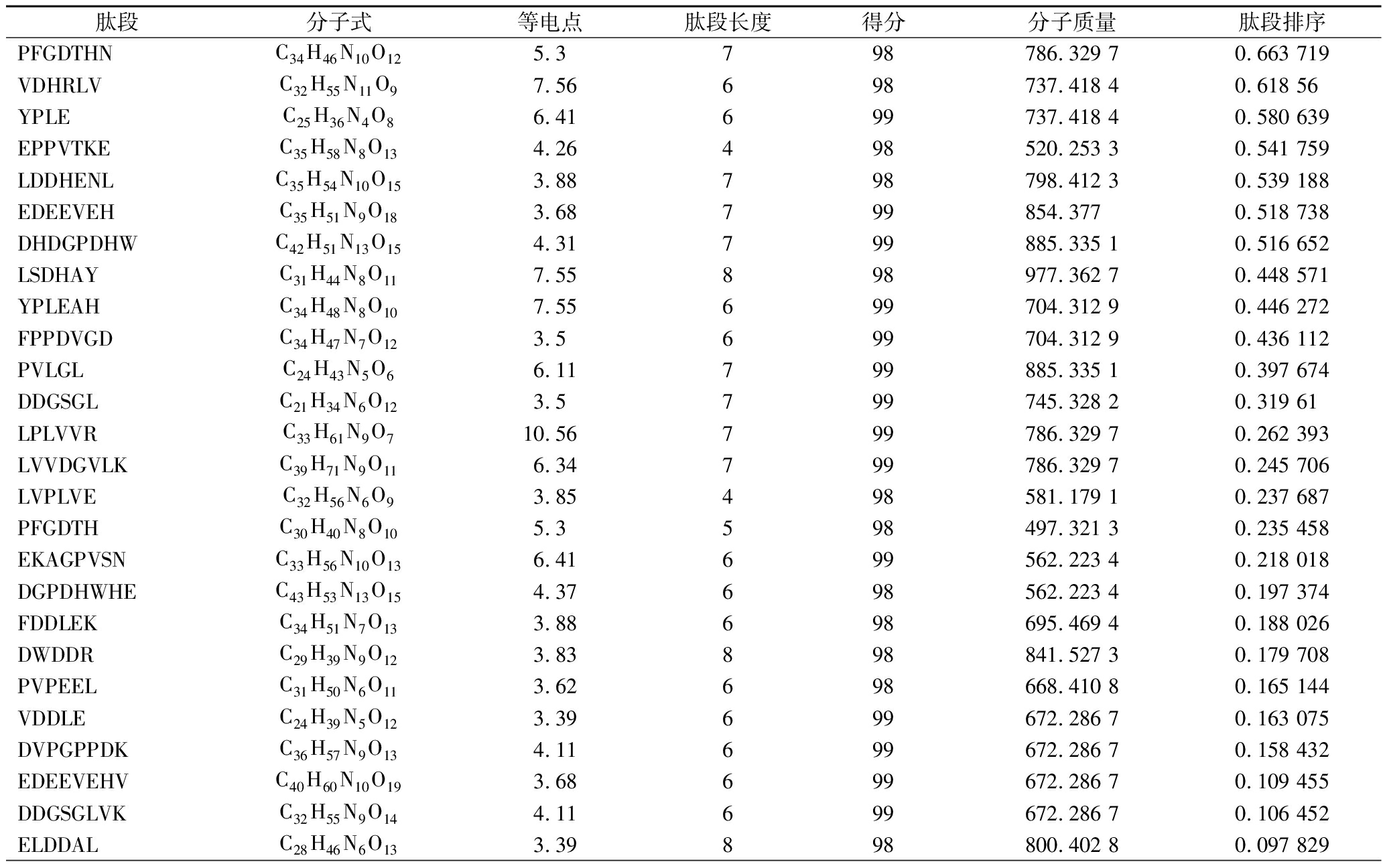
肽段分子式等电点肽段长度得分分子质量肽段排序PFGDTHNC34H46N10O125.3798786.329 70.663 719VDHRLVC32H55N11O97.56698737.418 40.618 56YPLEC25H36N4O86.41699737.418 40.580 639EPPVTKEC35H58N8O134.26498520.253 30.541 759LDDHENLC35H54N10O153.88798798.412 30.539 188EDEEVEHC35H51N9O183.68799854.3770.518 738DHDGPDHWC42H51N13O154.31799885.335 10.516 652LSDHAYC31H44N8O117.55898977.362 70.448 571YPLEAHC34H48N8O107.55699704.312 90.446 272FPPDVGDC34H47N7O123.5699704.312 90.436 112PVLGLC24H43N5O66.11799885.335 10.397 674DDGSGLC21H34N6O123.5799745.328 20.319 61LPLVVRC33H61N9O710.56799786.329 70.262 393LVVDGVLKC39H71N9O116.34799786.329 70.245 706LVPLVEC32H56N6O93.85498581.179 10.237 687PFGDTHC30H40N8O105.3598497.321 30.235 458EKAGPVSNC33H56N10O136.41699562.223 40.218 018DGPDHWHEC43H53N13O154.37698562.223 40.197 374FDDLEKC34H51N7O133.88698695.469 40.188 026DWDDRC29H39N9O123.83898841.527 30.179 708PVPEELC31H50N6O113.62698668.410 80.165 144VDDLEC24H39N5O123.39699672.286 70.163 075DVPGPPDKC36H57N9O134.11699672.286 70.158 432EDEEVEHVC40H60N10O193.68699672.286 70.109 455DDGSGLVKC32H55N9O144.11699672.286 70.106 452ELDDALC28H46N6O133.39898800.402 80.097 829
续表2
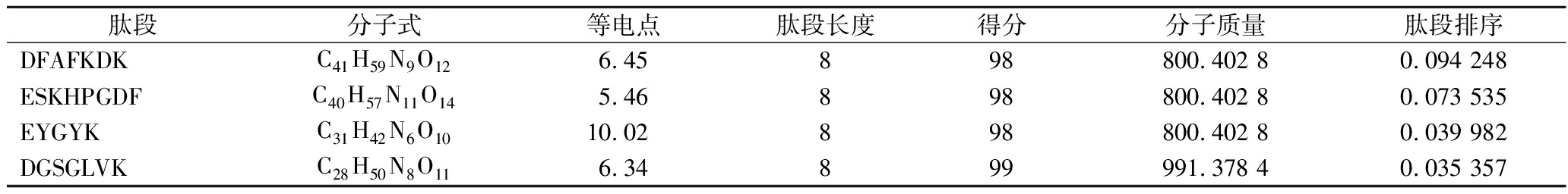
肽段分子式等电点肽段长度得分分子质量肽段排序DFAFKDKC41H59N9O126.45898800.402 80.094 248ESKHPGDFC40H57N11O145.46898800.402 80.073 535EYGYKC31H42N6O1010.02898800.402 80.039 982DGSGLVKC28H50N8O116.34899991.378 40.035 357
注:得分针对的是每张匹配到肽段的谱图与该肽段理论碎裂谱峰之间相似性高低的一个评价体系,一般来说得分越大证明该谱图与理论谱图越一致,信噪比一般也是越好。
2.5.2 合成肽的抗氧化活性分析
为了验证鉴定的肽活性,按照肽的序列进行人工合成,并测定了合成肽段的抗氧化活性[18],结果如图4所示,所合成的3条肽段对3种自由基都有清除效果。其中,清除DPPH自由基和ABTS阳离子自由基活性最强的肽段为FPPDVGD,分别为82.34%和84.22%。·OH清除能力最好的肽段则是DHDGPDHW。抗氧化肽活性的强弱通常与氨基酸组成和分子质量大小有关。大量研究表明,肽段分子质量在500~1 800 Da具有比较好的抗氧化活性[19],其中所含的氨基酸排序和种类也可以提升肽段的抗氧化活性,如果肽段中含有一个或几个疏水性氨基酸,则会很大程度上增强肽段的抗氧化活性[20]。在经过鉴定序列的3条肽段中,都存在这样的疏水性氨基酸,这可能是其具有抗氧化活性的原因之一。
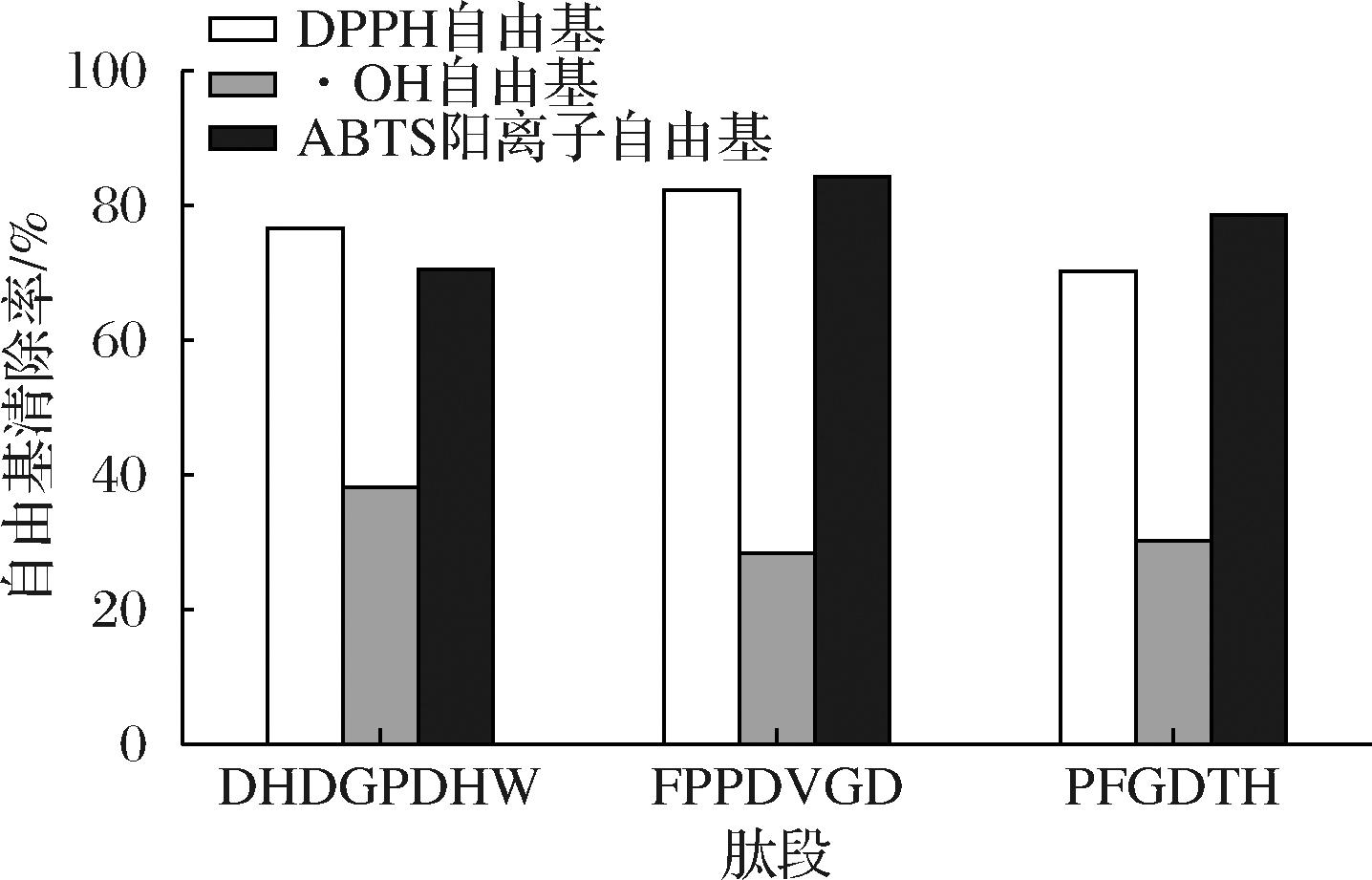
图4 合成肽的抗氧化性能图
Fig.4 Antioxidant performance of synthetic peptides
对接结果如图5所示,生物体内的抗氧化能力多为具有抗氧化能力的小分子化合物与SOD结合后发挥作用,为明确活性肽的抗氧化能力,采用分子对接的方法,将SOD分别与DHDGPDHW、FPPDVGD、PFGDTH进行分子对接。

a-DHDGPDHW;b-FPPDVGD;c-PFGDTH
图5 SOD与活性肽的对接图
Fig.5 Docking diagram of SOD and active peptide
注:绿色虚线表示氢键作用,红色齿轮部分表示疏水作用。
DHDGPDHW与SOD的Gln147、Ser75、Asn188形成氢键,氢键的长度分别为2.93、3.17、2.94 Å;与Cys196、Ile153、Ile72、His71、Ile76、Pro5、Glu191、Ala195、Arg192具有疏水作用,结合能为-6.3 kcal/mol。FPPDVGD与SOD的Gly148、Arg192形成氢键,氢键的长度分别为3.13、2.89、3.14、2.92 Å;与Trp78、Pro8、Ser75、Ile76、Ile72、Gln147、Pro154、Ile153、Ala195、Pro5、Thr79具有疏水作用,结合能为-6.6 kcal/mol。PFGDTH与SOD的His30、His163形成氢键,氢键的长度分别为2.98、3.03、3.03、3.47、3.10 Å;与Lys29、Leu25、Glu162、Tyr34、Ala33、Phe66具有疏水作用,结合能为-6.2 kcal/mol。由此可见,FPPDVGD与SOD的预测结合能最强,猜测FPPDVGD与SOD结合能发挥其抗氧化能力,这也表明抗氧化肽的强抗氧化活性不仅与分子质量和组成其的氨基酸有关,也可能是肽链自身内部氨基酸间或者是两条肽链间的相互作用组成了某个抗氧化位点[21]。
本实验通过测定金华火腿粗肽液的抗氧化能力,对抗氧化肽的抗氧化稳定性进行分析,结果表明在60 ℃,6% NaCl,pH值为7条件下,多肽的抗氧化能力最好。利用凝胶层析色谱对粗肽液进行分离提纯,经过nano-HPLC-MS/MS质谱鉴定,得到氨基酸序列分别为:DHDGPDHW、FPPDVGD、PFGDTH。对肽的序列进行合成,测试合成肽的抗氧化性,对选取的3条肽段与SOD进行分子对接,表明抗氧化肽的强抗氧化活性不仅仅与组成的氨基酸和分子质量有关,也可能是肽段酰胺键之间相互作用形成某种抗氧化位点,共同作用下,增强了对自由基的清除作用。同时,本研究也表明干腌金华火腿产品含有丰富的抗氧化性的活性肽,对人类健康有益,并对活性肽的抗氧化性机制作出一定的解释,也为干腌制品的开发研究提供了一定的理论依据。
[1] 李轻舟, 王红育.发酵肉制品研究现状及展望[J].食品科学, 2011, 32(3):247-251.
LI Q Z, WANG H Y.Present status and prospects of research on fermented meat products[J].Food Science, 2011, 32(3):247-251.
[2] VIRGILI R, SACCANI G, GABBA L, et al.Changes of free amino acids and biogenic amines during extended ageing of Italian dry-cured ham[J].LWT - Food Science and Technology, 2007, 40(5):871-878.
[3] MORA L, GALLEGO M, ARISTOY M C, et al.Peptides naturally generated from ubiquitin-60S ribosomal protein as potential biomarkers of dry-cured ham processing time[J].Food Control, 2015, 48:102-107.
[4] JIMÉNEZ-COLMENERO F, VENTANAS J, TOLDR F.Nutritional composition of dry-cured ham and its role in a healthy diet[J].Meat Science, 2010, 84(4):585-593.
F.Nutritional composition of dry-cured ham and its role in a healthy diet[J].Meat Science, 2010, 84(4):585-593.
[5] MORA L, CALVO L, ESCUDERO E, et al.Differences in pig genotypes influence the generation of peptides in dry-cured ham processing[J].Food Research International, 2016, 86:74-82.
[6] 张俊艳, 贺阳.超氧化物歧化酶研究与应用[J].食品工业, 2012, 33(3):119-122.
ZHANG J Y, HE Y.Literature review of research and application on superoxide dismutase[J].The Food Industry, 2012, 33(3):119-122.
[7] 郑锦晓, 邢路娟, 周光宏, 等.三种中国传统干腌火腿中粗多肽的抗氧化与抑菌活性的比较[J].食品工业科技, 2018, 39(16):75-79;86.
ZHENG J X, XING L J, ZHOU G H, et al.Antioxidant and antibacterial abilities of crude peptides extracted from the three Chinese traditional dry-cured hams[J].Science and Technology of Food Industry, 2018, 39(16):75-79;86.
[8] BRAND-WILLIAMS W, CUVELIER M E, BERSET C.Use of a free radical method to evaluate antioxidant activity[J].LWT - Food Science and Technology, 1995, 28(1):25-30.
[9] BANGAR S P, SANDHU K S, TRIF M, et al.The effect of mild and strong heat treatments on in vitro antioxidant properties of barley (Hordeum vulgare) cultivars[J].Food Analytical Methods, 2022, 15(8):2193-2201.
[10] 那吉, 马娇, 张海芬, 等.三种云南产鲜花醇提液对ABTS自由基的清除作用[J].化学与生物工程, 2019, 36(2):47-50.
NA J, MA J, ZHANG H F, et al.Scavenging effect of ethanol extract from three kinds of Yunnan flowers towards ABTS free radical[J].Chemistry &Bioengineering, 2019, 36(2):47-50.
[11] JING X L, YANG C, ZHANG L P. Characterization and analysis of protein structures in oat bran[J]. Journal of Food Science, 2016, 81(10): C2337-C2343.
[12] 冯雅蓉, 马俪珍, 李黎.SephadexG-25对羊骨胶原降血压肽的分离纯化效果研究[J].肉类研究, 2011, 25(6):30-33.
FENG Y R, MA L Z, LI L.Sephadexg-25 column chromatographic separation, MALDI-TOF-MS analysis and amino acid composition of sheep bone collagen-derived ACE inhibitory peptides[J].Meat Research, 2011, 25(6):30-33.
[13] 沈同. 生物化学(第二版)[M].北京:高等教育出版社, 1991:163-175.
SHEN T.Biochemistry (2nd Edition)[M].Beijing:Higher Education Press, 1991:163-175.
[14] 陶蔚孙. 蛋白质分子基础(第二版)[M].北京:高等教育出版社, 1995:72-86.
TAO W S.Molecular Basis of Protein (2nd Edition)[M].Beijing:Higher Education Press, 1995:72-86.
[15] 魏连会, 董艳, 石杰, 等.汉麻籽抗氧化肽的制备与氨基酸序列分析[J].中国油脂, 2022, 47(4):36-40.
WEI L H, DONG Y, SHI J, et al.Preparation and amino acid sequence analysis of antioxidant peptides from hemp seeds[J].China Oils and Fats, 2022, 47(4):36-40.
[16] 吴宝森, 王桂瑛, 谷大海, 等.诺邓火腿抗氧化肽的分离纯化与鉴定[J].食品与发酵工业, 2018, 44(7):102-109.
WU B S, WANG G Y, GU D H, et al.Isolation, purification and identification of antioxidant peptides of Nuodeng ham[J].Food and Fermentation Industries, 2018, 44(7):102-109.
[17] 邢路娟, 胡亚亚, 周光宏, 等.宣威火腿中粗肽的提取与抗氧化活性鉴定[J].南京农业大学学报, 2015, 38(4):661-666.
XING L J, HU Y Y, ZHOU G H, et al.The extraction and antioxidant activities of crude peptides from Xuanwei ham[J].Journal of Nanjing Agricultural University, 2015, 38(4):661-666.
[18] 吴淇, 邹亮华, 胡学一, 等.大麻二酚类似物的合成及其抗氧化性和抑菌性[J].精细化工, 2022, 39(3):584-591.
WU Q, ZOU L H, HU X Y, et al.Synthesis and antioxidant and bacteriostatic properties of cannabidiol analogs[J].Fine Chemicals, 2022, 39(3):584-591.
[19] CHEN H M, MURAMOTO K, YAMAUCHI F, et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].Journal of Agricultural and Food Chemistry, 1998, 46(1):49-53.
[20] HERN NDEZ-LEDESMA B, D
NDEZ-LEDESMA B, D VALOS A, BARTOLOMÉ B, et al.Preparation of antioxidant enzymatic hydrolysates from alpha-lactalbumin and beta-lactoglobulin.Identification of active peptides by HPLC-MS/MS[J].Journal of Agricultural and Food Chemistry, 2005, 53(3):588-593.
VALOS A, BARTOLOMÉ B, et al.Preparation of antioxidant enzymatic hydrolysates from alpha-lactalbumin and beta-lactoglobulin.Identification of active peptides by HPLC-MS/MS[J].Journal of Agricultural and Food Chemistry, 2005, 53(3):588-593.
[21] 李东辉, 吴红伟, 李国峰, 等.基于质谱及分子对接探究大黄褐变机理[J].天然产物研究与开发, 2022, 34(10):1666-1677.
LI D H, WU H W, LI G F, et al.Investigation on browning mechanism of Rhei Radix et Rhizoma based on mass spectrometry and molecular docking[J].Natural Product Research and Development, 2022, 34(10):1666-1677.