红鳍笛鲷(Lutjanus erythropterus),俗称红鱼,是我国南海重要经济鱼类,其肉质鲜美、营养丰富,深受消费者喜爱[1]。目前,红鱼年捕捞量约为3 000 t[2],主要用于餐饮烹饪或制作鱼干制品,但占鱼体干重2%的鱼鳞尚未得到充分利用[3],不利于行业的健康发展。研究表明,鱼鳞富含胶原蛋白等生物活性物质[4]。胶原蛋白由3条富含羟脯氨酸的多肽链扭曲成三螺旋结构[5],因其安全无毒,具有生物降解性、弱抗原性、成凝胶性和良好的生物相容性,广泛应用于功能食品、生物医药和化妆品等领域[6]。
目前,鱼鳞胶原蛋白的研究已取得阶段性进展。胶原蛋白常用的提取方法主要为酸法、胃蛋白酶法以及热水提取法[7]。酸法提取能最大限度地保留胶原蛋白完整结构,但得率低[7];胃蛋白酶法能切割蛋白端肽区提高得率,且能保留胶原蛋白的三螺旋结构[8];热水提取法具有较高的提取率但会使得胶原蛋白裂解为大分子多肽[9]。利用酸法、胃蛋白酶法从绯鲵鲣鱼鳞中提取出的酸溶性胶原蛋白(acid soluble collagen,ASC)、热水溶性胶原蛋白(hot water soluble collagen,HSC)均保留了完整的三螺旋结构,但在理化性质和结构上存在一定差异[8];林海生等[10]利用热水法、胃蛋白酶法从马氏珠母贝外套膜中提取的胶原蛋白HSC、酶溶性胶原蛋白(pepsin soluble collagen,PSC)在表面形貌结构以及热变性温度上存在明显差异。以上结果表明,不同提取方法对胶原蛋白的结构会产生一定的影响,而结构的不同,会影响到胶原蛋白的用途:具有疏松多孔结构且携带更多负电荷的胶原蛋白在止血生物海绵方面具有更好的应用前景[11];而具有良好的机械性能包括胶原蛋白适合应用于人工皮肤[12]或组织工程学支架[13]。
因此,本研究采用3种常用方法(酸法、胃蛋白酶法、热水提取法)提取红鳍笛鲷鱼鳞胶原蛋白,比较3种方法对胶原蛋白得率、提取率和纯度以及结构和理化特性的影响,探明提取方法与胶原蛋白结构和理化性质间的关联性,为特定红鳍笛鲷鱼鳞胶原蛋白的开发及个性化应用提供方法参考和理论支撑。
红鳍笛鲷鱼鱼鳞,湛江来高科技有限公司,用蒸馏水清洗并晾干,于-20 ℃下保存;胃蛋白酶,北京索莱宝科技有限公司;考马斯亮蓝G-250、无水甲醇、乙酸、NaCl,西陇科学股份有限公司;SDS-PAGE蛋白上样缓冲液、SDS-PAGE电泳液、R-250考马斯亮蓝、BeyoColorTM彩色预染蛋白分子质量标准(6.5~270 kDa)、Bradford蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;L-羟脯氨酸标准品、对二甲氨基苯甲醛、冰乙酸、氯胺T、SDS、丙烯酰胺、过硫酸铵、四甲基乙二胺、KBr,上海麦克林生化科技有限公司。本研究所使用的其它化学品和试剂均为分析纯。
UMVERSAL 320R台式高速冷冻离心机,德国Hettich公司;NanoBrook Omni激光粒度及zeta电位仪,美国布鲁克海文仪器公司;FV300激光共聚焦扫描显微镜,日本奥林巴斯仪器公司;DYY-8C电泳仪,北京六一生物科技有限公司;Spectrum 100傅里叶变换红外光谱仪,Bruker公司;FD-551冷冻干燥机,日本EYELA;UV-756MC紫外分光光度计,尤尼柯(上海)仪器有限公司。
1.3.1 胶原蛋白的提取
1.3.1.1 酸法提取胶原蛋白
参考绯鲵鲣鱼鳞胶原蛋白的提取方法[8],并稍作修改。将鱼鳞按料液比1∶10(g∶mL)加入至0.1 mol/L的NaOH溶液中搅拌6 h脱除杂蛋白,每隔3 h换液1次,用蒸馏水冲洗直至鱼鳞呈中性。将除杂后的鱼鳞按料液比1∶10(g∶mL)加入至0.5 mol/L的HCl溶液中搅拌3 h脱钙,用蒸馏水冲洗直至鱼鳞透明。将前处理后的鱼鳞剪碎,按料液比1∶10(g∶mL)加入到0.5 mol/L乙酸溶液中搅拌48 h,并用双层纱布过滤,收集ASC溶液。将收集后的溶液在9 000 r/min离心30 min并取上清液。离心后的上清液在2.5 mol/L的NaCl溶液下盐析12 h(0.05 mol/L Tris,pH 7.2)并在9 000 r/min离心1 h收集沉淀,沉淀用适量0.5 mol/L乙酸溶解,在0.1 mol/L的乙酸中透析24 h,再用超纯水透析48 h,每4 h换液1次。以上试剂均采用分析纯并在4 ℃下进行。将透析后的胶原蛋白冻干并储存在-20 ℃,得到ASC。
1.3.1.2 胃蛋白酶法提取胶原蛋白
将提取ASC后剩余的鱼鳞按料液比1∶10(g∶mL)添加在含有1%(质量分数)胃蛋白酶的0.5 mol/L的乙酸溶液中搅拌48 h以进一步提取PSC及HSC。提取结束后,采用与提取ASC的方法对提取液进行除杂、盐析、透析、冻干,得到的胶原蛋白为胃蛋白PSC。以上操作均在4 ℃下进行。
1.3.1.3 热水浸提法提取胶原蛋白
将前处理后的鱼鳞剪碎,将鱼鳞按料液比1∶10(g∶mL)加入超纯水中,置于80 ℃恒温水浴搅拌提取2 h,取出溶液用双层纱布过滤,收集滤液,旋蒸浓缩后冷冻干燥得到HSC。
1.3.2 鱼鳞基本成分的测定
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》的方法测定鱼鳞水分;参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》的方法测定鱼鳞蛋白含量;参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》的方法测定鱼鳞灰分含量;参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》的方法测定鱼鳞脂肪含量。
1.3.3 胶原蛋白羟脯氨酸含量的测定
参照GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》的方法测定羟脯氨酸含量。
1.3.4 胶原蛋白得率、纯度的测定
胶原蛋白得率(Y)按公式(1)计算:
(1)
式中:mx,胶原蛋白冻干粉质量,g;m0,鱼鳞质量,g。
胶原蛋白的提取率(E)按公式(2)计算:
(2)
式中:wp,胶原蛋白中羟脯氨酸的质量分数,%;11.10,胶原蛋白换算系数;wc,鱼鳞中胶原蛋白质量分数,%。
胶原蛋白的纯度(P)按公式(3)计算:
P/%=wp×11.10×100
(3)
1.3.5 胶原蛋白理化性质的测定
1.3.5.1 氨基酸组成测定
参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》的方法测定氨基酸组成。
1.3.5.2 紫外全波长扫描分析
分别取适量冻干好的样品溶于0.5 mol/L乙酸溶液中,配制成0.5 mg/mL的胶原蛋白溶液,以0.5 mol/L乙酸溶液作空白对照。在190~400 nm以2 nm/s的速度对不同样品的胶原蛋白溶液进行扫描。
1.3.5.3 SDS-PAGE
将胶原蛋白样品溶解于0.5 mol/L乙酸溶液中,并与SDS上样缓冲液以1∶5的体积比例混合,在上样前100 ℃加热5 min,将10 μL样品加入到进样孔中,使用高分子质量蛋白质标记物(marker)来计算蛋白质的分子质量,使用6%分离胶和5%浓缩胶将蛋白在80 V电压下浓缩,在120 V电压下将蛋白分离。电泳后使用考马斯亮蓝G-250将凝胶染色3 h,在染色完全后,使用甲醇-甲酸(3∶7,体积比)脱色,待凝胶透明后由Bio-Rad gel doc图像系统成像。
1.3.5.4 傅里叶变换红外光谱分析
KBr使用前于120 ℃烘箱烘干4 h以上备用,以1∶200的质量比将冻干的样品及KBr加入玛瑙钵体中研磨后进行压片。使用红外光谱扫描测定4 000~400 cm-1样品透过率,分辨率4 cm-1。
1.3.5.5 Zeta电位分析
将胶原蛋白以0.2 mg/mL溶解在0.5 mol/L乙酸中,在4 ℃条件下搅拌8 h使其彻底溶解,采用1 mol/L NaOH、1 mol/L硝酸调节酸碱度,使样品的pH值在2~11。使用电位分析仪测定样品的Zeta电位。
1.3.5.6 ASC、PSC相对溶解度的测定
将胶原蛋白溶解于0.5 mol/L的乙酸中在4 ℃下搅拌12 h,使其最终浓度为1 mg/mL。将8 mL胶原蛋白溶液转移至离心管中,用6 mol/L NaOH溶液和6 mol/L HCl溶液调节pH值为1~11。将溶液的体积用已调整至与测试样品相同pH值的蒸馏水定容至10 mL。将溶液搅拌1 h并在4 ℃、10 000 r/min离心20 min。取上清液,采用Bradford蛋白浓度测定试剂盒测定上清液中蛋白含量,以牛血清白蛋白作为标准。胶原蛋白的相对溶解度按公式(4)计算:
(4)
式中:RS,相对溶解度,%;Cs,上清液中的蛋白浓度;C0,pH 3时PSC上清液中的蛋白浓度。
1.3.5.7 胶原蛋白表面形貌结构分析
取适量样品固定在导电胶上,喷金时间400 s,加速电压10.00 kV,真空喷金处理后,采用40、100、200、500放大倍数的扫描电子显微镜观察3种胶原蛋白的微观结构。
实验数据使用Origin 2021软件作图,数据间的显著性差异采用SPSS 25.0软件分析,所有实验均重复3次,数据间显著性水平设置为P<0.05。
根据测定结果,红鱼鱼鳞中含有(15.90±0.08)%的水分,(0.43±0.04)%的脂肪以及(46.32±0.78)%的蛋白质。鱼鳞中羟脯氨酸含量为(18.05±0.64) mg/g,与绯鲵鲣的结果[(21.32±0.08) mg/g]类似[8],低于鲢鱼的(85.1±0.09) mg/g,这可能是由于绯鲵鲣鱼鳞和本研究采用的红鳍笛鲷鱼鳞均以湿重计算羟脯氨酸含量,导致羟脯氨酸含量较鲢鱼鱼鳞低。胶原蛋白占鱼鳞总重的20.04%,高于黄河鲤鱼的13.4%[14],表明红鳍笛鲷鱼鳞是提取胶原蛋白的良好原料。羟磷灰石[Ca10(PO4)6(OH)2]是鱼鳞无机成分(即灰分)的主要成分[15],构成了鱼鳞的上部骨层和下部纤维层[8]。鱼鳞主要由钙盐组成的刚性表面层和主要由胶原蛋白组成的纤维内层组成,随年龄增长,鱼鳞遵循同心生长环的模式逐渐矿化,灰分的含量升高[16]。红鳍笛鲷鱼鳞中灰分含量较高,达到了(41.15±0.47)%,高于鳙鱼的21.6%[15]和黄河鲤鱼的(24.67±0.08)%[14]。这是由于本研究采用的市售红鳍笛鲷体型一般较大,年龄偏大是其灰分高于其他鱼种的重要原因。脱灰处理之后,灰分含量为(2.11±0.56)%,脱灰处理使得灰分去除率达94%以上,适合胶原蛋白的进一步提取。
如图1所示,ASC的得率、提取率较低,可能是因为醛基与羟脯氨酸、赖氨酸在端肽螺旋位点反应,通过共价键形成交联,也有可能是分子间交联[17],使ASC在0.5 mol/L的乙酸中溶解度低。与绯鲵鲣[8]的结果相似,PSC的得率是ASC的2.5倍,表明胃蛋白酶的添加可以有效地提升胶原蛋白得率,是因为胃蛋白酶可以特异性地切割端肽区的交联分子[18],提升了PSC的溶解度。HSC的得率和提取率最高,分别达到了(10.05±0.61)%,(45.25±2.74)%,热处理破坏了胶原蛋白的三螺旋结构[10],胶原蛋白降解为大分子胶原肽,导致亲水性基团暴露,提高了HSC的得率和提取率。HSC中胶原蛋白纯度显著高于ASC及PSC,达到90%以上,可能是由于HSC的制备工艺简单,使其杂质更少,提示HSC是制备胶原肽的良好原料。
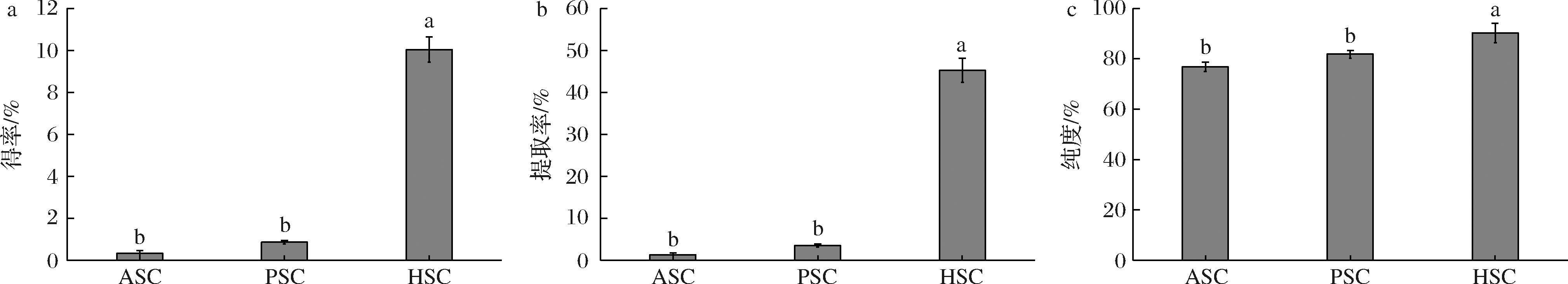
a-得率;b-提取率;c-纯度
图1 PSC、ASC、HSC的得率、提取率和纯度
Fig.1 Yield, extraction rate, and purity of PSC, ASC, and HSC
注:同一指标不同字母代表差异显著(P<0.05)(下同)。
由表1可知,由于胶原蛋白以特征性的氨基酸重复序列(Gly-Pro-Hyp)n构成三螺旋结构,因此胶原蛋白中甘氨酸含量是最丰富的[4]。ASC、PSC以及HSC中甘氨酸含量最高,分别为33.36%、34.72%、35.32%,大约占据氨基酸总量的1/3,这个结果与绯鲵鲣鱼鳞(33.6%、34.0%)[8]、日本和越南的马鲭鱼鱼皮(33.8%、33.6%)类似[19]。此外HSC、ASC和PSC中含量较高的为丙氨酸、天门冬氨酸、谷氨酸、精氨酸以及亚氨基酸(羟脯氨酸及脯氨酸),这个结果与其他鱼种的胶原蛋白类似[19-20]。3种胶原蛋白中,HSC中的甘氨酸、脯氨酸、羟脯氨酸含量较高,其次为PSC,ASC中含量最少。羟脯氨酸作为胶原蛋白特征氨基酸,在同一物种中的含量相对稳定,因此羟脯氨酸含量在一定程度上反映了胶原蛋白的纯度。鱼鳞中的蛋白以胶原蛋白和角蛋白为主,热水处理提升了胶原蛋白的溶解度,而角蛋白残留在鱼鳞内,导致HSC纯度更高,进而提升其羟脯氨酸含量。甘氨酸是构成胶原蛋白三螺旋结构的特征性氨基酸[4],而脯氨酸是机体内合成羟脯氨酸的前体,不同提取工艺对两者含量的影响与羟脯氨酸一致,表明这两种氨基酸的变化可能也与胶原蛋白的纯度有关。谷氨酸、天门冬氨酸是带负电的氨基酸,高含量的谷氨酸、天门冬氨酸可能导致蛋白的等电点出现在较低的pH下[8],在低等电点胶原蛋白如绯鲵鲣鱼鳞[8]、黄鳍金枪鱼鱼鳔[21]均发现较高含量的谷氨酸及天门冬氨酸。HSC、PSC、ASC中谷氨酸、天门冬氨酸含量较高,分别为(6.59%、6.77%、7.07%)和(4.32%、4.34%、4.57%),与绯鲵鲣鱼鳞中PSC、ASC的谷氨酸、天门冬氨酸含量(6.9%、7.1%)、(4.2%、4.3%)接近[8]。亚氨基酸包括脯氨酸和羟脯氨酸,是评价胶原蛋白热稳定性的重要因素,亚氨基酸占总氨基酸的比例取决于鱼的栖息地的温度,一般来说,热带、温带的鱼类,其胶原蛋白中的亚氨基酸含量较高,而冷水鱼的亚氨酸含量更低[19]。HSC、ASC和PSC中亚氨基酸比例较冷水鱼高,分别为18.28%、17.54%、18.30%,更接近罗非鱼鱼鳞的(20.7%)[22],高于冷水鱼如深海红鱼鱼皮的16%[20]以及马鲭鱼鱼鳞的16.5%[19]。这可能是由于红鳍笛鲷栖息于亚热带及热带[23],导致其亚氨酸含量较高。赖氨酸参与胶原分子端肽的交联,HSC、ASC和PSC均含有少量的赖氨酸,含量为2.86%、2.77%、2.65%,HSC、PSC赖氨酸含量低于ASC,可能是胃蛋白酶对端肽区的切割以及高温提取对端肽区交联的破坏,导致HSC、PSC中赖氨酸含量减少。抗氧化活性较高的肽中疏水性氨基酸含量普遍较高,疏水性氨基酸由于存在咪唑环作为重要质子,可以直接转移电子快速清除自由基,并促进疏水性靶点与细胞膜的相互作用,增强肽的抗氧化活性[24]。HSC中疏水性氨基酸质量分数高于ASC及PSC,达到34.30%。HSC含有较多的疏水性氨基酸,提示其适合作为制备抗氧化肽的原料。
表1 PSC、ASC、HSC的氨基酸组成
Table 1 Amino acid composition of PSC,ASC,and HSC

氨基酸PSCASCHSC相对含量(每100个氨基酸残基)质量分数/%相对含量(每100个氨基酸残基)质量分数/%相对含量(每100个氨基酸残基)质量分数/%天门冬氨酸4.34 4.87 4.57 5.30 4.32 5.42 苏氨酸2.60 2.61 2.84 2.94 2.35 2.64 丝氨酸3.04 2.70 3.15 2.88 2.99 2.96 谷氨酸6.77 8.41 7.07 9.06 6.59 9.14 甘氨酸34.72 22.00 33.36 21.80 35.32 25.00 丙氨酸13.57 10.20 13.15 10.20 13.69 11.50 缬氨酸2.06 2.04 2.39 2.44 1.89 2.09 蛋氨酸1.40 1.76 1.56 2.02 1.40 1.97 异亮氨酸0.75 0.83 1.01 1.15 0.66 0.82 亮氨酸2.03 2.25 2.33 2.66 2.02 2.50 酪氨酸0.29 0.45 0.63 0.99 0.42 0.71 苯丙氨酸1.32 1.84 1.47 2.12 1.29 2.01 赖氨酸2.77 3.42 2.86 3.64 2.65 3.65 组氨酸0.65 0.85 0.80 1.08 0.65 0.95 精氨酸5.39 7.92 5.28 8.00 5.48 9.00 脯氨酸11.63 11.30 11.47 11.50 11.70 12.70 羟脯氨酸6.67 7.38 6.06 6.92 6.58 8.13 疏水性氨基酸33.05 30.67 34.01 33.08 33.08 34.30 亚氨酸18.30 18.68 17.54 18.42 18.28 20.83
胶原蛋白肽链中含有的—C![]() O、—COOH和CO—NH2 等生色基团,可作为判断胶原蛋白类型的重要标志[21]。胶原蛋白中大量的羟脯氨酸、脯氨酸、甘氨酸的存在,使其在230 nm处有强吸收[25]。
O、—COOH和CO—NH2 等生色基团,可作为判断胶原蛋白类型的重要标志[21]。胶原蛋白中大量的羟脯氨酸、脯氨酸、甘氨酸的存在,使其在230 nm处有强吸收[25]。
如图2所示,HSC、ASC和PSC的最大吸收峰均出现在220~230 nm,与I型胶原蛋白的紫外吸收一致,如黄河鲤鱼鱼鳞[14]、鳙鱼鱼鳞[26],因此鉴定3种蛋白为Ⅰ型胶原蛋白。ASC在此附近的吸收峰强度较弱,可能是其溶解性较低造成的。此外,一些发色氨基酸(如组氨酸、苯丙氨酸、酪氨酸等)在250~288 nm处存在强吸收[27],在280 nm附近存在微弱的吸收峰表明3种胶原蛋白含有少量的芳香族氨基酸,这个结果与氨基酸组成的结果一致,3种胶原蛋白中含有少量的芳香族氨基酸,占总氨基酸组成的3%以下。在200~220 nm的紫外吸收,是由胶原蛋白中—COOH、—COOR引起的[25],对应红外光谱中出现的酰胺Ⅰ带。
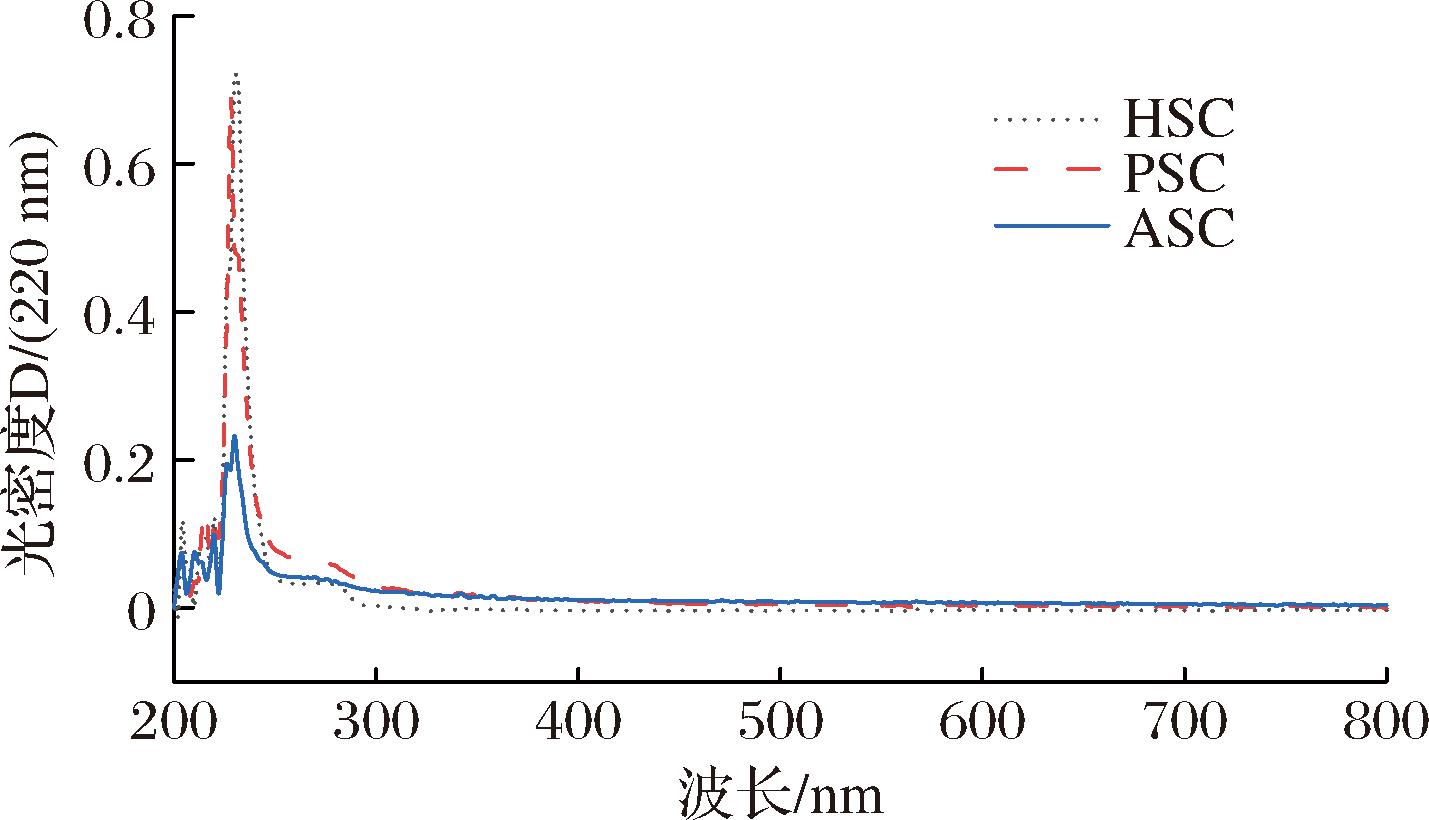
图2 PSC、ASC、HSC的紫外吸收光谱图
Fig.2 Ultraviolet absorption spectrum of PSC, ASC, and HSC
如图3所示,HSC、ASC和PSC均在270 kDa处存在由2条链组成的β带;在分子质量为95~130 kDa均存在2条不同的α链,分别为α-1链、α-2链。α-1链和α-2链是Ⅰ型胶原蛋白的一个基本特征[17],鉴于此HSC、ASC和PSC均可鉴定为Ⅰ型胶原蛋白。与绯鲵鲣[8]、深海红鱼[20]的结果类似,PSC相较于ASC,β带更浅而α链更深,γ带在PSC中消失,这是由于胃蛋白酶更倾向于切割端肽区[8],使β带和γ带容易转化为α链[20]。胶原蛋白在热处理后会引起氢键或静电性键断裂以及胶原的三股螺旋结构解体最终形成明胶[28]。有研究发现,明胶电泳特性表现为β带、α链受热降解,分子质量变小,没有明显的电泳条带[28]。HSC与ASC相比,β带、α链更浅且出现了低分子质量的条带,出现了明胶的电泳特征,表明热处理可能破坏了胶原蛋白的三螺旋结构。ASC在分子质量低于110 kDa没有出现明显的条带,表明胶原蛋白在提取过程未降解成更小分子胶原肽[29]。上述结果表明,HSC、ASC和PSC均为Ⅰ型胶原蛋白,酸提法能完整地保留胶原蛋白的分子结构;胃蛋白酶能够切割和去除胶原蛋白端肽区的小段肽,并使其低分子质量中出现[30];HSC呈现出明胶的电泳特性,表现为β带、α链变浅以及低分子质量的条带,表明热处理破坏了胶原蛋白的三螺旋结构。
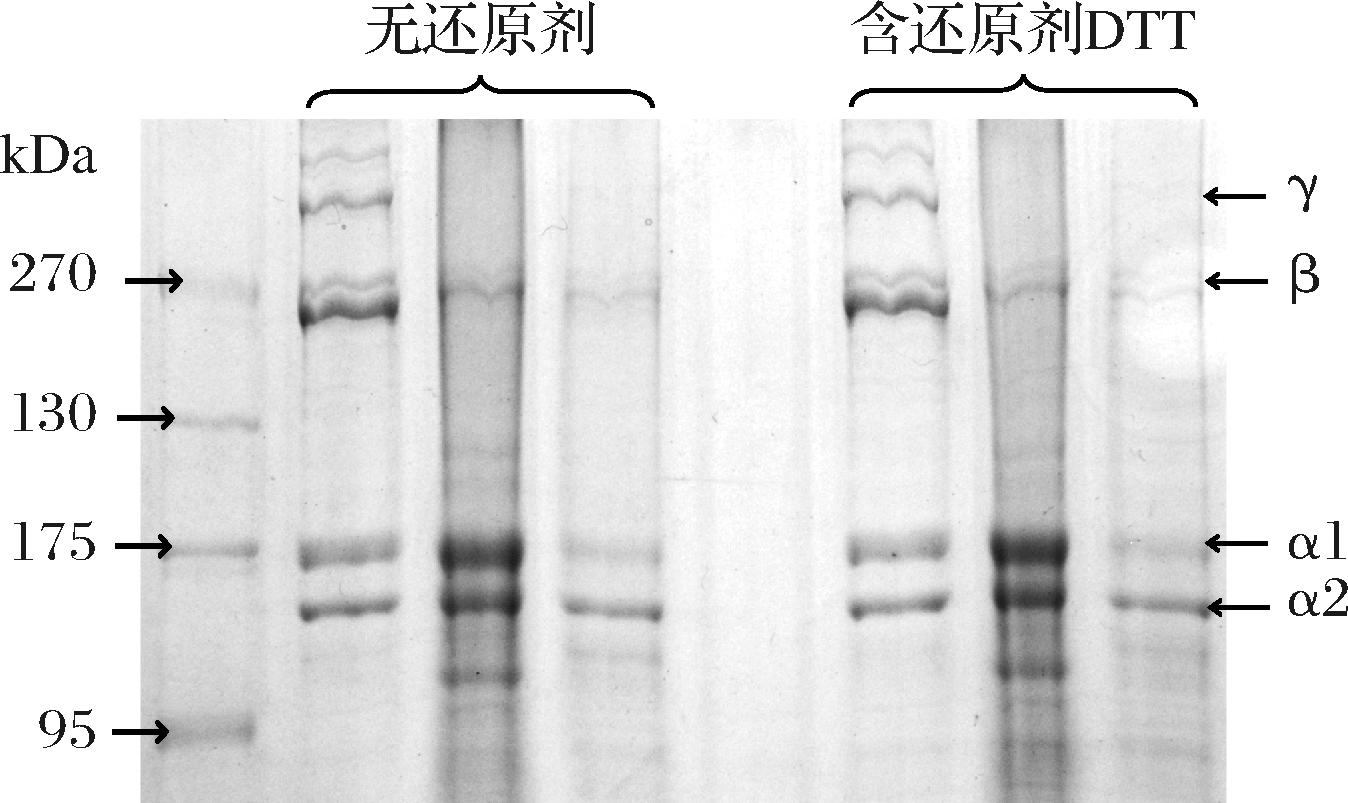
图3 PSC、ASC、HSC的SDS-PAGE图谱
Fig.3 SDS-PAGE pattern of PSC, ASC, and HSC
ASC和PSC在红外吸收光谱中均显示出5种主要的吸收峰(图4),分别为酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带以及A带B带,与其他鱼鳞胶原蛋白类似[14]。而HSC的酰胺Ⅱ带消失。在3 400~3 440 cm-1的波长范围内,N—H拉伸振动伴随着氢键合成形成酰胺A带,当N—H基团与肽链中的H键接触时,酰胺A带的位置开始向低频转移[8]。HSC、ASC和PSC分别在3 426、3 395、3 420 cm-1处检测到酰胺A带。PSC、HSC的酰胺A带相较于ASC在更高波长处出现,推测胃蛋白酶以及热处理破坏了氢键,导致PSC、HSC的酰胺A带出现在更高的波长[21]。HSC、PSC、ASC的酰胺B带分别在2 978、2 978、2 982 cm-1处出现,酰胺B带的出现与CH2不对称拉伸有关。通常,酰胺Ⅰ带位于1 600~1 700 cm-1,与C![]() O拉伸振动或H键耦合COO相关。HSC、PSC、ASC的酰胺Ⅰ带出现在1 626、1 614、1 620 cm-1处,符合酰胺Ⅰ带的出峰位置。酰胺Ⅱ带与的N—H的平面弯曲和C—N拉伸振动有关,PSC、ASC的酰胺Ⅱ带出现在1 584、1 578 cm-1,热处理引起氢键的断裂可能导致了HSC酰胺Ⅱ带消失。酰胺Ⅲ带通常位于1 220~1 240 cm-1,与酰胺链接的C—N拉伸和N—H平面弯曲,以及甘氨酸主链和脯氨酸侧链的CH2基团的振动有关[31],HSC、PSC、ASC酰胺Ⅲ带出现在1 240、1 238、1 238 cm-1处。酰胺Ⅲ带的吸收峰高度与1 452 cm-1附近的吸收峰高度的比值可用于指示三螺旋结构的完整性,比值接近1,可以证明胶原蛋白完好地保留了三螺旋结构[22]。结果显示PSC、ASC中酰胺Ⅲ带的吸收强度与1 452 cm-1附近吸收峰比值分别为1.016、0.996,两者的比值接近1,表明PSC、ASC具有完整的三螺旋结构。而HSC中的比值最大,达到1.064,酰胺Ⅲ带的吸收强度与1 452 cm-1附近吸收峰强度出现较大差异,提示热水处理可能破坏了三螺旋结构,与SDS-PAGE的结果一致。
O拉伸振动或H键耦合COO相关。HSC、PSC、ASC的酰胺Ⅰ带出现在1 626、1 614、1 620 cm-1处,符合酰胺Ⅰ带的出峰位置。酰胺Ⅱ带与的N—H的平面弯曲和C—N拉伸振动有关,PSC、ASC的酰胺Ⅱ带出现在1 584、1 578 cm-1,热处理引起氢键的断裂可能导致了HSC酰胺Ⅱ带消失。酰胺Ⅲ带通常位于1 220~1 240 cm-1,与酰胺链接的C—N拉伸和N—H平面弯曲,以及甘氨酸主链和脯氨酸侧链的CH2基团的振动有关[31],HSC、PSC、ASC酰胺Ⅲ带出现在1 240、1 238、1 238 cm-1处。酰胺Ⅲ带的吸收峰高度与1 452 cm-1附近的吸收峰高度的比值可用于指示三螺旋结构的完整性,比值接近1,可以证明胶原蛋白完好地保留了三螺旋结构[22]。结果显示PSC、ASC中酰胺Ⅲ带的吸收强度与1 452 cm-1附近吸收峰比值分别为1.016、0.996,两者的比值接近1,表明PSC、ASC具有完整的三螺旋结构。而HSC中的比值最大,达到1.064,酰胺Ⅲ带的吸收强度与1 452 cm-1附近吸收峰强度出现较大差异,提示热水处理可能破坏了三螺旋结构,与SDS-PAGE的结果一致。
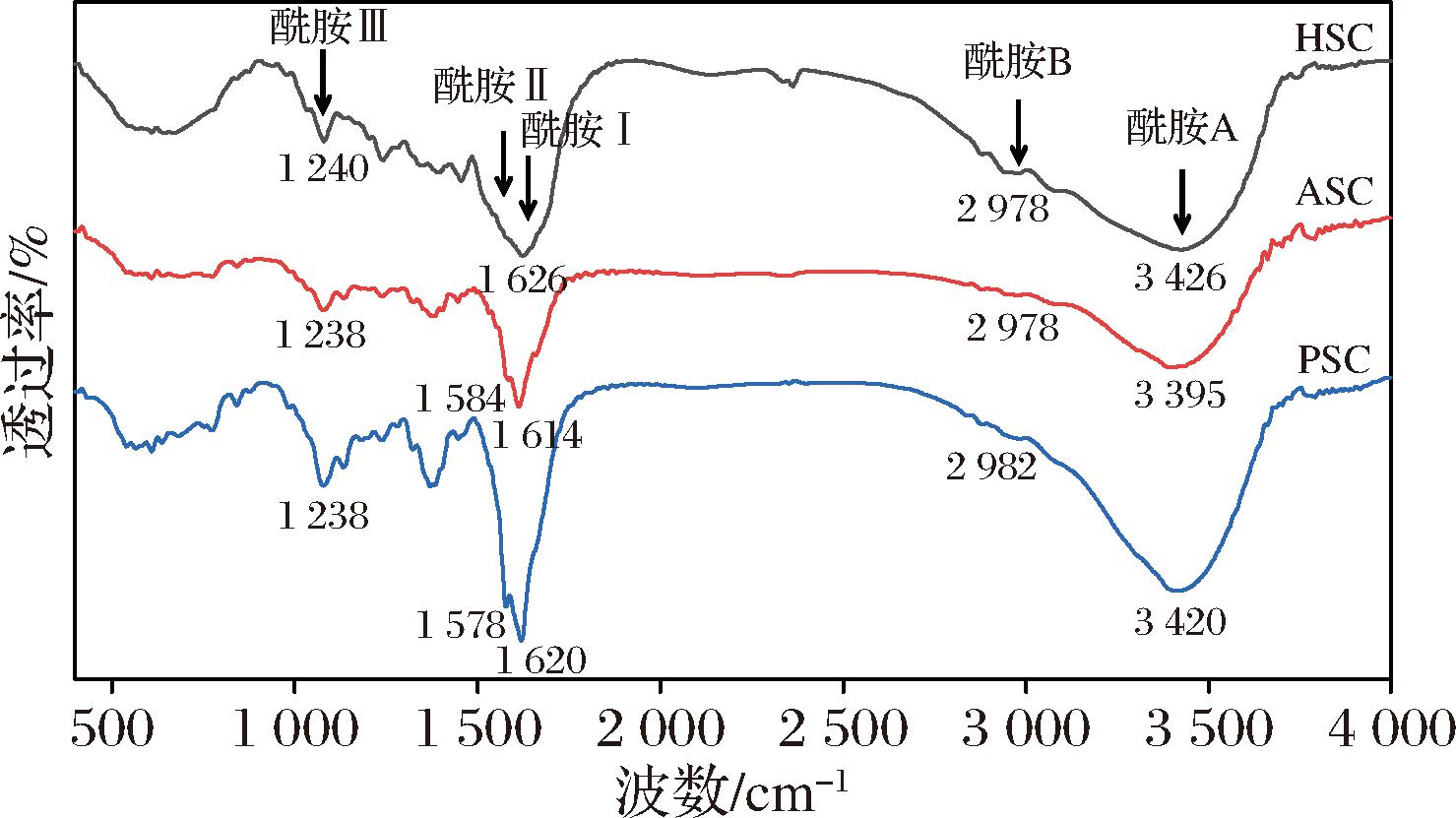
图4 PSC、ASC、HSC的红外光谱
Fig.4 Infrared spectrum of PSC, ASC, and HSC
如图5所示,pH值为2~5时,3种胶原蛋白都带正电荷,而pH值为6~11时,3种胶原蛋白都带负电荷。当pH值为5~6,HSC、PSC、ASC的电位值为0。与黄鳍金枪鱼鱼鳔[21]、绯鲵鲣[8]的研究类似,这些研究中的胶原蛋白酸性氨基酸(谷氨酸、天门冬氨酸)含量较高,在pH<6时电位等于零,而在罗非鱼鱼鳞和鱼皮胶原蛋白中酸性氨基酸含量相对较低,电位为零出现在更高的pH处(6.42、6.82)[22]。HSC、PSC、ASC在pH值介于5~6时电位等于零,可能是由于其含有较多酸性氨基酸(谷氨酸、天门冬氨酸)导致的(表1)[8]。人体血液呈弱碱性,在血液介质下红鳍笛鲷鱼鳞胶原蛋白所带的负电荷可以激活部分凝血因子,加速血小板的聚集[11],提示红鳍笛鲷鱼鳞胶原蛋白在止血海绵中的应用。
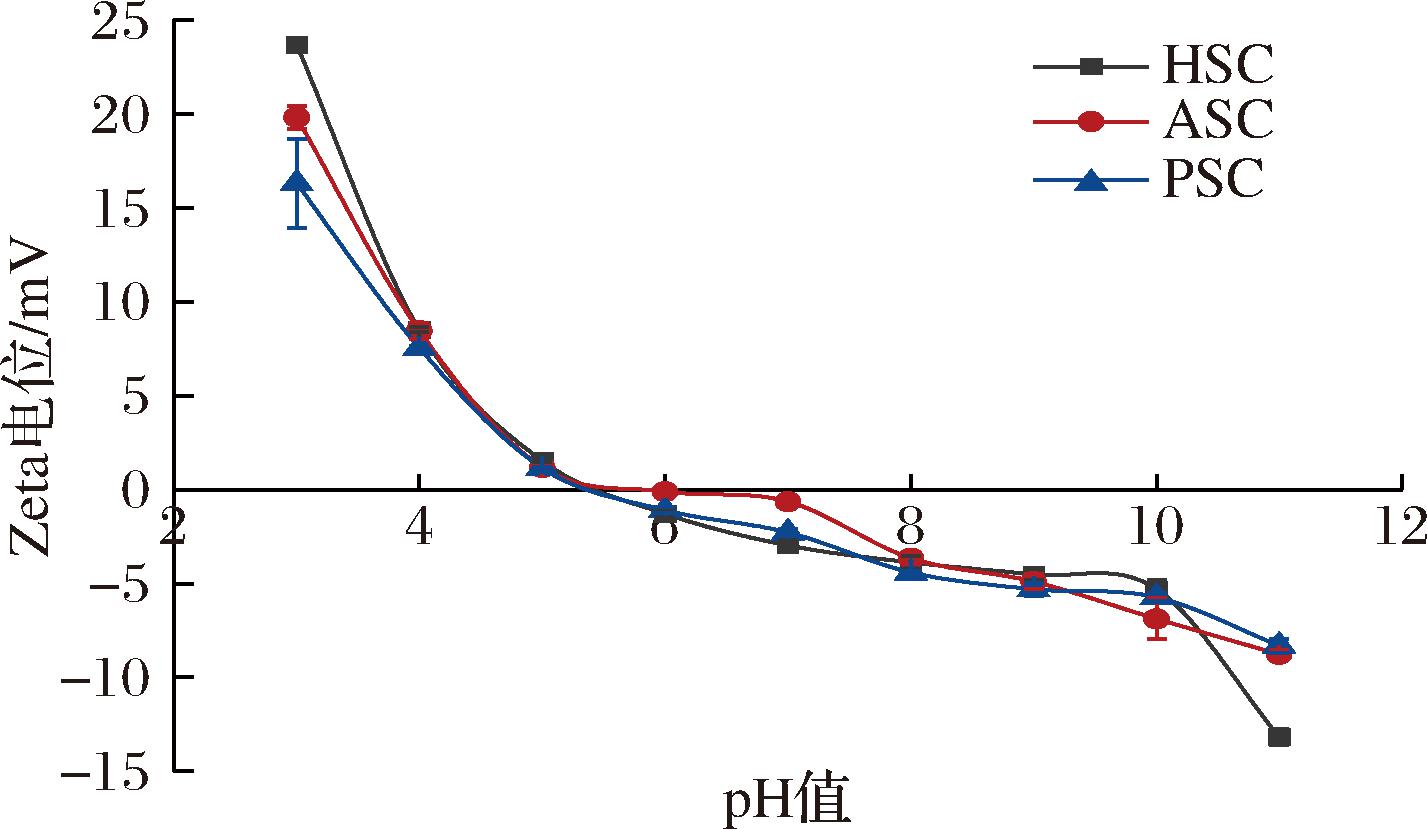
图5 PSC、ASC、HSC在不同pH下的Zeta电位
Fig.5 Zeta potential of PSC, ASC, and HSC at different pH
如图6所示, pH值为1~4时,胶原蛋白显示出较高的溶解度。相同的结果出现在罗非鱼鱼鳞[22]、绯鲵鲣鱼鳞[8]中。随着pH值升高,胶原蛋白的溶解性迅速降低,并在pH 6时达到最低点。当pH接近等电点时,蛋白表面净电荷趋近于零,疏水-疏水相互作用增加,导致蛋白质沉淀和聚集导致溶解性降低[32]。pH值为1~4时,PSC的溶解度大于ASC,这是因为胃蛋白酶对胶原蛋白端肽区切割破坏了分子间交联,暴露更多的亲水性基团,导致溶解度升高。这也解释了PSC得率高于ASC的原因。随着pH的升高,强碱性可能导致蛋白的展开和解离,暴露更多的亲水性基团[18],蛋白表面附着上负电荷,极性升高,提高了蛋白的溶解性。相较于传统的止血海绵羧甲基纤维素钠和羟乙基纤维素易溶解和溃散的缺点[33],红鳍笛鲷鱼鳞胶原蛋白在血液的弱碱性介质中的低溶解度有助于维持胶原蛋白止血海绵的完整形态,防止海绵结构的溃散。
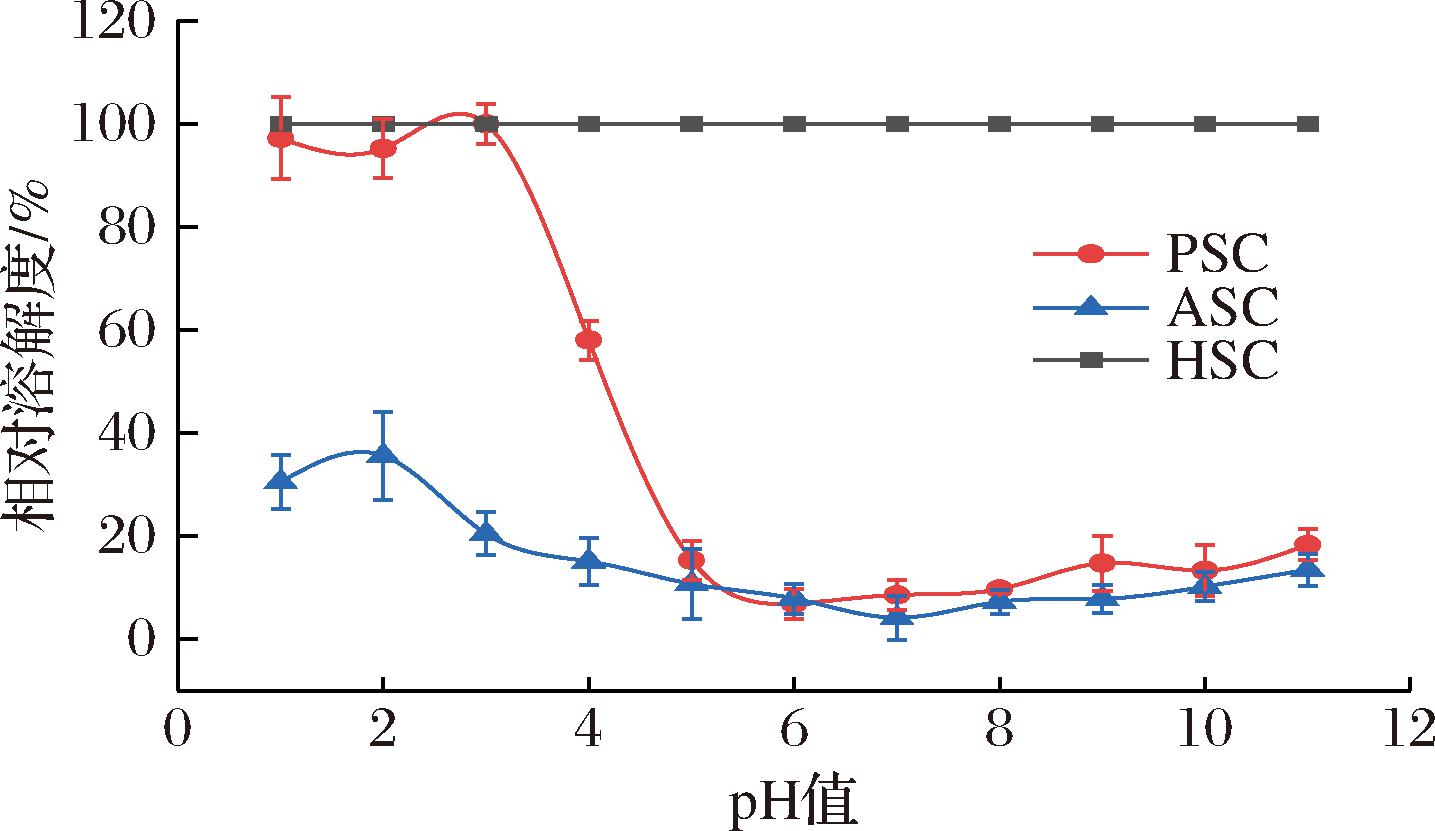
图6 PSC、ASC、HSC在不同pH下的相对溶解度
Fig.6 Relative solubility of PSC, ASC, and HSC at different pH
如图7所示,不同提取方法得到的胶原蛋白的微观均存在显著差异。与鳎鱼皮中提取的胶原蛋白类似[34],在低倍镜下,ASC由不规则的致密片状相互堆叠,呈絮状且表面粗糙起皱;在高倍镜下,ASC呈现无序缠绕的线圈状结构,薄片之间由随机卷曲的细丝连接,表明ASC保留了较为完整的纤维结构,相互缠绕的纤维细丝赋予其良好的机械强度,后续可以测定其延展性、硬度和弹性等力学性能探究其作为生物支架在修复皮肤或骨骼上的应用[12-13]。PSC在低倍镜下呈现疏松多孔的网状结构;在高倍镜下呈现独立不规则的褶皱堆叠,与ASC相比,蛋白薄片表面更光滑,薄片之间的纤维细丝消失,推测在胃蛋白酶的作用下,端肽区交联片段被切碎,导致胶原结构发生改变。PSC疏松多孔的特性,提示其在保湿及生物海绵中的应用[11]。HSC结构较PSC和ASC更加有序,呈排列紧密的多层薄片状结构,提示热水处理能使胶原蛋白发生变性与交联,呈现出明胶的凝胶特性[10]。

a-ASC;b-PSC;c-HSC
图7 PSC、ASC、HSC的扫描电镜图
Fig.7 SEM images of PSC, ASC, and HSC
本研究探究不同提取方式对红鳍笛鲷鱼鳞胶原蛋白理化特性的影响,热水提取法会破坏胶原蛋白的三螺旋结构,而酸提取法和胃蛋白酶提取法未破坏蛋白的三螺旋结构。PSC具有疏松多孔的特性,且在弱碱性条件下溶解性较低且带负电荷,有望被开发为新型医疗止血海绵。ASC的纤维细丝结构使其在生物支架方面具有良好的应用潜力。热水提取法得率高,得到的HSC分子结构更松散,且具有更高的纯度以及更多的疏水性氨基酸,是制备抗氧化肽的良好原料。综上,HSC、PSC和ASC的分子结构特征、理化特性和表面形貌结构均展现出较大的差异,可根据产品需求采用特定的提取方法。
[1] CUI K, FU Z L, CHENG D C, et al.Development of immune functionality in larval and juvenile crimson snapper Lutjanus erythropterus (Bloch 1790)[J].Aquaculture Reports, 2018, 10:1-7.
[2] 冯波, 陈文河, 颜云榕.基于体重的北部湾红鳍笛鲷单位补充量渔获量与亲体生物量的研究[J].上海海洋大学学报, 2009, 18(4):460-465.
FENG B, CHEN W H, YAN Y R.A research on weight-based yield per recruit and spawning-biomass per recruit of Lutjanus erythropterus in Beibu Gulf[J].Journal of Shanghai Ocean University, 2009, 18(4):460-465.
[3] ZALL R.Unconventional techniques to deal with waste recovery or treatment schemes[J].Managing Food Industry Waste, 2004:105-113.
[4] ZHANG F X, WANG A N, LI Z H, et al.Preparation and characterisation of collagen from freshwater fish scales[J].Food and Nutrition Sciences, 2011, 2(8):818-823.
[5] SHOULDERS M D, RAINES R T.Collagen structure and stability[J].Annual Review of Biochemistry, 2009, 78:929-958.
[6] SIONKOWSKA A, SKRZY SKI S,
SKI S,  MIECHOWSKI K, et al.The review of versatile application of collagen[J].Polymers for Advanced Technologies, 2017, 28(1):4-9.
MIECHOWSKI K, et al.The review of versatile application of collagen[J].Polymers for Advanced Technologies, 2017, 28(1):4-9.
[7] 王娟娟, 刘勋, 周学, 等.胶原蛋白的研究进展及其应用[J].中国皮革, 2022, 51(7):1-7.
WANG J J, LIU X, ZHOU X, et al.Research progress and application of collagen[J].China Leather, 2022, 51(7):1-7.
[8] MATMAROH K, BENJAKUL S, PRODPRAN T, et al.Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish (Parupeneus heptacanthus)[J].Food Chemistry, 2011, 129(3):1179-1186.
[9] 刘焱, 刘伦伦, 罗灿, 等.不同方法提取的草鱼鱼皮胶原蛋白性质比较[J].食品研究与开发, 2015, 36(8):34-39.
LIU Y, LIU L L, LUO C, et al.Property comparison of grass carp skin collagen extracted by different method[J].Food Research and Development, 2015, 36(8):34-39.
[10] 林海生, 王雯, 秦小明, 等.不同方法提取马氏珠母贝外套膜胶原蛋白理化性质比较[J].广东海洋大学学报, 2022, 42(1):106-112.
LIN H S, WANG W, QIN X M, et al.Characterization of collagens from mantle of Pinctada martensii by different extraction methods[J].Journal of Guangdong Ocean University, 2022, 42(1):106-112.
[11] 魏冉. 天然高分子基多孔止血海绵的制备及性能研究进展[J].化学推进剂与高分子材料, 2019, 17(6):20-27.
WEI R.Research progress in preparation and performance of natural polymer-based porous hemostatic sponge[J].Chemical Propellants &Polymeric Materials, 2019, 17(6):20-27.
[12] 田静. 胶原蛋白基人工皮肤的制备与性质研究[D].兰州:兰州大学, 2022.
TIAN J.Development and Characterization of Collagen-Based Artificial Skin[D].Lanzhou:Lanzhou University, 2022.
[13] 何会霞, 王莉莉, 蔡向东, 等.牦牛胶原蛋白-羟基磷灰石-海藻酸钠3D支架高效修复骨缺损[J].中国科学:化学, 2023, 53(9):1750-1760.
HE H X, WANG L L, CAI X D, et al.A 3D scaffold of yak collagen-hydroxyapatite-sodium alginate for efficiently repairing bone defects[J].Scientia Sinica Chimica, 2023, 53(9):1750-1760.
[14] 肖枫. 黄河鲤鱼鳞胶原蛋白的性质及胶原肽活性研究[D].镇江 江苏大学, 2014.
XIAO F.Study on the characterization of collagen and bioactive peptides from Cyprinus carpio haematopterus scale[D].Zhenjiang:Jiangsu University,2014.
[15] 曾芳. 鱼鳞胶原蛋白、明胶和羟基磷灰石综合提取研究[D].南昌:南昌大学, 2013.
ZENG F.Study on comprehensive extraction of fish scale collagen, gelatin and hydroxyapatite[D].Nanchang:Nanchang University, 2013.
[16] LIU W T, ZHANG Y, LI G Y, et al.Structure and composition of teleost scales from snakehead Channa argus (Cantor) (Perciformes:Channidae)[J].Journal of Fish Biology, 2008, 72(4):1055-1067.
[17] KNOTT L, BAILEY A J.Collagen cross-links in mineralizing tissues:A review of their chemistry, function, and clinical relevance[J].Bone, 1998, 22(3):181-187.
[18] NALINANON S, BENJAKUL S, KISHIMURA H.Collagens from the skin of arabesque greenling (Pleurogrammus azonus) solubilized with the aid of acetic acid and pepsin from albacore tuna (Thunnus alalunga) stomach[J].Journal of the Science of Food and Agriculture, 2010, 90(9):1492-1500.
[19] MINH THUY L, OKAZAKI E, OSAKO K.Isolation and characterization of acid-soluble collagen from the scales of marine fishes from Japan and Vietnam[J].Food Chemistry, 2014, 149:264-270.
[20] WANG L, AN X, XIN Z, et al.Isolation and characterization of collagen from the skin of deep-sea redfish (Sebastes mentella)[J].Journal of Food Science, 2007, 72(8):E450-E455.
[21] KAEWDANG O, BENJAKUL S, KAEWMANEE T, et al.Characteristics of collagens from the swim bladders of yellowfin tuna (Thunnus albacares)[J].Food Chemistry, 2014, 155:264-270.
[22] CHEN J D, LI L, YI R Z, et al.Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromis niloticus)[J].LWT-Food Science and Technology, 2016, 66:453-459.
[23] 陈涛, 李伟峰.红鳍笛鲷肌肉营养成分分析[J].海洋湖沼通报, 2016(6):67-72.
CHEN T, LI W F.Analysis of muscle nutrients of Lutjanus erythopterus[J].Transactions of Oceanology and Limnology, 2016(6):67-72.
[24] ZOU T B, HE T P, LI H B, et al.The structure-activity relationship of the antioxidant peptides from natural proteins[J].Molecules, 2016, 21(1):72.
[25] HE L, LAN W T, WANG Y, et al.Extraction and characterization of self-assembled collagen isolated from grass carp and crucian carp[J].Foods, 2019, 8(9):396.
[26] 黄宇玫, 李敏, 曾芳, 等.酸提和酶解两步法连续提取鳙鱼鱼鳞胶原蛋白工艺研究[J].食品科技, 2019, 44(2):152-158.
HUANG Y M, LI M, ZENG F, et al.Extraction process of bighead fish scale collagen by two-step method of acid extraction and enzymatic hydrolysis[J].Food Science and Technology, 2019, 44(2):152-158.
[27] WEI P, ZHENG H, SHI Z Y, et al.Isolation and characterization of acid-soluble collagen and pepsin-soluble collagen from the skin of hybrid sturgeon[J].Journal of Wuhan University of Technology-Mater.Sci.Ed., 2019, 34(4):950-959.
[28] 汲聪玲, 陆剑锋, 吕顺, 等.不同提取温度对白鲢鱼皮明胶理化性质的影响[J].食品科学, 2016, 37(9):117-122.
JI C L, LU J F, LYU S, et al.Effect of extraction temperature on physical and chemical properties of gelatin from silver carp skin[J].Food Science, 2016, 37(9):117-122.
[29] LIU Y W, MA D H, WANG Y H, et al.A comparative study of the properties and self-aggregation behavior of collagens from the scales and skin of grass carp (Ctenopharyngodon idella)[J].International Journal of Biological Macromolecules, 2018, 106:516-522.
[30] WU J L, GUO X B, LIU H, et al.Isolation and comparative study on the characterization of guanidine hydrochloride soluble collagen and pepsin soluble collagen from the body of surf clam shell (Coelomactra antiquata)[J].Foods, 2019, 8(1):11.
[31] SINTHUSAMRAN S, BENJAKUL S, KISHIMURA H.Comparative study on molecular characteristics of acid soluble collagens from skin and swim bladder of seabass (Lates calcarifer)[J].Food Chemistry, 2013, 138(4):2435-2441.
[32] TAN Y Q, CHANG S K C.Isolation and characterization of collagen extracted from channel catfish (Ictalurus punctatus) skin[J].Food Chemistry, 2018, 242:147-155.
[33] 何坤, 崔含蕊, 毛战强, 等.胶原蛋白海绵与常见纤维素海绵止血材料的理化性质及凝血效果对比研究[J].中国医学装备, 2023, 20(10):201-205.
HE K, CUI H R, MAO Z Q, et al.Comparative study of physicochemical properties and coagulation effects of collagen sponge and common cellulose sponge of hemostatic materials[J].China Medical Equipment, 2023, 20(10):201-205.
[34] ARUMUGAM G K S, SHARMA D, BALAKRISHNAN R M, et al.Extraction, optimization and characterization of collagen from sole fish skin[J].Sustainable Chemistry and Pharmacy, 2018, 9:19-26.