表1 样品处理方法
Table 1 Sample handling method
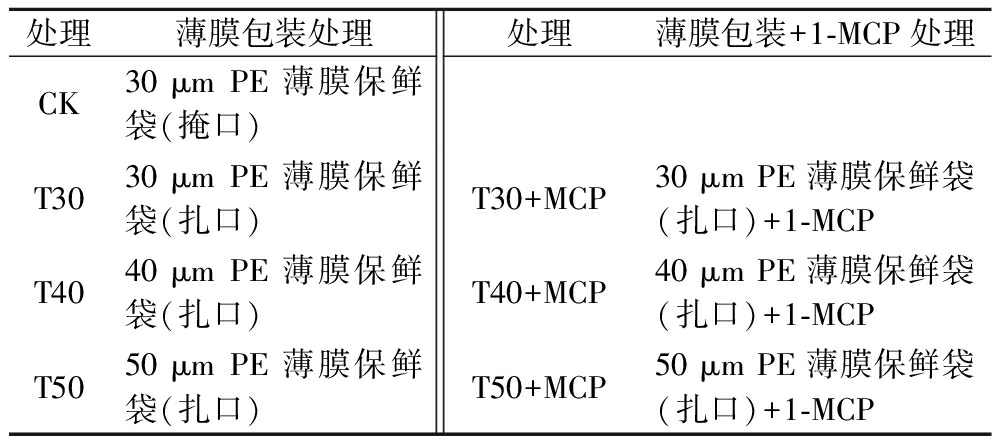
处理薄膜包装处理处理薄膜包装+1-MCP处理CK30 μm PE薄膜保鲜袋(掩口)T3030 μm PE薄膜保鲜袋(扎口)T30+MCP30 μm PE薄膜保鲜袋(扎口)+1-MCPT4040 μm PE薄膜保鲜袋(扎口)T40+MCP40 μm PE薄膜保鲜袋(扎口)+1-MCPT5050 μm PE薄膜保鲜袋(扎口)T50+MCP50 μm PE薄膜保鲜袋(扎口)+1-MCP
黄花又名金针菜,古时称忘忧草,为百合科萱草属多年生宿根草本植物,鲜蕾色泽金黄,香味浓郁,是常见的药食同源蔬菜之一,且作为食品和传统药品已有两千多年的历史[1-2]。鲜黄花因其营养价值丰富而受到消费者的青睐,不仅含有多种人体所需的营养物质,还富含许多具有保健作用的功能性因子,是一种高蛋白、低热量的健康蔬菜[3-4]。近年来,我国许多地区都建成了大规模的黄花菜种植基地,其中山西大同因出产鲜黄花品质上乘而驰名中外。但干制加工仍然是大同黄花产区主要的采后处理方式,不仅影响黄花本身的口感和风味,而且严重影响其营养价值。随着消费者生活水平和市场需求的提高,鲜食黄花已成为消费新习惯。然而鲜黄花采收时正值夏季高温多雨季节,采后生命活动仍然旺盛,极易开花衰老,出现萎蔫甚至腐烂等现象,极大地影响其商品性。因此,鲜黄花采后贮藏保鲜成为产业链中迫切需要解决的问题[5],开展鲜黄花采后贮藏保鲜研究对大同黄花产业发展意义重大。
薄膜包装是现阶段果蔬贮藏应用广泛的保鲜措施之一,适宜的薄膜包装不仅能有效减少果蔬的失水率,还可营造适宜的气体微环境,在低温处理的基础上进一步延长果蔬的货架期[6]。1-甲基环丙烯(1-methylcyclopropene, 1-MCP)是一种新型乙烯抑制剂。果蔬采后,在大量生成乙烯之前,通过1-MCP以阻断乙烯与受体结合,可以抑制植物内源乙烯的产生,从而延缓果蔬衰老[7],且在处理后的水果、蔬菜中未检测到其残留[8]。本研究通过低温下使用不同厚度薄膜包装结合1-MCP的方式对鲜黄花进行保鲜研究,以期筛选出鲜黄花最佳保鲜技术方案,为生产应用提供可靠技术参数。
试验鲜黄花由山西大同云州区黄花菜生产基地提供,选择9成熟花蕾(长度11 cm~13 cm,黄绿色,未开花蕾),采摘后立即送往实验室进行预冷(4±0.5) ℃。
无水乙醇、三氯乙酸、乙酸、乙酸钠,天津市北辰区方正试剂厂;聚乙二醇-6 000、磷酸二氢钠、磷酸氢二钠、柠檬酸、柠檬酸钠,天津市风船化学试剂科技有限公司;聚乙烯吡咯烷酮、愈创木酚、3,5-二硝基水杨酸、羧甲基纤维素、水杨苷、过氧化氢溶液,北京索莱宝科技有限公司;硫代巴比妥酸、氯化钠、二硫苏糖醇,上海麦克林生化科技有限公司。以上试剂均为分析纯。
F-920便携式氧气和二氧化碳分析仪,美国菲利克斯公司;JFQ-3150H果蔬呼吸测定仪,北京均方理化科技研究所;GS-15FTA水果质地分析仪,北京阳光亿事达有限公司;CR-400色差仪,日本柯尼卡公司;DDS-307A电导率仪,上海仪电科学仪器股份有限公司;SP-2500紫外分光光度计,上海仪电分析仪器有限公司;TY2020000024台式高速离心机,德国赛多利斯公司;Regulus8100扫描电镜,HT-7800透射电镜,日本日立公司。
经(4±0.5) ℃冷库预冷处理24 h后,挑选无病虫害和机械伤的鲜黄花作为试验样品。采用30 μm[CO2渗透系数:15 528.35 mL/(m2·d),O2渗透系数:4 792.21 mL/(m2·d),透湿率:3.73 g/(m2·d)(RH50%)]、40 μm[CO2渗透系数:12 392.81 mL/(m2·d),O2渗透系数:3 832.92 mL/(m2·d),透湿率:3.03 g/(m2·d)(RH50%)]、50 μm[CO2渗透系数:9 261.27 mL/(m2·d),O2渗透系数:2 873.64 mL/(m2·d),透湿率:2.32 g/(m2·d)(RH50%)]聚乙烯(polyethylene,PE)薄膜包装,渗透系数及透湿性由国家农产品保鲜中心测定,包装袋规格为(宽)35 cm×(长)75 cm直筒袋;1-MCP处理中每包装内放置1小袋1-MCP(含量3.3%),每小袋净含量0.5 g。样品处理方法见表1。
表1 样品处理方法
Table 1 Sample handling method

处理薄膜包装处理处理薄膜包装+1-MCP处理CK30 μm PE薄膜保鲜袋(掩口)T3030 μm PE薄膜保鲜袋(扎口)T30+MCP30 μm PE薄膜保鲜袋(扎口)+1-MCPT4040 μm PE薄膜保鲜袋(扎口)T40+MCP40 μm PE薄膜保鲜袋(扎口)+1-MCPT5050 μm PE薄膜保鲜袋(扎口)T50+MCP50 μm PE薄膜保鲜袋(扎口)+1-MCP
每个处理将包装袋中装入1 kg鲜黄花,置于(0±0.5) ℃条件下贮藏。分别从入贮0 d、7 d、14 d、21 d、28 d、35 d时进行指标的测定,均重复3次。
1.4.1 袋内气体成分的测定
采用便携式O2和CO2分析仪测定包装袋内O2、CO2体积分数。
1.4.2 呼吸强度和乙烯释放速率的测定
参照曹建康等[9]的测定方法并略作修改,采用果蔬呼吸测定仪测定鲜黄花的呼吸强度和乙烯释放速率。呼吸强度以每小时每千克鲜黄花释放CO2的质量表示,单位为mg CO2/(kg·h)。乙烯释放速率以每小时每千克鲜黄花释放C2H4的质量表示,单位为μL/(kg·h)。
1.4.3 硬度测定
采用质构仪测定鲜黄花硬度,选用HDP/BS探头,以完全切断鲜黄花花蕾为测试标准,每组鲜黄花样品取3个测定。
1.4.4 色差值的测定
采用色差仪测定,每个处理随机抽取30个鲜黄花选取花蕾中间位置进行测定。以L*值、a*值、b*值反映鲜黄花色差值。
1.4.5 叶绿素含量的测定
参照FARGA OV
OV 等[10]方法,略作修改。选取鲜黄花花蕾中间位置裁剪成1 mm3(去花蕊),称取2 g样品,加入10 mL无水乙醇充分混匀,避光浸提24 h。以无水乙醇作参比调零,分别在波长663 nm和645 nm处测定吸光值。叶绿素含量按公式(1)计算。
等[10]方法,略作修改。选取鲜黄花花蕾中间位置裁剪成1 mm3(去花蕊),称取2 g样品,加入10 mL无水乙醇充分混匀,避光浸提24 h。以无水乙醇作参比调零,分别在波长663 nm和645 nm处测定吸光值。叶绿素含量按公式(1)计算。
叶绿素含量![]()
(1)
式中:ρ,叶绿素的质量浓度,mg/L;V,样品提取液总体积,mL;m,样品质量,g。
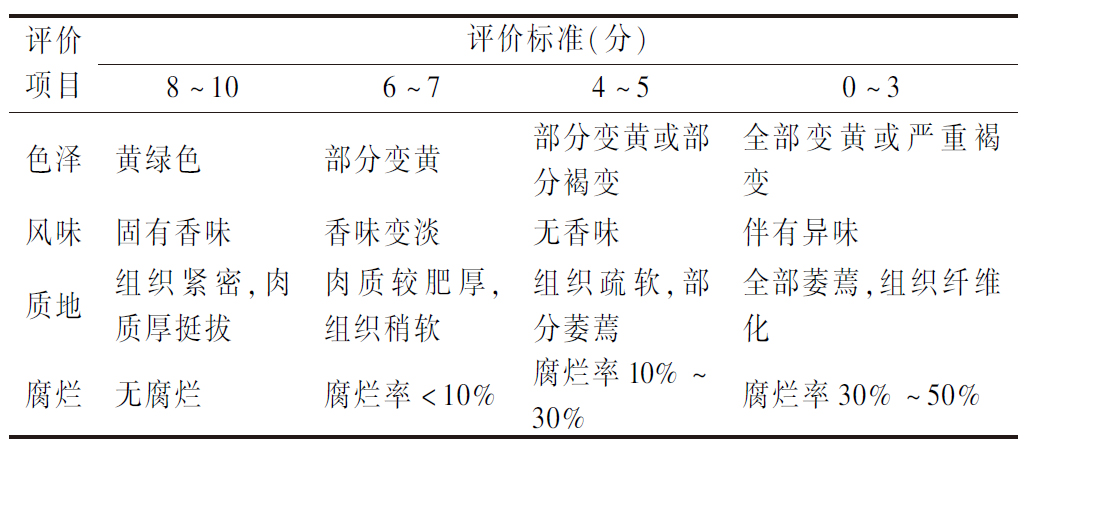
1.4.6 感官评价
参考高建晓等[11]的测定方法对鲜黄花进行感官评价并略作改动,根据表2的评价标准进行评分。
表2 鲜黄花感官评价标准
Table 2 Sensory evaluation criteria of fresh daylily
1.4.7 组织相对电导率和丙二醛(malondialdehyde,MDA)含量的测定
组织相对电导率测定参照李合生[12]方法,略作修改。MDA含量测定选用硫代巴比妥酸比色法,略作修改。
1.4.8 失重率和腐烂率测定
按公式(2)、公式(3)计算失重率和腐烂率:
失重率![]()
(2)
腐烂率![]()
(3)
1.4.9 过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)活性的测定
POD活性使用愈创木酚法测定,单位是ΔOD470/(min·g)。
CAT活性参考WANG等[13]的方法测定,单位是0.01ΔOD240/(min·g)。
1.4.10 纤维素酶(cellulase,Cx)和β-葡萄糖苷酶(β-glucosidase,β-Glu)活性的测定
Cx活性参考曹建康等[9]的方法测定,单位是μg/(h·g)。β-Glu活性采用水杨苷水解法[9]测定,单位是μg/(h·g)。
1.4.11 微观结构观察
扫描电镜观察:选取新鲜采摘和贮藏35 d的鲜黄花,在鲜黄花花萼部分中间偏上位置切取成2 mm3的薄片,随后用体积分数2.5%戊二醛溶液、体积分数1%的锇酸溶液分别固定24 h、1.5 h;用体积分数分别为30%、50%、70%、80%、90%、95%的乙醇溶液对样品进行脱水,再用100%的乙醇处理两次。将乙醇与醋酸异戊酯两种溶液制成混合液浸泡样品30 min,最后用纯醋酸异戊酯浸泡样品1 h。临界点干燥,镀膜。处理好的样品在扫描电镜中观察黄花细胞表面的结构并拍照记录。
透射电镜观察:取样、清洗、脱水处理同扫描电镜。用812环氧树脂包埋,将样品进行修样切片处理,再经柠檬酸铅和乙酸双氧铀染色10 min。完成后用透射电镜观察鲜黄花细胞的超微结构并拍照记录。
试验采用完全随机方式,结果为测定3次数据的平均值,采用SPSS软件进行方差分析,用ANOVA检验不同处理之间的差异显著性,并进行LSD事后多重差异分析,显著水平取P<0.05(差异显著),使用Origin 2021软件作图。
由图1可知,采用掩口包装的CK处理包装袋内O2和CO2的体积分数与大气环境一致。由于鲜黄花自身的呼吸作用消耗O2和释放CO2,以及包装袋的高阻隔性,袋内O2的体积分数不断降低,CO2的体积分数不断上升。在贮藏前中期,O2的体积分数迅速下降,CO2的体积分数快速上升。贮藏至21 d时,包装袋内O2体积分数已降低至3.7%~7.2%,CO2体积分数上升至11.2%~16.7%。3种不同厚度的薄膜包装处理的O2体积分数低于CK处理,CO2的体积分数高于CK处理,表明薄膜包装均形成不同的袋内气体微环境。
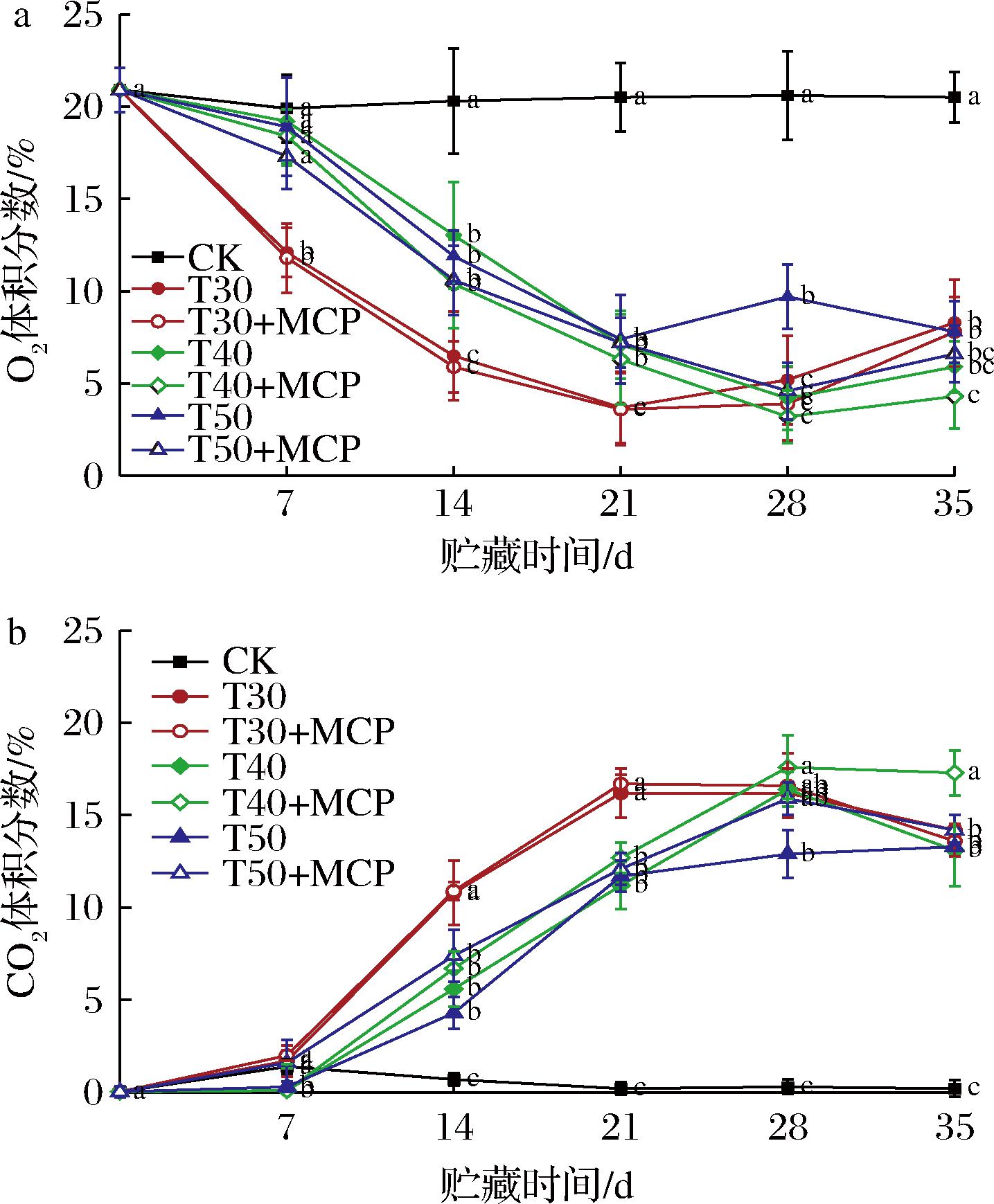
a-O2;b-CO2
图1 不同处理包装袋内O2和CO2体积分数的变化趋势
Fig.1 The variation trend of O2 and CO2 volume fractions in bags with different treatments
注:同一贮藏时间字母不同表示差异显著(P<0.05)(下同)。
由图2-a可知,贮藏过程中鲜黄花的呼吸强度均呈先升后降的趋势。所有处理均在贮藏7 d时达到呼吸高峰且各处理呼吸强度差异性显著(P<0.05),呼吸峰值随薄膜包装厚度的增加呈下降趋势,且薄膜包装结合1-MCP处理的鲜黄花呼吸强度低于单独使用同等厚度薄膜包装处理,说明结合使用1-MCP可有效抑制了鲜黄花的呼吸代谢。贮藏35 d时,CK、T30、T30+MCP、T40、T40+MCP、T50和T50+MCP处理的呼吸强度均有不同程度下降,呼吸强度分别为61.96 mg CO2/(kg·h)、73.43 mg CO2/(kg·h)、59.42 mg CO2/(kg·h)、77.73 mg CO2/(kg·h)、53.85 mg CO2/(kg·h)、59.83 mg CO2/(kg·h)、61.25 mg CO2/(kg·h)。

a-呼吸强度;b-乙烯释放速率
图2 不同处理对鲜黄花呼吸强度和乙烯释放速率的影响
Fig.2 Effects of different treatments on respiration intensity and ethylene release rate of fresh daylily
由图2-b可知,鲜黄花的乙烯释放速率在贮藏过程中基本呈逐渐上升的趋势,3种厚度薄膜包装处理中鲜黄花的乙烯释放速率均低于CK处理。在贮藏14 d前后,CK、T30+MCP处理乙烯释放速率上升呈前快后慢趋势。在贮藏14~35 d时,T50和T50+MCP处理鲜黄花的乙烯释放速率显著低于其他处理(P<0.05),贮藏35 d时两处理乙烯释放量分别为69.64 μL/(kg·h)、55.29 μL/(kg·h),说明50 μm PE薄膜包装可以有效降低鲜黄花的乙烯释放速率。在整个贮藏过程中,相同厚度PE薄膜包装结合1-MCP处理鲜黄花的乙烯释放速率均低于未结合1-MCP处理,说明薄膜包装结合1-MCP有效抑制了鲜黄花的乙烯释放速率的上升。
根据图3,随着贮藏时间的延长,鲜黄花的硬度呈逐渐下降的趋势,有少数处理在贮藏后期呈现出反常的上升趋势。原因是随着贮藏时间的延长,鲜黄花逐渐开花和成熟衰老,表皮组织软化萎蔫,不易被测试刀切断,表现出硬度增加。在贮藏7~21 d,3种薄膜包装处理鲜黄花的硬度始终显著高于CK处理(P<0.05),表明使用薄膜包装可有效抑制鲜黄花硬度的降低。T50+MCP处理在贮藏期间的硬度变化较小,在贮藏35 d时为42.41 N,显著低于其他处理(P<0.05),说明T50+MCP处理有效延缓了鲜黄花硬度的下降。
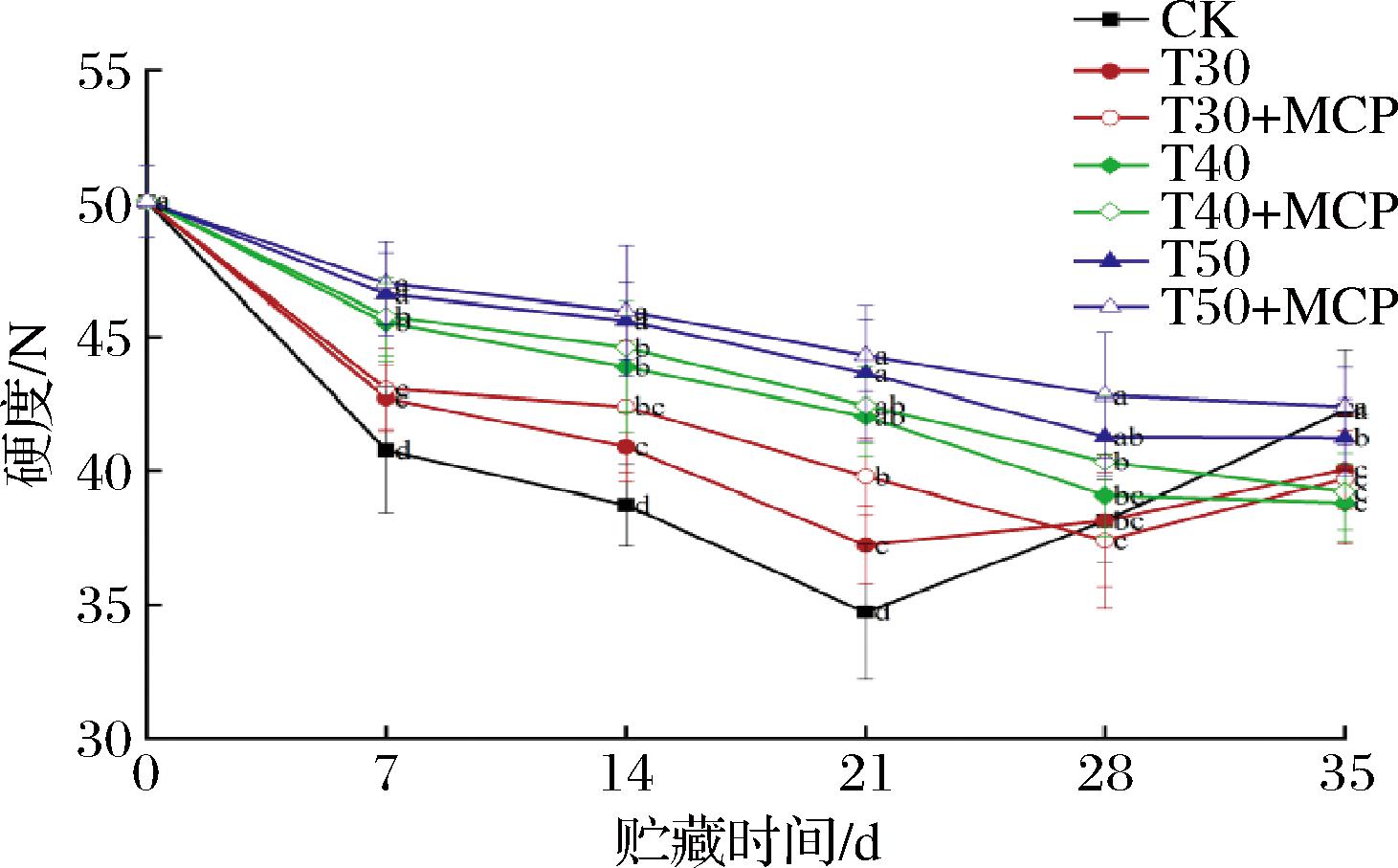
图3 不同处理对鲜黄花硬度的影响
Fig.3 Effects of different treatments on hardness of fresh daylily
由图4可知,T50和T50+MCP处理有效维持鲜黄花外观鲜亮。结合图5-a的L*值可以看出贮藏中后期,T50和T50+MCP处理的鲜黄花亮度始终高于其他处理。T50+MCP处理在贮藏35 d时L*值为64.27,CK处理为42.91,两者表现出显著差异性(P<0.05),说明T50和T50+MCP处理所用的50 μm厚度的PE包装袋,可以有效保持鲜黄花鲜亮品质。
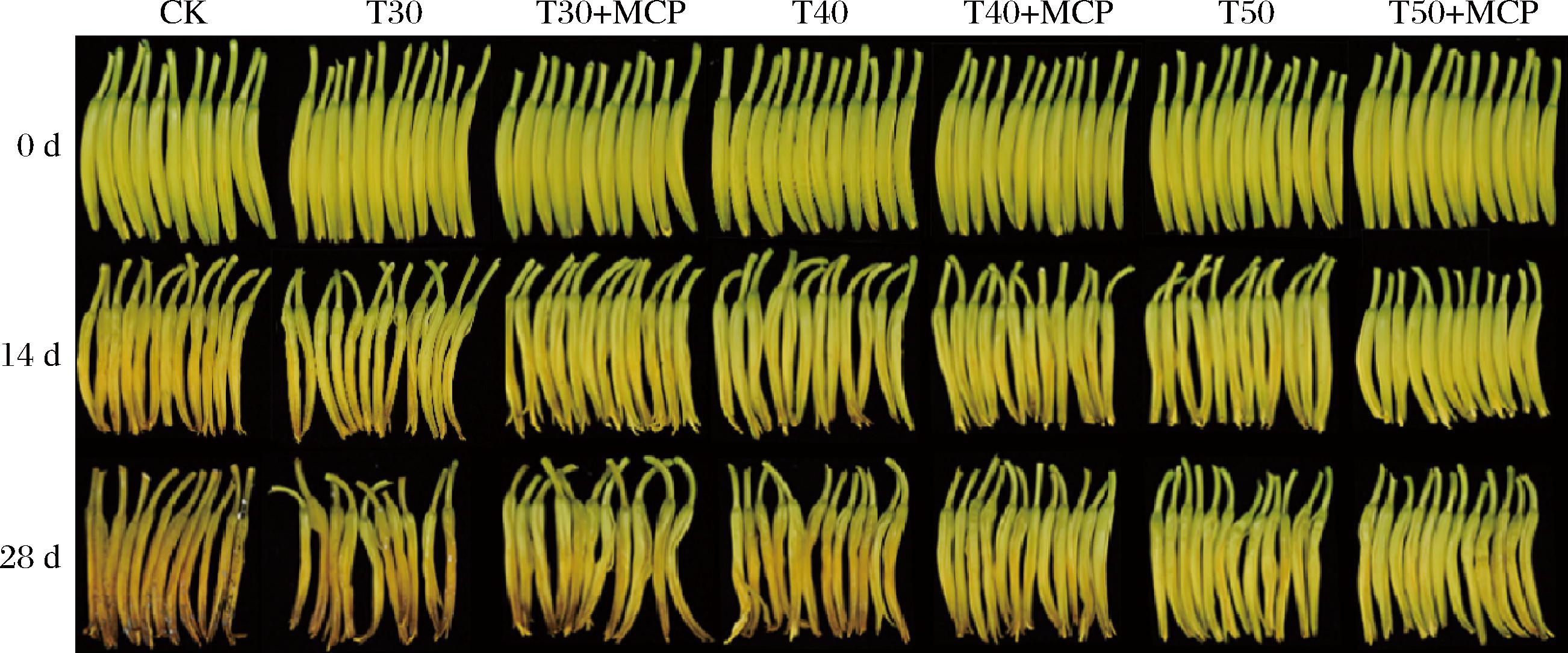
图4 鲜黄花的外观品质照片
Fig.4 Appearance quality photos of fresh daylily

a-L*值;b- a*值;c-b*值
图5 不同处理对鲜黄花L*值、a*值和b*值的影响
Fig.5 Effects of different treatments on L*value, a* value, and b* value of fresh daylily
a*值越低表示鲜黄花颜色越绿,由图4、图5-b可知,在整个贮藏过程中T50和T50+MCP处理中鲜黄花绿色外观维持最佳。在贮藏35 d时,T50+MCP处理的a*值为-6.11,显著低于其他处理(P<0.05)。说明使用50 μm厚度的PE包装是鲜黄花有效保绿措施。
由图4、图5-c可知,鲜黄花b*值在贮藏过程中呈现出不断上升的趋势。在贮藏35 d时,T50+MCP处理的b*值为54.69,显著低于其他处理(P<0.05)。3种厚度薄膜结合1-MCP处理的鲜黄花b*值低于未结合1-MCP处理,说明1-MCP处理可抑制鲜黄花外观转黄。
根据图6可知,鲜黄花的叶绿素含量在贮藏过程中呈下降趋势。各处理中相同厚度薄膜包装结合1-MCP处理抑制叶绿素降解的效果更加显著。在整个贮藏过程中,T50+MCP处理的叶绿素含量变化较小,在贮藏35 d时为0.014 9 mg/g,显著高于其他处理(P<0.05)。可见,T50+MCP处理有效减缓了鲜黄花叶绿素的降解。
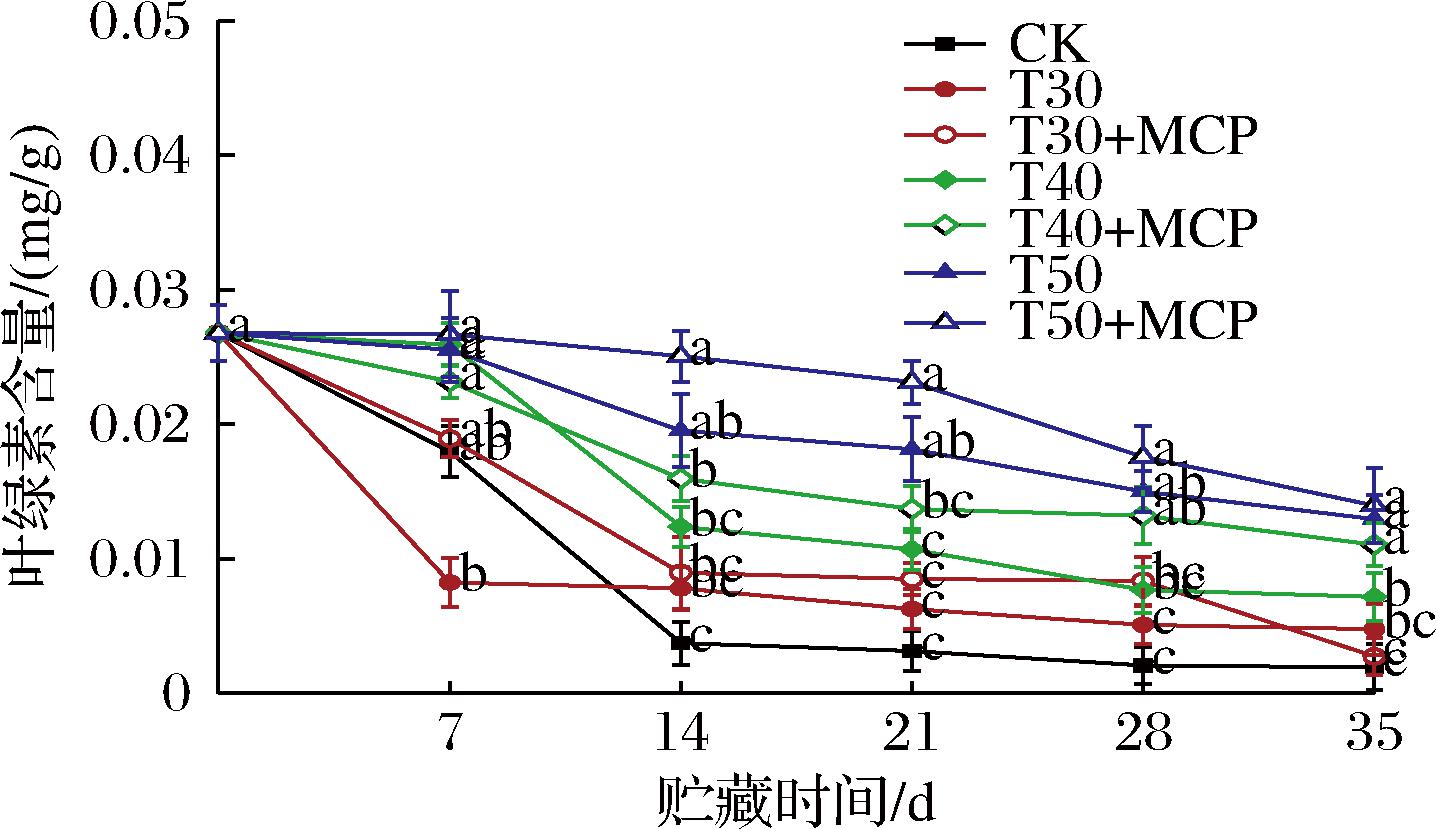
图6 不同处理对鲜黄花叶绿素含量的影响
Fig.6 Effects of different treatments on chlorophyll content of fresh daylily
根据表3、图4可知,鲜黄花的感官品质在贮藏过程中呈逐渐下降的趋势。贮藏至28~35 d时,不同处理鲜黄花的感官品质差异较明显,CK、T30、T30+MCP处理有较严重的腐烂现象,T50和T50+MCP处理有部分泛黄、失水萎蔫现象。T50和T50+MCP处理的感官效果最好,T40和T40+MCP处理好于CK处理,T30、T30+MCP处理与CK处理效果相当。
表3 鲜黄花在贮藏过程中的感官评价
Table 3 Sensory evaluation of fresh daylily during storage
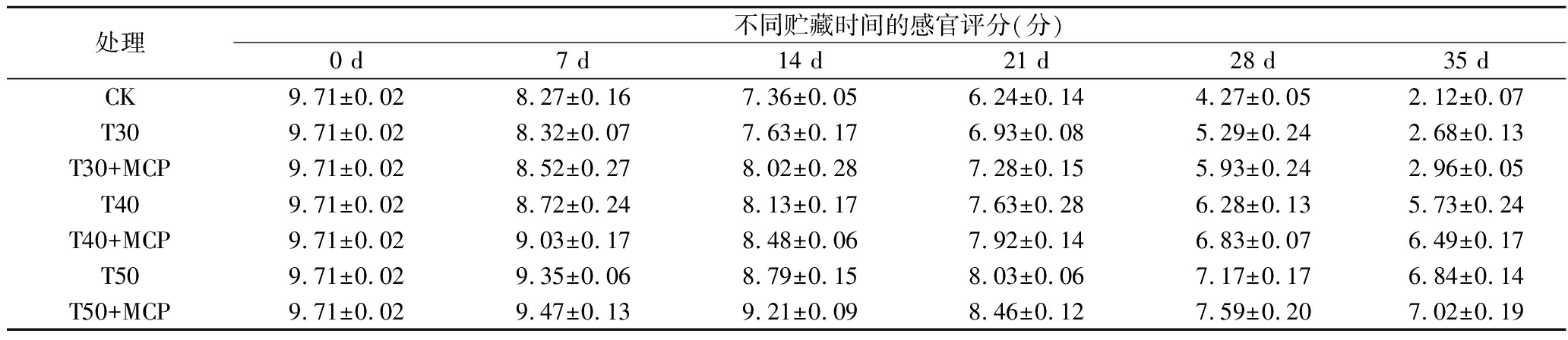
处理不同贮藏时间的感官评分(分)0 d7 d14 d21 d28 d35 dCK9.71±0.028.27±0.167.36±0.056.24±0.144.27±0.052.12±0.07T309.71±0.028.32±0.077.63±0.176.93±0.085.29±0.242.68±0.13T30+MCP9.71±0.028.52±0.278.02±0.287.28±0.155.93±0.242.96±0.05T409.71±0.028.72±0.248.13±0.177.63±0.286.28±0.135.73±0.24T40+MCP9.71±0.029.03±0.178.48±0.067.92±0.146.83±0.076.49±0.17T509.71±0.029.35±0.068.79±0.158.03±0.067.17±0.176.84±0.14T50+MCP9.71±0.029.47±0.139.21±0.098.46±0.127.59±0.207.02±0.19
根据图7可知,鲜黄花的组织相对电导率和MDA含量在贮藏期间呈上升趋势。贮藏35 d时,与其他处理相比,CK处理组织相对电导率和MDA含量上升速率较快。研究发现,贮藏后期3种不同厚度PE薄膜包装处理差异显著(P<0.05),50 μm 厚度的PE薄膜包装处理效果明显好于30 μm和40 μm厚度包装处理。T50+MCP处理明显较低,说明相同厚度薄膜包装条件下使用1-MCP抑制组织相对电导率和MDA含量上升效果更加明显,贮藏至35 d时,组织相对电导率和MDA含量分别是55.35%和17.78 μg/g,而CK处理的组织相对电导率和MDA含量分别是74.53%和35.28 μg/g,两者表现出显著差异性(P<0.05),说明厚度为50 μm薄膜包装结合1-MCP处理能够维持细胞膜的完整性,延缓了鲜黄花的衰老进程。
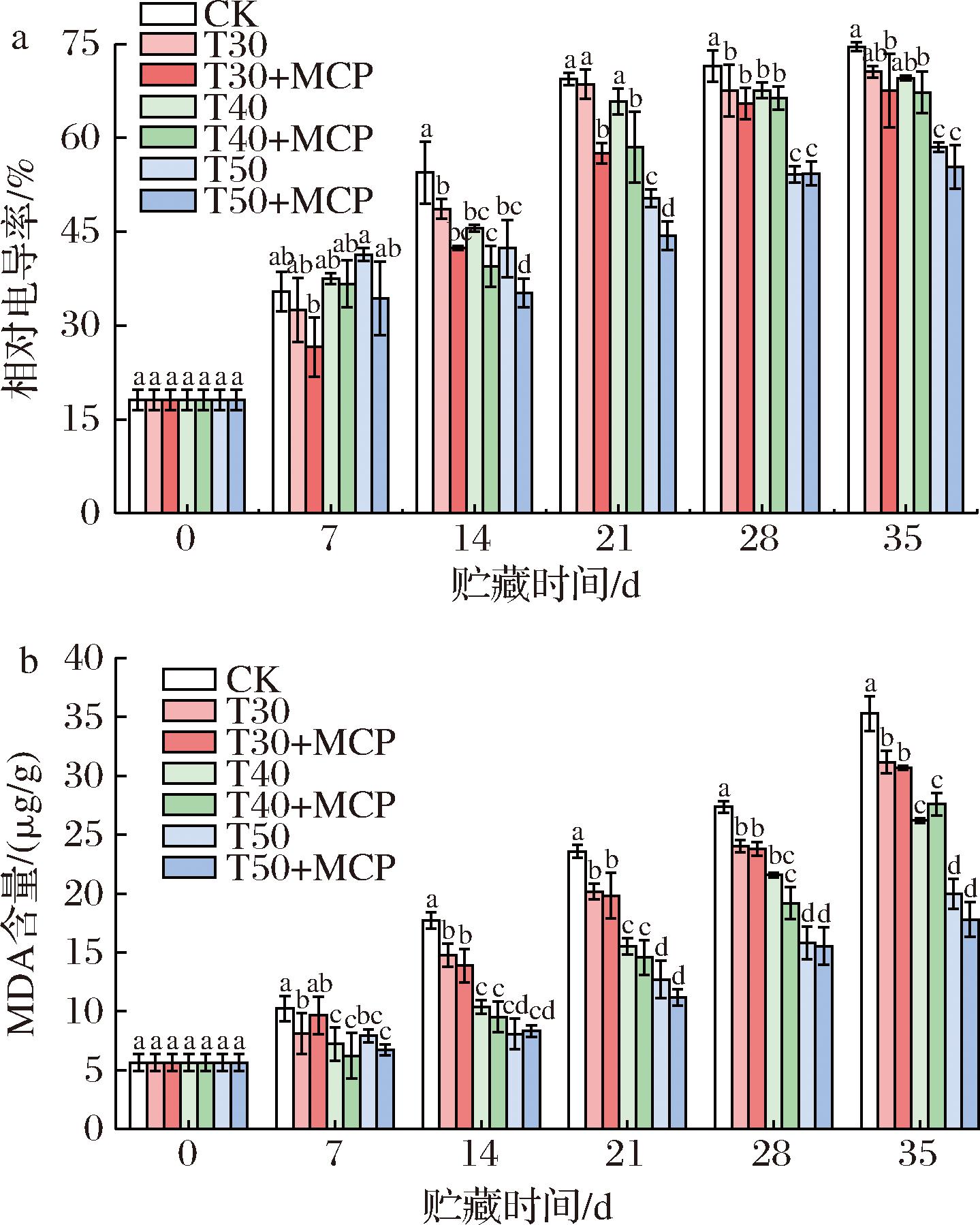
a-相对电导率;b-MDA含量
图7 不同处理对鲜黄花相对电导率和MDA含量的影响
Fig.7 Effects of different treatments on relative electrical conductivity and MDA content of fresh daylily
根据图8-a,鲜黄花的失重率在贮藏过程中呈逐渐上升的趋势。在整个贮藏过程中,CK处理失重率始终高于其他处理(P<0.05);T40、T40+1-MCP、T50、T50+1-MCP处理的失重率无明显差异,说明厚度为40 μm、50 μm的薄膜包装对鲜黄花失重率下降的抑制效果接近。
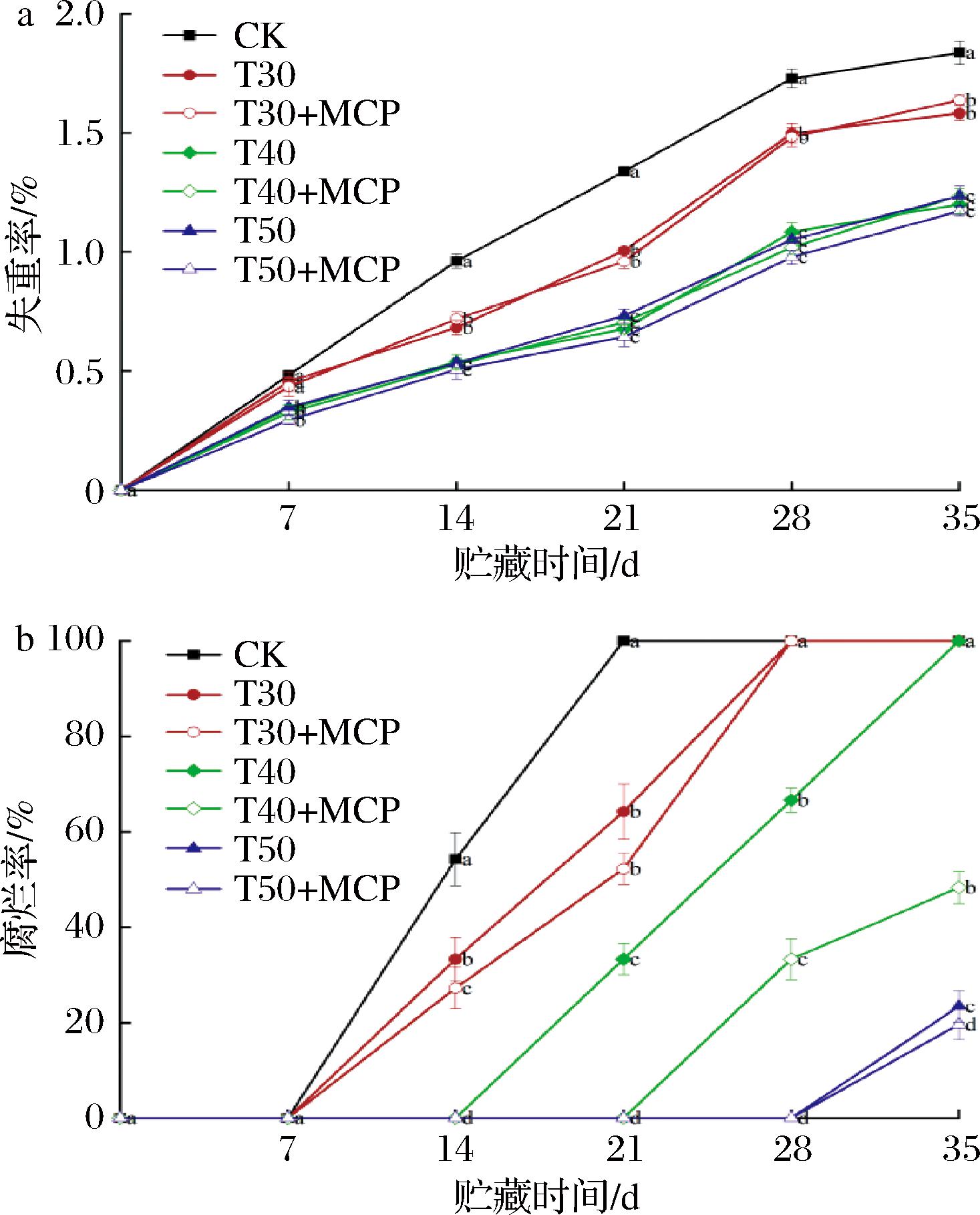
a-失重率;b-腐烂率
图8 不同处理对鲜黄花失重率和腐烂率的影响
Fig.8 Effects of different treatments on weight loss rate and decay rate of fresh daylily
由图8-b所知,随着贮藏时间的延长,鲜黄花腐烂率呈先慢后快上升趋势。在贮藏第14 d时,CK、T30、T30+MCP处理的腐烂率分别是54.26%、33.33%、27.24%。随着贮藏时间的延长腐烂率增高,CK、T30、T30+MCP、T40处理的腐烂率分别在贮藏21 d、28 d、35 d高达100%;贮藏35 d时,T50、T50+MCP处理的腐烂率较低,分别是23.46%、19.67%,表明T50和T50+MCP处理能更好抑制鲜黄花的腐烂。
根据图9-a,鲜黄花的POD活性在贮藏过程中呈先上升后下降的趋势。贮藏7 d时,CK处理POD活性上升且高于其他处理,在贮藏14 d时出现峰值,此时活性值是7.13 U/(min·g),而后逐渐下降。其他处理在贮藏0~21 d时,POD活性呈上升趋势,且在第21 d时达到峰值,其中T50+MCP处理POD活性与其他处理差异性显著(P<0.05),其活性值为19.4 U/(min·g)。在贮藏21~35 d时,各处理POD活性呈下降趋势,且T50+MCP处理POD活性始终显著高于其他各处理(P<0.05),说明50 μm PE薄膜包装结合1-MCP处理是维持鲜黄花POD活性的最佳方案。
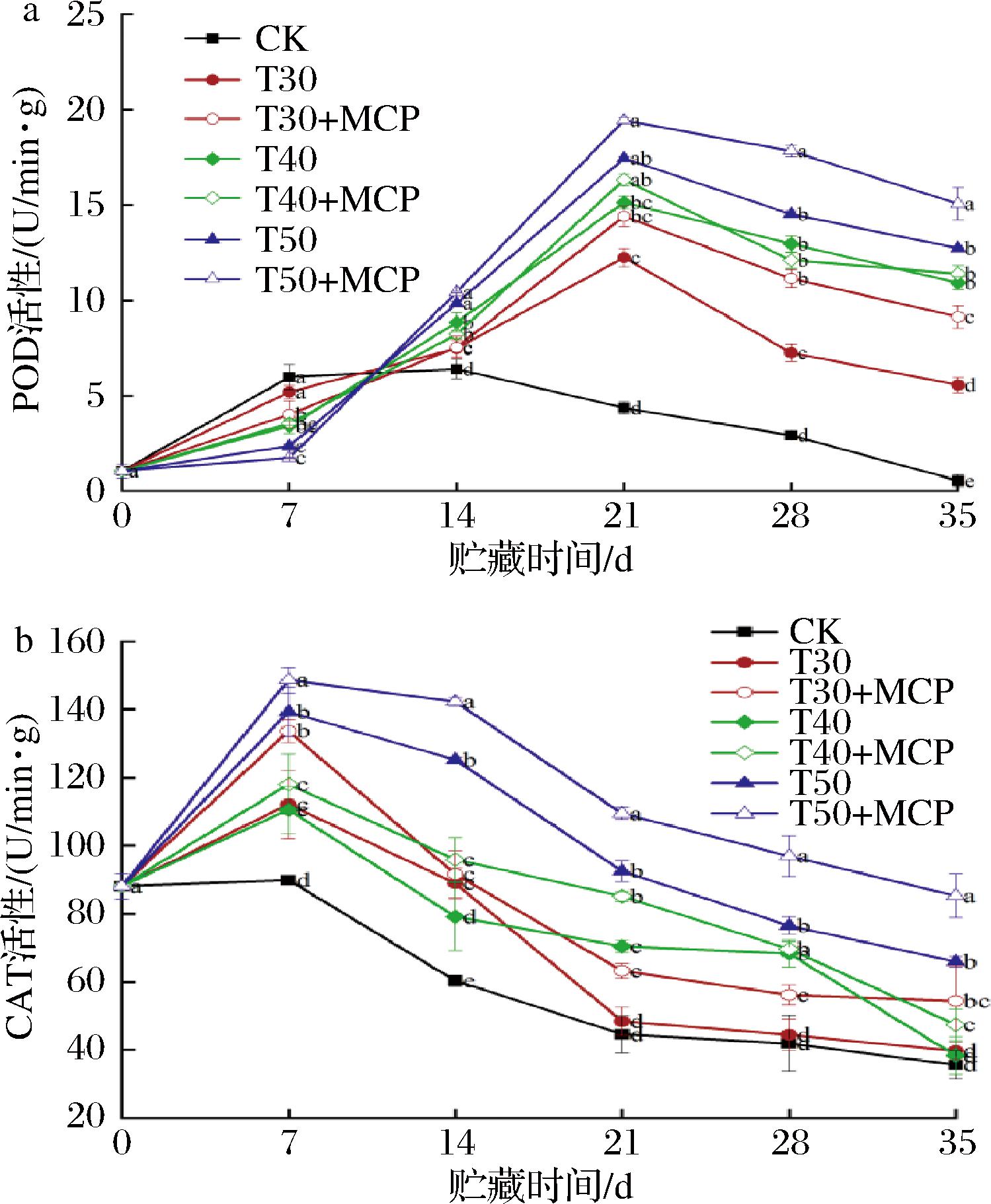
a-POD;b-CAT
图9 不同处理对鲜黄花POD和CAT活性的影响
Fig.9 Effects of different treatments on POD and CAT of fresh daylily
由图9-b可知,鲜黄花的CAT活性在贮藏过程中呈先升后降的趋势。所有处理鲜黄花的CAT活性在第7 d达到峰值,然后逐渐下降。在整个贮藏过程中,3种薄膜包装处理鲜黄花的CAT活性始终显著高于CK处理(P<0.05),表明3种厚度薄膜包装所产生的气体微环境均维持CAT活性,且50 μm 薄膜包装处理抑制CAT活性下降效果最显著。此外,相同厚度薄膜包装结合1-MCP处理的鲜黄花CAT活性要高于未结合1-MCP处理,在贮藏第35 d时,T50+MCP处理的CAT活性值为85.28 U/(min·g),显著高于其他处理(P<0.05),说明薄膜包装和1-MCP的协同作用对维持CAT高活性效果显著。
由图10-a可知,不同处理鲜黄花的Cx活性随着贮期的延长逐渐增高。CK处理的Cx活性在所有处理中上升最快,且在贮藏第21~35 d处于急速上升趋势,贮藏35 d活性值达到1 813.38 μg/(h·g)。在整个贮藏过程中,T50+MCP处理较其他处理的Cx活性上升速度显著减慢(P<0.05),活性值分别在贮藏28 d、35 d为573.19 μg/(h·g)、707.86 μg/(h·g)。表明1-MCP结合50 μm薄膜包装对鲜黄花Cx活性的增强有抑制作用,有利于减缓鲜黄花纤维素的降解,维持正常的细胞壁结构。
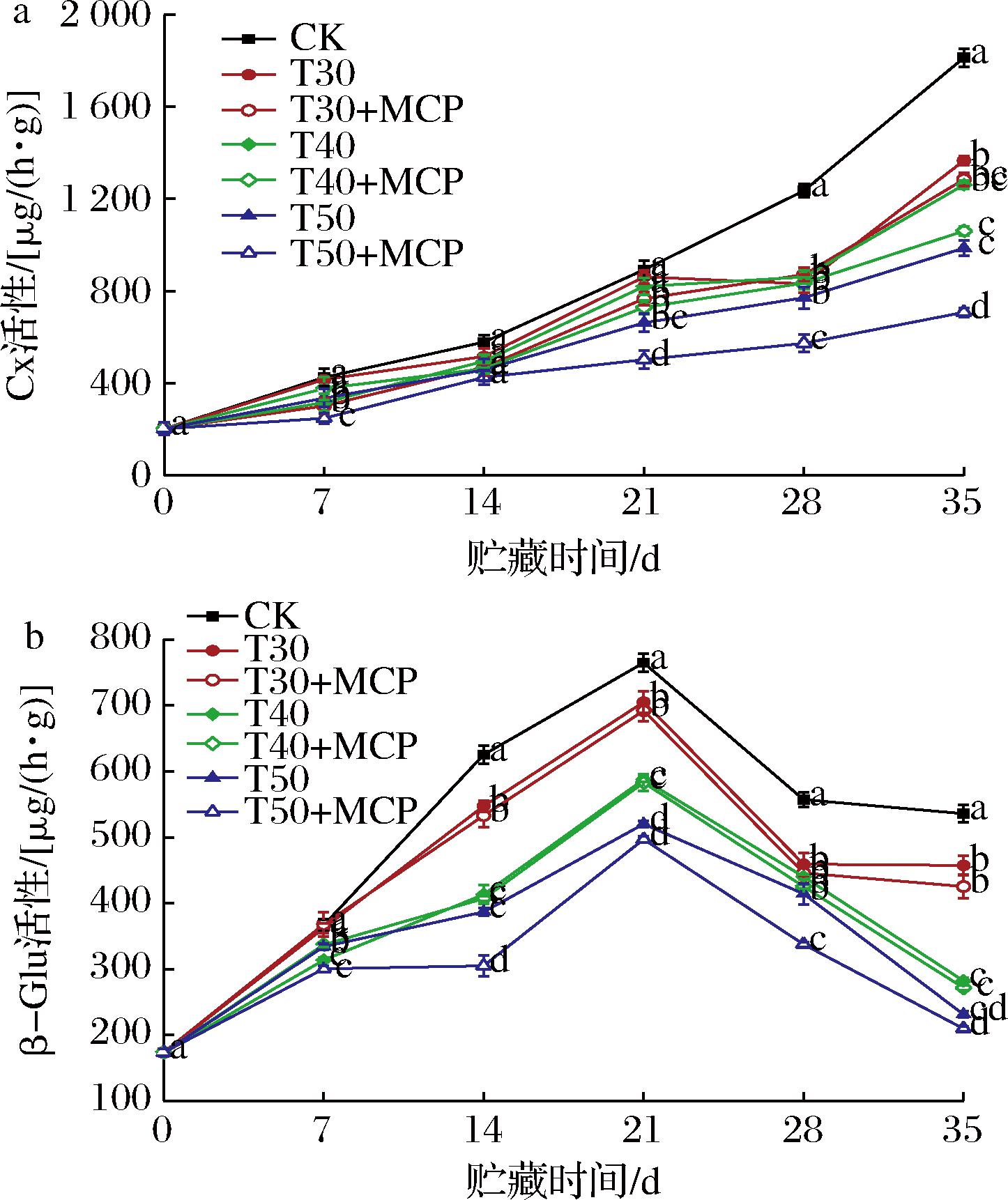
a-Cx;b-β-Glu
图10 不同处理对鲜黄花Cx和β-Glu活性的影响
Fig.10 Effects of different treatments on Cx and β-Glu of fresh daylily
根据图10-b可知,鲜黄花β-Glu的活性在贮藏21 d前后呈先升后降的趋势。贮藏21 d时,其中,CK处理鲜黄花的β-Glu活性始终高于其他处理(P<0.05),表明使用薄膜包装可有效抑制鲜黄花β-Glu活性的上升。T50+MCP处理的β-Glu活性保持在较低水平,在贮藏第35 d时活性值为209.41 μg/(h·g),显著低于其他处理(P<0.05)。由此可知,1-MCP可以抑制鲜黄花β-Glu活性的上升,维持其较好的细胞壁结构。
图11直观展示了新鲜采摘和薄膜包装结合1-MCP处理贮藏35 d对鲜黄花细胞表面结构的影响。CK处理的细胞表面形态结构排列紧密,由阵列状凸起结构组成,且凸起结构饱满,气孔是张开且形态饱满。贮藏35 d后,T30处理的细胞表面出现褶皱,其阵列状的凸起结构基本上已经萎缩,说明黄花失水较为严重;气孔呈闭合形态,周边保卫细胞出现褶皱且萎缩严重,这是由于张合的气孔在环境中促进黄花的蒸腾作用和光合作用,给黄花带来较大的水分蒸发量,因此出现失水、萎缩等形态。T30+MCP处理的细胞表面形态优于T30处理,虽有褶皱但不严重,仍然可以看出其阵列状的排列结构,失水程度不似T30处理严重;气孔仍呈闭合状态但周边保卫细胞皱缩不严重。T50处理的细胞表面形态出现褶皱,凸起结构部分萎缩;气孔呈张开状态但张开长度较小。T50+MCP处理的细胞表面结构仍排列紧密,阵列状凸起结构大部分饱满;气孔呈张开状态且张开长度较大,周边保卫细胞相对饱满。水分是影响黄花细胞表面和气孔形态的重要因素,当含水量降低时,黄花细胞表面的渗透压会增加,胞内水分会流向外部环境,促使细胞体积缩小,严重时变形,因此黄花细胞表面会出现褶皱、萎缩等现象;黄花处于失水状态时,也会使细胞与外界环境存在较大的蒸气压差,黄花蒸腾作用增加,周边保卫细胞失水而导致气孔关闭。总体来看,T50+MCP处理的细胞表面结构最接近新鲜采摘黄花,说明50 μm PE薄膜包装结合1-MCP可以减缓鲜黄花细胞表面形态破损。

图11 不同处理对鲜黄花细胞表面结构的影响
Fig.11 Effect of different treatments on cell surface structure of fresh daylily
注:-1、-2分别表示细胞表面形态(×800)和气孔形态(×3 000)。
如图12所示,CK处理的细胞结构完整,质壁结构完好并结合紧密,液泡体积大,各细胞器分布在细胞壁边缘。在贮藏第35 d时,T30处理的细胞结构变化较大,细胞膜解体并与细胞壁分离,液泡体积缩小,各细胞器无规律的散布在细胞中。T30+MCP处理发生了质壁分离现象,细胞质膜界限模糊,细胞膜边缘卷曲。T50处理的细胞结构有轻微质壁分离现象,但不及T30和T30+MCP处理严重,线粒体基粒片层松散,线粒体被膜消失。T50+MCP处理的细胞质壁结构完好,各细胞器排列在细胞壁边缘且清晰可见,在所有处理中最接近新鲜黄花的细胞形态。由此可见,50 μm薄膜包装结合1-MCP协同处理效果更佳。
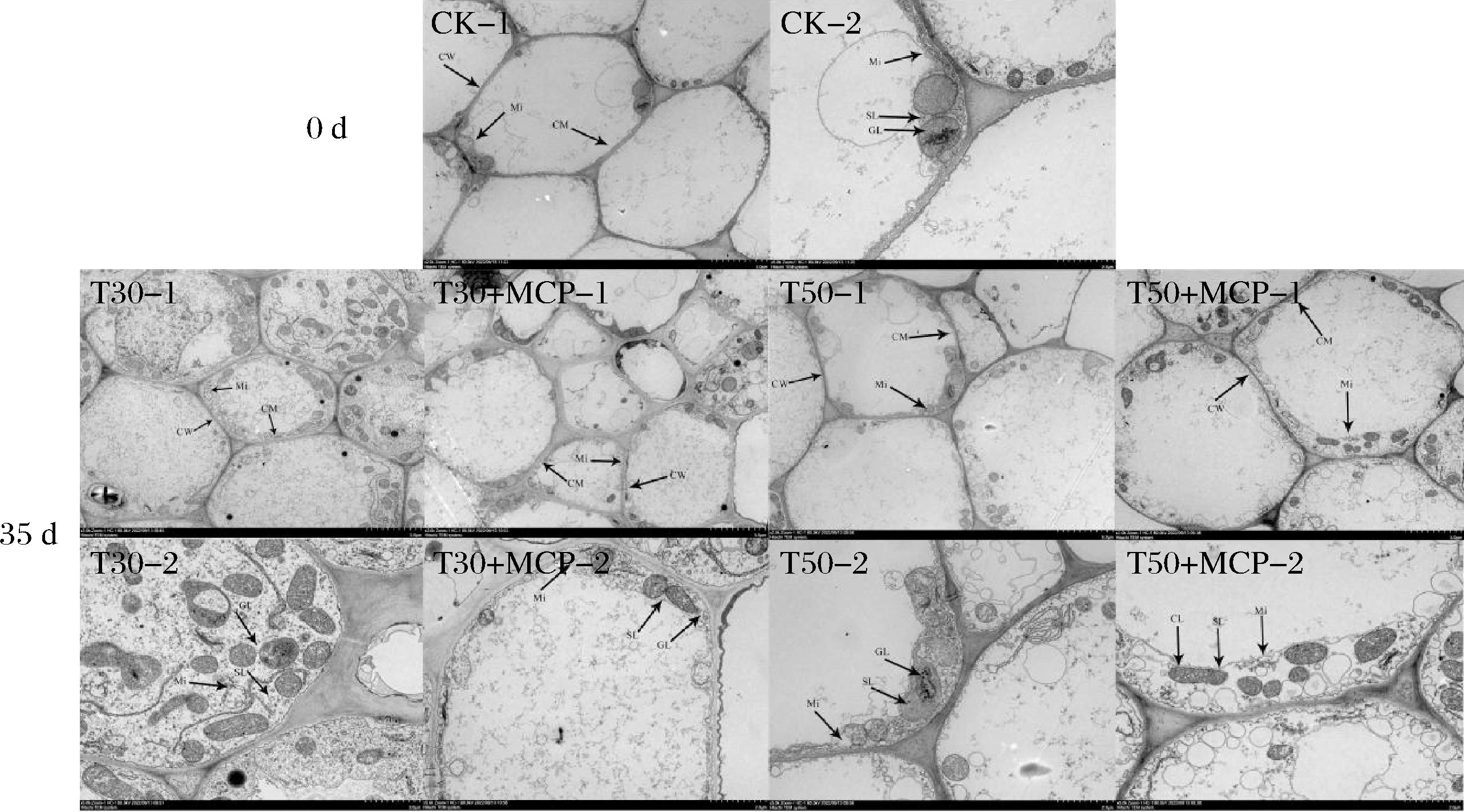
图12 不同处理对鲜黄花细胞超微结构的影响
Fig.12 Effect of different treatments on the ultrastructure of the cells of fresh daylily
注:-1、-2分别表示2 000倍、5 000倍;CW:细胞壁;CM:细胞膜;Mi:线粒体;GL:基粒片层;SL:基质片层。
鲜黄花采摘后仍然存在着一系列生理生化变化过程。薄膜包装可利用果蔬自身的呼吸作用与包装袋的渗透性之间的动态平衡,在袋内形成一个低O2高CO2的微环境,从而产生保鲜的作用[14]。在本研究中,贮藏后期除CK处理外,不同厚度薄膜包装鲜黄花均产生自发气调效应,这与高建晓等[11]的研究结果基本一致。并且薄膜包装结合1-MCP处理对鲜黄花的呼吸代谢有抑制作用,比简单使用薄膜包装一种贮藏方式效果更佳,说明薄膜包装与1-MCP结合处理对鲜黄花可产生协同保鲜作用。这与程赤云等[15]研究的PBAT/PLA复合膜结合1.0 μL/L 1-MCP处理能够抑制金玉兰菜的呼吸峰值、并推迟其出现,进一步维持金玉兰菜的新鲜品质的研究结果类似。组织相对电导率和MDA含量可以反映鲜黄花在贮藏期间的细胞膜渗透率和膜脂过氧化程度,本研究中,随着贮藏期的延长,各处理的组织相对电导率和MDA含量增加,品质随之下降。其中T50+MCP处理在贮藏35 d时组织相对电导率和MDA含量上升到58%、17.7 μg/g,相较于CK组降低了16%、17.5 μg/g,证明薄膜包装结合1-MCP可以降低细胞膜的受损程度,此结论与腐烂率研究结果相互印证,与杨万鹏等[16]在黑果枸杞上的研究结果一致。叶绿素含量和a*值是衡量果蔬绿色程度的重要指标。有研究发现薄膜包装能有效降低果蔬由绿转黄速率,起到较好的保绿效果,这可能与薄膜包装内形成的低O2高CO2的气体微环境抑制叶绿素降解有关。在本研究中,3种厚度薄膜包装处理抑制了叶绿素含量的降解以及a*值的上升,这与王玲等[17]在芥蓝上的研究结果一致,说明薄膜包装可减缓叶绿素降解,延缓黄化。
POD、CAT都是果蔬中重要的氧化还原酶,在清除自由基和活性氧方面起着关键作用。本研究发现,鲜黄花的POD、CAT活性呈先增后降的趋势,与CK处理相比,薄膜包装结合1-MCP处理的POD、CAT活性维持在较高水平。此外,鲜黄花的POD、CAT活性高峰出现的时间不同,表明POD、CAT是通过先后的方式共同协作清除代谢系统中的活性氧,这与贺艳娥[18]在猕猴桃上的研究结果一致。此外,鲜黄花CAT活性高峰与呼吸高峰出现在同一时期,然而POD活性出现在呼吸高峰之后,可能是由于呼吸作用加速了鲜黄花的成熟衰老,进一步刺激了CAT活性的上升;而POD活性高峰在贮藏后期出现,此时鲜黄花进入快速衰老期,贮藏过程中的氧化作用诱导了POD活性的上升,这与张中海[19]的研究结果一致。
硬度是判断果蔬组织是否发生软化的一项重要指标。本研究中,3种厚度薄膜包装处理抑制了鲜黄花硬度的下降。阎香言等[20]研究发现,植物果实软化的主要原因是细胞壁降解。细胞壁降解酶是影响细胞壁完整性的重要因素,其中Cx和β-Glu主要参与细胞壁中纤维素的降解,而纤维素则是细胞壁的主要骨架成分,它的降解就意味着细胞壁的解体以及果蔬软化[21];陈新艳[22]研究表明,1-MCP处理可显著抑制哈密瓜细胞壁物质的降解以及Cx、β-Glu等与软化相关酶的活性。在本研究中,T50+MCP处理鲜黄花Cx、β-Glu活性处于较低水平,纤维素降解速率较慢,说明50 μm 薄膜包装结合1-MCP处理可显著抑制鲜黄花Cx、β-Glu活性的升高,此结论能够在鲜黄花硬度变化规律相互印证,这与陈艺辉等[23]在杨桃上的研究结果一致。
果蔬微观结构的变化规律是判断其抗逆性的重要指标,通过扫描电镜和透射电镜可以清楚观察到细胞表面、超微结构以及细胞内各细胞器的形态。李瑶[24]研究认为,1-MCP结合保鲜盒包装可以缓解和抑制金针菇细胞质壁分离的出现以及防止细胞膜破裂。本研究发现,贮藏期间不同处理中鲜黄花细胞结构表现出明显差异,T30处理鲜黄花的细胞结构破损严重,其阵列状的凸起结构已经萎缩,出现质壁分离现象,液泡体积缩小。与T30处理相比,T50处理维持着鲜黄花细胞结构的完整性和饱满度,尤其是结合1-MCP处理下的鲜黄花在贮藏35 d时仍然能保持细胞的良好状态且是最接近其采摘时的新鲜状态,说明50 μm PE薄膜包装结合1-MCP处理对鲜黄花的贮藏保鲜效果最好。
本研究采用薄膜包装结合1-MCP对鲜黄花进行保鲜试验。研究发现,薄膜包装在袋内形成低O2高CO2的气体微环境,抑制了呼吸强度和乙烯释放速率的上升,有效维持了鲜黄花花蕾的质地与色泽,减慢了叶绿素含量的降解速率,抑制了相对电导率和MDA含量的升高,延缓了硬度的降低,有效降低了鲜黄花在贮藏期内的失重率和腐烂率,延缓了POD、CAT活性的降低,明显抑制了Cx、β-Glu活性的升高;并且相同厚度薄膜包装结合1-MCP处理比单独使用薄膜包装效果更佳,在维持鲜黄花感官品质、保持花蕾鲜绿和纤维素降解以及细胞氧化速率和细胞形态破损等方面具有较好效果。其中以50 μm 薄膜包装并结合1-MCP处理鲜黄花的保鲜效果最佳,该方法是提高其食用价值和商品价值有效技术手段。
[1] 戢得蓉, 杨芳, 杨雯珺, 等.黄花菜贮藏及深加工技术研究进展[J].食品与发酵科技, 2016, 52(2):48-51.
JI D R, YANG F, YANG W J, et al.Review of the research on the storage and processing of daylily[J].Food and Fermentation Technology, 2016, 52(2):48-51.
[2] OU X B, LIU G, WU L H.The complete chloroplast genome of Hemerocallis citrina (Asphodelaceae), an ornamental and medicinal plant[J].Mitochondrial DNA.Part B, Resources, 2020, 5(1):1109-1110.
[3] CHEN Q, FU M R, QU Q L, et al.Effect of blanching pre-treatment on antioxidant activities and involved compounds in fresh daylily (Hemerocallis fulva L.) flowers[J].Quality Assurance and Safety of Crops &Foods, 2015, 7(3):287-293.
[4] FANG Y J, WAKISAKA M.A review on the modified atmosphere preservation of fruits and vegetables with cutting-edge technologies[J].Agriculture, 2021, 11(10):992.
[5] 圣晓婷, 张引引, 罗运君, 等.1-甲基环丙烯结合不同保鲜袋对叶用甘薯茎尖冷藏保鲜效果的影响[J].食品安全质量检测学报, 2019, 10(9):2521-2526.
SHENG X T, ZHANG Y Y, LUO Y J, et al.Effect of 1-methylcyclopropylene combined with different fresh-keeping bags on the cold preservation effect of the stalk eatable sweet potato tips[J].Journal of Food Safety &Quality, 2019, 10(9):2521-2526.
[6] LI J K, LEI H H, SONG H M, et al.1-methylcyclopropene (1-MCP) suppressed postharvest blue mold of apple fruit by inhibiting the growth of Penicillium expansum[J].Postharvest Biology and Technology, 2017, 125:59-64.
[7] WATKINS C B.The use of 1-methylcyclopropene (1-MCP) on fruits and vegetables[J].Biotechnology Advances, 2006, 24(4):389-409.
[8] SITBON C, PALIYATH G.Pre- and Postharvest Treatments Affecting Nutritional Quality[M]//Comprehensive Biotechnology.Amsterdam:Elsevier, 2011:349-357.
[9] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B ,ZHAO Y M. Experimental Guidance of Postharvest Physiological Production of Fruits and Vegetables[M]. Beijing China Light Industry Press, 2007.
[10] FARGA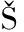 OV
OV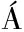 A.Inhibitive effect of organotin compounds on the chlorophyll content of the green freshwater alga Scenedesmus quadricauda[J].Bulletin of Environmental Contamination and Toxicology, 1996, 57(1):99-106.
A.Inhibitive effect of organotin compounds on the chlorophyll content of the green freshwater alga Scenedesmus quadricauda[J].Bulletin of Environmental Contamination and Toxicology, 1996, 57(1):99-106.
[11] 高建晓, 古荣鑫, 胡花丽, 等. 不同薄膜包装对黄花菜贮藏品质的影响[J]. 江苏农业科学, 2015, 43(2):255-259.
GAO J X, GU R X, HU H L, et al. Effects of different film packaging on storage quality of day lily[J]. Jiangsu Agricultural Sciences, 2015, 43(2):255-259.
[12] 李合生. 植物生理生化实验原理和技术[M].北京:高等教育出版社, 2000.
LI H S.Experimental Principles and Techniques of Plant Physiology and Biochemistry[M].Beijing:Higher Education Press, 2000.
[13] WANG Y S, TIAN S P, XU Y.Effects of high oxygen concentration on pro- and anti-oxidant enzymes in peach fruits during postharvest periods[J].Food Chemistry, 2005, 91(1):99-104.
[14] ESCALONA V H, VERLINDEN B E, GEYSEN S, et al.Changes in respiration of fresh-cut butterhead lettuce under controlled atmospheres using low and superatmospheric oxygen conditions with different carbon dioxide levels[J].Postharvest Biology and Technology, 2006, 39(1):48-55.
[15] 程赤云, 张娜, 朱喜成, 等.PBAT/PLA复合膜结合1-MCP处理对金玉兰菜保鲜效果的影响[J].食品研究与开发, 2023, 44(6):21-29.
CHENG C Y, ZHANG N, ZHU X C, et al.Effect of PBAT/PLA film combined with 1-MCP on preservation of chicory[J].Food Research and Development, 2023, 44(6):21-29.
[16] 杨万鹏, 马瑞, 杨永义, 等.NaCl处理对黑果枸杞生长、生理指标的影响[J].分子植物育种, 2019, 17(13):4437-4447.
YANG W P, MA R, YANG Y Y, et al.Effects of NaCl treatment on the growth and physiological indexes of Lycium ruthenicum[J].Molecular Plant Breeding, 2019, 17(13):4437-4447.
[17] 王玲, 戴凡炜, 吴继军, 等.自发气调包装对芥蓝采后叶绿素降解及品质保持的影响[J].食品科学技术学报, 2023, 41(1):163-174.
WANG L, DAI F W, WU J J, et al.Effects of modified atmosphere packaging on chlorophyll degradation and quality maintenance of Chinese kale after harvest[J].Journal of Food Science and Technology, 2023, 41(1):163-174.
[18] 贺艳娥. 1-MCP处理对猕猴桃贮藏品质及软化效应的影响[D].杨凌:西北农林科技大学, 2019.
HE Y E.Effects of 1-MCP treatment on quality and softening of kiwifruit during storage[D].Yangling:Northwest A &F University, 2019.
[19] 张中海. 猕猴桃“果锈” 去除方法及其对耐贮性的影响[D].杨凌:西北农林科技大学, 2006.
ZHANG Z H.Removing fruit rust methodes of kiwifruit and influence on storage trait[D].Yangling:Northwest A &F University, 2006.
[20] 阎香言, 张熠可, 李福瑞, 等.不同质地桃果实软化过程中细胞壁组分变化的差异[J].北方园艺, 2017(20):60-66.
YAN X Y, ZHANG Y K, LI F R, et al.Differences in cell wall composition during softening of peach fruit with different flesh texture[J].Northern Horticulture, 2017(20):60-66.
[21] HOLLAND N, NUNES F L, DE MEDEIROS I U D, et al.High-temperature conditioning induces chilling tolerance in mandarin fruit:A cell wall approach[J].Journal of the Science of Food and Agriculture, 2012, 92(15):3039-3045.
[22] 陈新艳. 1-MCP抑制哈密瓜果实采后软化机理的研究[D].乌鲁木齐:新疆农业大学, 2015.
CHEN X Y.Study on inhibiting softening mechanism of postharvest hami cantaloupe by 1-MCP[D].Urumqi:Xinjiang Agricultural University, 2015.
[23] 陈艺晖, 张华, 林河通, 等.1-甲基环丙烯处理对采后杨桃果实软化和细胞壁代谢的影响[J].热带亚热带植物学报, 2013, 21(6):566-571.
CHEN Y H, ZHANG H, LIN H T, et al.Effect of 1-methylcyclopropene(1-MCP) on softening and cell wall metabolism of harvested Averrhoa carambola fruits[J].Journal of Tropical and Subtropical Botany, 2013, 21(6):566-571.
[24] 李瑶. 1-MCP处理结合聚丙烯保鲜盒包装调控金针菇品质劣变机制研究[D].重庆:西南大学, 2018.
LI Y.Study on Mechanism of quality deterioration of flammulina velutipes regulated by 1-MCP treatment combined with polypropylene crisper[D].Chongqing:Southwest University, 2018.