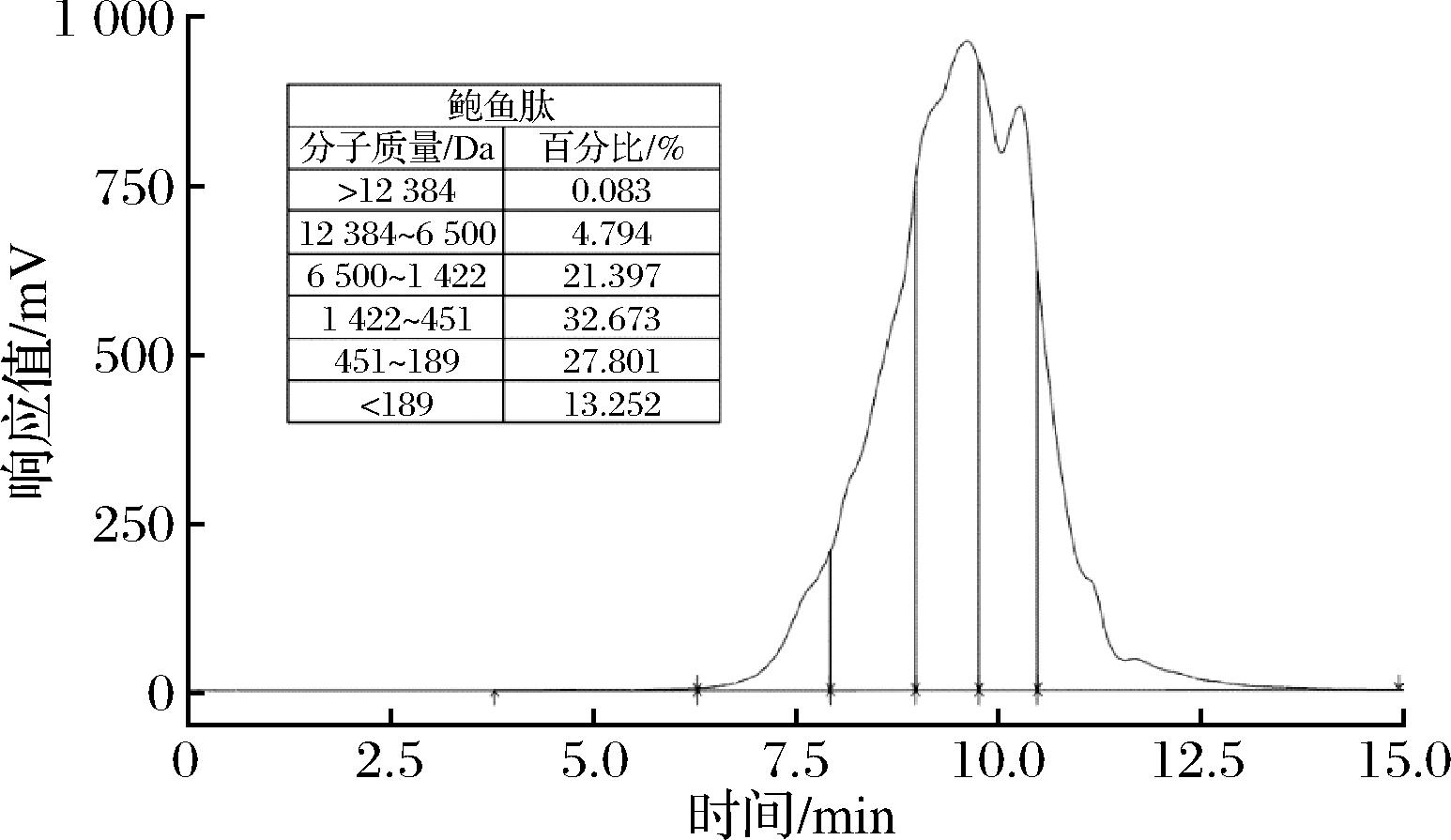
图1 鲍鱼肽分子质量分布
Fig.1 Molecular weight distribution of abalone peptide
鲍鱼是一种海洋腹足类动物,单壳软体动物,深受广大消费者的喜爱。鲍鱼作为重要海洋产品,其市场价格低于高档名贵经济鱼类,但它们的营养价值并不逊色,具有很高的食用价值和药用价值[1]。本草纲目记载,鲍鱼性平,味甘,咸,可明目补虚、清热滋阴、养血益胃、补肝肾[2]。鲍鱼富含蛋白质、多糖、牛磺酸及微量元素[3-4],而它的肽制品中胶原蛋白含量也高达30%~50%,远高于其他鱼贝类,同时,鲍鱼中的牛磺酸、硒等的含量远高于贻贝、牡蛎、文蛤等常见海洋贝类,是开发海洋生物活性肽的良好资源[5]。研究者们[6-7]发现鲍鱼酶解产物具有较好的体外抗氧化性能;QIAN等[8]研究了鲍鱼副产物对高血压大鼠血管紧张素的抑制作用和降血压作用,王军玲[9]提取了鲍鱼不同部位的多糖,发现其具有抗肿瘤和调节免疫活性的功能,目前也有多篇文献研究了鲍鱼肽的制备[10-12],但对鲍鱼肽的体内抗氧化、提高免疫的功能评价研究较少。
本论文研究了酶解鲍鱼肽的分子质量分布,并对氨基酸含量进行测定,结合动物实验的抗氧化酶活性、血液白细胞数、细胞免疫、体液免疫和NK细胞活性等指标,评估了鲍鱼肽的体内抗氧化和提高免疫力的功能性,旨在为鲍鱼肽的深入应用提供更多理论和实验依据。
本研究所使用鲍鱼肽由福建大众健康生物科技有限公司提供,制备过程经过鲍鱼肉蒸煮预处理,降温后添加固含量2%复合蛋白酶(含木瓜蛋白酶、碱性蛋白酶、脂肪酶等)水解5 h,后期分离干燥获得固体粉末,密封于铝箔袋中4 ℃避光干燥保存。
丙二醛(malondialdehyde,MDA)测试盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、微量还原型谷胱甘肽(reducing glutathione,GSH)测试盒、BCA法蛋白定量测试盒、蛋白质羰基(protein carbonyl,PCO)含量测试盒,南京森贝伽生物科技有限公司;RPMI1640完全培养液、小牛血清、PBS、青链霉素,赛默飞世尔科技公司;小鼠淋巴瘤细胞(YAC-1),中国科学院细胞库;绵羊红细胞(SRBC)、Hank’s液(pH=7.2)、刀豆蛋白A(concanavalin A,ConA)、噻唑蓝 (MTT)、补体(豚鼠血清)、SA缓冲液、都氏试剂、生理盐水、LDH基质液、氧化型辅酶I等,上海源叶生物科技有限公司;甲醇、乙腈均为色谱纯,美国TEDIA公司;四氢呋喃、三乙胺、盐酸、结晶乙酸钠、三氟乙酸均为分析纯,生工生物工程(上海)股份有限公司;1 nmol/μL 的17种氨基酸标准品(天门冬氨酸、组氨酸、谷氨酸、丝氨酸、甘氨酸、苏氨酸、丙氨酸、精氨酸、酪氨酸、胱氨酸、缬氨酸、蛋氨酸、苯丙氨酸、异亮氨酸、亮氨酸、赖氨酸、脯氨酸)、细胞色素C(Mw=12 384 Da)、抑肽酶(Mw=6 500 Da)、杆菌肽(Mw=1 422 Da)、乙氨酸—乙氨酸—酪氨酸—精氨酸(Mw=451 Da)、乙氨酸—乙氨酸—乙氨酸(Mw=189 Da),Sigma公司;邻苯二甲醛(o-phthalaldehyde,OPA)、芴甲氧羰酰氯(fluorene methoxycarbonyl chloride,FMOC),美国安捷伦公司。
BS420全自动生化分析仪,迈瑞医疗器械公司;ChampSpot Ⅲ溶血空斑检测仪,北京安泰永信医疗公司;1510全波长酶标仪、TSK gel 2000 SWXL色谱柱(300 mm×7.8 mm)、Countess Ⅱ全自动细胞计数仪,美国赛默飞世尔科技公司;Agilent1100高效液相色谱系统、Agilent Hypersil ODS柱(5 μm,4.0 mm×250 mm),美国安捷伦公司。
SPF级健康雄性KM小鼠(18~22 g),由斯贝福(苏州)生物技术有限公司提供(许可证号为SCXK(京)2022-0006),动物质量合格证编号:2022248509。
1.3.1 鲍鱼肽的分子质量分布分析
采用高效液相色谱仪检测鲍鱼肽的相对分子质量分布,色谱条件:色谱柱TSK gel 2000 SWXL,流动相:V(乙腈)∶V(水)∶V(三氟乙酸)=36∶64∶0.1,检测波长UV 205 nm,流速1 mL/min,柱温30 ℃,上样体积10 μL。样品制备:配制10 g/L鲍鱼肽溶液,微孔滤膜(13 mm×0.45 μm)过滤后进样。以细胞色素C、抑肽酶、杆菌肽、乙氨酸-乙氨酸-酪氨酸-精氨酸、乙氨酸-乙氨酸-乙氨酸为标准品,测定鲍鱼肽中肽段的分布情况。
1.3.2 氨基酸组成测定
样品制备:酸水解过程(色氨酸被破坏):准确称取0.1 g鲍鱼肽放入水解管,加入8 mL 6 mol/L HCl。充氮气3 min,拧紧水解管,置于120 ℃烘箱中,水解22 h,加入4.8 mL 10 mol/L NaOH中和,用蒸馏水定容至25 mL,双层滤纸过滤,取1 mL澄清滤液于1.5 mL离心管内,15 000 r/min,30 min。上样检测。碱水解过程(测色氨酸,其他氨基酸部分被破坏):准确称取0.1 g鲍鱼肽放入水解管,加入8 mL 5 mol/L NaOH。充N2 3 min,拧紧水解管,置于120 ℃烘箱中,水解22 h,加入6.7 mL 6 mol/L HCl中和,用蒸馏水定容至25 mL,双层滤纸过滤,取1 mL澄清滤液于1.5 mL离心管内,15 000 r/min,30 min。上样检测。
采用OPA柱前衍生反相高效液相色谱紫外检测法测定总氨基酸(total amino acid,TAA),流动相A(pH=7.2):V(27.6 mmol/L醋酸钠)∶V(三乙胺)∶V(四氢呋喃)=500∶0.11∶2.5。流动相B(pH=7.2):V(80.9 mmol/L醋酸钠)∶V(甲醇)∶V(乙腈)=1∶2∶2。Agilent Hypersil ODS柱;采用梯度洗脱,洗脱程序为:0 min, 8% B;17 min, 50% B;20 min, 100% B;24 min, 0% B;流速为1.0 mL/min;柱温40 ℃;紫外检测器检测波长为338 nm,脯氨酸以262 nm检测;氨基酸含量以外标法定量。
1.3.3 抗氧化功能评价
购入SPF级健康雄性KM小鼠,按体重随机分成5个组,即空白组、模型组、低(0.25 g/kg BW)、中(0.5 g/kg BW)、高(1.0 g/kg BW)3个剂量组,每组10只动物。适应5 d后,受试样品组经口灌胃连续给予30 d,灌胃量为10 mL/kg BW,空白和模型组灌胃等量蒸馏水。末次灌胃后,除空白组外,其余4组禁食16 h(过夜)后一次性灌胃给予50%(体积分数)乙醇12 mL/kg BW进行造模,6 h后取肝脏,液氮速冻后放入-80 ℃冰箱存放备用。用试剂盒法测定小鼠血清中脂质氧化产物MDA、PCO、GSH含量、抗氧化酶SOD活力。具体方法参照食药监保化[2012]107号附件1抗氧化功能评价方法进行。
1.3.4 提高免疫功能评价
按照1.3.3节分组及处理进行实验。分别进行血液白细胞数测定试验、ConA诱导小鼠淋巴细胞转化试验(MTT法)、迟发型变态反应试验(足趾增厚法)、抗体生成细胞试验 (Jerne改良玻片法)、血清溶血素测定试验 (半数溶血素法)和NK活性测定试验(乳酸脱氢酶测定法)。具体方法参照《保健食品功能检验与评价方法(2022年版,征求意见稿)》中的免疫功能低下模型方法。
1.3.5 数据处理
试验数据结果用SPSS软件进行方差齐性检验,数据采用平均值±标准差表示,P<0.05表示具有显著性意义。
图1中可以看出,鲍鱼肽分子质量在450 Da以下的肽约占40%,表明鲍鱼肽主要是由2~3个氨基酸残基组成的小肽。寡肽尤其是二肽、三肽极易穿越小肠黏膜被机体吸收用[13],且容易作为机体的能量来源,缓解疲劳,具有较高的营养价值[6-7]。GUO等[14]研究发现,通过优化酶解条件对鲍鱼内脏进行酶解,筛选得到的分子质量在1 500~6 000 Da鲍鱼肽,可以清除DPPH自由基和羟自由基,具有较高的体外抗氧化性。

图1 鲍鱼肽分子质量分布
Fig.1 Molecular weight distribution of abalone peptide
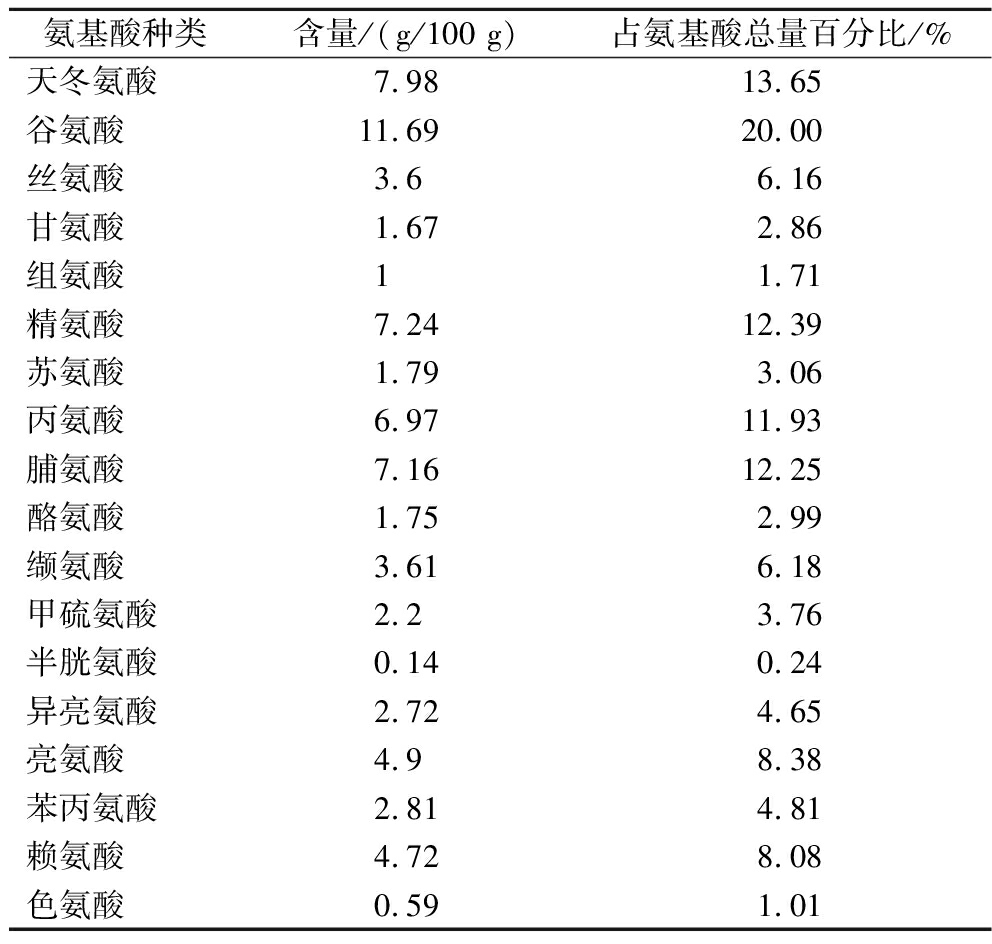
由表1可知,鲍鱼肽的氨基酸总量为72.54 g/100 g,其中谷氨酸含量最高,其次是天冬氨酸和精氨酸。必需氨基酸含量为23.34 g/100 g,占鲍鱼肽氨基酸总量的39.94%。乔路[15]在试验中发现,鲍鱼内脏酶解产物中的天冬氨酸、谷氨酸和精氨酸含量较高,且特定的氨基酸残基和多肽水解产物的抗氧化活性有着很好的相关性,国内外研究者也纷纷证明,高含量氨基酸普遍具有抗氧化活性[16]。试验选用小鼠进一步验证和评价鲍鱼肽的体内抗氧化性。
表1 鲍鱼肽氨基酸成分分析
Table 1 Analysis of amino acid composition of abalone peptide
氨基酸种类含量/(g/100 g)占氨基酸总量百分比/%天冬氨酸7.9813.65谷氨酸11.6920.00丝氨酸3.66.16甘氨酸1.672.86组氨酸11.71精氨酸7.2412.39苏氨酸1.793.06丙氨酸6.9711.93脯氨酸7.1612.25酪氨酸 1.752.99缬氨酸3.616.18甲硫氨酸2.23.76半胱氨酸0.140.24异亮氨酸2.724.65亮氨酸4.98.38苯丙氨酸2.814.81赖氨酸4.728.08色氨酸0.591.01
MDA是机体内脂质过氧化作用分解所产生的,其浓度与细胞膜受损程度呈正相关[17];机体内氧化剂含量升高会加速蛋白质羰基化,使细胞遭受自由基的破坏,体内PCO含量越高,表明机体抗氧化能力越弱[18-19]。GSH和SOD可以清除体内H2O2和脂质过氧化物,具有抗氧化作用,机体可以通过提高这类抗氧化物酶活力来强化机体清除自由基的能力[20-21]。
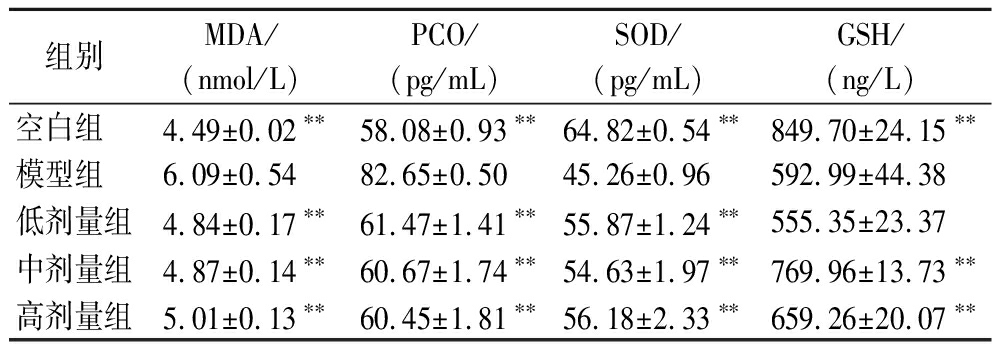
由表2可知,小鼠连续灌胃30 d后,与空白组比较,模型组小鼠肝脏GSH和SOD含量均显著低于空白组(P<0.01),MDA和PCO含量均显著高于空白组(P<0.01),表明急性酒精肝损伤动物模型造模成功。鲍鱼肽3个剂量组的MDA和PCO含量与模型组相比均显著降低(P<0.01),SOD含量与模型组相比显著升高(P<0.01),中、高剂量组小鼠的GSH含量与模型组相比显著升高(P<0.01),表明鲍鱼肽可以迅速提高肝损伤小鼠体内SOD和GSH含量,抑制MDA和PCO的产生,减轻肝脏内氧化应激反应,提高肝细胞的抗氧化能力,从而发挥保护作用。
表2 小鼠血清中MDA、PCO、GSH和SOD含量
Table 2 MDA, PCO, GSH, and SOD content in serum of mice
组别MDA/(nmol/L)PCO/(pg/mL)SOD/(pg/mL)GSH/(ng/L)空白组4.49±0.02∗∗58.08±0.93∗∗64.82±0.54∗∗849.70±24.15∗∗模型组6.09±0.5482.65±0.5045.26±0.96592.99±44.38低剂量组4.84±0.17∗∗61.47±1.41∗∗55.87±1.24∗∗555.35±23.37中剂量组4.87±0.14∗∗60.67±1.74∗∗54.63±1.97∗∗769.96±13.73∗∗高剂量组5.01±0.13∗∗60.45±1.81∗∗56.18±2.33∗∗659.26±20.07∗∗
注:同一列数据中,*表示与模型组比较差异显著(P<0.05),**表示与模型组比较差异极显著(P<0.01)(下同)。
2.3.1 鲍鱼肽对小鼠血液白细胞数的影响
白细胞是机体免疫系统和防御系统的重要组成部分,图2可以看出模型组白细胞数显著低于空白组,说明免疫低下模型造模成功。与模型组相比,中、高剂量组的白细胞数均有显著性的上升,且有一定的量效关系。说明鲍鱼肽可以提高免疫低下小鼠的白细胞数量。
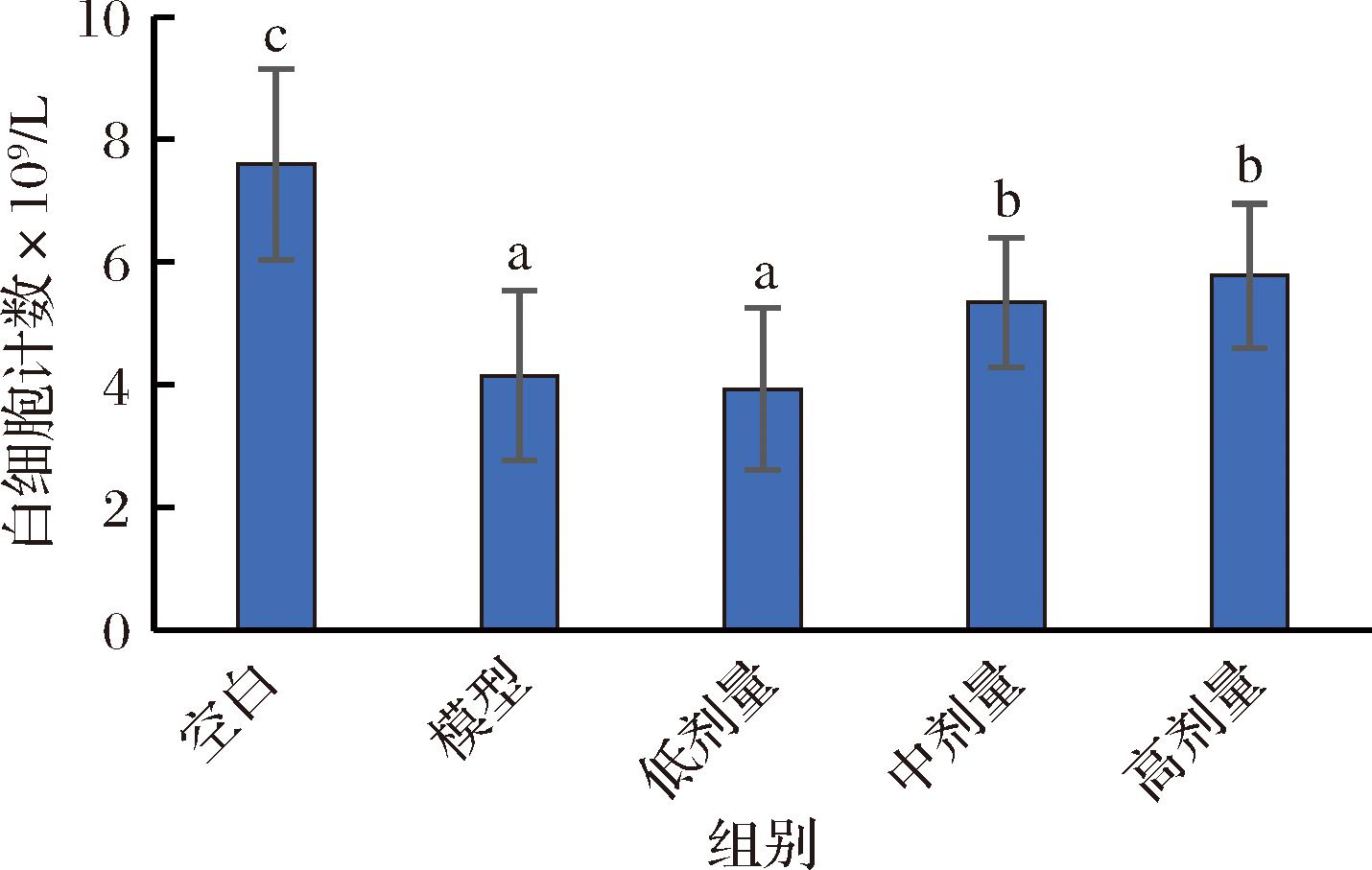
图2 鲍鱼肽对小鼠血液白细胞的影响
Fig.2 Effect of abalone peptide on leukocyte in mouse blood
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3.2 鲍鱼肽对小鼠细胞免疫功能的影响
淋巴细胞转化能力和迟发型变态反应可反映机体细胞免疫功能,淋巴细胞转化能力是细胞免疫能力最直接的指标,脾脏内的T淋巴细胞和B淋巴细胞受到抗原刺激会产生淋巴因子或抗体,诱导机体发生免疫应答[22]。迟发型变态反应是当机体被致敏性T细胞刺激时产生的一种细胞免疫反应,足趾肿胀度越高,机体免疫功能越强。由图3可知,与空白组相比,模型组小鼠脾淋巴细胞增殖能力与足趾肿胀有显著性变化,说明免疫低下模型造模成功,3个剂量组的淋巴细胞转化能力与模型组相比,无显著变化;低剂量组的足趾肿胀度显著高于模型,中、高剂量组的组织肿胀度与模型组相比,无显著差异。从淋巴细胞增殖能力和足趾肿胀度两个试验看出,鲍鱼肽未能提高T细胞的应答能力增强小鼠的细胞免疫功能。
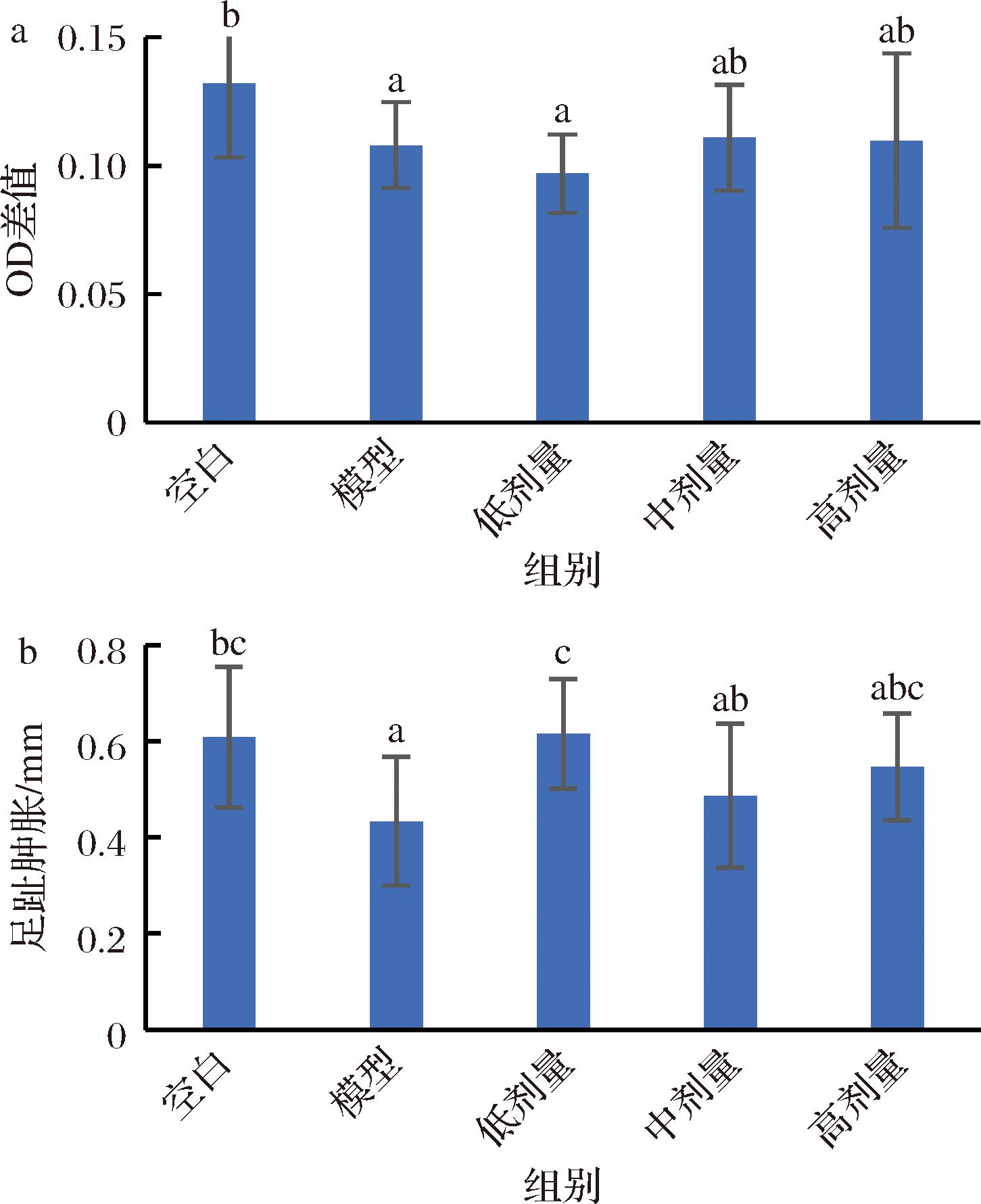
a-淋巴细胞增殖能力;b-足趾肿胀度
图3 鲍鱼肽对小鼠细胞免疫功能的影响
Fig.3 Effect of abalone peptide on cellular immune function in mice
2.3.3 鲍鱼肽对小鼠体液免疫功能的影响
血清溶血素水平反映淋巴细胞的增殖和分化水平,溶血素高低与抗体形成细胞数量成正比,从而评价机体体液免疫功能[23];溶血空斑数量也可反映抗体生成细胞能力。图4可以看出,模型组的半数溶血值和溶血空斑数显著低于空白组,说明环磷酰胺造免疫低下模型成功,3个剂量组与模型组相比,均有量效关系的上升,高剂量组的半数溶血值和溶血空斑数量与模型组相比,均有显著性差异。从这两个试验看,鲍鱼肽在一定程度上可以调节体液免疫功能。
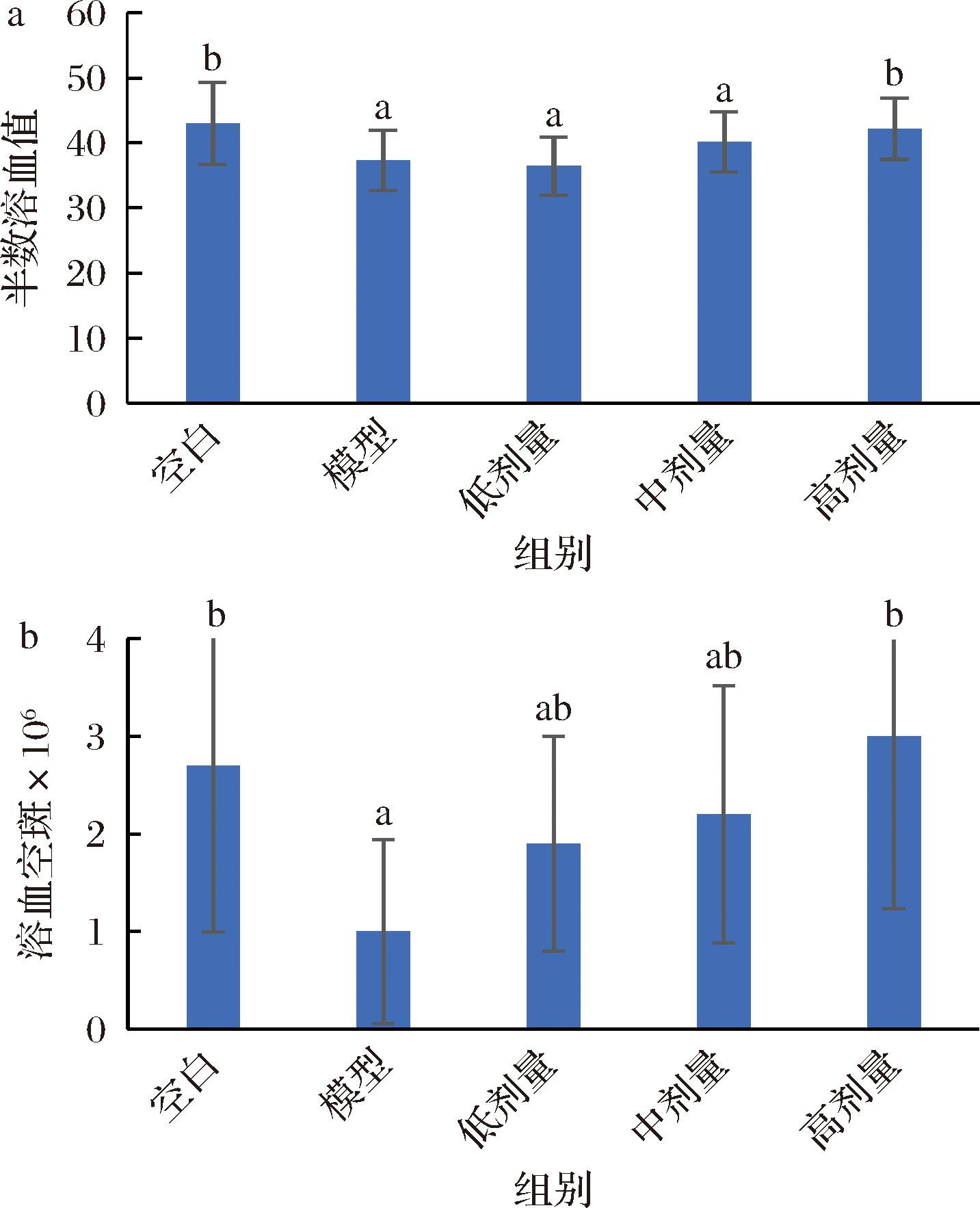
a-血清溶血素含量;b-抗体生成细胞含量
图4 鲍鱼肽对小鼠体液免疫功能的影响
Fig.4 Effect of abalone peptide on humoral immune function in mice
2.3.4 鲍鱼肽对小鼠NK细胞活性的影响
NK细胞是机体重要的免疫细胞,与抗肿瘤、抗病毒和调节免疫有关,是衡量机体非特异性免疫功能的重要指标。由表3可知,模型组的NK细胞活性显著低于空白组,说明免疫低下模型造模成功。中、高剂量组的NK细胞活性均有显著性的回升,表明鲍鱼肽具有增强小鼠NK细胞活性的作用。
表3 鲍鱼肽对小鼠NK细胞活性的影响
Table 3 Effect of abalone peptide on the activity of mouse NK cells

组别NK细胞活性/%NK细胞活性换算值空白组15.33±3.91∗0.40±0.06∗模型组11.99±2.580.35±0.04低剂量13.75±2.940.38±0.04中剂量15.28±2.11∗0.40±0.03∗高剂量15.05±3.20∗0.40±0.04∗
鲍鱼肽的分子质量95%分布在6 500 Da以下,易于吸收,在机体中更易发挥其活性。通过动物实验,发现鲍鱼肽可以提高急性酒精肝损伤动物的抗氧化物酶含量,降低机体内的MDA和PCO含量,从而发挥辅助抗氧化能力;鲍鱼肽还可以提高免疫低下模型小鼠的白细胞数量,调节小鼠体液免疫功能和NK细胞活性,从而增强免疫低下小鼠的免疫力。本研究结果为未来功能性鲍鱼肽的研究与开发提供参考。
[1] 刘先进. 不同品种、产地与养殖模式鲍鱼营养品质评价与鲍鱼内脏多糖活性功能研究[D].上海:上海海洋大学, 2018.
LIU X J.Study on the nutritional quality of abalone in different varieties, habitats and aquaculture models, and the function of polysaccharide in abalone[D].Shanghai:Shanghai Ocean University, 2018.
[2] 王敏, 卢赛, 张曾亮, 等.鲍鱼水解肽的抗氧化、抗炎及免疫调节作用[J].食品工业科技, 2021, 42(5):282-288.
WANG M, LU S, ZHANG C L, et al.Antioxidant, anti-inflammatory and immunomodulatory effects of abalone hydrolytic peptide[J].Science and Technology of Food Industry, 2021, 42(5):282-288.
[3] 陈胜军, 杨少玲, 刘先进, 等.鲍鱼及其副产物综合加工利用研究进展[J].肉类研究, 2019, 33(10):76-81.
CHEN S J, YANG S L, LIU X J, et al.Recent progress in comprehensive processing and utilization of abalone and its byproducts[J].Meat Research, 2019, 33(10):76-81.
[4] 苏柳智. 鲍鱼脏器醇溶性物质的营养价值及其抗氧化活性的研究[D].福州:福建农林大学, 2012.
SU L Z.Study on trophic value and antioxidant activity of alcohol soluble substances from abalone viscera[D].Fuzhou:Fujian Agriculture and Forestry University, 2012.
[5] 刘先进, 陈胜军, 李来好, 等.四种鲍鱼肌肉营养成分分析与品质评价[J].食品与发酵工业, 2018, 44(5):227-231.
LIU X J, CHEN S J, LI L H, et al.Nutritional analysis and quality evaluation of four kinds of abalone muscle[J].Food and Fermentation Industries, 2018, 44(5):227-231.
[6] ZHOU D Y, ZHU B W, QIAO L, et al.In vitro antioxidant activity of enzymatic hydrolysates prepared from abalone (Haliotis discus hannai Ino) viscera[J].Food and Bioproducts Processing, 2012, 90(2):148-154.
[7] 叶燕军, 陈俊, 翁武银.超滤膜分离鲍鱼内脏酶解物及其体外抗氧化活性的研究[J].现代食品科技, 2015, 31(5):130-136;284.
YE Y J, CHEN J, WENG W Y.In vitro antioxidant activity of abalone viscera hydrolysates isolated by ultrafiltration[J].Modern Food Science and Technology, 2015, 31(5):130-136;284.
[8] QIAN Z J, ZHANG Y Y, OH G W, et al.Antioxidant and angiotensin I converting enzyme inhibition effects and antihypertensive effect in spontaneously hyertensive rats of peptide isolated from boiled abalone by-products, Hallotis discus hannai[J].Journal of Aquatic Food Product Technology, 2018, 27(9):946-960.
[9] 王军玲. 鲍鱼不同部位多糖的性质、结构及其抗肿瘤和免疫调节活性研究[D].厦门:集美大学, 2017.
WANG J L.Study on the properties, structure, antitumor and immunological activity of polysaccharides in different parts of abalone[D].Xiamen:Jimei University, 2017.
[10] HU Y J, YANG J H, HE C B, et al.Fractionation and purification of antioxidant peptides from abalone viscera by a combination of Sephadex G-15 and Toyopearl HW-40F chromatography[J].International Journal of Food Science and Technology, 2022,57(2):1218-1225.
[11] 陈申如, 魏配晓, 叶燕军, 等.鲍鱼肽的制备及其抑制人乳腺癌MDA-MB-231细胞增殖作用[J].食品科学, 2018, 39(23):120-125.
CHEN S R, WEI P X, YE Y J, et al.Preparation of peptides derived from enzymatic hydrolysate of abalone viscera and their inhibitory effect on MDA-MB-231 human breast cancer cells[J].Food Science, 2018, 39(23):120-125.
[12] POWNALL T L, UDENIGWE C C, ALUKO R E.Amino acid composition and antioxidant properties of pea seed (Pisum sativum L.) enzymatic protein hydrolysate fractions[J].Journal of Agricultural and Food Chemistry, 2010, 58(8):4712-4718.
[13] MAEBUCHI M, SAMOTO M, KOHNO M, et al.Improvement in the intestinal absorption of soy protein by enzymatic digestion to oligopeptide in healthy adult men[J].Food Science and Technology Research, 2007, 13(1):45-53.
[14] GUO S, WANG J, HE C B, et al.Preparation and antioxidant activities of polysaccharides obtained from abalone viscera by combination of enzymolysis and multiple separation methods[J].Journal of Food Science, 2020, 85(12):4260-4270.
[15] 乔路. 酶法制备鲍鱼内脏呈味肽和呈味氨基酸及其生物活性的研究[D].大连:大连工业大学, 2010.
QIAO L.Preparation and bioactivity of flavor peptides and flavor amino acids from abalone viscera by enzymatic method[D].Dalian:Dalian Polytechnic University, 2010.
[16] AHN C B, JE J Y, CHO Y S.Antioxidant and anti-inflammatory peptide fraction from salmon byproduct protein hydrolysates by peptic hydrolysis[J].Food Research International, 2012, 49(1):92-98.
[17] TSIKAS D.Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples:Analytical and biological challenges[J].Analytical Biochemistry, 2017, 524:13-30.
[18] SAITO K, JIN D H, OGAWA T, et al.Antioxidative properties of tripeptide libraries prepared by the combinatorial chemistry[J].Journal of Agricultural and Food Chemistry, 2003, 51(12):3668-3674.
[19] D VALOS A, MIGUEL M, BARTOLOMÉ B, et al.Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J].Food Protection, 2004, 67(9):1939-1944.
VALOS A, MIGUEL M, BARTOLOMÉ B, et al.Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J].Food Protection, 2004, 67(9):1939-1944.
[20] 魏好程, 邵杰, 何传波, 等.鲍内脏多糖体内抗氧化及增强小鼠免疫活性[J].食品科学, 2018, 39(9):140-144.
WEI H C, SHAO J, HE C B, et al.In vivo antioxidant capacity and immunoenhancing activity in mice of polysaccharides from abalone viscera[J].Food Science, 2018, 39(9):140-144.
[21] 王诗洋, 王枭, 徐祖清, 等.苦杏仁苷通过抑制氧化应激及炎症反应减轻四氯化碳诱导的大鼠肝纤维化作用[J].现代免疫学, 2020, 40(6):471-475;481.
WANG S Y, WANG X, XU Z Q, et al.Amygdalin alleviates carbon tetrachloride induced hepatic fibrosis in rats by inhibiting oxidative stress and inflammatory response[J].Current Immunology, 2020, 40(6):471-475;481.
[22] 刘奇, 慎凯峰, 周丹英, 等.当归口服液对正常小鼠免疫功能的影响[J].海峡药学, 2020, 32(12):19-23.
LIU Q, SHEN K F, ZHOU D Y, et al.Effect of Angelica oral liquid on immune function of normal mice[J].Strait Pharmaceutical Journal, 2020, 32(12):19-23.
[23] 李晓梅, 鞠玉琳.中药“FH” 对小鼠血清溶血素和淋巴细胞转化的影响[J].延边大学农学学报, 2005, 27(3):197-200.
LI X M, JU Y L.Effects of Chinese traditional medicine “FH” on hemolysinin serum and transformation function oflymphocyte in rice[J].Journal of Agricultural Science Yanbian University, 2005, 27(3):197-200.