表1 梯度洗脱过程
Table 1 Gradient elution program table

时间/min流动相A/%流动相B/%0100011000234357270100340100401000411000
虎奶菌(Pleurotus tuber-rigium (Fr.) Sing),又名虎奶菇、菌核侧耳等,其隶属于担子菌亚门、侧耳科、侧耳属[1]。虎奶菌广泛分布于世界热带和亚热带地区,包括非洲、亚洲、澳大拉西亚[2],我国早在1995年从尼日利亚引进栽培,目前在我国主要分布在纬度较低区域,如云南腾冲和章凤市[3-4]。
虎奶菌是典型的真菌单倍体,其能够通过无性及有性的方式繁殖[5],虎奶菌生长过程不同于其他侧耳属菇类,它在发育阶段具有菌核(一种地下茎块)和长柄杯状子实体,虎奶菌是已知的唯一一种利用菌核产生子实体的菇类[6]。这种球形菌核是一种能量储存器官,能够在干旱时期存活,在不利的生长情况下可以产生新的子实体[7],虎奶菌菌核与子实体均可食用,且具有药用价值[8-9]。在相关研究报道中虎奶菌被非洲当地草药医生用于治疗各种疾病,包括心脏灼烧、胃溃疡、哮喘、高血压,甚至乳腺癌等。近年来,证明虎奶菌在功能性食品、化妆品和药品中具有潜在价值的科学证据正在出现。虎奶菌中具有多种化学成分,其中富含具有生物活性的β-葡聚糖组成的非淀粉多糖,这些多糖有着非常重要的药理作用[10]。虎奶菌子实体中超过一半营养成分被鉴定为碳水化合物,其次是蛋白质,脂肪和蛋白质的含量相对较低,同时在虎奶菌中含有大量的矿物质元素,例如钾、钙、钠、镁、锌、铜等,此外,虎奶菌中有丰富的活性成分,如多糖、生物碱、酚类化合物、鞣质、黄酮类化合物等[11]。
传统上,虎奶菌的有效成分主要是从菌核中提取的[12-13],但人工栽培虎奶菌具有周期长和成本价格高的缺点,提取具有治疗和保健的有效成分不可避免地会花费太多成本。因此,对虎奶菌的开发和利用也会受到限制,采用液体深层次发酵可在短时间获得大量菌丝体和发酵产物[14]。与此同时,相关研究表明菌丝体的营养价值在多糖、蛋白质、氨基酸含量方面接近或超过子实体[15-16]。本研究对虎奶菌菌核和液体发酵菌丝体的常规营养成分如氨基酸、脂肪酸和微量元素的组成以及活性成分多糖、多酚、三萜、黄酮等组分含量进行对比分析和评价,进一步完善了虎奶菌菌核和菌丝体中有效成分的信息,为其质量的综合评价提供科学数据。同时,也为该菌的研究提供理论和实践依据,在功能食品和制药行业中提取有效成分将大大降低成本,为虎奶菌的应用奠定了一定的基础。
虎奶菌菌株由乌鲁木齐食用菌研究所采集、鉴定、驯化所得;虎奶菌菌核由乌鲁木齐食用菌研究所栽培提供。
种子培养液:PDB培养基。
发酵培养液(g/L):葡萄糖30、酵母浸粉4、KH2PO4 1、MgSO4 0.6。
KDN-1凯式定氮仪,上海雷兹公司;SZC-1脂肪测定仪,上海纤检仪器有限公司;UV-2450紫外-可见分光光度计,日本岛津公司;SpectraMax M酶标仪,美谷分子仪器有限公司。
1.4.1 菌丝体发酵
将生长旺盛的虎奶菌菌株接种至种子培养液中,设定摇床条件为30 ℃、180 r/min,培养3 d,种子液接种量为5%,30 ℃、180 r/min,培养7 d,过滤、冲洗菌丝体。将收集得到的菌丝体与菌核放置在60 ℃烘箱中,热风干燥至恒重,粉碎、过筛备用。
1.4.2 常规营养成分测定
根据GB 5009.3—2010《食品安全国家标准 食品中水分的测定》测定样品中水分含量;根据GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》测定样品中灰分含量;根据GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》测定样品中脂肪含量;根据GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》测定样品中蛋白质含量;根据GB/T 15672—2009《食用菌中总糖含量的测定》测定样品中总糖含量;根据GB 5009.8—2023《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》利用高效液相方法测定果糖、葡萄糖、蔗糖、麦芽糖、乳糖的含量;根据GB 5009.86—2016《食品安全国家标准 食品中抗坏血酸的测定》利用高效液相色谱测定维生素C的含量;根据GB 5009.157—2016《食品安全国家标准 食品中有机酸的测定》利用高效液相色谱测定有机酸含量。
1.4.3 氨基酸含量测定
样品处理:除色氨酸外剩余17种氨基酸酸解,称取0.1 g样品于密封瓶中,加入10 mL 6 mol/L盐酸(含1%苯酚),充N2 1 min,封瓶,110 ℃水解22 h。取出冷却,加水稀释定容至50 mL,取1 mL 95 ℃下氮吹挥干,准确加入1 mL 0.01 mol/L HCl溶液溶解,过0.2 μm水系滤膜,上机分析。
色氨酸采用碱解方法,称取粉末0.05 g样品于密封瓶中,加5 mL 5 mol/L NaOH溶液,110 ℃水解20 h,取出冷却,加水定容至10 mL。取2 mL,用2.5 mol/L HCl溶液调节pH 7,定容至5 mL,过0.2 μm水系滤膜,上机分析。
色谱条件:Agilent 1100液相色谱仪(配VWD检测器)ZORBAX Eclipse AAA (4.6 mm×150 mm, 3.5 μm);检测信号:紫外338 nm (0~19 min),266 nm (19.01~25 min);流动相A:40 mmol/L磷酸二氢钠(pH 7.8);流动相B:V(乙腈)∶V(甲醇)∶V(水)=45∶45∶10;流速:1.0 mL/min。流动相梯度洗脱比例详见表1。
表1 梯度洗脱过程
Table 1 Gradient elution program table

时间/min流动相A/%流动相B/%0100011000234357270100340100401000411000
1.4.4 脂肪酸含量测定
油脂提取:参照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》操作进行水解-提取法。
脂肪酸的甲酯化:称取油脂,油脂中加入2 mL 140 g/L三氟化硼-甲醇,60 ℃水浴30 min进行甲酯化,冷却至室温,加入1 mL蒸馏水和2 mL正己烷振荡,静置分层完全后吸取上层有机层,N2吹挥干溶剂后用1 mL正己烷溶解,样品上GC/MS分析。
脂肪酸的GC/MS分析
色谱条件:色谱柱HP-5MS(60 m×0.25 mm,0.25 μm);进样口温度280 ℃;进样量1.0 μL,分流比20∶1;载气氦气;恒线速度流速1.5 mL/min;升温程序初始柱温120 ℃,保持1 min;以6 ℃/min速率升到170 ℃,保持0 min;再以2.5 ℃/min速率升到215 ℃,保持12 min;以4 ℃/min速率升到230 ℃,保持10 min;以10 ℃/min速率升到280 ℃,保持15 min。
质谱条件:离子源温度200 ℃;四级杆150 ℃;连接线温度260 ℃;电子轰击能量70 eV;质量扫描范围m/z 40~550。
1.4.5 矿物质元素含量测定
采用原子吸收分光光度计测定试样的各种元素含量。其中Cu、Fe、Ca、K、Mg、Zn采用火焰法,Mo、Se采用石墨炉法。称量0.5 g试样于50 mL消解罐中,加入10 mL的硝酸,盖上盖子,消解温度170 ℃,保持时间15 min的消解仪中消解。待消解结束之后,取出消解罐,置于通风橱中冷却至室温,打开气盖,在140 ℃条件下进行赶酸,在赶酸的过程中每隔20 min摇动1次消解罐,等到消解液为2~3 mL时全量转移出罐内的消解液,用超纯水清洗管内壁2次,收集所有溶液,定容至20 mL。火焰法元素含量计算如公式(1)所示、石墨炉法元素含量的计算如公式(2)所示:
元素含量![]()
(1)
元素含量![]()
(2)
式中:ρ,试样溶液元素含量,mg/L;ρck,空白对照中元素含量,mg/L;V,消解液定容体积,mL;N,稀释倍数;m,样品质量,g。
1.4.6 多糖含量测定
虎奶菌菌丝体与菌核多糖按照NY/T 1676—2023《食用菌中粗多糖的测定 分光光度法》计算菌丝体和菌核中总多糖,结果以葡萄糖当量表示,标准曲线方程为y1=11.168x1+0.010 2,R2=0.999 5。
1.4.7 三萜含量测定
按照NY/T 3676—2020《灵芝中总三萜含量的测定 分光光度法》测定总三萜的含量,三萜类化合物在酸性条件下与香草醛反应生成蓝紫色产物,结果以齐墩果酸当量表示,标准曲线方程为y2=18.887x2-0.011 6,R2=0.999。
1.4.8 多酚含量测定
参照MARSOUL等[17]实验方法,稍作修改,称取没食子酸粉末,蒸馏水溶解、定容质量浓度为0.001 g/mL。吸取0、0.25、0.5、0.75、1.0、1.25、1.5 mL没食子酸溶液于25 mL容量瓶中,加入福林酚试剂1 mL,振荡摇匀后静置3 min,加入120 g/L的Na2CO3溶液2 mL,定容后室温、无光条件下存放2 h。结果以没食子酸当量表示,标准曲线方程为y3=0.515 5x3+0.019 7,R2=0.997 8。
1.4.9 黄酮含量测定
黄酮含量参照植物类黄酮试剂盒进行测定,其测定原理为在碱性亚硝酸盐溶液中,类黄酮与Al3+反应能够形成红色络合物,在510 nm处有特征吸收峰。通过测定510 nm吸光值,即可计算样品类黄酮含量。
1.4.10 组分测定
称取1 g经干燥粉碎处理的菌丝体和菌核样品,加入1 mL去离子水润湿样品,加入10 mL甲醇,振荡混匀后超声波处理20 min,4 000 r/min离心5 min除去残渣,上清液经0.22 μm滤膜过滤后,进样体积1 μL,用GC-MS分析。
GC条件:SHIMADZU SH-Rxi-5Sil MS色谱(30 m×0.25 mm×0.25 μm);分流进样,分流比10∶1;程序升温:进样口温度250 ℃,初始温度30 ℃,保持1 min,以5 ℃/min升至250 ℃,保持3 min,再以10 ℃/min升至280 ℃,保持5 min。
MS条件:EI电离源;载气为He;吹扫流量3 mL/min;电子能量70 eV;离子源温度200 ℃;全扫描模式,质量扫描范围35~600 amu;溶剂延迟2 min。
图1为虎奶菌菌丝体与菌核的主要营养成分,其中图1-a表示为灰分、粗蛋白、粗脂肪等营养成分含量,图1-b表示为单双糖组成,由图1-a可知,菌丝体水分含量、总糖含量、粗脂肪含量显著(P<0.05)低于菌核,菌丝体与菌核的灰分含量差异不显著(P>0.05),菌丝体粗蛋白含量显著(P<0.05)高于菌核,均具有统计学意义。通过高效液相色谱法测定菌丝体与菌核中单双糖组成如图1-b所示,菌丝体中共检测到2种单糖和1种双糖,分别是果糖3.29 g/100 g、葡萄糖4.71 g/100 g和乳糖2.59 g/100 g;菌核中共检测到2种单糖和3种双糖,分别为果糖3.39 g/100 g、葡萄糖2.80 g/100 g、蔗糖2.44 g/100 g、麦芽糖2.80 g/100 g和乳糖2.61 g/100 g。在菌丝体与菌核中,菌丝体中葡萄糖含量高于菌核,果糖和乳糖含量结果基本一致。
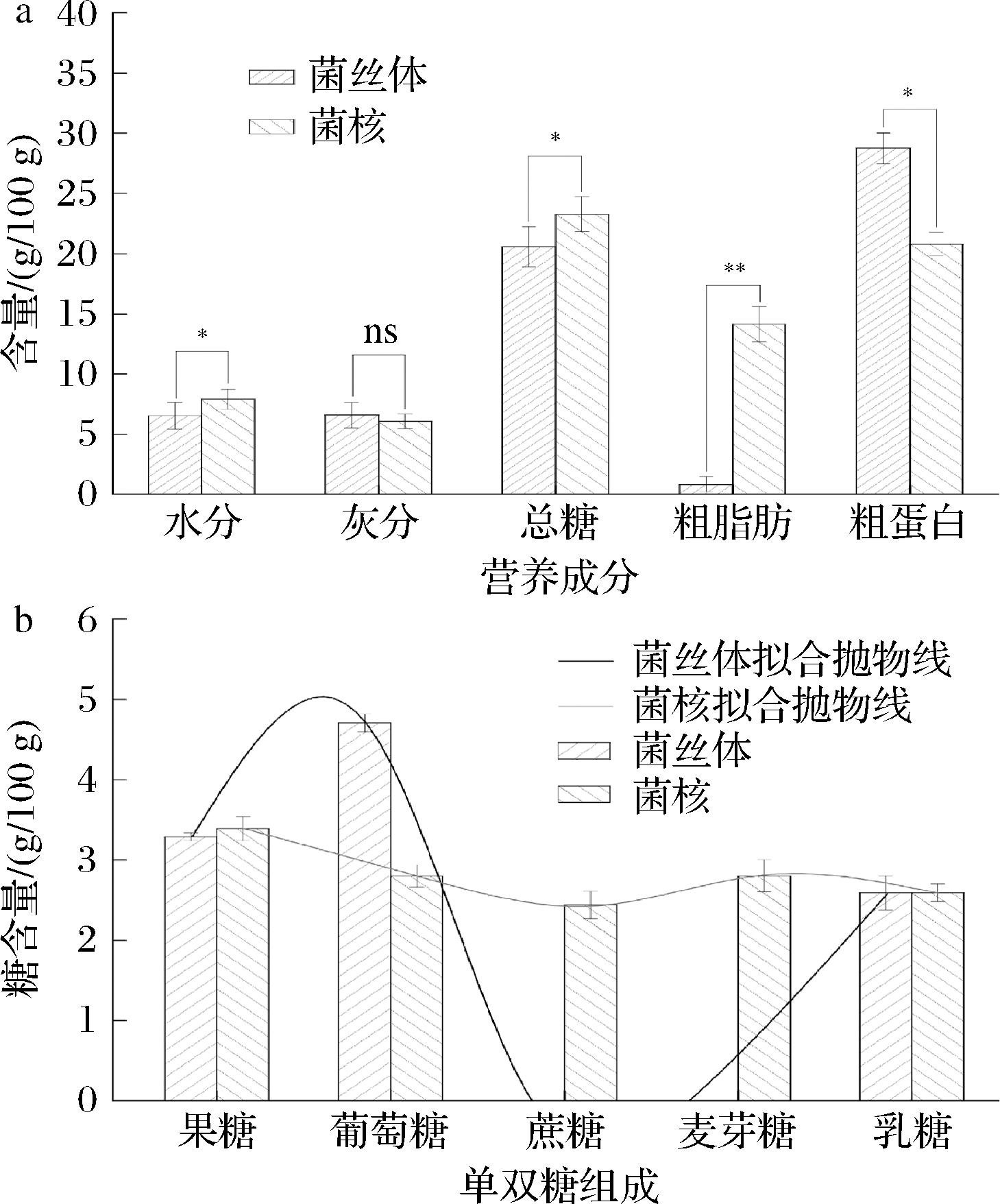
a-营养成分;b-单双糖组成
图1 虎奶菌菌丝体和菌核中主要营养成分
Fig.1 The main nutrients of the mycelium and sclerotia of Pleurotus tuber-rigium
注:*差异显著(P<0.05),**差异极显著(P<0.01),ns表示差异不显著(P>0.05)(下同)。
由表2可知,虎奶菌菌丝体中共检测出2种有机酸,分别为苹果酸1.08 mg/kg和丁二酸30.14 mg/kg,菌核中共检测出4种有机酸,分别为苹果酸1.00 mg/kg、丁二酸11.41 mg/kg、富马酸0.06 mg/kg和己二酸9.30 mg/kg,通过对比研究发现,菌丝体和菌核中都含有苹果酸和丁二酸,菌丝体中丁二酸含量为菌核3倍。丁二酸又名琥珀酸,当存在Na+时能形成琥珀酸钠,琥珀酸及其钠盐均有鲜味,可用于调味料。
表2 虎奶菌菌丝体和菌核中有机酸的含量 单位:mg/kg
Table 2 The contents of organic acids in the mycelium and sclerotia of Pleurotus tuber-rigium
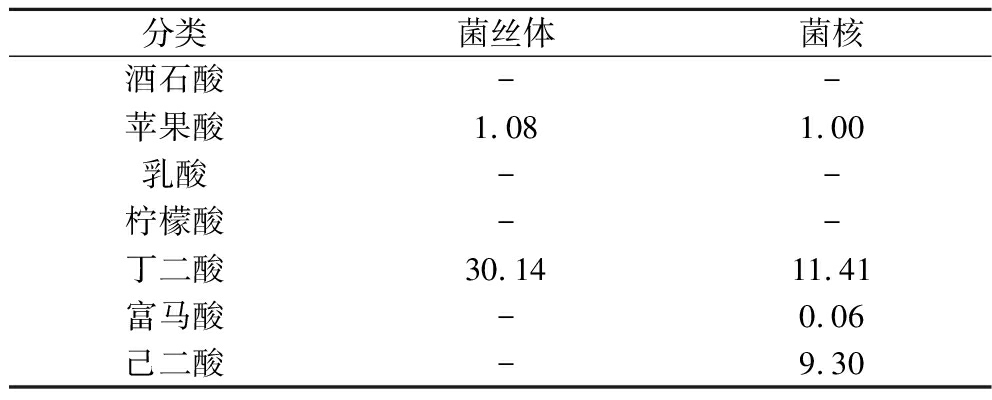
分类菌丝体菌核酒石酸--苹果酸1.081.00乳酸--柠檬酸--丁二酸30.14 11.41富马酸-0.06己二酸-9.30
注:“-”代表未检出(下同)。
维生素C是人体中不可或缺的一种营养成分,当缺乏维生素C时,存在于组织中的胶原质会变得不稳定从而无法发挥其正常功能。通过近些年的研究表明,食用菌中含有丰富的维生素C,所以通过不同的手段及方法探讨定量分析食用菌中维生素C含量具有一定的实用价值。从表3中可以看出在虎奶菌菌丝体与菌核中维生素C含量差异显著(P<0.05),菌核中维生素C含量显著高于菌丝体,其中菌丝体中维生素C总量为64.40 mg/100 g;菌核中维生素C总量为146.52 mg/100 g。
表3 虎奶菌菌丝体和菌核中维生素C的含量 单位:mg/100 g
Table 3 The contents of vitamin C in mycelium and sclerotia of Pleurotus tuber-rigium
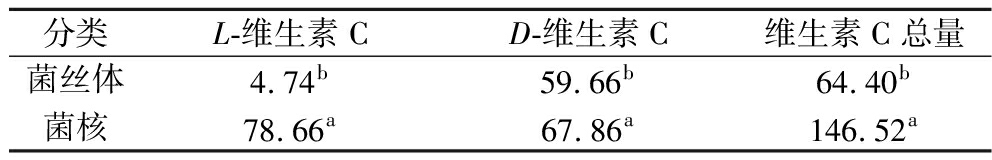
分类L-维生素CD-维生素C维生素C总量菌丝体4.74b59.66b64.40b菌核78.66a67.86a146.52a
注:同列不同小写字母说明差异显著(P<0.05)(下同)。
虎奶菌菌丝体和菌核中氨基酸组成结果如电子版增强出版附表1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.036309),在虎奶菌菌丝体与菌核中均检测出18种氨基酸,菌丝体的总氨基酸(total amino acids,TAA)含量为5.226 9 mg/g,其中必需氨基酸(essential amino-acid,EAA)含量为1.20 mg/g,占总氨基酸的22.95%;菌核的TAA含量为1.667 3 mg/g,EAA含量为0.395 1 mg/g,占总氨基酸的23.69%;菌丝体与菌核的EAA/非必需氨基酸(non-essential amino acid,NEAA)比值分别为29.77%和31.05%。菌丝体与菌核中均含有8种必需氨基酸和10种非必需氨基酸,在菌丝体中苏氨酸含量最高,在菌核中亮氨酸含量最高,与此同时,菌丝体的必需氨基酸和非必需氨基酸总含量均高于菌核。
不饱和脂肪酸与人体生理机能相关,是目前脂肪酸代谢研究的一个重点。研究表明,科学食用和合理摄取脂肪酸起到预防、减轻疾病的作用,脂肪酸是人体健康密切相关,必不可缺少的营养养分之一[18]。由电子版增强出版附表2结果分析可知,虎奶菌菌丝体中共检出11种脂肪酸,其中不饱和脂肪酸为0.137 6 g/100 g,相对含量占总检出量58.61%;饱和脂肪酸为0.097 g/100 g,相对含量占总检出量41.38%。由电子版增强出版附表3结果分析可知,虎奶菌菌核中共检出26种脂肪酸,其中不饱和脂肪酸为2.99 g/100 g,相对含量占总检出量86.20%;饱和脂肪酸为0.479 1 g/100 g,相对含量占总检出量13.80%。通过电子版增强出版附表2和附表3对比分析可知,在虎奶菌菌丝体与菌核中的脂肪酸主要为不饱和脂肪酸,并且在虎奶菌菌核中不饱和脂肪酸含量高于菌丝体。其中在菌丝体中脂肪酸以亚油酸为主,其次为油酸,菌核中主要以亚麻酸为主,其次为亚油酸,油酸和亚油酸是已知的两种对人体有益的长链不饱和脂肪酸。
矿物质元素在人体、动物和植物体内具有重要的作用,是构成骨骼、血红蛋白,维持神经、肌肉正常功能,抵抗疾病、促进生长发育的基础。矿物质元素不能由人体自行合成,通常是来自食物和各种外源性物质中,微量元素在人体生命过程中有着极其重要的作用。由表4可知虎奶菌菌丝体与菌核中矿物质元素较为丰富,含对人体有益的K、Ca、Mg常量元素以及人体必需的Zn、Fe、Mn、Cu、Mo、Se微量元素,在菌丝体中常量元素依次为K、Mg、Ca,微量元素依次为Zn、Fe、Cu、Mo、Se;菌核中常量元素依次为K、Ca、Mg,微量元素依次为Fe、Zn、Cu、Mo、Se。总体而言,K在菌丝体和菌核中含量均最高,分别高达984.6 mg/100 g、1 276.1 mg/100 g,K能够帮助维持人体神经系统的发育,从而使注意力和学习力都有提高。Se的含量最低,分别是0.3 μg/100 g、1.0 μg/100 g。虎奶菌菌丝体和菌核中矿物质元素在含量上呈现差异显著(P<0.05),其中菌丝体中Zn元素显著(P<0.05)高于菌核的元素含量,而其他元素含量菌核均显著(P<0.05)高于菌丝体。
表4 虎奶菌菌丝体和菌核中矿物质元素的含量
Table 4 The contents of mineral elements in the mycelium and sclerotia of Pleurotus tuber-rigium
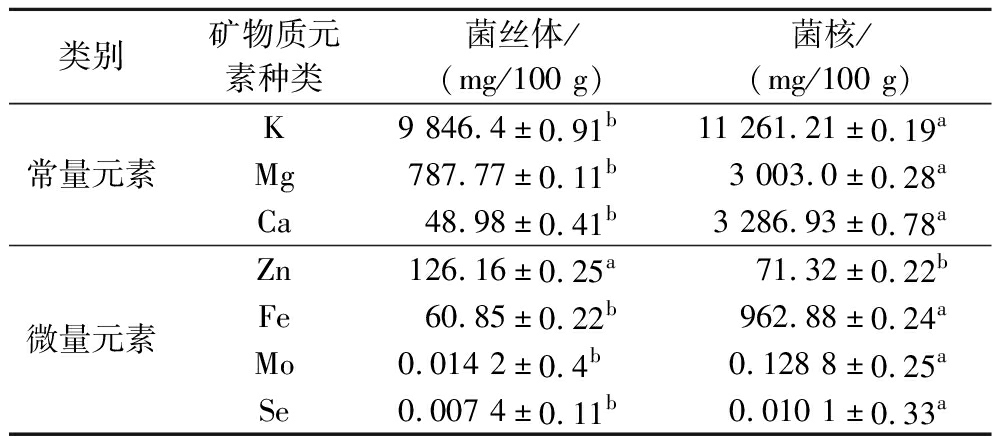
类别矿物质元素种类菌丝体/(mg/100 g)菌核/(mg/100 g)常量元素K9 846.4±0.91b11 261.21±0.19aMg787.77±0.11b3 003.0±0.28aCa48.98±0.41b3 286.93±0.78a微量元素Zn126.16±0.25a71.32±0.22bFe60.85±0.22b962.88±0.24aMo0.014 2±0.4b0.128 8±0.25aSe0.007 4±0.11b0.010 1±0.33a
虎奶菌菌丝体和菌核中均含有多糖、多酚、三萜和黄酮活性成分结果如图2所示,菌丝体中多糖、多酚、三萜、黄酮含量分别为3.23、1.2、1.94、1.12 mg/g;菌核中多糖、多酚、三萜、黄酮含量分别为4.01、1.6、2.55、1.23 mg/g。通过对比研究发现虎奶菌菌核中三萜、多糖、多酚含量显著(P<0.05)高于菌丝体,菌丝体与菌核中黄酮含量差异不显著(P>0.05)。
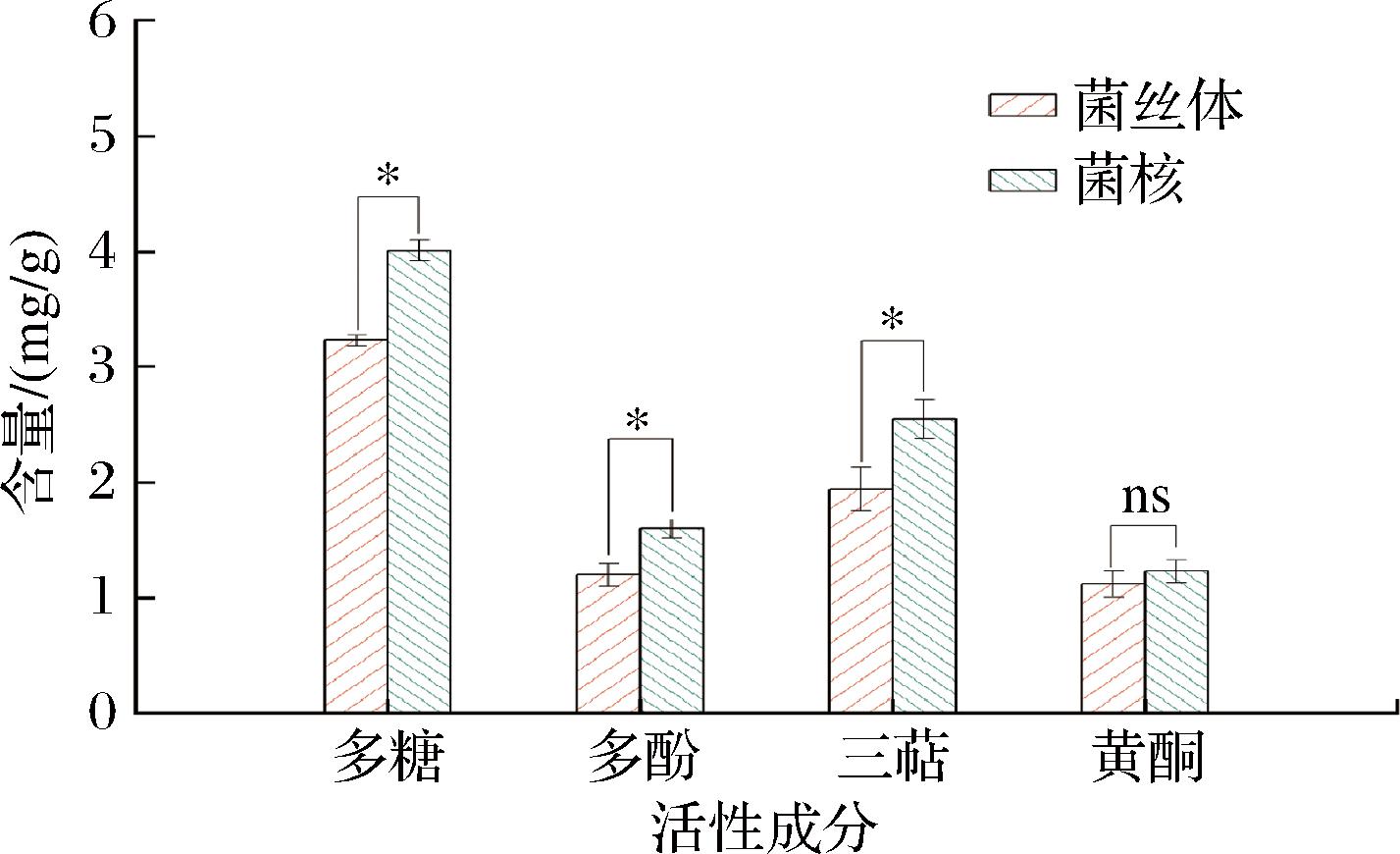
图2 虎奶菌菌丝体与菌核中活性成分的含量
Fig.2 The contents of active ingredients in the mycelium and sclerotia of Pleurotus tuber-rigium
图3是虎奶菌菌丝体GC-MS总离子流图。通过NIST质谱图库鉴定在虎奶菌菌丝体中共检测出32种化合物,其中亚麻酸甲酯(34.08%)、亚油酸(22.04%)、二十烯酸(10.08%)和5-羟甲基二氢呋喃-2酮(5.09%)是相对含量较多的化合物。检测出化合物主要是酸类(37.51%)、酯类(35.77%)、酮类(14.15%),占到了检出总化合物的87.43%。
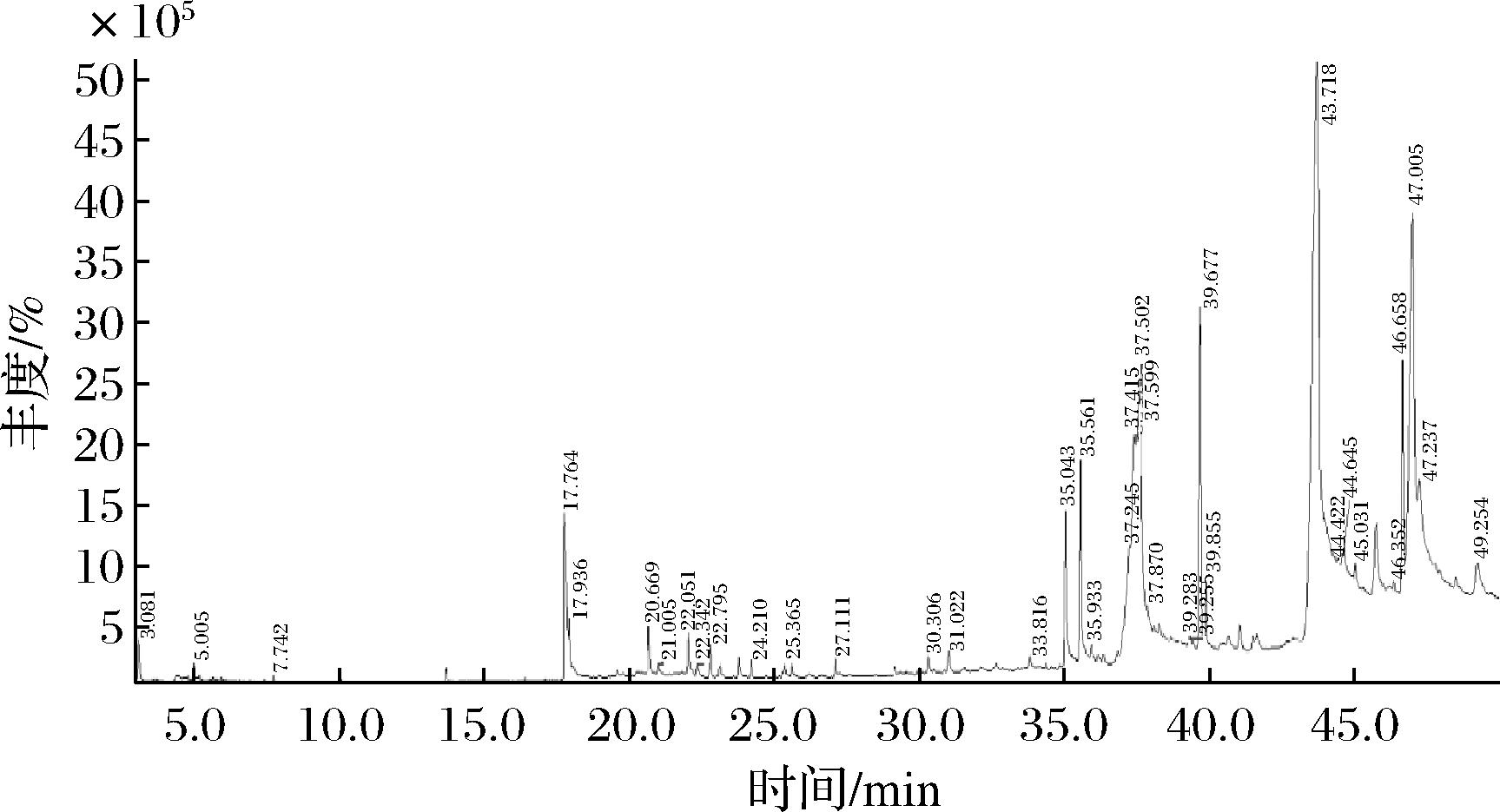
图3 虎奶菌菌丝体GC-MS总离子流图
Fig.3 GC-MS total ion flow diagram of Pleurotus tuber-rigium mycelium
图4是虎奶菌菌核GC-MS总离子流图。通过NIST质谱图库鉴定虎奶菌菌核中共检测出18种化合物,其中亚麻酸(22%)、丙三醇(18.88%)、硬脂酸(10.27%)是相对含量较多的化合物。检测出化合物主要是酸类(52.31%)、醇类(18.88%)、酯类(5.86%)、酮类(5.02%),占到了检出总化合物的82.07%。
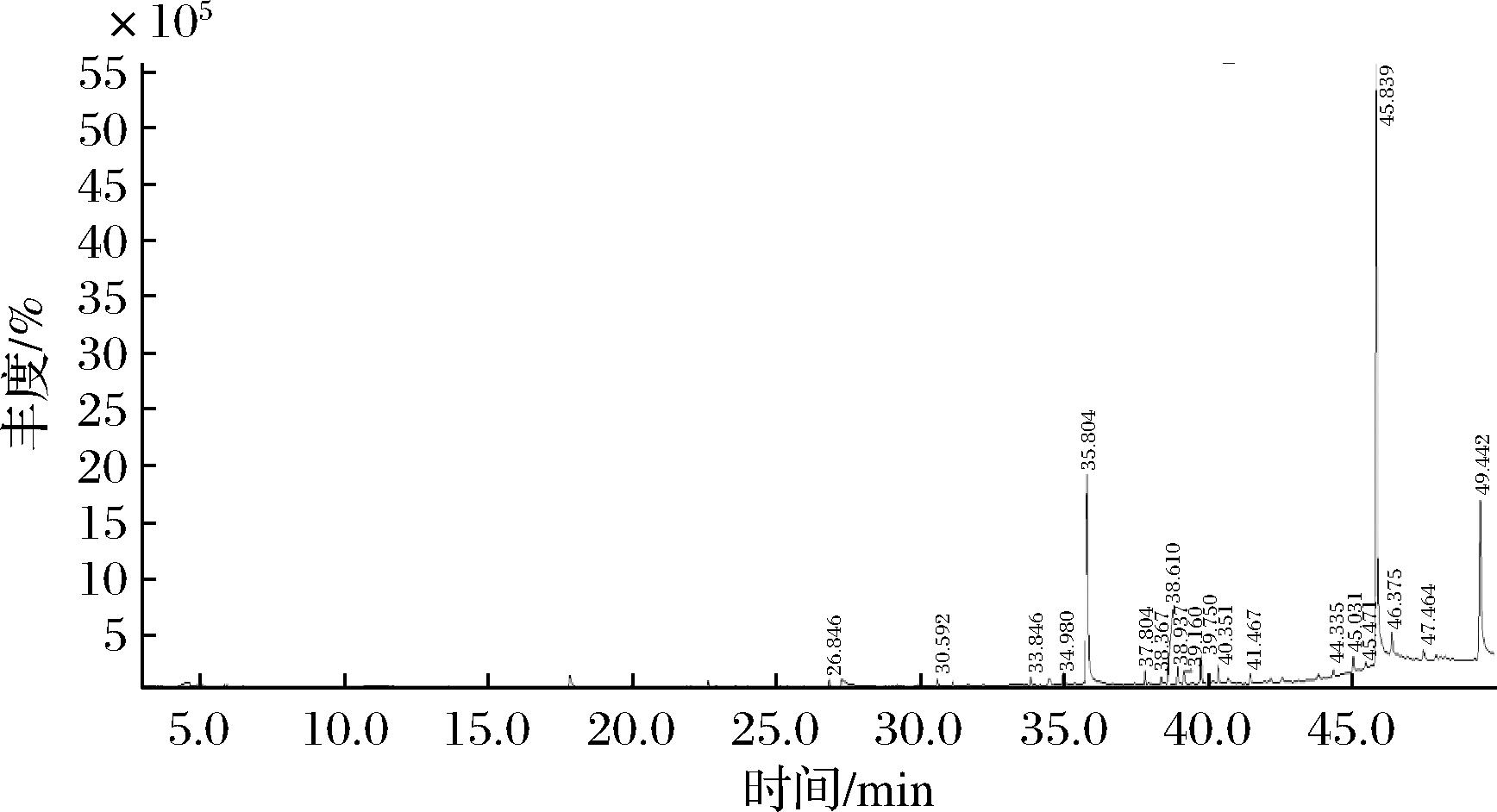
图4 虎奶菌菌核GC-MS总离子流图
Fig.4 GC-MS total ion flow diagram of the nucleus of Pleurotus tuber-rigium sclerotia
由电子版增强出版附表4可知,虎奶菌菌丝体与菌核中共同含有的化合物有5种,分别为亚油酸、亚麻酸、棕榈酸、亚麻酸甲酯、2,3-二氢-3,5二羟基-6-甲基-4(H)-吡喃-4-酮。说明这5种化合物能够在虎奶菌生长的过程中稳定存在,占主导地位。在虎奶菌菌丝体中主要化合物分别为亚麻酸甲酯、亚油酸、二十碳烯酸、5-羟甲基二氢呋喃-2-酮,菌核中主要为亚麻酸、丙三醇、硬脂酸。通过对比发现菌丝体和菌核的化合物均以不饱和脂肪酸为主,高比例的不饱和脂肪酸对维持机体健康具有重要作用[18]。其中菌丝体中亚麻酸甲酯含量最多,其次为亚油酸,菌核中亚麻酸含量最多,这与前期脂肪酸含量结果基本一致。2,3-二氢-3,5二羟基-6-甲基-4(H)-吡喃-4-酮的相对含量在菌丝体中高于菌核,2,3-二氢-3,5二羟基-6-甲基-4(H)-吡喃-4-酮是一种美拉德反应的中间体之一,能够有效调控美拉德反应[19]。与此同时,该化合物具有较强的抗氧化活性,对于宫颈癌的预防和治疗具有潜在的应用价值[20-22]。
虎奶菌菌丝体酯类和酮类化合物的相对含量高于菌核,而酸类和醇类化合物的含量菌核高于菌丝体,且菌丝体中的化合物类别多于菌核。酮类化合物具有保护肾脏、抵抗肺损伤、镇痛消炎的作用[23],酯类化合物能够产生特殊的挥发性香气,例如果香味、烧焦味、香酯味等[24]。醇类化合物能够降低胆固醇的含量,减少心脑血管疾病的发生[25]。
虎奶菌菌丝体和菌核中均具有丰富的营养成分,总糖、粗脂肪、脂肪酸、维生素C含量在菌核中高于菌丝体,而氨基酸、蛋白质含量在菌丝体中高于菌核,菌核中具有较为丰富的有机酸。这表明虎奶菌菌丝体是一种低脂肪、高蛋白质的营养来源。在虎奶菌菌丝体和菌核中同样含有丰富的矿物质元素,K、Mg、Fe、Zn含量均较高,其中菌丝体中Zn的含量高于菌核,研究表明Zn能够帮助儿童智力发育。虎奶菌菌丝体与菌核中均以不饱和脂肪酸占主导地位,且主要为多不饱和脂肪酸,其中菌丝体中以亚油酸为主,其次为油酸,菌核中主要以亚麻酸为主,其次为亚油酸,油酸和亚油酸是2种对人体非常有益的长链不饱和脂肪酸。在虎奶菌菌丝体和菌核活性成分中,多糖、三萜、多酚的含量在菌核中均高于菌丝体,而黄酮含量在菌丝体和菌核中含量基本相同。
虎奶菌菌丝体和菌核中的组分主要由酸类、酯类和酮类化合物构成。菌丝体中主要化合物分别为亚麻酸甲酯、亚油酸、二十碳烯酸、5-羟甲基二氢呋喃-2-酮,菌核中主要为亚麻酸、丙三醇、硬脂酸。通过对比研究发现,菌丝体和菌核中的化合物均以不饱和脂肪酸为主,目前较多的研究结果表明多不饱和脂肪酸具有如降低血脂、抗氧化等多种生物活性。菌丝体和菌核中具有丰富的组成成分,这些成分能够使虎奶菌具有特殊的挥发性香气。
综上,通过本研究发现虎奶菌菌丝体和菌核中均含有丰富的营养成分和活性成分及组成成分。与菌核相比,各成分在菌丝体中具有差异性,但部分成分在菌丝体中与菌核相似甚至更高,这说明虎奶菌液体发酵菌丝体同样具有较高的营养价值和一定开发价值,同时多成分分析检测及差异性比较可为虎奶菌进一步功能食品的开发提供参考依据。
[1] 葛梦蝶. 虎奶菇菌丝体超支化多糖合成及影响因素的研究[D].无锡:江南大学, 2020.
GE M D.Study on the biosynthesis and affecting factors of hyperbranched polysaccharide from Pleurotus tuber-regium mycelium[D].Wuxi:Jiangnan University, 2020.
[2] OKHUOYA J A, ETUGO J E.Studies of the cultivation of Pleurotus tuberregium (Fr) sing.An edible mushroom[J].Bioresource Technology, 1993, 44(1):1-3.
[3] 曾小龙, 胡高蒙.虎奶菇的化学成分与药理作用研究[J].中国食用菌, 2007, 26(5):3-7.
ZENG X L, HU G M.Research on chemical elements and medical effects of Pleurotus tuber-regium(Fr.) sing[J].Edible Fungi of China, 2007, 26(5):3-7.
[4] 王利, 王峰.深层发酵培养虎奶菇多糖的培养基优化[J].安徽农业科学, 2014, 42(1):67-69;82.
WANG L, WANG F.Optimization of submerged fermentation conditions for intracellular polysaccharide of Pleurotus tuber-regium[J].Journal of Anhui Agricultural Sciences, 2014, 42(1):67-69;82.
[5] LIN S L, WANG P X, LAM K L, et al.Research on a specialty mushroom (Pleurotus tuber-regium) as a functional food:Chemical composition and biological activities[J].Journal of Agricultural and Food Chemistry, 2020, 68(35):9277-9286.
[6] APETORGBOR A, DZOMEKU M, APETORGBOR M.Growth factors and cultivation of Pleurotus tuber-regium on selected plant wastes[J].International Food Research Journal, 2013, 20:3387-3393.
[7] OSO B A.Pleurotus tuber-regium from Nigeria[J].Mycologia, 1977, 69(2):271-279.
[8] MOON B, LO Y M.Conventional and novel applications of edible mushrooms in today’s food industry[J].Journal of Food Processing and Preservation, 2014, 38(5):2146-2153.
[9] 魏云辉, 包水明, 方金山, 等.临川虎奶菇0121栽培试验初报[J].食用菌, 2016, 38(4):37-38;42.
WEI Y H, BAO S M, FANG J S, et al.Preliminary report on cultivation experiment of Linchuan Pleurotus ostreatus 0121[J].Edible Fungi, 2016, 38(4):37-38;42.
[10] CHEUNG P C K, LEE M Y.Comparative chemical analysis of fiber material prepared by enzymatic and chemical methods from two mushrooms (Pleurotus sajor-caju and Pleurotustuber-regium)[J].Journal of Agricultural and Food Chemistry, 1998, 46(12):4854-4857.
[11] CHENGHUA D, XIANGLIANG Y, XIAOMAN G, et al.A β-D-glucan from the sclerotia of Pleurotus tuber-regium (Fr.) sing[J].Carbohydrate Research, 2000, 328(4):629-633.
[12] 莫翠园, 盛丽, 刘若凡, 等.虎奶菇多糖提取工艺优化、结构鉴定及抗氧化活性研究[J].食品科技, 2022, 47(9):156-163.
MO C Y, SHENG L, LIU R F, et al.Extraction process optimization, structure identification and antioxidant activity of Pleurotus tuber-regium polysaccharide[J].Food Science and Technology, 2022, 47(9):156-163.
[13] 张鹏. 虎奶菇菌核多糖的分离纯化、结构表征和生物活性研究[D].西安:陕西师范大学, 2013.
ZHANG P.Isolation, purification and structure characterization and biological activity of the polysaccharides from Pleurotus tuber-regium(Fr.)sing sclerotium[D].Xi’an:Shaanxi Normal University, 2013.
[14] 刘春辉. 虎奶菇发酵特性及菌丝体、菌核多糖的纯化和部分特性研究[D].福州:福建师范大学, 2006.
LIU C H.Submerged fermentation of mycelia, purification and characterization of polysaccharides from mycelia and sclerotia of Pleurotus tuber-regium[D].Fuzhou:Fujian Normal University, 2006.
[15] 叶玉洁, 石光, 周正乙, 等.桑黄菌丝体与子实体成分的比较分析[J].食品科学, 2019, 40(24):246-251.
YE Y J, SHI G, ZHOU Z Y, et al.Comparative chemical composition of mycelium and fruit body of Phellinus igniarius[J].Food Science, 2019, 40(24):246-251.
[16] 周鹏程, 张黎明, 崔燕, 等.红缘拟层孔菌子实体和发酵菌丝体营养成分比较分析[J].食品科学, 2021, 42(24):159-165.
ZHOU P C, ZHANG L M, CUI Y, et al.Comparative analysis of nutrients in fruiting bodies and cultured mycelia of Fomitopsis pinicola[J].Food Science, 2021, 42(24):159-165.
[17] MARSOUL A, IJJAALI M, OUMOUS I, et al.Determination of polyphenol contents in Papaver rhoeas L.flowers extracts (soxhlet, maceration), antioxidant and antibacterial evaluation[J].Materials Today:Proceedings, 2020, 31:S183-S189.
[18] LOPEZ-JIMENEZ F, XU L, EDENS K L.Improvement of metabolic syndrome with low refined carbohydrates, relatively high protein diet enriched with mono-and poly-unsaturated fatty acids[J].Journal of the American College of Cardiology, 2010, 55(10):A58.E550.
[19] 白冰, 何静, 杨静, 等.美拉德反应中间体二氢-3,5-二羟基-6-甲基-4(H)吡喃-4-酮的研究进展[J].食品与发酵工业, 2024,50(5):326-333.
BAI B, HE J, YANG J, et al Advances in the research of Maillard intermediate 2,3-dihydro-3,5-dihydroxy-6-methyl-4H-pyran-4-one[J].Food and Fermentation Industries, 2024,50(5):326-333.
[20] ALI M R, YONG M J, GYAWALI R, et al.Mango (Mangifera indica L.) peel extracts inhibit proliferation of HeLa human cervical carcinoma cell via induction of apoptosis[J].Journal of the Korean Society for Applied Biological Chemistry, 2012, 55(3):397-405.
[21] PADMASHREE M S, ASHWATHANARAYANA R, NAIKA R, et al.Antioxidant, cytotoxic and nutritive properties of Ipomoea staphylina Roem &Schult.plant extracts with preliminary phytochemical and GCMS analysis[J].Asian Journal of Pharmacy and Pharmacology, 2018, 4(4):473-492.
[22] SAKAMOTO T, LI Z S, NISHIDA A, et al.Identification of major antioxidant compounds from the edible mushroom Basidiomycetes-x (echigoshirayukidake)[J].Frontiers in Bioscience (Elite Edition), 2022, 14(2):10.
[23] 任越, 霍梦琪, 马婧, 等.基于系统中药学的丹参组分功效研究[J].中国中药杂志, 2020, 45(14):3251-3258.
REN Y, HUO M Q, MA J, et al.Study on components efficacy of Salviae Miltiorrhizae Radix et Rhizoma based on systematic traditional Chinese medicine[J].China Journal of Chinese Materia Medica, 2020, 45(14):3251-3258.
[24] G MEZ-M
MEZ-M GUEZ M J, CACHO J F, FERREIRA V, et al.Volatile components of Zalema white wines[J].Food Chemistry, 2007, 100(4):1464-1473.
GUEZ M J, CACHO J F, FERREIRA V, et al.Volatile components of Zalema white wines[J].Food Chemistry, 2007, 100(4):1464-1473.
[25] MONTSERRAT-DE LA PAZ S, GARC A-GIMÉNEZ M D,
A-GIMÉNEZ M D,  NGEL-MART
NGEL-MART N M, et al.Long-chain fatty alcohols from evening primrose oil inhibit the inflammatory response in murine peritoneal macrophages[J].Journal of Ethnopharmacology, 2014, 151(1):131-136.
N M, et al.Long-chain fatty alcohols from evening primrose oil inhibit the inflammatory response in murine peritoneal macrophages[J].Journal of Ethnopharmacology, 2014, 151(1):131-136.