
图1 酒精在人体内的代谢流程图
Fig.1 Metabolic flow chart of alcohol in human body
我国是世界酒精饮料的生产和消费大国。据中国酒业协会统计,2021年我国酿酒行业规模以上企业累计完成产品销售收入8 686.7亿元,进口酒总额达到54.9亿美元(约合人民币347亿元),加上规模以下酒企的产品销售收入,从零售端预估,中国酒水消费市场规模至少为万亿元。尽管这是一个巨大的经济机会,但随之而来的健康风险也在增加,并对医疗保健系统造成负担。在全球范围内,大约有20亿人饮用酒精饮料,其日益增长的消费和相关的健康风险是世界卫生组织非常关注的问题[1]。
酒精在进入人体后会被迅速吸收,并聚集于血液和各组织中(尤其是脑组织,其酒精浓度是血液的约10倍),仅有极少量酒精能够直接排出体外,大部分仍然需要通过肝脏代谢[2-3]。酒精作为一种非特异性的中枢神经抑制剂,会造成中枢神经系统的兴奋和抑制,从而改变饮酒者的行为。当饮酒者饮入少量酒精时,会刺激饮酒者产生愉悦感;但随着酒精摄入量的增大,饮酒者的思维会变得迟钝,无法控制自己的身体。长期饮酒会诱发多种疾病,因此探索减轻酒精损伤的生物学机制和途径是必要的。
本文围绕酒精在人体吸收、转运、排泄和分解的具体过程,分析了酒精在机体引起的主要损伤以及减轻酒精伤害的作用机理,综述了各类有减少酒精损伤同时加速醒酒作用的活性物质。此外,对目前研究者使用频率较多的酒精代谢动物模型进行了介绍,包括模式动物的选择、造模方法的优化、动物行为学的研究以及早期生物标志物的识别等。本项工作旨在理解酒精介导相关疾病发生和发展的作用机制和风险因素的基础上,为新型低醉酒、低损伤、代谢快的解酒保肝类产品开发提供新思路。
乙醇分子质量小,同时具备亲水性和亲脂性,被人体摄入后可快速通过简单扩散和易化扩散两种方式顺着浓度梯度直接穿过细胞膜进入血液系统,这是一种被动扩散过程,不需要消耗能量,只要膜两侧存在浓度差就可以持续进行下去[4]。因此,酒精饮料在口腔的短暂停留即可突破口腔黏膜表面被微量吸收快速进入血液。此外,胃黏膜会进一步吸收10%~20%的酒精,其余绝大部分被胃液稀释到体积分数5%左右的酒精浓度,然后进入小肠被快速吸收。乙醇分子主要通过门静脉转运至肝脏,并通过肝静脉到达心脏,然后进入肺部,再返回心脏,最后被泵入整个体循环。肝脏是负责代谢摄入酒精的主要器官,超过90%酒精经过肝脏氧化代谢后排出,少量是在肝外组织(如大脑等)通过细胞色素P450和过氧化氢酶(catalase,CAT)代谢,剩余小部分不被吸收直接经肾以尿液排出、经肺从呼吸道呼出或经皮肤汗腺蒸发排出[5]。
酒精在体内的代谢分为氧化途径和非氧化途径(图1)。氧化途径是酒精代谢的主要方式,依赖于以下3种酶系:①细胞质中乙醇脱氢酶(alcohol dehydrogenase,ADH);②内质网中微粒体乙醇氧化系统(microsomal ethanol oxidizing system,MEOS);③过氧化物酶体中CAT。3条氧化途径主要区别在于参与乙醇氧化成乙醛的酶不同,而之后乙醛氧化为乙酸的过程是相同的[6]。ADH由多种同工酶组成,是肝脏中催化酒精氧化代谢的主要酶系,大约80%的乙醇通过此途径转化为乙醛,然后在乙醛脱氢酶(aldehyde dehydrogenase,ALDH)作用下进一步氧化为乙酸,活化成乙酰辅酶A,进入三羧酸循环氧化分解为CO2和H2O排出体外,并释放大量能量[7]。MEOS主要包含细胞色素P450同工酶CYP2E1、CYP1A2和CYP3A4,其Km值(米氏常数)明显高于I型ADH酶系[8],因此MEOS途径通常在高血液酒精浓度(blood alcohol concentration,BAC)和长期慢性饮酒(几周或几个月)时发挥有效作用[9]。CAT通路是乙醇氧化的另一个辅助途径,能够在H2O2生成系统存在的情况下介导酒精代谢,是大脑中乙醇氧化代谢的核心途径,同时在重度酒精消费者中发挥重要作用[6, 10]。非氧化途径是酒精代谢的次要方式,依赖于2种酯化酶:①脂肪酸乙酯合酶;②磷脂酶D。2条非氧化途径的区别在于前者催化乙醇与脂肪酸作用形成脂肪酸乙酯,后者催化乙醇与磷脂酰胆碱作用生成磷脂酰乙醇[11]。整体来讲,酒精代谢的氧化和非氧化途径是相互关联的,抑制ADH、MEOS和CAT降低酒精的氧化代谢会导致酒精的非氧化代谢增加以及肝脏和胰腺中脂肪酸乙酯增加。酒精代谢主要受环境因素(如饮食情况、酒精浓度、饮酒量等)和个体差异(如性别、年龄、遗传、种族、烟酒嗜好、营养状况等)影响[12]。

图1 酒精在人体内的代谢流程图
Fig.1 Metabolic flow chart of alcohol in human body
研究显示,酒精及其氧化代谢产生的乙醛和自由基等中间产物是影响人体健康的主要风险因子,它们以多种方式协同诱导细胞和组织损伤[6,12]。酒精非氧化代谢途径占比很少,非氧化代谢产物引起组织损伤的潜在病理和诊断相关性还需要进一步评估[6]。
酒精在胃中停留时以浓度依赖性方式诱导胃上皮细胞快速死亡,激活坏死性凋亡途径中关键介质的磷酸化[13],通过激活胃黏膜肥大细胞,使其释放组胺、血小板激活因子、白三烯、内皮素及各种超氧化物[14]。这些物质可通过增加胃黏膜的通透性使胃黏膜屏障受损,导致胃黏膜损伤。此外,慢性酒精暴露导致腺泡细胞的消化酶和溶酶体酶水平显著升高,与此同时含有这些酶的细胞器稳定性下降。这些变化增加了消化酶和溶酶体酶之间接触的可能性。在适当触发因子存在的情况下,可过早激活细胞内的消化酶,从而导致胰腺炎[15]。
乙醛作为乙醇的中间代谢产物已被国际癌症研究机构(International Agency for Research on Cancer,IARC)列为人类I类致癌物质。乙醛可使肝细胞内线粒体受损,分解脂肪酸的功能下降,伴随饮酒时进食的过量脂类物质,造成脂肪在肝细胞内蓄积,引起肝细胞脂肪变性,严重时会发生脂肪肝。乙醛还可与蛋白质结合形成乙醛复合体,使内质网中的蛋白质发生错误折叠,引起内质网应激,导致蛋白质功能紊乱[16]。此外,乙醛的积累会进一步导致心律失常、恶心、焦虑和面部潮红等体征,刺激纤维生成和诱导免疫应答,使得肝细胞再度受损[17]。研究证明,乙醛对脑神经组织和胰腺腺泡细胞具有直接毒性[18]。乙醛代谢时所需的酶类是脑内正常氨类神经介质合成时所需的酶,因而乙醛代谢竞争性地抑制了脑内正常神经介质的形成。因此,饮酒过量引起的酒精性昏迷实际上是一种兴奋性神经介质被抑制的现象。长期过量饮酒会导致大脑神经结构(如大脑皮层、海马体和小脑)发生持久性或不可逆性改变,包括因神经元丢失而造成的皮质和白质萎缩、脑室扩大、树突和突触等部位的神经递质和受体数量改变等,这些变化将导致酒精性精神障碍、大脑萎缩、智力减退等现象[19]。
乙醇代谢为乙醛的过程中通过CYP2E1产生许多活性氧(reactive oxygen species,ROS),例如乙氧基自由基、羟乙基自由基、超氧自由基、H2O2、羟基自由基和过氧自由基等[20]。部分在胃中代谢产生的自由基自身会直接损伤胃黏膜毛细血管内皮细胞,还可促使巨噬细胞和多核白细胞吸附在内皮细胞表面,引起血浆渗出和出血,造成胃黏膜损伤[21]。肝组织内的自由基能直接与乙醇结合生成羟乙基自由基,羟乙基自由基可攻击甲硫氨酸和半胱氨酸等含硫氨基酸,引起蛋白质结构改变从而影响其功能,最终导致肝脏部分代谢酶系活性降低以及功能性糖蛋白失效[22]。此外,羟乙基自由基也能竞争性结合谷胱甘肽形成稳定的络合物,从而降低肝脏对自由基和氧化应激的自我防御能力[23]。过量累积的自由基也会导致肝脏脂质过氧化,破坏肝细胞通透性,引起肝细胞的病变和凋亡[17]。
1.3.1 通过加强乙醇在胃肠道的首过消除(first pass metabolism,FPM)减少酒精在肝脏的含量
胃肠道黏膜中存在多种ADH,比如ADH7,该酶参与酒精的代谢,反应与肝脏中类似[24],所以酒精入口后,少部分会在尚未被吸收进入血液循环之前经消化道在胃内被氧化代谢,这一现象被称为乙醇的FPM[25]。FPM可以减少进入血液循环的酒精量,同时酒精在胃中的吸收速度明显比在小肠中慢,可以一定程度上减少有害物质如乙醛的堆积。因此,任何能够增加胃中酒精滞留时间和增加ADH7活性的食物都能够在降低酒精吸收量的同时增加酒精在肝外的代谢,从而减少对肝脏的损伤[26]。
在饱腹状态下,将胃和小肠分开的幽门括约肌会关闭,相比于空腹喝酒,只有1/4左右的酒精会进入肝脏。因此,在喝酒前摄入一些食物能够增加酒精在胃中的滞留时间和代谢,减少在肝脏中的代谢。另外,还可以通过抑制消化道对乙醇的吸收,加强乙醇在胃肠道的FPM,减少进入肝脏的酒精含量。长时间摄入乙醇会导致胃肠道组织中ADH活性下降,因此提高机体胃组织中ADH活性可以减少机体对乙醇的生物利用度,加强FPM,缓解乙醇对肝脏和大脑等重要组织器官的毒害作用[27]。
1.3.2 通过与酒精代谢过程中产生的醛类结合而减少对肝脏的损伤
某些物质(如一些小肽)可以在乙醛与细胞蛋白质结合之前优先与乙醛发生反应,减少因乙醛与细胞蛋白质结合而导致的蛋白质功能紊乱和诱导免疫应答,从而减少器官和组织损伤[28]。此外,肝脏中ADH和ALDH活力水平是人体乙醇代谢的关键。提高其活性可加速乙醇在体内的代谢,降低中间代谢产物产生的细胞毒性,减轻乙醇对肝的毒性[29]。
1.3.3 通过提高体内多种抗氧化酶含量来清除酒精代谢产生的过剩自由基
人体内抗氧化酶主要分为三大类:超氧化物歧化酶(superoxide dismutase,SOD)、CAT和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)。SOD是生物体内最重要的自由基清除剂,可以维持机体代谢平衡,其主要作用途径是催化超氧阴离子自由基歧化为H2O2和O2,减少细胞损伤[30]。CAT本质为一类氧化还原酶,具有强烈的抗氧化性,可增强机体对H2O2的抑制,使其快速分解,减少有害物质丙二醛的含量[31]。同时,CAT还可作为ROS清除剂,减少肠黏膜ROS数量,调控肠道健康[32]。GPx是体内主要的硒蛋白,有助于控制炎症部位自由基的过度产生,维持细胞内氧化还原状态,并表现出抗氧化活性[33]。有研究表明,当小鼠肝脏中的硒依赖型谷胱甘肽过氧化物酶(selenium-dependent glutathione peroxidase,Se-GPx)活性增加时,抗氧化系统减轻损伤的能力随后增强[34]。
目前治疗酒精性肝病研究最多的是天然活性成分,主要包括:动植物中提取的多肽、植物中的有效活性成分和中草药提取物等。
1997年,YAMAGUCHI等[35]首次报道了玉米肽在加速酒精代谢和预防酒精性肝损伤方面的能力。经多项实验发现,玉米肽可能主要通过激活酒代谢相关酶系、为酒精代谢提供充足的NAD+和竞争性与乙醛结合3种途径共同起作用。①激活乙醇代谢相关酶系:将玉米肽分别应用于原发性高血压大鼠和肥胖病人中,发现两者血液中乙醇及其氧化产物乙醛的含量明显降低(P<0.01),说明玉米肽可以通过激活ADH活性而促进酒精代谢,进而拮抗酒精对肝脏的损伤。其机理可能是玉米肽诱导ADH的三级或四级结构发生变化,使ADH能迅速适应底物的进入以促进乙醇与ADH活性位点的结合,从而加速酒精代谢[28]。②为乙醇代谢提供充足的NAD+:与其他寡肽(小麦肽和豌豆肽)相比,玉米肽的摄入使血液中丙氨酸和亮氨酸含量显著升高(P<0.01),为乙醇氧化过程提供充足的NAD+。③竞争性与乙醛结合:玉米肽的分子质量小于细胞蛋白的分子质量,并且玉米肽中游离氨基比细胞蛋白多。因此,另一个可能的原因是玉米肽竞争性结合乙醇代谢产生的醛,从而减少乙醛与细胞蛋白的结合,起到保护肝脏的作用。此外,从其他植物中提取的多肽,如鹰嘴豆肽[36]、核桃肽[37]和越南油茶肽[38]等也具有一定程度上减少酒精损伤,促进醒酒的作用。与植物相比,动物的蛋白质含量更高,更易通过水解来获得具有不同活性的多肽,如鸡肉肽[39]、蛤蜊肽[40]和东海乌参肽[41]等都被证明有醒酒护肝的效果。
葛根具有明确的解酒保肝效果,也是目前解酒保肝研究最多的药材[42]。葛根中主要起作用的物质是异黄酮,包括葛根素和大豆苷元[43]。葛根进入人体后,可使乙醇代谢中起主要作用的ADH活性升高[44]。另有研究表明,葛根素和大豆苷元通过抑制消化道对乙醇的吸收延迟胃排空,加强了乙醇在胃肠道的FPM,降低血液乙醇浓度,从而延长醉酒小鼠的醉酒潜伏期,并缩短醒酒时间[45]。并且大豆苷元不仅具有分解乙醛的功能,还有减弱酒精对大脑抑制的功能[46]。其他一些活性成分(如魔芋葡甘聚糖[47]、香芹酚[48]和叶黄素[49]等)也表现出缓解酒精肝损伤和加速醒酒的功能。
有些草药提取物可以缓解常见的醉酒症状,如茯苓、柑橘、枸杞、人参和水飞蓟等[12]。杜仲草提取物显示出清除自由基、抗宿醉特性和保护肝脏的作用,可能是因为其含有杂多糖、鼠李糖、阿拉伯糖、半乳糖[50];一些植物配方通过使用富含多糖的混合物来减少碳水化合物的消耗,如刺五加提取物对酒精诱导的低血糖和炎症反应有抑制作用[51];青蒿素是一种从黄花蒿提取物中得到的半合成药物,已证明对肝损伤和慢性酒精中毒具有保护作用,它可以抑制坏死因子的激活和炎症细胞因子的表达[52]。
目前微生物及其代谢产物疗法也是改善酒精性肝损伤的热门方案,包括益生菌、益生元、合生元及后生元等。它们的使用能不同程度改善有益微生物菌群数量、调节肠道菌群比例、增强肠道黏膜完整性和抑制有害微生物产生酒精等,从而发挥保肠护肝的作用[53]。研究表明,使用艾克曼嗜黏蛋白菌(Akkermansia muciniphila)和鼠李糖乳酸杆菌GG株(Lactobacillus rhamnosus GG)能提高肠道屏障功能,降低炎症反应,改善酒精性肝损伤[54]。两歧双歧杆菌(Bifidobacterium bifidum)和植物乳杆菌8PA3(Lactobacillus plantarum 8PA3)治疗也可以改善患者肝损伤水平[55]。春港乳球菌(Lactococcus chungangensis)是乳制品中常用的发酵剂,与其他乳球菌相比,用春港乳球菌CAU 28T生产的奶油奶酪样品显示出最高的ALDH活性,并且能降低小鼠血清中的乙醛水平[56]。
多项研究表明,烟酸和锌在酒精代谢中起重要作用[57]。研究人员分析了23名参加自然宿醉研究的健康饮酒者的数据,发现饮食中摄入的烟酸和锌含量与宿醉程度呈负相关,即饮酒者摄入较高的烟酸和锌,其严重宿醉的程度明显较轻[58]。在探讨维生素D缺乏与酒精性肝病的相关性实验中发现维生素D缺乏和不足的群体发生酒精性肝炎和酒精性肝硬化的例数明显增加[59]。也有文献报道显示口服维生素B6显著减少了宿醉症状的数量[60]。
有研究发现,各种矿物质,包括硒、锌、铜、钒、铁和镁,可能对酒精代谢和谷氨酸活性有直接影响,或者可能通过其抗氧化和抗炎特性影响酒精宿醉的严重程度[61]。
目前,实验室中经常使用的动物物种(模式生物)包括:啮齿动物(小鼠和大鼠)、斑马鱼、猪、恒河猴、豚鼠等。最常用的是啮齿类动物模型,小鼠不同的品系有很大差异,比如C57BL/6J小鼠就因为其高度嗜酒的天性而常被用于酒精成瘾的相关研究[62]。Wistar大鼠具备繁殖快、易饲养等特点,也常用于酒精饮用动物造模研究。斑马鱼是一种小型(3~4 cm长)淡水硬骨鱼,与人类基因同源性高达87%。斑马鱼多用于饮酒后行为学观察,使用计算机化的视频跟踪可以分析斑马鱼的游泳路径、游泳速度以及游泳姿势等[63]。但是由于斑马鱼体型较小,不易解剖,血量较少,因而测量其醉酒相关理化指标有一定难度。此外,猪、比格犬、猴子等大型动物虽然可以实现连续取血,但是在实验室饲养有一定难度且造价成本较高。
常用啮齿类酒精饮用动物模型的造模方法有酒精流质食物暴露模型、酒精灌胃模型、单瓶强制饮酒实验模型和双瓶自由选择实验模型等。酒精流质食物暴露模型是把包含一定酒精成分的流质饲料作为动物的唯一食物,可造成较好的酒精摄入水平,使大鼠达到低至中度的BAC水平[64]。该模型的优点是操作简单,流质饲料既可自主饮用又可灌胃,缺点是不能保证动物达到醉酒状态且BAC难以维持稳定[65]。酒精灌胃模型是指采用灌胃针通过食管将酒精灌入动物胃中[66]。该模型优点是可以精确控制给予动物的酒精剂量和达到的BAC,缺点是构建方法具有侵入性,且打破了动物饮酒的自主性[67]。单瓶强制饮酒实验是仅允许动物饮用单一酒精溶液,旨在通过禁水而促进动物对酒精的摄入,但因其不能模拟人类饮酒的自主选择性,制约了其在酒精成瘾及相关中枢机制研究中的应用[68]。双瓶自由选择实验是目前国际最常用的自主酒精饮用动物模型,实验中同时给予动物酒精溶液和水。与单瓶强制饮酒实验相比,双瓶自由选择实验能更好地模拟人类饮酒习惯[69]。斑马鱼等鱼类模型采用的是将酒精稀释为一定度数的养鱼水,通过酒精暴露实施给药。实验证明斑马鱼在低浓度酒精(≤1%,体积分数,下同)暴露下呈现兴奋状态,表现为游动速度加快、在鱼缸上层游动频率增多和与同伴互动次数增加等;而在高浓度酒精(≥1.5%)暴露下呈现抑制活动的状态,表现为游动速度减慢甚至静止、在鱼缸下层游动频率增多和与同伴互动次数减少等[70]。猪、比格犬、猴子等大型动物一般采用灌胃、和水混合饮用以及混合在食物中进食等方法[71]。此外,调查总结了近10年酒精损伤相关动物模型的优缺点以及相关应用,如表1所示。
表1 近10年酒精代谢相关动物模型
Table 1 Animal models related to alcohol metabolism in recent decade
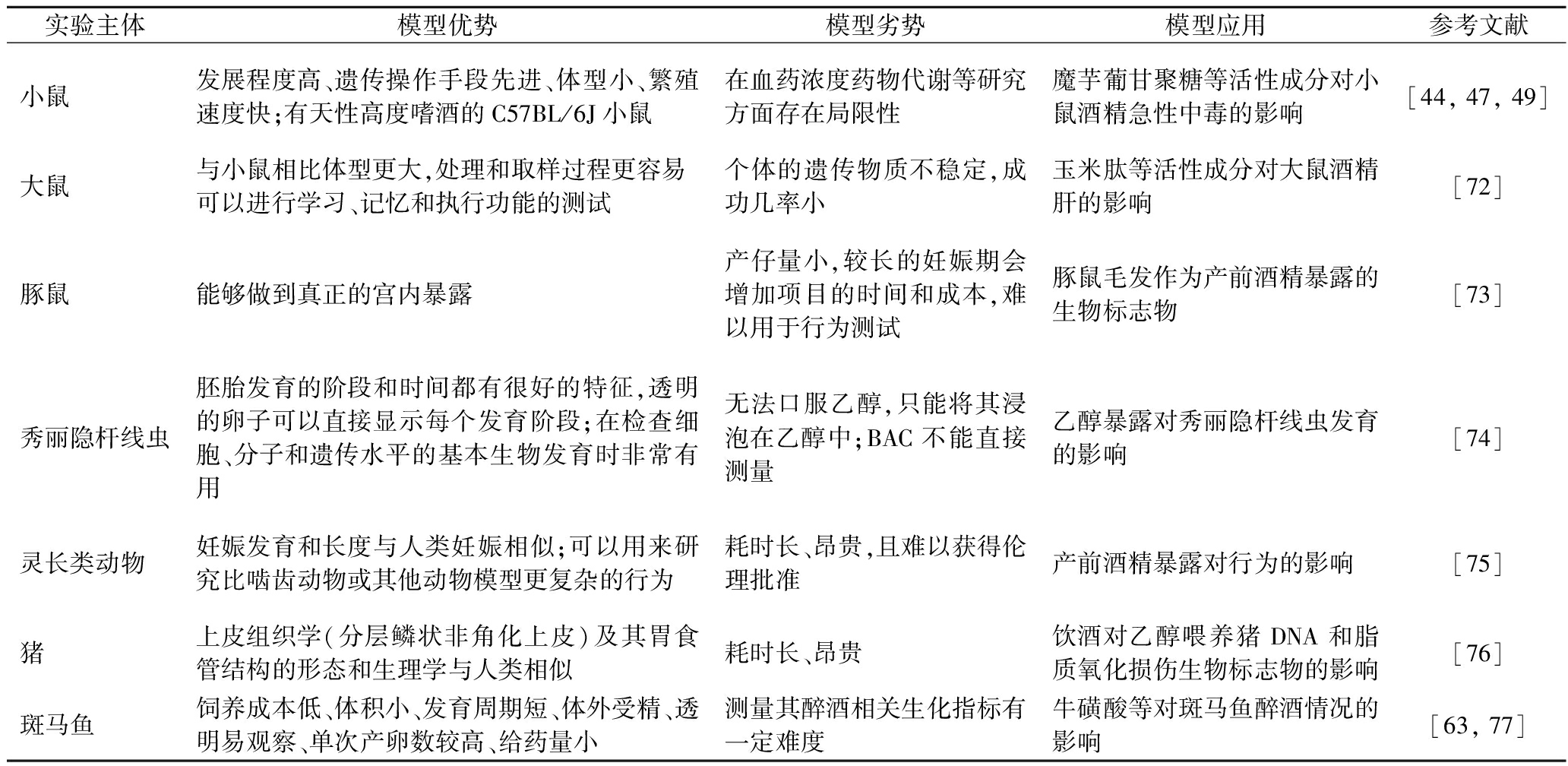
实验主体模型优势模型劣势模型应用参考文献小鼠发展程度高、遗传操作手段先进、体型小、繁殖速度快;有天性高度嗜酒的C57BL/6J小鼠在血药浓度药物代谢等研究方面存在局限性魔芋葡甘聚糖等活性成分对小鼠酒精急性中毒的影响[44, 47, 49]大鼠与小鼠相比体型更大,处理和取样过程更容易可以进行学习、记忆和执行功能的测试个体的遗传物质不稳定,成功几率小玉米肽等活性成分对大鼠酒精肝的影响[72]豚鼠能够做到真正的宫内暴露产仔量小,较长的妊娠期会增加项目的时间和成本,难以用于行为测试豚鼠毛发作为产前酒精暴露的生物标志物[73]秀丽隐杆线虫胚胎发育的阶段和时间都有很好的特征,透明的卵子可以直接显示每个发育阶段;在检查细胞、分子和遗传水平的基本生物发育时非常有用无法口服乙醇,只能将其浸泡在乙醇中;BAC不能直接测量乙醇暴露对秀丽隐杆线虫发育的影响[74]灵长类动物妊娠发育和长度与人类妊娠相似;可以用来研究比啮齿动物或其他动物模型更复杂的行为耗时长、昂贵,且难以获得伦理批准产前酒精暴露对行为的影响[75]猪上皮组织学(分层鳞状非角化上皮)及其胃食管结构的形态和生理学与人类相似耗时长、昂贵饮酒对乙醇喂养猪DNA和脂质氧化损伤生物标志物的影响[76]斑马鱼饲养成本低、体积小、发育周期短、体外受精、透明易观察、单次产卵数较高、给药量小测量其醉酒相关生化指标有一定难度牛磺酸等对斑马鱼醉酒情况的影响[63, 77]
酒精代谢的关键生物标志物分为:乙醇代谢酶系、血清肝功能酶系、氧化应激标志物和炎症因子等几类。
①乙醇代谢酶系:ADH和ALDH是乙醇代谢的关键酶,能反应酒精在体内的代谢速度。②血清肝功能酶系:正常动物谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)主要存在于肝脏中,血液中含量较低,当过度饮酒或疲劳时,肝细胞受到损伤可导致这些转氨酶释放进入血液。因此ALT和AST是检测肝细胞功能的灵敏指标[78]。③氧化应激标志物:乙醇代谢过程中会产生多余的自由基,而谷胱甘肽作为体内最重要的自由基清除剂之一,起到维持氧化平衡的作用。丙二醛的量常常可反映机体内脂质过氧化的程度,间接地反映出细胞损伤的程度。丙二醛的测定常常与SOD的测定相互配合,SOD活力的高低间接反映了机体清除氧自由基的能力[47]。甘油三酯、血清总胆固醇是血清中主要的脂质,可以直接反映血脂水平,而酒精代谢会产生更高的NADH/NAD+比率,从而抑制脂肪酸氧化并增强甘油三酯合成,导致脂肪肝[79]。④炎症因子:健康动物血清中炎症因子浓度极低,在急/慢性炎症以及组织损伤时炎症因子的浓度会迅速上升。因此,炎症因子可作为炎症和组织损伤的标志物,并在疾病的发展中起重要调节作用。白细胞介素-6作为肝细胞刺激因子,在感染或外伤引起的急性炎症反应中诱导反应蛋白的合成。过量酒精摄入会诱导白细胞介素-1β、白细胞介素-6、白细胞介素-10等炎症介质产生,促进酒精性肝损伤的发生和进展[80]。
在选择一个动物模型进行酒精代谢相关研究时,有许多不同的因素需要考虑。所选择的动物模型应该反映出要回答的具体研究问题。根据要检测的内容,每个模型都有自己的优点和缺点。还应考虑动物年龄、给药途径、BAC峰值和营养控制。简单的无脊椎动物和脊椎动物,如秀丽隐杆线虫、非洲爪蟾和斑马鱼,可以成为在遗传水平或特定的发育阶段检查乙醇影响的极好工具。啮齿动物更常用于转化研究,其中可以检查治疗方法的效果,以便将来在临床人群中使用。在研究复杂行为时,非人灵长类动物模型是金标准,但由于样本量小、成本大和时间限制,研究往往受到限制。这时候可以选择大鼠和斑马鱼等以节省成本[72]。
我国是酿酒大国,同时也是饮酒大国,酒文化源远流长。饮酒已成为数千年来人类文化的一部分,是一种传统待客之道,也是社交礼仪的重要组成。了解酒精从入口到吸收、转运和排泄的生理过程,明晰其潜在健康风险并制定有效预防策略对酒类行业发展以及“健康中国”建设具有重要意义。目前,ALD是全球慢性肝病的主要原因,并且仍然是全球主要的健康问题。虽然已有很多研究表明一些活性物质(如玉米肽、异黄酮和牛磺酸等)可以减少肝脏损伤,但内在的作用机制尚不清楚。用于酒精代谢研究的动物模型虽然很多,研究者也开发出了适应不同研究内容的造模方法,但是仍有许多不足之处。比如斑马鱼的行为学研究,现在大部分研究侧重点是斑马鱼在酒精环境下的恐惧行为改变,而缺乏类似小鼠翻正反射等明确的醉酒/醒酒标准。其次,在动物模型中如何更好地模拟人类饮酒的社会因素,也是一个值得关注的方面。针对目前市场上各类解酒产品销售情况来看,除解酒功能需要进一步强化之外,适应消费者口味也是重要的研究方向之一。此外,醒酒解酒产品药食不分,市场混乱也是一大问题。天然活性产物是目前研究最多的醒酒功能物质,并且对长期饮酒造成的肝损伤有缓解效果,消费者也更容易接受。研究者可以围绕天然活性产物,结合多种功能物质,研制出更有效果的低醉酒、低损伤、代谢快的解酒保肝类产品。
[1] JEON S, CARR R.Alcohol effects on hepatic lipid metabolism[J].Journal of Lipid Research, 2020, 61(4):470-479.
[2] 徐佳楠, 杨帅, 倪永培, 等.影响迎驾贡酒饮后舒适度的关键酒体成分研究[J].酿酒科技, 2019(12):23-28;31.
XU J N, YANG S, NI Y P, et al.Study on the key components influencing the comfort after drinking Yingjia Gongjiu liquor[J].Liquor-Making Science &Technology, 2019(12):23-28;31.
[3] 孟庆义. 急诊临床思维[M].北京:科学技术文献出版社, 2010.
[4] BERGGREN S M, GOLDBERG L.The absorption of ethyl alcohol from the gastro-intestinal tract as a diffusion process[J].Acta Physiologica Scandinavica, 1940, 1(3):246-270.
[5] JONES A W.Alcohol, its absorption, distribution, metabolism, and excretion in the body and pharmacokinetic calculations[J].WIREs Forensic Science, 2019, 1(5):e1340.
[6] ZAKHARI S.Overview:How is alcohol metabolized by the body?[J].Alcohol Research &Health, 2006, 29(4):245-254.
[7] CABALLER A J.Current concepts in alcohol metabolism[J].Annals of Hepatology, 2003, 2(2):60-68.
A J.Current concepts in alcohol metabolism[J].Annals of Hepatology, 2003, 2(2):60-68.
[8] GUENGERICH F P.Cytochrome P450 s and other enzymes in drug metabolism and toxicity[J].The AAPS Journal, 2006, 8(1):E101-E111.
[9] TSUTSUMI M, LASKER J M, TAKAHASHI T, et al.In vivo induction of hepatic P4502E1 by ethanol:Role of increased enzyme synthesis[J].Archives of Biochemistry and Biophysics, 1993, 304(1):209-218.
[10] TSERMPINI E E, PLEMENITA ILJE
ILJE A, DOLŽAN V.Alcohol-induced oxidative stress and the role of antioxidants in alcohol use disorder:A systematic review[J].Antioxidants, 2022, 11(7):1374.
A, DOLŽAN V.Alcohol-induced oxidative stress and the role of antioxidants in alcohol use disorder:A systematic review[J].Antioxidants, 2022, 11(7):1374.
[11] PETERSEN O H, TEPIKIN A V, GERASIMENKO J V, et al.Fatty acids, alcohol and fatty acid ethyl esters:Toxic Ca2+ signal generation and pancreatitis[J].Cell Calcium, 2009, 45(6):634-642.
[12] MARTINEZ-HURTADO J, CALO-FERNANDEZ B, VAZQUEZ-PADIN J.Preventing and mitigating alcohol toxicity:A review on protective substances[J].Beverages, 2018, 4(2):39.
[13] LIU J N, GUO M, FAN X T.Ethanol induces necroptosis in gastric epithelial cells in vitro[J].Journal of Food Biochemistry, 2021, 45(4):e13692.
[14] 余贤恩, 罗绮凝.外源性一氧化氮对豚鼠酸化乙醇性胃粘膜损伤的保护作用[J].世界华人消化杂志, 2000, 8(2):224.
YU X E, LUO Q N.Protective effect of exogenous nitric oxide on gastric mucosal injury induced by acidified ethanol in guinea pigs[J].World Chinese Journal of Digestology, 2000, 8(2):224.
[15] APTE M V, PIROLA R C, WILSON J S.Mechanisms of alcoholic pancreatitis[J].Journal of Gastroenterology and Hepatology, 2010, 25(12):1816-1826.
[16] HEYMANN H M, GARDNER A M, GROSS E R.Aldehyde-induced DNA and protein adducts as biomarker tools for alcohol use disorder[J].Trends in Molecular Medicine, 2018, 24(2):144-155.
[17] CHEN J, ROBINSON N C, SCHENKER S, et al.Formation of 4-hydroxynonenal adducts with cytochrome c oxidase in rats following short-term ethanol intake[J].Hepatology, 1999, 29(6):1792-1798.
[18] 蔡振寨, 李兆申.酒精性慢性胰腺炎发病机制研究进展[J].国外医学(消化系疾病分册), 2005, (6):391-394.
CAI Z Z, LI Z S.Research progress on the pathogenesis of alcoholic chronic pancreatitis[J].International Journal of Digestive Diseases, 2005, (6):391-394.
[19] 陈旭, 王建国.乙醇在体内的代谢及对机体的损害[J].科技信息, 2008, (35):460.
CHEN X, WANG J G.Metabolism of ethanol in the body and its damage to the body[J].Science&Technology Information, 2008, (35):460.
[20] TESCHKE R.Alcoholic liver disease:Alcohol metabolism, cascade of molecular mechanisms, cellular targets, and clinical aspects[J].Biomedicines, 2018, 6(4):106.
[21] SMITH G S, MERCER D W, CROSS J M, et al.Gastric injury induced by ethanol and ischemia-reperfusion in the rat.Differing roles for lipid peroxidation and oxygen radicals[J].Digestive Diseases and Sciences, 1996, 41(6):1157-1164.
[22] LOUVET A, MATHURIN P.Alcoholic liver disease:Mechanisms of injury and targeted treatment[J].Nature Reviews.Gastroenterology &Hepatology, 2015, 12(4):231-242.
[23] COMPORTI M, SIGNORINI C, LEONCINI S, et al.Ethanol-induced oxidative stress:Basic knowledge[J].Genes &Nutrition, 2010, 5(2):101-109.
[24] MORENO A, PARÉS X.Purification and characterization of a new alcohol dehydrogenase from human stomach[J].Journal of Biological Chemistry, 1991, 266(2):1128-1133.
[25] JULKUNEN R J, DI PADOVA C, LIEBER C S.First pass metabolism of ethanol:A gastrointestinal barrier against the systemic toxicity of ethanol[J].Life Sciences, 1985, 37(6):567-573.
[26] PESTALOZZI D M, BÜHLER R, VON WARTBURG J P, et al.Immunohistochemical localization of alcohol dehydrogenase in the human gastrointestinal tract[J].Gastroenterology, 1983, 85(5):1011-1016.
[27] 王国祥, 缪扬德, 徐荣亮, 等.乙醇首过代谢发生部位的实验性研究[J].胃肠病学和肝病学杂志, 2005, 14(3):275-276.
WANG G X, MIAO Y D, XU R L, et al.Study on localization of the first pass metabolism of alcohol[J].Chinese Journal of Gastroenterology and Hepatology, 2005, 14(3):275-276.
[28] LI H M, WEN L K, LI S J, et al.In vitro and in vivo effects and safety assessment of corn peptides on alcohol dehydrogenase activities[J].Chemical Research in Chinese Universities, 2011, 27(5):820-826.
[29] XIAO C Q, ZHOU F B, ZHAO M M, et al.Chicken breast muscle hydrolysates ameliorate acute alcohol-induced liver injury in mice through alcohol dehydrogenase (ADH) activation and oxidative stress reduction[J].Food &Function, 2018, 9(2):774-784.
[30] 朱秀敏. 超氧化物歧化酶的生理活性[J].当代医学, 2011, 17(15):26-27.
ZHU X M.Physiological activity of superoxide dismutase[J].Contemporary Medicine, 2011, 17(15):26-27.
[31] 铁梅, 刘丽, 庄晓虹, 等.硒蛋白和过氧化氢酶清除羟自由基作用的研究[J].食品研究与开发, 2017, 38(17):6-10.
TIE M, LIU L, ZHUANG X H, et al.Studies on scavenging hydroxyl free radical by selenoprotein and catalase[J].Food Research and Development, 2017, 38(17):6-10.
[32] HARRISON S C.Variation on an src-like theme[J].Cell, 2003, 112(6):737-740.
[33] HARIHARAN S, DHARMARAJ S.Selenium and selenoproteins:It’s role in regulation of inflammation[J].Inflammopharmacology, 2020, 28(3):667-695.
[34] DE CAVANAGH E M V, INSERRA F, FERDER L, et al.Superoxide dismutase and glutathione peroxidase activities are increased by enalapril and captopril in mouse liver[J].FEBS Letters, 1995, 361(1):22-24.
[35] YAMAGUCHI M, NISHIKIORI F, ITO M, et al.The effects of corn peptide ingestion on facilitating alcohol metabolism in healthy men[J].Bioscience, Biotechnology, and Biochemistry, 1997, 61(9):1474-1481.
[36] ZAN R, ZHU L, WU G C, et al.Identification of novel peptides with alcohol dehydrogenase (ADH) activating ability in chickpea protein hydrolysates[J].Foods, 2023, 12(8):1574.
[37] 王崔, 徐成灵, 羊忠山.核桃肽对急性酒精中毒小鼠的胃黏膜保护及解酒醒脑护肝作用研究[J].中医学报, 2023, 38(5):1038-1046.
WANG C, XU C L, YANG Z S.Protective effect of walnut peptide on gastric mucosa, anti alcoholism, awakening brain and protecting liver in acute alcoholism mouse[J].Acta Chinese Medicine, 2023, 38(5):1038-1046.
[38] YAO G, TANG X, YE Z, et al.Protective effect of Camellia vietnamensis active peptide on alcohol-induced hepatocyte injury[J].Food and Agricultural Immunology, 2021, 32(1):425-449.
[39] XIAO C Q, ZHAO M M, ZHOU F B, et al.Data on bioactive peptides derived from chicken hydrolysate with potential alcohol dehydrogenase stabilizing activity and in silico analysis of their potential activity and applicability[J].Data in Brief, 2020, 29:105163.
[40] GAO J L, ZHANG C H, QIN X M, et al.Hepatoprotective effect of clam (Corbicula fluminea) protein hydrolysate on alcohol-induced liver injury in mice and partial identification of a hepatoprotective peptide from the hydrolysate[J].Food Science and Technology, 2022, 42:61522.
[41] 阙凡迪, 王娇燕, 王琼芬, 等.东海乌参肽对小鼠酒精性肝损伤及肠道菌群的调节作用[J].食品科学, 2023, 44(7):29-38.
QUE F D, WANG J Y, WANG Q F, et al.Regulatory effect of Acaudina leucoprocta peptides on alcoholic liver injury and intestinal flora in mice[J].Food Science, 2023, 44(7):29-38.
[42] 房伟. 葛根药理作用研究进展[J].中国药物经济学, 2017, 12(11):159-160.
FANG W.Research progress on pharmacological effects of Pueraria lobata[J].China Journal of Pharmaceutical Economics, 2017, 12(11):159-160.
[43] SONG W, LI Y J, QIAO X, et al.Chemistry of the Chinese herbal medicine Puerariae Radix(Ge-Gen):A review[J].Journal of Chinese Pharmaceutical Sciences, 2014, 23(6):347-360.
[44] 陈醇, 郝靖宇, 冯昊天, 等.一种枳椇子、葛根、益生菌配方产品醒酒及肝损伤保护作用研究[J].食品科技, 2020, 45(2):91-97.
CHEN C, HAO J Y, FENG H T, et al.Anti-alcoholism and hepatoprotective effects of Hovenia dulcis Thunb., Pueraria and probiotics composite[J].Food Science and Technology, 2020, 45(2):91-97.
[45] 王晶, 李洪敏, 艾芳, 等.葛根素的提取及对小鼠解酒护肝功能的鉴定[J].局解手术学杂志, 2015, 24(4):358-361.
WANG J, LI H M, AI F, et al.Puerarin extraction and identification of solution wine to protect liver function in mice[J].Journal of Regional Anatomy and Operative Surgery, 2015, 24(4):358-361.
[46] KEUNG W M, KLYOSOV A A, VALLEE B L.Daidzin inhibits mitochondrial aldehyde dehydrogenase and suppresses ethanol intake of Syrian golden hamsters[J].Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(5):1675-1679.
[47] 郑连姬, 邓利玲, 罗嘉妮, 等.魔芋葡甘聚糖抗醉解酒作用机理研究[J].食品与机械, 2017, 33(5):156-161.
ZHENG L J, DENG L L, LUO J N, et al.The mechanism for anti-drunk and anti-inebriation of konjac glucomannan[J].Food &Machinery, 2017, 33(5):156-161.
[48] WANG D Y, WANG Q, LI S C, et al.Carvacrol methyl ether, a compound from the essential oil of Gardenia jasminoides fruits, exhibits antioxidant effects in the deep-frying of Chinese Youmotou using sunflower oil[J].LWT, 2020, 128:109502.
[49] 赵丽晶, 乔振鑫, 于乐, 等.叶黄素对急性酒精中毒小鼠胃黏膜的保护作用[J].吉林医药学院学报, 2022, 43(1):23-26.
ZHAO L J, QIAO Z X, YU L, et al.Protective effect of lutein on gastric mucosa in mice with acute alcoholism[J].Journal of Jilin Medical University, 2022, 43(1):23-26.
[50] BAYRO A, MANLUSOC J K, ALONTE R, et al.Preliminary characterization, antioxidant and antiproliferative properties of polysaccharide from Caulerpa taxifolia[J].Pharmaceutical Sciences and Research, 2021, 8(1):30-36.
[51] BANG J S, CHUNG Y H, CHUNG S J, et al.Clinical effect of a polysaccharide-rich extract of Acanthopanax senticosus on alcohol hangover[J].Die Pharmazie, 2015, 70(4):269-273.
[52] ZHAO X Y, WANG L Q, ZHANG H, et al.Protective effect of artemisinin on chronic alcohol induced-liver damage in mice[J].Environmental Toxicology and Pharmacology, 2017, 52:221-226.
[53] 李国华, 李鹤龄, 陈智岗, 等.酒精性肝病与肠道微生物群落研究进展[J].中国实验动物学报, 2022, 30(3):423-427.
LI G H, LI H L, CHEN Z G, et al.Research progress on alcoholic liver diseases and gut microbiota[J].Acta Laboratorium Animalis Scientia Sinica, 2022, 30(3):423-427.
[54] GRANDER C, ADOLPH T E, WIESER V, et al.Recovery of ethanol-induced Akkermansia muciniphila depletion ameliorates alcoholic liver disease[J].Gut, 2018, 67(5):891-901.
[55] KIRPICH I A, SOLOVIEVA N V, LEIKHTER S N, et al.Probiotics restore bowel flora and improve liver enzymes in human alcohol-induced liver injury:A pilot study[J].Alcohol, 2008, 42(8):675-682.
[56] KONKIT M, CHOI W J, KIM W.Aldehyde dehydrogenase activity in Lactococcus chungangensis:Application in cream cheese to reduce aldehyde in alcohol metabolism[J].Journal of Dairy Science, 2016, 99(3):1755-1761.
[57] K GI J H R, VALLEE B L.The role of zinc in alcohol dehydrogenase[J].Journal of Biological Chemistry, 1960, 235(11):3188-3192.
GI J H R, VALLEE B L.The role of zinc in alcohol dehydrogenase[J].Journal of Biological Chemistry, 1960, 235(11):3188-3192.
[58] VERSTER J C, VERMEULEN S A, LOO A J A E V, et al.Dietary nutrient intake, alcohol metabolism, and hangover severity[J].Journal of Clinical Medicine, 2019, 8(9):1316.
[59] 杨冰冰, 胡纯秋, 胡永迪, 等.维生素D缺乏与酒精性肝病的相关性研究[J].安徽医科大学学报, 2019, 54(8):1273-1276.
YANG B B, HU C Q, HU Y D, et al.Associations between vitamin D deficiency and alcoholic liver disease[J].Acta Universitatis Medicinalis Anhui, 2019, 54(8):1273-1276.
[60] KHAN M A, JENSEN K, KROGH H J.Alcohol-induced hangover.A double-blind comparison of pyritinol and placebo in preventing hangover symptoms[J].Quarterly Journal of Studies on Alcohol, 1973, 34(4):1195-1201.
[61] ROSA-E-SILVA L, TRONCON L E, OLIVEIRA R B, et al.Su1320 fecal parameters and gastrointestinal transit in patients with alcohol related chronic pancreatitis with and without chronic diarrhea.factors associated with this symptom[J].Gastroenterology, 2013, 144(5):S-457.
[62] 刘欣, 张倩倩, 王圣霞, 等.建立啮齿类酒精饮用动物模型的影响因素及研究进展[J].中国药理学与毒理学杂志, 2017, 31(6):607-614.
LIU X, ZHANG Q Q, WANG S X, et al.Factors affecting establishment of rodent alcohol drinking models and recent advances[J].Chinese Journal of Pharmacology and Toxicology, 2017, 31(6):607-614.
[63] FONTANA B D, STEFANELLO F V, MEZZOMO N J, et al.Taurine modulates acute ethanol-induced social behavioral deficits and fear responses in adult zebrafish[J].Journal of Psychiatric Research, 2018, 104:176-182.
[64] DRINGENBERG H C, RICHARDSON D P, BRIEN J F, et al.Spatial learning in the guinea pig:Cued versus non-cued learning, sex differences, and comparison with rats[J].Behavioural Brain Research, 2001, 124(1):97-101.
[65] SIEGMUND S, HAAS S, SCHNEIDER A, et al.Animal models in gastrointestinal alcohol research-a short appraisal of the different models and their results[J].Best Practice &Research.Clinical Gastroenterology, 2003, 17(4):519-542.
[66] REZVANI A H, PARSIAN A, OVERSTREET D H.The Fawn-Hooded (FH/Wjd) rat:A genetic animal model of comorbid depression and alcoholism[J].Psychiatric Genetics, 2002, 12(1):1-16.
[67] ADACHI M, ISHII H.Role of mitochondria in alcoholic liver injury 1[J].Free Radical Biology and Medicine, 2002, 32(6):487-491.
[68] 王剑锋, 程学英, 初海鹰, 等.慢性酒精中毒性肌病模型的建立[J].中华神经医学杂志, 2006, 5(4):382-385.
WANG J F, CHENG X Y, CHU H Y, et al.Establishment of the model of chronic alcoholic myopathy in rats[J].Chinese Journal of Neuromedicine, 2006, 5(4):382-385.
[69] WEN R T, ZHANG M, QIN W J, et al.The phosphodiesterase-4 (PDE4) inhibitor rolipram decreases ethanol seeking and consumption in alcohol-preferring Fawn-Hooded rats[J].Alcoholism, Clinical and Experimental Research, 2012, 36(12):2157-2167.
[70] GERLAI R, LEE V, BLASER R.Effects of acute and chronic ethanol exposure on the behavior of adult zebrafish (Danio rerio)[J].Pharmacology Biochemistry and Behavior, 2006, 85(4):752-761.
[71] XIE S Y, CUI Y H, YANG Y J, et al.Tissue distribution and bioaccumulation of 8:2 fluorotelomer alcohol and its metabolites in pigs after oral exposure[J].Chemosphere, 2020, 249:126016.
[72] PATTEN A R, FONTAINE C J, CHRISTIE B R.A comparison of the different animal models of fetal alcohol spectrum disorders and their use in studying complex behaviors[J].Frontiers in Pediatrics, 2014, 2:93.
[73] KULAGA V, CAPRARA D, IQBAL U, et al.Fatty acid ethyl esters (FAEE);comparative accumulation in human and guinea pig hair as a biomarker for prenatal alcohol exposure[J].Alcohol and Alcoholism, 2006, 41(5):534-539.
[74] DAVIS J R, LI Y, RANKIN C H.Effects of developmental exposure to ethanol on Caenorhabditis elegans[J].Alcoholism, Clinical and Experimental Research, 2008, 32(5):853-867.
[75] SCHNEIDER M L, MOORE C F, ADKINS M M.The effects of prenatal alcohol exposure on behavior:Rodent and primate studies[J].Neuropsychology Review, 2011, 21(2):186-203.
[76] CHRISTIE K N, THOMSON C, HOPWOOD D.A comparison of membrane enzymes of human and pig oesophagus;the pig oesophagus is a good model for studies of the gullet in man[J].The Histochemical Journal, 1995, 27(3):231-239.
[77] LIU Y S, YUAN M H, ZHANG C Y, et al.Puerariae Lobatae radix flavonoids and puerarin alleviate alcoholic liver injury in zebrafish by regulating alcohol and lipid metabolism[J].Biomedicine &Pharmacotherapy, 2021, 134:111121.
[78] CHANG Y N, LI H, REN H, et al.Misclassification of chronic hepatitis B natural history phase:Insight from new ALT, AST, AKP, and GGT reference intervals in Chinese children[J].Clinica Chimica Acta, 2019, 489:61-67.
[79] BALKRISHNA A, GOHEL V, SINGH R, et al.Livogrit ameliorates acetaldehyde-induced steatosis in HepG2 cells through modulation of lipogenesis and β-oxidation pathways[J].Phytomedicine Plus, 2021, 1(3):100067.
[80] PFEIFFER S E M, QUESADA-MASACHS E, MCARDLE S, et al.Effect of IL4 and IL10 on a human in vitro type 1 diabetes model[J].Clinical Immunology, 2022, 241:109076.