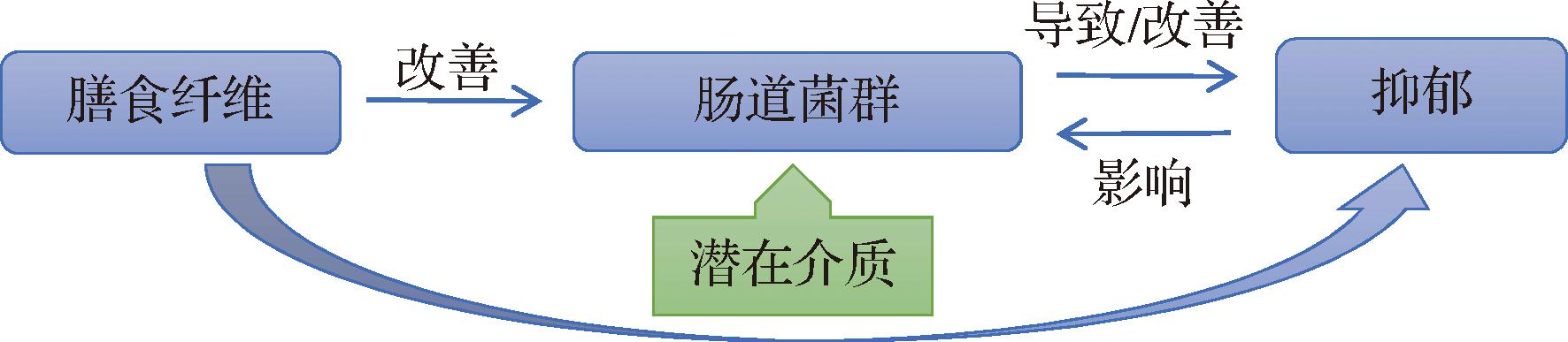
图1 膳食纤维与肠道菌群和抑郁症的关系
Fig.1 The relationship of dietary fiber and intestinal flora and depression
抑郁症是一种常见的神经精神疾病,以持久的疲劳、兴趣减退、快感缺失、睡眠障碍为主的临床特征,严重者甚至出现自杀行为,严重损害了人类生活和社会稳定[1-2]。抑郁症的患病率在不同国家虽有不同,但整体上都呈上升趋势,全球约有3.5亿人饱受抑郁症的折磨,且近些年COVID-19的大流行进一步增加了抑郁症的患病率[3]。抑郁症是导致残疾的主要原因之一,预计到2030年抑郁症将成为造成全球医疗负担的首要疾病因素[1-2]。
人体可以被描述为一个可行走的微生物群落,其中肠道菌群的数量最多[4]。肠道菌群与宿主处于互惠、共生或致病关系,在宿主的稳态中起着至关重要的作用[5]。但肠道生态系统的平衡可能会被不健康的饮食、抗生素治疗等破坏,导致微生物多样性降低,影响身体健康。已有研究表明,肠道菌群失衡是驱动糖尿病、肥胖、抑郁等多种疾病发生的关键因素[2, 4-5]。近年来,肠-脑轴,即大脑和肠道微生物群之间的双向信号通路受到广泛关注[6]。肠-脑轴整合了肠道和大脑之间的神经、激素、免疫信号和其他因素,为肠道微生物群及其代谢物进入大脑提供了一条潜在途径[7],肠-脑轴的调节已成为治疗抑郁症等精神疾病的新靶点[4]。
膳食纤维是健康饮食的重要组成部分,根据2009年国际食品法典委员会的定义,膳食纤维是指具有10个或以上单体链节的不可被人体小肠消化吸收的碳水化合物(是否包括3~9个单体链节的碳水化合物由国家管理当局决定)。近些年流行病学研究表明,膳食纤维有利于肠道微生物群的稳定[8]。综上,我们推测膳食纤维可能通过调节肠道菌群进而改善抑郁症。在本综述中,我们介绍了肠道菌群与抑郁症、膳食纤维与抑郁症的关系,总结了膳食纤维干预肠道菌群改善抑郁症的可能机制,见图1。

图1 膳食纤维与肠道菌群和抑郁症的关系
Fig.1 The relationship of dietary fiber and intestinal flora and depression
肠道菌群在抑郁症的病理生理学中起着重要的作用,成为近些年的研究热点。与健康人群相比,抑郁症患者的肠道微生物群组成与健康人群相比存在明显差异[3, 9]。在门水平上主要表现为放线菌门、变形菌门等在抑郁症患者中的丰度较健康人群明显升高[3]。而JIANG等[10]发现抑郁症患者肠道菌群中的变形菌门丰度显著升高,放线菌门丰度却显著降低。在属水平上的研究发现拟杆菌属会在抑郁症患者体内富集,而乳酸杆菌属和双歧杆菌属的丰度会降低[6]。一项Meta分析发现Eggerthella主要富集于重度抑郁症患者体内,而Faecalibacterium和Coprococcus的相对丰度显著降低[11]。尽管各项研究之间存在部分差异菌群的不同,但促炎菌群的富集和抗炎菌群的减少是一致的。另外肠道菌群是一个复杂的生态群落,某些特定的菌群可能是通过与其他致病菌的协同作用引发抑郁症,而不是单个致病菌引起的[12]。动物实验研究发现与正常小鼠相比,给予压力刺激后,无菌小鼠表现出明显的抗抑郁行为。此外,将抑郁患者的粪菌移植到无菌小鼠体内可以显著增加无菌小鼠的抑郁样行为[13]。以上表明微生物群在抑郁症病理生理学中起因果作用的可能性。
多项研究表明,给予益生菌或益生元干预可以改善肠道菌群组成,减缓抑郁样行为。例如,鼠李糖乳杆菌的补充可以减轻孕期及产后母亲的抑郁症状[3]。另一项研究用低聚果糖和低聚半乳糖喂养慢性社会失败应激诱导的抑郁小鼠,结果发现抑郁小鼠的抑郁样行为明显得到改善[14]。此外,粪菌移植在临床前研究中已被广泛证明能够缓解抑郁样行为,这使其成为与肠道菌群生态失调相关慢性疾病的有前途的干预策略[12]。由此可见,肠道菌群与抑郁症的发生、发展有着密切的联系。
1.2.1 膳食纤维的消化和吸收离不开肠道菌群的作用
人体的消化酶不能降解膳食纤维,当膳食纤维(特别是可溶性膳食纤维)通过小肠进入结肠时,肠道细菌可以通过不同的降解途径将膳食纤维降解为低聚糖或单糖,然后通过特定的运输途径吸收其代谢产物作为能量来源[15]。短链脂肪酸(short chain fatty acid, SCFA)是膳食纤维在胃肠道细菌作用下发酵产生的主要代谢物,主要包括乙酸、丙酸和丁酸等,在调节宿主代谢、黏膜上皮细胞的增殖和加强肠道屏障中起关键作用,被认为是结肠细胞的主要能量来源[16]。
1.2.2 膳食纤维对肠道菌群结构和组成的影响
膳食纤维对肠道微生物群组成、多样性和丰富度方面有重要影响[16]。多项研究表明,补充膳食纤维可以重组肠道微生物群,且肠道微生物群的改变在很大程度上归因于不同种类的膳食纤维。通常膳食纤维会促进更能发酵该纤维的细菌生长[17]。SO等[18]的Meta分析发现,低聚木糖、低聚甘露糖的干预增加了健康成人肠道中有益菌双歧杆菌属和乳酸杆菌属的丰度。另一项研究表明,藜麦麸皮可溶性膳食纤维的喂养使得小鼠肠道微生物群的多样性和丰富度增加,且显著增加了厚壁菌门的丰度,降低了拟杆菌门和致病性螺旋杆菌属的丰度[19]。表1中列举了不同种类的膳食纤维对肠道菌群的不同的影响。
表1 不同种类的膳食纤维会导致肠道微生物群不同的变化
Table 1 Different types of dietary fiber lead to different changes in the gut microbiota

研究设计样本量(n)研究人群年龄/岁持续时间纤维类型肠道微生物群变化参考文献双盲,安慰剂11健康55~802个月菊苣长链菊粉微生物多样性↑,双歧杆菌属、Alistipes shahii、Anaerostipes hadrus、Parabacteroides distasonis↑[20]随机,交叉30肥胖36~524周阿拉伯木聚糖普雷沃氏菌↑[21]随机,双盲,安慰剂50酒精使用障碍38~5817 d菊粉放线菌门、双歧杆菌属↑[22]单组设计试验26健康18~8533 d菊粉型果聚糖放线菌门、双歧杆菌属↑,草酸杆菌科↓[23]横断面研究设计356糖尿病患者18~852年总膳食纤维黄体链球菌、脆弱拟杆菌、双歧杆菌属↑[24]
除此之外,肠道微生物群的改变还与膳食纤维的摄入剂量有关,LIU等[25]用高膳食纤维(菊粉,0.037 g/kcal)干预高脂肪饮食诱导的的抑郁小鼠,结果发现,高膳食纤维摄入显著提高了抑郁小鼠肠道中乳酸杆菌属、普雷沃氏菌属的相对丰度,降低了脱硫弧菌目的相对丰度,此外,还显著提高了标准饲料喂养的普通小鼠肠道中双歧杆菌属的丰度,增强了肠道微生物群的多样性。另一项临床研究表明高纤维饮食(全谷物、益生元和中药食品组成的高膳食纤维饮食)能够改善Ⅱ型糖尿病受试者的肠道菌群,增加乳酸杆菌属和双歧杆菌属丰度,降低脱硫弧菌属等致病菌的丰度[26]。最近的研究发现,长期缺乏膳食纤维会导致微生物多样性降低,使肠道微生物代谢转向不太有利的底物,不利于肠道健康[16]。有研究表明,无膳食纤维的饮食会在短短3 d内改变肠道微生物群的组成,并且这种反应会持续至少2周,会导致身体的炎症[27]。综上所述,膳食纤维与肠道菌群之间有着密切的联系,二者相互作用,共同维持肠道微生物群的稳态。
越来越多的证据表明,饮食模式和特定的饮食因素与精神疾病有关,尤其是抑郁症。近些年来,人们对膳食纤维与抑郁症之间的关联越来越感兴趣。XU[28]在美国的人群调查研究发现,膳食纤维摄入量超过14.9 g/d的人患抑郁症的风险比低于10.5 g/d的人低42%。LIU等[29]的研究结果也表明膳食纤维摄入量与抑郁呈负相关,且对总膳食纤维及膳食纤维的不同种类(可溶性纤维、水果纤维、蔬菜纤维和谷物纤维)对抑郁症的发生及发展也做了人群研究。此外,一项横断面研究调查显示,较多的可溶性膳食纤维,较高的蔬菜和大豆膳食纤维摄入量与抑郁症状的患病率较低有关[30]。更多膳食纤维摄入与抑郁症关系的研究见表2。
表2 膳食纤维摄入与抑郁症关系的研究
Table 2 Study on the relationship between dietary fiber intake and depression

样本评估膳食纤维摄入量的方法抑郁症评估方法结果协变量参考文献2007—2014年 美国数据库NHANES的16 807个研究对象24 h膳食回顾法:总膳食纤维、蔬菜纤维、水果纤维和谷物纤维患者健康问卷(PHQ-9)总膳食纤维、蔬菜纤维、水果纤维:最高摄入量组的抑郁症患病风险最低,其摄入量的增加可能与抑郁症患病风险降低有关。年龄、性别、种族、婚姻状况、教育水平、家庭年收入、体质指数(body mass index,BMI)、每日总能量摄入量、吸烟、饮酒、职业体力活动和休闲体力活动水平、是否患有高血压及糖尿病[31]2019年7月—2020年5月苏州某社区和医院20~81周岁的459位高血压患者24 h膳食回顾法:总膳食纤维PROMIS抑郁-简表8b-1.0版调整人口学指标和临床指标后,较高的膳食纤维摄入量为高血压患者抑郁的保护因素。年龄、性别、婚姻状况、文化程度、职业、医疗支付、运动、睡眠时间和质量、吸烟、饮酒、BMI、腰臀比、是否便秘、收缩压、舒张压、高血压病程、服用降压药情况、并发症[32]2012年—2016年韩国国民健康和营养检查调查的546名19~64岁的韩国成年人食物频率问卷:粗纤维、谷物、蔬菜、水果、海藻和蘑菇PHQ-9未调整协变量前,谷物、蔬菜、水果、海藻和蘑菇纤维:最高摄入量组与抑郁症状呈负相关。协变量调整后,海藻和蘑菇的最高摄入量组中抑郁症患病率最低。年龄、性别、BMI、家庭收入、教育水平、吸烟状况、酒精使用、身体活动、整体健康状况和每日能量摄入[33]849名12~18周岁的韩国女孩食物频率问卷:总膳食纤维韩版贝克抑郁症量表(K-BDI)膳食纤维摄入量最高的组与摄入量最低的组相比患抑郁症的几率较低能量摄入和月经规律[34]69 954名50~75岁的绝经后妇女食物频率问卷:总膳食纤维伯纳姆量表(Burnam scale)与最低摄入量组相比,纤维摄入量最高的参与者在 3 年随访中抑郁的几率较低。饮食、种族、教育、收入、BMI、糖尿病等疾病、身体活动、压力性生活事件、社会支持、吸烟、饮酒和能量调节脂肪酸摄入量[35]
肠道菌群在抑郁症中的预防和改善作用已日益得到认可,是膳食纤维有益作用的重要介质,包括调节食欲、代谢过程和慢性炎症途径等[5,36]。膳食纤维对肠道屏障的完整性有很好的保护作用,并能为肠道微生物提供能量,促进有益菌的生长[4,36]。此外,由于肠道微生物组是第一个与食物相互作用的身体系统之一,抑郁症病理生理学中许多相关机制(例如炎症、神经发生、色氨酸代谢)可能至少部分是由肠道微生物组调节的[37]。因此,肠道微生物群在膳食纤维饮食和抑郁症之间的联系中呈现出一个潜在的关键中介途径。
膳食纤维通过调节肠道菌群改善抑郁症的机制之一可能是得益于膳食纤维在肠道中发酵反应的产物SCFA,其在改善肠道健康方面发挥了许多局部作用(特别是丁酸盐),增强肠壁屏障的完整性,调节肠道微生物生长环境,进而在宿主代谢、免疫系统和细胞增殖方面具有关键作用[8]。有研究表明,SCFA能够激活G蛋白偶联受体(G protein-coupled receptors,GPCR),介导肠上皮信号,也可以抑制组蛋白脱乙酰酶(histone deacetylase,HDAC),稳定神经系统[38]。
2.1.1 抑制HDAC
组蛋白乙酰化状态被认为是抑郁症的潜在诊断生物标志物。HDAC是一类蛋白酶,通过从染色质中去除乙酰基在表观遗传基因调控中发挥作用,近年研究表明,HDAC的高表达与抑郁症状的出现有关[39-40]。而SCFA,特别是丁酸盐和丙酸盐,可以抑制HDAC对染色质的去乙酰化,在局部水平上动态调节组蛋白与DNA之间的相互作用,合理地增加DNA对转录因子的可及性,从而增加基因转录。抑制HDAC已被建议作为治疗抑郁症的潜在靶点[40]。
2.1.2 激活GPCR
GPCRs是接受来自微环境的细胞外刺激参与细胞间交流的膜蛋白[39]。最近的研究发现,肠道微生物群发酵膳食纤维产生的SCFA可以激活肠道外GPCRs,在抑郁症的发生和发展中起着非常重要的作用[41]。例如,乙酸盐能够激活GPCRs和游离脂肪酸受体2(FFAR2 /GPR43)的代谢途径以缓解身体炎症。此外,SCFA激活GPCRs还可以导致去甲肾上腺素释放,具有很好的抗抑郁作用。这使得GPCRs成为抑郁症等多种疾病的非常成功的药物靶标[39,41]。
2.2.1 炎症水平与抑郁
研究表明,炎症过程与抑郁症的病理生理学有关[1]。动物研究发现慢性应激诱发的抑郁样行为常伴随着促炎细胞因子水平的显著升高[42]。此外,已有多项研究将细胞因子和炎症标志物与抑郁症联系起来。C反应蛋白(C-reactive protein,CRP)是一种急性期炎症反应物,其血清浓度随着炎症而显著迅速地增加。有研究发现在抑郁症患者中观察到CRP水平升高,且CRP浓度和抑郁严重程度平行增加[39]。而且,抑郁症患者体内的促炎细胞因子(包括IL-6和TNF-α)的数量增加,而抗炎细胞因子(如IL-10和TGF-β)减少,使整体免疫反应趋向于炎症[9]。
2.2.2 调节炎症水平,从而改善抑郁
研究表明,炎症是膳食纤维与抑郁症状之间关联的潜在介质,增加膳食纤维的摄入量可能会通过肠道菌群的作用减少或预防慢性炎症,从而改善抑郁症,这其中可能涉及多种复杂的途径[39]。肠道菌群与宿主免疫系统有着密不可分的联系。肠道生态的失调以及肠道微生物的细胞成分(例如革兰氏阴性菌产生的脂多糖)会引起肠道屏障受损和炎症反应[5]。此外,肠道微生物的不同门之间相对丰度的变化也可能会导致慢性炎症的发展,其中变形杆菌数量的增加可能会导致肠道通透性的增加和慢性炎症[43]。
膳食纤维可以通过调节肠道菌群进而改善炎症。膳食纤维在肠道发酵产生的SCFA可以成为肠道微生物群的能量来源,能够调节中性粒细胞、树突状细胞、巨噬细胞以及T细胞的分化、募集和激活,影响免疫细胞和免疫调节剂以维持体内平衡[44]。MA等[45]的队列研究结果表明,膳食纤维的摄入可以改变肠道微生物的组成,特别是梭状芽孢杆菌,在调节局部和全身炎症中也起着关键作用。此外,膳食纤维还显著降低了炎症因子CRP的水平。另一项研究结果表明,菊粉可以通过增加双歧杆菌等有益菌的丰度改善肠道微环境,从而改善肠黏膜屏障,减轻慢性炎症[46]。综上,膳食纤维可能是通过改变肠道微环境、减少炎症因子等途径改善炎症水平,进而改善抑郁症。
神经递质在大脑发育和情绪调节等方面发挥着重要作用[6]。目前单胺假说是最普遍接受的抑郁症病因学假说之一,调节单胺神经递质在抑郁症的治疗中起着重要作用[1]。
2.3.1 色氨酸(Trp)
血清素,即5-羟色胺(5-hydroxytryptamine,5-HT)是一种关键的神经递质,参与情绪控制、食物摄入、睡眠等的调节。而Trp是5-HT的唯一前体,主要通过饮食获得[47]。研究表明,Trp及其代谢途径与抑郁症密切相关。许多现有论文研究了血液、血小板和血浆中的外周5-HT水平,抑郁症患者5-HT水平低于对照组[48-49]。另一项有关重度抑郁症患者外周血代谢物和生物学功能的综合Meta回归分析结果显示,抑郁评分较高的患者Trp水平可能较低[50]。另外,临床上使用的5-HT再摄取抑制剂等药物也对抑郁症的治疗起到了有效作用[2]。这些结论提示了Trp代谢在抑郁症病因学中的关键作用。
最近的研究表明较高膳食纤维摄入量的饮食能够调节肠道微生物的组成,增加5-HT的合成。XIE等[51]的研究发现,高膳食纤维饮食(20%的纤维素)能够促进小鼠的肠道蠕动,改变肠道微生物群的组成,促进拟杆菌门的生长,且增加了小鼠体内色胺酸代谢物和5-HT的表达。KUNDI等[52]用来自燕麦和黑麦麸皮的膳食纤维分别喂养经西方饮食喂养17周的小鼠,结果发现两种麸皮都能够支持有益微生物(乳酸杆菌属和双歧杆菌属)的生长,增加SCFA的产生,改善肠道屏障的完整性。这可能决定Trp代谢的途径,改变Trp从5-HT合成途径转移到吲哚衍生物的生产途径,从而增加Trp的含量。由此推测膳食纤维可能是通过肠道菌群增加肠道Trp的合成以减轻抑郁症状。
2.3.2 脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)
BDNF是一类功能和结构相关的蛋白质,在促进神经元的存活、发育和功能方面起着至关重要的作用[1]。越来越多的证据表明BDNF参与了抑郁症的病理生理过程。在抑郁症患者中观察到血清BDNF蛋白和mRNA水平低于健康对照组[53]。
研究表明,肠道微生物群组成的改变可以增加肠道屏障的通透性,并降低BDNF的丰度,最终导致抑郁症。而BDNF也可以通过调节肠黏膜屏障功能影响肠道菌群[6, 54]。一项关于肠道菌群与BDNF之间关系的Meta分析结果显示,肠道微生物的组成可以调节BDNF的产生。且乳酸杆菌属和双歧杆菌属被认为是与BDNF水平呈正相关的菌群,而厚壁菌门和拟杆菌门与其呈负相关[55]。
膳食纤维可以通过调节肠道菌群增加BDNF的水平。例如,ZHUANG等[56]的研究表明,藻类低聚糖能够减轻抑郁小鼠的肠道菌群失调,并增加了大脑中BDNF的水平,小鼠的抑郁样行为也得到改善。另一项研究表明低聚果糖联合低聚半乳糖的补充能够调节肠道微生物的组成,增加有益菌的丰度,并且还增加了抑郁小鼠体内BDNF的基因表达,小鼠的焦虑和抑郁样行为也明显得到了改善[14]。综上,膳食纤维可能是通过调节肠道菌群而增加BDNF的水平,进一步改善抑郁症。
2.3.3 多巴胺和去甲肾上腺素
单胺能神经递质多巴胺和去甲肾上腺素是神经和免疫系统之间相互作用的关键参与者,也参与了抑郁症的发生发展过程[57-58]。研究显示,脂多糖诱导的抑郁小鼠体内的去甲肾上腺素水平显著降低[59]。且多项研究表明,抑郁患者体内的多巴胺和去甲肾上腺素水平低于健康人[59-61]。
肠道微生物的组成可以调节多巴胺和去甲肾上腺素的合成和产生,进而影响到情绪和行为,且这些神经递质在肠道的病理生理中也起着重要的作用[62-63]。WU等[64]的实验发现一些差异细菌分类群与抑郁小鼠去甲肾上腺素呈显著的正相关,这提示肠道菌群确实能够对去甲肾上腺素的合成有重要作用。
膳食纤维的补充可以上调抑郁小鼠体内的多巴胺和去甲肾上腺素的水平,并抑制神经炎症,改善了小鼠的抑郁样行为[25, 65]。此外,多巴胺和去甲肾上腺素两者可能是相互作用,共同影响抑郁症的发展,且基于这两者设计的具有选择性或多种作用模式的药物也具有比较好的治疗效果[66]。以上结果表明,膳食纤维可能是通过调节肠道菌群的组成,以提高多巴胺和去甲肾上腺素的水平进而改善抑郁症。
以上关于膳食纤维改善抑郁症的可能机制有可能并不是独立作用的,而是相互作用,共同参与抑郁症的改善过程。简而言之,膳食纤维可能是基于肠道菌群,通过调节肠道菌群组成、结构,减少炎症反应、增加单胺类神经递质水平等机制改善抑郁症的,相关机制图解见图2,但具体的确切的机制还有待继续研究。
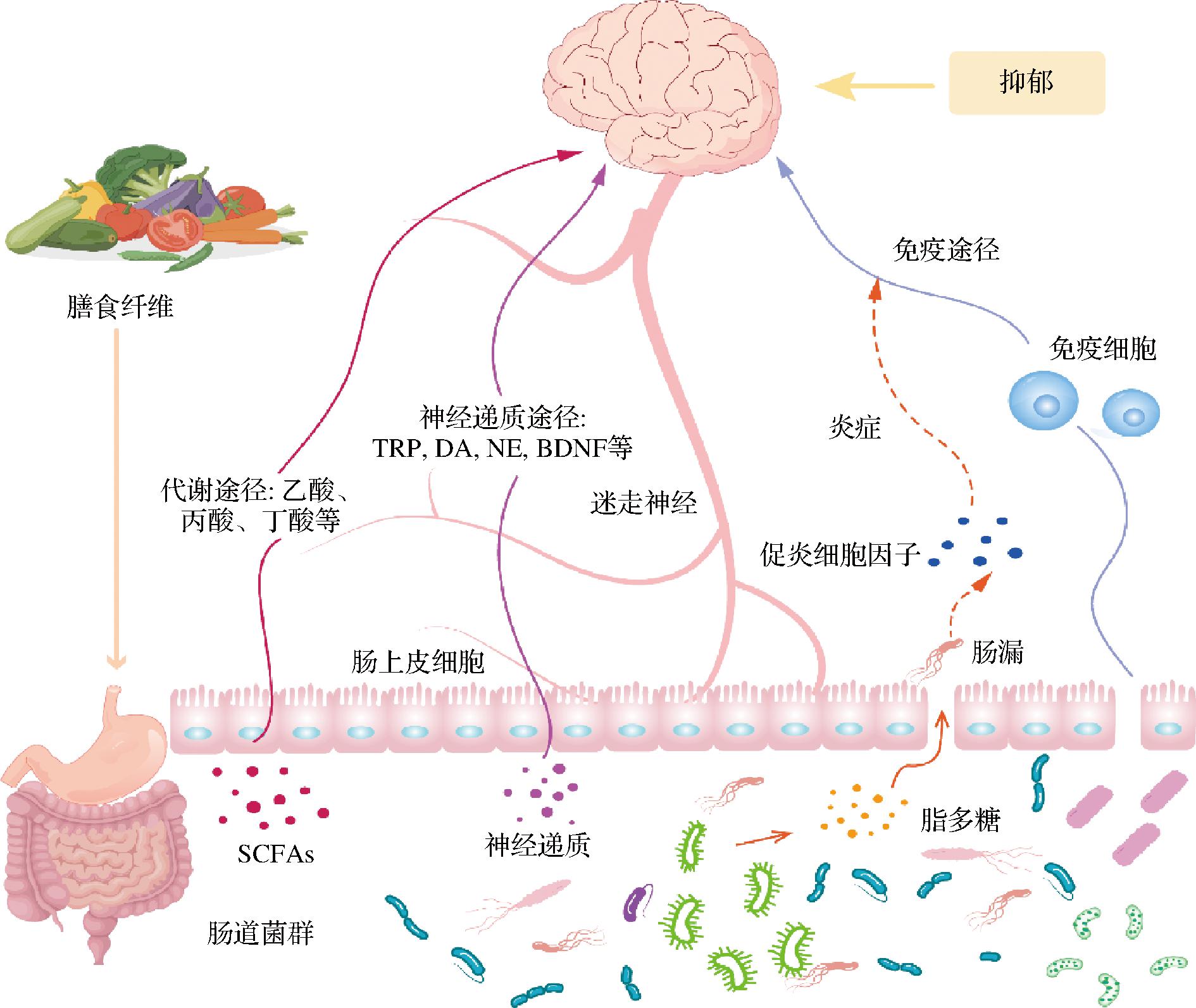
图2 膳食纤维可能通过肠道菌群影响抑郁症的机制
Fig.2 Dietary fiber may influence the mechanism of depression through intestinal flora
近年来,抑郁症的发病率不断上升,使得患者的生活质量严重下降,其相关研究受到广泛关注。临床一般使用选择性5-HT再摄取抑制剂、三环类抗抑郁药、单胺氧化酶抑制剂等药物治疗抑郁症,然而这些药物大多不能通过血脑屏障而导致治疗效果不明显[53]。一些膳食天然产物和营养素对抑郁症有保护作用,例如膳食纤维,健康饮食的重要组成部分,研究发现,膳食纤维可以有效调节肠道菌群紊乱并改善抑郁症状,可能是通过不同机制发挥作用,包括增加SCFA、抑制炎症、促进单胺类神经递质的产生等。但前关于膳食纤维影响抑郁症的具体机制尚未阐明。因此,膳食纤维改善抑郁症机制的研究对我们预防和管理抑郁症是至关重要的。我们应倡导平衡饮食,多吃富含膳食纤维的食物,也可以将其开发成功能性产品,以预防抑郁症的发生。
[1] WU S X, LI J H, ZHOU D D, et al.Possible effects and mechanisms of dietary natural products and nutrients on depression and anxiety:A narrative review[J].Antioxidants, 2022, 11(11):2132.
[2] 舒香玲. 低聚木糖改善小鼠抑郁样行为及机制研究[D].无锡:江南大学, 2022.
SHU X L.Xylo-oligosaccharides improves depression-like behavior in mice and its mechanism[D].Wuxi:Jiangnan University, 2022.
[3] JACH M E, SEREFKO A, SZOPA A, et al.The role of probiotics and their metabolites in the treatment of depression[J].Molecules, 2023, 28(7):3213.
[4] SUN Y, CHENG L, ZENG X X, et al.The intervention of unique plant polysaccharides - Dietary fiber on depression from the gut-brain axis[J].International Journal of Biological Macromolecules, 2021, 170:336-342.
[5] SONALI S, RAY B, AHMED TOUSIF H, et al.Mechanistic insights into the link between gut dysbiosis and major depression:An extensive review[J].Cells, 2022, 11(8):1362.
[6] DU Y, GAO X R, PENG L, et al.Crosstalk between the microbiota-gut-brain axis and depression[J].Heliyon, 2020, 6(6):e04097.
[7] 田明, 郑丹, 刘春龙.肠道微生物参与抑郁症发病机制研究进展[J].临床军医杂志, 2022, 50(6):658-660.
TIAN M, ZHENG D, LIU C L.Research progress of intestinal microbes involved in the pathogenesis of depression[J].Clinical Journal of Medical Officers, 2022, 50(6):658-660.
[8] GILL S K, ROSSI M, BAJKA B, et al.Dietary fibre in gastrointestinal health and disease[J].Nature Reviews.Gastroenterology &Hepatology, 2021, 18(2):101-116.
[9] LIANG S, WU X L, HU X, et al.Recognizing depression from the microbiota-gut-brain axis[J].International Journal of Molecular Sciences, 2018, 19(6):1592.
[10] JIANG H Y, LING Z X, ZHANG Y H, et al.Altered fecal microbiota composition in patients with major depressive disorder[J].Brain, Behavior, and Immunity, 2015, 48:186-194.
[11] NIKOLOVA V L, SMITH M R B, HALL L J, et al.Perturbations in gut microbiota composition in psychiatric disorders:A review and meta-analysis[J].JAMA Psychiatry, 2021, 78(12):1343-1354.
[12] LIU L X, WANG H Y, CHEN X Y, et al.Gut microbiota and its metabolites in depression:From pathogenesis to treatment[J].eBioMedicine, 2023, 90:104527.
[13] 饶雪琛. 炎症反应介导的肠道菌群和慢性应激诱导抑郁相关行为的机制研究[D].重庆:重庆医科大学, 2021.
RAO X C.Study on the mechanism of intestinal flora mediated by inflammatory reaction and depression-related behavior induced by chronic stress[D].Chongqing:Chongqing Medical University, 2021.
[14] BUROKAS A, ARBOLEYA S, MOLONEY R D, et al.Targeting the microbiota-gut-brain axis:Prebiotics have anxiolytic and antidepressant-like effects and reverse the impact of chronic stress in mice[J].Biological Psychiatry, 2017, 82(7):472-487.
[15] GUAN Z W, YU E Z, FENG Q.Soluble dietary fiber, one of the most important nutrients for the gut microbiota[J].Molecules, 2021, 26(22):6802.
[16] MAKKI K, DEEHAN E C, WALTER J, et al.The impact of dietary fiber on gut microbiota in host health and disease[J].Cell Host &Microbe, 2018, 23(6):705-715.
[17] HU R Q, LI S W, DIAO H, et al.The interaction between dietary fiber and gut microbiota, and its effect on pig intestinal health[J].Frontiers in Immunology, 2023, 14:1095740.
[18] SO D, WHELAN K, ROSSI M, et al.Dietary fiber intervention on gut microbiota composition in healthy adults:A systematic review and meta-analysis[J].The American Journal of Clinical Nutrition, 2018, 107(6):965-983.
[19] LIU J, WANG Z W, MAI P S, et al.Quinoa bran soluble dietary fiber ameliorates dextran sodium sulfate induced ulcerative colitis in BALB/c mice by maintaining intestinal barrier function and modulating gut microbiota[J].International Journal of Biological Macromolecules, 2022, 216:75-85.
[20] KIEWIET M B G, ELDERMAN M E, EL AIDY S, et al.Flexibility of gut microbiota in ageing individuals during dietary fiber long-chain inulin intake[J].Molecular Nutrition &Food Research, 2021, 65(4):e2000390.
[21] BEN TEZ-P
TEZ-P EZ A, KJØLB☞K L, G
EZ A, KJØLB☞K L, G MEZ DEL PULGAR E M, et al.A multi-omics approach to unraveling the microbiome-mediated effects of Arabinoxylan oligosaccharides in overweight humans[J].mSystems, 2019, 4(4):e00209-e00219.
MEZ DEL PULGAR E M, et al.A multi-omics approach to unraveling the microbiome-mediated effects of Arabinoxylan oligosaccharides in overweight humans[J].mSystems, 2019, 4(4):e00209-e00219.
[22] AMADIEU C, COSTE V, NEYRINCK A M, et al.Restoring an adequate dietary fiber intake by inulin supplementation:A pilot study showing an impact on gut microbiota and sociability in alcohol use disorder patients[J].Gut Microbes, 2022, 14(1):2007042.
[23] HIEL S, BINDELS L B, PACHIKIAN B D, et al.Effects of a diet based on inulin-rich vegetables on gut health and nutritional behavior in healthy humans[J].The American Journal of Clinical Nutrition, 2019, 109(6):1683-1695.
[24] 付炯兴, 姚伟元, 徐望红.2型糖尿病患者膳食纤维摄入量与肠道菌群的关联:基于一项随机对照试验的数据再分析[J].中华疾病控制杂志, 2022, 26(9):1078-1084.
FU J X, YAO W Y, XU W H.Dietary fiber intake and gut microbiota in Chinese patients with type 2 diabetes:Secondary data analyses of a randomized controlled trial[J].Chinese Journal of Disease Control &Prevention, 2022, 26(9):1078-1084.
[25] LIU Z G, LI L, MA S B, et al.High-dietary fiber intake alleviates antenatal obesity-induced postpartum depression:Roles of gut microbiota and microbial metabolite short-chain fatty acid involved[J].Journal of Agricultural and Food Chemistry, 2020, 68(47):13697-13710.
[26] CHEN L H, LIU B, REN L X, et al.High-fiber diet ameliorates gut microbiota, serum metabolism and emotional mood in type 2 diabetes patients[J].Frontiers in Cellular and Infection Microbiology, 2023, 13:1069954.
[27] SHEN S, PRAME KUMAR K, WEN S W, et al.Deficiency of dietary fiber modulates gut microbiota composition, neutrophil recruitment and worsens experimental colitis[J].Frontiers in Immunology, 2021, 12:619366.
[28] XU H, LI S Y, SONG X X, et al.Exploration of the association between dietary fiber intake and depressive symptoms in adults[J].Nutrition, 2018, 54:48-53.
[29] LIU Y Y, JU Y, CUI L L, et al.Association between dietary fiber intake and incidence of depression and anxiety in patients with essential hypertension[J].Nutrients, 2021, 13(11):4159.
[30] XIA Y, LIU Y S, ZHANG S M, et al.Associations between different types and sources of dietary fibre intake and depressive symptoms in a general population of adults:A cross-sectional study[J].The British Journal of Nutrition, 2021, 125(11):1281-1290.
[31] 徐慧. 成年人膳食纤维摄入与抑郁症的关系研究[D].青岛:青岛大学, 2018.
XU H.Exploration of the association between dietary fiber intake and depressive symptoms in adults[D].Qingdao:Qingdao University, 2018.
[32] 崔伶伶. 膳食纤维摄入对原发性高血压患者抑郁、焦虑影响的横断面调查及随机对照研究[D].苏州:苏州大学, 2021.
CUI L L.The effect of dietary fiber intake on depression and anxiety in patients with essential hypertension:A cross-sectional survey and a randomized controlled study[D].Suzhou:Soochow University, 2021.
[33] KIM C S, BYEON S, SHIN D M.Sources of dietary fiber are differently associated with prevalence of depression[J].Nutrients, 2020, 12(9):2813.
[34] KIM T H, CHOI J Y, LEE H H, et al.Associations between dietary pattern and depression in Korean adolescent girls[J].Journal of pediatric and adolescent gynecology, 2015, 28(6):533-537.
[35] GANGWISCH J E, HALE L, GARCIA L, et al.High glycemic index diet as a risk factor for depression:Analyses from the Women’s Health Initiative1[J].The American Journal of Clinical Nutrition, 2015, 102(2):454-463.
[36] BARBER T M, KABISCH S, PFEIFFER A F H, et al.The health benefits of dietary fibre[J].Nutrients, 2020, 12(10):3209.
[37] MARX W, LANE M, HOCKEY M, et al.Diet and depression:Exploring the biological mechanisms of action[J].Molecular Psychiatry, 2021, 26(1):134-150.
[38] 朱慧越, 邹仁英, 许梦舒, 等.短链脂肪酸-酰化淀粉对小鼠抑郁样行为的缓解及机制[J].食品与发酵工业, 2021, 47(6):26-33.
ZHU H Y, ZOU R Y, XU M S, et al.Short chain fatty acid-acylated starch alleviates depression-like behaviors in mice and its mechanisms[J].Food and Fermentation Industries, 2021, 47(6):26-33.
[39] SWANN O G, KILPATRICK M, BRESLIN M, et al.Dietary fiber and its associations with depression and inflammation[J].Nutrition Reviews, 2020, 78(5):394-411.
[40] PARK H S, KIM J, AHN S H, et al.Epigenetic targeting of histone deacetylases in diagnostics and treatment of depression[J].International Journal of Molecular Sciences, 2021, 22(10):5398.
[41] KUMAR J, RANI K, DATT C.Molecular link between dietary fibre, gut microbiota and health[J].Molecular Biology Reports, 2020, 47(8):6229-6237.
[42] 陈亚婷, 雷梦珠, 张波, 等.慢性应激诱导动物抑郁样行为机制研究进展[J].中国实验动物学报, 2023,31(6):811-819.
CHEN Y T, LEI M Z, ZHANG B, et al.Research progress on mechanisms underlying chronic-stress-induced depressive-liked behavior in animals[J].Acta Laboratorium Animalis Scientia Sinica, 2023,31(6):811-819.
[43] TSAI Y L, LIN T L, CHANG C J, et al.Probiotics, prebiotics and amelioration of diseases[J].Journal of Biomedical Science, 2019, 26(1):3.
[44] CHUDZIK A, ORZY OWSKA A, ROLA R, et al.Probiotics, prebiotics and postbiotics on mitigation of depression symptoms:Modulation of the brain-gut-microbiome axis[J].Biomolecules, 2021, 11(7):1000.
OWSKA A, ROLA R, et al.Probiotics, prebiotics and postbiotics on mitigation of depression symptoms:Modulation of the brain-gut-microbiome axis[J].Biomolecules, 2021, 11(7):1000.
[45] MA W J, NGUYEN L H, SONG M Y, et al.Dietary fiber intake, the gut microbiome, and chronic systemic inflammation in a cohort of adult men[J].Genome Medicine, 2021, 13(1):102.
[46] 郭丽. 菊粉通过肠道菌群调节色氨酸代谢干预精神分裂症小鼠神经炎症的作用及机制研究[D].银川:宁夏医科大学, 2022.
GUO L.Effects and mechanism of inulin on neuroinflammation in Schizophrenia mice by regulating tryptophan metabolism via gut microbiota[D].Yinchuan:Ningxia Medical University, 2022.
[47] GAO K, MU C L, FARZI A, et al.Tryptophan metabolism:A link between the gut microbiota and brain[J].Advances in Nutrition, 2020, 11(3):709-723.
[48] CORREIA A S, VALE N.Tryptophan metabolism in depression:A narrative review with a focus on serotonin and kynurenine pathways[J].International Journal of Molecular Sciences, 2022, 23(15):8493.
[49] DAVIDSON M, RASHIDI N, NURGALI K, et al.The role of tryptophan metabolites in neuropsychiatric disorders[J].International Journal of Molecular Sciences, 2022, 23(17):9968.
[50] PU J C, LIU Y Y, ZHANG H P, et al.An integrated meta-analysis of peripheral blood metabolites and biological functions in major depressive disorder[J].Molecular Psychiatry, 2021, 26(8):4265-4276.
[51] XIE T, JIN F, JIA X K, et al.High cellulose diet promotes intestinal motility through regulating intestinal immune homeostasis and serotonin biosynthesis[J].Biological Chemistry, 2021, 403(3):279-292.
[52] KUNDI Z M, LEE J C Y, PIHLAJAM KI J, et al.Dietary fiber from oat and rye brans ameliorate western diet-induced body weight gain and hepatic inflammation by the modulation of short-chain fatty acids, bile acids, and tryptophan metabolism[J].Molecular Nutrition &Food Research, 2021, 65(1):e1900580.
KI J, et al.Dietary fiber from oat and rye brans ameliorate western diet-induced body weight gain and hepatic inflammation by the modulation of short-chain fatty acids, bile acids, and tryptophan metabolism[J].Molecular Nutrition &Food Research, 2021, 65(1):e1900580.
[53] LIN C C, HUANG T L.Brain-derived neurotrophic factor and mental disorders[J].Biomedical Journal, 2020, 43(2):134-142.
[54] LI C, CAI Y Y, YAN Z X.Brain-derived neurotrophic factor preserves intestinal mucosal barrier function and alters gut microbiota in mice[J].The Kaohsiung Journal of Medical Sciences, 2018, 34(3):134-141.
[55] AGNIHOTRI N, MOHAJERI M H.Involvement of intestinal microbiota in adult neurogenesis and the expression of brain-derived neurotrophic factor[J].International Journal of Molecular Sciences, 2022, 23(24):15934.
[56] ZHUANG Y, ZENG R Y, LIU X, et al.Neoagaro-oligosaccharides ameliorate chronic restraint stress-induced depression by increasing 5-HT and BDNF in the brain and remodeling the gut microbiota of mice[J].Marine Drugs, 2022, 20(11):725.
[57] CARANDINI T, CERCIGNANI M, GALIMBERTI D, et al.The distinct roles of monoamines in multiple sclerosis:A bridge between the immune and nervous systems?[J].Brain, Behavior, and Immunity, 2021, 94:381-391.
[58] RUHÉ H G, MASON N S, SCHENE A H.Mood is indirectly related to serotonin, norepinephrine and dopamine levels in humans:A meta-analysis of monoamine depletion studies[J].Molecular Psychiatry, 2007, 12(4):331-359.
[59] TAO W W, WANG H Q, SU Q, et al.Paeonol attenuates lipopolysaccharide-induced depressive-like behavior in mice[J].Psychiatry Research, 2016, 238:116-121.
[60] YEHUDA R, SIEVER L J, TEICHER M H, et al.Plasma norepinephrine and 3-methoxy-4-hydroxyphenylglycol concentrations and severity of depression in combat posttraumatic stress disorder and major depressive disorder[J].Biological Psychiatry, 1998, 44(1):56-63.
[61] NOORI T, SUREDA A, SOBARZO-S NCHEZ E, et al.The role of natural products in treatment of depressive disorder[J].Current Neuropharmacology, 2022, 20(5):929-949.
NCHEZ E, et al.The role of natural products in treatment of depressive disorder[J].Current Neuropharmacology, 2022, 20(5):929-949.
[62] D’ALESSANDRO G, LAURO C, QUAGLIO D, et al.Neuro-signals from gut microbiota:Perspectives for brain glioma[J].Cancers, 2021, 13(11):2810.
[63] MITTAL R, DEBS L H, PATEL A P, et al.Neurotransmitters:The critical modulators regulating gut-brain axis[J].Journal of Cellular Physiology, 2017, 232(9):2359-2372.
[64] WU M, TIAN T, MAO Q, et al.Associations between disordered gut microbiota and changes of neurotransmitters and short-chain fatty acids in depressed mice[J].Translational Psychiatry, 2020, 10(1):350.
[65] KRISHNA G, DIVYASHRI G, PRAPULLA S G, et al.A combination supplement of fructo- and xylo-oligosaccharides significantly abrogates oxidative impairments and neurotoxicity in maternal/fetal milieu following gestational exposure to acrylamide in rat[J].Neurochemical Research, 2015, 40(9):1904-1918.
[66] EL MANSARI M, GUIARD B P, CHERNOLOZ O, et al.Relevance of norepinephrine-dopamine interactions in the treatment of major depressive disorder[J].CNS Neuroscience &Therapeutics, 2010, 16(3):e1-e17.