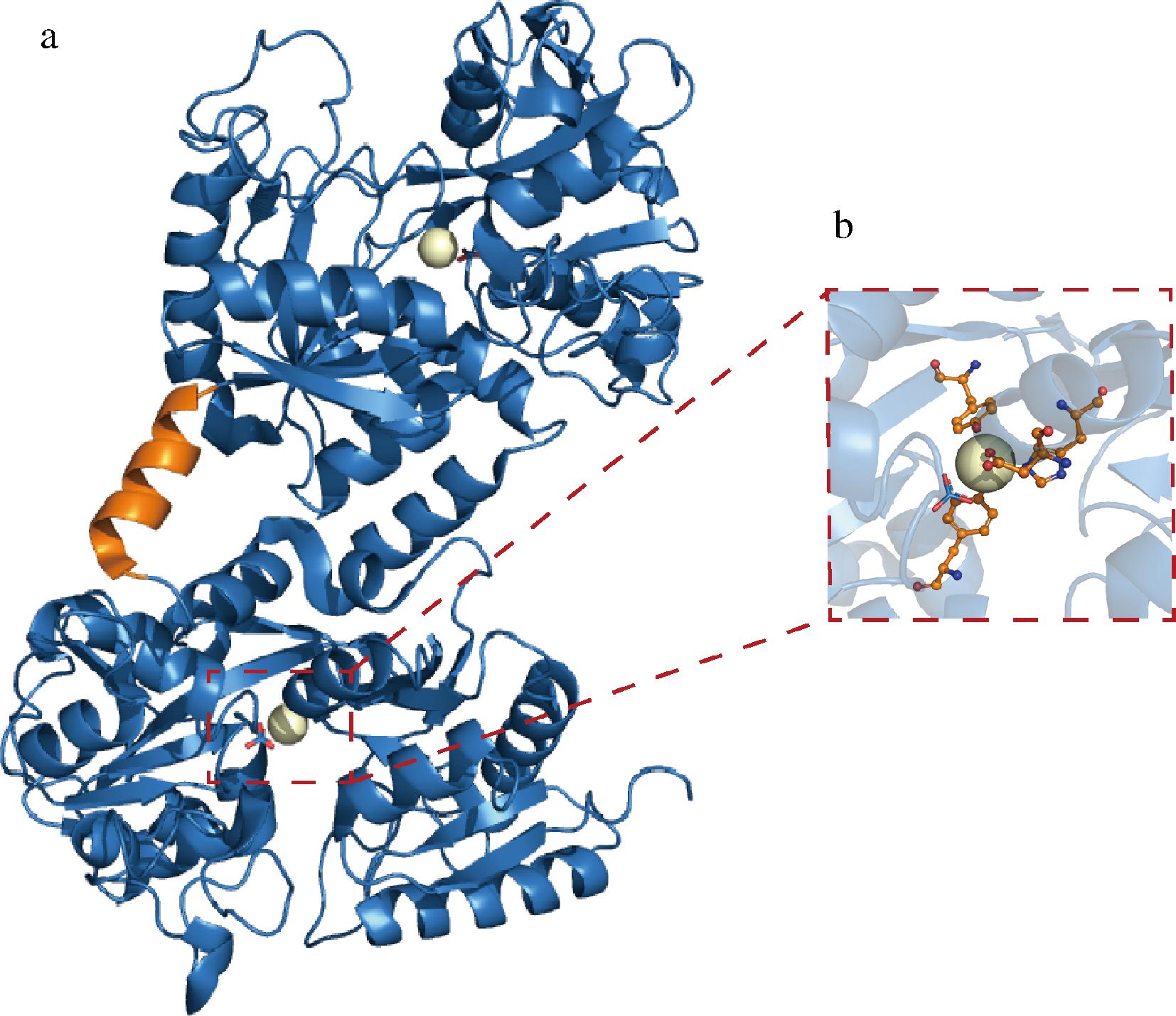
a-乳铁蛋白的三维构象;b-与金属离子相互作用的氨基酸残基位点
图1 乳铁蛋白的立体结构
Fig.1 The three-dimensional structure of lactoferrin
乳铁蛋白(lactoferrin,LF)是一种功能性糖蛋白,属于转铁蛋白家族,大约由700个氨基酸构成,分子质量在80 kDa左右[1]。1939年,SORENSEN等[2]首次从牛奶中分离得到了这种粉红色的蛋白质;1960年,JOHANSON[3]又从人乳中成功将其提取出来。人初乳中富含乳铁蛋白,平均浓度可达到6 g/L;随着时间的推移,浓度会降低并维持在1~2 g/L水平;牛初乳和常乳中的乳铁蛋白浓度分别为0.8 g/L左右和0.03~0.49 g/L,低于人初乳和常乳中的含量。除了普遍存在于哺乳动物的乳汁当中,乳铁蛋白还分布在胆汁、胃肠液、尿液、眼泪、唾液等各种黏膜分泌物里,同时也是次级中性粒细胞的重要组成成分[3-4]。
人乳铁蛋白(human lactoferrin,hLF)由703个氨基酸组成,METZ-BOUTIGUE等[5]在1984年完成了对其整体序列的测定;1989年,ANDERSON等[3]解析了人乳铁蛋白的晶体结构。乳铁蛋白的三维构象呈两个球形叶片状,N-叶与C-叶之间有40%左右的序列一致性,两者通过一段α螺旋连接。以人乳铁蛋白1FCK(文件1FCK来自PDB数据库)为例,N-叶与C-叶又各自分为2个结构域,结构域之间的裂隙是Fe3+的结合位点,结合时需要阴离子如CO32-的配合(图1)[6]。乳铁蛋白在哺乳动物当中的进化高度保守[7]。牛乳铁蛋白(bovine lactoferrin,bLF)的氨基酸序列与人乳铁蛋白有69%的一致性,两者的二级结构和三维构象几乎相同,仅在N-叶与C-叶的相对位置以及两者内部各自2个结构域闭合程度上略有差异[8]。除了人和牛之外,数据库里还包含其他8个物种的乳铁蛋白序列,分别来自鼠、马、猪、山羊、绵羊、水牛、牦牛和骆驼[9-10]。在不同的哺乳动物体内,乳铁蛋白含量存在显著差异,而针对不同来源的乳铁蛋白进行生化特性对比研究的报道很少[7]。

a-乳铁蛋白的三维构象;b-与金属离子相互作用的氨基酸残基位点
图1 乳铁蛋白的立体结构
Fig.1 The three-dimensional structure of lactoferrin
乳铁蛋白作为一种糖蛋白,通过Asn-X-Thr/Ser三肽中的天冬酰胺残基进行N-连接型糖基化。从氨基酸序列上可预测出,人乳铁蛋白有4个潜在位点,但研究结果表明,其中只有2个真正连接了糖链[5];牛乳铁蛋白有5个潜在位点,只有3个连接了糖链[8]。乳铁蛋白的空间构象和生物活性不受糖基化的直接影响,但其抵抗胰蛋白酶降解的能力会在糖基化之后增强,从而提升结构稳定性[11]。来自哺乳动物的天然乳铁蛋白带有复杂型糖链,而重组表达的乳铁蛋白,根据不同的表达系统和培养条件,具有多样性的糖基化形式,或者缺乏糖基化修饰[12]。
乳铁蛋白是哺乳动物固有免疫系统的重要组成成分,具有广泛的抵抗病原体的活性,包括抵抗细菌、真菌、病毒的能力及抗寄生虫能力等;同时,乳铁蛋白还具有抗氧化、抗癌、促进成骨细胞增殖以及免疫调节等功能[13-15]。
乳铁蛋白能够通过结合Fe3+限制细菌的生长。铁是大多数细菌生长所必需的元素,乳铁蛋白凭借高度的亲和力竞争性螯合Fe3+,从而抑制大肠杆菌、变形链球菌、霍乱弧菌等需铁细菌的生长,以及抑制铜绿假单胞菌等病原菌生物膜的形成[16];自身铁饱和度越低,乳铁蛋白的抑菌活性越强[17]。然而,铁争夺只是延缓了细菌的生长繁殖,补铁之后抑菌作用会消失[18]。
除了抑菌作用之外,乳铁蛋白还具有直接的杀菌活性。对于细胞壁含有脂多糖(lipopolysaccharide,LPS)的革兰氏阴性菌,乳铁蛋白能够与细胞外膜上的孔道蛋白结合,诱导LPS释放,从而增加外膜对疏水分子的通透性,有利于溶菌酶和其他抗菌分子进入菌体内部杀死细菌[19]。对于细胞壁含有负电性磷壁酸的革兰氏阳性菌,乳铁蛋白能够通过静电相互作用,以N-叶带正电荷的氨基酸残基与磷壁酸结合,打破非极性环境,改变膜通透性,使菌体因内部成分外泄而死[20]。
乳铁蛋白对包括酵母菌和霉菌在内的多种真菌病原体具有抑制或杀伤作用。FERNANDES等[21]评估了牛乳铁蛋白对22种酵母和24种霉菌的抗真菌活性,及其与6种广泛使用的抗真菌药物的协同效果。实验结果表明,牛乳铁蛋白对所有被测试的酵母菌具有广泛且一致的抑制能力,而只对4种霉菌有效果;其抑制酵母菌的活性会受到铁饱和度以及消化程度的影响。当牛乳铁蛋白与两性霉素B(amphotericin B,AMB)联合用于抑制真菌时,对22种酵母中的19种展现出高度的协同作用。LF-AMB能够促使菌体孔隙形成、菌丝变薄以及细胞塌陷,具有应用于抗真菌治疗的潜力。
乳铁蛋白能够诱导常见的条件致病菌——白色念珠菌的调节性细胞死亡。通过扫描电镜可观察到,暴露于乳铁蛋白的白色念珠菌细胞会出现膨胀、内容物泄露,或者表面凹陷、裂缝等变化,最终走向死亡。2008年,ANDRÉS等[22]首次证明了K+外流参与了这一细胞凋亡过程。K+通过离子通道流出导致渗透压变化,细胞发生收缩从而一定程度上促进了凋亡,而菌体细胞膜的通透性并未改变。2019年,该团队进一步提出,乳铁蛋白抑制Pma1p H+-ATPase活性导致细胞质酸化,才是调控细胞死亡通路的第一个转导信号[23]。除此之外,人乳铁蛋白诱导的白色念珠菌细胞凋亡样表型还包括磷脂酰丝氨酸外化、核染色质凝结、DNA降解和活性氧(reactive oxygen species,ROS)产生增加[22]。ACOSTA-ZALD VAR等[24]在酿酒酵母模型中研究该细胞凋亡机制时,进一步发现了乳铁蛋白能引起与ROS积累和细胞色素C释放相关的线粒体功能障碍,说明线粒体能量代谢在人乳铁蛋白的杀伤功效中起着关键作用。
VAR等[24]在酿酒酵母模型中研究该细胞凋亡机制时,进一步发现了乳铁蛋白能引起与ROS积累和细胞色素C释放相关的线粒体功能障碍,说明线粒体能量代谢在人乳铁蛋白的杀伤功效中起着关键作用。
乳铁蛋白对感染人类和动物的多种RNA及DNA病毒具有抗性,通常而言,缺铁型乳铁蛋白的抗病毒效果更为显著,但铁饱和型也能够起到一定的作用,可见铁饱和度并非决定性因素[25]。一些情况下,乳铁蛋白可以阻止病毒进入靶细胞,在病毒感染的早期发挥作用,如针对脊髓灰质炎病毒[26]、单纯疱疹病毒[27]、巨细胞病毒[28]以及艾滋病病毒[29];而另外一些情况下,乳铁蛋白还可以直接与病毒颗粒作用,阻止其发挥毒性或者抑制其在宿主细胞中的复制,如针对丙型肝炎病毒[30]和轮状病毒[31]。以轮状病毒为例,乳铁蛋白能够与病毒颗粒结合,阻止其吸附到靶细胞上,预防感染;而在轮状病毒感染过程中,乳铁蛋白能够干扰其合成抗原,即在病毒进入靶细胞后仍能保持抗病毒作用[31]。
关于乳铁蛋白的抗病毒作用,研究者们已经提出了几种机制,其中被广泛接受的,是乳铁蛋白结合并阻断糖胺聚糖病毒受体,特别是硫酸乙酰肝素,从而阻止病毒进入宿主细胞,避免了感染的发生[31]。但WEIMER等[32]的研究表明,体外与体内实验结果之间存在矛盾,乳铁蛋白的抗病毒机制仍有待进一步探索。
多项体内、体外试验表明,乳铁蛋白是一种具有生理活性的功能性蛋白质,参与调节免疫功能、调节铁吸收、促进肠道细胞增殖分化、促进成骨细胞增殖、抗氧化以及抗肿瘤等生物体内多种病理生理过程[33]。这些功能使得乳铁蛋白具有强大的应用价值和市场潜力,引起了食品与饲料行业及医学界的广泛关注。
2018年,中国营养学会妇幼营养分会发布《乳铁蛋白婴幼儿健康效应专家共识》,明确了LF能够降低婴幼儿、儿童呼吸道疾病和腹泻的发病率,降低新生儿坏死性小肠结肠炎和败血症的发病率和死亡率,提高儿童幽门螺杆菌根除率,促进幼儿生长发育[34]。4年之后,中国营养学会临床营养分会又发布了《乳铁蛋白临床应用中国专家共识》,进一步明确了LF功能特性的九大共识,将LF纳入专业医学视角,以期将LF合理应用到更多临床治疗场景[35]。截至目前,我国尚无添加LF的药品,成人可以通过摄入普通食品或者保健品进行补充。随着人们对LF了解的逐渐深入以及LF相关产品的推广普及,通过补充LF来提高免疫力和增强身体素质,有可能成为全民的共同选择。
乳铁蛋白因其独特的生物学活性,在食品、日用品、保健品和药品中都有广阔的应用空间。通过转基因表达系统在工业级别上生产重组乳铁蛋白,既可以打破因畜牧业规模和产业结构带来的产量限制,又可以解决人源乳铁蛋白获得困难的问题。多数已开发的表达系统生产的重组乳铁蛋白,在物理、生化和生物学特性上,与天然乳铁蛋白相比没有显著区别[36]。
已报道的成功用于乳铁蛋白异源表达的细菌有大肠杆菌、枯草芽孢杆菌和干酪乳杆菌等。大肠杆菌表达系统具有操作简单、遗传背景清晰、成本低廉等优势,劣势是重组蛋白缺乏合适的翻译后加工修饰,无法通过连接糖链阻止聚集而多以包涵体形式存在[12]。另外,大肠杆菌细胞壁外膜中的脂多糖可在临床上引起多种生理和病理反应[37],以及大肠杆菌本身作为条件致病菌,对人体健康也存在风险;因此,以大肠杆菌为宿主生产乳铁蛋白,必须对最终产品的内毒素残留水平和微生物指标进行严格的监测。枯草芽孢杆菌和干酪乳杆菌虽然没有大肠杆菌应用广泛,但这两种菌株作为一般认为安全(generally recognized as safe,GRAS)菌株,在安全性上具有先天优势。
WANG等[9]通过BL21(DE3)表达系统获得了昆明小鼠乳铁蛋白及其N-叶部分,经镍柱纯化后产量分别为17 mg/L和20 mg/L;由于两者均以包涵体的形式存在,因此抗菌效果不够理想。HU等[38]通过BL21(DE3)表达系统获得了以包涵体形式存在的人乳铁蛋白C-叶部分,经纯化和复性处理后产量为700 mg/L;与全长人乳铁蛋白相比,该工作中表达的乳铁蛋白C-叶具有更强的抑制人乳腺癌细胞MDA-MB-231的能力,这可能要归因C-叶独特的空间构象和高底物亲和力,更加详细的抗肿瘤机制有待进一步研究。GAR
 A-MONTOYA等[39]通过BL21(DE3)成功表达了牛乳铁蛋白-硫氧还蛋白融合蛋白,产量为15.3 mg/L;经凝血酶和胃蛋白酶处理所得的乳铁蛋白肽,对大肠杆菌的抑制作用是未处理样品的4倍。JIN等[40]以枯草芽孢杆菌为宿主,通过优化氨基酸密码子和选择最优启动子Pveg,成功表达了牛乳铁蛋白N-叶,纯化后产量为16.5 mg/L。表达产物对大肠杆菌、铜绿假单胞菌和金黄色葡萄球菌均表现出明显的抑菌活性。
A-MONTOYA等[39]通过BL21(DE3)成功表达了牛乳铁蛋白-硫氧还蛋白融合蛋白,产量为15.3 mg/L;经凝血酶和胃蛋白酶处理所得的乳铁蛋白肽,对大肠杆菌的抑制作用是未处理样品的4倍。JIN等[40]以枯草芽孢杆菌为宿主,通过优化氨基酸密码子和选择最优启动子Pveg,成功表达了牛乳铁蛋白N-叶,纯化后产量为16.5 mg/L。表达产物对大肠杆菌、铜绿假单胞菌和金黄色葡萄球菌均表现出明显的抑菌活性。
乳铁蛋白具有广谱抑菌性,但在以上工作中,重组乳铁蛋白均在细胞内完成表达,似乎并未对宿主产生毒害作用,研究者们没有就此问题开展讨论。对于干酪乳杆菌表达体系,情况则又有不同。由于乳酸菌可以适应缺铁环境,乳铁蛋白的存在不会对其活力产生负面影响,反而是可以促进肠道内双歧杆菌和乳酸杆菌的增殖[41-42]。CHEN等[43]将干酪乳杆菌作为宿主表达人乳铁蛋白,产物在培养基中的浓度达到了10.6 mg/L。以重组干酪乳杆菌对小鼠进行灌胃试验,与使用野生型菌株灌胃的对照组相比,实验组小鼠对致病性大肠杆菌表现出更强的抵抗能力和更低的肠道损伤,说明该重组干酪乳杆菌具有作为肠道微生态制剂的潜力。
酵母表达系统具有培育周期短、操作简单的特点,同时还具有翻译后加工修饰的功能,重组产物多以高甘露糖基化的糖蛋白形式存在;除此之外,目的蛋白还可以通过分泌途径分泌至酵母细胞外,提取程序简单。相比于大肠杆菌等常用的原核表达体系,使用酵母表达乳铁蛋白更便于工业化生产[12, 44]。
LIANG等[45]在1993年以酿酒酵母为宿主成功表达了重组人乳铁蛋白。在该表达系统中,部分产物可以通过酵母转化酶信号肽分泌至细胞外,培养液中浓度为1.5~2 mg/L,还有部分产物残留在细胞内。测试结果表明,分泌型重组目的蛋白的结构经过了糖基化修饰,且具有Fe2+和Cu2+结合能力。然而,在后期进行大规模培养时,出现了产物表达量显著低于前期测试水平的现象,作者推测可能是由于乳铁蛋白对酵母细胞具有毒性从而导致了表达量难以稳定。并且,在表达分子质量高于30 kDa的外源蛋白时,酿酒酵母在分泌效率上不占优势[46],所以此后更多的团队把毕赤酵母表达重组乳铁蛋白作为研究方向。
PARAMASIVAM等[47]首次在毕赤酵母中成功表达了完整的马乳铁蛋白,摇瓶中的产量达到16.5 mg/L,圆二色光谱测试结果证实了产物具有合理的空间构象。IGLESIAS-FIGUEROA等[48]将牛乳铁蛋白在毕赤酵母KM71-H中进行胞内表达,最终产量达到3.5 g/L,表达产物对大肠杆菌、金黄色葡萄球菌和部分铜绿假单胞菌具有抑制作用。该工作中,目的蛋白的表达量非常可观,但由于需要对菌体进行裂解以及对包涵体进行复性处理,纯化工艺复杂,所以工业化难度较大。此外,来源于藏羊[49]、牦牛[10]的乳铁蛋白也都在毕赤酵母中得到了成功表达,分泌表达量分别为60 mg/L和40 mg/L,且产物均具有相应的抑菌活性。
在毕赤酵母中,最常用的醇氧化酶启动子需要通过甲醇进行诱导,使得该表达体系在生产应用时存在安全隐患。以上研究均处于实验室阶段,未对该问题进行讨论。如果项目进入到了投产阶段,那么对每批次的产品进行跟踪检测,确保甲醇残留量在历经纯化、干燥等工艺后已降低至安全限量以下,是不可缺少的程序。
霉菌作为生产蛋白质的细胞工厂,具有很多独特的优势。它具有强大的蛋白表达能力和分泌途径,能够正确地进行各种翻译后处理,包括糖基化、多肽链剪切、二硫键形成等,并且能够将错误折叠的蛋白快速清除[50]。更加重要的是,霉菌还具有很强的生存能力,这使得它优于以大肠杆菌、毕赤酵母为代表的原核体系和酵母体系,尤其适合作为生产乳铁蛋白这种具有广谱抗菌性的“毒蛋白”的底盘细胞。
来自Baylor医学院的Ward课题组,是最早在霉菌中异源表达哺乳动物糖蛋白的团队。1992年,该课题组在构巢曲霉中表达人乳铁蛋白,获得了5 mg/L的产量[51];同时期在米曲霉中表达人乳铁蛋白,分泌表达量为25 mg/L,且重组产物与天然乳铁蛋白具有相同的分子质量、铁结合能力以及免疫活性[52]。1995年,该团队又进一步在泡盛曲霉中将人乳铁蛋白与葡萄糖淀粉酶进行融合表达,再通过内源性KEX-2肽酶切割加工成为成熟的乳铁蛋白,该重组产物具有与人肠细胞受体结合的能力,且分泌表达产量高达2 g/L,已具备商业化价值[53]。虽然基于该重组乳铁蛋白开发的药物,因在三期临床试验中与安慰剂组相比没有疗效上的差异[54],未能成功走向市场,但该研究仍让我们窥见了霉菌体系生产重组乳铁蛋白走向产业化的可能。
在动物细胞系和转基因动物中诱导表达重组产物,是目前基础研究、生物制药以及基因治疗的重要研究方向[55]。通过哺乳动物细胞表达目的蛋白,能够获得与天然蛋白在结构和功能上更加一致的产物;但由于细胞培养对专业技术和经济投入的较高要求,难以避免地在规模化应用上受到限制[56]。通过转基因动物生产目的蛋白,乳腺细胞无疑是最理想的表达场所;乳腺是外分泌器官,乳汁不会进入体循环影响宿主的生理代谢,且重组蛋白在分泌过程中已经过充分的加工和修饰,一般具有稳定的生物活性[57]。
目前,人乳铁蛋白已在转基因小鼠、山羊、猪和牛中得到了成功表达,产量从3 g/L到30 g/L不等,重组产物均与天然人乳铁蛋白具有相似的铁结合释放特性以及抗菌能力[56,58-61]。荷兰Pharming公司联合莱顿大学[60]克隆的转基因小鼠能够在泌乳期分泌人乳铁蛋白,分泌量可达13 g/L,但是小鼠乳腺的尺寸限制了乳铁蛋白的规模化生产,相比之下,奶牛乳腺生物反应器是更加理想的靶蛋白表达系统。该团队又通过核显微注射法克隆了转基因牛,重组人乳铁蛋白的表达水平在整个泌乳期内保持平稳,产量达到3 g/L,且未影响牛奶的总体产量及理化参数[61]。WANG等[56]采用相比于显微注射更加简单高效的核转染法,获得了无抗生素标记的高拷贝细菌人工染色体(bacterial artifcial chromosome,BAC)转基因牛,克隆牛表达的人乳铁蛋白产量可达4.5~13.6 g/L。该团队通过进一步的胚胎移植繁育了200头转基因牛,表明转基因牛乳腺生物反应器具有大规模生产蛋白质的潜力;但另一方面,转基因动物群的饲养仍要依赖传统的养殖模式,在投入产出比和可持续发展上还需要更多考量。
表1 乳铁蛋白的表达系统
Table 1 Various expression systems of recombinant lactoferrin

表达系统来源载体/启动子分子质量产量参考文献细菌大肠杆菌(Escherichia coli)干酪乳杆菌(Lactobacillus casei)枯草芽孢杆菌(Bacillus subtilis)小鼠(mouse)牛(bovine)人(human)人(human)人(human)pET28a(+)87.3 kDa17 mg/L[9]pET28a(+)40.9 kDa20 mg/L[9]pET32a(+)96 kDa15.3 mg/L[39]pET28a(+)39 kDa700 mg/L[38]pSD78 kDa10.6 mg/L[43]pMA0911NR16.5 mg/L[40]酵母酿酒酵母(Saccharomyces cerevisiae)毕赤酵母(Komagatella pastoris)人(human)pCGY144482 kDa1.5~2 mg/L[45]马(equine)pPIC9K80 kDa40 mg/L[47]藏羊(Tibetan sheep)pPICZαA76 kDa60 mg/L[49]牛(bovine)pJ90280 kDa3 500 mg/L[48]霉菌构巢曲霉(Aspergillus nidulans)人(human)pAL3 hLFTNR5 mg/L[51]米曲霉(Aspergillus oryzae)人(human)pAhLFG78 kDa25 mg/L[52]泡盛曲霉(Aspergillus awamori)人(human)pPLF-1978 kDa2 000 mg/L[53]动物细胞系BHK细胞(Baby-hamster kidney cells,幼仓鼠肾细胞)人(human)pNUTNR20 mg/L[62]CHO细胞(Chinese hamster ovary cells,中国仓鼠卵巢细胞)人(human)pTT580 kDa200 mg/L[63]转基因动物小鼠(Mus musculus)牛(Bos taurus)山羊(Capra hircus)猪(Sus scrofa)人(human)人(human)人(human)人(human)人(human)人(human)bovine αS1-caseinbovine αS1-caseinBACpBC-hLFNRpBAC-hLF-LZ-NeohLF BACNR13 g/L[60]77 kDa3 g/L[61]79 kDa4.5~13.6 g/L[56]80 kDa30 g/L[58]80 kDa2~16 g/L[64]80 kDa6.5 g/L[59]
注:NR-文献中未提及。
3.1.1 天然乳铁蛋白
2000年,美国食品药品管理局(Food and Drug Administration,FDA)首次批准bLF为GRAS物质,可用于特定食品的生产;2012年,欧盟委员会批准bLF可添加于特定食品中以强化其健康功能。关于应用范围和使用限量,美国FDA陆续许可将bLF用于婴幼儿配方乳粉、调制乳粉、风味发酵乳、冰淇淋、甜点及口香糖等产品中,添加量在100~400 mg/100 g;欧盟允许bLF应用的范围更广,除上述品类外,还包括饮料、糖果、糕点以及奶酪基产品等,添加量在80~3 000 mg/100 g[65]。
在我国,乳铁蛋白属于食品添加剂当中的细分类别——营养强化剂,产品规格按照GB 1903.17—2016《食品安全国家标准 食品营养强化剂 乳铁蛋白》进行管理,使用限量的发展历程见表2。根据GB 14880—2012 《食品安全国家标准 营养强化剂使用标准》,乳铁蛋白可添加到调制乳、风味发酵乳和含乳饮料中,使用量≤1.0 g/kg;可用在婴幼儿配方食品中,使用量≤1.0 g/kg(限粉状产品,液态按稀释倍数折算)。2012年,卫生部发布第15号公告,附件4《铁等8种扩大使用范围及用量的食品营养强化剂》中规定,乳铁蛋白可用于调制乳粉,使用量≤1.0 g/kg。2013年,卫生计生委发布第11号文件《关于批准抗坏血酸钠等8种食品添加剂扩大使用范围用量的公告》,乳铁蛋白在婴幼儿配方食品中的最大使用量为1.0 g/L,以即食状态计,粉状产品按冲调倍数增加使用量。
表2 乳铁蛋白的使用规定
Table 2 Regulations for the application of lactoferrin

信息发布食品类别使用量GB 14880—2012《食品安全国家标准 营养强化剂使用标准》调制乳≤1.0 g/kg风味发酵乳≤1.0 g/kg含乳饮料≤1.0 g/kg婴幼儿配方食品≤1.0 g/kg(粉状)卫生部公告2012年第15号调制乳粉≤1.0 g/kg卫生计生委公告2013年第11号婴幼儿配方食品≤1.0 g/L(即食)
3.1.2 重组乳铁蛋白
现阶段,我国尚未出台任何关于重组乳铁蛋白的使用标准和政策,国外也没有关于重组乳铁蛋白的安全食用历史。2021年,国家卫健委正式打开了转基因食品添加剂新品种的申报路径,如果针对重组乳铁蛋白进行申报,需要先根据《农业转基因生物安全管理条例》和《农业转基因生物安全评价管理办法》对产品进行转基因生物安全评价;取得农业农村部出具的转基因安全评价证书之后,再参照《食品添加剂新品种管理办法》和《食品添加剂新品种申报与受理规定》向国家卫生计生委提出关于食品添加剂新品种生产与经营的申请。
1985年,比利时Oleofina公司成为首家商业化生产牛乳铁蛋白的企业。1989年,日本森永乳业开始在德国Milei公司生产牛乳铁蛋白。随后,新西兰新莱特、荷兰皇家菲仕兰、澳洲百斯顿等公司也加入进来,全球乳铁蛋白年产量从2006年的不足80 t上升至2015年的221 t,并在2021年达到300 t左右[66-67]。2022年5月,飞鹤首条乳铁蛋白自动化生产线也已正式投产,开创了国内乳业先河。1986年,森永乳业首次将乳铁蛋白应用于婴儿配方乳粉的生产。历经多年发展,乳铁蛋白在日本的应用范围已扩大至酸奶、饮料、营养补充剂、宠物食品、牙膏和化妆品等,在产品中起到改善肠道菌群、免疫调节、抗氧化、抗感染等作用[66,68]。目前,我国对乳铁蛋白的应用多集中在婴幼儿配方乳粉和保健食品领域,原料主要依赖进口。
重组人乳铁蛋白(recombinant human lactoferrin,rhLF)在抗菌、铁的结合释放性能等方面与天然人乳铁蛋白(hLF)具有相似的性质。体外试验结果表明,胃蛋白酶能在60 min内将rhLF完全消化,与hLF的消化情况相似。截至目前,没有关于人类对乳铁蛋白这种存在于自身分泌腺中的物质过敏的报道。因此,对具有相同氨基酸序列的外源蛋白质过敏的可能性几乎可以忽略不计[69]。另外,戴亚妮等[70]通过急性经口毒性试验和90 d喂养试验证明,rhLF属无毒级产品,无亚慢性毒性,无潜在的食用安全风险。
2022年8月,新加坡生物技术公司TurtleTree宣布,将通过发酵技术(乳腺细胞)生产重组牛乳铁蛋白产品,专注于婴儿营养、免疫、肠道健康等方面的研究,并计划于2023年率先在美国推出商业化产品[71]。De Novo Dairy是首家总部位于南非的精密发酵公司,这家初创公司通过毕赤酵母表达体系生产rhLF,并计划在2023年将新产品推向市场[72]。
重组乳铁蛋白的二级和三级结构与天然乳铁蛋白基本一致,来自不同表达体系的产品虽然在糖基化方面存在差异,但生物活性几乎不受影响。同时,重组乳铁蛋白在产量与规格上更具可控性,在生产上更加高效、环保、可持续,高度符合“未来食品”的特征。随着合成生物学的快速发展,以及法规管理的与时俱进,一些勇于创新的生物技术公司已经开始对重组乳铁蛋白的商业化进行布局,未来有望出现重组产品与天然产品在市场上并驾齐驱的景象。
在表达体系的考量上,相比于仍要依赖传统养殖模式的转基因动物,以及培养成本居高不下的哺乳动物细胞,能够对重组蛋白进行翻译后修饰的酵母和霉菌无疑是更加具有竞争力的选择。鉴于乳铁蛋白具有广谱抑菌性,想要获得高效分泌和表达的菌株,宿主细胞对重组乳铁蛋白的耐受程度是关键因素。或许,可以通过高通量筛选或者底盘细胞改造等手段,获得具有商业价值的高产菌株,最终促成重组乳铁蛋白的产业化之路。
[1] SCHANBACHER F L, GOODMAN R E, TALHOUK R S.Bovine mammary lactoferrin:Implications from messenger ribonucleic acid (mRNA) sequence and regulation contrary to other milk Proteins[J].Journal of Dairy Science, 1993, 76(12):3812-3831.
[2] SORENSEN M, SORENSEN S P L. The proteins in whey[J]. Comptes rendus des Travaux du Laboratoire Carlsberg, 1939, 23(7): 55-99.
[3] JOHANSON B. Isolation of an iron-containing red protein from milk[J]. Acta Chemica Scandinavica, 1960, 14(2): 510-512.
[4] WANG B, TIMILSENA Y P, BLANCH E, et al.Lactoferrin:Structure, function, denaturation and digestion[J].Critical Reviews in Food Science and Nutrition, 2019, 59(4):580-596.
[5] METZ-BOUTIGUE M H, JOLL S J, MAZURIER J, et al.Human lactotransferrin:Amino acid sequence and structural comparisons with other transferrins[J].European Journal of Biochemistry, 1984, 145(3):659-676.
S J, MAZURIER J, et al.Human lactotransferrin:Amino acid sequence and structural comparisons with other transferrins[J].European Journal of Biochemistry, 1984, 145(3):659-676.
[6] BAKER H M, BAKER C J, SMITH C A, et al.Metal substitution in transferrins:Specific binding of cerium(IV) revealed by the crystal structure of cerium-substituted human lactoferrin[J].Journal of Biological Inorganic Chemistry:JBIC:a Publication of the Society of Biological Inorganic Chemistry, 2000, 5(6):692-698.
[7] TENG C T.Lactoferrin gene expression and regulation:An overview[J].Biochemistry and Cell Biology, 2002, 80(1):7-16.
[8] MOORE S A, ANDERSON B F, GROOM C R, et al.Three-dimensional structure of diferric bovine lactoferrin at 2.8 Å resolution[J].Journal of Molecular Biology, 1997, 274(2):222-236.
[9] WANG J R, TIAN Z G, TENG D, et al.Cloning, expression and characterization of Kunming mice lactoferrin and its N-lobe[J].Biometals:an International Journal on the Role of Metal Ions in Biology, Biochemistry, and Medicine, 2010, 23(3):523-530.
[10] DONG Z Y, ZHANG Y Z.Molecular cloning and expression of yak (Bos grunniens) lactoferrin cDNA in Pichia pastoris[J].Biotechnology Letters, 2006, 28(16):1285-1292.
[11] SUN X L, BAKER H M, SHEWRY S C, et al.Structure of recombinant human lactoferrin expressed in Aspergillus awamori[J].Acta Crystallographica.Section D, Biological Crystallography, 1999, 55(Pt 2):403-407.
[12] 许强, 王克夷.异源表达系统中蛋白质糖基化[J].生物化学与生物物理学报, 1999(2):111-115.
XU Q, WANG K Y.Protein glycosylation in heterologous expression system[J].Acta Biochimica et Biophysica Sinica, 1999(2):111-115.
[13] WANG X Y, GUO H Y, ZHANG W, et al.Effect of iron saturation level of lactoferrin on osteogenic activity in vitro and in vivo[J].Journal of Dairy Science, 2013, 96(1):33-39.
[14] LEGRAND D, ELASS E, CARPENTIER M, et al.Lactoferrin:A modulator of immune and inflammatory responses[J].Cellular and Molecular Life Sciences:CMLS, 2005, 62(22):2549-2559.
[15] HAYES T G, FALCHOOK G F, VARADHACHARY G R, et al.Phase I trial of oral talactoferrin Alfa in refractory solid tumors[J].Investigational New Drugs, 2006, 24(3):233-240.
[16] SINGH P K, PARSEK M R, GREENBERG E P, et al.A component of innate immunity prevents bacterial biofilm development[J].Nature, 2002, 417(6888):552-555.
[17] YAMAUCHI K, TOMITA M, GIEHL T J, et al.Antibacterial activity of lactoferrin and a pepsin-derived lactoferrin peptide fragment[J].Infection and Immunity, 1993, 61(2):719-728.
[18] VALENTI P, ANTONINI G.Lactoferrin:An important host defence against microbial and viral attack[J].Cellular and Molecular Life Sciences:CMLS, 2005, 62(22):2576-2587.
[19] ELLISON R T, GIEHL T J.Killing of gram-negative bacteria by lactoferrin and lysozyme[J].Journal of Clinical Investigation, 1991, 88(4):1080-1091.
[20] ONISHI J, ROY M K, JUNEJA L R, et al.A lactoferrin-derived peptide with cationic residues concentrated in a region of its helical structure induces necrotic cell death in a leukemic cell line (HL-60)[J].Journal of Peptide Science:an Official Publication of the European Peptide Society, 2008, 14(9):1032-1038.
[21] FERNANDES K E, WEEKS K, CARTER D A.Lactoferrin is broadly active against yeasts and highly synergistic with amphotericin B[J].Antimicrobial Agents and Chemotherapy, 2020, 64(5):e02284-e02219.
[22] ANDRÉS M T, VIEJO-D AZ M, FIERRO J F.Human lactoferrin induces apoptosis-like cell death in Candida albicans:Critical role of K+-channel-mediated K+ efflux[J].Antimicrobial Agents and Chemotherapy, 2008, 52(11):4081-4088.
AZ M, FIERRO J F.Human lactoferrin induces apoptosis-like cell death in Candida albicans:Critical role of K+-channel-mediated K+ efflux[J].Antimicrobial Agents and Chemotherapy, 2008, 52(11):4081-4088.
[23] ANDRÉS M T, ACOSTA-ZALD VAR M, GONZ
VAR M, GONZ LEZ-SEISDEDOS J, et al.Cytosolic acidification is the first transduction signal of lactoferrin-induced regulated cell death pathway[J].International Journal of Molecular Sciences, 2019, 20(23):5838.
LEZ-SEISDEDOS J, et al.Cytosolic acidification is the first transduction signal of lactoferrin-induced regulated cell death pathway[J].International Journal of Molecular Sciences, 2019, 20(23):5838.
[24] ACOSTA-ZALD VAR M, ANDRÉS M T, REGO A, et al.Human lactoferrin triggers a mitochondrial- and caspase-dependent regulated cell death in Saccharomyces cerevisiae[J].Apoptosis:an International Journal on Programmed Cell Death, 2016, 21(2):163-173.
VAR M, ANDRÉS M T, REGO A, et al.Human lactoferrin triggers a mitochondrial- and caspase-dependent regulated cell death in Saccharomyces cerevisiae[J].Apoptosis:an International Journal on Programmed Cell Death, 2016, 21(2):163-173.
[25] HAMMER J, HAAHEIM H, GUTTEBERG T, et al.Bovine lactoferrin is more efficient than bovine lactoferricin in inhibiting HSV-I/-II replication in vitro[Z].Lactoferrin:structure, function and applications.Elsevier Science.2000:239-243
[26] MARCHETTI M, SUPERTI F, AMMENDOLIA M G, et al.Inhibition of poliovirus type 1 infection by iron-, manganese- and zinc-saturated lactoferrin[J].Medical Microbiology and Immunology, 1999, 187(4):199-204.
[27] HASEGAWA K, MOTSUCHI W, TANAKA S, et al.Inhibition with lactoferrin of in vitro infection with human herpes virus[J].Japanese Journal of Medical Science &Biology, 1994, 47(2):73-85.
[28] BELJAARS L, VAN DER STRATE B W A, BAKKER H I, et al.Inhibition of cytomegalovirus infection by lactoferrin in vitro and in vivo[J].Antiviral Research, 2004, 63(3):197-208.
[29] PUDDU P, BORGHI P, GESSANI S, et al.Antiviral effect of bovine lactoferrin saturated with metal ions on early steps of human immunodeficiency virus type 1 infection[J].The International Journal of Biochemistry &Cell Biology, 1998, 30(9):1055-1063.
[30] IKEDA M, NOZAKI A, SUGIYAMA K, et al.Characterization of antiviral activity of lactoferrin against hepatitis C virus infection in human cultured cells[J].Virus Research, 2000, 66(1):51-63.
[31] VAN DER STRATE B W A, BELJAARS L, MOLEMA G, et al.Antiviral activities of lactoferrin[J].Antiviral Research, 2001, 52(3):225-239.
[32] WEIMER K E D, ROARK H, FISHER K, et al.Breast milk and saliva lactoferrin levels and postnatal cytomegalovirus infection[J].American Journal of Perinatology, 2021, 38(10):1070-1077.
[33] SUPERTI F.Lactoferrin from bovine milk:A protective companion for life[J].Nutrients, 2020, 12(9):2562.
[34] 中国营养学会妇幼营养分会. 乳铁蛋白婴幼儿健康效应专家共识[J].临床儿科杂志, 2018, 36(11):884-888.
Maternal and Child Nutrition Branch of Chinese Nutrition Society.Expert consensus on the health effects of lactofemic in infants and young children[J].Journal of Clinical Pediatrics, 2018, 36(11):884-888.
[35] 中国医疗保健国际交流促进会营养与代谢管理分会. 乳铁蛋白临床应用中国专家共识[J].中华预防医学杂志, 2022, 56(12):1694-1701.
Nutrition and Metabolism Management Branch of China International Exchange and Promotive Association for Medical and Health Care.Consensus of Chinese experts on clinical application of lactoferrin[J].Chinese Journal of Preventive Medicine, 2022, 56(12):1694-1701.
[36] GONZ LEZ-CH
LEZ-CH VEZ S A, ARÉVALO-GALLEGOS S, RASC
VEZ S A, ARÉVALO-GALLEGOS S, RASC N-CRUZ Q.Lactoferrin:Structure, function and applications[J].International Journal of Antimicrobial Agents, 2009, 33(4):301.e1-301.e8.
N-CRUZ Q.Lactoferrin:Structure, function and applications[J].International Journal of Antimicrobial Agents, 2009, 33(4):301.e1-301.e8.
[37] 刘中原, 李延平.细菌脂多糖的生物活性及作用机制[J].医学综述, 2010, 16(2):166-169.
LIU Z Y, LI Y P.Biological activity and mechanism of bacterial lipopolysaccharide[J].Medical Recapitulate, 2010, 16(2):166-169.
[38] HU L L, GAO C H, HONG C, et al.Expression, purification, and breast cancer cell inhibiting effect of recombinant human lactoferrin C-lobe[J].Bioscience, Biotechnology, and Biochemistry, 2016, 80(2):257-263.
[39] GARC A-MONTOYA I, GONZ
A-MONTOYA I, GONZ LEZ-CH
LEZ-CH VEZ S A, SALAZAR-MART
VEZ S A, SALAZAR-MART NEZ J, et al.Expression and characterization of recombinant bovine lactoferrin in E.coli[J].Biometals:an International Journal on the Role of Metal Ions in Biology, Biochemistry, and Medicine, 2013, 26(1):113-122.
NEZ J, et al.Expression and characterization of recombinant bovine lactoferrin in E.coli[J].Biometals:an International Journal on the Role of Metal Ions in Biology, Biochemistry, and Medicine, 2013, 26(1):113-122.
[40] JIN L, LI L H, ZHOU L X, et al.Improving expression of bovine lactoferrin N-lobe by promoter optimization and codon engineering in Bacillus subtilis and its antibacterial activity[J].Journal of Agricultural and Food Chemistry, 2019, 67(35):9749-9756.
[41] WEINBERG E D.The Lactobacillus anomaly:Total iron abstinence[J].Perspectives in Biology and Medicine, 1997, 40(4):578-583.
[42] GRZYWACZ K, BUTCHER J, ROMAIN G, et al.The impact of probiotics and lactoferrin supplementation on piglet gastrointestinal microbial communities[J].Biometals:an International Journal on the Role of Metal Ions in Biology, Biochemistry, and Medicine, 2019, 32(3):533-543.
[43] CHEN H L, LAI Y W, CHEN C S, et al.Probiotic Lactobacillus casei expressing human lactoferrin elevates antibacterial activity in the gastrointestinal tract[J].Biometals:an International Journal on the Role of Metal Ions in Biology, Biochemistry, and Medicine, 2010, 23(3):543-554.
[44] JENKINS N, PAREKH R B, JAMES D C.Getting the glycosylation right:Implications for the biotechnology industry[J].Nature Biotechnology, 1996, 14(8):975-981.
[45] LIANG Q W, RICHARDSON T.Expression and characterization of human lactoferrin in yeast Saccharomyces cerevisiae[J].Journal of Agricultural and Food Chemistry, 1993, 41(10):1800-1807.
[46] 唐香山, 张学文.酿酒酵母表达系统[J].生命科学研究, 2004, 8(S1):106-109.
TANG X S, ZHANG X W.Saccharomyces serevisiae expression system[J].Life Science Research, 2004, 8(S1):106-109.
[47] PARAMASIVAM M, SARAVANAN K, UMA K, et al.Expression, purification, and characterization of equine lactoferrin in Pichia pastoris[J].Protein Expression and Purification, 2002, 26(1):28-34.
[48] IGLESIAS-FIGUEROA B, VALDIVIEZO-GODINA N, SIQUEIROS-CEND N T, et al.High-level expression of recombinant bovine lactoferrin in Pichia pastoris with antimicrobial activity[J].International Journal of Molecular Sciences, 2016, 17(6):902.
N T, et al.High-level expression of recombinant bovine lactoferrin in Pichia pastoris with antimicrobial activity[J].International Journal of Molecular Sciences, 2016, 17(6):902.
[49] LI J B, ZHU W Z, LUO M R, et al.Molecular cloning, expression and purification of lactoferrin from Tibetan sheep mammary gland using a yeast expression system[J].Protein Expression and Purification, 2015, 109:35-39.
[50] ZHANG T, LIU H, LV B, et al.Regulating strategies for producing carbohydrate active enzymes by filamentous fungal cell factories[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:691.
[51] WARD P P, MAY G S, HEADON D R, et al.An inducible expression system for the production of human lactoferrin in Aspergillus nidulans[J].Gene, 1992, 122(1):219-223.
[52] WARD P P, LO J Y, DUKE M, et al.Production of biologically active recombinant human lactoferrin in Aspergillus oryzae[J].Bio/technology (Nature Publishing Company), 1992, 10(7):784-789.
[53] WARD P P, PIDDINGTON C S, CUNNINGHAM G A, et al.A system for production of commercial quantities of human lactoferrin:A broad spectrum natural antibiotic[J].Bio/technology (Nature Publishing Company), 1995, 13(5):498-503.
[54] RAMALINGAM S S, CRAWFORD J, CHANG A, et al.Fortis-M, a randomized, double-blind, placebo-controlled phase 3 study of oral talactoferrin Alfa with best supportive care in patients with advanced non-small cell lung cancer following two or more prior regimens- by the fortis-M study group[J].Annals of Oncology, 2012, 23:ixe23.
[55] WEBER W, FUSSENEGGER M.Inducible gene expression in mammalian cells and mice[J].Methods in Molecular Biology, 2004, 267:451-466.
[56] WANG M, SUN Z L, YU T, et al.Large-scale production of recombinant human lactoferrin from high-expression, marker-free transgenic cloned cows[J].Scientific Reports, 2017, 7(1):10733.
[57] CUI S X, LV X Q, SUN G Y, et al.Recent advances and prospects in purification and heterologous expression of lactoferrin[J].Food Bioengineering, 2022, 1(1):58-67.
[58] YU H Q, CHEN J Q, SUN W, et al.The dominant expression of functional human lactoferrin in transgenic cloned goats using a hybrid lactoferrin expression construct[J].Journal of Biotechnology, 2012, 161(3):198-205.
[59] CUI D, LI J, ZHANG L L, et al.Generation of bi-transgenic pigs overexpressing human lactoferrin and lysozyme in milk[J].Transgenic Research, 2015, 24(2):365-373.
[60] NUIJENS J H, VAN BERKEL P H C, GEERTS M E J, et al.Characterization of recombinant human lactoferrin secreted in milk of transgenic mice[J].Journal of Biological Chemistry, 1997, 272(13):8802-8807.
[61] VAN BERKEL P H C, WELLING M M, GEERTS M, et al.Large scale production of recombinant human lactoferrin in the milk of transgenic cows[J].Nature Biotechnology, 2002, 20(5):484-487.
[62] STOWELL K M, RADO T A, FUNK W D, et al.Expression of cloned human lactoferrin in baby-hamster kidney cells[J].The Biochemical Journal, 1991, 276 (Pt 2):349-355.
[63] KRUZEL M L, ACTOR J K, ZIMECKI M, et al.Novel recombinant human lactoferrin:Differential activation of oxidative stress related gene expression[J].Journal of Biotechnology, 2013, 168(4):666-675.
[64] SEMAK I, BUDZEVICH A, MALIUSHKOVA E, et al.Development of dairy herd of transgenic goats as biofactory for large-scale production of biologically active recombinant human lactoferrin[J].Transgenic Research, 2019, 28(5-6):465-478.
[65] 纪颖, 艾连中, 邢明霞, 等.基于牛乳铁蛋白的生产技术创新及应用研究进展[J].食品与发酵工业, 2022, 48(15):332-340.
JI Y, AI L Z, XING M X, et al.Advances on bovine lactoferrin-based technical innovation and application[J].Food and Fermentation Industries, 2022, 48(15):332-340.
[66] KROLITZKI E, SCHWAMINGER S P, PAGEL M, et al.Current practices with commercial scale bovine lactoferrin production and alternative approaches[J].International Dairy Journal, 2022, 126:105263.
[67] WAKABAYASHI H, YAMAUCHI K, ABE F.Quality control of commercial bovine lactoferrin[J].Biometals:an International Journal on the Role of Metal Ions in Biology, Biochemistry, and Medicine, 2018, 31(3):313-319.
[68] CONESA C, CALVO M, S NCHEZ L.Recombinant human lactoferrin:A valuable protein for pharmaceutical products and functional foods[J].Biotechnology Advances, 2010, 28(6):831-838.
NCHEZ L.Recombinant human lactoferrin:A valuable protein for pharmaceutical products and functional foods[J].Biotechnology Advances, 2010, 28(6):831-838.
[69] ZHOU C, SUN N.Allergenicity assessment of a genetically modified protein-recombinant human lactoferrin[J].Journal of Allergy &Therapy, 2013, S3:1-6.
[70] 戴亚妮, 杨雪珍, 刘燊, 等.重组人乳铁蛋白急性经口毒性试验和90天喂养试验[J].卫生研究, 2018, 47(2):286-289;311.
DAI Y N, YANG X Z, LIU S, et al.Acute oral toxicity and 90 days feeding test of recombinant human lactoferrin[J].Journal of Hygiene Research, 2018, 47(2):286-289;311.
[71] TurtleTree steps into functional protein space with world’s first fermentation-produced lactoferrin.[EB/OL].Food Ingredients First 819, 2022 https://wwwfoodingredientsfirstcom/news/turtletree-steps-into-functional-protein-space-with-worlds-first-fermentation-produced-lactoferrinhtml.
[72] De novo dairy milks new cult food science investment into scaling precision fermentation dairy[EB/OL].Food Ingredients First 282, 2022 https://wwwfoodingredientsfirstcom/news/de-novo-dairy-milks-new-cult-food-science-investment-into-scaling-precision-fermentation-dairyhtml.