补充植物蛋白对运动能力的影响
谭秋实,陈玥,邵晶,安楠*,王启荣*
(国家体育总局运动医学研究所,北京 100029)
摘 要 肉类和其他动物来源蛋白质一直被视为运动员和健身人群饮食中不可或缺的组成部分。近年来,植物蛋白因其对环境和健康的积极作用越来越受到欢迎。但相较于动物蛋白,我国对植物蛋白应用仍处于初步阶段,植物蛋白的补充对人体运动能力影响的相关研究也相对较少。该文简述了植物蛋白的营养特点,探讨了阻力、耐力训练中补充植物蛋白质对肌肉力量及质量、瘦体重、运动表现以及肌肉损伤和恢复等方面的作用,指出了植物蛋白改善运动能力的有效剂量和其他影响因素,以期为植物蛋白在运动领域的研究、开发和应用提供依据。
关键词 植物蛋白;营养特点;阻力运动;耐力运动;肌肉损伤
DOI:10.13995/j.cnki.11-1802/ts.038391
引用格式:谭秋实,陈玥,邵晶,等.补充植物蛋白对运动能力的影响[J].食品与发酵工业,2024,50(9):330-339.TAN Qiushi, CHEN Yue, SHAO Jing, et al.Effects of plant protein supplementation on exercise ability[J].Food and Fermentation Industries,2024,50(9):330-339.
第一作者:学士,助理研究员(王启荣研究员和安楠研究员为共同通信作者,E-mail:qirongw@163.com;532813269@qq.com)
基金项目:国家重点研发计划“科技冬奥”专项(2019YFF0301702)
收稿日期:2023-12-27,改回日期:2024-01-22
随着人类社会可持续发展和健康意识的觉醒,植物来源的蛋白质,正越来越受到人们的关注[1-2]。与动物性蛋白食品相比,生产植物蛋白食品可以更好节约生态资源,减少碳排放量,减轻环境压力[3-4]。同时,植物蛋白对降低心血管及代谢性疾病风险、控制体重、抗肿瘤等均有积极作用[5-6]。考虑植物蛋白对环境和健康的潜在益处,以及运动员及健身人群对植物性饮食需求不断增加的趋势[7-8],在运动领域,越来越多的研究也将植物蛋白纳入研究方案中,不同来源的植物蛋白在刺激肌肉蛋白质合成、促进运动恢复等方面的证据不断积累[9]。然而,由于许多植物蛋白亮氨酸含量较低,缺乏其他必需氨基酸,如蛋氨酸或赖氨酸[10],并且消化率也低于动物蛋白[11],运动人群在利用植物蛋白补充营养、提高运动表现过程中还存在一定的顾虑和偏见。且相较于动物蛋白,我国对植物蛋白应用及发展仍处于初步阶段,植物蛋白在运动领域应用的研究相对较少[12]。为了弥补这一差距,迫切需要在植物蛋白相关知识构建上取得进展。本文拟通过梳理近年来国内外的研究成果,探讨补充植物蛋白对运动能力的影响,并阐述植物蛋白在运动领域应用过程中的潜在益处以及未来的发展前景。
1 植物蛋白的营养品质
1.1 植物蛋白与动物蛋白质量比较
联合国粮食及农业组织最新建议利用消化必需氨基酸评分(digestible indispensable amino acid score,DIAAS)对蛋白质质量进行评估[13]。通常认为,植物来源蛋白质量得分要低于肉、鱼、蛋和乳制品等动物来源蛋白。这主要由于植物蛋白的必需氨基酸组成及消化率不及动物蛋白。
除大豆、豌豆、藜麦和苋菜蛋白中含有所有必需氨基酸外[14],大多数植物蛋白往往容易缺乏一种或几种必需氨基酸。在必需氨基酸中,包括亮氨酸、异亮氨酸和缬氨酸的支链氨基酸与运动关系密切,被认为可以促进肌肉蛋白质合成和提高运动表现[15-16]。与植物蛋白相比,动物蛋白中支链氨基酸含量更高,其中以乳清蛋白以及蛋、奶中的蛋白中的亮氨酸含量尤为丰富,一些植物蛋白如玉米、燕麦和高粱中的蛋白质具备与乳清蛋白相似的亮氨酸含量,但必需氨基酸的总体比例还是不及乳清蛋白[17]。
植物蛋白消化率也普遍要低于动物蛋白,一些动物蛋白如乳清蛋白补充后能够被迅速消化,其氨基酸能迅速出现在血液中,更快为机体提供营养物质并刺激肌肉的代谢合成[18]。植物蛋白由于抗营养素因子存在而影响其消化率。抗营养因子是食物基质中干扰某些营养物质吸收的食物成分或化合物,如植酸盐、单宁、胰蛋白酶抑制剂、凝集素等,摄入后还可能导致尿素生成增加以及对肌肉蛋白质合成的刺激减少[19]。
目前已有多种途径可以提高植物蛋白的营养质量。将不同来源植物蛋白质混合可以改善必需氨基酸结构。例如,豆类蛋白富含赖氨酸,但含硫氨基酸蛋氨酸和半胱氨酸含量低。为确保氨基酸平衡,豆类蛋白可以与富含含硫氨基酸的谷物蛋白混合,这种组合平衡了植物蛋白的氨基酸结构,可以提高植物蛋白质量。此外,植物蛋白中的抗营养因子,也可以通过浸泡、蒸煮、高压灭菌、发芽、微波、辐照、喷雾和冷冻干燥、发酵和挤压等食品加工技术来减少其浓度[20],提高植物蛋白的消化率并降低食用风险。
1.2 不同来源植物蛋白营养特点
1.2.1 豆类蛋白
大豆蛋白被认为是良好的动物蛋白替代品。大豆蛋白大豆的DIAAS值(0.9)最接近牛奶[21],同时,大豆蛋白的消化率(95%~99%)也高于豌豆(83%~90%)等豆类蛋白,与乳清蛋白(89%~100%)相似[22-23],运动过程中可快速被人体吸收利用,为肌肉提供能量。大豆蛋白中蛋氨酸、半胱氨酸含量有限,但赖氨酸、亮氨酸、精氨酸、谷氨酰胺含量丰富[24]。豌豆蛋白是一种相对较新的植物蛋白,豌豆蛋白与大豆蛋白同样含有所有必需氨基酸,同时豌豆蛋白还具有低致敏性、抗氧化等特点[25]。乳清、酪蛋白、鸡蛋、大豆和豌豆分离蛋白每100 g食物中分别含有8.6 g、5.8 g、3.6 g、5.0 g和5.7 g亮氨酸[26]。相比之下,大豆和豌豆中亮氨酸含量要低于乳清蛋白而优于鸡蛋蛋白。
1.2.2 谷物蛋白
谷物蛋白通常富含谷氨酰胺、脯氨酸、亮氨酸、蛋氨酸和半胱氨酸,而赖氨酸、色氨酸、苏氨酸和缬氨酸等必需氨基酸含量有限[27]。几乎所有谷物中主要的储存蛋白是醇溶蛋白,其次是谷蛋白,而燕麦和大米是例外,他们的主要储存蛋白分别属于球蛋白和谷蛋白,而球蛋白比醇溶蛋白富含更多的必需氨基酸[28-29]。另外,由于球蛋白和谷蛋白比醇溶蛋白更容易消化,因此,大米和燕麦的消化率要高于来自玉米、大麦、黑麦和小麦的蛋白质[30]。另外,一些科学研究表明,燕麦蛋白可以有效缓解运动引起的疲劳,有关燕麦蛋白抗氧化、抗疲劳等与运动相关的功能近年来也备受关注[31]。精制大米和脱壳燕麦的DIAAS评分分别为0.64和0.77,而玉米(0.48)、高粱(0.29)、小麦(0.43)等DIAAS评分均低于0.5[29]。DIAAS分值表明,谷物蛋白质量不及动物蛋白。通常,谷物蛋白可以与豆类蛋白搭配食用,来提高混合蛋白营养价值。
1.2.3 树坚果、种子蛋白
核桃、腰果、杏仁、开心果、花生、南瓜子等树坚果、种子是植物蛋白的其他常见来源。树坚果中苯丙氨酸、酪氨酸、组氨酸含量较高,而苏氨酸、含硫氨基酸含量较低。一般来说,苏氨酸是树坚果的限制性氨基酸,含量在25~40 mg/g,巴西果中苏氨酸含量最低,腰果含量最高[32]。近年来,奇亚籽蛋白作为种子类蛋白因含有多种生物活性肽,具有抗炎、抗氧化性而受到运动领域的关注[33-35],奇亚籽蛋白中含有所有必需氨基酸,且拥有较高消耗率(78.9%)[36],未来可能更多被应用于运动营养食品。需要注意的是,虽然很多树坚果/种子中蛋白含量丰富且具有多种生物活性,但其致敏性也不容忽视。花生、杏仁、核桃、榛子、腰果等都是诱发免疫球蛋白E介导过敏反应的常见食物过敏原[37]。因此,运动过程中选择和摄入树坚果/种子等植物蛋白时,需要更加关注由于过敏反应带来的食品安全等问题。
2 补充植物蛋白对运动能力的影响
2.1 补充植物蛋白对阻力运动适应性的影响
阻力运动训练通常是为了增加肌肉大小和力量[38],大豆蛋白因为被认为是典型的植物蛋白,在研究不同来源蛋白对阻力运动影响中,它经常与动物蛋白进行比较。有学者进行了大豆蛋白补充对阻力训练适应性影响的研究。HARTMAN等[39]让54名年轻举重运动员在阻力训练后,分别服用17.5 g/d的脱脂牛奶或者与脱脂牛奶等能量等含氮量的大豆蛋白。通过12周试验发现,阻力运动后食用牛奶比食用大豆蛋白更能促进肌肉的增加。HEVIA等[40]研究了素食者和杂食者分别补充大豆蛋白和乳清蛋白对阻力训练适应性的影响。发现不同来源高蛋白[1.6 g/(kg BW·d)]饮食,对于纯植物性饮食或混合饮食未经训练的年轻男性来说,在支持肌肉力量和质量方面没有区别的。上述2项研究结果存在矛盾,分析原因可能跟蛋白补充量有关。假设摄入2.7 g亮氨酸足以最大限度地触发肌肉蛋白质合成机制,则需要摄入20~25 g乳清蛋白(提供2.2~2.7 g亮氨酸)才可以满足亮氨酸需求[41]。HARTMAN等[39]试验中蛋白补充量为17.5 g/d,补充量不足,且大豆蛋白亮氨酸含量要低于乳清蛋白或牛奶,导致大豆蛋白增肌效果不如牛奶或乳清蛋白。而HEVIA等[40]采用高蛋白饮食时,亮氨酸得到充足补充,缩小了不同来源蛋白对肌肉力量和质量影响的差距,使得不同来源蛋白质在保持肌肉力量和质量方面效果趋于一致。
大豆蛋白对阻力运动影响的这种量效关系在谷物蛋白上也有所体现。2013年,JOY等[42]首次研究了大米蛋白对阻力训练的影响。试验选取24名健康男性随机分为2组,分别在阻力运动后摄入48 g/d乳清蛋白或大米蛋白分离物。此项研究中蛋白质剂量(48 g/d)以确保在大米和乳清蛋白组中提供足够量的亮氨酸,结果发现2种蛋白质在瘦体重、最大力量和下半身力量均能产生相同作用效果。在JOY等[42]试验的基础上,MOON等[43]将大米蛋白的摄入量减少为24 g/d(亮氨酸含量85.4 mg/g),该剂量刚好满足许多人认为的刺激蛋白质翻译的最小亮氨酸量(~2.0 g)[44-45],结果与JOY等[42]一致,24 g/d的大米蛋白质摄入量能够起到等量乳清蛋白对阻力训练影响的相同效果。
以上这些研究可能支持这样一种观点:只要摄入充足蛋白质,特别是亮氨酸达到有效剂量,植物来源蛋白就能够同动物蛋白一样,对阻力运动适应性产生相同的效果。健康成年人阻力训练通常每天蛋白质推荐摄入量为1.2~1.6 g/(kg BW),以有效提高肌肉质量和减少体内脂肪[46],运动后补充20~25 g/d动物蛋白质(乳清蛋白或全蛋蛋白)则可以最大限度地刺激肌肉蛋白的合成[41,47-48]。从上述研究结果来看,当植物蛋白的摄入达到一定剂量(亮氨酸摄入量>2.0 g/d),基本可实现利用植物蛋白代替动物蛋白,对阻力运动适应性产生相同影响。考虑植物蛋白中亮氨酸含量普遍要低于动物蛋白,所以植物蛋白每日补充量也要高于动物蛋白,具体应根据不同来源植物蛋白中亮氨酸含量来制定合理的补充方案。近年有学者还对豌豆蛋白[49]、花生蛋白[50]、奇亚籽蛋白[51]、马铃薯蛋白[52]等对阻力运动的影响进行了研究。结果发现,在补充50 g/d豌豆蛋白或30 g/d的花生、马铃薯蛋白条件下,都能对受试人群的肌肉厚度、力量、肌肉蛋白质合成率等一项或多项指标产生积极作用,提示有效剂量的植物来源蛋白质可以作为良好的营养补充剂应用于阻力运动中。
另外,从这些研究的补充时间来看,大多阻力训练研究蛋白质补充剂都使用了“运动后”补充方案,只有HEVIA等[40]的补充方案选择在日常饮食中添加。但是从结果来看,日常饮食中添加植物蛋白同样起到了代替动物性蛋白的效果。这一数据可能表示只要每日总蛋白质摄入量充足,锻炼后的蛋白质摄入量可能并不重要。然而,这并不排除运动后补充合适剂量的植物蛋白更有益的可能性。表1总结了近年来植物蛋白补充对阻力运动适应性影响的相关研究。
表1 近年植物蛋白补充对阻力运动适应性影响的相关研究
Table 1 Recent studies related to the effect of plant protein supplementation on adaptation of resistance exercise
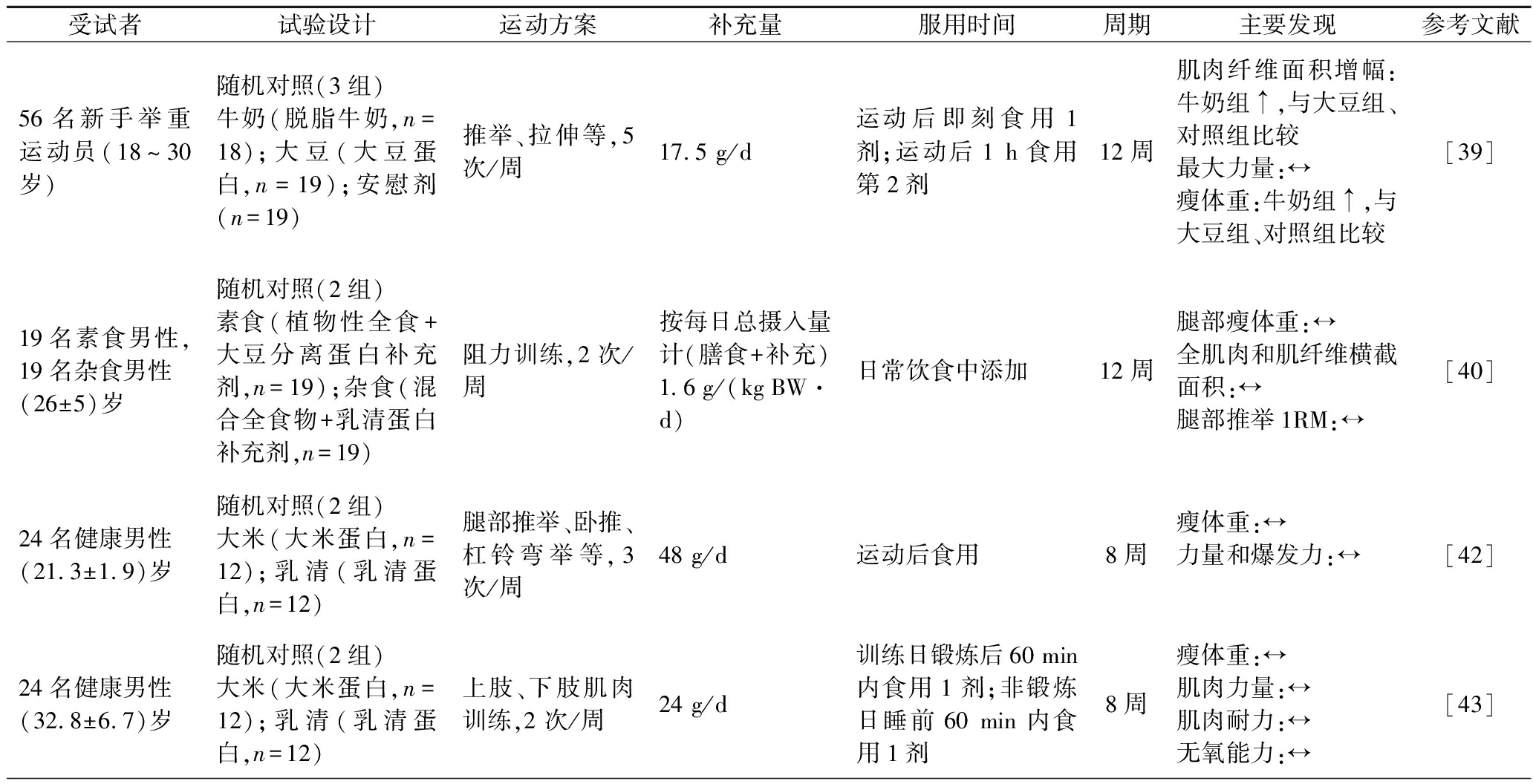
受试者试验设计运动方案补充量服用时间周期主要发现参考文献56名新手举重运动员(18~30岁)随机对照(3组)牛奶(脱脂牛奶,n=18);大豆(大豆蛋白,n=19);安慰剂(n=19)推举、拉伸等,5 次/周17.5 g/d运动后即刻食用1剂;运动后1 h食用第2剂12周肌肉纤维面积增幅:牛奶组↑,与大豆组、对照组比较最大力量:↔瘦体重:牛奶组↑,与大豆组、对照组比较[39]19名素食男性,19名杂食男性(26±5)岁随机对照(2组)素食(植物性全食+大豆分离蛋白补充剂,n=19);杂食(混合全食物+乳清蛋白补充剂,n=19)阻力训练,2次/周按每日总摄入量计(膳食+补充)1.6 g/(kg BW·d)日常饮食中添加12周腿部瘦体重:↔全肌肉和肌纤维横截面积:↔腿部推举1RM:↔[40]24名健康男性(21.3±1.9)岁随机对照(2组)大米(大米蛋白,n=12);乳清(乳清蛋白,n=12)腿部推举、卧推、杠铃弯举等,3 次/周48 g/d运动后食用8周瘦体重:↔力量和爆发力:↔[42]24名健康男性(32.8±6.7)岁随机对照(2组)大米(大米蛋白,n=12);乳清(乳清蛋白,n=12)上肢、下肢肌肉训练,2 次/周24 g/d训练日锻炼后60 min内食用1剂;非锻炼日睡前60 min内食用1剂8周瘦体重:↔肌肉力量:↔肌肉耐力:↔无氧能力:↔[43]
续表1

受试者试验设计运动方案补充量服用时间周期主要发现参考文献137名健康男性(18~35岁)随机对照(3组)豌豆(豌豆蛋白,n=47);乳清(乳清蛋白,n=46);安慰剂(n=44)上肢肌肉训练,3 次/周50 g/d训练日早上食用1剂,训练后食用第2剂;非训练日上午食用1剂,下午食用第2剂12周肱二头肌肌厚度:↔肌肉力量:↔[49]68名肌肉力量较弱男性(18~35岁,肘部屈曲可举起最大负载量<25 kg)随机对照(3组)豌豆(豌豆蛋白,n=17);乳清(乳清蛋白,n=31);安慰剂(n=20)上肢肌肉阻力训练,3 次/周50 g/d训练日早上食用1剂,训练后食用第2剂;非训练日上午食用1剂,下午食用第2剂12周肱二头肌肌厚度:豌豆组↑,与安慰剂组比肌肉力量:↔[49]39名老年男性和女性[17名女性,22名男性,(58.6±8.0)岁]随机对照(2组)花生(花生蛋白,n=20);对照(无补剂,n=19)坐姿腿部推举、腿部伸展、绳索下拉等,2 次/周30 g/d训练日运动后即刻食用;非训练日两餐间食用6周瘦体重:↔股外侧肌肉厚度:花生组↑膝关节屈曲峰值扭矩:花生组↑[50]18名健康男性(22.4±3.1)岁随机对照(3组)奇亚籽(奇亚籽粉,n=6);乳清蛋白(乳清蛋白,n=6);安慰剂(n=6)阻力训练,3 次/周奇亚籽:20.1 g/d;乳清蛋白:23 g/d训练后10 min内食用8周瘦体重:↔下肢和上肢力量:↔[51]24名健康男性(24±4)岁随机对照(2组)马铃薯(马铃薯蛋白,n=12);牛奶(牛奶蛋白,n=12)单侧阻力运动30 g/d运动后食用单次休息和运动恢复期间的肌肉蛋白质合成率:↔[52]
注:↑表示组间比较显著升高(P<0.05);↓表示组间比较显著降低(P<0.05);↔表示组间比较无差异(下同)。
2.2 补充植物蛋白对耐力运动表现的影响
耐力运动中补充蛋白质的作用效果一直存在争议[53]。近年,一项蛋白质补充对耐力训练适应性影响的荟萃分析显示[54],补充蛋白质可提高健康和临床人群的有氧能力和耐力运动表现。但上述荟萃分析共纳入的19项研究中,涉及的蛋白除氨基酸外主要以乳清蛋白和牛奶蛋白为主,只有一项涉及了植物来源蛋白质(豆浆)[55],植物蛋白对耐力运动的影响依然有待探讨。
针对植物蛋白与碳水化合物混合补充情况,2010年,GHOSH等[56]让8名非专业男性自行车手在一次自行车高强度耐力运动试验过程中补充西米和西米-大豆蛋白组合物,观察碳水化合物混合植物蛋白同时补充对一次性耐力运动的影响。结果发现,相对于补充安慰剂(提供碳水化合物0 g,蛋白质0 g)和西米淀粉(提供碳水化合物60 g),西米与大豆蛋白的混合补充(提供碳水化合物52.5 g,蛋白质15 g,碳水化合物与蛋白质比值3.5),能够使受试者力竭时间提高84%(P<0.001)和37%(P<0.05)。另一项研究[55]同样发现,相对于单纯康复锻炼,8周的康复锻炼后立即摄入加糖豆浆(碳水化合物与蛋白质质量比值1.83;提供蛋白质17.9 g/d)可明显改善中老年慢性脑卒中患者的步行速度和运动表现。上述结论为碳水化合物与植物蛋白混合补充促进耐力运动表现提供了有利证据,但可能受试对象、运动强度、碳水化合物与植物蛋白比例等因素均会对研究结果造成影响。有研究证实,蛋白质补充剂与碳水化合物混合使用,是通过在运动期间保留肌肉糖原和提高恢复期间糖原恢复的速度,直接提高耐力表现。当碳水化合物充足,且在耐力运动期间或之后以最佳速率输送时,蛋白质就不会起到明显地改善运动表现的作用[57]。国际运动营养学会立场:碳水化合物与蛋白质质量比例在2~4∶1时,有利于糖原的快速恢复[58],上述2项试验碳水化合物与植物蛋白质比值均在此范围内,且一项运动类型为高强度耐力运动,另一项受试人群为老年临床患者,导致运动后受试者均容易出现糖原储备不足情况,这些可能是造成试验正向结果的原因。因此,在实际训练中应用碳水化合物混合植物蛋白补充来提高耐力运动表现,需根据运动强度、碳水化合物补充量以及补充人群糖原储备情况等,来制定合理的植物蛋白补充策略。
针对植物蛋白单独补充情况,LI等[59]对16名有久坐行为的健康女性进行为期8周的有氧训练,观察训练后补充40 g/d的大豆分离蛋白对女性身体成分及心肺耐力等方面影响。研究发现与仅接受有氧运动训练的女性相比,训练后服用大豆分离蛋白补充剂的女性在身体成分和人体测量学特征方面产生了更多有利的变化,但对于心肺功能和耐力表现只具有提高的趋势并不显著,说明40 g/d大豆分离蛋白补充量并不能满足提高女性耐力运动表现的蛋白质需求量。实际上,长时间的耐力运动会导致氨基酸(特别是亮氨酸)的大量氧化,加上运动缺氧可能会引起小肠损伤,负氮平衡在耐力运动员中可能很常见[60],可能需要更高剂量的植物蛋白补充量才能对耐力运动表现起到积极作用。KRITIKOS等[61]将每日乳清或大豆蛋白补充剂摄入量增加到1.5 g/(kg BW·d),就发现可以减轻足球运动员连续速度耐力训练期间的运动表现的下降。虽然上述试验没有对蛋白质摄入量设计其他数量级以明确不同蛋白质摄入量对运动表现的具体影响,但这些发现也可以在一定程度上证明植物蛋白质摄入量对耐力表现的影响具有相关性。表2总结了近年来植物蛋白补充对耐力运动适应性影响的相关研究。
表2 近年植物蛋白补充对耐力运动表现影响的相关研究
Table 2 Recent studies related to the effect of plant protein supplementation on endurance exercise performance

受试者试验设计运动方案补充量服用时间周期主要发现参考文献22例卒中患者(57~84)岁随机对照(2组)甜豆浆(碳水化合物与蛋白质比值1.83,n=11);安慰剂(n=11)自行车耐力训练+肌肉训练,每周3次17.9 g/d运动后8 周手握力:↑8英尺步行速度:↑6 min步行表现:↑[55]8名非专业男性自行车手(21.5±1.1)岁随机交叉对照(3组)大豆(大豆蛋白+西米粉,n=8);西米(西米粉,n=8);安慰剂(n=8)60%最大摄氧量骑行60 min,90%最大摄氧骑行至力竭5 g/次,共3次15 g稳态骑行0、20、40 min食用单次力竭时间:大豆组↑,与西米组、安慰剂组比[56]16名有久坐行为的健康女性(25~46岁)随机对照(2组)大豆(大豆分离蛋白,n=8);对照(不补充,n=8)60 min有氧训练,2 次/周40 g/d运动后8周腰围、臀围:大豆组↓体重、体重指数、体脂百分比:大豆组↓去脂体重百分比:大豆组↑胸部、手臂、大腿和小腿周长或皮褶厚度:↔心肺功能:↔运动耐力:↔[59]10名男性足球运动员随机对照(3组)大豆(大豆分离蛋白,n=10);乳清(乳清蛋白,n=10);安慰剂(n=10)适应期、预实验期:日常训练;实验期:2次速度耐力训练按每日总摄入量计(膳食+补充):大豆、乳清蛋白组1.5 g/(kg BW·d);安慰剂组0.8~1 g/(kg BW·d)训练日运动后食用;非训练日早餐食用适应期7 d;预实验期7 d;试验期3 d第1次训练后 48 h第2次高速跑速度降幅:对照组↓,与大豆组、乳清组比肌肉损伤:↔氧化还原状态:↔[61]
2.3 补充植物蛋白对肌肉损伤和恢复的影响
过去,运动期间补充动物性蛋白质对肌肉损伤的积极影响已被广泛讨论[62]。而有关植物蛋白补充对肌肉损伤及恢复影响的研究数量有限,部分研究结论相反。LIU等[63]观察了20名男性排球运动员训练后持续4周补充大豆肽(10 g大豆肽+30 g糖)的反应。结果显示,大豆肽组与糖组(30 g糖)和安慰剂组相比,肌酸激酶水平以及自主感觉劳累等级(rating of perceived exertion,RPE)显著下降。SHENOY等[64]研究补充4周大豆分离蛋白粉(42.2 g/d)对运动员单次离心活动后运动引起的肌肉损伤的影响。同样发现与安慰剂相比,连续 4 周食用大豆分离蛋白可减少肌肉损伤及氧化应激相关标志物水平并缓解肌肉酸痛。但也有研究得出不同结论,KRITIKOS等[61]在试验中增加大豆蛋白和乳清蛋白对耐力训练恢复的比对,发现持续补充乳清蛋白或大豆蛋白7 d[总蛋白质摄入量达到1.5 g/(kg·d)]并不能降低足球运动员运动引起的肌肉酸痛以及肌肉损伤和氧化还原状态标志物指数。BALASEKARAN等[65]进行了一次性无氧冲刺运动试验,在运动前1.5 h为10名健康男性补充500 mL豆浆(约补充大豆蛋白21.5 g/d),观察到运动后豆浆组最大血乳酸峰值与纯水组相比无明显改变。分析上述研究结果差异,不排除大豆肽相较于大豆蛋白具有更优秀的抗炎和抗氧化等生物活性[66],同时也有可能是LIU[63]及SHENOY等[64] 4周的长期试验设计引起了结果的差异性。利用植物蛋白的补充来降低运动引起的肌酸激酶等肌肉损伤标志物水平,除满足每日大豆蛋白质需求量外,可能持续补充时间也是关键影响因素。这也与PASIAKOS等[67]得到的结论一致,该综述报道急性单次蛋白补充不能改善肌肉损伤,而训练期间长期补充蛋白则可以减少肌肉酸痛和损伤标志物。
补充周期的长短对肌肉损伤和恢复的影响在豌豆蛋白上也有所体现。SPOELDER等[68]以豌豆蛋白进行试验,发现与安慰剂相比,13 d(25 g/d)的豌豆蛋白补充不会减弱老年人在一次长时间的步行锻炼后肌酸激酶、乳酸脱氢酶等肌肉损伤标志物水平以及肌肉酸痛程度,而同剂量乳清蛋白与豌豆与安慰剂相比,显著降低血清中肌酸激酶水平。NIEMAN等[69]将蛋白质摄入量增加至0.9 g/(kg·d),比较了高强度离心运动后5 d大量补充乳清蛋白或豌豆蛋白对离心运动引起的肌肉损伤的影响。结果显示,与补水相比,乳清蛋白能显著减缓血液中肌酸激酶、肌红蛋白等肌肉损伤标志物的增加,而豌豆蛋白的影响与水相比没有显著差异,2种蛋白均对缓解肌肉酸痛无明显作用。可见豌豆蛋白与大豆蛋白相似,即使2周时间内足量补充可能也无法引起肌肉损伤标志物的改变,而2周补充周期内动物蛋白对肌肉损伤恢复的效果可能要好于植物蛋白。
除了植物蛋白的补充周期外,植物蛋白自身的生物活性可能也是影响肌肉损伤和恢复效果的关键因素。XIA等[70]观察了燕麦蛋白补充对未经训练的青年男性下坡跑步后骨骼肌损伤、炎症和性能恢复效果。此项研究中,植物蛋白的补充量25 g/d为中等剂量,且补充时长19 d(运动前14 d及运动后5 d共计19 d)也没有达到4周以上。可结果发现,与安慰剂相比,燕麦蛋白补充可缓解运动引起的骨骼肌酸痛;降低白介素-6、肌红蛋白、C反应蛋白浓度;抑制损伤性运动后的肢体水肿;促进肌肉的恢复等方面均有显著效果。燕麦蛋白已被证实具有抗氧化、抗疲劳等功效[31],相比其他蛋白,可能正是由于燕麦蛋白的活性成分导致其对运动后肌肉损伤的恢复效果优于大豆等其他蛋白。目前,蛋白质摄入与肌酸激酶、延迟肌肉酸痛等确切作用机制仍尚不清楚[64],不排除上述研究由于人群个体状况、植物蛋白来源、摄入量、运动方案设计等均不同,均可能会对研究结果造成差异,可能今后对于植物蛋白对肌肉损伤和恢复的影响还需要进行更多的探索以明确。表3总结了近年来植物蛋白补充对肌肉损伤和恢复的相关研究。
表3 近年来植物蛋白补充对肌肉损伤和恢复影响的相关研究
Table 3 Recent studies related to the effect of plant protein supplementation on muscle damage and recovery

受试者试验设计运动方案补充量服用时间周期主要发现参考文献19名男排运动员(24±1.93)岁随机对照(3组)肽组(30 g糖+10 g大豆肽,n=6);糖组(30 g糖,n=6);安慰剂组(n=7)日常训练,5 次/周10 g/d运动后4周肌酸激酶:肽组↓,与糖组和安慰剂组比RPE:肽组↓,与糖组和安慰剂组比[63]40 名训练有素运动员(20.3±1.49)岁随机对照(2组)大豆组(大豆蛋白,n=20);安慰剂(n=20)0.6 m的高度 100 次跳下42.2 g/d运动前4周肌肉损伤标志物:大豆组↓氧化应激指标:大豆组↓肌肉酸痛:大豆组↓[64]10名健康男性(23±1.23)岁随机交叉对照(2组)豆浆(n=10);安慰剂(纯水,n=10)6次35 m冲刺约21.5 g/d运动前1.5 h单次疲劳指数:↓冲刺平均时间:↔冲刺平均速度:↔[65]45名老年人(70±6)岁随机对照(3组)乳清(乳清蛋白,n=15);豌豆(豌豆蛋白,n=15);安慰剂(n=15)长距离步行25 g/d运动前10 d和运动后 3 d13 d肌酸激酶:乳清组↓,与豌豆组和安慰剂组比乳酸脱氢酶:↔肌肉酸痛:↔[68]92名未进行定期训练的非肥胖男性(18~55岁)随机对照(3组)豌豆(豌豆蛋白,n=31);乳清(乳清蛋白,n=31);纯水(n=30)90 min的离心运动0.9 g/(kg BW·d)运动当天及运动后4 d5 d肌肉损伤生物标志物的水平:乳清组↓,与豌豆组和安慰剂组比[69]16名健康男性(19.7±1.1)岁随机对照(2组)燕麦(燕麦蛋白,n=8);安慰剂(n=8)下坡跑25 g/d早晚各1次19 d骨骼肌酸痛:燕麦组↓肌酸激酶、白介素-6、肌红蛋白、C反应蛋白浓度:燕麦组↓损伤性肢体水肿:燕麦组↓[70]
3 植物蛋白与其他来源蛋白对运动的混合效应
植物蛋白与动物蛋白混合补充对运动的作用效果可能还要优于单独动物蛋白补充。阻力运动后,将植物蛋白与亮氨酸或富含亮氨酸的高质量动物蛋白质混合补充(50%酪蛋白,25%乳清蛋白,25%大豆分离蛋白)较单一动物蛋白(乳清蛋白),在2种蛋白补充方式均提供相似数量的必需氨基酸和亮氨酸条件下,混合蛋白更能延长血液中支链氨基酸浓度,促进肌肉合成代谢反应。植物蛋白的这种混合效应同样体现在提高耐力运动表现方面[71]。REN等[72]将18只雄性Wistar大鼠分成3组,其中2组在负荷游泳训练后分别喂食乳清大豆蛋白混合物(大豆蛋白∶乳清蛋白=1∶1,质量比)乳清蛋白,剩余一组不添加蛋白作为对照组。经7周喂养后发现与不摄入蛋白或单一摄入乳清蛋白相比,摄入大豆、乳清混合蛋白可以改善大鼠的游泳运动表现并改善运动引起的疲劳。
分析植物蛋白与动物蛋白混合增效的原因,可能与植物蛋白富含具备关键功能的氨基酸有一定关系。亮氨酸是肌肉蛋白质合成的关键调节因子[16],乳清蛋白含有高水平的亮氨酸,大豆蛋白中亮氨酸含量虽然不如乳清蛋白高,但谷氨酰胺比乳清蛋白高出2~3倍,精氨酸高出近3倍[21],其他植物蛋白也可能富含这些氨基酸。精氨酸、谷氨酰胺虽不是必需氨基酸,但它们具备许多与运动相关的关键功能:精氨酸是维持尿素循环功能、调节激素分泌和免疫功能所必需的氨基酸[73];谷氨酰胺在能量代谢、调节糖原合成和分解、调节免疫力等方面均发挥重要作用[74]。正是植物蛋白中富含这些具备关键功能的氨基酸,当与动物蛋白混合,能够进一步改善氨基酸谱,增强了对运动的作用效果。
4 小结与展望
长期以来,人们普遍认为动物蛋白在帮助运动人群提高运动表现上更具有优势。直到近年来,随着人们对植物蛋白关注度的提高,各种来源植物蛋白在运动领域应用的研究才开始大量出现。总体来讲,对于阻力运动,与动物源性蛋白质相比,植物源性蛋白质质量和合成代谢效力均稍显不足,但当植物蛋白补充量达到有效剂量,亮氨酸摄入量>2.0 g/d时,植物蛋白可以同乳清蛋白等动物蛋白一样对阻力训练适应性产生相同的效果,对体成分、肌肉力量、肌肉质量等均有积极促进作用。植物蛋白质的来源以及每日摄入时间不是影响阻力训练效果的主要因素,每日总蛋白质摄入量的充足在促进阻力运动适应性方面起着关键作用。对于耐力运动,植物蛋白对耐力运动适应性的影响较之阻力运动并不那么明显。将植物蛋白质用于和碳水化合物共同补充,其对耐力运动的作用效果可能更取决于碳水化合物摄入充足与否以及体内糖原储备是否良好,植物蛋白对耐力运动表现及恢复产生影响的有效剂量值也可能要高于阻力运动。对于肌肉损伤和恢复,如果想通过补充植物蛋白来抑制肌肉损伤标志物水平,可能除满足植物蛋白质每日需求量外,还需要持续2周以上的补充时间才能发挥作用,而对于2周内中短期补充周期,可能动物蛋白补充效果更好。同时来源植物蛋白其自身抗炎、抗氧化等生物活性水平不同也会影响肌肉损伤和恢复效果。此外,将植物蛋白与富含亮氨酸的高质量动物蛋白质混合补充可以补偿某些植物蛋白质来源中必需氨基酸缺陷,甚至能够进一步改善氨基酸谱,增强对运动的作用效果。这为植物蛋白的在运动领域的利用提供了一种潜在可行的选择。
虽然,目前植物蛋白在运动领域的研究逐年增多,但相较动物蛋白仍处于起始阶段。许多新型植物蛋白对运动影响的研究尚未涉及,植物蛋白的摄入对耐力运动表现及对损伤恢复的一些确切作用机制也尚不清楚。未来,针对不同人群、不同来源植物蛋白制定合理的补充策略,以及如何将植物蛋白再加工(水解、热处理等)或者与其他营养素合理搭配食用以提高植物蛋白的合成代谢潜力,可能会成为对植物蛋白开展研究探讨的主要方向。正如前文所述,植物蛋白的未来是光明的,随着人们对其功能特性的不断了解,以及加工技术的逐步成熟,植物蛋白将在运动领域发挥更大作用。
参考文献
[1] 陈春梅, 王确, 周国强, 等.植物蛋白及其产品应用的研究进展[J].现代食品, 2022, 28(20):53-62.
CHEN C M, WANG Q, ZHOU G Q, et al.Research progress on the application of plant proteins and their products[J].Modern Food, 2022, 28(20):53-62.
[2] BOUKID F.The realm of plant proteins with focus on their application in developing new bakery products[J].Advances in Food and Nutrition Research, 2022, 99:101-136.
[3] ESTELL M, HUGHES J, GRAFENAUER S.Plant protein and plant-based meat alternatives:Consumer and nutrition professional attitudes and perceptions[J].Sustainability, 2021, 13(3):1478.
[4] ASCHEMANN-WITZEL J, GANTRIIS R F, FRAGA P, et al.Plant-based food and protein trend from a business perspective:Markets, consumers, and the challenges and opportunities in the future[J].Critical Reviews in Food Science and Nutrition, 2021, 61(18):3119-3128.
[5] OL AS R, DELGADO-ANDRADE C, PADIAL M, et al.An updated review of soy-derived beverages:Nutrition, processing, and bioactivity[J].Foods, 2023, 12(14):2665.
AS R, DELGADO-ANDRADE C, PADIAL M, et al.An updated review of soy-derived beverages:Nutrition, processing, and bioactivity[J].Foods, 2023, 12(14):2665.
[6] CRUNKHORN S.Plant protein blocks tumour growth[J].Nature Reviews.Drug Discovery, 2022, 21(7):494.
[7] FERRARI L, PANAITE S A, BERTAZZO A, et al.Animal- and plant-based protein sources:A scoping review of human health outcomes and environmental impact[J].Nutrients, 2022, 14(23):5115.
[8] KATHARINA C W.Vegan diet in sports and exercise-health benefits and advantages to athletes and physically active people:A narrative review[J].International Journal of Sports and Exercise Medicine, 2020, 6(3):165.
[9] KERKSICK C M, JAGIM A, HAGELE A, et al.Plant proteins and exercise:What role can plant proteins have in promoting adaptations to exercise?[J].Nutrients, 2021, 13(6):1962.
[10] GORISSEN S H M, CROMBAG J J R, SENDEN J M G, et al.Protein content and amino acid composition of commercially available plant-based protein isolates[J].Amino Acids, 2018, 50(12):1685-1695.
[11] SIM S Y J, SRV A, CHIANG J H, et al.Plant proteins for future foods:A roadmap[J].Foods, 2021, 10(8):1967.
[12] 中国食品科学技术学会植物基食品分会. 植物基食品的科学共识(2022年版)[J].中国食品学报, 2022, 22(10):450-457.
Plantbased Foods Society of the Chinese Institute of Food Science and Technology.Scientific consensus on plant-based foods(2022)[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(10):450-457.
[13] CRADDOCK J C, GENONI A, STRUTT E F, et al.Limitations with the digestible indispensable amino acid score (DIAAS) with special attention to plant-based diets:A review[J].Current Nutrition Reports, 2021, 10(1):93-98.
[14] KUMAR M, TOMAR M, POTKULE J, et al.Advances in the plant protein extraction:Mechanism and recommendations[J].Food Hydrocolloids, 2021, 115:106595.
[15] KAMEI Y, HATAZAWA Y, UCHITOMI R, et al.Regulation of skeletal muscle function by amino acids[J].Nutrients, 2020, 12(1):261.
[16] PLOTKIN D L, DELCASTILLO K, VAN EVERY D W, et al.Isolated leucine and branched-chain amino acid supplementation for enhancing muscular strength and hypertrophy:A narrative review[J].International Journal of Sport Nutrition and Exercise Metabolism, 2021, 31(3):292-301.
[17] DAY L, CAKEBREAD J A, LOVEDAY S M.Food proteins from animals and plants:Differences in the nutritional and functional properties[J].Trends in Food Science &Technology, 2022, 119:428-442.
[18] LYNCH H, JOHNSTON C, WHARTON C.Plant-based diets:Considerations for environmental impact, protein quality, and exercise performance[J].Nutrients, 2018, 10(12):1841.
[19] CARBONE J W, PASIAKOS S M.The role of dietary plant and animal protein intakes on mitigating sarcopenia risk[J].Current Opinion in Clinical Nutrition and Metabolic Care, 2022, 25(6):425-429.
[20] S A G A, MORENO Y M F, CARCIOFI B A M.Food processing for the improvement of plant proteins digestibility[J].Critical Reviews in Food Science and Nutrition, 2020, 60(20):3367-3386.
A G A, MORENO Y M F, CARCIOFI B A M.Food processing for the improvement of plant proteins digestibility[J].Critical Reviews in Food Science and Nutrition, 2020, 60(20):3367-3386.
[21] FRUCTUOSO I, ROM O B, HAN H, et al.An overview on nutritional aspects of plant-based beverages used as substitutes for cow’s milk[J].Nutrients, 2021, 13(8):2650.
O B, HAN H, et al.An overview on nutritional aspects of plant-based beverages used as substitutes for cow’s milk[J].Nutrients, 2021, 13(8):2650.
[22] QIN P X, WANG T R, LUO Y C.A review on plant-based proteins from soybean:Health benefits and soy product development[J].Journal of Agriculture and Food Research, 2022, 7:100265.
[23] HERTZLER S R, LIEBLEIN-BOFF J C, WEILER M, et al.Plant proteins:Assessing their nutritional quality and effects on health and physical function[J].Nutrients, 2020, 12(12):3704.
[24] BOYE J, ZARE F, PLETCH A.Pulse proteins:Processing, characterization, functional properties and applications in food and feed[J].Food Research International, 2010, 43(2):414-431.
[25] SHANTHAKUMAR P, KLEPACKA J, BAINS A, et al.The current situation of pea protein and its application in the food industry[J].Molecules, 2022, 27(16):5354.
[26] BOGAHAWATHTHA D, CHAU N H B, TRIVEDI J, et al.Impact of controlled shearing on solubility and heat stability of pea protein isolate dispersed in solutions with adjusted ionic strength[J].Food Research International, 2019, 125:108522.
[27] YADAV D, SINGH N K.Wheat triticin:A potential target for nutritional quality improvement[J].Asian Journal of Biotechnology, 2010, 3(1):1-21.
[28] BOUCHARD J, MALALGODA M, STORSLEY J, et al.Health benefits of cereal grain- and pulse-derived proteins[J].Molecules, 2022, 27(12):3746.
[29] POUTANEN K S, KÅRLUND A O, G MEZ-GALLEGO C, et al.Grains: A major source of sustainable protein for health[J].Nutrition Reviews, 2022, 80(6):1648-1663.
MEZ-GALLEGO C, et al.Grains: A major source of sustainable protein for health[J].Nutrition Reviews, 2022, 80(6):1648-1663.
[30] CERVANTES-PAHM S K, LIU Y H, STEIN H H.Digestible indispensable amino acid score and digestible amino acids in eight cereal grains[J].The British Journal of Nutrition, 2014, 111(9):1663-1672.
[31] RAFIQUE H, DONG R, WANG X L, et al.Dietary-nutraceutical properties of oat protein and peptides[J].Frontiers in Nutrition, 2022, 9:950400.
[32] BRUFAU G, BOATELLA J, RAFECAS M.Nuts:Source of energy and macronutrients[J].The British Journal of Nutrition, 2006, 96(Suppl 2):S24-S28.
[33] RABAIL R, KHAN M R, MEHWISH H M, et al.An overview of chia seed (Salvia hispanica L.) bioactive peptides’ derivation and utilization as an emerging nutraceutical food[J].Frontiers in Bioscience (Landmark Edition), 2021, 26(9):643-654.
[34] LESTARI Y N, FARIDA E, AMIN N, et al.Chia seeds (Salvia hispanica L.):Can they be used as ingredients in making sports energy gel?[J].Gels, 2021, 7(4):267.
[35] AGUILAR-TOAL J E, VIDAL-LIMON A, LICEAGA A M.Multifunctional analysis of chia seed (Salvia hispanica L.) bioactive peptides using peptidomics and molecular dynamics simulations approaches[J].International Journal of Molecular Sciences, 2022, 23(13):7288.
J E, VIDAL-LIMON A, LICEAGA A M.Multifunctional analysis of chia seed (Salvia hispanica L.) bioactive peptides using peptidomics and molecular dynamics simulations approaches[J].International Journal of Molecular Sciences, 2022, 23(13):7288.
[36] L PEZ D N, GALANTE M, ROBSON M, et al.Amaranth, quinoa and chia protein isolates:Physicochemical and structural properties[J].International Journal of Biological Macromolecules, 2018, 109:152-159.
PEZ D N, GALANTE M, ROBSON M, et al.Amaranth, quinoa and chia protein isolates:Physicochemical and structural properties[J].International Journal of Biological Macromolecules, 2018, 109:152-159.
[37] BORRES M P, SATO S, EBISAWA M.Recent advances in diagnosing and managing nut allergies with focus on hazelnuts, walnuts, and cashew nuts[J].World Allergy Organization Journal, 2022, 15(4):100641.
[38] BUCKNER S L, JESSEE M B, DANKEL S J, et al.Resistance exercise and sports performance:The minority report[J].Medical Hypotheses, 2018, 113:1-5.
[39] HARTMAN J W, TANG J E, WILKINSON S B, et al.Consumption of fat-free fluid milk after resistance exercise promotes greater lean mass accretion than does consumption of soy or carbohydrate in young, novice, male weightlifters[J].The American Journal of Clinical Nutrition, 2007, 86(2):373-381.
[40] HEVIA L V, GUALANO B, LONGOBARDI I, et al.High-protein plant-based diet versus a protein-matched omnivorous diet to support resistance training adaptations:A comparison between habitual vegans and omnivores[J].Sports Medicine, 2021, 51(6):1317-1330.
[41] PINCKAERS P J M, TROMMELEN J, SNIJDERS T, et al.The anabolic response to plant-based protein ingestion[J].Sports Medicine, 2021, 51(Suppl 1):59-74.
[42] JOY J M, LOWERY R P, WILSON J M, et al.The effects of 8 weeks of whey or rice protein supplementation on body composition and exercise performance[J].Nutrition Journal, 2013, 12:86.
[43] MOON J M, RATLIFF K M, BLUMKAITIS J C, et al.Effects of daily 24-gram doses of rice or whey protein on resistance training adaptations in trained males[J].Journal of the International Society of Sports Nutrition, 2020, 17(1):60.
[44] MOORE D R.Maximizing post-exercise anabolism:The case for relative protein intakes[J].Frontiers in Nutrition, 2019, 6:147.
[45] J GER R, KERKSICK C M, CAMPBELL B I, et al.International Society of Sports Nutrition Position Stand:Protein and exercise[J].Journal of the International Society of Sports Nutrition, 2017, 14:20.
GER R, KERKSICK C M, CAMPBELL B I, et al.International Society of Sports Nutrition Position Stand:Protein and exercise[J].Journal of the International Society of Sports Nutrition, 2017, 14:20.
[46] MORTON R W, MURPHY K T, MCKELLAR S R, et al.A systematic review, meta-analysis and meta-regression of the effect of protein supplementation on resistance training-induced gains in muscle mass and strength in healthy adults[J].British Journal of Sports Medicine, 2018, 52(6):376-384.
[47] MOORE D R, ROBINSON M J, FRY J L, et al.Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men[J].The American Journal of Clinical Nutrition, 2009, 89(1):161-168.
[48] YANG Y F, BREEN L, BURD N A, et al.Resistance exercise enhances myofibrillar protein synthesis with graded intakes of whey protein in older men[J].The British Journal of Nutrition, 2012, 108(10):1780-1788.
[49] BABAULT N, PAÏZIS C, DELEY G, et al.Pea proteins oral supplementation promotes muscle thickness gains during resistance training:A double-blind, randomized, Placebo-controlled clinical trial vs.Whey protein[J].Journal of the International Society of Sports Nutrition, 2015, 12(1):3.
[50] LAMB D A, MOORE J H, SMITH M A, et al.The effects of resistance training with or without peanut protein supplementation on skeletal muscle and strength adaptations in older individuals[J].Journal of the International Society of Sports Nutrition, 2020, 17(1):66.
[51] ZBINDEN-FONCEA H, RAMOS-NAVARRO C, HEVIA-LARRA N V, et al.Neither chia flour nor whey protein supplementation further improves body composition or strength gains after a resistance training program in young subjects with a habitual high daily protein intake[J].Nutrients, 2023, 15(6):1365.
N V, et al.Neither chia flour nor whey protein supplementation further improves body composition or strength gains after a resistance training program in young subjects with a habitual high daily protein intake[J].Nutrients, 2023, 15(6):1365.
[52] PINCKAERS P J M, HENDRIKS F K, HERMANS W J H, et al.Potato protein ingestion increases muscle protein synthesis rates at rest and during recovery from exercise in humans[J].Medicine and Science in Sports and Exercise, 2022, 54(9):1572-1581.
[53] KNUIMAN P, HOPMAN M T E, VERBRUGGEN C, et al.Protein and the adaptive response with endurance training:Wishful thinking or a competitive edge?[J].Frontiers in Physiology, 2018, 9:598.
[54] LIN Y N, TSENG T T, KNUIMAN P, et al.Protein supplementation increases adaptations to endurance training:A systematic review and meta-analysis[J].Clinical Nutrition, 2021, 40(5):3123-3132.
[55] LIAO Y H, CHEN C N, HU C Y, et al.Soymilk ingestion immediately after therapeutic exercise enhances rehabilitation outcomes in chronic stroke patients:A randomized controlled trial[J].NeuroRehabilitation, 2019,44(2):217-229.
[56] GHOSH A K, RAHAMAN A A, SINGH R.Combination of sago and soy-protein supplementation during endurance cycling exercise and subsequent high-intensity endurance capacity[J].International Journal of Sport Nutrition and Exercise Metabolism, 2010, 20(3):216-223.
[57] MCLELLAN T M, PASIAKOS S M, LIEBERMAN H R.Effects of protein in combination with carbohydrate supplements on acute or repeat endurance exercise performance:A systematic review[J].Sports Medicine, 2014, 44(4):535-550.
[58] KERKSICK C M, ARENT S, SCHOENFELD B J, et al.International society of sports nutrition position stand:Nutrient timing[J].Journal of the International Society of Sports Nutrition, 2017, 14:33.
[59] LI F, HSUEH Y T, HSU Y J, et al.Effects of isolated soy protein supplementation combined with aerobic exercise training on improving body composition, anthropometric characteristics and cardiopulmonary endurance in women:A pilot study[J].International Journal of Environmental Research and Public Health, 2021, 18(22):11798.
[60] MOORE D R, CAMERA D M, ARETA J L, et al.Beyond muscle hypertrophy:Why dietary protein is important for endurance athletes[J].Applied Physiology, Nutrition, and Metabolism = Physiologie Appliquee, Nutrition et Metabolisme, 2014, 39(9):987-997.
[61] KRITIKOS S, PAPANIKOLAOU K, DRAGANIDIS D, et al.Effect of whey vs.soy protein supplementation on recovery kinetics following speed endurance training in competitive male soccer players:A randomized controlled trial[J].Journal of the International Society of Sports Nutrition, 2021, 18(1):23.
[62] DAVIES R W, CARSON B P, JAKEMAN P M.The effect of whey protein supplementation on the temporal recovery of muscle function following resistance training:A systematic review and meta-analysis[J].Nutrients, 2018, 10(2):221.
[63] LIU W X.Experimental research into the influence of soy peptide on the volleyball players’ biochemical indexes[J].Journal of Chemical and Pharmaceutical Research, 2013, 5(12):364-367.
[64] SHENOY S, DHAWAN M, SINGH SANDHU J.Four weeks of supplementation with isolated soy protein attenuates exercise-induced muscle damage and enhances muscle recovery in well trained athletes:A randomized trial[J].Asian Journal of Sports Medicine, 2016, 7(3):e33528.
[65] BALASEKARAN G, PAN S Y, NG Y C.Effects of soy milk ingestion on anaerobic performance and physiological measures[J].Journal of Exercise Physiology,2021, 24(2):102-116.
[66] CHATTERJEE C, GLEDDIE S, XIAO C W.Soybean bioactive peptides and their functional properties[J].Nutrients, 2018, 10(9):1211.
[67] PASIAKOS S M, LIEBERMAN H R, MCLELLAN T M.Effects of protein supplements on muscle damage, soreness and recovery of muscle function and physical performance:A systematic review[J].Sports Medicine, 2014, 44(5):655-670.
[68] SPOELDER M, KOOPMANS L, HARTMAN Y A W, et al.Supplementation with whey protein, but not pea protein, reduces muscle damage following long-distance walking in older adults[J].Nutrients, 2023, 15(2):342.
[69] NIEMAN D C, ZWETSLOOT K A, SIMONSON A J, et al.Effects of whey and pea protein supplementation on post-eccentric exercise muscle damage:A randomized trial[J].Nutrients, 2020, 12(8):2382.
[70] XIA Z, CHOLEWA J M, DARDEVET D, et al.Effects of oat protein supplementation on skeletal muscle damage, inflammation and performance recovery following downhill running in untrained collegiate men[J].Food &Function, 2018, 9(9):4720-4729.
[71] REIDY P T, WALKER D K, DICKINSON J M, et al.Protein blend ingestion following resistance exercise promotes human muscle protein synthesis[J].The Journal of Nutrition, 2013, 143(4):410-416.
[72] REN G X, YI S Q, ZHANG H R, et al.Ingestion of soy-whey blended protein augments sports performance and ameliorates exercise-induced fatigue in a rat exercise model[J].Food &Function, 2017, 8(2):670-679.
[73] PAHLAVANI N, ENTEZARI M H, NASIRI M, et al.The effect of l-arginine supplementation on body composition and performance in male athletes:A double-blinded randomized clinical trial[J].European Journal of Clinical Nutrition, 2017, 71(4):544-548.
[74] COQUEIRO A Y, ROGERO M M, TIRAPEGUI J.Glutamine as an anti-fatigue amino acid in sports nutrition[J].Nutrients, 2019, 11(4):863.
Effects of plant protein supplementation on exercise ability
TAN Qiushi, CHEN Yue, SHAO Jing, AN Nan*, WANG Qirong*
(National Institute of Sports Medicine, Beijing 100029, China)
ABSTRACT Meat and other animal-derived proteins have long been seen as an integral part of the diet of athletes and fitness enthusiasts.In recent years, plant proteins have become increasingly popular due to their positive effects on the environment and health.However, compared with animal protein, the application of plant protein in China is still in the preliminary stage, and there are also relatively few relevant studies on the effects of plant protein supplementation on human exercise ability.In this paper, the nutritional characteristics of plant protein were summarized, the effects of adding plant protein in resistance exercise and endurance exercise on muscle strength, muscle mass, lean body weight, exercise performance, muscle damage and recovery were discussed, the effective doses and other factors of plant protein to improve exercise performance were pointed out.It is hoped that this will provide a basis for the research, development and application of plant protein in the field of sports.
Key words plant protein;nutritional characteristics;resistance exercise;endurance exercise;muscle damage




 AS R, DELGADO-ANDRADE C, PADIAL M, et al.An updated review of soy-derived beverages:Nutrition, processing, and bioactivity[J].Foods, 2023, 12(14):2665.
AS R, DELGADO-ANDRADE C, PADIAL M, et al.An updated review of soy-derived beverages:Nutrition, processing, and bioactivity[J].Foods, 2023, 12(14):2665. A G A, MORENO Y M F, CARCIOFI B A M.Food processing for the improvement of plant proteins digestibility[J].Critical Reviews in Food Science and Nutrition, 2020, 60(20):3367-3386.
A G A, MORENO Y M F, CARCIOFI B A M.Food processing for the improvement of plant proteins digestibility[J].Critical Reviews in Food Science and Nutrition, 2020, 60(20):3367-3386. O B, HAN H, et al.An overview on nutritional aspects of plant-based beverages used as substitutes for cow’s milk[J].Nutrients, 2021, 13(8):2650.
O B, HAN H, et al.An overview on nutritional aspects of plant-based beverages used as substitutes for cow’s milk[J].Nutrients, 2021, 13(8):2650. MEZ-GALLEGO C, et al.Grains: A major source of sustainable protein for health[J].Nutrition Reviews, 2022, 80(6):1648-1663.
MEZ-GALLEGO C, et al.Grains: A major source of sustainable protein for health[J].Nutrition Reviews, 2022, 80(6):1648-1663. GER R, KERKSICK C M, CAMPBELL B I, et al.International Society of Sports Nutrition Position Stand:Protein and exercise[J].Journal of the International Society of Sports Nutrition, 2017, 14:20.
GER R, KERKSICK C M, CAMPBELL B I, et al.International Society of Sports Nutrition Position Stand:Protein and exercise[J].Journal of the International Society of Sports Nutrition, 2017, 14:20.