表1 引物序列
Table 1 Primer sequence
基因序列正向引物反向引物FAD2ACTTTTGCTCGTGGTGCTGCTGTGGCTTCGGTTGCTTCTCTTGCRPL4AAGTTTCCGTCATCTCCGTTCAAGGGCAACAGCGTATGCTTGTCTCTTGRPL10TGCCATGTCTGTTGATGACTTGAAGCCTTTGACAAAGTTGGTCCCActinTGATGGTGTCACTCACGTTGTTCCCAGCAGTAGTGGAGAAACCGTAACC
泡菜是以新鲜蔬菜为原料,经中低浓度食盐水泡渍发酵、调味、包装、灭菌等过程生产加工而成的发酵食品[1]。截至2021年年底,四川省共有泡菜生产企业450余家,市场份额占中国总市场份额的70%,年产值446亿元[2]。但由于泡菜原料未经过灭菌处理和泡菜发酵过程难以控制,在发酵过程中一旦发酵条件不利,腐败微生物就会大量滋生,造成泡菜品质劣变,大量产品废弃,给泡菜生产企业带来严重经济损失[3]。因此,泡菜品质的保持对于泡菜生产企业而言就显得尤为重要。
在泡菜品质劣变的众多现象中,“生花”是泡菜最常见的品质裂变现象。泡菜“生花”是微生物在不良环境影响下,与渗出的胞外聚合物一起凝聚成的膜,可附着在固体表面或漂浮于液体表面[4]。泡菜“生花”不仅影响风味,还会加快泡菜的腐败,导致整坛泡菜都不能食用[5-6]。现有研究表明引起泡菜“生花”的微生物主要是酵母菌:毕赤酵母、假丝酵母、汉斯德巴氏酵母、酿酒酵母等[6-8]。作者在前期研究中证实了“生花”酵母菌(Candida parapsilosis B7)易成膜且成膜稳定,并且“生花”受温度和O2的影响[9]。虽然现在众多研究证明了导致泡菜“生花”的主要菌属是酵母菌,也分离到了具体的“生花”菌株,但是关于“生花”菌株的“生花”机制研究并不多见,使得泡菜“生花”问题未能有效解决。
泡菜“生花”受环境因素影响,泡菜坛/池的密封性是影响泡菜“生花”的关键因素[9]。本文选取在“生花”泡菜中分离鉴定的主要“生花”菌株C.parapsilosis B7为研究对象,模拟密封/非密封2种环境条件,利用转录组学和生物信息学结合分析的方法,研究C.parapsilosis B7在有/无空气下转录组表达的差异情况,同时进行实时荧光定量PCR(real-time quantitative PCR, qRT-PCR)验证关键差异基因的变化,探究C.parapsilosis B7的“生花”分子机制,为研究泡菜“生花”精准防控提供理论基础。
1.1.1 菌株
“生花”酵母菌(C.parapsilosis B7)由本实验室菌种资源库保藏(“生花”泡菜样液中分离得到)。
1.1.2 试剂
YPD培养基、酵母基因组DNA提取试剂盒,北京索莱宝科技有限公司;Trizol Reagent、RevertAid第一链cDNA合成试剂盒,美国Thermo Fisher科技有限公司;异丙醇、无水乙醇,重庆川东化工有限公司;三氯甲烷,重庆科试化学有限公司;无核糖核酸酶水,上海碧云天公司。
H-2050R台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;CFX Connect型PCR仪,美国BioRad公司;LRHS-150-Ⅱ恒温恒湿培养箱,上海跃进医疗器械有限公司;SW-CJ 2FD双人单面超净工作台,苏州安泰空气技术有限公司;HiSeq X Reagent Kits/NovaSeq Reagent Kits测序平台,美国Illumina公司。
1.3.1 菌株的活化
取甘油保藏的C.parapsilosis B7 200 μL接种到10 mL液体YPD培养基中,37 ℃培养48 h。在液体YPD培养基菌悬液中取一环接种到固体YPD培养基中,37 ℃培养48 h;在固体YPD培养基菌落中取一环接种到10 mL液体YPD培养基中,37 ℃培养48 h;最后在该液体YPD培养基菌悬液中取一环接种到固体YPD培养基中,37 ℃培养48 h后于4 ℃储存,备用。
1.3.2 转录组测序
1)菌体收集
将活化的C.parapsilosis B7接种到YPD液体培养基中,实验组(有空气)使用透气试管塞,对照组(无空气)使用玻璃塞,37 ℃培养48 h。于10 000×g 4 ℃离心10 min,去除上清液,使用无菌PBS洗涤菌体3次,收集菌体,经液氮速冻保存。每个组3个重复。
2)RNA提取、文库构建及测序
采用TRIzol(Invitrogen)法提取样本中的总RNA,并使用DNase I(TaKaRa)去除基因组DNA。分别采用2100 Bioanalyser(Agilent)、ND-2000(NanoDrop Technologies)方法检测RNA样品的质量。采用TruSeqTM RNA sample preparation Kit(Illumina,San Diego,CA)试剂盒进行RNA文库的构建。使用Ilumina HiSeq xten/NovaSeq 6000测序平台进行高通量测序。
1.3.2.1 差异基因(differential expression analyses,DEGs)表达
使用软件RSEM(http://deweylab.github.io/RSEM/)分别定量分析基因和转录本的表达水平。使用DESeq2软件进行差异基因筛选并对原始计数(raw counts)进行统计分析以获得组间差异表达基因或转录本的比较结果,筛选条件为P<0.05且|log2FC|≥1。
1.3.2.2 GO和KEGG富集
以进行差异显著分析并注释到GO和KEGG数据库的基因集为背景基因集,差异显著分析所得到的DEGs注释到GO和KEGG数据库的基因集为差异基因集,利用DESeq2软件对DEGs进行GO功能富集和KEGG通路分析。
1.3.3 qRT-PCR检测差异基因表达
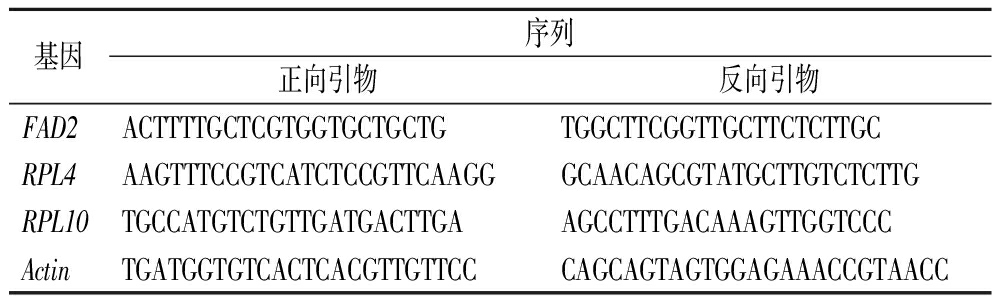
根据RNA-seq数据随机选择DEGs,采用Primer 3程序设计引物。PCR条件为95 ℃预变性3 min;95 ℃变性5 s,56 ℃退火30 s,共40个循环。以Actin为内参,采用2-△△CT法计算相对表达。引物及序列见表1。
表1 引物序列
Table 1 Primer sequence

基因序列正向引物反向引物FAD2ACTTTTGCTCGTGGTGCTGCTGTGGCTTCGGTTGCTTCTCTTGCRPL4AAGTTTCCGTCATCTCCGTTCAAGGGCAACAGCGTATGCTTGTCTCTTGRPL10TGCCATGTCTGTTGATGACTTGAAGCCTTTGACAAAGTTGGTCCCActinTGATGGTGTCACTCACGTTGTTCCCAGCAGTAGTGGAGAAACCGTAACC
使用美吉平台(cloud.majorbio.com)对数据进行转录组测序。使用SPSS 21.0的ANOVA法对数据进行单因素方差分析。使用Microsoft Office Excel对qRT-PCR和RNA-seq结果进行皮尔逊相关性分析。使用Origin 2018绘图。
总体而言,在去除接头污染、长度不足或质量差的序列后,获得了两组有效的数据,超过93.79%的reads的平均质量值≥30,6个样品的GC含量为(40.42±0.02)%(表2)。以上结果说明,本次测序所得cDNA文库质量高,可以进行后续生物信息学的进一步研究。对比其他文献对于其研究内容的转录组数据统计分析,本研究与其相似之处在于同样进行了Clean reads和Clean bases的统计比较,不同之处在于其根据研究内容特性对每个样品总比对数/率、特异比对数/率及外显子比对数/率进行了统计[10]。而本研究则是对样品的碱基质量百分数和GC含量进行统计分析,能更好突出本次测序文库质量。
表2 C.parapsilosis B7测序数据统计评估
Table 2 Evaluation and statistics of sequencing data of C.parapsilosis B7
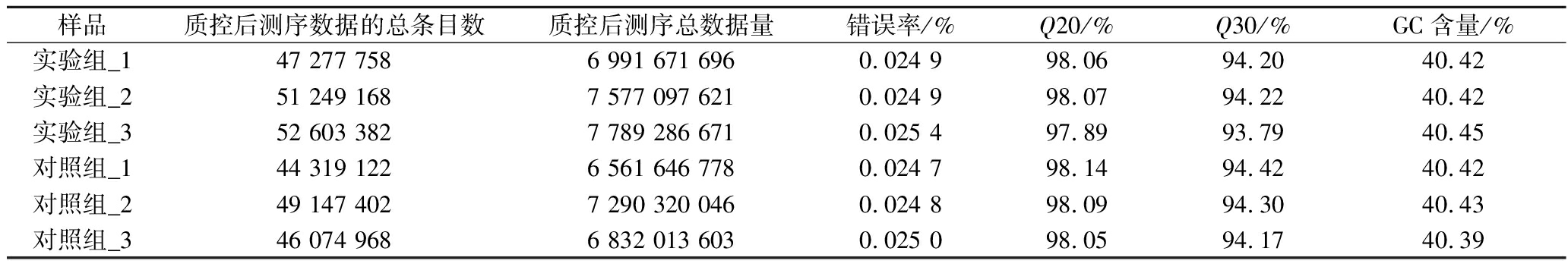
样品质控后测序数据的总条目数质控后测序总数据量错误率/%Q20/%Q30/%GC含量/%实验组_147 277 7586 991 671 6960.024 998.0694.2040.42实验组_251 249 1687 577 097 6210.024 998.0794.2240.42实验组_352 603 3827 789 286 6710.025 497.8993.7940.45对照组_144 319 1226 561 646 7780.024 798.1494.4240.42对照组_249 147 4027 290 320 0460.024 898.0994.3040.43对照组_346 074 9686 832 013 6030.025 098.0594.1740.39
注:Q20,碱基质量值>20的碱基占总碱基的百分比;Q30,碱基质量值>30的碱基占总碱基的百分比。
表3 显著差异通路及基因分析
Table 3 Significant difference pathways and gene analysis

通路号描述基因号KO_名称上调/下调map03010核糖体DN5437_c0_g1RPL10 (核糖体蛋白L10基因)上调DN1751_c0_g1RPS2 (核糖体蛋白S2基因)上调DN5749_c1_g1RPL3 (核糖体蛋白L3基因)上调DN1737_c1_g1RPS2 (核糖体蛋白S2基因)上调DN8990_c0_g1RPL5 (核糖体蛋白L5基因)上调DN1097_c1_g1RACK1 (蛋白激酶C1受体基因)上调DN2574_c0_g1RPS2 (核糖体蛋白S2基因)上调DN3332_c0_g1RPL12 (核糖体蛋白L12基因)上调DN5235_c0_g3RPSA (核糖体蛋白SA基因)上调DN1561_c0_g1RPL4 (核糖体蛋白L4基因)上调DN2609_c2_g1L10Ae (核糖体蛋白L10Ae基因)上调DN7242_c0_g1RPL15 (核糖体蛋白L10基因)上调DN5380_c0_g1RPL3 (核糖体蛋白L10基因)上调map01040不饱和脂肪酸生物合成DN8925_c0_g1FAD2 (油酸脱氢酶)上调DN139_c0_g5SCD(酰基脂质去饱和酶)下调
使用DESeq2软件筛选出具有显著差异表达的基因(P<0.05,上/下调差异倍数为>2.0倍)。采用散点图和火山图表现差异基因在两个样本间的表达差异程度。其他文献采用韦恩图和火山图进行实验组和对照组的基因表达差异分析,通过韦恩图展现实验组和对照组基因的相似性[11-13]。如图1所示,横坐标表示基因的表达倍数变化,纵坐标表示基因的差异显著性;红点表示上调基因,蓝点表示下调基因,灰点表示差异不显著基因。转录组数据分析表明,与对照组相比,实验组中筛选到183个DEGs,其中42个DEGs表达显著上调,占总DEGs的22.95%,141个DEGs表达显著下调(图1)(P<0.05)。结果表明C.parapsilosis B7在空气刺激下,基因表达发生一定的差异性。从上述结果中筛选有空气条件下C.parapsilosis B7形成生物膜相关表达差异基因进行后续分析。
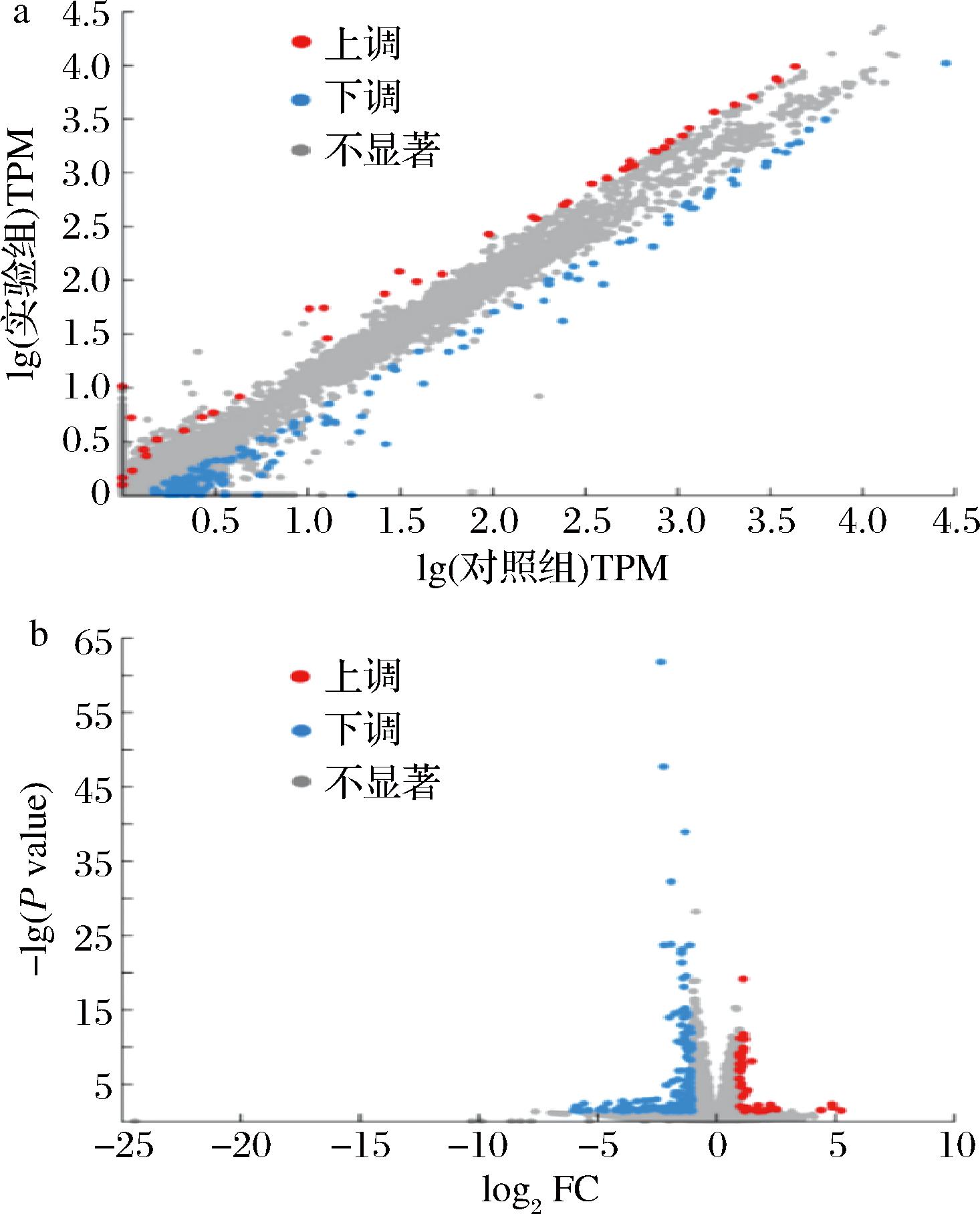
a-表达量差异散点图;b-表达量差异火山图
图1 DEGs表达量差异统计
Fig.1 Differential statistics of DEGs Expression
通过Goatools软件将DEGs注释到Gene Ontology(GO)数据库,得到DEGs可能具有的功能信息,其中GO包括分子功能(molecular function, MF)、细胞组分(cellular component, CC)和生物过程(biological process, BP)3个维度。如图2所示,显著上调的DEGs在3个维度中富集的显著性水平较高,在BP类主要富集到蛋白质相关过程(有机氮化合物生物合成过程、肽生物合成过程、肽代谢过程、细胞蛋白质代谢过程、细胞氮化合物生物合成过程)以及酰胺合成、代谢,在CC和MF类主要富集到核糖体相关部位(胞质小核糖体亚单位、核糖体小亚基、核糖核蛋白复合物、大核糖体亚基、核糖体亚基、胞质大核糖体亚基、核糖体的结构成分)。如图2所示,显著下调的DEGs在BP类主要富集到某些糖类酶的活性(葡聚糖外切-1,3-β-葡萄糖苷酶活性、葡聚糖内切-1,6-β-葡萄糖苷酶活性、D-阿拉伯糖-1-脱氢酶活性),在CC类主要富集到某些糖类代谢(葡聚糖分解代谢过程、多糖分解代谢过程、细胞碳水化合物代谢过程)及脂肪酸的合成、代谢。脂肪酸的生物合成原料主要是葡萄糖分解代谢产生的乙酰CoA,且天冬酰胺等参与脂肪酸的生物合成,则酰胺生物合成、细胞酰胺代谢可能与脂肪酸生物合成相关。同时核糖体是合成蛋白质的场所,它将遗传密码转换成氨基酸序列并从氨基酸单体构建蛋白质聚合物[14-15]。以上结果表明,空气刺激会影响核糖体功能和脂肪酸合成及代谢进而影响C.parapsilosis B7的生长及代谢,这为差异基因的KEGG富集分析提供思路。

图2 DEGs GO富集分析
Fig.2 GO analysis classification of DEGs
注:横坐标表示GO term,纵坐标表示富集的显著性水平,对应的是柱子的高度。3个颜色表示的是3大分类,分别是BP、CC和MF。
为了进一步系统地分析差异基因富集到的代谢通路,采用KOBAS(一个用于注释和识别丰富的路径和疾病的web服务器)分析受空气影响的C.parapsilosis B7对KEGG途径的富集,采用BH(FDR)方法进行多路复用,并根据生物信息学数据库将DEGs分配到不同的途径。如图3所示,DEGs显著富集到核糖体途径,脂肪酸生物合成途径中(P<0.05),则KEGG富集到的通路与GO富集分析到的功能一致。
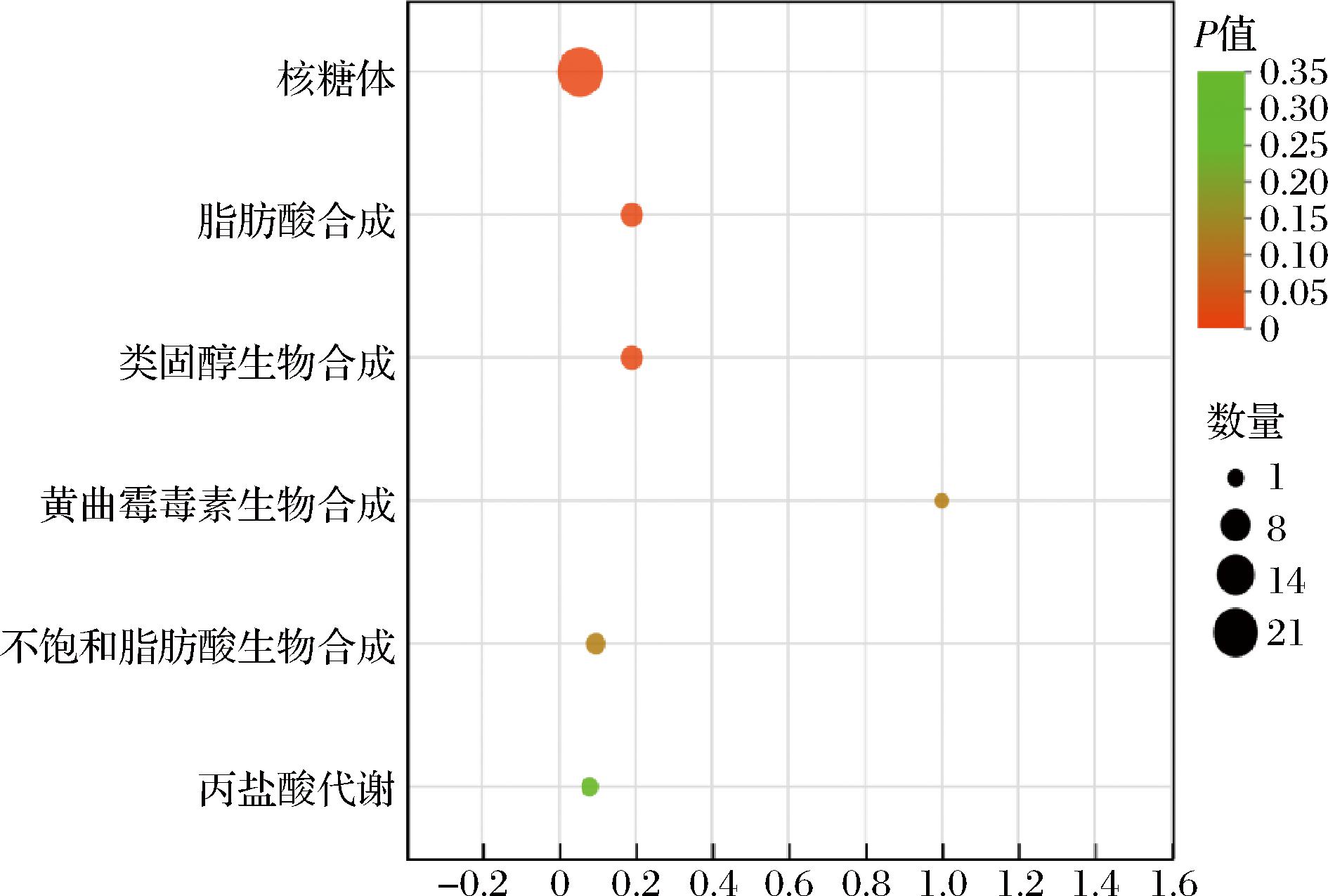
图3 差异表达基因KEGG富集分析
Fig.3 KEGG pathway analysis of differentially expressed genes
注:纵轴表示通路名称,横轴表示该通路中富集到的unigene数目(sample number)与注释unigen数目(background number)的比值,横轴数值越大,表示富集的程度越大。点的大小表示此通路中基因个数多少,而点的颜色对应于不同的Q值范围。该图只显示富集程度 在前20位的基因。
DEGs在核糖体的通路显著富集,且富集数最多,超过差异基因总数的25%。核糖体是合成蛋白质的分子机器,通过对mRNA的解读,与携带氨基酸的tRNA协同作用翻译出一条多肽链,多肽链再经过后期的加工、折叠及转运等过程,最后形成有功能的蛋白[14-15]。在菌株进行生命活动的每个过程中都有核糖体的参与,本研究中核糖体中的亚基蛋白的调控基因RPL3/4/5/10/12/15、RPSA/3A/15A、RPS9和RPL7A/10A是显著上调的(图4)。

图4 核糖体通路
Fig.4 The pathway of ribosome
RPL3/4/5/10/12/15、RPSA/3A/15A、RPS9和RPL7A/10A基因注释到翻译过程,上述基因的上调提高了翻译准确度,促进了翻译的正向调节,说明翻译质量和速度将可能会加快。核糖体蛋白SA(ribosomal protein SA, RPSA)是40S核糖体亚基的一个组成部分,在HeLa细胞中被鉴定为H2O2靶点[16]。核糖体蛋白L4和L22形成大核糖体亚基中肽出口通道的一部分。RPL4蛋白是一种高度保守的核糖体亚基,其对于维持核糖体翻译效率和保真度至关重要[17]。RPL10位于氨基酸tRNAs在调节过程中移动的通道附近,并参与tRNA通过该结构的运动;RPL10还很好地定位为肽酰转移酶中心附近的活性传感器,并将该信息传递到其他功能中心以协调核糖体功能。RPL10环是核糖体结构和功能的主控制器,影响核糖体组装和生物发生的关键步骤以及延伸的蛋白质合成阶段[18]。生物膜的主要成分是脂质和蛋白质,蛋白质在生物膜的形成中起促进作用[9,19]。有空气条件下,核糖体通路中RPL10、RPSA等基因上调有利于蛋白质的合成,从而有利于生物膜的形成。
另外,DEGs在脂肪酸生物合成途径中显著富集。脂肪酸分为饱和脂肪酸和不饱和脂肪酸,其中在不饱和脂肪酸合成途径中FAD2显著上调(P<0.05)。FAD2基因编码对多不饱和脂质合成至关重要的酶,在不饱和脂肪酸的生物合成途径中起着极其重要的作用[20]。磷脂的组成成分磷脂酰丝氨酸和磷脂酰乙醇胺含不饱和脂肪酸较多,而磷脂又是生物膜的重要组成部分[21-22]。细胞膜上的磷脂主要由磷脂酰乙醇胺(phosphatidylethanolamine, PE)、磷脂酰肌醇(phosphatidylinositol, PI)和磷脂酰胆碱(phosphatidylcholine, PC)组成,其中PS、PE和PI位于细胞膜脂质双层内侧,PC位于膜外侧,PS和PE中[22]。因此脂肪酸代谢通路中FAD2是不饱和脂肪酸合成的关键基因,从而有利于形成磷脂,进而有利于生物膜的形成。
在KEGG富集分析中,实验组相对于对照组而言,FAD2上调(表2),由于FAD2基因编码对多不饱和脂质合成至关重要的酶[20],则多不饱和脂质合成增加。同时核糖体蛋白调控基因如RPL4、RPL10,RACK1,RPS2等上调(表2),说明核糖体的作用加剧,促进蛋白质的产生[14-15],从而有利于生物膜的形成[19]。为了验证转录组学预测的准确性,定量分析了核糖体通路和脂肪酸生物合成通路中的FAD2、RPL4、RPL10的表达量。其中并没有选择甾醇通路中基因进行qRT-PCR验证,这是因为在这个通路中基因虽然发生显著变化,但其表达量非常低。如图5所示,验证结果表明,实验组相对于对照组,这3个基因的表达量显著上调(P<0.05)。转录组测序结果与qRT-PCR结果一致,表明DEGs的结论是可靠的。
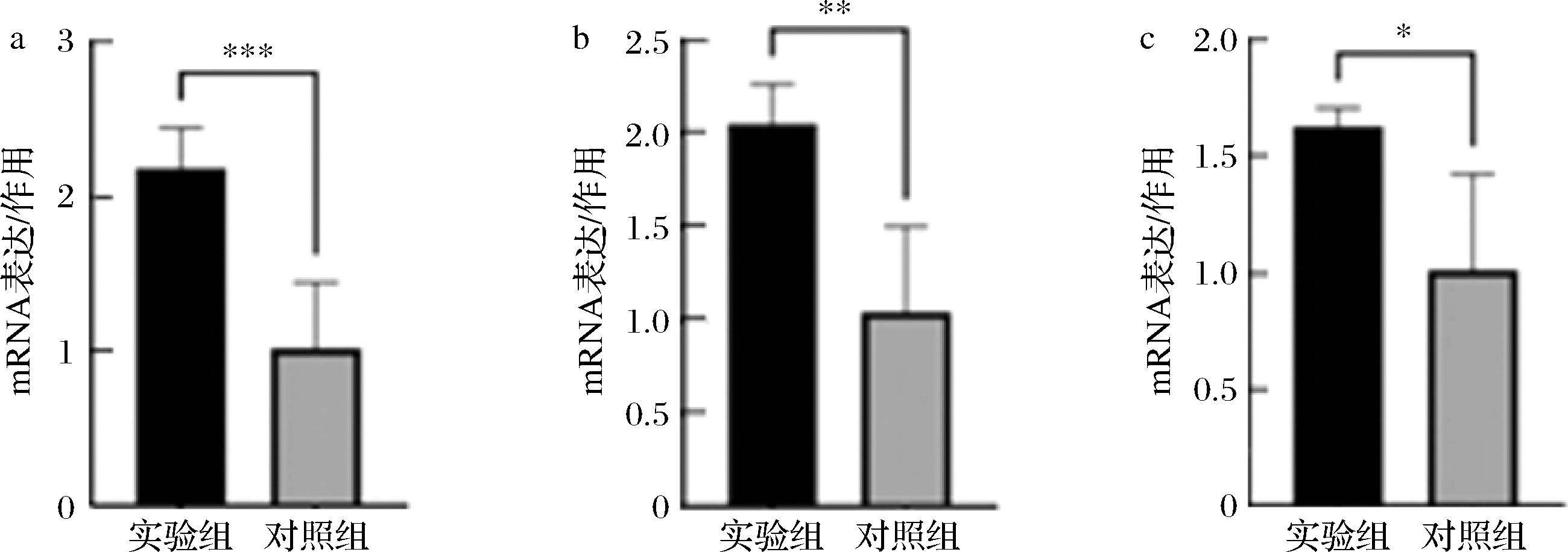
a-FAD2;b-RPL4;c-RPL10
图5 DEGs的qRT-PCR验证
Fig.5 qRT-PCR validations of DEGs
注:*表示P<0.05,**表示P<0.01,***表示P<0.001。
本文通过对泡菜中“生花”酵母菌C.parapsilosis B7进行转录组测序,分析了有空气和无空气条件下C.parapsilosis B7差异表达基因。研究发现,空气刺激下C.parapsilosis B7中具有合成蛋白质和磷脂功能的基因发生了变化,对核糖体通路和脂肪酸合成通路具有显著影响,改变了这两个通路中的25个基因的上调/下调。在核糖体通路中,核糖体蛋白调控基因RPL4、RPL10、RPSA较为关键,且脂肪酸合成通路中FAD2为关键基因。经过qRT-PCR验证,证实空气刺激导致RPL4、RPL10、FAD2基因显著上调。综上所述,空气刺激可通过上调RPL4、RPL10、FAD2等关键基因的表达,而使核糖体和脂肪酸合成通路上调,进而有利于产生蛋白质和磷脂,从而导致C.parapsilosis B7“生花”。本研究结果为C.parapsilosis B7“生花”机理的深入探索提供依据,同时为泡菜“生花”现象的抑制提供靶向研究方向。
[1] 邓维琴, 伍亚龙, 陈功, 等.多代发酵泡菜母水微生物多样性及其理化指标动态研究[J].食品与发酵工业, 2018, 44(8):49-56.
DENG W Q, WU Y L, CHEN G, et al.Study on microbial diversity and physiochemical index of multi-generational fermented Paocai brine[J].Food and Fermentation Industries, 2018, 44(8):49-56.
[2] 黄润秋, 唐垚, 费敏, 等.四川泡菜盐渍液处理及应用的研究进展[J].食品与发酵工业, 2023, 49(1):330-336.
HUANG R Q, TANG Y, FEI M, et al.Research progress on treatment and application of Sichuan Paocai saline[J].Food and Fermentation Industries, 2023, 49(1):330-336.
[3] LIU L, SHE X, QIAN Y, et al.Effect of different fermenting containers on the deterioration of Sichuan pickle[J].LWT, 2019, 111:829-836.
[4] 王猛. 四川泡菜腐败过程中腐败细菌的分离鉴定及其腐败特性分析[D].成都:西华大学, 2016.
WANG M.Isolation, identification and characteristics analysis of spoilage bacteria in Sichuan pickle during the deteriorating process[D].Chengdu:Xihua University, 2016.
[5] RAO Y, QIAN Y, SHE X, et al.Pellicle formation, microbial succession and lactic acid utilisation during the aerobic deteriorating process of Sichuan pickle[J].International Journal of Food Science &Technology, 2018, 53(3):767-775.
[6] 何鹏晖, 厍晓, 钱杨, 等.发酵蔬菜中腐败微生物及其防控的研究进展[J].食品工业科技, 2017, 38(11):374-378;384.
HE P H, SHE X, QIAN Y, et al.Research advances of spoilage microorganisms and their preventive measures in fermented vegetables[J].Science and Technology of Food Industry, 2017, 38(11):374-378;384.
[7] LU J Y, HU X C, REN L J.Biofilm control strategies in food industry:Inhibition and utilization[J].Trends in Food Science &Technology, 2022, 123:103-113.
[8] 黄道梅, 胡露, 贾秋思, 等.多菌协同发酵萝卜过程中不同盐浓度对菌相的影响[J].食品与发酵工业, 2016, 42(6):36-43.
HUANG D M, HU L, JIA Q S, et al.Effect of different salinity on the microbial community diversity during strains synergism fermentation of pickled radish[J].Food and Fermentation Industries, 2016, 42(6):36-43.
[9] YANG Y, LIAN Y Y, YIN S M, et al.Inhibition of Lactobacillus fermentum SHY10 on the white membrane production of soaked pickled radish[J].Food Science &Nutrition, 2022, 10(7):2236-2244.
[10] FENG G R, LI X D, WANG W J, et al.Effects of peptide thanatin on the growth and transcriptome of Penicillium digitatum[J].Frontiers in Microbiology, 2020, 11:606482.
[11] 文明明, 毕洁, 贺艳萍, 等.高糖饮食抑制后代雄性果蝇寿命和育性及其作用机制[J].现代食品科技, 2022, 38(10):9-18.
WEN M M, BI J, HE Y P, et al.Lifespan and fertility of male Drosophila melanogaster decreased by A high-sucrose diet and the related mechanisms[J].Modern Food Science and Technology, 2022, 38(10):9-18.
[12] 李姝, 童钰琴, 杨舒淋, 等.β-烟酰胺单核苷酸促秀丽隐杆线虫生长及其作用机制[J].食品工业科技, 2023, 44(19):417-426.
LI S, TONG Y Q, YANG S L, et al.Effect of β-nicotinamide mononucleotide on the growth promotion of Caenorhabditis elegans and its mechanism[J].Science and Technology of Food Industry, 2023, 44(19):417-426.
[13] 刘永泉. 基于转录组学和代谢组学研究脐橙-黄龙病菌-柑橘木虱的互作机制[D].南昌:南昌大学, 2022.
LIU Y Q.The interaction mechanism of navel orange-candidatus liberibacter asiaticus-asian citrus psyllids based on transcriptomics and metabolomics[D].Nanchang:Nanchang University, 2022.
[14] 杨恺清, 赵景霖, 毛小琴.核糖体蛋白的核糖体外功能及其在疾病中的作用[J].生理科学进展, 2021, 52(3):227-230.
YANG K Q, ZHAO J L, MAO X Q.The extra-ribosomal functions of ribosomal proteins and their role in disease[J].Progress in Physiological Sciences, 2021, 52(3):227-230.
[15] 郭文环. 间充质干细胞对阿尔茨海默症模型小鼠的治疗作用及相关机制研究[D].北京:北京科技大学, 2022.
GUO W H.Therapeutic effects and mechanisms of mesenchymal stem cell on Alzheimer’s disease model mice[D].Beijing:University of Science and Technology Beijing, 2022.
[16] VILAS-BOAS F, BAGULHO A, JER NIMO A, et al.Data on intracellular localization of RPSA upon alteration of its redox state[J].Data in Brief, 2016, 6:311-315.
NIMO A, et al.Data on intracellular localization of RPSA upon alteration of its redox state[J].Data in Brief, 2016, 6:311-315.
[17] 任红玉. 禽呼肠孤病毒σA蛋白与宿主蛋白HSP70、HSP40和RPL4相互作用的初步研究[D].南宁:广西大学, 2019.
REN H Y.Preliminary study on the interaction between avian reovirus σA protein and host proteins HSP70, HSP40 and RPL4[D].Nanning:Guangxi University, 2019.
[18] RAMU V S, DAWANE A, LEE S, et al.Ribosomal protein QM/RPL10 positively regulates defence and protein translation mechanisms during nonhost disease resistance[J].Molecular Plant Pathology, 2020, 21(11):1481-1494.
[19] 魏荷芬, 施明雨, 郭亭, 等.耐盐异养好氧氨氧化菌株的筛选、鉴定及特性研究[J].生物加工过程, 2023, 21(1):76-82.
WEI H F, SHI M Y, GUO T, et al.Screening, identification and characterization of salt-tolerant heterotrophic aerobicammoxidation strain[J].Chinese Journal of Bioprocess Engineering, 2023, 21(1):76-82.
[20] 魏小艳, 李勇, 谭宇萍, 等.薏苡delta-12脂肪酸去饱和酶基因FAD2的克隆和表达分析[J].药学学报, 2021, 56(5):1478-1485.
WEI X Y, LI Y, TAN Y P, et al.Cloning and expression analysis of delta-12 fatty acid desaturase gene in Coix lacryma-jobi L[J].Acta Pharmaceutica Sinica, 2021, 56(5):1478-1485.
[21] 王霞, 林婉玲, 李来好, 等.高效液相色谱-蒸发光散射法分析海鲈肌肉磷脂组成[J].中国油脂, 2020, 45(9):97-101.
WANG X, LIN W L, LI L H, et al.Determination of phospholipids composition in Lateolabrax japonicus muscle by HPLC-ELSD[J].China Oils and Fats, 2020, 45(9):97-101.
[22] 余鹏, 郑方盈, 余义和, 等.采前喷施胺鲜酯对葡萄果实贮藏期间膜脂代谢的影响[J].食品科学, 2023,44(23):159-164.
YU P, ZHENG F Y, YU Y H, et al.Effects of preharvest spraying of diethyl aminoethyl hexanoate on membrane lipid metabolism of postharvest grapes during storage[J].Food Science, 2023,44(23):159-164.