反式-4-羟基脯氨酸是一种常见的非标准蛋白质氨基酸,是动物结构蛋白(如胶原蛋白和弹性蛋白)的天然成分。在食品行业,反式-4-羟基脯氨酸具有的独特风味,能够改善果汁饮料风味,被用作增味剂[1]。在医药行业,可用于合成碳青霉烯类抗生素药物[2]。并且还具备抗氧化等功能,在化妆品中也被广泛使用[3]。反式-4羟基脯氨酸的广泛用途使其近年来在世界范围内的应用不断增加。目前生产反式-4-羟基脯氨酸的主要方法分为蛋白水解法、化学合成法以及微生物发酵法3种[1,4]。蛋白水解法是指以蛋白质为原料经酸、碱或蛋白水解酶水解生成反式-4-羟基脯氨酸[4],化学合成法是采用具有对映选择性合成法,经烷基化及水解反应得到。但成本高、过程复杂,而且造成严重的环境污染[5-6]。因此,近年来微生物发酵法成为了工业化生产反式-4羟基脯氨酸的主流方法[7]。
随着生物技术的发展,对关键影响因子的探索被视作提高菌种发酵潜力的另一途径。金属离子常作为酶的辅因子及活性中心参与菌体的代谢活动。Fe2+是菌体生长、生产过程中必需的微量元素,起到电子转移反应、基因调节、氧的结合和转运等作用[8-9],它还是反式-4-羟基脯氨酸发酵过程中关键酶(脯氨酸羟化酶)的辅因子,参与脯氨酸的羟基化过程。脯氨酸羟化酶是一种α-酮戊二酸依赖型双加氧酶,是依赖单核非血红素含铁酶,发酵过程需要脯氨酸和α-酮戊二酸作为共同底物,Fe2+作为辅酶因子,分子氧作为供体[7,10]。但是目前微生物发酵生产常用的金属离子大多以无机盐的形式存在,例如Fe2(SO4)3、MnSO4、MgCl2等,在发酵时Fe2+不稳定,极易转化成Fe3+,导致发酵过程Fe2+供应不足,造成反式-4-羟基脯氨酸的产量大大下降[11]。
金属螯合剂广泛应用于医药、化工、食品等领域。金属离子与螯合剂能形成稳定螯合物,减少了金属离子氧化作用的发生[12]。有研究报道金属离子鳌合剂由于能和Fe、Co、Ni等金属离子形成稳定的鳌合物从而可以大大提高它们的利用率,金属螯合剂具有很强的稳定性,使得金属离子的生物可利用性得到提高[13]。胡庆昊[14]通过实验证实了金属离子鳌合物的形成,使溶解性金属离子浓度加倍。他以镍离子为主要研究对象,通过采用向厌氧发酵系统中添加金属离子螯合剂的方法,提高了金属离子的生物可利用性,优化了甲烷菌的营养条件,甲烷菌发酵生产得到增强。刘小都[15]通过对3种金属元素螯合剂的发酵优化,使色氨酸生产菌的菌体量及色氨酸产量大大提升。日常发酵生产中常面临微量元素不能以充足量和有效的生物学形式存在,进而使底物的最大转化率受到影响的问题,所以找到最适合羟脯氨酸发酵的Fe2+螯合剂是提高羟脯氨酸产量及转化率的关键。
本实验以实验室前期构建的HYP-08为宿主菌株,分别添加甘氨酸亚铁、葡萄糖酸亚铁、富马酸亚铁、氯化亚铁、硫酸亚铁等Fe2+螯合剂,来探究Fe2+螯合剂对羟脯氨酸发酵的影响。氨基酸发酵生产常采用一次性添加培养基的方法,但前期过高的Fe2+对菌体生长并非有利,会对其产生毒副作用,还会造成浪费,因此,本实验在发酵优化时设计3种Fe2+螯合剂的添加方式来探究最适发酵工艺,最终菌体生物量、羟脯氨酸产量、转化率、发酵周期均得到了较大的提升。对其他α-酮戊二酸依赖型加氧酶的氨基酸的发酵生产具有指导意义。
HYP-08[16],天津科技大学代谢工程实验室。
种子培养基(g/L):葡萄糖30,柠檬酸0.8,酵母粉6.0,(NH4)2SO4 3.0,MgSO4·7H2O 0.4, MnSO45.0 mg/L,维生素B(1.3.5.12) 0.5 mg/L,微混1.0 mL/L,谷氨酸0.5,蛋氨酸0.5,α-酮戊二酸2.0,维生素C 1.0。
发酵培养基(g/L):葡萄糖30,柠檬酸0.8,酵母粉2.0,(NH4)2SO4 3.0,MgSO4·7H2O 0.4, MnSO45.0 mg/L,维生素B(1.3.5.12) 0.5 mg/L,微混1.0 mL/L,谷氨酸 1.5,蛋氨酸0.5,α-酮戊二酸2.0,维生素C 2.0。
722G紫外分光光度计,上海菁华科技仪器有限公司;5 L自动控制发酵罐,上海保兴生物设备工程有限公司;Agilent1200高效液相色谱仪,日本岛津公司;SBA-40ES生物传感分析仪,济南延和生物科技有限公司。
1.4.1 菌种活化
二代活化:将菌种从甘油管中接到斜面培养基中活化培养12 h;将斜面培养基上的菌株接入到茄形瓶中进行二次传代培养12 h[17]。
1.4.2 摇瓶发酵培养
采用500 mL挡板瓶,接种量10%,总发酵体系为30 mL,以苯酚红作酸碱指示剂,过程使用注射器注射氨水调节pH,培养36 h[18]。
1.4.3 5 L发酵罐培养
1.4.3.1 种子培养
种子罐发酵液体积为2 L,发酵温度为37 ℃,搅拌转速200 r/min,溶氧30%左右,通过流加25%(体积分数,下同)氨水维持发酵液pH 7.0左右,当OD600nm>20时接种发酵[19]。
1.4.3.2 发酵培养
接种量为20%~30%,发酵温度37 ℃,搅拌转速200 r/min,溶氧30%左右,通过流加25%氨水维持发酵液pH 7.0左右。
1.5.1 pH、溶氧(dissolved oxygen,DO)、温度值测定
发酵过程中的pH、溶氧、温度通过发酵罐的智能检测系统实时检测,并通过pH试纸进行实测,已实现更为精准的发酵过程控制[18]。
1.5.2 菌体量测定方法
发酵过程中每2 h取1次样,取样稀释一定倍数之后,分光光度计(600 nm处)测定菌体量。
1.5.3 羟脯氨酸及副产物测定
发酵液羟脯氨酸、脯氨酸产量采用高效液相色谱仪测定,乙酸通过Agilent 1200高效液相色谱仪测定,谷氨酸检测采用生物传感分析仪测定。
SA计算如公式(1)所示,为保证数据的准确性,每个数据取3次平行实验的平均值。
(1)
式中:m,产物质量浓度,g/L;V,发酵液体积,L;M,添加糖的总量,g。
1.7.1 Fe2+螯合剂添加种类及添加量的测定
保证其他营养条件及发酵条件一致的前提下,按照表1所示的5种不同种类的Fe2+螯合剂,进行梯度实验,并设置3组平行。
表1 Fe2+螯合剂实验批次及添加量 单位:mg/L
Table 1 Experimental batch and addition amount of Fe2+ chelating agent
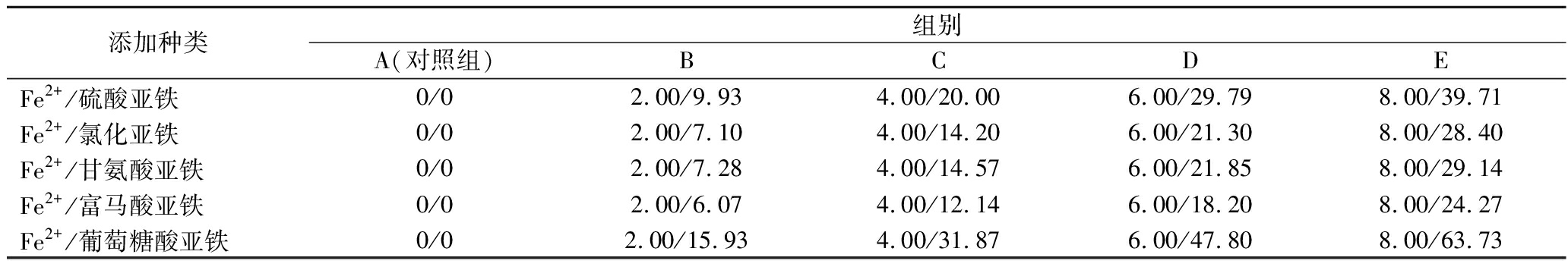
添加种类组别A(对照组)BCDEFe2+/硫酸亚铁0/02.00/9.934.00/20.006.00/29.798.00/39.71Fe2+/氯化亚铁0/02.00/7.104.00/14.206.00/21.308.00/28.40Fe2+/甘氨酸亚铁0/02.00/7.284.00/14.576.00/21.858.00/29.14Fe2+/富马酸亚铁0/02.00/6.074.00/12.146.00/18.208.00/24.27Fe2+/葡萄糖酸亚铁0/02.00/15.934.00/31.876.00/47.808.00/63.73
注:Fe2+/硫酸亚铁:9.93 mg/L的硫酸亚铁里含2 mg/L的Fe2+。
1.7.2 5 L发酵罐中葡萄糖酸亚铁添加方式优化实验
设计3种添加策略(表2),总的葡萄糖酸亚铁添加量均为31.87 mg/L。
表2 葡萄糖酸亚铁的添加方式
Table 2 Addition method of ferrous gluconate
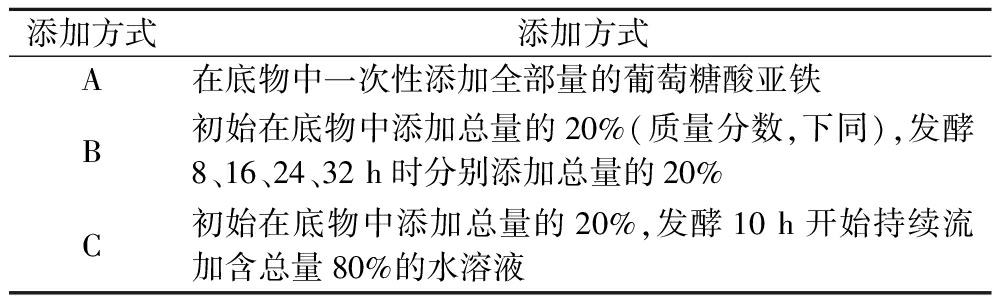
添加方式添加方式A在底物中一次性添加全部量的葡萄糖酸亚铁B初始在底物中添加总量的20%(质量分数,下同),发酵8、16、24、32 h时分别添加总量的20%C初始在底物中添加总量的20%,发酵10 h开始持续流加含总量80%的水溶液
有机铁离子盐相较于无机铁离子盐具有较强稳定性,本研究选用了甘氨酸亚铁、葡萄糖酸亚铁、富马酸亚铁、氯化亚铁、硫酸亚铁等Fe2+螯合剂,以期能够更好地加强脯氨酸羟化酶的表达能力,提高菌株性能。
图1-a显示了Fe2+螯合剂及添加量在生物量方面的影响,与对照组相比,Fe2+螯合剂添加后的生物量都有所提高,添加有机Fe2+螯合剂的生物量明显高于添加Fe2+无机盐的生物量。其中甘氨酸亚铁对菌体生物量影响最大,在不添加Fe2+螯合剂时,生物量仅有47.2,甘酸亚铁添加量为7.28 mg/L时,羟脯氨酸OD600达最大值67.3,较不添加增长了26%,但是随着添加量的增加,菌体生物量呈下降趋势。通过分析,无机微量元素会对菌体内环境酸碱平衡及pH值造成影响,且无机盐过多时会与其他金属离子产生拮抗作用[11]。甘氨酸亚铁在菌体内能自我调控螯合结构的解离和形成,以此来控制细胞内Fe2+浓度,使其在正常范围内缓冲,并节省了吸收无机铁所须的大量复杂的生化过程,大大提高了铁元素的利用率[9]。且甘氨酸螯合铁能提供甘酸和Fe2+双重营养因素,协同提供营养,具有营养强化剂的功效,因此有效地提高了菌体的生物活性,菌体量大幅度上升[11]。但菌体不能吸收过多的Fe2+,过量的Fe2+会对菌体产生毒副作用[20],导致超过最适浓度时菌体生物量大大降低。因此,菌体生长前期只需要少量的Fe2+即可满足菌体生长需求。
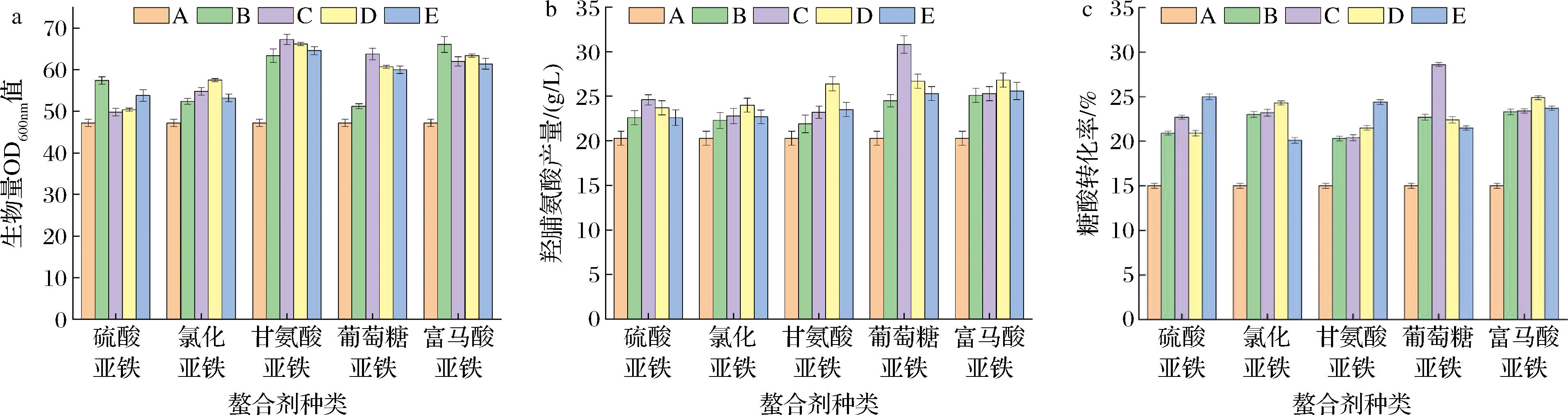
a-生物量;b-产量;c-转化率
图1 Fe2+螯合剂及添加量对生物量、产量、转化率的影响
Fig.1 Effect of Fe2 + chelating agent and addition amount on biomass, yield and the conversion rate
注:A、B、C、D、E指相应Fe2+螯合剂不同浓度梯度。
图1-b和图1-c显示了Fe2+螯合剂及添加量在产量和转化率方面的影响。
由图1-b可知,添加FeSO4和FeCl2时最高产量为24.6、24.1 g/L,均低于添加其他Fe2+螯合剂时的最高产量,分析原因是发酵过程中以游离的Fe2+形式存在,极易被氧化为Fe3+失去活性,导致反应过程中Fe2+供应不足,培养基中添加少量维生素C可改善此情况,因维生素C具有较强还原性[21],且促进Fe2+吸收。但有机Fe2+螯合剂能在发酵过程中保持稳定的化学性质,因此能提供较充足的Fe2+,其还具有较高的生物学效价[22]。添加葡萄糖酸亚铁时产量及转化率最高,当无外源添加Fe2+螯合剂时,羟脯氨酸产量仅有20.3 g/L,转化率为18.80%,随着葡萄糖酸亚铁添加量增长至31.87 mg/L时,羟脯氨酸产量和糖酸转化率达到最高,分别为30.81 g/L和28.53%,远高于对照组。分析原因为Fe2+与代谢过程中众多酶的活性相关或起到激活作用,比如乙酰辅酶A,琥珀酸脱氢酶等[23],尤其是在脯氨酸羟化酶催化脯氨酸的过程中,需要Fe2+结合α-酮戊二酸,与此同时Fe2+发挥作用与底物作用发生羟基化反应[24],而葡萄糖酸亚铁由还原铁中和葡萄糖酸而成,生物利用率高[25]。葡萄糖酸亚铁通过基团转运进入细胞,再根据不同组织的需求分解为葡萄糖和Fe2+,因此能更好地满足细胞生长和生产的需求。但是过多时产量和转化率出现了下降,对菌体产生了毒害作用,进而抑制了生长。因此,只有在添加最适的葡萄糖酸亚铁浓度时,才能保证菌体的生长和生产性能达到最高。
上述实验确定了最适合羟脯氨酸发酵的Fe2+螯合剂为葡萄糖酸亚铁,添加量为31.87 mg/L时效果最好,以优化前添加FeSO4为对照组,以添加葡萄糖酸亚铁为实验组,验证前期实验结果。
如图2所示,优化后实验组菌体生物量最高达134.2,对照组菌体生物量为108.7,优化后较原始培养基提高了23.4%,整个发酵过程中,实验组菌体生长速率一直高于对照组;并且在羟脯氨酸产量方面也有很大影响,在16~36 h,羟脯氨酸产量增长趋势明显,当发酵44 h时产量积累量为101.5 g/L,远高于对照组的88.6 g/L,优化后培养基较大提升了羟脯氨酸产量。但菌体发酵后期出现的活性降低、产酸率下降等问题仍需解决,因此下一步进行葡萄糖酸亚铁添加方式优化实验,进一步提高羟脯氨酸产量。
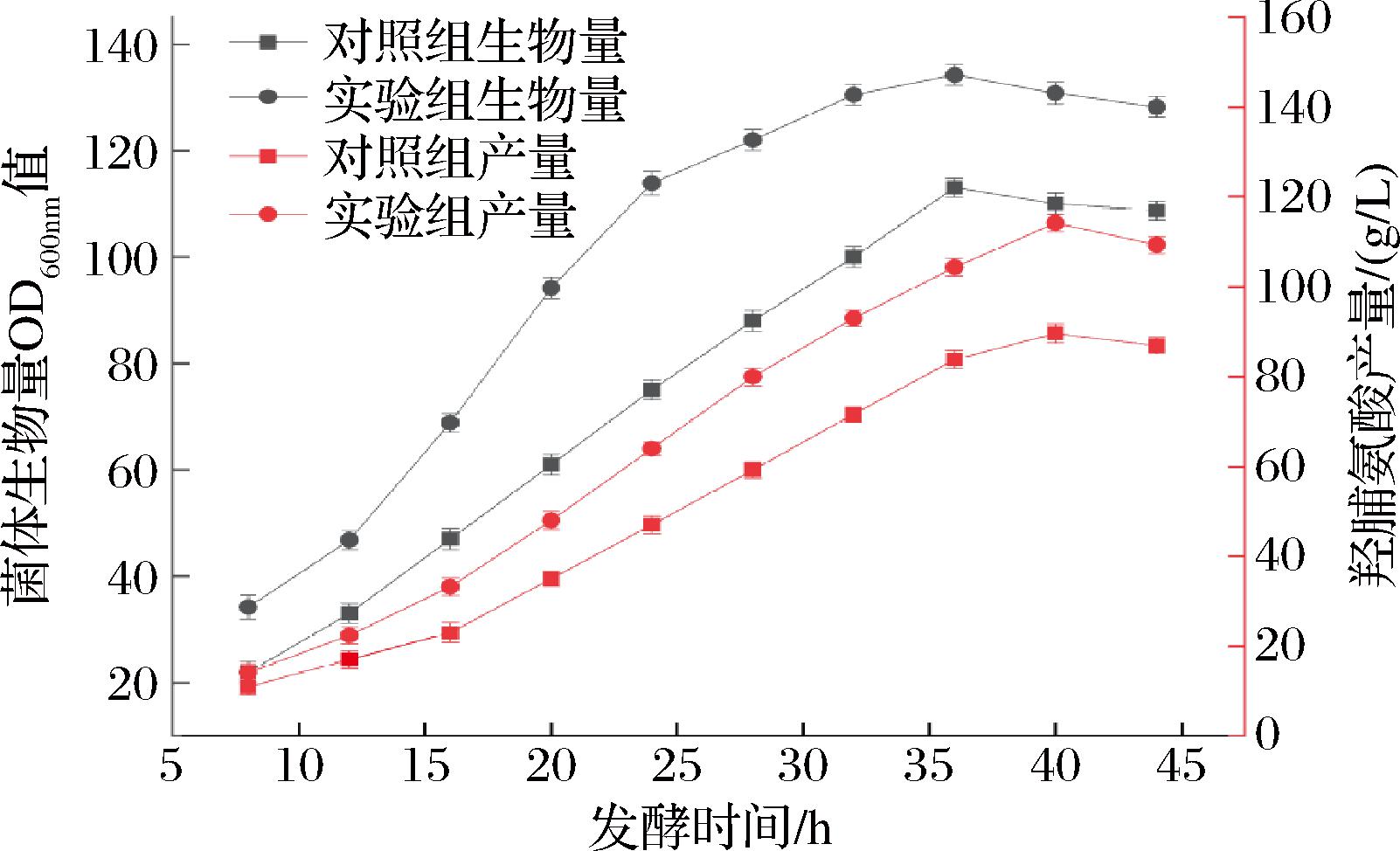
图2 优化前后在5 L发酵罐中对比
Fig.2 Comparison in 5 L fermentor before and after optimization
通过上述实验选出了最适的Fe2+螯合剂及最适浓度,但原始的葡萄糖酸亚铁添加方式会导致前期Fe2+浓度过高,对菌体产生毒害作用,后期又供应不足,进而选择3种添加方式,对羟脯氨酸发酵进行优化实验,以达到实验预期。
2.3.1 添加方式对羟脯氨酸生物量、产量及糖酸转化率的影响
为探究整个发酵过程中罐内最有利于提高产量及合成速率的葡萄糖酸亚铁浓度,设计了优化葡萄糖酸亚铁添加工艺,考虑到葡萄糖酸亚铁对脯氨酸羟基化过程起到的关键作用,因此整个发酵过程中对其含量控制是至关重要的一步。按照1.7.2节中葡萄糖酸亚铁的添加策略A、B、C,进行发酵对比实验,结果如图3所示。
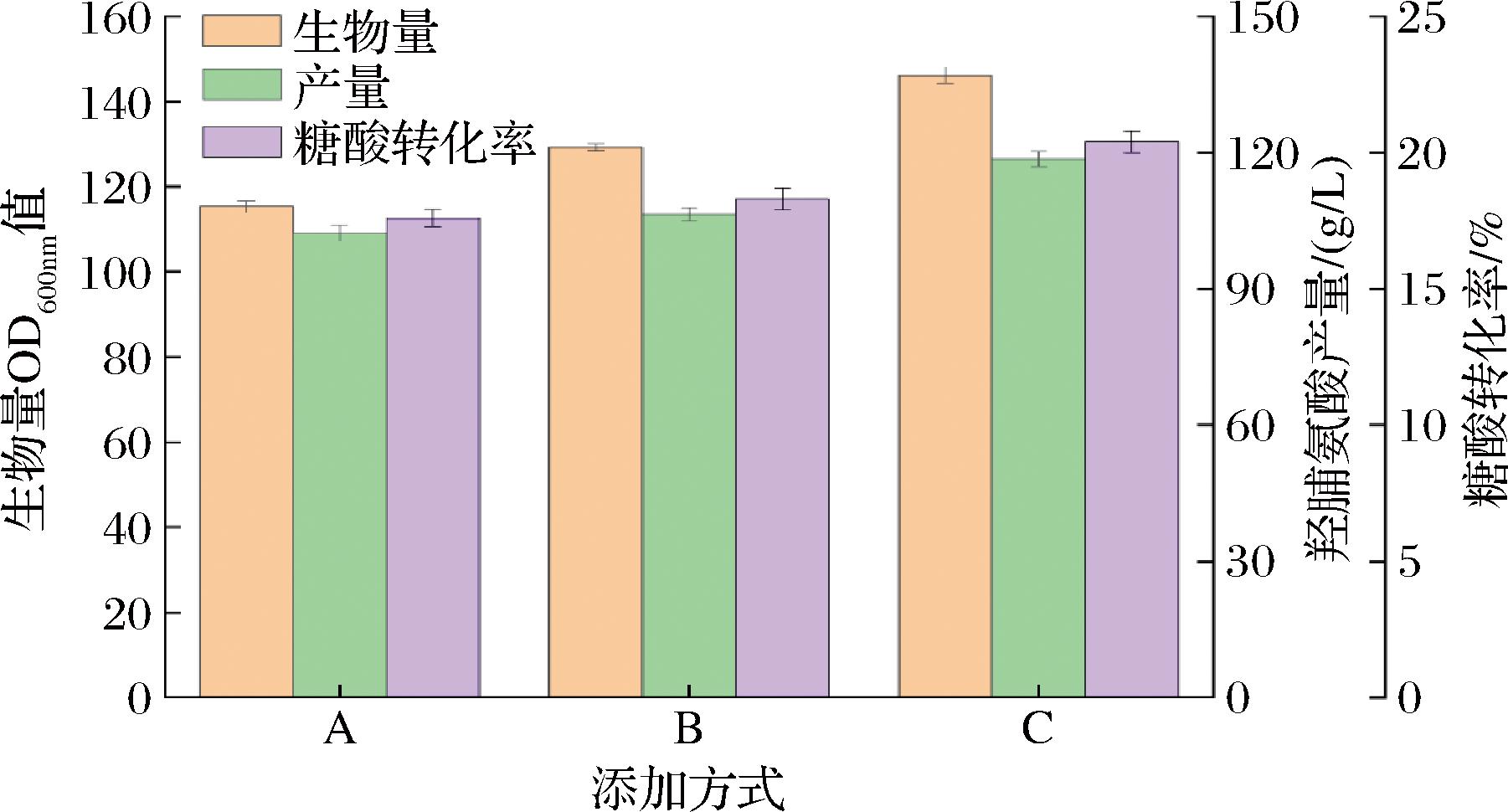
图3 不同葡萄糖酸亚铁添加方式对生物量、羟脯氨酸产量和糖酸转化率的影响
Fig.3 Effects of different glucose ferrous addition methods on cell weight, hydroxyproline yield and sugar-acid conversion rate
注:A为在底物中添加;B为在8、16、24、32 h添加;C为从10 h持续流加(下同)。
如图3可知,3种葡萄糖酸亚铁添加策略对菌体生长和产酸都有较大的影响,添加策略C中生物量、产量及糖酸转化率最高。通过对比可得,A添加方式一次性全部添加,因此发酵前期Fe2+供应充足,生长速率较快,但随着发酵培养基底物中葡萄糖酸亚铁浓度的降低,菌体对数生长期逐渐延后,后期生长状态较差,最终OD600值为115.3,产量和转化率分别为102.3和17.6%。添加策略B较A有明显上升,结果表明补料添加使菌体量增长速度大大提升,在产量和糖酸转化率方面也有明显增幅,OD600值和产量分别为129.3、106.4 g/L,较方式 A 分别提高了12.0%和4.0%,添加方式 C会使发酵过程中Fe2+维持在相对稳定的浓度,为脯氨酸羟化酶提供足够的动力,最后在生物量产量及糖酸转化率方面都显示出明显的优势,最终菌体生物量(OD600值)达到了146.2,比添加方式A和添加方式B分别提高了26.7%和13.1%,最终的羟脯氨酸产量为118.6 g/L,糖酸转化率为20.4%。
2.3.2 添加方式对耗糖速率和生长速率的影响
由图4可知,3组添加方式在生长前期耗糖速率都有迅速提升,策略C的耗糖速率整体趋势较为稳定,发酵28 h时耗糖速率最高达到12.1 g/(h·L),策略A和B达到发酵中期后,耗糖速率出现明显下降,稳定期缩短,菌体活性大大降低,这与生物量总体变化趋势完全一致。对羟脯氨酸合成速率进行分析,3组均在20~28 h达到最大合成速率,C组最大合成速率为4.3 g/(h·L),明显高于另外2组,且趋势较为平稳,因此,添加策略C能使发酵过程中Fe2+维持较为稳定的水平,为菌体前期生长及后期羟基化过程提供充足的Fe2+。
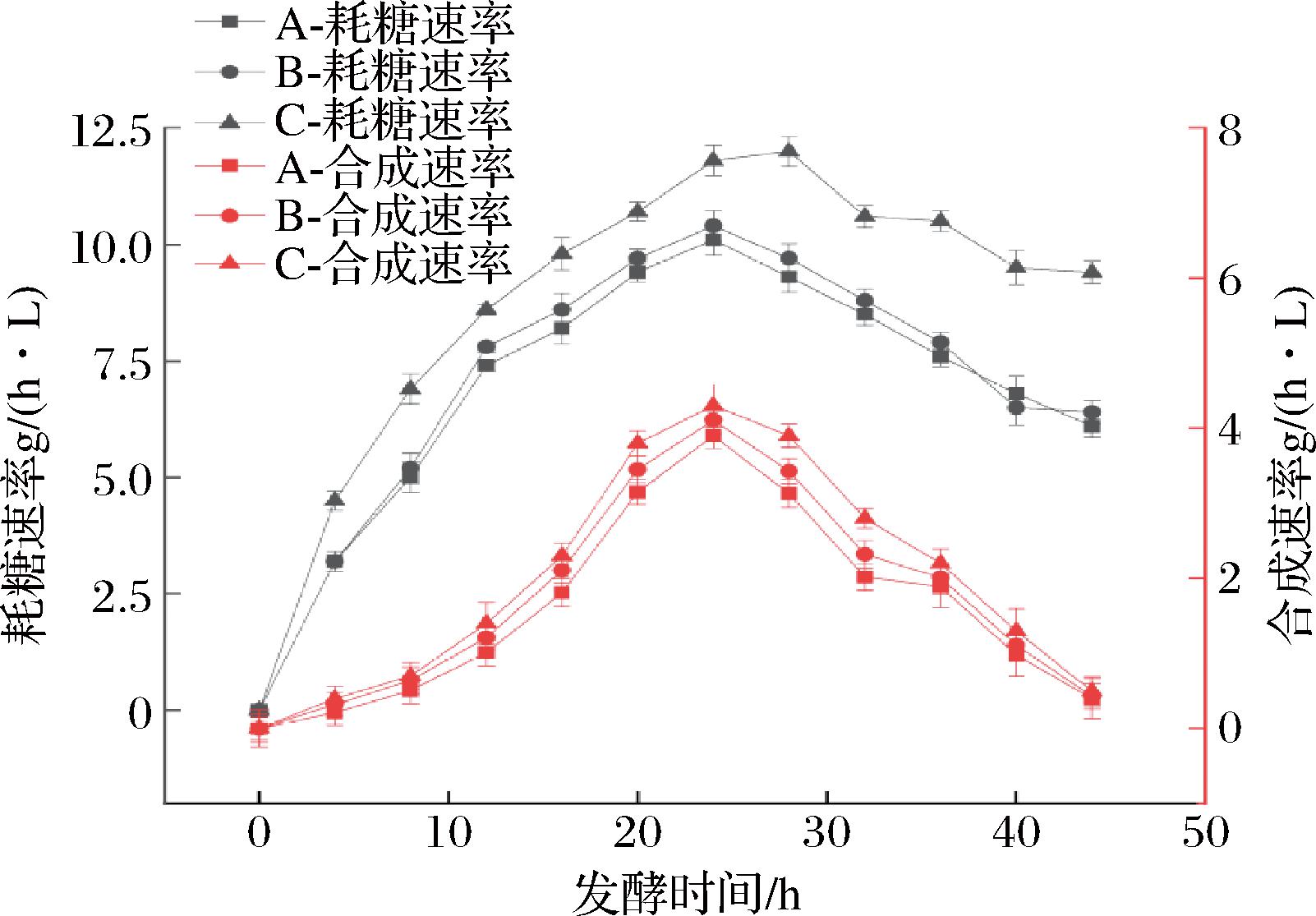
图4 不同葡萄糖酸亚铁添加方式对菌体耗糖速率和羟脯氨酸合成速率的影响
Fig.4 Effects of different glucose ferrous addition methods on sugar consumption rate and hydroxyproline synthesis rate of bacteria
2.3.3 添加方式对羟脯氨酸发酵副产物的影响
乙酸是氨基酸代谢中常见的副产物,而谷氨酸和脯氨酸为羟脯氨酸发酵过程中的前体物质,侧面反映了脯氨酸羟化酶的转化能力,C添加方式乙酸最终含量为1.05 g/L,分别比方式A和方式B降低了38.0%和15.2%,C方式大大提高了脯氨酸羟化酶活性,使代谢流更多流向羟脯氨酸的合成。策略A和B两种添加方式中,前体物质谷氨酸和脯氨酸含量较大,分析原因为发酵后期Fe2+含量较低,导致脯氨酸羟化酶活性降低,进而导致前体物质剩余较多(图5)。
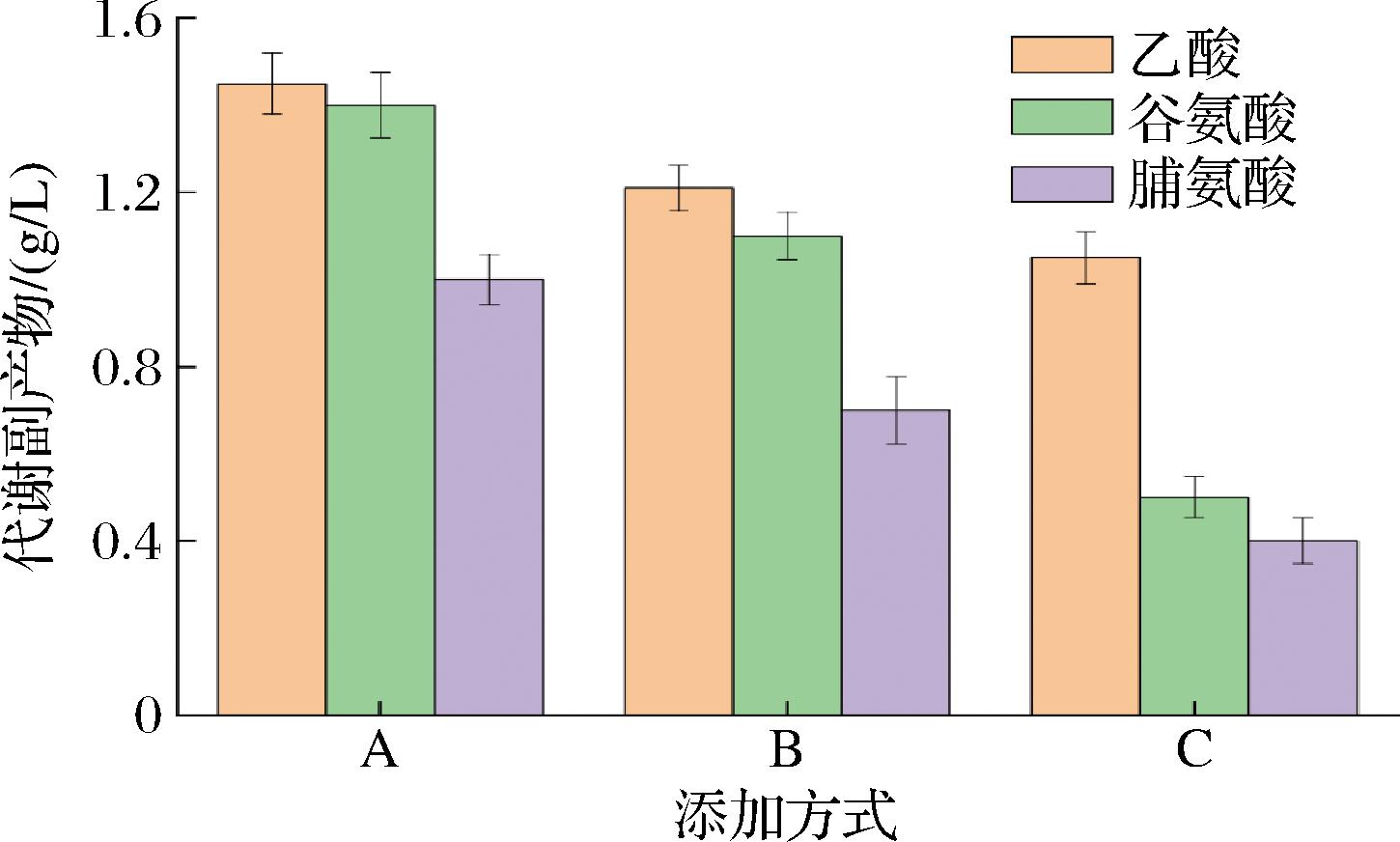
图5 不同葡萄糖酸亚铁添加方式对代谢副产物的影响
Fig.5 Effects of different ferrous glucose addition methods on metabolic by-products
菌体合成羟脯氨酸过程中需要充足的Fe2+,常见的Fe2+化合物在发酵过程中极易氧化,不能满足菌体生长生产的需要。但葡萄糖酸亚铁活性稳定,使大肠杆菌生产羟脯氨酸的最终生物量和产量均有明显提高。通过对葡萄糖酸亚铁添加方式的优化,羟脯氨酸产量和生物量最高分别达到118.6 g/L和146.2,糖酸转化率为20.4%,副产物乙酸降低到1.05 g/L。这一结果为实现羟脯氨酸大规模生产提供了参考。
[1] 王晓姣. 产反式-4-羟基-L-脯氨酸菌株代谢途径的改造[D].无锡:江南大学,2017.
WANG X J.Modification of metabolic pathway of trans-4-hydroxy-L-proline producing strain[D].Wuxi:Jiangnan University, 2017.
[2] BRANDS K M J, JOBSON R B, CONRAD K M, et al.Efficient one-pot synthesis of the 2-aminocarbonylpyrrolidin-4-ylthio-containing side chain of the new broad-spectrum carbapenem antibiotic ertapenem[J].The Journal of Organic Chemistry, 2002, 67(14):4771-4776.
[3] PHANG J M, DONALD S P, PANDHARE J, et al.The metabolism of proline, a stress substrate, modulates carcinogenic pathways[J].Amino Acids, 2008, 35(4):681-690.
[4] 李强, 韩亚昆, 蒋帅, 等.代谢工程改造大肠杆菌合成反式-4-羟基-L-脯氨酸[J].食品科学, 2020, 41(2):202-207.
LI Q, HAN Y K, JIANG S, et al.Metabolic engineering of Escherichia coli for production of trans-4-hydroxy-L-proline[J].Food Science, 2020, 41(2):202-207.
[5] 张自强, 赵东旭, 杨新林.羟脯氨酸的研究与开发[J].氨基酸和生物资源, 2006, 28(1):55-58;62.
ZHANG Z Q, ZHAO D X, YANG X L.Research and development of hydroxyproline[J].Amino Acids &Biotic Resources, 2006, 28(1):55-58;62.
[6] MEHLFÜHRER M, BERNER H, THIRRING K.A short stereoselective synthesis of cis- and trans-4-hydroxyl-L-proline[J].Journal of the Chemical Society, Chemical Communications, 1994:1291.
[7] ISLAM M S, LEISSING T M, CHOWDHURY R, et al.2-Oxoglutarate-dependent oxygenases[J].Annual Review of Biochemistry, 2018, 87:585-620.
[8] 葛淑华, 刁屾, 栾俊, 等.蛋白质螯合金属研究进展及应用[J].皮革与化工, 2018, 35(2):21-25.
GE S H, DIAO S, LUAN J, et al.Research progress and application of protein chelated metals[J].Leather and Chemicals, 2018, 35(2):21-25.
[9] 沐建煜. 氨基酸螯合铁在动物营养中的研究进展[J].国外畜牧学(猪与禽), 2020, 40(1):68-70.
MU J Y.Research progress of amino acid chelated iron in animal nutrition[J].Animal Science Abroad (Pigs and Poultry), 2020, 40(1):68-70.
[10] 季俊杰. 青霉素扩环酶的定向改造[D].济南:山东师范大学, 2010.
JI J J.Directed mutation of deacetoxycephaolosporin C Synthase[D].Jinan:Shandong Normal University, 2010.
[11] 王丽霞. 氨基酸微量元素螯合物的研究与应用[J].氨基酸和生物资源, 2013, 35(1):46-50.
WANG L X.Research advance in microelement amino acid chelates[J].Amino Acids &Biotic Resources, 2013, 35(1):46-50.
[12] 王晓滨, 段洪东, 秦大伟.螯合剂合成新方法及其在化学化工中的应用[J].山东轻工业学院学报(自然科学版), 2007, 21(3):57-62.
WANG X B, DUAN H D, QIN D W.New synthetical methods of chelating agent and application in chemistry and chemistry industry[J].Journal of Shandong Institute of Light Industry (Natural Science Edition), 2007, 21(3):57-62.
[13] GONZALEZ-GIL G, JANSEN S, ZANDVOORT M H, et al.Effect of yeast extract on speciation and bioavailability of nickel and cobalt in anaerobic bioreactors[J].Biotechnology and Bioengineering, 2003, 82(2):134-142.
[14] 胡庆昊. 镍及其螯合物对甲烷发酵的影响及机理研究[D].无锡:江南大学, 2008.
HU Q H.Effects of Ni and Ni complexes on methane fermentation and their mechanism[D].Wuxi:Jiangnan University, 2008.
[15] 刘小都. 添加微量元素螯合剂的L-色氨酸发酵研究[J].发酵科技通讯, 2021, 50(3):156-162.
LIU X D.L-Tryptophan fermentation by adding trace element chelating agent[J].Bulletin of Fermentation Science and Technology, 2021, 50(3):156-162.
[16] 徐庆阳, 龚雨, 孙鹏杰.用于生产反式-4-羟基脯氨酸的基因工程菌及其构建方法与应用:中国,CN115806927A[P].2023-03-17.
XU Q Y, GONG Y, SUN P J.Genetic engineering bacteria for the production of trans-4-hydroxyproline and their construction methods and applications:China, CN115806927A[P].2023-03-17.
[17] 陈志超, 王金多, 徐庆阳.微量元素与生长因子对L-苯丙氨酸发酵的影响[J].食品与发酵工业, 2022, 48(8):82-89.
CHEN Z C, WANG J D, XU Q Y.Effects of trace elements and growth factors on L-phenylalanine fermentation[J].Food and Fermentation Industries, 2022, 48(8):82-89.
[18] 李澜潇, 王硕, 徐庆阳.金属离子及生长因子对核黄素发酵影响的研究[J].食品与发酵工业, 2023, 49(10):177-184.
LI L X, WANG S, XU Q Y.Effects of metal ions and growth factors on riboflavin fermentation[J].Food and Fermentation Industries, 2023, 49(10):177-184.
[19] 陈志超, 李澜潇, 徐庆阳.大肠杆菌发酵生产L-苯丙氨酸新工艺研究[J].中国调味品, 2022, 47(12):84-89.
CHEN Z C, LI L X, XU Q Y.Study on new technology of producing L-phenylalanine by fermentation of Escherichia coli[J].China Condiment, 2022, 47(12):84-89
[20] 石文艳, 潘晓亮, 万鹏程.铁元素的生理功能及其研究进展[J].畜牧兽医科技信息, 2005(3):15-18.
SHI W Y, PAN X L, WAN P C.Physiological function of iron and its research progress[J].Scientific Information of Animal Husbamdry Veterinary Mecicine, 2005(3):15-18.
[21] 张文丽, 聂尧, 景晓冉, 等.Fe(Ⅱ)/2-酮戊二酸依赖型双加氧酶重组大肠杆菌全细胞催化合成4-羟基异亮氨酸[J].高等学校化学学报, 2019, 40(6):1172-1177.
ZHANG W L, NIE Y, JING X R, et al.Synthesis of 4-hydroxyisoleucine catalyzed by recombinant Escherichia coli expressing Fe (Ⅱ)/2-ketoglutarate-dependent dioxygenase[J].Chemical Journal of Chinese Universities, 2019, 40(6):1172-1177.
[22] 虞俊翔, 孙南耀, 王光然, 等.微量元素氨基酸螯合物的生物学效价研究进展[J].食品科学, 2015, 36(23):367-371.
YU J X, SUN N Y, WANG G R, et al.Advances in bioavailability of amino acid-microelement chelates[J].Food Science, 2015, 36(23):367-371.
[23] 孙鹏杰, 余子辰, 徐庆阳.B族维生素对枯草芽孢杆菌发酵生产腺苷的影响[J].中国酿造, 2022, 41(4):93-98.
SUN P J, YU Z C, XU Q Y.Effect of vitamin B on adenosine production by Bacillus subtilis fermentation[J].China Brewing, 2022, 41(4):93-98.
[24] 文方, 聂尧, 穆晓清, 等.α-酮戊二酸依赖型双加氧酶催化特性及反应耦联辅因子对其催化羟基化反应的影响[J].微生物学通报, 2017, 44(3):505-512.
WEN F, NIE Y, MU X Q, et al.Characterization of α-ketoglutaric acid-dependent dioxygenase and the effect of reaction-coupled cofactor on dioxygenase-catalyzed hydroxylation[J].Microbiology China, 2017, 44(3):505-512.
[25] 周家华, 崔英德, 曾颢, 等.食品添加剂[M].2版.北京:化学工业出版社, 2008:348.
ZHOU J H, CUI Y D, ZENG H.Food Additives[M].2nd ed.Beijing:Chemical Industry Press, 2008:348.