表1 响应面因素及水平
Table 1 Experimental design and variables levels for Box-Behnken design

水平X1晶种添加量/%X2赤藓糖醇初始质量浓度/(mg/mL)X3结晶时间/hX4结晶温度/℃-10.84501-1001.05002-511.255030
人类生活水平提高和生活方式改变,伴随的能量过度摄入引起的超重、糖尿病、“三高”之类的慢性疾病在全球范围内发病率呈逐年增长态势。国际糖尿病联盟的预测显示,截止2030年,全球将会有高达5.78亿的成年人患有糖尿病,当前仅在我国就有1.35亿糖尿病患者。民众对美味和健康的双重需求,使得低热量甜味替代品的开发和应用成为“健康摄取”糖分的最有效途径之一。
赤藓糖醇是一种少量存在于海藻、蘑菇、梨、葡萄和西瓜等食物以及发酵食品(如酱油、葡萄酒)中的天然糖醇[1-2],常温下为白色结晶体,易溶于水,对酸和热的稳定性高,口感接近于蔗糖,热量仅为蔗糖的1/10(0.4 kcal/g),人体对其耐受性高,对血糖没有影响[3-4]。此外,赤藓糖醇还具有防龋齿[5-6]、血糖调控、减缓肥胖、保护肝脏和心血管等功效[7-10]。赤藓糖醇先后通过日本食品法规[11]、美国食品与药品监督局[12]、联合国粮农组织和世界卫生组织下的食品添加剂联合专家委员会[13]的安全认证。2008年5月,我国卫生部批准赤藓糖醇作为新资源食品,并在2014年对其进行了增补[14-15],公告中允许赤藓糖醇在各类食品中按实际需要适量使用。
赤藓糖醇的生产通常是以葡萄糖为发酵底物,通过微生物发酵(主要使用包括Yarrowia,Pichia,Candida,Torulopsis,Moniliella,Trichospornides在内的耐高渗透性酵母菌)获得[16-18]。赤藓糖醇的商品形式是晶体。然而,赤藓糖醇在水中溶解度高,结晶难度较大,当前行业未能对结晶工艺细化研究,现行的结晶方法是在较高温度下通过蒸发浓缩达到结晶目的,能耗较高[19],母液中残留赤藓糖醇含量较高,导致晶体收率偏低,造成一定程度浪费。近两年,随着赤藓糖醇进入“红海”市场,售价一路走低,必然要求对成本的进一步降低和对工艺和进一步优化。其中,优化赤藓糖醇的结晶工艺对其产业的进一步发展十分重要。因此,本文旨在优化赤藓糖醇的结晶工艺,研究影响结晶收率的主要因素和影响规律,并在单因素实验的基础上,采用响应曲面法对结晶工艺进行综合性优化,大幅提升了赤藓糖醇的单次结晶收率。为赤藓糖醇的产业的降本减耗、提质增效提供参考依据,对赤藓糖醇行业发展具有重要意义。
改良解脂耶氏酵母、赤藓糖醇发酵液,中粮营养健康研究院提供;赤藓糖醇标准品,国药集团化学试剂有限公司;实验中用于高效液相色谱检测的流动相均为色谱纯级;液相检测使用的水为Milli-Q水净化系统(Millipore, Bedford, MA, USA)制备的18.2 MΩ超纯水;其余所涉及化学试剂皆为分析纯级。
1260型高效液相色谱系统,美国Agilent公司;XMTD-6000型恒温真空干燥箱,重庆长风生物科技有限公司;陶瓷膜过滤系统,安徽普朗膜技术有限公司;Centrifuge 5424型控温水浴锅,德国Eppendorf公司;TDL-5-A型离心机,上海安亭科学仪器厂;PAL-1型糖度仪,北京阳光亿事达贸易有限公司;RE-2002型旋转蒸发系统,北京神泰伟业仪器设备有限公司。
1.2.1 赤藓糖醇的定量分析
配制10.0 mg/mL的赤藓糖醇标准溶液,并将此标准溶液稀释成10.0、8.0、6.0、4.0、2.0、1.0、0.5、0.25 mg/mL的质量浓度梯度溶液。使用HPLC检测赤藓糖醇梯度溶液的峰面积,绘制标准曲线,并求回归方程。依据回归方程对待检样品定量分析。色谱条件如下:HPLC系统(Agilent 1260型),配置G 1316 A型柱温箱、G 1329 B型自动进样器、G 1311C型四元泵、G 1236A型示差检测器和waters sugar-PakI型专用糖分析色谱柱(10 μm,6.5 mm×300 mm);色谱柱温度和示差折光检测器检测温度均设为55 ℃;流动相0.005 mol/L H2SO4水溶液,流速0.5 mL/min。流动相和所有待检测样品进样前均通过0.22 μm的微滤膜过滤除杂。
结晶过程中,赤藓糖醇结晶率的计算如公式(1)所示:
赤藓糖醇结晶率/%=(me-ms)/(Vs×Cs)×100
(1)
式中:me,结晶后得到的赤藓糖醇晶体总质量,g;Vs,赤藓糖醇溶液的初始体积,mL;Cs,溶液中赤藓糖醇的初始质量浓度,mg/mL;ms,晶种添加质量,g。
1.2.2 赤藓糖醇溶液制备
采用改良解脂耶氏酵母,发酵生产赤藓糖醇,终质量浓度约为220 mg/mL。发酵液使用陶瓷过滤膜(孔径50 nm,膜面积0.25 m2)固液分离,收集透过液。透过液采用活性炭脱色(固液比1∶200,g∶mL)。脱色液依次通过LX-160强酸型阳离子交换树脂脱盐和D-354强碱型阴离子交换树脂脱盐,真空减压浓缩。按如下流程制备赤藓糖醇。
基因工程菌→一级种子培养→二级种子培养→补料发酵培养→陶瓷膜固液分离→活性炭脱色→离子交换树脂纯化→减压浓缩
1.2.3 赤藓糖醇的介稳曲线绘制
取赤藓糖醇晶体45.0 g放入50 mL离心管,加去离子水定容到50 mL。8组样品依次放置在0、10、20、30、40、50、60、70 ℃的水浴中加热保温,振荡至充分溶解,取上清液稀释100倍测定浓度。以赤藓糖醇溶液温度为横坐标,浓度为纵坐标绘制其溶解度曲线。
将一系列不同温度下的饱和赤藓糖醇溶液(700、650、600、550、500、450、400 mg/mL)以0.1 ℃/min的速率降温,同时观察赤藓糖醇溶液。当赤藓糖醇溶液透光率突然降低时,认为此时溶液达到了极限超溶解浓度,记录其溶液温度[20]。为排除赤藓糖醇溶液中存在晶核的影响,降温起点从高于溶液饱和温度5 ℃开始[21]。以溶液达到极限超溶解时刻的温度为横坐标,对应浓度为纵坐标绘制赤藓糖醇的超溶解曲线。
1.2.4 单因素试验
1.2.2节所获得的赤藓糖醇溶液,其纯度可达98.0%以上。将前述赤藓糖醇溶液浓缩到550 mg/mL,分别按固含物质量的0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%加入赤藓糖醇晶种,25 ℃条件下结晶1 h,抽滤干燥称取晶体质量,研究晶种添加量对赤藓糖醇结晶率的影响。将1.2.2节所获得的赤藓糖醇浓缩到600 mg/mL以上的质量浓度,依次加水稀释配制成250、300、350、400、450、500、550、600 mg/mL溶液,环境温度25 ℃,并加少量晶种,结晶1 h。研究赤藓糖醇质量浓度在250~600 mg/mL变化时对结晶率的影响。配制550 mg/mL赤藓糖醇溶液,加少量晶种,分别在25 ℃结晶0.5、1、2、3、4、5、6 h后,研究结晶时间在0.5~6 h内变化时对其结晶率的影响。配制550 mg/mL赤藓糖醇溶液,加少量晶种,分别在-10、-5、0、5、10、15、20、25 ℃的环境温度下结晶3 h,研究赤藓糖醇在环境温度从-10~25 ℃对其结晶率的影响。
1.2.5 Box-Behnken(BBD)设计试验
为了进一步优化赤藓糖醇的结晶工艺,依据1.2.4节所述的单因素试验结果,使用BBD中心复合法设计试验[22-23]。将赤藓糖醇的晶种添加量(X1),初始浓度(X2),结晶时间(X3)和结晶温度(X4)设定为自变量,赤藓糖醇结晶率(Y)设为因变量。设计4因素3水平的响应面试验,试验设计详见表1。
表1 响应面因素及水平
Table 1 Experimental design and variables levels for Box-Behnken design

水平X1晶种添加量/%X2赤藓糖醇初始质量浓度/(mg/mL)X3结晶时间/hX4结晶温度/℃-10.84501-1001.05002-511.255030
依据公式(2)模拟二次回归方程。
(2)
式中:Y,因变量;β0,βi,βii,βij依次为常数项、一次项、二次项和交互项的系数;Xi和Xj为独立变量。
所有实验数据均采用3组平行实验测量结果的均值±标准差表示。采用Design-Expert软件(V.12)对赤藓糖醇结晶工艺进行响应面法优化。研究数据通过单因素方差分析(ANOVA)和回归分析处理。
赤藓糖醇的高效液相色谱详见图1-a,赤藓糖醇的保留时间为13 min左右,峰型对称。根据不同浓度梯度的标准溶液与其对应的高效液相色谱峰面积关系,绘制标准曲线,详见图1-b,标准曲线R2为0.999 8,表明线性关系良好。
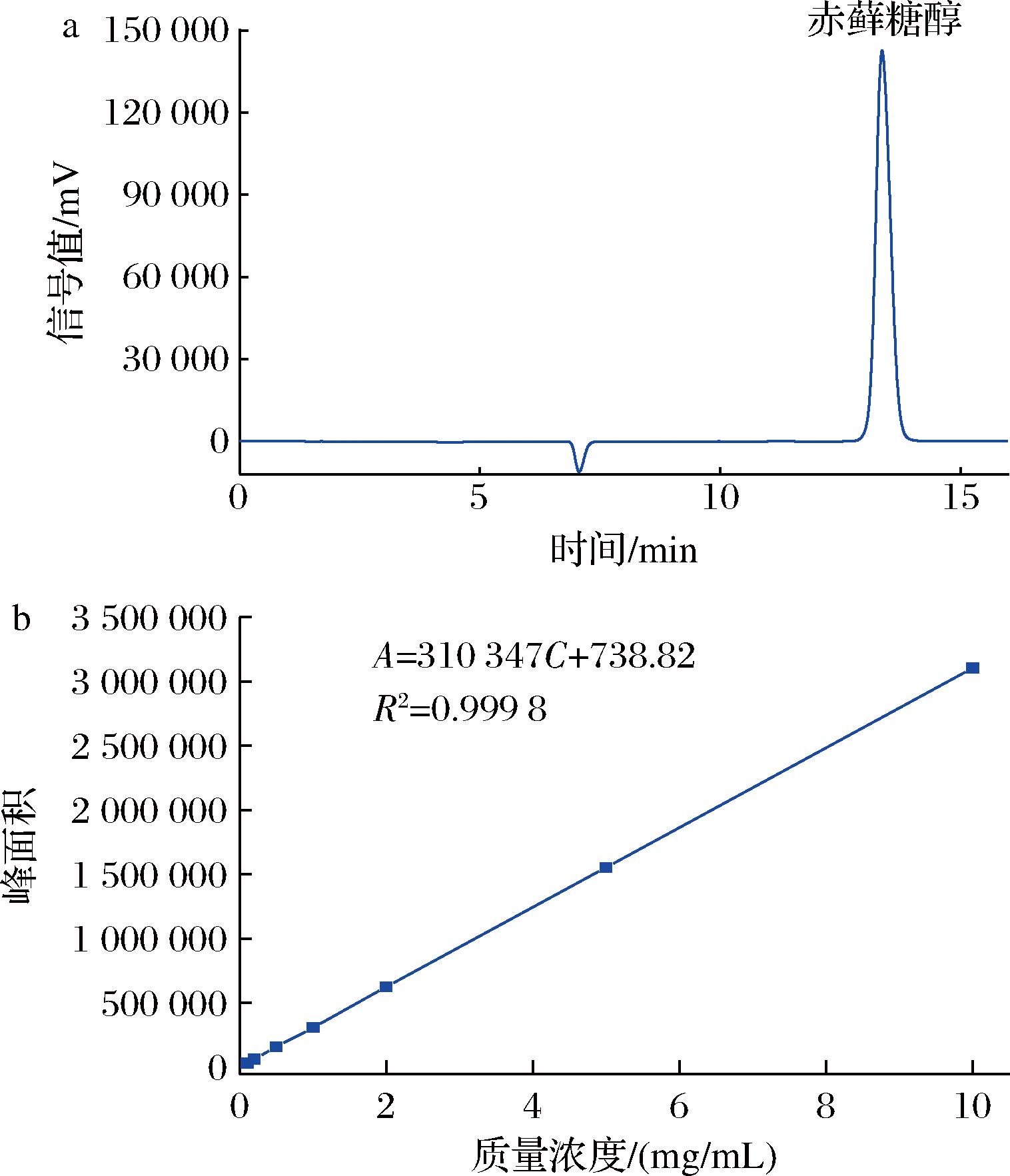
a-高效液相色谱图;b-标准曲线
图1 赤藓糖醇标样的高效液相色谱图及标准曲线
Fig.1 HPLC pattern of erythritol and standard curve
根据标准曲线获得的回归方程如公式(3)所示。
A=310 347Cs+738.82
(3)
式中:A,高效液相色谱测得的赤藓糖醇峰面积;Cs,溶液中赤藓糖醇的质量浓度,mg/mL;R2=0.999 8。
过饱和是一种溶质在溶液中以高于饱和度的浓度存在,且保持稳定的溶解状态而不结晶析出的现象。溶液中溶质处于过饱和状态而欲自发产生晶核时的极限溶解度称为超溶解度,宏观表现为一定温度下溶质结晶析出的起始浓度[20]。一系列变化的温度下测定出溶质的超溶解度,顺次连接各点即可绘制出超溶解度曲线。介于溶解度曲线和超溶解度曲线之间的区域,即为溶质在该溶液体系中的介稳区。
如图2所示,右下方的曲线为赤藓糖醇的溶解度曲线,溶解度曲线右下方是稳定区。在稳定区中溶液尚未达到饱和状态,赤藓糖醇无结晶析出的可能性。左上方的曲线为赤藓糖醇的超溶解度曲线,此曲线左上方的区域为不稳定区。在不稳定区,赤藓糖醇溶液处在过饱和状态,可以自发地产生晶核。介于溶解度曲线与超溶解度曲线之间的区域,即为赤藓糖醇的介稳区。在介稳区中,赤藓糖醇溶液无法自然地产生晶核,但如果溶液中已存在或引入一定量的晶种,晶种便会生长、变大。介稳区宽度是指超溶解度曲线与溶解度曲线之间的直线距离,其垂直方向的距离代表赤藓糖醇的最大过超溶解度,水平方向的距离则代表最大过冷却温度。介稳区的研究对于赤藓糖醇的结晶过程具有重要意义,在工业生产中,可作为选择结晶操作条件的重要依据。介稳区宽度越大,往往结晶操作弹性较大,结晶率较高。
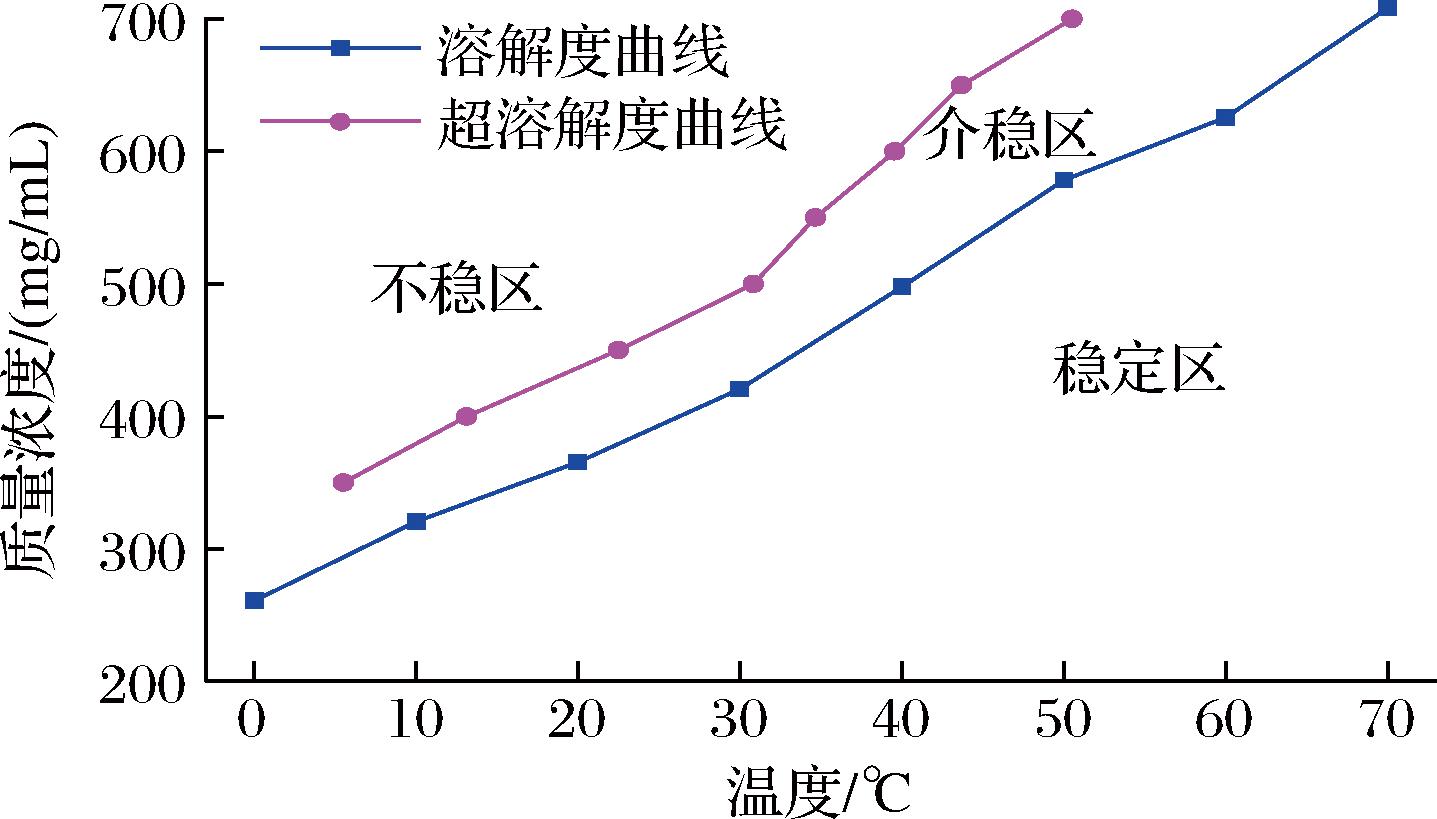
图2 赤藓糖醇介稳曲线
Fig.2 Metastable curve of erythritol
在降温结晶过程中,降温速率与添加晶种的时机对结晶过程有着重要的影响[19]。若在不添加晶种的情况下直接快速降温,则溶液的状态迅速达到不稳定区域,此刻溶液中就会发生初级成核现象,大量微小的晶核骤然产生。这种工况属于无控制结晶,大量微小、不规则晶体影响后续固液分离;且无控制结晶会导致产品晶体夹带、包裹少量母液中的杂质,从而影响产品最终品质(图3-a)。
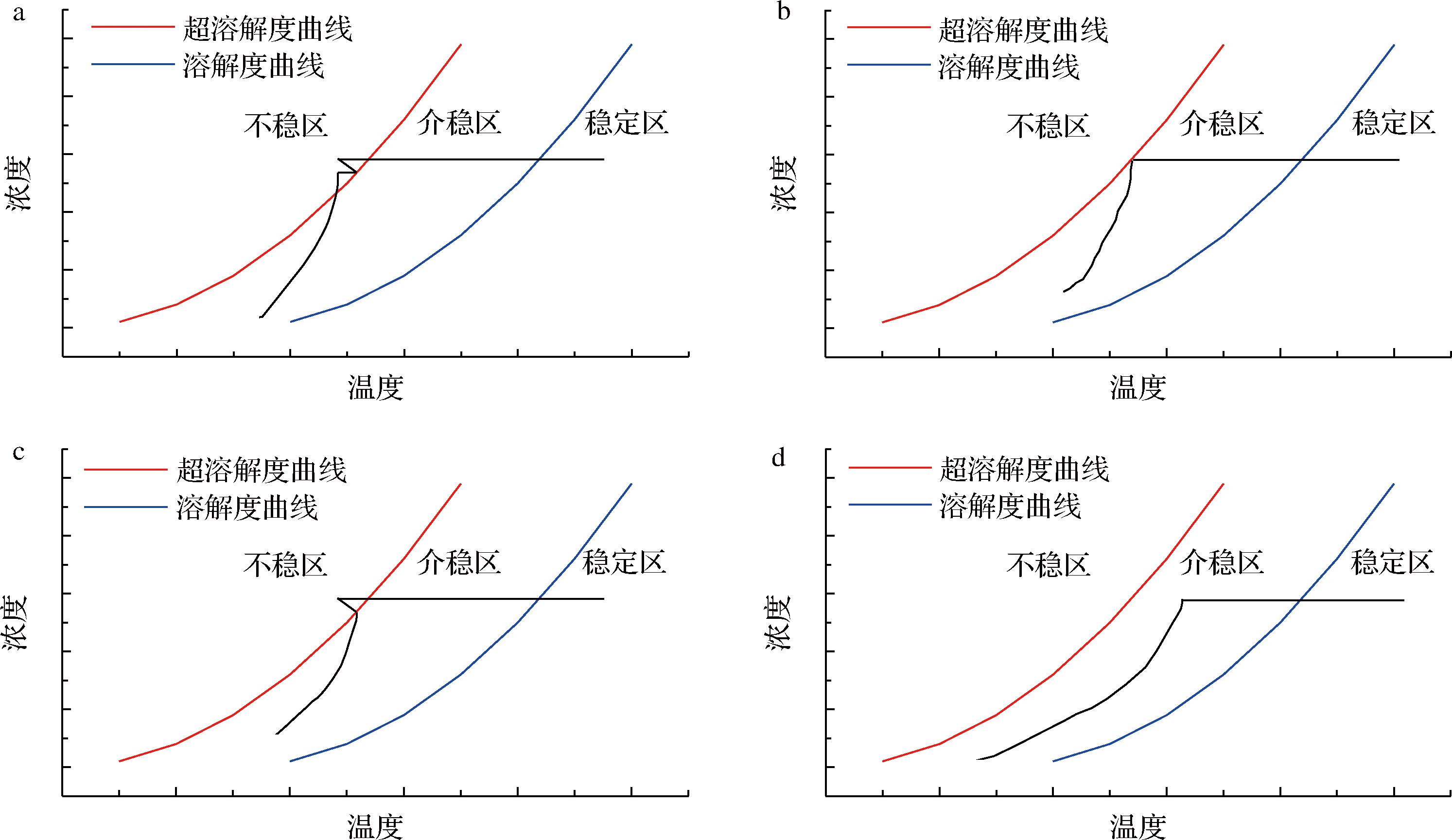
a-不存在晶种,快速降温;b-不存在晶种,缓慢降温;c-存在晶种,快速降温;d-存在晶种,缓慢降温
图3 晶种和降温对结晶的影响
Fig.3 Effect of seed addition and cooling on crystallization
若体系中不存在晶种而缓慢冷却,体系的状态会从稳定区平稳穿越介稳区,到达超溶解度曲线,此时会溶液中会生成较多的晶核。当溶液的过饱和度因成核而有一定量的消耗后,体系的状态便会脱离超溶解度曲线而回归到介稳区,此时便不再有晶核生成,但已形成的晶体颗粒会逐渐生长。由于初级成核速率过快,其晶核的生成量无法与晶体颗粒生长速率匹配,导致所得晶体的粒度分布范围较宽,也会影响后续分离和产品品质(图3-b)。
若体系中有晶种存在且以较快速度降温,则溶液的状态从稳定区快速越过溶解度曲线到达介稳区,此时晶种开始长大。但由于降温迅速,晶粒生长速度无法消耗掉体系的过饱和度。溶液仍有可能越过超溶解度曲线而到达不稳区,从而发生初级核,影响后续分离工艺和产品品质(图3-c)。
若溶液中存在晶种且缓慢降温,则在溶液状态从稳定区越过溶解度曲线后,会始终保持在介稳区状态。此种操作情况下,体系的降温速率决定了晶体的生长速率。因溶液体系不会越过超溶解度曲线而进入不稳区,故不会有初级成核现象出现。这种操作方法所得的晶体形态一致,粒度均匀,后续分离容易,晶体颗粒不会夹带包裹母液中的杂质。实际生产过程中,一般追求这种操作方式(图3-d)。
赤藓糖醇结晶过程中,晶种的添加量对结晶率的影响如图4-a所示,在1 h的结晶时间内,赤藓糖醇的结晶率随着晶种的添加量增加而呈现递增趋势。当晶种的添加量达到赤藓糖醇溶液中固含物质量的1%后,结晶率不再随着晶种添加量有显著提升。对应前述降温结晶机理,当晶种添加量<1%时,意味着体系中晶粒的数量达不到晶体析出速率的要求,因此结晶率较低。这种情况下,随着时间的延长,赤藓糖醇晶体会长的过大,晶体颗粒的规则性和粒度均匀性也会受影响。因此后续结晶过程中,将晶种的添加量维持在固含物质量的1%左右。
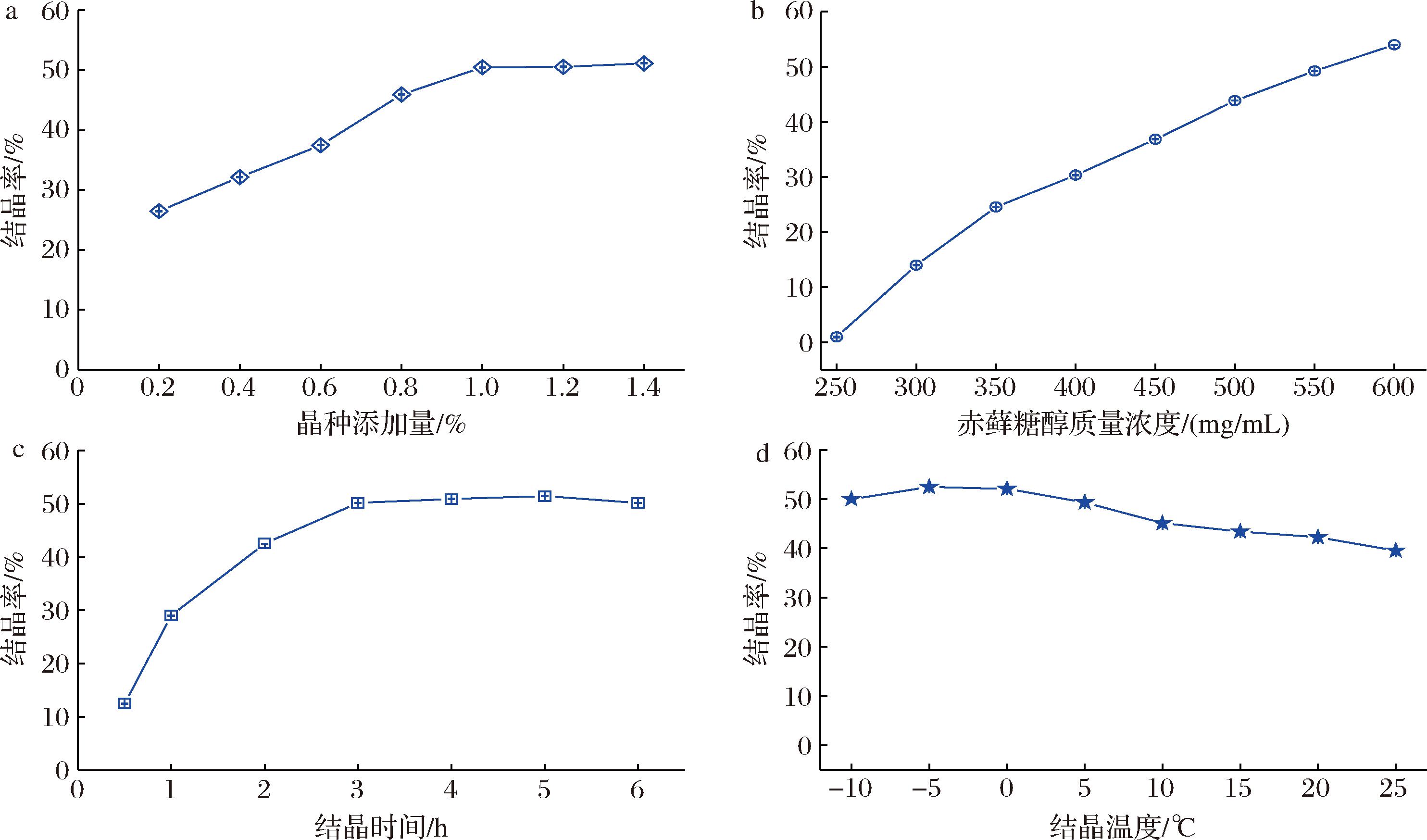
a-晶种添加量;b-初始质量浓度;c-结晶时间;d-温度
图4 赤藓糖醇晶种添加量、初始浓度、结晶时间和温度对赤藓糖醇结晶率的影响
Fig.4 Effects of seed addition, initial concentration, crystallizing time, and temperature on erythritol yield
图4-b表明,水溶液中赤藓糖醇质量浓度<250 mg/mL,25 ℃的条件下基本不会出现结晶,在赤藓糖醇溶液的质量浓度<600 mg/mL时,结晶率随着初始浓度的升高而增高。但在工业生产过程中,若赤藓糖醇溶液的质量浓度达到600 mg/mL,降温过程中容易(结晶过程中冷媒一般在10 ℃以下)穿过介稳区到达不稳定区,形成初级晶核。除此之外,加热浓缩过程中,随着溶液的浓度升高,黏度会随之增大,导致液体传热速率下降,局部受热现象加剧,浓缩液中残留还原糖类受热促使溶液颜色褐变,影响产品品质。因此初始质量浓度不宜过高,控制在500~550 mg/mL。
图4-c表明,在3 h之前,赤藓糖醇的结晶率随着结晶时间的延长快速增高。3 h之后,赤藓糖醇的结晶率增加速率明显放缓,尽管整体而言还是略有所增。其内在原因是随着赤藓糖醇以固态形式结晶析出,溶液中的赤藓糖醇浓度逐渐降低。从而致使溶解-结晶平衡过程中,溶解速率随着晶体总量升高而逐渐加快,结晶速率随溶液浓度减小而逐渐降低。当溶液中结晶速率和溶解速率最终趋同时,结晶率便不再增高[23]。整体权衡结晶率和时间成本,将合适的结晶时间选在3 h左右。
图4-d显示,温度在-10~-5 ℃时赤藓糖醇的结晶率随着溶液的温度升高而增大,当温度>-5 ℃时,赤藓糖醇结晶率随着溶液温度的升高而降低。这是因为,温度在较低范围内波动时,随着温度升高,溶液黏度有所下降,微观环境中分子运动加快,有利于赤藓糖醇分子相互碰撞,加快赤藓糖醇结晶析出。但当温度超过临界值时,一方面赤藓糖醇的过饱和度下降,另一方面,溶液黏度对分子运动的约束程度也降低,致使赤藓糖醇结晶率下降[24]。赤藓糖醇最适结晶温度宜选在-5 ℃左右。
将表2实验数据通过Design-Expert V.12统计软件进行多元回归分析,即可得到因变量Y与4个自变量(X1、X2、X3和X4)之间的模拟回归方程,如公式(4)所示。
表2 BBD设计表与实测的赤藓糖醇结晶率
Table 2 The Box-Behnken design matrix and response values for erythritol yield
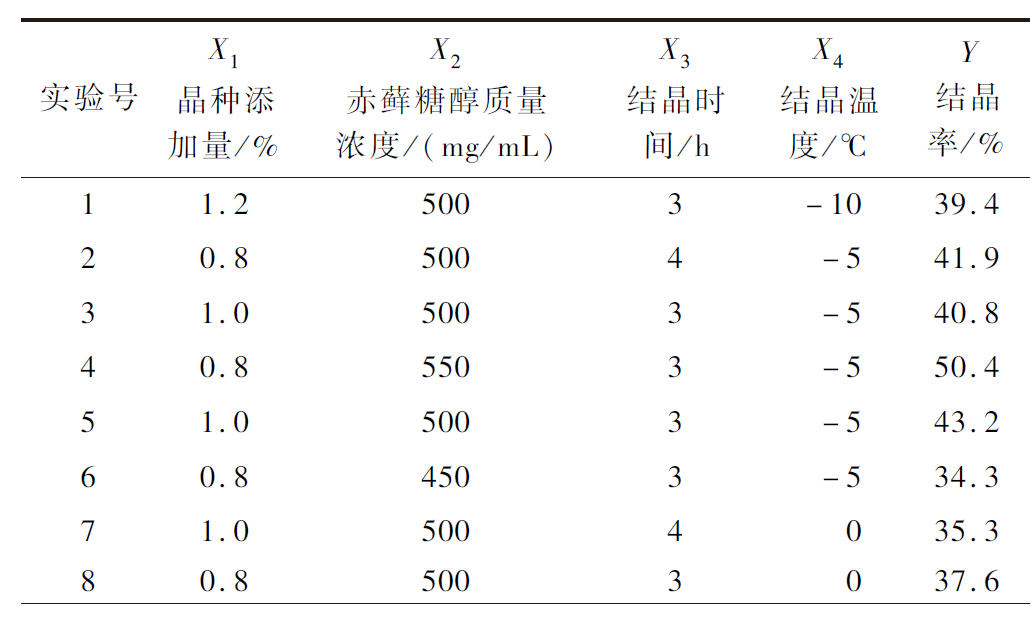
续表2
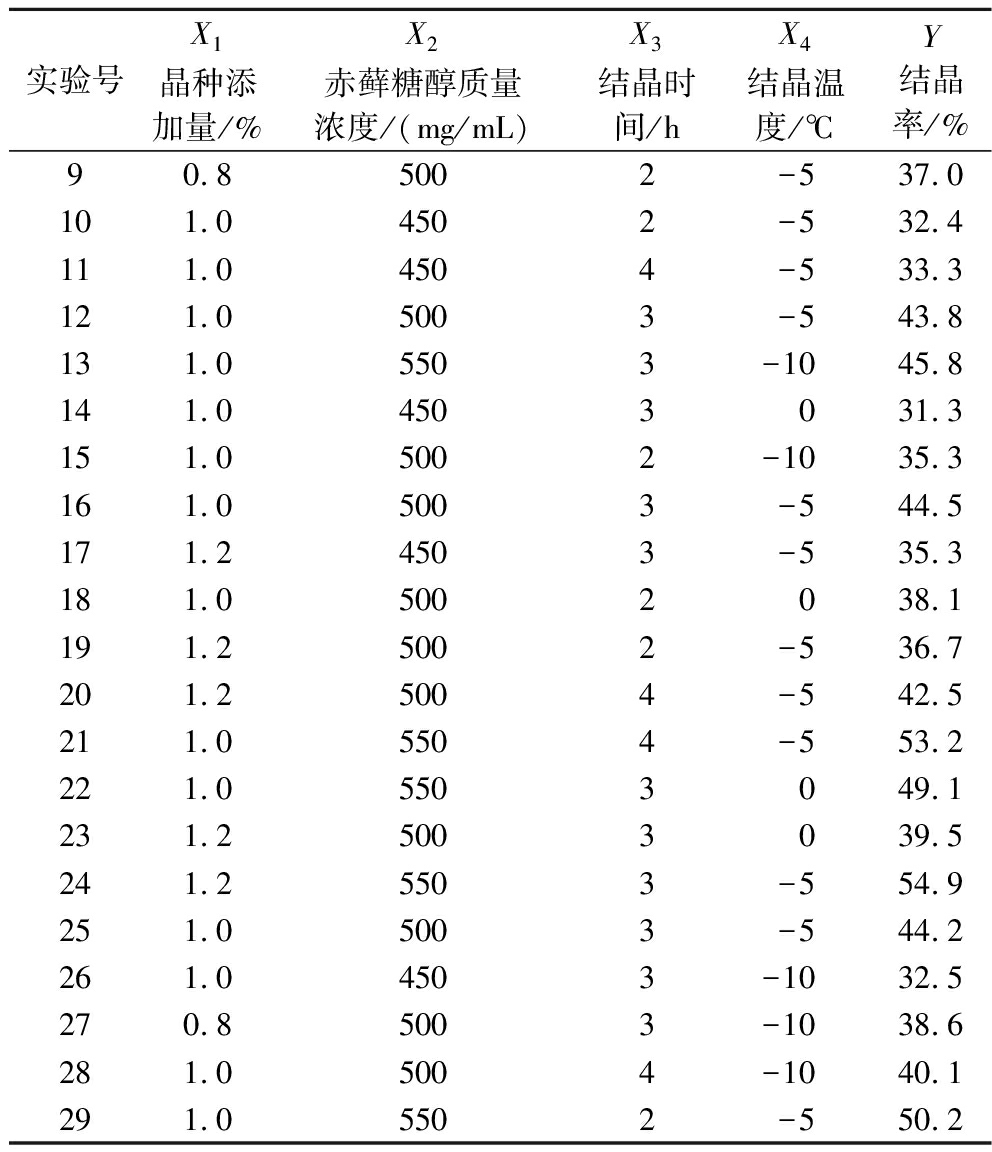
实验号X1晶种添加量/%X2赤藓糖醇质量浓度/(mg/mL)X3结晶时间/hX4结晶温度/℃Y结晶率/%90.85002-537.0101.04502-532.4111.04504-533.3121.05003-543.8131.05503-1045.8141.04503031.3151.05002-1035.3161.05003-544.5171.24503-535.3181.05002038.1191.25002-536.7201.25004-542.5211.05504-553.2221.05503049.1231.25003039.5241.25503-554.9251.05003-544.2261.04503-1032.5270.85003-1038.6281.05004-1040.1291.05502-550.2
Y=39.57+0.48X1+8.18X2+6.07X3+1.83X4+0.88X1X2+0.23X1X3+0.28X1X4+0.53X2X3+1.23X2X4-1.90X3X4-0.83X12-0.99X22-2.35X32-4.02X42
(4)
式中:Y,赤藓糖醇的结晶率;X1,晶种添加量,%;X2,赤藓糖醇初始质量浓度,mg/mL;X3,结晶时间,h;X4,结晶温度,℃。
P>0.05意味着自变量对响应值的影响不显著,P<0.05则意味着变量对响应值的影响显著。如表3所示,模型P<0.000 1,意味着由扰动所导致的模型失真概率低于0.01%,因此回归模型具有显著性。失拟检验的P=0.469 1,意味着失拟检验相比纯误差不显著,根据BBD分析原理,失拟检验不显著表示结果良好。在所有的变量中,二次项X12对响应值Y具有显著影响(P<0.05),一次项X2和X3,以及二次项X42对响应值Y有着极显著影响(P<0.01)。
表3 响应面回归模型的单因素方差分析结果
Table 3 Analysis of variance (ANOVA) for the response surface regression model
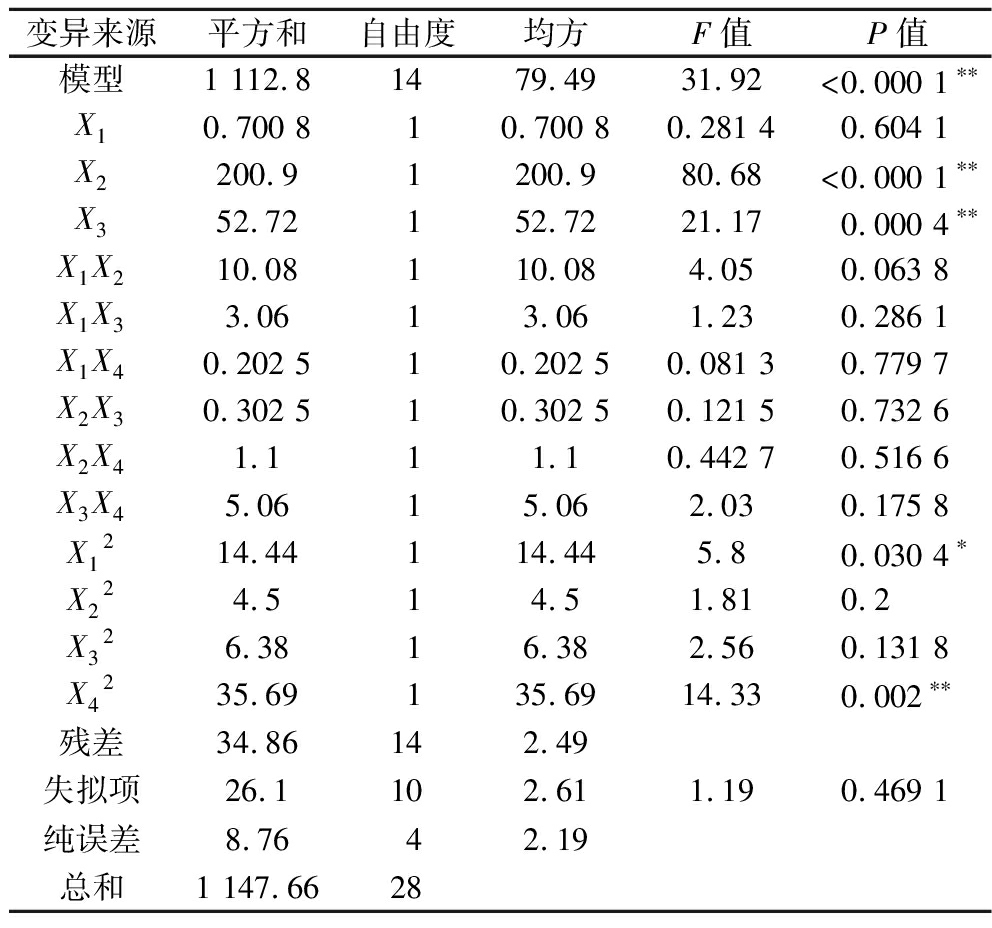
变异来源平方和自由度均方F值P值模型1 112.81479.4931.92<0.000 1∗∗X10.700 810.700 80.281 40.604 1X2200.91200.980.68<0.000 1∗∗X352.72152.7221.170.000 4∗∗X1X210.08110.084.050.063 8X1X33.0613.061.230.286 1X1X40.202 510.202 50.081 30.779 7X2X30.302 510.302 50.121 50.732 6X2X41.111.10.442 70.516 6X3X45.0615.062.030.175 8X1214.44114.445.80.030 4∗X224.514.51.810.2X326.3816.382.560.131 8X4235.69135.6914.330.002∗∗残差34.86142.49失拟项 26.1102.611.190.469 1纯误差 8.7642.19总和 1 147.6628
注:**表示极显著差异P<0.01;*表示显著差异P<0.05。
如图5所示,将4个自变量中的2个保持在中间水平,则另外2个自变量的投影组成一系列同心圆或椭圆,这一系列同心圆或椭圆便代表了变量之间相互影响的显著程度。若曲线呈现椭圆状,意味着相应的变量之间的交互作用对响应值存在显著影响;若曲线呈圆形则意味着变量之间的交互作用对响应值的影响不显著[25]。结晶温度和晶种添加量之间的投影近似椭圆形,意味着两者交互作用对响应值有显著性影响。
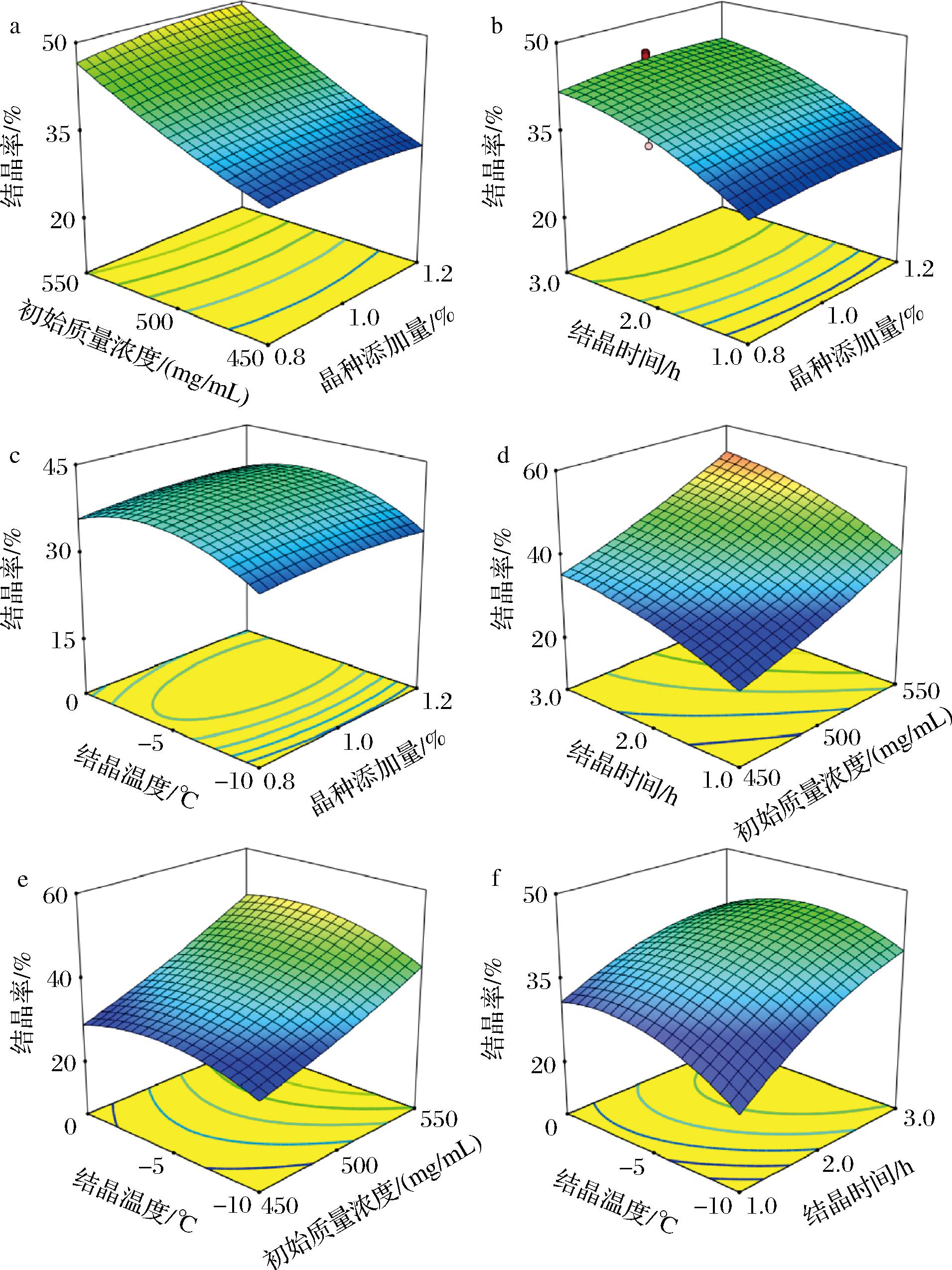
a-晶种添加量与初始质量浓度;b-晶种添加量与结晶时间;c-晶种添加量与结晶温度;d-初始质量浓度与结晶时间;e-初始质量浓度与结晶温度;f-结晶时间与结晶温度
图5 不同因素交互的响应曲面图
Fig.5 Response surface contour plots of different factors
通过响应面法对赤藓糖醇的结晶工艺进行优化,最优条件为晶种添加量赤藓糖醇溶液中固含物质量的1.11%,初始质量浓度550 mg/L,结晶时间3 h,结晶温度-4.36 ℃。考虑工业生产过程操作的方便性,将晶种添加量设定为1%,溶液初始质量浓度设定为550 mg/mL,结晶终止温度设定为-4.5 ℃,结晶持续时间为3 h。在修正的条件下,使用BBD预测的赤藓糖醇结晶率为53.10%。为发进一步验证模型的可信度,在修正条件下进行了3组平行结晶实验,平均结晶率为52.78%。
本工艺不同于蒸发结晶[22],因此省去了长时间蒸发所消耗的大量热损耗,利用温差所致的溶解度差异实现赤藓糖醇结晶,工艺更加经济。此外,与现有降温结晶工艺中一次结晶收率仅为40%~50%相比[24],工艺更加稳定,收率明显提高。总体而言,该模型与预测值相对误差仅为0.60%,模型预测值与实际验证值基本吻合,对实际应用模拟效果较佳。
针对当前赤藓糖醇产业中面临的工艺粗放,结晶收率偏低的问题,为了获得在水溶液体系中结晶赤藓糖醇的最优工艺技术,本文研究了晶种添加量、溶液初始浓度、结晶时间和结晶温度等4个主要影响因素对赤藓糖醇结晶率的影响规律。单因素结果表明,晶种添加量、溶液初始浓度和结晶时间与结晶收率呈正相关性,且晶种添加量和结晶时间对结晶收率的影响有封顶现象。在单因素试验的基础上,进一步通过通过响应曲面法优化工艺。结果显示赤藓糖醇在水系中结晶的最优操作参数为:晶种添加量为1%,溶液初始质量浓度为550 mg/mL,结晶终止温度为-4.5 ℃,结晶持续时间为3 h。在此条件下,赤藓糖醇的结晶率可达52.78%。结晶收率高于当前工业生产水平。此工艺操作简单易于放大,工艺优化方案可靠,可以为赤藓糖醇的工业化结晶提供参考依据。
[1] BERNT W O, BORZELLECA J F, FLAMM G, et al.Erythritol:A review of biological and toxicological studies[J].Regulatory Toxicology and Pharmacology, 1996, 24(2):S191-S197.
[2] 李俊霖, 郭传庄, 王松江, 等.赤藓糖醇的特性及其应用研究进展[J].中国食品添加剂, 2019, 30(10):169-172.
LI J L, GUO C Z, WANG S J, et al.Research progress in physicochemical properties, biological activities and application of erythritol[J].China Food Additives, 2019, 30(10):169-172.
[3] MART U G A, COMAN V, VODNAR D C.Recent advances in the biotechnological production of erythritol and mannitol[J].Critical Reviews in Biotechnology, 2020, 40(5):608-622.
U G A, COMAN V, VODNAR D C.Recent advances in the biotechnological production of erythritol and mannitol[J].Critical Reviews in Biotechnology, 2020, 40(5):608-622.
[4] OKU T, NAKAMURA S.Digestion, absorption, fermentation, and metabolism of functional sugar substitutes and their available energy[J].Pure and Applied Chemistry, 2002, 74(7):1253-1261.
[5] 程楠, 孙晓瑜, 王晓玮, 等.赤藓糖醇龈下喷砂辅助龈下刮治及根面平整术治疗中重度慢性牙周炎的临床疗效[J].安徽医学, 2021, 42(7):731-735.
CHENG N, SUN X Y, WANG X W, et al.Subgingival erythritol powder air - polishing as an additional approach to scaling and root planning in treatment with untreated moderate to severe chronic periodontitis[J].Anhui Medical Journal, 2021, 42(7):731-735.
[6] FALONY G, HONKALA S, RUNNEL R, et al.Long-term effect of erythritol on dental caries development during childhood:A posttreatment survival analysis[J].Caries Research, 2016, 50(6):579-588.
[7] ROBERTS A C, PORTER K E.Cellular and molecular mechanisms of endothelial dysfunction in diabetes[J].Diabetes &Vascular Disease Research, 2013, 10(6):472-482.
[8] BOESTEN D M P H J, DEN HARTOG G J M, DE COCK P, et al.Health effects of erythritol[J].Nutrafoods, 2015, 14(1):3-9.
[9] BOESTEN D M P H J, BERGER A, DE COCK P, et al.Multi-targeted mechanisms underlying the endothelial protective effects of the diabetic-safe sweetener erythritol[J].PLoS One, 2013, 8(6):e65741.
[10] FLINT N, HAMBURG N M, HOLBROOK M, et al.Effects of erythritol on endothelial function in patients with type 2 diabetes mellitus:A pilot study[J].Acta Diabetologica, 2014, 51(3):513-516.
[11] ANONYMOUS.Cargill and Mitsubishi form joint venture to build erythritol plant[J].Food Technology, 1997, 51(12):10.
[12] AGUILAR F, CREBELLI R, DI DOMENICO A, et al.Scientific opinion on the safety of the proposed extension of use of erythritol (E968) as a food additive[J].EFSA J, 2015, 13(3):4033.
[13] 曹佳彦, 文静, 杨丽君, 等.“糖界贵族”赤藓糖醇的标准法规现状研究[J].质量探索, 2021, 18(1):37-40.
CAO J Y, WEN J, YANG L J, et al.Research on the status of standards and regulations of erythritol known as “sugar aristocracy”[J].Quality Exploration, 2021, 18(1):37-40.
[14] RZECHONEK D A, DOBROWOLSKI A, RYMOWICZ W, et al.Recent advances in biological production of erythritol[J].Critical Reviews in Biotechnology, 2018, 38(4):620-633.
[15] CARLY F, VANDERMIES M, TELEK S, et al.Enhancing erythritol productivity in Yarrowia lipolytica using metabolic engineering[J].Metabolic Engineering, 2017, 42:19-24.
[16] 中华人民共和国卫生部. GB 26404—2011食品安全国家标准-食品添加剂赤藓糖醇[S].北京:中国标准出版社, 2011.
Ministry of Health of the People’s Republic of China.GB 26404—2011 National standard for food safety - erythritol, a food additive[S].Beijing:China Standards Press, 2011.
[17] LU Y P, YANG Q Y, LIN Z L, et al.A modular pathway engineering strategy for the high-level production of beta-ionone in Yarrowia lipolytica[J].Microbial Cell Factories, 2020.19(1):49.
[18] 李克文. 赤藓糖醇的高效生产[D].济南:齐鲁工业大学, 2015.
LI K W.Efficient production of erythritol[D].Jinan:Qilu University of Technology, 2015.
[19] 李克文, 栾庆民, 贾慧慧, 等.一种赤藓糖醇的高收率制备方法:中国, CN110903165A[P].2020-03-24.
LI K W, LUAN Q M, JIA, H H, et al.An efficient preparation method of erythritol:China, CN110903165A[P].2020-03-24.
[20] 闫序东. 果糖结晶工艺研究[D].无锡:江南大学, 2008.
YAN X D.Technical studies on the crystallization of fructose[D].Wuxi:Jiangnan university, 2008.
[21] 李国昌, 王萍.结晶学教程[M].北京:国防工业出版社, 2008, 26-34.
LI G C, WANG P.Course of Crystallography[M].Beijing:National Defense Industry Press, 2008, 26-34.
[22] 郭元亨, 马李一, 郑华, 等.响应曲面法优化微波辅助提取胭脂虫红色素工艺[J].林产化学与工业, 2011, 31(4):87-92.
GUO Y H, MA L Y, ZHENG H, et al.Optimizing conditions for microwave-assisted extraction of cochineal dye using response surface method[J].Chemistry and Industry of Forest Products, 2011, 31(4):87-92.
[23] ZHANG L, TU Z C, WANG H, et al.Response surface optimization and physicochemical properties of polysaccharides from Nelumbo nucifera leaves[J].International Journal of Biological Macromolecules, 2015, 74:103-110.
[24] 刘鎏. 赤藓糖醇发酵和提取工艺研究[D].济南:齐鲁工业大学, 2013.
LIU L.Study on fermentation and extraction process of erythritol[D].Jinan:Qilu University of Technology, 2013.
[25] 郭元亨, 吕哲, 丁子元, 等.乙醇体系中D-阿洛酮糖的结晶工艺优化[J].食品工业科技, 2019, 40(24):185-189;198.
GUO Y H, LYU Z, DING Z Y, et al.Crystallization process optimization of D-psicose in ethanol system[J].Science and Technology of Food Industry, 2019, 40(24):185-189;198.