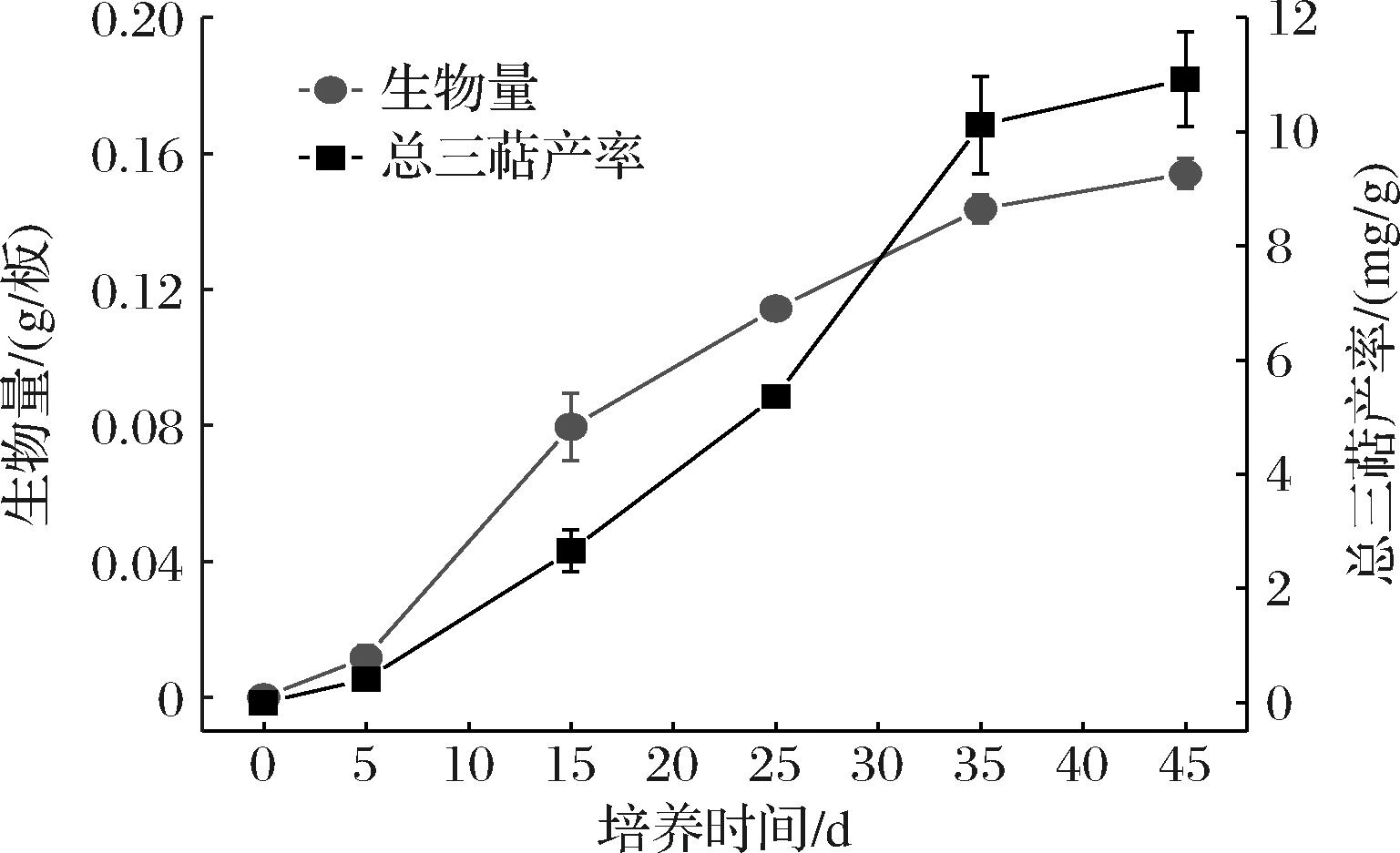
图1 樟芝皿式培养生长曲线
Fig.1 Growth curve of Antrodia cinnamomea cultured in petri-dish
樟芝(Antrodia cinnamomea),又名牛樟芝,属于担子菌门、多孔菌科、薄孔菌属,是一种药食两用真菌[1]。樟芝具有多种药理成分,包括三萜类化合物、多糖、泛醌类化合物、马来酸和琥珀酸的衍生物、腺苷等[2-5]。药理研究表明,樟芝具有抗癌、保肝、抗炎、免疫调节、神经保护等生物活性[6-9],因此樟芝具有的极高药用价值,市场需求极大,但是野生樟芝子实体数量稀少、采集不易。皿式培养是人工培养樟芝菌丝体的重要方式之一,培养周期比椴木栽培法短,但是皿式培养菌丝体三萜的产量仍与野生子实体三萜产量有较大的差距[10]。
目前已有多种方式提高樟芝皿式培养菌丝体的三萜产量,包括改善培养基的组成与配比、添加树木及草药的浸出液以及添加刺激因子等。鲁东大学冯路瑶等[11]研究发现樟芝在胡萝卜培养基(胡萝卜200 g/L、葡萄糖20 g/L、琼脂15 g/L,pH自然)和葡萄糖酵母浸粉蛋白胨培养基(葡萄糖20 g/L、蛋白胨6 g/L、酵母膏10 g/L、琼脂15 g/L,pH自然)上培养的菌丝中总三萜含量较高,且适合三萜积累的碳源有葡萄糖、麦芽糖和甘露糖等,适合三萜积累的氮源有(NH4)2SO4和鱼蛋白胨等。福建农林大学李晶等[12]研究发现不同菌草浸出液对樟芝皿式培养菌丝体总三萜含量促进作用由大到小排列顺序为:香茅草、巨菌草、忧遁草、紫色象草、象草。且香茅草浸出液显著促进漆酶、谷氨酸合成酶合成,显著促进AcHMGS、AcHMGR和AcSE表达,能作为牛樟芝菌丝体培养基,促进菌丝体生长和三萜含量积累。另外,多种刺激因子已被证明具有促进樟芝皿式培养菌丝体三萜生成的作用,广西中医药大学李一凡等[13]研究发现植物激素生长素可以显著促进樟芝皿式培养菌丝体三萜的产量,添加0.5 mg/L时有最大的三萜产量133.24 mg/L,较对照组提高了61.31%;并且添加牛樟树粉末对牛樟芝菌丝体粗三萜产量提升作用明显,在添加质量浓度为0.5 mg/L时,三萜产量为98.87 mg/L,较对照组提升了84.26%。ZHANG等[14]研究了一种单萜α-松油醇对樟芝皿式培养菌丝三萜生成的影响,发现α-松油醇的最佳添加量为0.05 mL/L,三萜产率达到32.52 mg/g。
本研究评价存在于牛樟树挥发性化合物中[15]的3种单环单萜(4-萜烯醇、α-松油烯和松油烯)(图1)对樟芝皿式培养的影响。首先比较了3种单萜对樟芝皿式培养三萜生成的影响,再通过LC-MS分析各物质最佳添加浓度下菌丝体三萜组成的变化,为提高樟芝人工培养三萜生产的效率提供新思路以及实践依据,具有较大的开发价值及应用前景。

图1 樟芝皿式培养生长曲线
Fig.1 Growth curve of Antrodia cinnamomea cultured in petri-dish
1.1.1 主要材料与试剂
樟芝菌株ATCC 200183,实验室保存。
齐墩果酸、α-松油醇,西格玛奥德里奇(上海)贸易有限公司;香兰素、冰醋酸、高氯酸,国药集团化学试剂有限公司;甲醇、乙腈(HPLC级),上海麦克林生化科技股份有限公司;4-萜烯醇、松油烯,上海阿拉丁生化科技股份有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,日本荣研生物科技有限公司。
1.1.2 仪器与设备
UV-1600紫外可见分光光度计,上海翱艺仪器有限公司;GZX-9146MBE电热鼓风干燥箱,上海博讯实业有限公司;SW-CJ-1FD超净工作台,吴江市金晓空调净化有限公司;WATERS ACQUITY超高效液相色谱仪、WATERS MALDI SYNAPT Q-TOF MS质谱仪,沃特世科技(上海)有限公司;有机微孔滤膜(0.22 μm),天津市领航实验设备股份有限公司。
1.2.1 菌种的保存及活化
牛樟芝的菌丝体保存在体积分数30%的甘油中,置于-80 ℃冰箱内长时间保存。取边长为1 cm的菌丝接种至含有PDA培养基的斜面中,置于26 ℃的恒温培养箱中避光培养20 d,待菌丝长满培养基表面,菌种活化完成。用直径为0.8 cm的凝胶打孔器从斜面中取下圆形的菌块,接种至含PDA培养基的平皿中央,置于26 ℃的恒温培养箱中避光培养30 d,待菌丝长满培养基表面,获得实验接种的初始培养菌丝。
1.2.2 樟芝皿式培养时间的确定
用直径为0.8 cm的打孔器从初始平板上取菌丝置于含有PDA培养基的平皿中,置于26 ℃的恒温培养箱中培养。分别在培养第5、15、25、35、45天取样,分离菌丝与培养基并记录菌丝干重,测量菌丝的三萜含量以及三萜组成的变化情况。
1.2.3 不同浓度单萜对樟芝皿式培养的影响
在PDA培养基凝固前加入不同质量浓度的单萜(0、0.04、0.08、0.12、0.16、0.20 g/L),混匀,待培养基凝固后,接种直径为0.8 cm的樟芝菌丝至平皿中央,置于26 ℃恒温培养箱中培养。
1.2.4 樟芝菌丝体生物量的测定
分离每组菌丝体与培养基,将菌丝体置于50 ℃烘箱中干燥至恒重,测定干重,得到每组樟芝菌丝体生物量。
1.2.5 樟芝菌丝体三萜含量的测定
采用香草醛-高氯酸法进行测定。精确称取香草醛0.50 g于10 mL的容量瓶中,用冰醋酸定容,得到50 g/L的香草醛-冰醋酸溶液;精确称取4 mg齐墩果酸对照品于10 mL容量瓶中,用甲醇定容,得到质量浓度为0.4 mg/mL的齐墩果酸标准液,分别吸取上述标准溶液0、0.4、0.8、1.2、1.6、2.0 mL于20 mL比色管中,100 ℃水浴蒸干溶剂,加入0.3 mL的香草醛-冰醋酸溶液和1 mL的高氯酸溶液,60 ℃水浴20 min,反应后的溶液置于冰水中冷却,加入10 mL的冰醋酸溶液,摇匀后测定溶液在550 nm下的吸光值,以齐墩果酸的含量为X,吸光值为Y,绘制标准曲线为Y=4.790 8X-0.003 6,R2=0.998 5。实验中各组樟芝干燥后的菌丝体用2 mL甲醇超声波提取三萜类物质,超声波功率400 W,温度50 ℃,提取120 min,得到的溶液用0.22 μm的有机微孔滤膜进行过滤,取200 μL滤液置于20 mL比色管中,按照上述测定操作测定吸光值,并根据标准曲线计算总三萜含量。
1.2.6 樟芝菌丝体三萜组成变化的检测
采用LC-MS法对樟芝菌丝体三萜组成进行检测,与文献中各三萜的质谱信息进行对比,确定液相图谱中各峰的信息[16]。超高效液相色谱仪型号,WATERS ACQUITY;液相色谱柱型号,Shim-pack XR-ODS Ⅲ 2.2 μm,2.0 mm × 15 cm;液相检测条件:流动相,乙腈、0.01%磷酸-水溶液;进样量10 μL;柱温50 ℃;流速0.5 mL/min;检测波长254 nm;时间程序,0~15 min,30%~80% 乙腈;内标化合物,香兰素。质谱仪型号:WATERS MALDI SYNAPT Q-TOF MS;质谱检测条件:离子方式ESI-;毛细管电压3.5 kV;锥孔电压30 V;离子源温度100 ℃;脱溶剂气温度400 ℃;碰撞能量6/20 V;质量范围20~2 000 m/z;电压1 800 V。
采用Origin 2021对结果进行单因素方差分析,所有实验重复3次,生物量和三萜产率以平均值±标准差表示。采用SPSS对结果进行显著性分析,P<0.05表示差异具有统计学意义;*表示P<0.05,**表示P<0.01,***表示P<0.001。
在樟芝皿式培养不同时间取样,检测菌丝体生物量与三萜产率,绘制樟芝皿式培养生长曲线(图1)。可以看出,樟芝皿式培养5~25 d是菌丝快速生长的时期,25 d之后樟芝生长速率减慢;培养5 d后三萜开始积累,在培养25~35 d是三萜快速积累的时期。培养35 d后樟芝菌丝体生长速率和三萜合成速率开始减慢,因此在本研究中选择35 d作为樟芝皿式培养的时间。
α-松油醇的添加质量浓度在0.04~ 0.12 g/L时,对樟芝皿式培养菌丝生长具有显著的促进作用;添加质量浓度为0.08 g/L时,生物量达到最大值165.67 mg/板,且三萜产率显著提升,达到最大值17.55 mg/g,较对照组提高了50.39%(图2-a)。4-萜烯醇在试验浓度范围内并没有对樟芝皿式培养生长产生明显的促进作用,但是在添加质量浓度为0.12 g/L时,三萜产率显著提高并达到最大值8.89 mg/g,较对照组提高了28.65%,且在添加质量浓度为0.20 g/L时显著抑制三萜生成(图2-b)。松油烯在试验浓度范围内也没有对樟芝皿式培养生长产生明显的促进作用,但对三萜产率有明显的促进作用,三萜产率随着添加浓度的增大而先升高后降低;松油烯添加质量浓度为0.16 g/L时,三萜产率达到最大值13.56 mg/g,较对照组提高了55.68%(图2-c)。综上所述,α-松油醇、4-萜烯醇和松油烯的最佳添加质量浓度分别为0.08、0.12、0.16 g/L。
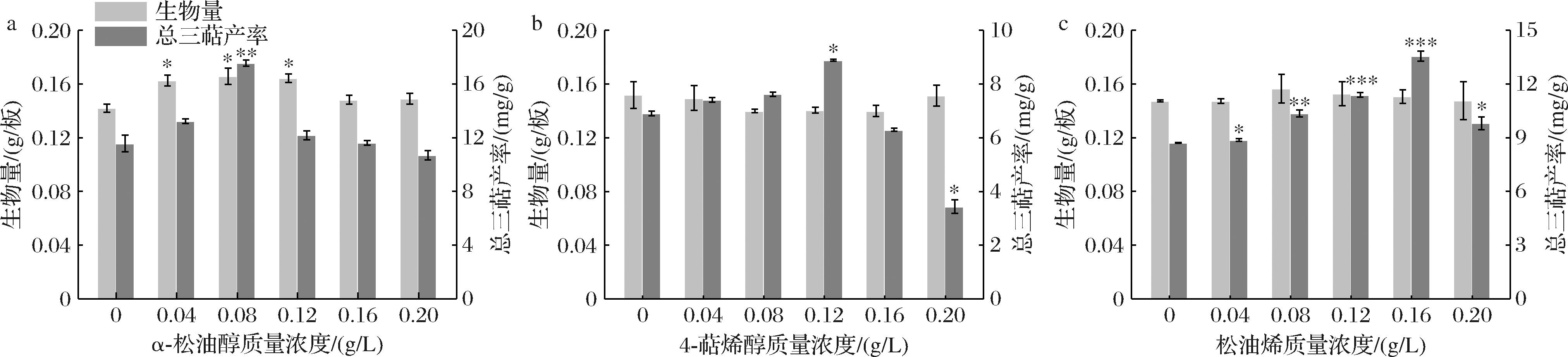
a-α-松油醇;b-4-萜烯醇;c-松油烯
图2 不同浓度单萜对樟芝皿式培养菌丝生长和三萜产率的影响
Fig.2 Effect of different concentration monoterpenoids on biomass and triterpenoids yield of A. cinnamomea cultured in petri-dish
2.3.1 添加0.08 g/L α-松油醇对樟芝皿式培养三萜组成的影响
通过LC-MS对皿式培养基中添加0.08 g/L α-松油醇的菌丝体进行了检测,液相图谱显示有4个峰(保留时间分别为3.86、6.07、6.27、6.74 min)的丰度比对照组显著增加(图3)。通过与文献中樟芝三萜类物质质谱信息的对照,确定2号峰为三萜去氢硫色多孔菌酸,含量较对照组增加了3.20倍(表1)。
表1 培养基中添加0.08 g/L α-松油醇皿式培养樟芝菌丝体中三萜类物质的鉴定
Table 1 Triterpenoids determination of the mycelia cultured with 0.08 g/L α-terpineol in petri-dish culture

峰号出峰时间/min一级质谱碎片 (m/z)理论值测量值Δm鉴定结果丰度(校正后)0.08 g/L α-松油醇对照组含量提高倍数26.07483.348 0483.346 72.69去氢硫色多孔菌酸42 67910 1733.20

a-添加0.08 g/L α-松油醇培养的菌丝体;b-对照组菌丝体
图3 培养基中添加0.08 g/L α-松油醇皿式培养菌丝体的LC-MS检测结果
Fig.3 LC-MS results of the mycelia cultured with 0.08 g/L α-terpineol in petri-dish culture
2.3.2 添加0.12 g/L 4-萜烯醇对樟芝皿式培养三萜组成的影响
通过LC-MS对皿式培养基中添加0.12 g/L 4-萜烯醇的菌丝体进行检测,液相图谱显示有1个峰(保留时间:3.86 min)的丰度比对照组显著增加(图4)。与文献中三萜类物质质谱信息进行比对,未能鉴定出此峰代表什么物质。
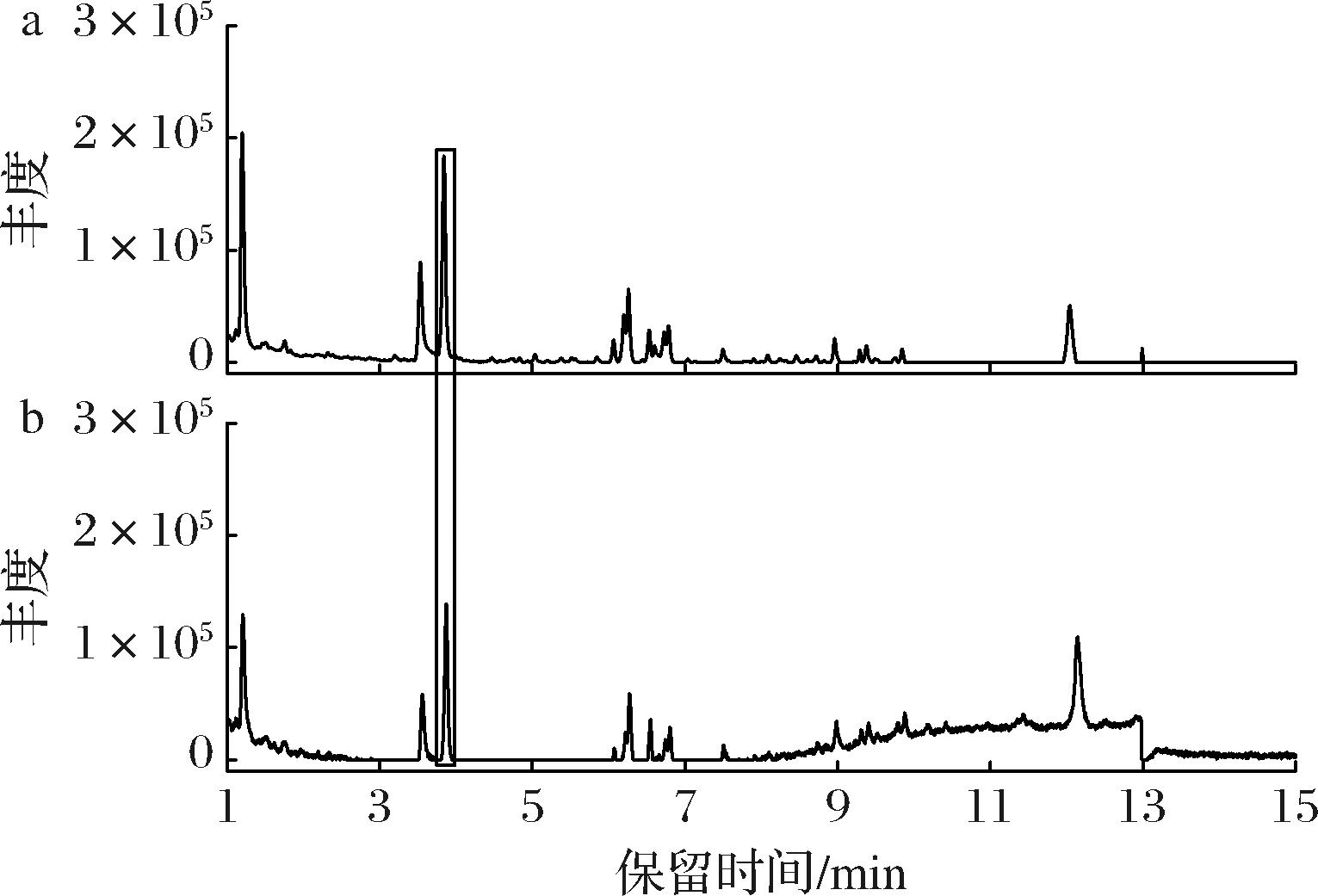
a-添加0.12 g/L 4-萜烯醇培养的菌丝体;b-对照组菌丝体
图4 培养基中添加0.12 g/L 4-萜烯醇皿式培养樟芝菌丝体的LC-MS检测结果
Fig.4 LC-MS results of the mycelia cultured with 0.12 g/L terpinene-4-ol in petri-dish culture
2.3.3 添加0.16 g/L 松油烯对樟芝皿式培养三萜组成的影响
通过LC-MS对皿式培养基中添加0.16 g/L松油烯的菌丝体进行了检测,液相图谱显示有3个峰(保留时间分别为6.07、6.71、8.98 min)的丰度比对照组显著增加(图5)。通过与文献中樟芝三萜类物质质谱信息的对照,确定1号峰为三萜去氢硫色多孔菌酸,含量较对照组增加了5.56倍;3号峰为三萜去氢齿孔菌酸,含量较对照组增加了0.96倍(表2)。
表2 培养基中添加0.16 g/L松油烯皿式培养菌丝体中三萜类物质的鉴定
Table 2 Triterpenoids determination of the mycelia cultured with 0.16 g/L α-terpinene in petri-dish culture
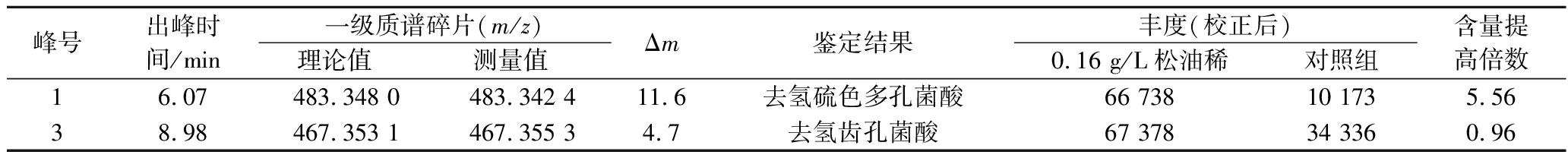
峰号出峰时间/min一级质谱碎片(m/z)理论值测量值Δm鉴定结果丰度(校正后)0.16 g/L松油稀对照组含量提高倍数16.07483.348 0483.342 411.6去氢硫色多孔菌酸66 73810 1735.5638.98467.353 1467.355 34.7去氢齿孔菌酸67 37834 3360.96
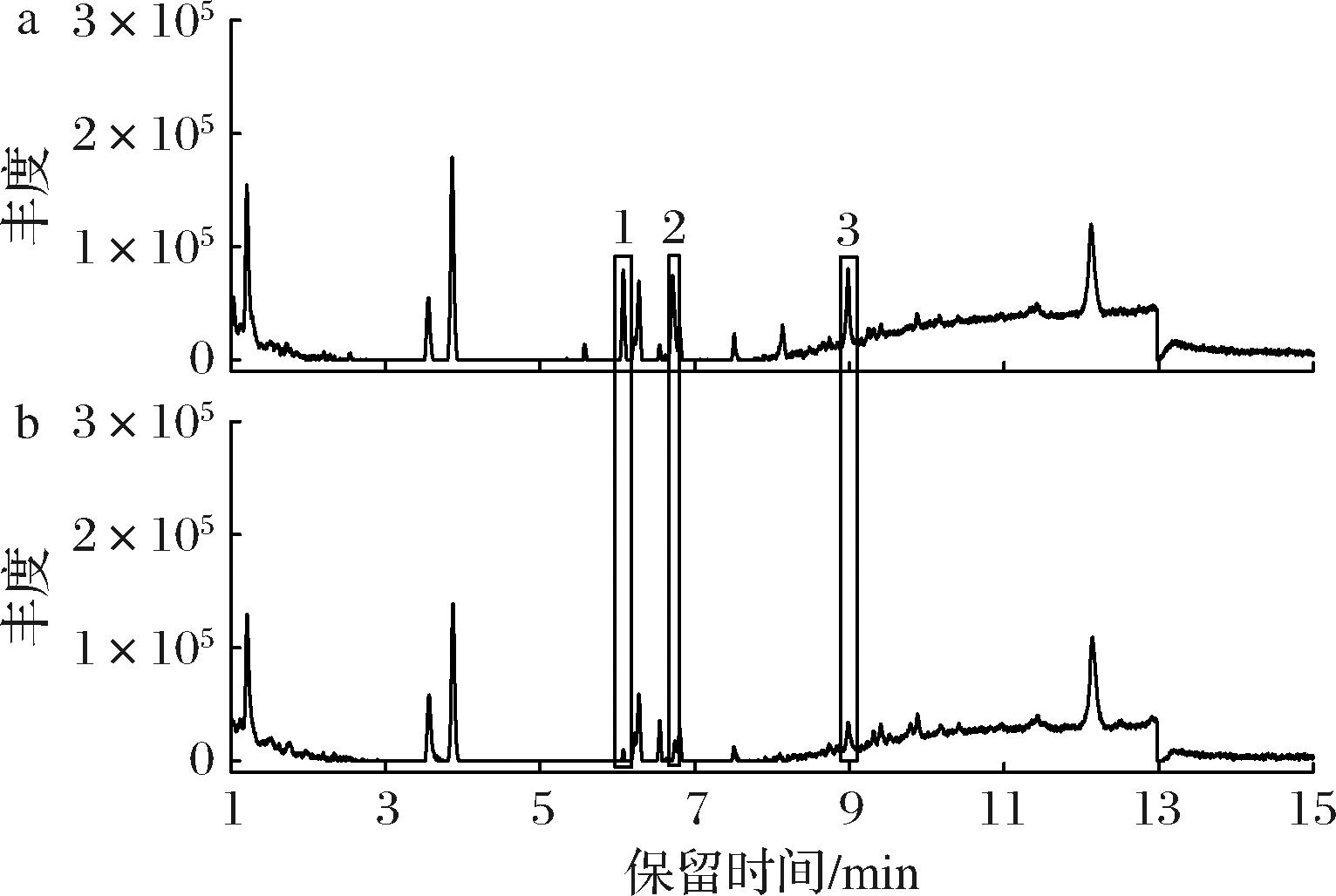
a-添加0.16 g/L松油烯培养的菌丝体;b-对照组菌丝体
图5 培养基中添加0.16 g/L松油烯皿式培养菌丝体的LC-MS检测结果
Fig.5 LC-MS results of the mycelia cultured with 0.16 g/L α-terpinene in petri-dish culture
本文首先研究了3种单萜α-松油醇、4-萜烯醇和松油烯对樟芝皿式培养生物量和三萜产率的影响。结果表明,只有α-松油醇对樟芝生长具有促进作用,在α-松油醇添加质量浓度为0.08 g/L时,樟芝皿式培养生物量达到最大。且3种单萜对樟芝皿式培养三萜生成均有不同程度的促进作用,最佳添加浓度和作用大小为0.16 g/L松油稀>0.08 g/L α-松油醇>0.12 g/L 4-萜烯醇,三萜产率分别较对照组提高了55.68%、50.39%和28.65%。通过LC-MS对各组菌丝体三萜组成的分析,发现培养基中添加0.16 g/L松油烯的菌丝体中两种三萜(去氢硫色多孔菌酸和去氢齿孔菌酸)的含量显著升高,分别较对照组提高了5.56倍和0.96倍;培养基中添加0.08 g/L α-松油醇的菌丝体中去氢硫色多孔菌酸的含量显著升高,较对照组提高了3.20倍。去氢硫色多孔菌酸和去氢齿孔菌酸都是樟芝的活性三萜,1996年这两种三萜首次被YANG等[8]在樟芝子实体中检测并鉴定出来;一些研究报道,去氢硫色多孔菌酸具有抗氧化活性[17],并且对人类白血病细胞系U397、胰腺癌细胞BxPC3[18]展现出了毒性作用;而去氢齿孔菌酸也被报道对多种癌细胞都具有毒性作用,包括胶质母细胞瘤细胞系U87MG[19]、结肠细胞系HT-29和HCT116、乳腺癌细胞系MDAMB231以及肺癌细胞系A549和CL1-0[20],另外,去氢齿孔菌酸也被报道在人体内具有抗炎症作用[21]。由于去氢硫色多孔菌酸和去氢齿孔菌酸是野生樟芝子实体药理活性的重要来源,因此提高人工培养樟芝菌丝体中这两种三萜的产率具有重要的医学价值。
羊毛甾烷型三萜的合成较麦角甾烷型三萜合成需要更少的步骤,因此羊毛甾烷型三萜能够更快地响应萜类合成前体含量的变化。去氢硫色多孔菌酸和去氢齿孔菌酸是人工培养樟芝菌丝体中主要的羊毛甾烷型三萜,它们的产率一定程度上可以代表菌丝体内总三萜的表达水平[22],这个结论与本研究中的结果一致。在樟芝萜类合成的途径中,单萜是三萜合成过程中的重要分支代谢产物,过多单萜的合成可能是人工培养樟芝三萜无法积累的原因。在本研究中,培养基中添加的3种单萜可能发挥了萜烯合酶抑制剂的作用,阻碍了萜类合成前体向单萜的转化,从而使三萜的产率显著提高。这也可能是在含有多种单萜及单萜衍生物的牛樟木上,野生樟芝子实体中三萜能够大量积累的原因。在今后的研究中,期望通过实时荧光定量PCR检测萜类合成相关基因的表达水平来证实这个假设。
[1] WU S H, RYVARDEN L, CHANG T T.Antrodia camphorata (“niu-chang-chih”), new combination of a medicinal fungus in Taiwan[J].Botanical Bulletin of Academia Sinica, 1997, 38(4):273-275.
[2] GUO W J, YU J, ZHU D W, et al.Chemical constituents of the artificial fruit body of Antrodia cinnamomea[J].Chemistry of Natural Compounds, 2020, 56(4):777-779.
[3] 赵春艳, 吴素蕊, 高观世, 等.牛樟芝药用功能成分作用及应用进展[J].食品工业科技, 2016, 37(23):391-395.
ZHAO C Y, WU S R, GAO G S, et al.Research progress of the medicinal function components and utilization of Antrodia cinnamomea[J].Science and Technology of Food Industry, 2016, 37(23):391-395.
[4] LU M C, EL-SHAZLY M, WU T Y, et al.Recent research and development of Antrodia cinnamomea[J].Pharmacology &Therapeutics, 2013, 139(2):124-156.
[5] ZHANG B B, GUAN Y Y, HU P F, et al.Production of bioactive metabolites by submerged fermentation of the medicinal mushroom Antrodia cinnamomea:Recent advances and future development[J].Critical Reviews in Biotechnology, 2019, 39(4):541-554.
[6] LIU Y W, LU K H, HO C T, et al.Protective effects of Antrodia cinnamomea against liver injury[J].Journal of Traditional and Complementary Medicine, 2012, 2(4):284-294.
[7] LIU H, XING H, JIN Y H, et al.Application of multiple strategies to improve the production of the potential cancer drug 4-acetylantroquinonol B (4-AAQB) by the rare fungus Antrodia cinnamomea[J].Applied Biochemistry and Biotechnology, 2022, 194(6):2720-2730.
[8] YANG S W, SHEN Y C, CHEN C H.Steroids and triterpenoids of Antodia cinnamomea:A fungus parasitic on Cinnamomum micranthum[J].Phytochemistry, 1996, 41(5):1389-1392.
[9] LIN T Y, TSENG A J, QIU W L, et al.A sulfated glucan from Antrodia cinnamomea reduces Slug expression through regulation of TGFβ/AKT/GSK3β axis in lung cancer[J].Carbohydrate Polymers, 2019, 210:175-184.
[10] LIANG M T, LIANG R C, HUANG L R, et al.Supercritical fluids as the desorbent for simulated moving bed:Application to the concentration of triterpenoids from Taiwanofugus camphorata[J].Journal of The Taiwan Institute of Chemical Engineers, 2014, 45(4):1225-1232.
[11] 冯路瑶, 程显好, 李寅, 等.培养皿培养对牛樟芝生长特性及其总三萜含量的影响[J].中国食用菌, 2015, 34(4):31-35.
FENG L Y, CHENG X H, LI Y, et al.Cultural characteristics and content of total triterpenes of Antrodia camphorata on solid media[J].Edible Fungi of China, 2015, 34(4):31-35.
[12] 李晶, 夏舒宁, 张黛, 等.不同菌草对皿培牛樟芝菌丝体的影响[J].北方园艺, 2022(8):108-115.
LI J, XIA S N, ZHANG D, et al.Effects of different Juncao on solid cultured mycelium of Antrodia camphorata[J].Northern Horticulture, 2022(8):108-115.
[13] 李一凡, 谢观雯, 李翁坤, 等.植物激素及木质素对牛樟芝菌丝体生长情况的影响[J].中草药, 2019, 50(6):1453-1460.
LI Y F, XIE G W, LI W K, et al.Effects of phytohormones and lignin on growth of Antrodia cinnamomea mycelium[J].Chinese Traditional and Herbal Drugs, 2019, 50(6):1453-1460.
[14] ZHANG Y T, LI D Y, WANG Z, et al.Alpha-terpineol affects synthesis and antitumor activity of triterpenoids from Antrodia cinnamomea mycelia in solid-state culture[J].Food &Function, 2018, 9(12):6517-6525.
[15] 杨海宽, 章挺, 汪信东, 等.牛樟叶精油化学成分分析及类型划分研究[J].江西农业大学学报, 2016, 38(4):668-673.
YANG H K, ZHANG T, WANG X D, et al.A study on the chemical components in essential oil from leaves of Cinnamomum kanehirae and chemotype divisions[J].Acta Agriculturae Universitatis Jiangxiensis, 2016, 38(4):668-673.
[16] QIAO X, SONG W, WANG Q, et al.Comprehensive chemical analysis of triterpenoids and polysaccharides in the medicinal mushroom Antrodia cinnamomea[J].RSC Advances, 2015, 5(58):47040-47052.
[17] CHOU M C, CHANG R N, HUNG Y H, et al.Antrodia camphorata ameliorates high-fat-diet induced hepatic steatosis via improving lipid metabolism and antioxidative status[J].Journal of Functional Foods, 2013, 5(3):1317-1325.
[18] CHEN Y J, CHOU C J, CHANG T T.Compound MMH01 possesses toxicity against human leukemia and pancreatic cancer cells[J].Toxicology in Vitro, 2009, 23(3):418-424.
[19] DENG J Y, CHEN S J, JOW G M, et al.Dehydroeburicoic acid induces calcium- and calpain-dependent necrosis in human U87MG glioblastomas[J].Chemical Research in Toxicology, 2009, 22(11):1817-1826.
[20] YEH C T, RAO Y K, YAO C J, et al.Cytotoxic triterpenes from Antrodia camphorata and their mode of action in HT-29 human colon cancer cells[J].Cancer Letters, 2009, 285(1):73-79.
[21] CHEN J J, LIN W J, LIAO C H, et al.Anti-inflammatory benzenoids from Antrodia camphorata[J].Journal of Natural Products, 2007, 70(6):989-992.
[22] LIN Y L, LEE Y R, TSAO N W, et al.Characterization of the 2, 3-oxidosqualene cyclase gene from Antrodia cinnamomea and enhancement of cytotoxic triterpenoid compound production[J].Journal of Natural Products, 2015, 78(7):1556-1562.