骨骼在体内起着维持机体运动功能、保护内脏、调节矿物质稳态等重要作用,维持骨骼健康对于机体健康至关重要[1]。骨健康与基因、年龄、激素、膳食等多种因素有关[2]。合理膳食对维持骨健康至关重要[3]。钙、维生素D和维生素K的摄入已被证实有利于骨骼发育,缺乏会减慢儿童青少年期的骨量增加,影响峰值骨量,并导致中老年人骨质疏松风险升高[4-7]。儿童青少年期的高峰值骨量能够提供更大的骨量储备,有效降低老年期骨质疏松症和骨折的发生风险[8]。目前我国儿童钙摄入不足的情况依然严峻[9-10],因此提高儿童期钙摄入量及其生物利用度是改善全年龄周期人群骨健康的有效途径。
骨碎补(Drynariae Rhizoma)是植物槲蕨Drynaria fortunei (Kunze) J.Sm.的干燥根茎,主要活性成分包括黄酮类、甾体类、苯丙素类、三萜类、酚酸类等,其中柚皮苷是主要活性物质,具有抗骨质疏松、抗炎、抗氧化应激、抗细胞凋亡等作用[11-12]。动物研究结果表明,骨碎补可有效抑制大鼠的骨质流失[13]、促进骨折愈合[14-16]、治疗糖皮质激素引起的骨质疏松症[17-18]、预防骨质疏松症的发生[19-20]。骨碎补属于可用于保健食品的中药之一,但尚无添加了骨碎补的奶粉对于骨骼健康的促进作用的研究。奶粉是钙的良好来源,是日常促进骨健康的重点关注食品种类,将骨碎补加入其中有望更好的提高钙的生物利用度,更有效地促进骨骼健康。
因此,本研究参考《保健食品功能检验与评价方法(2023年版)》中有助于改善骨密度检验方法中的方案一,以低钙饲料为基础饲料,采用碳酸钙作为阳性对照,同时给予不同剂量的添加了骨碎补的奶粉,初步探索强化了钙、维生素D和维生素K2且添加了骨碎补的奶粉对生长期大鼠骨健康的影响,为骨碎补在奶粉中的应用提供依据。
碳酸钙,分析纯,成都科隆化工有限公司;受试奶粉,国家乳业技术创新中心提供,每100 g奶粉含有钙960~1 440 mg,维生素D 16~24 μg,维生素K2 80~120 μg,骨碎补提取物0.5~1.0 g,人体推荐剂量为每日50 g奶粉。
50只出生4周左右的断乳SPF级雌性SD大鼠,体重60~80 g,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2021—0011。大鼠饲养于四川大学华西公共卫生学院屏障级动物房[许可证号为SYXK(川)2023—0011]。饲养环境:20~26 ℃,相对湿度40%~70%,明暗交替周期为12 h,自由饮水(去离子水)和摄食。本研究采用的基础低钙饲料参照《保健食品功能检验与评价方法(2023年版)》中有助于改善骨密度检验方法中的方案一的基础饲料配制,钙的含量为150 mg/100 g饲料,购自四川省医学科学院。本研究经四川大学华西第四医院/华西公共卫生学院伦理委员会批准(批件号:Gwll2023002)。
适应性喂养1周后,50只大鼠按照体重水平随机分为5组,每组10只,分别为低钙对照组、碳酸钙对照组、奶粉低剂量组(人体推荐量的2.5倍)、奶粉中剂量组(人体推荐量的5倍)和奶粉高剂量组(人体推荐量的10倍)。受试奶粉的人体推荐剂量为每日50 g,成人体重以60 kg计,则每日推荐剂量为0.833 g/kg BW,即奶粉低、中、高剂量组对应的剂量分别为2.083 g/kg BW、4.167 g/kg BW和8.333 g/kg BW。碳酸钙对照组的钙含量等同于奶粉高剂量组的钙含量,而奶粉高剂量组每只大鼠每日从奶粉中摄入的钙含量为84.497 mg/kg BW,换算成碳酸钙为211.243 mg/kg BW,因此碳酸钙对照组的干预剂量设定为211.243 mg/kg BW。各组受试物溶于纯水配制,经口灌胃给予受试物,灌胃量为1.5 mL/100 g BW,低钙对照组灌胃给予相同体积纯水,连续90 d。
BSA224S分析天平,德国赛多利斯公司;5424R高速冷冻离心机,德国艾本德Eppendorf公司;FZ366电热恒温鼓风干燥箱,黄石市恒丰医疗器械有限公司;discovery QDR双能X射线骨密度仪,美国豪洛捷公司;5100电感耦合等离子体发射光谱仪,美国安捷伦公司;SkyScan 1276型Micro-CT仪,德国布鲁克公司;RT-6100全自动酶标仪,美国杜雷公司;Contr AA700型原子吸收分光光度仪,德国耶拿ZEEnit公司;Pannoramic 250数字切片扫描仪,匈牙利3DHISTECH公司。
4%多聚甲醛溶液,Biosharp公司;生理盐水,四川科伦药业股份有限公司;体积分数为75%的酒精,成都金山化学试剂有限公司;硝酸、盐酸,均为分析纯,成都科隆化工有限公司;ELISA试剂盒,上海酶联生物科技有限公司;抗酒石酸碱性磷酸酶(tartrate-resistant acid phosphatase, TRAP)染色试剂盒,武汉塞维尔生物科技有限公司。
1.5.1 体重和一般情况
记录大鼠初始体重和干预结束后的空腹体重,干预期内每隔7 d称量1次体重。每天观察大鼠的躯体运动、食欲、毛色等一般情况。
1.5.2 股骨常规指标
处死大鼠后,分离右侧股骨,去除表面附着的肌肉和软组织等,置于105 ℃干燥箱中烘干,用游标卡尺测量股骨长并称量股骨干重。
1.5.3 骨密度和骨钙测定
取右侧股骨于双能X射线骨密度仪中测量股骨中点及远心端的骨密度值(bone mineral density, BMD),湿法消化后,用原子吸收法测定骨钙含量。
1.5.4 钙代谢实验
干预期结束前3 d,每组随机选取8只大鼠进行钙代谢实验。每只大鼠单独饲养于代谢笼中,记录3 d的进食量,收集尿液和粪便并记录排出量。湿法消化后,采用原子吸收法测定饲料、尿液和粪便中的钙含量,并按公式(1)和公式(2)计算大鼠的钙吸收率和钙储留率:
钙吸收率![]()
(1)
钙储留率![]()
(2)
1.5.5 血清骨代谢标志物检测
大鼠腹主动脉采血,于4 ℃、3 500 r/min离心15 min后分离血清,采用ELISA试剂盒检测血清中Ⅰ型胶原C端交联肽(C-telopeptide of type Ⅰ collagen, CTX-Ⅰ)、Ⅰ型前胶原氨基端原肽(procollagen type Ⅰ amino-terminal peptide, PINP)和骨钙素(osteocalcin, BGP)的水平。
1.5.6 股骨TRAP染色
取扫描后的左侧股骨用150 g/L EDTA脱钙,脱钙后脱水、石蜡包埋、切片、TRAP染色,在显微镜下观察切片染色情况并用数字切片扫描仪进行图像采集,分析破骨细胞数量。酸性磷酸酶活性处呈酒红色为阳性表达。
1.5.7 股骨Micro-CT检测
处死后,取大鼠左侧股骨,剔除肌肉和软组织后置于4%多聚甲醛溶液中固定,4 ℃冰箱保存。每组随机选取5只大鼠的左侧股骨进行扫描,具体分析参数包括BMD、骨体积分数(bone volume fraction, BV/TV)、骨表面积骨体积比(specific bone surface, BS/BV)、骨表面积组织体积比(bone surface density, BS/TV)、骨小梁模型因子(trabecular pattern factor, Tb.Pf)、结构模型指数(structure model index, SMI)、骨小梁厚度(trabecular thickness, Tb.Th)、骨小梁数目(trabecular number, Tb.N)和骨小梁分离度(trabecular separation, Tb.Sp)。
采用SPSS 26.0软件进行数据处理和统计分析,采用GraphPad Prism 8.0.1软件进行图像绘制,结果以均数±标准差表示。数据先进行正态性和方差齐性检验,采用单因素方差分析(one-way ANOVA)和LSD检验进行组间差异比较,不服从方差齐性的数据采用Tamhane’s T2法进行分析,检验水准α=0.05。
灌胃90 d期间,除低钙对照组外,各组大鼠的一般情况良好,食欲、毛发、对外界反应等均正常,奶粉组大鼠更活泼好动。低钙对照组在灌胃2周后出现明显的脱毛现象,但未见其他不良反应。各组大鼠大体解剖未见异常。各组大鼠体重变化曲线如图1所示,灌胃期间,各组大鼠体重稳步增加,低钙对照组大鼠的体重整体增长较少,从灌胃14 d起,奶粉各剂量组大鼠的体重均显著高于低钙对照组(P<0.05或P<0.01)。从灌胃28 d起,奶粉各剂量组大鼠的体重均显著高于碳酸钙对照组(P<0.05或P<0.01)。提示低钙摄入不利于生长期大鼠体重增长,而补充受试奶粉可有效促进生长期大鼠的体重增长。
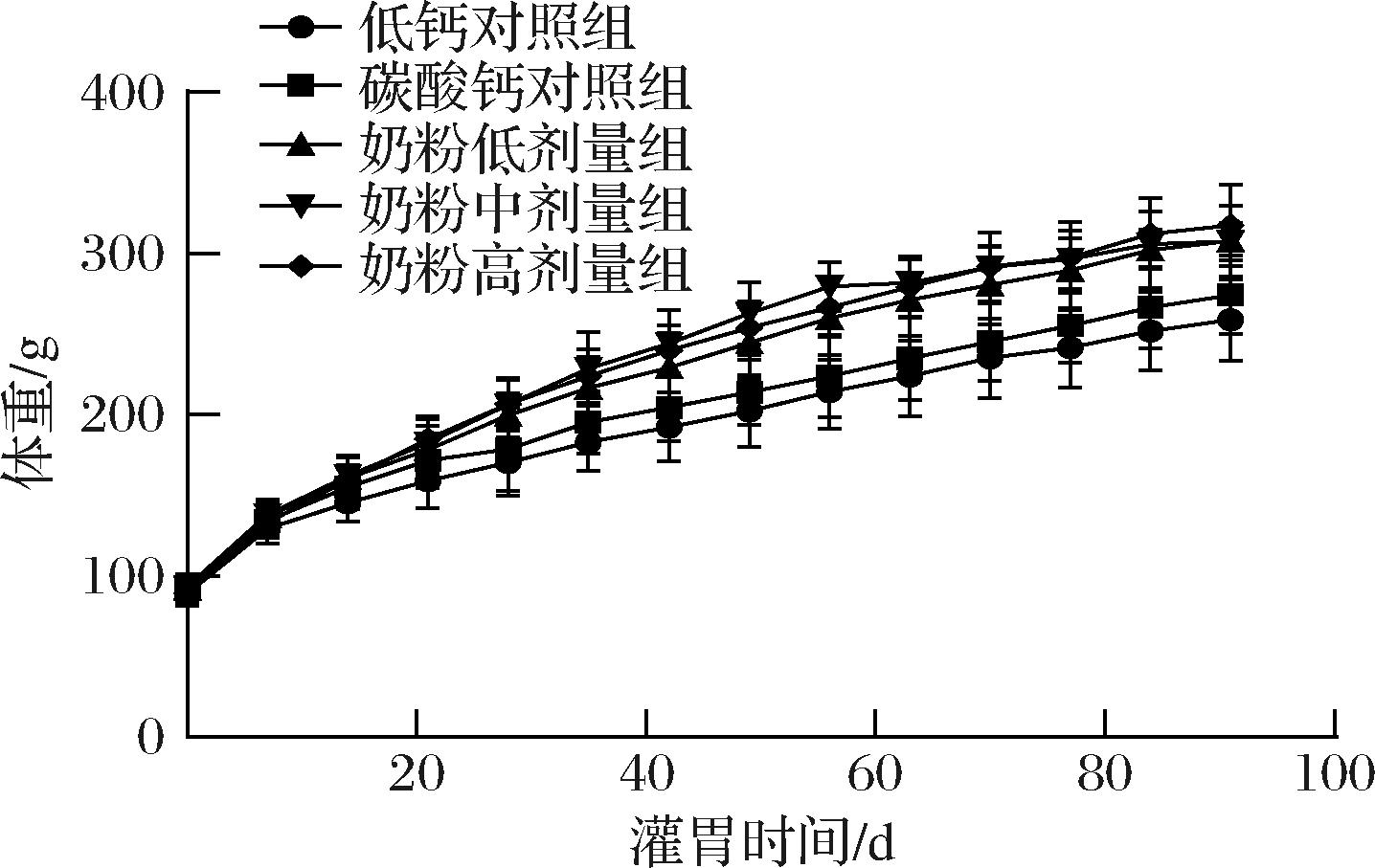
图1 各组大鼠体重变化曲线(n=10)
Fig.1 Body weight change curve of rats in each group (n=10)
各组大鼠的股骨常规指标结果如图2所示。与低钙对照组相比,碳酸钙对照组与奶粉各剂量组的股骨干重均显著增加(P<0.01);与碳酸钙对照组相比,奶粉中剂量组(P<0.05)和高剂量组(P<0.01)的股骨干重显著增加,且奶粉各剂量组的股骨干重随着剂量升高而逐渐增加(P<0.05)。碳酸钙对照组(P<0.05)和奶粉各剂量组(P<0.01)的股骨长均显著高于低钙对照组,奶粉中剂量组(P<0.01)和高剂量组(P<0.05)的股骨长显著高于碳酸钙对照组,表明低钙摄入不利于生长期大鼠股骨正常发育,而受试奶粉可弥补低钙导致的不良影响,且中和高剂量时的效果优于与高剂量组同等剂量碳酸钙的效果。
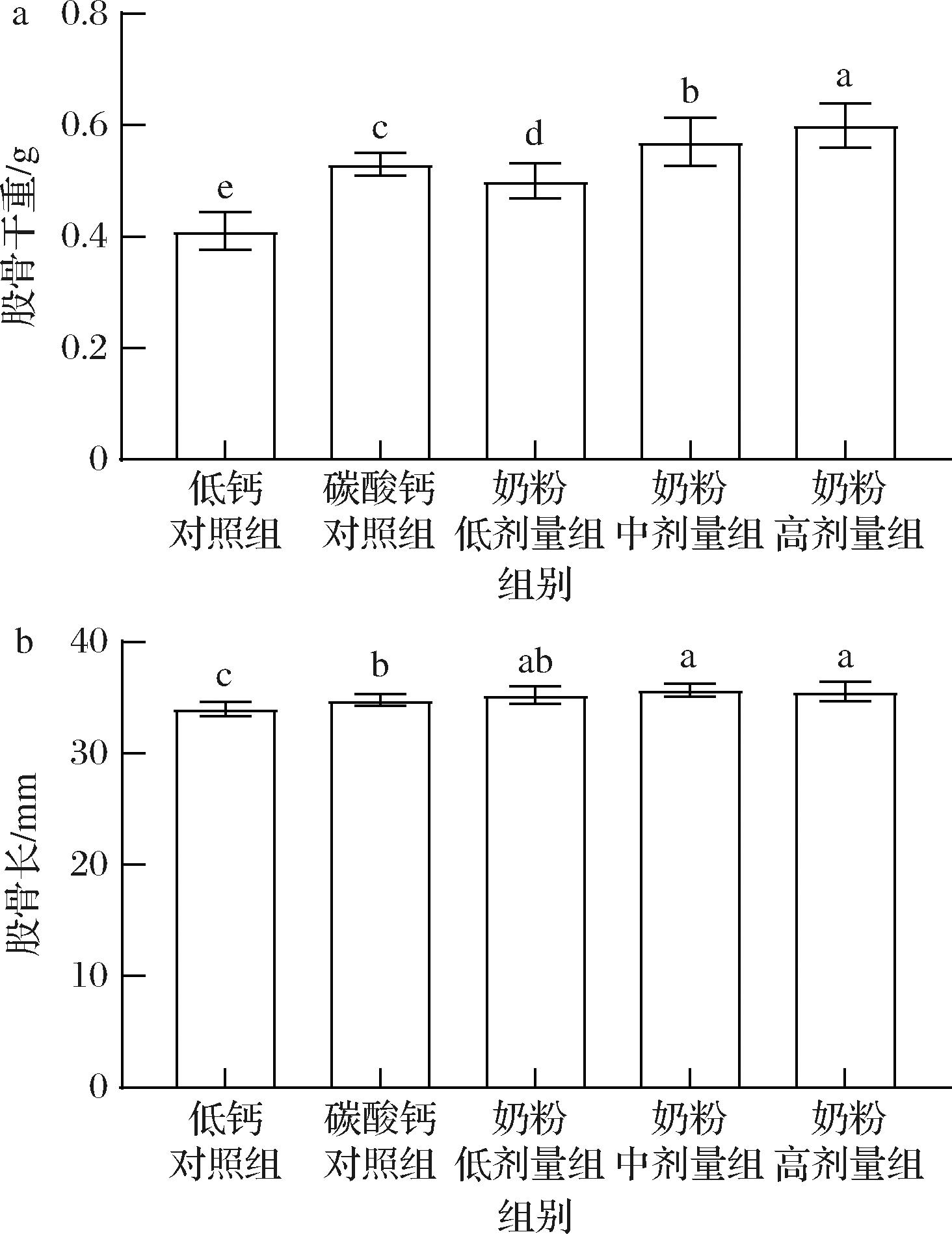
a-股骨干重;b-股骨长
图2 各组大鼠的股骨常规指标(n=10)
Fig.2 Femur dry weights and femur lengths of rats in each group(n=10)
注:字母不同表示差异有统计学意义(P<0.05)(下同)。
如图3所示,碳酸钙对照组和奶粉各剂量组大鼠的股骨远心端BMD和股骨中点BMD均显著高于低钙对照组(P<0.01);奶粉高剂量组的BMD均显著高于碳酸钙对照组(P<0.01);奶粉各剂量组的骨密度随着剂量升高而逐渐增加(P<0.01)。奶粉各剂量组的骨钙含量均显著高于低钙对照组(P<0.01),奶粉高剂量组的骨钙含量显著高于碳酸钙对照组(P<0.01),表明碳酸钙和受试奶粉可有效减轻低钙摄入对生长期大鼠股骨骨量和骨钙含量的负面影响,且高剂量组奶粉的效果最优。
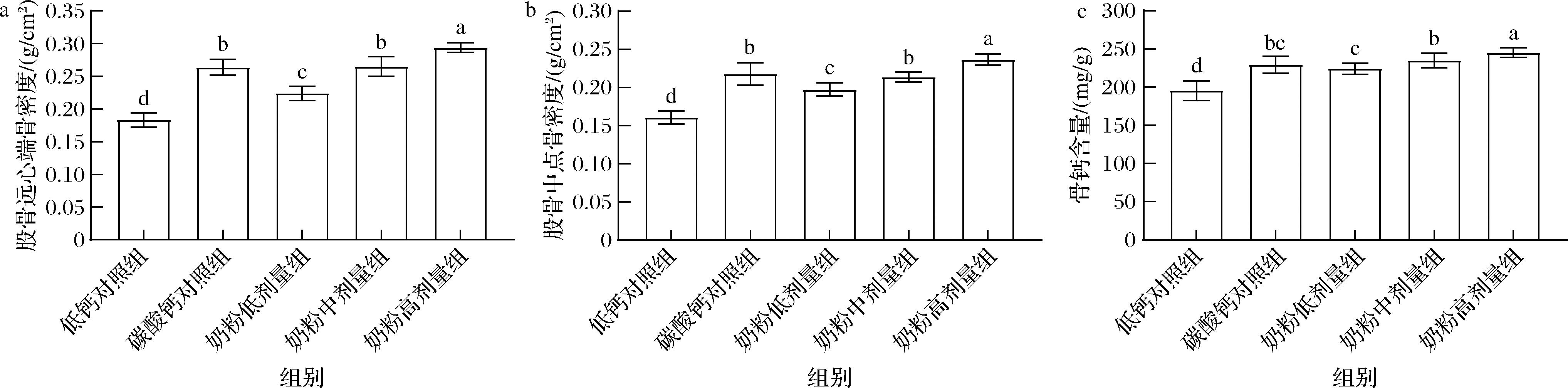
a-股骨远心端BMD;b-股骨中点BMD;c-股骨骨钙
图3 各组大鼠的股骨BMD和骨钙含量
Fig.3 BMD and bone calcium contents in femurs of rats in each group
如图4所示,奶粉低和中剂量组的钙吸收率和钙储留率显著高于碳酸钙对照组(P<0.01)。碳酸钙对照组和奶粉高剂量组的钙吸收率和钙储留率显著低于低钙对照组(P<0.05,P<0.01),提示在实验末期两组体内钙负荷可能已较饱和。

图4 各组大鼠的钙吸收率和钙储留率情况(n=8)
Fig.4 Calcium absorption rate and calcium retention rate of rats in each group (n=8)
如图5所示,碳酸钙对照组和奶粉各剂量组的CTX-Ⅰ水平均显著高于低钙对照组(P<0.01),奶粉中和高剂量组的CTX-Ⅰ水平显著高于碳酸钙对照组(P<0.01)。碳酸钙对照组和奶粉各剂量组的PINP水平均显著高于低钙对照组(P<0.01),奶粉中剂量组的PINP水平显著高于碳酸钙对照组(P<0.01)。奶粉高剂量组的PINP/CTX-Ⅰ比值显著低于低钙对照组(P<0.01)。碳酸钙对照组和奶粉各剂量组的BGP水平均显著高于低钙对照组(P<0.01),奶粉中剂量组和高剂量组的BGP水平显著高于碳酸钙对照组(P<0.05,P<0.01)。上述结果表明,受试奶粉可同时促进大鼠骨形成和骨吸收,即骨代谢加速,但更显著地促进骨形成。

a-CTX-Ⅰ水平;b-PINP水平;c-PINP/CTX-Ⅰ比值;d-BGP水平
图5 各组大鼠的血清生化指标结果(n=10)
Fig.5 Serum biochemical indicators results of rats in each group (n=10)
如图6所示,碳酸钙对照组、奶粉中和高剂量组的破骨细胞数量均显著低于低钙对照组(P<0.05或P<0.01),奶粉高剂量组的破骨细胞数量显著低于碳酸钙对照组(P<0.01),且奶粉中和高剂量组的破骨细胞数量显著低于低剂量组(P<0.01)。
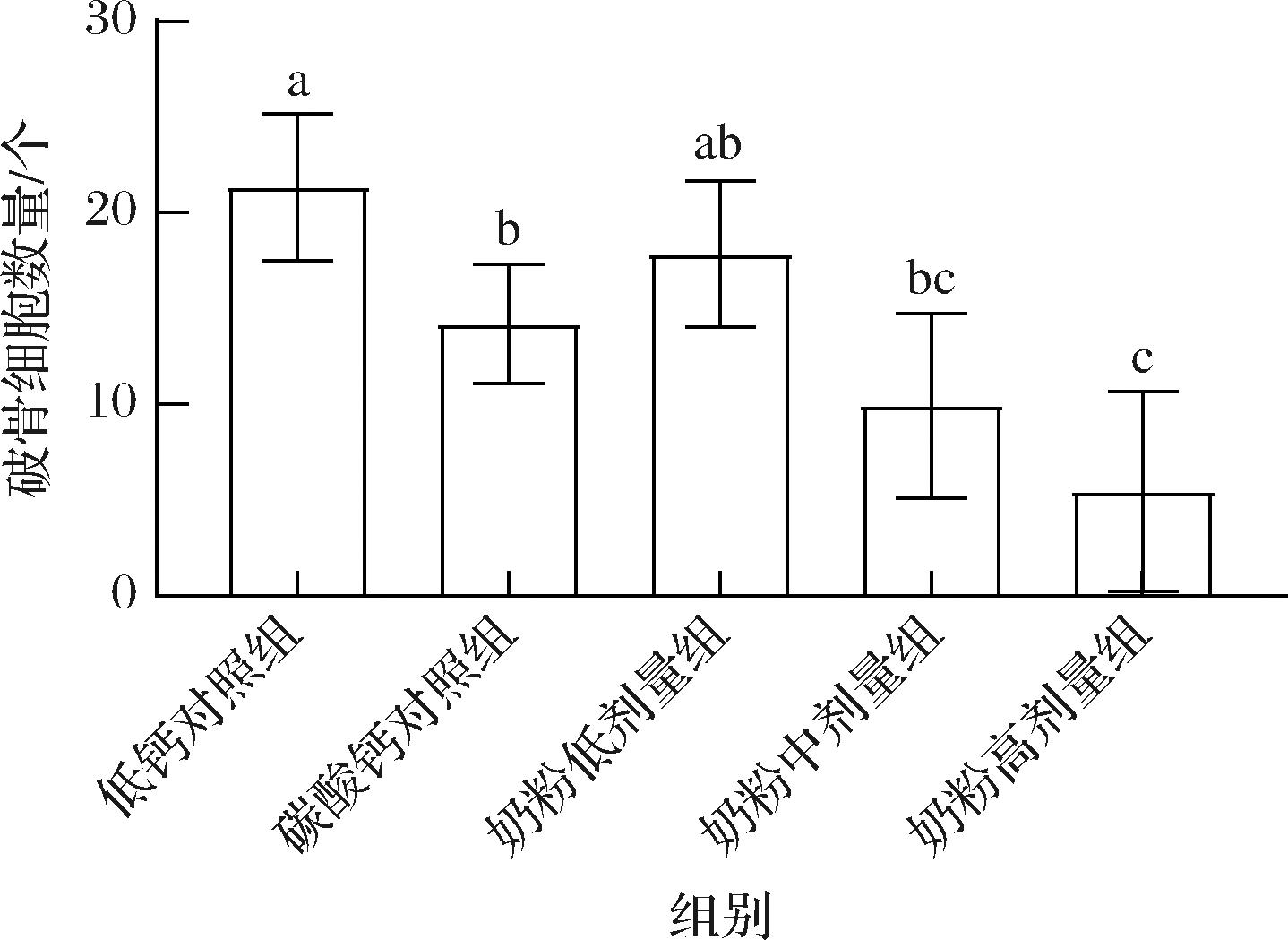
图6 各组大鼠的破骨细胞数量(n=5)
Fig.6 The number of osteoclasts of rats in each group (n=5)
各组TRAP染色典型示意图显示(图7),低钙对照组呈现酒红色的破骨细胞数量明显更多,其余各组酒红色的破骨细胞数量均有不同程度地减少。

图7 各组大鼠的TRAP染色典型示意图(×400)
Fig.7 Typical diagram of TRAP staining of rats in each group (×400)
注:绿色箭头表示阳性表达的细胞。
各组Micro-CT典型示意图(图8)结果显示,低钙对照组明显骨小梁更加稀疏,数量较少,而碳酸钙对照组和奶粉各组骨小梁数量均有不同程度地增加,其中高剂量组尤为显著。
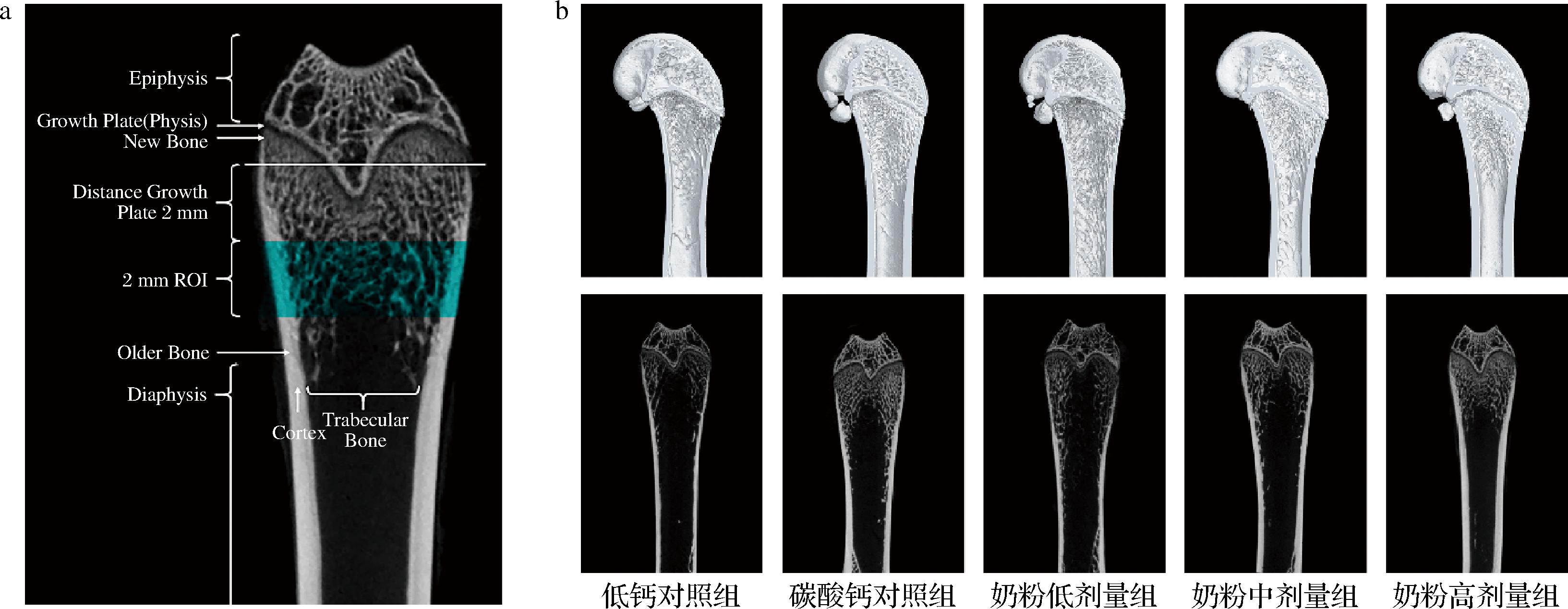
a-Micro-CT的感兴趣区域(region of interest, ROI)及各部位指示图;b-各组大鼠股骨Micro-CT典型示意图(第一行-股骨矢状位3D重建图,第二行-股骨纵切面扫描图)
图8 各组大鼠股骨微结构典型示意图
Fig.8 Microstructure of femur of rats in each group
如表1所示,碳酸钙对照组、奶粉中和高剂量组大鼠的BMD显著高于低钙对照组(P<0.01),奶粉高剂量组的BMD显著高于碳酸钙对照组(P<0.01)。奶粉中和高剂量组的BV/TV显著高于低钙对照组(P<0.05,P<0.01)且奶粉高剂量组的BV/TV显著高于碳酸钙对照组(P<0.01)。碳酸钙对照组、奶粉中和高剂量组大鼠的BS/BV显著低于低钙对照组(P<0.01),奶粉低和中剂量组的BS/BV显著高于碳酸钙对照组(P<0.01,P<0.05)。奶粉高剂量组的BS/TV显著高于低钙对照组和碳酸钙对照组(P<0.01)。碳酸钙对照组、奶粉中和高剂量组大鼠的Tb.Pf显著低于低钙对照组(P<0.01),奶粉低剂量组的Tb.Pf显著高于碳酸钙对照组(P<0.05)。碳酸钙对照组和奶粉高剂量组的SMI显著低于低钙对照组(P<0.05,P<0.01)且奶粉高剂量组的SMI显著低于碳酸钙对照组(P<0.05)。奶粉高剂量组的Tb.N显著高于低钙对照组和碳酸钙对照组(P<0.01)。各组大鼠的Tb.Th和Tb.Sp之间的差异无统计学意义。
表1 各组大鼠股骨骨微结构参数结果(n=5)
Table 1 Results of the bone microarchitecture of the femur in rats of each group (n=5)
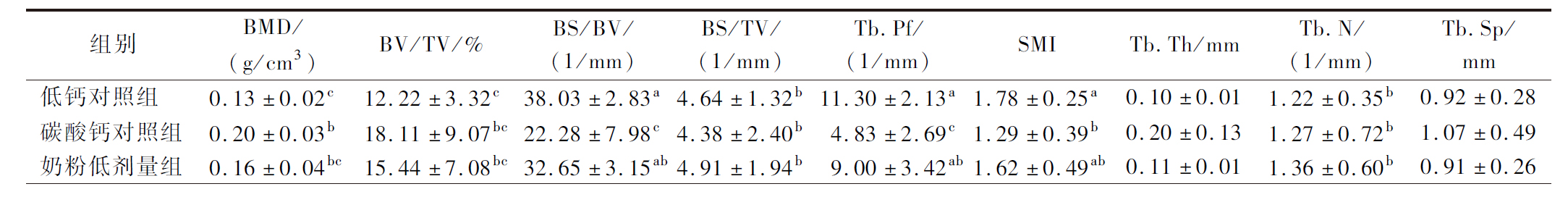
续表1

组别BMD/(g/cm3)BV/TV/%BS/BV/(1/mm)BS/TV/ (1/mm)Tb.Pf/(1/mm)SMITb.Th/mmTb.N/(1/mm)Tb.Sp/mm奶粉中剂量组0.20±0.04b21.52±5.17b28.29±3.60b5.97±1.00ab6.36±1.75bc1.33±0.21ab0.13±0.011.71±0.35ab0.76±0.27奶粉高剂量组0.28±0.03a32.52±4.72a24.45±1.67bc7.90±0.75a3.24±1.51c0.78±0.34c0.14±0.012.37±0.32a0.54±0.13
注:字母不同表示差异有统计学意义(P<0.05)。
本研究参考《保健食品功能检验与评价方法(2023年版)》中有助于改善骨密度检验方法,对受试奶粉促进生长期大鼠骨骼发育的作用进行了评价。本研究采用低钙饲料作为基础饲料构建大鼠低钙模型。
在本研究中,碳酸钙对照组和奶粉各剂量组的股骨干重和股骨长均显著高于低钙对照组,且奶粉中和高剂量组的股骨干重和股骨长显著高于碳酸钙对照组,说明补充碳酸钙和奶粉可有效弥补低钙对大鼠股骨发育的不良影响。骨密度可反映骨骼坚硬程度,是诊断骨质疏松症的主要参数,也是评价干预措施对骨组织骨健康改善程度的主要指标[21]。当机体钙摄入量持续不足时,骨吸收增加,骨钙含量下降,骨钙被释放入血以维持循环钙浓度[3]。本研究结果显示,碳酸钙对照组和奶粉各剂量组的股骨远心端和中点骨密度以及骨钙含量均显著高于低钙对照组,且奶粉高剂量组的骨密度和骨钙含量均显著高于碳酸钙对照组,表明补充受试奶粉有利于低钙摄入的生长期大鼠的骨骼健康,且奶粉剂量越高增加骨密度的效果越明显,且效果优于同等剂量的碳酸钙。
当机体钙摄入不足时,血钙浓度下降,甲状旁腺激素的合成和释放增加,代偿性地提高机体对钙的吸收和利用,包括促进肾小管对钙的重吸收、增加肠道的钙吸收以及释放骨钙入血,导致钙的吸收率高于正常水平[3, 22-23],且研究表明,钙摄入剂量过高反而会降低机体对钙的吸收率和储留率[24]。钙代谢实验结果显示,低钙对照组的粪钙和尿钙排出量均下降而钙吸收率和钙储留率均上升,说明低钙摄入代偿性地增加了大鼠对钙的吸收利用率,这与本课题组此前的研究结果一致[25],且碳酸钙对照组和奶粉高剂量组的钙吸收率和钙储留率显著低于低钙对照组,符合上述研究结果。此外,王灿楠等[26]的结果表明,摄入钙与骨密度和骨钙含量呈正相关,而与钙吸收率和储留率呈负相关。在本研究中,碳酸钙对照组和奶粉各剂量组大鼠的摄入钙均显著高于低钙对照组,而碳酸钙对照组和奶粉高剂量组的钙吸收率和钙储留率显著低于低钙对照组,且奶粉低和中剂量组的钙吸收率和钙储留率显著高于碳酸钙对照组,与前述结果相符。
血清PINP是在I型胶原蛋白合成过程中产生的,其水平与骨形成的组织形态计量学指标显著相关[27],BGP是骨骼中最丰富的非胶原蛋白,在成骨细胞中特异性表达[28],两者均为骨形成标志物,可反映成骨细胞活性及骨转换情况。血清CTX-Ⅰ水平与骨吸收的组织形态计量学指标显著相关,是骨吸收的标志物,反映破骨细胞活性[27, 29]。本研究结果表明,碳酸钙对照组和奶粉各剂量组的CTX-Ⅰ、PINP及BGP水平均显著高于低钙对照组,提示受试奶粉对大鼠的骨形成和骨吸收均有促进作用。PINP/CTX比值被称为骨形成指数[30],该值升高与老年女性骨质疏松椎体骨折发生有关[31]。在本研究中,奶粉高剂量组的PINP/CTX-Ⅰ显著低于其余各组,提示受试奶粉更倾向于促进大鼠的骨形成。
TRAP染色可反映各组破骨细胞的数量。本研究结果表明,碳酸钙对照组、奶粉中和高剂量组的破骨细胞数量均显著低于低钙对照组,且奶粉各剂量组的破骨细胞数量随着剂量增加而减少,说明受试奶粉可抑制大鼠破骨细胞的生成,这与前人对骨碎补的研究结果一致[32]。结合血清生化指标可进一步说明受试奶粉通过促进大鼠骨形成和抑制破骨细胞生成发挥促进大鼠骨健康的作用。
Micro-CT可在不损伤样本的情况下将骨微结构参数准确、快速地定量,已被广泛应用于骨微结构的评价中[33]。BV/TV表示骨体积与ROI总体积的比值,可反映骨量变化,该值增高说明骨量增加。BS/BV和BS/TV分别表示单位体积骨组织的面积大小以及骨表面积与感兴趣区域总体积的比值,均可间接反映骨量。Tb.Pf和SMI分别用于衡量骨小梁的表面凹凸程度和反映骨小梁结构中板层结构和杆状结构的比例,共同反映骨小梁的结构变化,当发生骨质疏松时,骨小梁结构由板状转为杆状,Tb.Pf和SMI均上升。Tb.Th和Tb.N分别表示骨小梁的平均厚度以及单位长度的平均骨小梁数,当骨健康受损时,Tb.Th和Tb.N均下降[34-35]。在本研究中,与低钙对照组相比,奶粉中剂量组的BV/TV显著升高,BS/BV、Tb.Pf显著降低,奶粉高剂量组的BV/TV、BS/TV、Tb.N显著升高,BS/BV、Tb.Pf、SMI显著降低,直观表明受试奶粉有助于低钙摄入生长期大鼠的骨量累积,增加骨小梁数量,有利于骨骼健康。
综上所述,添加了骨碎补的受试奶粉可促进生长期大鼠股骨发育,增加股骨骨密度和骨钙,促进大鼠对钙的吸收和利用,效果优于同等剂量碳酸钙。依据《保健食品功能检验与评价方法(2023年版)》中有助于改善骨密度检验方法中的方案一的结果判定,可认为该受试奶粉具有有助于改善骨密度的作用,且受试物可直观改善低钙导致的骨微结构的破坏,促进生长期大鼠骨健康,其机制可能与促进骨形成有关。
[1] RIZZOLI R.Dairy products and bone health[J].Aging Clinical and Experimental Research, 2022, 34(1):9-24.
[2] MU OZ-GARACH A, GARC
OZ-GARACH A, GARC A-FONTANA B, MU
A-FONTANA B, MU OZ-TORRES M.Nutrients and dietary patterns related to osteoporosis[J].Nutrients, 2020, 12(7):1986.
OZ-TORRES M.Nutrients and dietary patterns related to osteoporosis[J].Nutrients, 2020, 12(7):1986.
[3] CASHMAN K D.Calcium intake, calcium bioavailability and bone health[J].The British Journal of Nutrition, 2002, 87(Suppl 2):S169-S177.
[4] TSUGAWA N, SHIRAKI M.Vitamin K nutrition and bone health[J].Nutrients, 2020, 12(7):1909.
[5] REYES-GARCIA R, MENDOZA N, PALACIOS S, et al.Effects of daily intake of calcium and vitamin D-enriched milk in healthy postmenopausal women:A randomized, controlled, double-blind nutritional study[J].Journal of Women’s Health (2002), 2018, 27(5):561-568.
[6] KRUGER M C, BOOTH C L, COAD J, et al.Effect of calcium fortified milk supplementation with or without vitamin K on biochemical markers of bone turnover in premenopausal women[J].Nutrition, 2006, 22(11-12):1120-1128.
[7] ZOFKOV I, NEMCIKOVA P, MATUCHA P.Trace elements and bone health[J].Clinical Chemistry and Laboratory Medicine, 2013, 51(8):1555-1561.
I, NEMCIKOVA P, MATUCHA P.Trace elements and bone health[J].Clinical Chemistry and Laboratory Medicine, 2013, 51(8):1555-1561.
[8] 秦锐. 中国儿童钙营养专家共识(2019年版)[J].中国妇幼健康研究, 2019, 30(3):262-269.
QIN R.China children’s calcium nutrition expert consensus (2019 edition)[J].Chinese Journal of Woman and Child Health Research, 2019, 30(3):262-269.
[9] 郭林啸, 庞学红, 段一凡, 等.2019—2021年中国2~5岁儿童膳食微量营养素摄入状况[J].卫生研究, 2023, 52(1):60-66.
GUO L X, PANG X H, DUAN Y F, et al.Dietary micronutrient intake of children aged 2-5 years in China in 2019-2021[J].Journal of Hygiene Research, 2023, 52(1):60-66.
[10] 毕小艺, 杨媞媞, 徐培培, 等.2010—2012年中国6~17岁儿童膳食钙摄入情况[J].卫生研究, 2021, 50(3):431-434.
BI X Y, YANG T T, XU P P, et al.Dietary calcium intake of children aged 6 - 17 years in China in 2010-2012[J].Journal of Hygiene Research, 2021, 50(3):431-434.
[11] WANG W, MAO J, CHEN Y, et al.Naringin promotes osteogenesis and ameliorates osteoporosis development by targeting JAK2/STAT3 signalling[J].Clinical and Experimental Pharmacology &Physiology, 2022, 49(1):113-121.
[12] GAN J W, DENG X L, LE Y H, et al.The development of naringin for use against bone and cartilage disorders[J].Molecules, 2023, 28(9):3716.
[13] SONG S H, ZHAI Y K, LI C Q, et al.Effects of total flavonoids from Drynariae rhizoma prevent bone loss in vivo and in vitro[J].Bone Reports, 2016, 5:262-273.
[14] SUN W P, LI M Y, XIE L, et al.Exploring the mechanism of total flavonoids of Drynariae rhizoma to improve large bone defects by network pharmacology and experimental assessment[J].Frontiers in Pharmacology, 2021, 12:603734.
[15] LIN H X, WANG X T, WANG L G, et al.Identified the synergistic mechanism of Drynariae rhizoma for treating fracture based on network pharmacology[J].Evidence-Based Complementary and Alternative Medicine, 2019, 2019:7342635.
[16] SONG N, ZHAO Z H, MA X L, et al.Naringin promotes fracture healing through stimulation of angiogenesis by regulating the VEGF/VEGFR-2 signaling pathway in osteoporotic rats[J].Chemico-Biological Interactions, 2017, 261:11-17.
[17] PENG C H, LIN W Y, LI C Y, et al.Gu Sui Bu (Drynaria fortunei J.Sm.) antagonizes glucocorticoid-induced mineralization reduction in zebrafish larvae by modulating the activity of osteoblasts and osteoclasts[J].Journal of Ethnopharmacology, 2022, 297:115565.
[18] ZHANG F Q, LI Q Y, WU J S, et al.Total flavonoids of Drynariae rhizoma improve glucocorticoid-induced osteoporosis of rats:UHPLC-MS-based qualitative analysis, network pharmacology strategy and pharmacodynamic validation[J].Frontiers in Endocrinology, 2022, 13:920931.
[19] LI F B, SUN X L, MA J X, et al.Naringin prevents ovariectomy-induced osteoporosis and promotes osteoclasts apoptosis through the mitochondria-mediated apoptosis pathway[J].Biochemical and Biophysical Research Communications, 2014, 452(3):629-635.
[20] MU P Y, HU Y M, MA X, et al.Total flavonoids of Rhizoma Drynariae combined with calcium attenuate osteoporosis by reducing reactive oxygen species generation[J].Experimental and Therapeutic Medicine, 2021, 21(6):618.
[21] FONSECA H, MOREIRA-GONÇALVES D, CORIOLANO H J A, et al.Bone quality:The determinants of bone strength and fragility[J].Sports Medicine, 2014, 44(1):37-53.
[22] REID I R, BRISTOW S M.Calcium and Bone[M] //Handbook of Experimental Pharmacology.Cham:Springer,2020, 262:259-280.
[23] 陈浩凡, 林秋雄, 李宗文, 等.钙联合淫羊藿及女贞子对低骨密度大鼠的改善作用研究[J].中国药师, 2020, 23(12):2403-2408.
CHEN H F, LIN Q X, LI Z W, et al.Ameliorative effect of calcium combined with Epimedium and Fructus Ligustri ligustri in rats with low bone density[J].China Pharmacist, 2020, 23(12):2403-2408.
[24] 阎春生, 刘辉, 王志凡, 等.不同钙负荷剂量对大鼠生长及钙铁锌水平影响[J].中国公共卫生, 2005, 21(10):1176-1178.
YAN C S, LIU H, WANG Z F, et al.Effect of different calcium load on growth and lever of Ca, Fe, Zn in rats[J].Chinese Journal of Public Health, 2005, 21(10):1176-1178.
[25] 周运争, 袁亚, 李娜, 等.低聚半乳糖与聚葡萄糖联用对生长期大鼠钙代谢和骨量的影响[J].现代预防医学, 2022, 49(10):1887-1891.
ZHOU Y Z, YUAN Y, LI N, et al.Effects of combination of galacto-oligosaccharides and polydextroses on calcium metabolism and bone mass in growing rats[J].Modern Preventive Medicine, 2022, 49(10):1887-1891.
[26] 王灿楠, 刘德成, 庄明, 等.钙吸收利用与钙摄入量关系的动物实验研究[J].卫生研究, 2002, 31(6):439-441.
WANG C N, LIU D C, ZHUANG M, et al.Effect of different doses of calcium in rats’diet on absorption and utilization of calcium[J].Journal of Hygiene Research, 2002, 31(6):439-441.
[27] SZULC P, NAYLOR K, HOYLE N R, et al.Use of CTX-I and PINP as bone turnover markers:National Bone Health Alliance recommendations to standardize sample handling and patient preparation to reduce pre-analytical variability[J].Osteoporosis International, 2017, 28(9):2541-2556.
[28] KOMORI T.Functions of osteocalcin in bone, pancreas, testis, and muscle[J].International Journal of Molecular Sciences, 2020, 21(20):7513.
[29] EASTELL R, SZULC P.Use of bone turnover markers in postmenopausal osteoporosis[J].The Lancet, Diabetes &Endocrinology, 2017, 5(11):908-923.
[30] POTASSO L, REFARDT J, MEIER C, et al.Effect of hyponatremia normalization on osteoblast function in patients with SIAD[J].European Journal of Endocrinology, 2021, 186(1):1-8.
[31] 徐文, 邹明, 岳建彪.血清高t-PINP/β-CTX比值和正常低TSH水平与老年女性骨质疏松性椎体骨折相关性研究[J].中国骨质疏松杂志, 2022, 28(2):162-167.
XU W, ZOU M, YUE J B.Research on the correlation between serum high t-PINP/β-CTX ratio, normal low TSH level and osteoporotic vertebral fracture in elderly women[J].Chinese Journal of Osteoporosis, 2022, 28(2):162-167.
[32] JIANG N N, JIN H, YANG K, et al.The mechanism of metformin combined with total flavonoids of Rhizoma Drynariae on ovariectomy-induced osteoporotic rats[J].Biomedicine &Pharmacotherapy, 2023, 165:115181.
[33] 何琪, 杨均政, 张罡瑜, 等.通过Micro-CT评价瘦素受体缺乏的2型糖尿病小鼠四肢骨的骨代谢变化[J].中国骨质疏松杂志, 2021, 27(4):492-497.
HE Q, YANG J Z, ZHANG G Y, et al.The changes of bone metabolism in the extremities of type 2 diabetic mice with leptin receptor deficiency were evaluated by micro-CT[J].Chinese Journal of Osteoporosis, 2021, 27(4):492-497.
[34] 魏占英, 章振林.Micro-CT在骨代谢研究中骨微结构指标的解读及应用价值[J].中华骨质疏松和骨矿盐疾病杂志, 2018, 11(2):200-205.
WEI Z Y, ZHANG Z L.Interpretation and application of micro-CT to obtain microstructure index in bone metabolism research[J].Chinese Journal of Osteoporosis and Bone Mineral Research, 2018, 11(2):200-205.
[35] BOUXSEIN M L, BOYD S K, CHRISTIANSEN B A, et al.Guidelines for assessment of bone microstructure in rodents using micro-computed tomography[J].Journal of Bone and Mineral Research, 2010, 25(7):1468-1486.