乳酸菌是一种重要的工业微生物,广泛应用于发酵食品、生物治疗和农业领域[1]。高密度培养乳酸菌对于提高菌体生物量以进一步降低生产成本具有重要意义[2]。在培养过程中,乳酸菌可通过糖代谢途径产生大量乳酸[3]。值得注意的是,乳酸的过量产生会降低培养基的pH值,抑制菌体的生长[4]。未解离形式的乳酸是主要的抑制物质[5],主要是由于其具有脂溶性,可自由穿透细胞膜进入细胞内部,然后解离成乳酸根离子和H+,导致细胞内酸化和毒性效应[6],此外,乳酸还可作为解偶联剂将H+运输到细胞内部,导致质子能量耗散,从而影响多种生物能的运行[7]。因此,解除乳酸抑制作用是乳酸菌高密度培养的关键。
加碱中和是解除乳酸胁迫的常用方法[8]。然而,加碱过量后,容易产生金属离子(如Na+)和阴离子的积累,导致盐胁迫[9]。盐胁迫会使细胞内水分流失,导致细胞的结构和生理损伤,使得乳酸菌生长停止或死亡[10]。在乳酸菌培养过程中原位分离乳酸是解除乳酸抑制作用的一种可行的方法[11]。膜分离和树脂吸附是原位分离乳酸的有效手段,但在菌体培养中的应用还存在一些局限性[12-13]。膜孔阻塞造成的非连续生产和树脂洗脱产生的大量废水,以及树脂吸附造成的葡萄糖和氨基酸等营养物质的额外损失是限制其应用的主要因素[12-13]。
萃取也被用于原位分离乳酸,但传统的溶剂萃取效率低,而且大多数萃取剂和稀释剂对乳酸菌有毒[14]。支撑液膜萃取是指一种将浸渍有溶剂的多孔载体置于进料相和接收相之间,使被萃取物通过液膜相向接收相传质的技术[15]。近年来,人们对从发酵液或其他水溶液中萃取有机酸的支撑液膜进行了广泛的研究[16]。与传统的液-液萃取法相比,它具有更高的传质速率、更高的特异性和更少的溶剂需求[17]。MATSUMOTO等[18]使用离子液体(ionic liquids, ILs)CYPHOS IL-102和聚偏二氟乙烯(polyvinylidene difluoride, PVDF)膜制备了一种支撑液膜,进料相为0.01 mol/L乳酸,24 h后乳酸萃取率达到56.14%。然而,大多数离子液体有毒、昂贵且降解性差[19]。也有研究利用优化的支撑液膜膜组件,在乳酸菌发酵过程中对乳酸进行原位分离。PÉREZ等[20]使用泰勒流液膜在乳酸杆菌Lactobacillus casei ATCC 393的发酵过程中原位去除乳酸,与传统的间歇发酵相比,乳酸和生物质产量分别增加了41.8%和12%。然而,选择三异辛胺作为萃取剂不仅不环保,还对乳酸杆菌的生长有毒性作用。此外,与之相关的分子毒性问题仍有待解决,而且其在食品中的应用更为严格。
天然低共熔溶剂(natural deep eutectic solvents, NADES)是2种或2种以上天然化合物的混合物[16],被视为传统有机溶剂和惰性溶剂的替代品[1]。此外,NADES还具有制备方法简单、成本低廉、易于贮存等优点[16],有潜力成为乳酸菌培养过程中原位分离乳酸的理想萃取剂。尽管之前的研究提出了利用液膜萃取促进乳酸菌增殖的可能性,但关于应用液膜萃取技术提高乳酸菌密度的研究却很少,尤其是利用由食品级天然化合物成分组成的绿色萃取剂。因此,本研究讨论了使用支撑液膜原位分离乳酸实现乳酸菌高密度培养的潜力。PVDF疏水性微孔滤膜被用作制备支撑液膜的固体支撑材料。根据高效、低毒和高稳定性的原则,从已报道的文献中选择2种低共熔溶剂(油酸/薄荷醇[21]和己酸/薄荷醇[22])、生物基溶剂香叶醇[23]、离子液体三辛基甲基氯化铵(trioctylmethylammonium chloride, TOMAC)[24]和1-十二烷基-3-甲基咪唑鎓双(三氟甲基磺酰基)亚胺(1-dodecyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imide,[docmim][Tf2N])[25]用作萃取剂。虽然有关油酸/薄荷醇(2/1)对于乳酸萃取的研究较少,但是薄荷醇可以通过氢键作用与乳酸结合[26],油酸也可根据“相似相溶”的原理[27]进行乳酸的萃取分离。并且,油酸作为细菌细胞膜的重要组成成分,对菌体的生长及耐酸性都具有重要意义[28]。
1 材料与方法
1.1 材料与试剂
PVDF疏水性微孔滤膜(0.22 μm),海宁市德滤新材料科技有限公司;油酸(96%)、乳酸(90%),上海阿拉丁试剂(上海)有限公司;己酸(99%)、薄荷醇(98%)、[docmim][Tf2N](95%)、香叶醇(98%)、TOMAC(97%),上海麦克林生化科技股份有限公司;MRS肉汤、MRS固体培养基,青岛海博生物技术有限公司;甘油,国药集团化学试剂有限公司。所有试剂均按原样使用,无需进一步纯化。
1.2 仪器与设备
Nicolet iS10傅立叶变换红外光谱仪,赛默飞世尔科技公司;LRH-250生化培养箱,上海一恒仪器有限公司;Multiskan FC酶标仪,美国赛默飞世尔科技公司;1260高效液相色谱仪,美国安捷伦公司;扩散池,上海文甚实验器材有限公司。
1.3 实验方法
1.3.1 菌株的活化和培养
保加利亚乳杆菌sp1.1(Lactobacillus bulgaricus sp1.1)(CGMCC:16586)在使用前保存在含有25%(体积分数)甘油的MRS肉汤培养基中,温度为-80 ℃。L.bulgaricus sp1.1以2%(体积分数)接种至MRS肉汤培养基中,在37 ℃培养24 h,使用前再连续培养2次。
1.3.2 天然低共熔溶剂的制备
NADES是根据MATSUMOTO等[22]的加热混合法制备的。混合物中使用薄荷醇作为氢键供体(HBA),使用己酸和油酸作为氢键受体(HBD)。以HBA和HBD的摩尔比(1∶2)制备NADES混合物,混合物在80 ℃下搅拌,直至形成透明均匀的混合物。使用前在室温下放置过夜,以确认未发生重结晶[22]。
1.3.3 萃取载体的毒性测试
使用肉汤稀释法[29]测定萃取载体对L.bulgaricus sp1.1的毒性作用。制备一系列试管,其中包含10 mL添加或不添加萃取载体成分(0~8 g/L)的无菌MRS肉汤培养基。每支试管接种200 μL L.bulgaricus sp1.1,在37 ℃下培养24 h。将发酵液以200 μL加样量装入96孔微孔板中,用Multiskan FC酶标仪在600 nm处测量吸光度,测定菌体的生长情况。
1.3.4 傅立叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)分析
对乳酸、NADES及其组成纯组分和萃取后的NADES进行了分析。FTIR用于研究前体分子之间的相互作用,以及验证乳酸可被NADES萃取至萃取相中。将NADES和100 g/L乳酸水溶液按照等体积混合,得到的混合物置于10 mL玻璃瓶中,在磁力搅拌器上以200 r/min搅拌2 h,然后在7 000 r/min转速下离心10 min。分层后,吸出上层NADES溶液作为萃取后的NADES。
1.3.5 支撑液膜的制备
支撑液膜采用直接浸渍法制备[30]。PVDF固体支撑膜在60 ℃真空条件下干燥3 h,以去除挥发性化合物残留,如附着的残留水分[31]。然后将膜放在超净工作台中,紫外线灭菌处理60 min。随后,将膜浸入装有萃取溶剂的平板培养皿中达24 h。萃取溶剂是由葵花籽油与萃取剂(NADES或ILs)按7∶3的体积比混合而成。此外,葵花籽油和萃取剂在使用前均在121 ℃下,灭菌处理15 min。在使用前轻轻擦拭支撑液膜表面的附着液体[22]。
1.3.6 支撑液膜的表面水接触角测试
在室温下,使用接触角分析仪(昆山盛鼎SDC 350KS)观察膜上的2 μL水滴与膜体的接触角,测定膜样品的疏水性[32]。
1.3.7 萃取实验装置
萃取过程所需的设备如图1所示。主要由一个支撑液膜(负载萃取相)和2个扩散池构成。由耐高温的高硼硅玻璃制成的2个扩散池分别用于负载进料相和接收相,体积均为120 mL,渗透传质面积为(7.26±0.01) cm2。
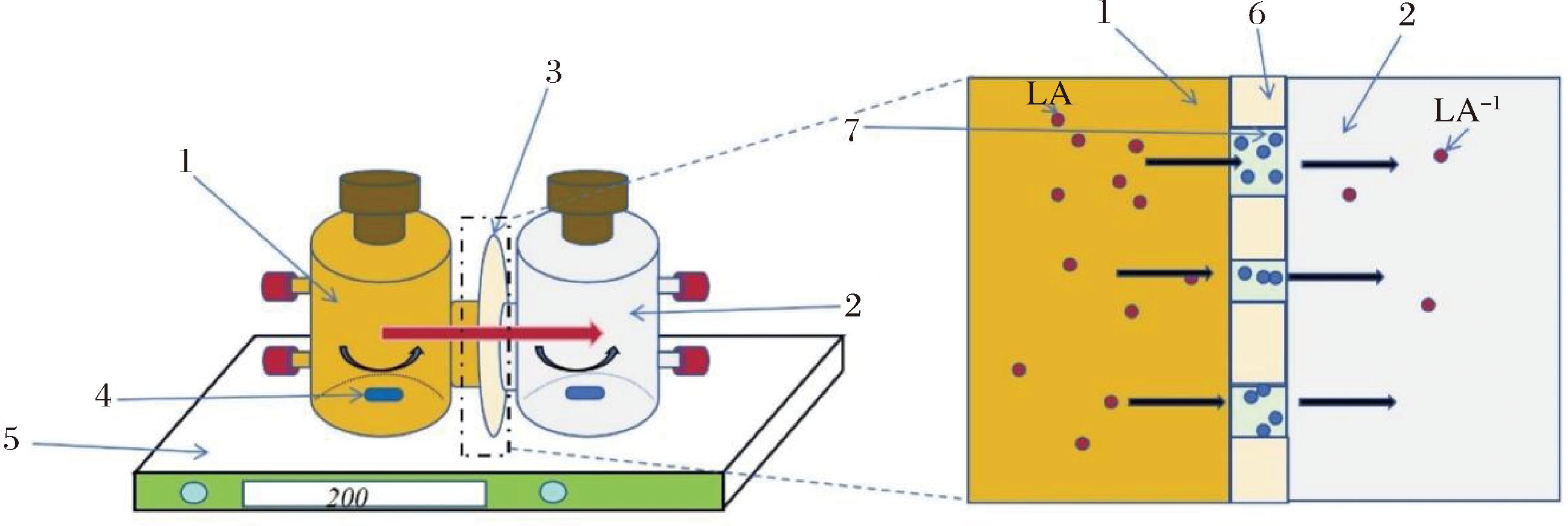
1-进料相;2-接收相;3-支撑液膜;4-磁力转子;5-磁力搅拌器;6-支撑载体;7-萃取溶剂;LA-乳酸;LA--乳酸根离子
图1 萃取设备示意图
Fig.1 Schematic drawing of extraction equipment
1.3.8 萃取效率
萃取过程使用的实验设备如图1所示。进料相为含有10 g/L乳酸的MRS肉汤培养基水溶液,接收相为NaOH溶液(0.1 mol/L),两相溶液的体积均设置为110 mL。定期从接收相中提取样品,并通过高效液相色谱分析乳酸的浓度[22-33]。
乳酸萃取效率(P)[18]的计算如公式(1)所示:
(1)
式中:Ct为接收相中乳酸的浓度,C0为最初进料相中乳酸的浓度。
1.3.9 稳定性
称量并记录干燥薄膜、制备完成的支撑液膜和萃取结束时支撑液膜的质量。根据萃取结束时残留在膜体中的溶剂质量确定支撑液膜的稳定性[34],其计算如公式(2)所示:
稳定性![]()
(2)
式中:m1和m2分别为萃取过程前后支撑液膜的质量。
1.3.10 L.bulgaricus sp1.1的支撑液膜萃取培养
使用图1所示的设备进行萃取培养。使用前,将设备在121 ℃下,高温高压灭菌处理15 min。无菌支撑液膜固定在设备的2个扩散池之间。进料相为MRS肉汤发酵液,接收相为NaOH溶液,均为110 mL。NaOH溶液的初始浓度为0.1 mol/L,随后在0.05~0.3 mol/L进行了优化,使用前在121 ℃下,灭菌15 min。在无菌MRS肉汤培养基中接种2%(体积分数)的L.bulgaricus sp1.1后,在37 ℃下培养至一定生长阶段,初始阶段采取对数生长后期(10 h),然后转入萃取设备,于200 r/min的转速下继续萃取培养。根据L.bulgaricus sp 1.1的生长曲线,在不同的时间点开始萃取培养,以优化萃取起始时间。分别为对数生长初期(4 h)、对数生长中期(6、8 h)、对数生长后期(10 h)和稳定初期(12 h)。除无需萃取培养外,空白对照组的条件与萃取培养组相同。总培养时间控制在18 h。
1.3.11 支撑液膜的扫描电子显微镜(scanning electron microscope, SEM)分析
使用Hitachi Regulus 8 100(3 kV)SEM测定支撑液膜的形态[15]。
1.3.12 不同pH值下L.bulgaricus sp1.1的增殖
用乳酸调节MRS肉汤培养基的pH值为5.6、4.7、4.6、4.5、4.4、4.3和4.2。以2%(体积分数)接种L.bulgaricus sp1.1于酸化MRS肉汤培养基中。在37 ℃下培养24 h后,用酶标仪在600 nm下测量发酵液的吸光度。
1.3.13 L.bulgaricus sp1.1活菌数和pH的测定
根据CHEN等[35]的方法,用平板计数法测定L.bulgaricus sp1.1的活菌数。菌悬液用无菌的9 g/L NaCl进行梯度稀释。结果用CFU/mL来表示。pH值使用pH计在室温下测量。
1.4 数据分析
所有实验均独立重复至少2次。数据统计分析采用Microsoft Excel(美国微软公司)和SPSS(美国IBM公司)进行。所有图表均使用Origin Pro 2022(Origin Lab,美国)和Adobe Illustrator 2022绘制。采用邓肯检验法进行单因素方差分析(ANOVA),以检测平均值之间的显著性差异,显著性水平为0.05。
2 结果与分析
2.1 选择萃取载体
2.1.1 萃取载体的毒性测试
本文测定了萃取载体对L.bulgaricus sp1.1生长的抑制作用。如图2所示,结果表明NADES(油酸/薄荷醇和己酸/薄荷醇)的毒性均低于离子液体(TOMAC、[docmim][Tf2N])。此外,NADES成分来源于天然食品,对人体无毒害作用,可应用于食品[36]。一般情况下,油酸比己酸更疏水,因此直接接触乳酸菌的能力较弱[36],此外,低浓度的油酸还可通过保持细胞膜的流动性来赋予菌体更强的耐酸性[28]。然而,本研究发现油酸/薄荷醇(2/1)与己酸/薄荷醇(2/1)相比具有更强的菌体抑制作用。这可能是因为,过高浓度的油酸会导致细胞膜流动性过度增加[28],从而使细胞膜不稳定,细胞最终裂解[37]。并且,作为一种不饱和脂肪酸,油酸对细菌生存和生长所必需的酶活力的抑制作用可能比己酸更强[37]。

图2 载体的最小抑制浓度
Fig.2 Minimum inhibitory concentration of carriers
尽管如此,无论是油酸/薄荷醇(2/1)还是己酸/薄荷醇(2/1),它们作为萃取载体在支撑液膜中的低用量对L.bulgaricus sp1.1的抑制作用都很小,并且可应用于食品,符合发酵剂生产的要求。
2.1.2 萃取载体的性质及其与乳酸的相互作用分析
FTIR用于分析NADES中的氢键相互作用。如图3所示,形成油酸/薄荷醇(2/1)后,薄荷醇中的羟基(—OH)从3 307.08 cm-1移动到3 669.93 cm-1,而己酸/薄荷醇(2/1)中没有可见的—OH。此外,油酸和己酸中的羰基(—C![]() O)分别从1 710.11 cm-1和1 710.95 cm-1移动到1 711.63 cm-1和1 713.87 cm-1。这证实了薄荷醇的羟基与油酸和己酸的羧基之间氢键的形成。
O)分别从1 710.11 cm-1和1 710.95 cm-1移动到1 711.63 cm-1和1 713.87 cm-1。这证实了薄荷醇的羟基与油酸和己酸的羧基之间氢键的形成。

a-己酸、薄荷醇和己酸/薄荷醇(2/1);b-己酸/薄荷醇、乳酸和己酸/薄荷醇(2/1)+乳酸;c-油酸、薄荷醇、油酸/薄荷醇(2/1);d-油酸/薄荷醇、乳酸和油酸/薄荷醇(2/1)+乳酸
图3 不同萃取载体的傅里叶红外光谱图
Fig.3 Fourier infrared spectra of different extraction carriers
根据MALIK等[38]的研究,它主要在HODLM(薄荷醇中的羟基氧原子)和HOC18、HOC6(油酸和己酸中的羟基氢原子)之间以及OHDLM(薄荷醇中的羟基氢原子)和OC18、OC6(油酸和己酸中的羰基氧原子)之间形成强氢键(图4)。此外,油酸/薄荷醇(2/1)具有更高的化学稳定性,这是因为短链脂肪酸基NADES在与水混合时与水分子的非共价相互作用增强,从而导致NADES结构的破坏[39]。疏水性羧酸可与水溶液中的挥发性脂肪酸形成具有C![]() O…H—O单氢键的开链二聚体,从而可用于挥发性脂肪酸的回收[27]。所以,薄荷醇可能主要是通过与油酸或己酸的氢键作用来稳定NADES,而油酸或己酸更常用于萃取乳酸。为了证实NADES可以萃取乳酸,本文对NADES、乳酸和萃取后的NADES进行了FTIR分析。如图3所示,乳酸在3 410.71 cm-1和1 726.90 cm-1处分别产生了与—OH和—C
O…H—O单氢键的开链二聚体,从而可用于挥发性脂肪酸的回收[27]。所以,薄荷醇可能主要是通过与油酸或己酸的氢键作用来稳定NADES,而油酸或己酸更常用于萃取乳酸。为了证实NADES可以萃取乳酸,本文对NADES、乳酸和萃取后的NADES进行了FTIR分析。如图3所示,乳酸在3 410.71 cm-1和1 726.90 cm-1处分别产生了与—OH和—C![]() O相对应的条带。萃取乳酸后,油酸/薄荷醇(2/1)产生的与—OH和—C
O相对应的条带。萃取乳酸后,油酸/薄荷醇(2/1)产生的与—OH和—C![]() O对应的条带分别移至3 458.22 cm-1和1 730.22 cm-1,同样,己酸/薄荷醇(2/1)萃取乳酸后,—OH和—C
O对应的条带分别移至3 458.22 cm-1和1 730.22 cm-1,同样,己酸/薄荷醇(2/1)萃取乳酸后,—OH和—C![]() O分别移动到1 734.36 cm-1和3 467.96 cm-1。这证实了油酸/薄荷醇(2/1)和己酸/薄荷醇(2/1)可以萃取乳酸,并且它们可以通过—OH和—C
O分别移动到1 734.36 cm-1和3 467.96 cm-1。这证实了油酸/薄荷醇(2/1)和己酸/薄荷醇(2/1)可以萃取乳酸,并且它们可以通过—OH和—C![]() O形成氢键相互作用,并推测乳酸分子与萃取载体之间的分子对接位点如图4-c和图4-d所示。此外,根据“相似相溶”的规律[27],己酸的萃取效率可能高于油酸。
O形成氢键相互作用,并推测乳酸分子与萃取载体之间的分子对接位点如图4-c和图4-d所示。此外,根据“相似相溶”的规律[27],己酸的萃取效率可能高于油酸。
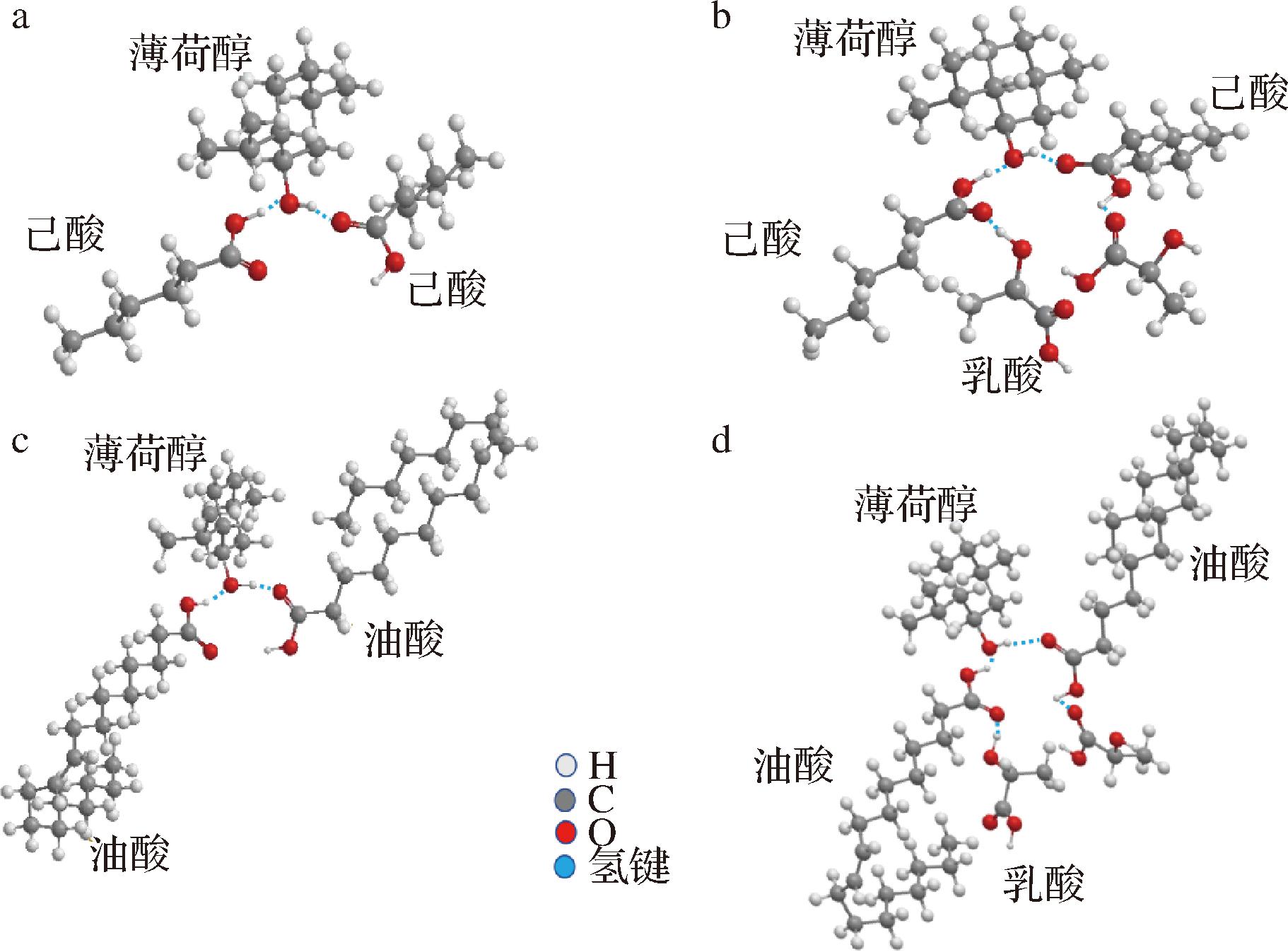
a-己酸/薄荷醇(2/1);b-油酸/薄荷醇(2/1);c-己酸/薄荷醇(2/1)+乳酸;d-油酸/薄荷醇(2/1)+乳酸
图4 不同萃取在的分子结构及其与乳酸分子之间的相互作用分析
Fig.4 Analysis of the molecular structure of different extracts and their interactions with lactic acid molecules
2.1.3 支撑液膜在乳酸原位分离中的应用
本文测定了乳酸萃取系统的萃取效率和稳定性。如图5-a所示,在整个萃取过程中,2种萃取体系的萃取效率没有明显差异。在初始质量浓度为10 g/L的条件下,萃取10 h后,基于己酸/薄荷醇(2/1)的乳酸萃取体系的萃取效率达到了0.108,基于油酸/薄荷醇(2/1)的萃取效率达到了0.097 8。然而,在萃取结束时,基于油酸/薄荷醇(2/1)的萃取体系的溶剂损失率为6.06%,低于基于己酸/薄荷醇(2/1)的萃取体系的7.63%(图5-b),这可能是由于油酸/薄荷醇(2/1)的组分链长较长,疏水性较高[40]。液膜相在水溶液中的溶解度是导致液膜损失的主要机制[32],因此高疏水性液膜相能更有效地保持支撑液膜的稳定性。然而,随着疏水性的增加,乳酸的高亲水性会降低其与乳酸的亲和力[41]。在本研究中,油酸/薄荷醇(2/1)和己酸/薄荷醇(2/1)萃取乳酸的效率没有明显差异,这可能是由于己酸/薄荷醇(2/1)在水溶液中的稳定性较低,影响了萃取的正常进行。

a-支撑液膜的萃取效率;b-支撑液膜的稳定性;c-水接触角[a:PVDF基膜;b:己酸/薄荷醇(2/1)支撑液膜;c:油酸/薄荷醇(2/1)支撑液膜];d-不同类型支撑液膜对L.bulgaricus sp1.1生长的影响
图5 支撑液膜的应用
Fig.5 Application of supported liquid membrane
注:不同小写字母表示差异差著(P<0.05)(下同)
为了进一步比较两者的疏水性,测定了膜的表面润湿性,结果如图5-c所示。PVDF基膜具有疏水性,在空气中的水接触角(water contact angle, WCA)为109.474°。支撑液膜的水接触角低于PVDF基膜的水接触角,这表明支撑液膜的形成降低了PVDF基膜的疏水性。此外,油酸/薄荷醇(2/1)支撑液膜的WCA为73.962°,大于己酸/薄荷醇(2/1)支撑液膜的62.312°。这表明油酸/薄荷醇(2/1)的疏水性更强,与油酸比己酸更疏水的结论一致[42]。这也证实了,疏水性较强是油酸/薄荷醇(2/1)支撑液膜在萃取过程中稳定性较高的原因[42]。
为了进一步确定萃取载体的选择,并验证基于NADES的支撑液膜的应用可行性,制备了含有不同类型NADES的支撑液膜萃取系统,并用于L.bulgaricus sp1.1的培养。如图5-d所示,培养18 h后,经萃取培养的L.bulgaricus sp1.1的菌密度高于空白对照组。并且,基于油酸/薄荷醇(2/1)支撑液膜培养所得菌液的ΔOD600nm值为1.316,明显高于基于己酸/薄荷醇(2/1)的1.230和空白对照组的1.189。在培养过程中,油酸/薄荷醇(2/1)支撑液膜比己酸/薄荷醇(2/1)具有更好的稳定性,因此膜溶剂渗漏较少,减少了对L.bulgaricus sp1.1的抑制,并且更好地维持了萃取系统的正常运行。因此,油酸/薄荷醇(2/1)被选为萃取载体。
油酸/薄荷醇(2/1)支撑液膜的扫描电镜显示膜溶剂分布均匀,PVDF的所有支撑孔都被NADES饱和,这反映了膜体的成功制备(图6)。

a、b-PVDF基膜;c、d-含有油酸/薄荷醇(2/1)的支撑液膜
图6 膜的扫描电镜图
Fig.6 SEM of the membranes
2.2 萃取因子的优化
根据NADES体积浓度、接收溶液浓度、搅拌速率和萃取起始时间对膜分离过程进行了优化。
当NADES体积分数为30%时,支撑液膜萃取培养系统对L.bulgaricus sp1.1的生长促进效果最好(图7-a)。随着NaOH浓度从0.1 mol/L增至0.25 mol/L,促增殖效果越来越明显,0.25 mol/L时的效果最佳(图7-b)。这可能是因为当NaOH浓度增加时,加速了络合物的解离,提高了乳酸从进料相进入接收相的驱动力,从而提高了萃取效率[17]。但是,当NaOH浓度过高时,进料相和接收相之间的渗透压差较大,这增加了膜液在水中的溶解度,加剧了膜的不稳定性。在200 r/min下,对L.bulgaricus sp1.1生长的促进效果最好(图7-c)。如图7-d所示,当萃取开始较晚(≥10 h)时,支撑液膜不再抑制L.bulgaricus sp1.1的生长,甚至促进其增殖,这可能是由于菌体在早期培养阶段生长不稳定,而在生长中期或后期对载体毒性的抗性较强。将L.bulgaricus sp1.1预培养8 h后再进行萃取培养时,菌密度达到最高(图7-e)。过早萃取会导致支撑液膜对菌体的抑制作用较强,而过晚萃取时,乳酸对菌体的抑制作用过强,支撑液膜无法及时解除乳酸的抑制作用。

a-不同体积分数的载体;b-不同浓度的NaOH;c-不同的搅拌速率;d-不同萃取起始时间支撑液膜膜体对L.bulgaricus sp1.1生长的影响;e-不同萃取起始时间
图7 萃取因子的优化
Fig.7 Optimization of extraction factors
2.3 支持液膜萃取系统对L.bulgaricus sp1.1活菌数和pH值的影响
为了进一步分析支撑液膜萃取系统在最佳萃取条件下的实际应用,按照优化条件在正常条件下培养8 h后对L.bulgaricus sp1.1进行了萃取培养。图8-a显示了支撑液膜萃取培养的结果。由于乳酸的抑制作用,对照组的活菌数在对数生长中期(8 h)后继续培养的2~6 h内增加,在6 h达到最大值,然后开始下降。相反,萃取培养组的活菌数在继续萃取培养的10 h内持续增加。在18 h时,L.bulgaricus sp1.1的活菌数达到了1.46×109 CFU/mL,为未萃取时的4.62倍,为未经萃取培养所得最高活菌数的1.8倍。然而,随着萃取时间的延长,液膜相的损失量增加,接收相出现轻微浑浊,因此没有继续测定活菌数。

a-原位萃取乳酸10 h对L.bulgaricus sp1.1培养过程中活菌数的影响;b-原位萃取乳酸10 h对L.bulgaricus sp1.1培养过程中pH值的影响;c-不同pH值下L.bulgaricus sp1.1的增殖情况
图8 原位萃取乳酸对L.bulgaricus sp1.1的影响
Fig.8 Effect of in situ extraction of lactic acid on L.bulgaricus sp1.1
培养18 h时,未进行萃取的肉汤培养基pH值最低达到4.01,但萃取系统能够将肉汤培养基的pH值控制在4.32以上(图8-b)。在整个培养过程中,进行萃取培养的L.bulgaricus sp1.1的pH值始终高于对照组,此外,pH值的下降速度较慢,最终趋于稳定。这可能是由于随着乳酸菌的增殖,肉汤培养基的pH值降低,导致乳酸的萃取效率增加[40,43],逐渐接近于乳酸的生产效率。如图8-c所示,当肉汤培养基pH值为4.2时,L.bulgaricus sp1.1的生长受到完全抑制,而支撑液膜可使肉汤培养基pH值保持在4.32以上,有效地解除了pH值对其生长的完全抑制,这也是L.bulgaricus sp1.1在整个萃取培养过程中能够持续增殖的原因。在萃取培养过程中,L.bulgaricus sp1.1的最大比生长率为0.64 h-1,明显高于对照组的0.49 h-1,萃取培养具有更高的菌体增殖率。但在培养后期,经萃取培养的菌体增殖率逐渐降低,在16 h 时接近于0。其原因可能是,一方面,随着萃取时间的延长,支撑液膜的不稳定性增加,在一定程度上影响了乳酸萃取率,膜液的流失也增强了对菌体的抑制作用;另一方面,培养过程中营养物质的消耗也限制了菌体的有效增殖。今后,可以通过液膜凝胶化[44]或制备Janus膜等措施来提高稳定性[45]。此外,还可通过使用中空纤维膜组件增加接触面积来提高萃取效率,通过补充阻隔层来隔离萃取载体与乳酸菌,或设计对乳酸菌无毒的萃取剂来消除支撑液膜对菌体的毒性。
总之,与对照组相比,萃取法培养的L.bulgaricus sp1.1由于萃取了乳酸,缓解了乳酸对菌体的抑制作用,有效地促进了菌体的增殖。因此,本研究表明支撑液膜萃取系统能有效缓解乳酸抑制效应,促进L.bulgaricus sp1.1的增殖。
3 结论
通过将绿色萃取载体与葵花籽油混合并浸渍聚偏二氟乙烯基膜,成功制备了由天然组分作为载体的支撑液膜。使用油酸/薄荷醇(2/1)支撑液膜萃取系统成功实现了L.bulgaricus sp1.1的高密度培养,可将pH值保持在4.32以上,培养终期(18 h)的活菌数为正常培养的4.62倍。然而,支撑液膜整体萃取效率和萃取稳定性需进一步提高。总之,本研究开发了一种使用绿色无毒原位萃取乳酸系统促进乳酸菌增殖的新方法,为乳酸菌的高密度培养提供了一种新的方法。
[1] ![]() K,
K, ![]() M, et al.Antimicrobial, cytotoxic and antioxidative evaluation of natural deep eutectic solvents[J].Environmental Science and Pollution Research, 2018, 25(14):14188-14196.
M, et al.Antimicrobial, cytotoxic and antioxidative evaluation of natural deep eutectic solvents[J].Environmental Science and Pollution Research, 2018, 25(14):14188-14196.
[2] SUBRAMANIAM R.High-density cultivation in the production of microbial products[J].Chemical and Biochemical Engineering Quarterly, 2019, 32(4):451-464.
[3] ABDEL-RAHMAN M A, TASHIRO Y, SONOMOTO K, et al.Recent advances in lactic acid production by microbial fermentation processes[J].Biotechnology Advances, 2013,31(6):877-902.
[4] BRANSON S R, BROADBENT J R, CARPENTER C E.Internal pH and acid anion accumulation in Listeria monocytogenes and Escherichia coli exposed to lactic or acetic acids at mildly acidic pH[J].Frontiers in Microbiology, 2022, 12:803271.
[5] BALANNEC B, BOUGUETTOUCHA A, AMRANE A.Unstructured model for batch cultures without pH control of Lactobacillus helveticus-inhibitory effect of the undissociated lactic acid[J].Biochemical Engineering Journal, 2007, 35(3):289-294.
[6] ROSENGREN Å, LINDBLAD M, LINDQVIST R.The effect of undissociated lactic acid on Staphylococcus aureus growth and enterotoxin A production[J].International Journal of Food Microbiology, 2013, 162(2):159-166.
[7] AXE D D, BAILEY J E.Transport of lactate and acetate through the energized cytoplasmic membrane of Escherichia coli[J].Biotechnology and Bioengineering, 1995, 47(1):8-19.
[8] PATEL M, BASSI A S, ZHU J J X, et al.Investigation of a dual-particle liquid-solid circulating fluidized bed bioreactor for extractive fermentation of lactic acid[J].Biotechnology Progress, 2008, 24(4):821-831.
[9] CUI S M, ZHAO J X, ZHANG H, et al.High-density culture of Lactobacillus plantarum coupled with a lactic acid removal system with anion-exchange resins[J].Biochemical Engineering Journal, 2016, 115:80-84.
[10] ZHAO S S, ZHANG Q X, HAO G F, et al.The protective role of glycine betaine in Lactobacillus plantarum ST-III against salt stress[J].Food Control, 2014, 44:208-213.
[11] SINGHVI M, ZENDO T, SONOMOTO K.Free lactic acid production under acidic conditions by lactic acid bacteria strains:Challenges and future prospects[J].Applied Microbiology and Biotechnology, 2018, 102(14):5911-5924.
[12] ALEXANDRI M, SCHNEIDER R, VENUS J.Membrane technologies for lactic acid separation from fermentation broths derived from renewable resources[J].Membranes, 2018, 8(4):94.
[13] DIN N A S, LIM S J, MASKAT M Y, et al.Lactic acid separation and recovery from fermentation broth by ion-exchange resin:A review[J].Bioresources and Bioprocessing, 2021, 8(1):31.
[14] GÖSSI A, BURGENER F, KOHLER D, et al.In-situ recovery of carboxylic acids from fermentation broths through membrane supported reactive extraction using membrane modules with improved stability[J].Separation and Purification Technology, 2020, 241:116694.
[15] LOZANO L J, GOD NEZ C, DE LOS R
NEZ C, DE LOS R OS A P, et al.Recent advances in supported ionic liquid membrane technology[J].Journal of Membrane Science, 2011, 376(1-2):1-14.
OS A P, et al.Recent advances in supported ionic liquid membrane technology[J].Journal of Membrane Science, 2011, 376(1-2):1-14.
[16] MI AN A, NADPAL J, STUPAR A, et al.The perspectives of natural deep eutectic solvents in agri-food sector[J].Critical Reviews in Food Science and Nutrition, 2020, 60(15):2564-2592.
AN A, NADPAL J, STUPAR A, et al.The perspectives of natural deep eutectic solvents in agri-food sector[J].Critical Reviews in Food Science and Nutrition, 2020, 60(15):2564-2592.
[17] KUMAR A, THAKUR A, PANESAR P S.Statistical optimization of lactic acid extraction using green emulsion ionic liquid membrane (GEILM)[J].Journal of Environmental Chemical Engineering, 2018, 6(2):1855-1864.
[18] MATSUMOTO M, PANIGRAHI A, MURAKAMI Y, et al.Effect of ammonium- and phosphonium-based ionic liquids on the separation of lactic acid by supported ionic liquid membranes (SILMs)[J].Membranes, 2011, 1(2):98-108.
[19] ZHENG D Y, HUA D, HONG Y P, et al.Functions of ionic liquids in preparing membranes for liquid separations:A review[J].Membranes, 2020, 10(12):395.
[20] PÉREZ A D, RODR GUEZ-BARONA S, FONTALVO J.Integration of a liquid membrane in Taylor flow regime with a fermentation by Lactobacillus casei ATCC 393 for in-situ lactic acid removal[J].Chemical Engineering and Processing-Process Intensification, 2019, 140:85-90.
GUEZ-BARONA S, FONTALVO J.Integration of a liquid membrane in Taylor flow regime with a fermentation by Lactobacillus casei ATCC 393 for in-situ lactic acid removal[J].Chemical Engineering and Processing-Process Intensification, 2019, 140:85-90.
[21] KONGPOL K, SERMKAEW N, MAKKLIANG F, et al.Extraction of curcuminoids and ar-turmerone from turmeric (Curcuma longa L.) using hydrophobic deep eutectic solvents (HDESs) and application as HDES-based microemulsions[J].Food Chemistry, 2022, 396:133728.
[22] MATSUMOTO M, TAKEMORI S, TAHARA Y.Lactic acid permeation through deep eutectic solvents-based polymer inclusion membranes[J].Membranes, 2020, 10(9):244.
[23] RODR GUEZ-LLORENTE D, BENGOA A, PASCUAL-MU
GUEZ-LLORENTE D, BENGOA A, PASCUAL-MU OZ G, et al.Sustainable recovery of volatile fatty acids from aqueous solutions using terpenoids and eutectic solvents[J].ACS Sustainable Chemistry &Engineering, 2019,7(19):16786-16794.
OZ G, et al.Sustainable recovery of volatile fatty acids from aqueous solutions using terpenoids and eutectic solvents[J].ACS Sustainable Chemistry &Engineering, 2019,7(19):16786-16794.
[24] KUMAR A, THAKUR A, PANESAR P S.Lactic acid extraction using environmentally benign Green emulsion ionic liquid membrane[J].Journal of Cleaner Production, 2018, 181:574-583.
[25] ARAYA-L PEZ C, CONTRERAS J, MERLET G, et al.[Tf2N]-based ionic liquids for the selective liquid-liquid extraction of Levulinic acid/Formic acid:COSMO-RS screening and ternary LLE experimental data[J].Fluid Phase Equilibria, 2022, 561:113518.
PEZ C, CONTRERAS J, MERLET G, et al.[Tf2N]-based ionic liquids for the selective liquid-liquid extraction of Levulinic acid/Formic acid:COSMO-RS screening and ternary LLE experimental data[J].Fluid Phase Equilibria, 2022, 561:113518.
[26] RIBEIRO B D, FLORINDO C, IFF L D C, et al.Menthol-based eutectic mixtures:Hydrophobic low viscosity solvents[J].ACS Sustainable Chemistry &Engineering, 2015, 3(10):2469-2477.
[27] ROCHA M A A, RAEISSI S, HAGE P, et al.Recovery of volatile fatty acids from water using medium-chain fatty acids and a cosolvent[J].Chemical Engineering Science, 2017, 165:74-80.
[28] GUAN N Z, LIU L.Microbial response to acid stress:mechanisms and applications[J].Applied Microbiology and Biotechnology, 2020, 104(1):51-65.
[29] MARCHEL M, ![]() H, BOCZKAJ G.Deep eutectic solvents microbial toxicity:Current state of art and critical evaluation of testing methods[J].Journal of Hazardous Materials, 2022, 425:127963.
H, BOCZKAJ G.Deep eutectic solvents microbial toxicity:Current state of art and critical evaluation of testing methods[J].Journal of Hazardous Materials, 2022, 425:127963.
[30] SCOVAZZO P, KIEFT J, FINAN D, et al.Gas separations using non-hexafluorophosphate [PF6]-anion supported ionic liquid membranes[J].Journal of Membrane Science, 2004, 238(1-2):57-63.
[31] JIANG B, ZHOU J H, XU M, et al.Multifunctional ternary deep eutectic solvent-based membranes for the cost-effective ethylene/ethane separation[J].Journal of Membrane Science, 2020, 610:118243.
[32] SUN H, YAO J, CONG H, et al.Enhancing the stability of supported liquid membrane in phenols removal process by hydrophobic modification[J].Chemical Engineering Research and Design, 2017, 126:209-216.
[33] L PEZ-PORFIRI P, GONZ
PEZ-PORFIRI P, GONZ LEZ-MIQUEl M, GORGOJO P.Green supported liquid membranes:The permeability activity-based linear operation (PABLO) method[J].Chemical Engineering Journal, 2022, 446(Part 3):137253.
LEZ-MIQUEl M, GORGOJO P.Green supported liquid membranes:The permeability activity-based linear operation (PABLO) method[J].Chemical Engineering Journal, 2022, 446(Part 3):137253.
[34] LI Z, CUI Y N, SHEN Y M, et al.Extraction process of amino acids with deep eutectic solvents-based supported liquid membranes[J].Industrial &Engineering Chemistry Research, 2018, 57(12):4407-4419.
[35] CHEN S W, GONG P M, ZHANG J M, et al.Quantitative analysis of Lactobacillus delbrueckii subsp.bulgaricus cell division and death using fluorescent dye tracking[J].Journal of Microbiological Methods, 2020, 169:105832.
[36] VAN DEN BRUINHORST A, RAES S, MAESARA S A, et al.Hydrophobic eutectic mixtures as volatile fatty acid extractants[J].Separation and Purification Technology, 2019, 216:147-157.
[37] DESBOIS A P, SMITH V J.Antibacterial free fatty acids:Activities, mechanisms of action and biotechnological potential[J].Applied Microbiology and Biotechnology, 2010, 85(6):1629-1642.
[38] MALIK A, KASHYAP H K.Heterogeneity in hydrophobic deep eutectic solvents:SAXS prepeak and local environments[J].Physical Chemistry Chemical Physics, 2021, 23(6):3915-3924.
[39] PAUL N, HARISH G, BANERJEE T.Stability mechanism of menthol and fatty acid based hydrophobic eutectic solvents:Insights from nonbonded interactions[J].ACS Sustainable Chemistry &Engineering, 2023, 11(8):3539-3556.
[40] DARWISH A S, WARRAG S E E, LEMAOUI T, et al.Green extraction of volatile fatty acids from fermented wastewater using hydrophobic deep eutectic solvents[J].Fermentation, 2021,7(4):226.
[41] MAI Y L, XIAN X L, HU L, et al.Liquid-liquid extraction of levulinic acid from aqueous solutions using hydrophobic tri-n-octylamine/alcohol-based deep eutectic solvent[J].Chinese Journal of Chemical Engineering, 2023, 54:248-256.
[42] CAO J, ZHU F, DONG Q H, et al.Insight into the physicochemical properties of deep eutectic solvents by systematically investigating the components[J].Journal of Molecular Liquids, 2022, 346:118315.
[43] REYHANITASH E, ZAALBERG B, KERSTEN S R A, et al.Extraction of volatile fatty acids from fermented wastewater[J].Separation and Purification Technology, 2016, 161:61-68.
[44] REN X S, JIA Y, LU X L, et al.Preparation and characterization of PDMS-D2EHPA extraction gel membrane for metal ions extraction and stability enhancement[J].Journal of Membrane Science, 2018, 559:159-169.
[45] DONG Y, LI J, PEDERSEN-BJERGAARD S, et al.Unidirectional solute transfer using a Janus membrane[J].Journal of Membrane Science, 2020, 596:117723.