高级醇,俗称“杂醇油”,指含有3个碳原子以上一元醇的混合物[1],广泛存在于各种饮料酒中。不同的高级醇具有不同的香气特征,适量的高级醇可以赋予酒体醇厚甘甜,增强其协调性,给人带来舒畅的感觉;然而,酒中高级醇含量过高时,酒体会变得苦涩、冲辣,饮酒后容易“上头”、难醒酒,甚至中毒,给人体带来不可逆的损伤[2]。酒中高级醇种类较多,其中含量较高的通常为正丙醇、异丁醇和异戊醇[3]。
高级醇可通过分解代谢途径(Ehrlich pathway)和糖代谢合成途径(Harris pathway)产生,2种产生途径均可分为上下游途径[4]:氨基酸/丙酮酸到α-酮酸为上游途径;α-酮酸脱羧还原为对应的高级醇为下游途径。上游途径所涉及的酶对高级醇生成不具有特异性,且已有较多的研究报道[5-7];下游途径中的丙酮酸脱羧酶(pyruvate decarboxylases, PDCs)和醇脱氢酶(alcohol dehydrogenases, ADHs)直接决定高级醇的生成[4,8],相关研究报道较少。
中药材在传统制曲酿酒中广泛应用,其意义包括提升酒曲性能、增加酒的风味和保健功效等[9]。研究表明,一些药食两用中药材如茯苓、黄芪、人参、甘草、白术和桑叶等可减少酿酒中的高级醇生成[10-11],但具体机制尚不明确。研究显示[12-14],一些中药材小分子组分可通过与酶蛋白的结合而实现对酶活性的抑制。在获得酶蛋白三级结构和药材组分信息的基础上,分子对接为探讨两者之间相互作用的可能性提供了一种有效的分析预测手段[15]。
本研究对高级醇形成途径中PDCs和ADHs两类关键酶进行了生物信息学分析,通过分子对接分析了它们与茯苓、黄芪、人参、甘草、白术和桑叶小分子组分结合的可能性,并从关键酶讨论了控制酿酒中高级醇生成的可能方式。
1 材料与方法
1.1 PDCs和ADHs序列查询及数据收集
从UniProt数据库获得PDCs和ADHs序列及微生物归属信息:以PDCs和ADHs的EC number为筛选条件,在UniProt数据库中搜索氨基酸序列,去除来自人类和动植物的序列,下载后去除重复,用于进一步分析。
1.2 系统发育树的构建
通过MEGA软件选择Clustal W默认参数进行多序列比对,将比对结果保存为mega格式;选择建邻接方法(neighbor joining)构建系统发育树,重复取样1 000 次进行自展值分析以评估系统进化树的拓扑结构稳定性。
1.3 PDCs和ADHs的理化性质和结构预测
氨基酸序列等电点、不稳定系数等理化性质分析用Protparam(https://web.expasy.org/protparam/)在线进行;亚细胞定位分析用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行;信号肽预测用Signal P软件6.0版(https://services.healthtech.dtu.dk/services/SignalP-6.0/)进行;磷酸化位点预测用NetPhos 3.1(https://services.healthtech.dtu.dk/services/NetPhos-3.1/)进行;采用SWISS-MODEL(https://swissmodel.expasy.org/)进行同源建模;采用SuperPose(http://superpose.wishartlab.com/)进行蛋白质三级结构比对。
1.4 分子对接
在TCMSP(https://old.tcmsp-e.com/tcmsp.php)数据库收集茯苓、黄芪、人参、甘草、白术和桑叶的组分信息,从Pubchem(https://pubchem.ncbi.nlm.nih.gov/)下载中药材小分子组分及前体氨基酸3D结构。使用Autodock半柔性对接分析PDCs和ADHs与中药材组分小分子之间的结合能大小。应用AutoDockTools软件准备受体(PDCs或ADHs)与配体(中药材小分子组分)的坐标文件,添加氢原子和电荷,并用于确定中药材小分子组分分子中可旋转的单键及根原子的数量。设置好后,作为pdb文件设定后保存。对接盒子以受体(PDCs或ADHs)几何中心为其中心点,盒子设定为适当大小(全部包裹PDCs或ADHs即可),选用拉马克遗传基因算法,将对接轮数设定为100。中药材小分子与PDCs和ADHs结合三维结构使用PyMOL查看。
2 结果与分析
2.1 酿酒中异戊醇、异丁醇和正丙醇的形成途径及关键酶
在KEGG代谢网络数据库中查询异戊醇、异丁醇和正丙醇形成途径并结合相关文献[16-17],如图1所示,3种高级醇可通过2条代谢途径形成:发酵体系中氨基酸含量充足时的Ehrlich途径和发酵体系中氨基酸含量不足时的Harris途径。在Ehrlich途径中,亮氨酸、缬氨酸和苏氨酸分别转化为异戊醇、异丁醇和正丙醇。在Harris途径中,通过糖酵解途径生成丙酮酸,再经相关酶催化生成对应的α-酮酸中间体,然后通过脱羧和加氢还原反应生成相应的高级醇。3种高级醇生成的上游途径所涉及的酶有所不同,但下游途径均是α-酮酸中间体经PDCs和ADHs催化形成相应高级醇。从理论上讲,降低PDCs和ADHs活性可减少高级醇生成[18]。

图1 酿酒中正丙醇、异戊醇和异丁醇的合成途径
Fig.1 The synthesis pathways of n-propanol, isoamyl alcohol and isobutanol in brewing
2.2 不同微生物来源的PDCs和ADHs系统发育树分析
研究显示,在酵母菌Saccharomyces cerevisiae、Kluyveromyces marxianus、Kluyveromyces lactis、霉菌Aspergillus parasiticus、Aspergillus nidulans、Aspergillus oryzae、细菌Zymomonas mobilis、Zymobacter palmae、Acetobacter pasteurianus、Sarcina ventriculi等,以及高等植物中都有PDCs存在[19]。PDCs在植物和真菌中相对广泛存在,在细菌中很少发现,PDCs可由PDC1、PDC5、PDC6编码[4,19],不同基因编码的PDCs的催化特异性未见报道。
在UniProt数据库仅检索到来自微生物的6条PDCs序列,均来自真菌(Saccharomyces、Candida、Kluyveromyces),序列长度为563~564 aa;未检索到来自细菌的PDCs序列。系统进化树分析结果显示,各PDCs序列相似度总体上较高,由不同基因编码的来自S.cerevisiae的PDCs氨基酸序列存在一定差异(图2-A),来自S.cerevisiae的PDC6单独为一个分支;其余5条来自不同微生物PDC1和PDC5属于另一分支。
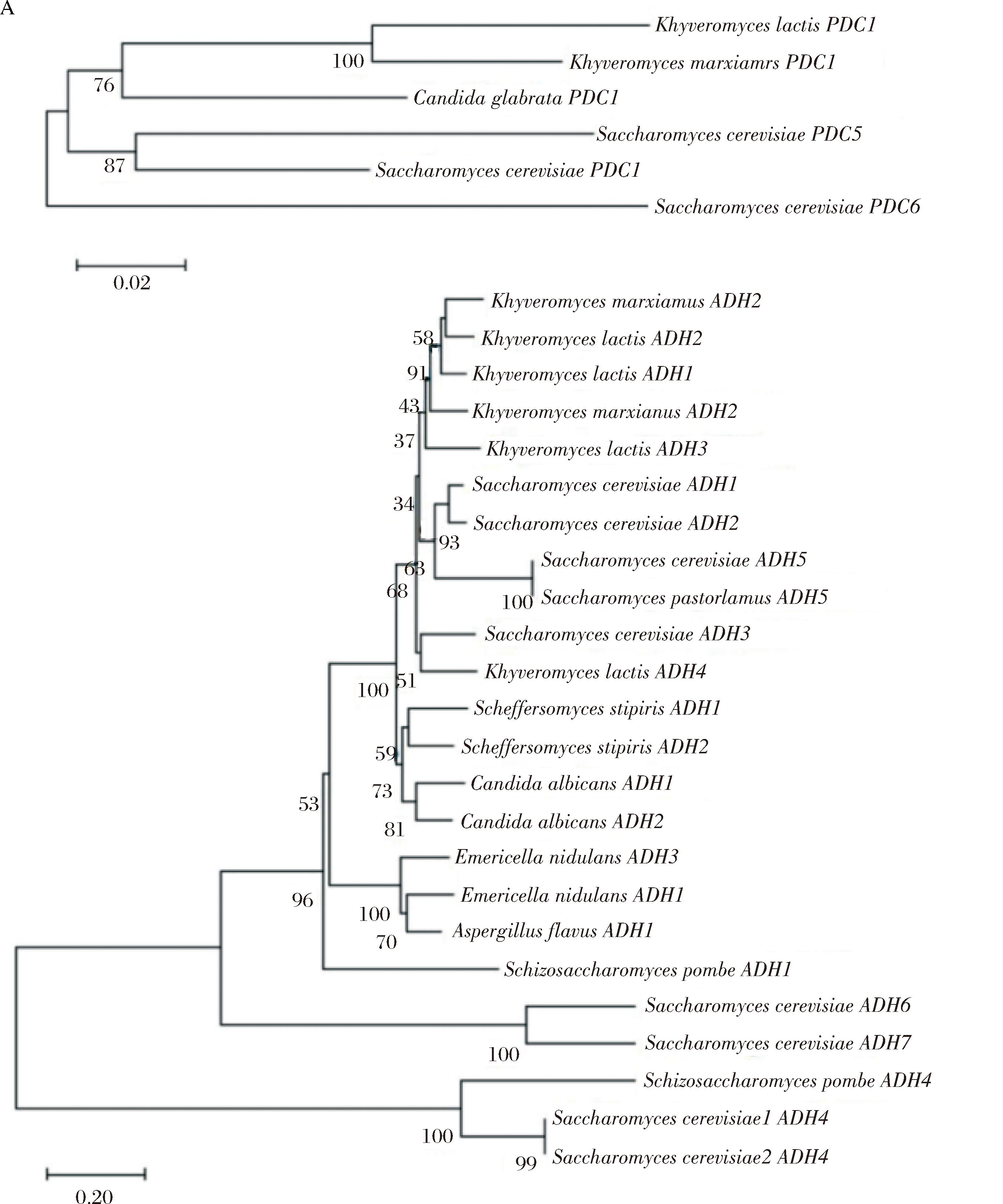
A-PDCs氨基酸序列;B-ADHs氨基酸序列
图2 来自不同微生物的PDCs和ADHs氨基酸序列的系统发育树分析
Fig.2 Phylogenetic tree analysis of the amino acid sequences of PDCs and ADHs from different microorganisms
ADHs是一种氧化还原酶[20],目前为止已从动物、植物和微生物中分离出多种不同的ADHs[8,21],研究显示,S.cerevisiae有7种ADHs,其中ADH2能够氧化乙醇,ADH1、ADH3、ADH4和ADH5能够还原乙醛,ADH6对NADPH有严格特异性,ADH7的还原酶活性约为脱氢酶活性的5倍[22],其他ADHs的氧化性与还原性相对强弱未见报道。除S.cerevisiae外,Kluyveromyces、Candida、Pichia中均发现ADHs基因,Aspergillus和Rhizopus中也发现ADHs基因。
在UniProt数据库仅检索到来自微生物的24条ADHs序列,主要来自Saccharomyces,少数来自Candida、Kluyveromyces、Aspergillus,序列长度为348~374 aa,多数为350 aa左右;同样未检索到来自细菌的ADHs序列,可能是因为没有进行测序。一般认为在酿酒过程中高级醇主要是由S.cerevisiae代谢产生,但Candida、Aspergillus等与高级醇生成也有一定的相关性[23-24]。ADHs序列的系统进化树也分为两大支(图2-B),来自S.cerevisiae的3条ADH4为一个分支;其他19条来自不同微生物的ADHs序列为另一个分支。总体上看,来自同一微生物的ADHs多有较高的相似度;而来自S.cerevisiae的某些ADHs相似度略低。
2.3 几种代表性微生物的PDCs和ADHs理化性质和结构预测
在前述系统发育树分析的基础上,选取代表性的PDCs(来自S.cerevisiae的PDC6和PDC5、来自Candida的PDC1)和ADHs(来自S.cerevisiae的ADH4、ADH5和ADH7;来自Schizosaccharomyces的ADH1、来自Candida的ADH1和来自Aspergillus的ADH3)序列作进一步分析。
理化性质预测结果(表1)显示,各PDCs理论等电点在5.51~5.80;ADHs理论等电点为5.76~6.60。蛋白质在等电点时溶解度最小,易形成沉淀物而降低活性。酿酒初期pH值一般在4.0左右,后期为3.0左右,与PDCs和ADHs的等电点相距较远,对其活性不会造成直接影响。各PDCs和ADHs均无跨膜结构和信号肽。亚细胞定位预测结果显示,各PDCs和ADHs多数位于细胞质,少数位于细胞核、胞浆、线粒体。PDCs和ADHs的稳定系数均小于40,属于稳定蛋白。
表1 几种代表性微生物的PDCs和ADHs的理化性质预测
Table 1 Prediction of physicochemical properties of PDCs and ADHs of several representative microorganisms
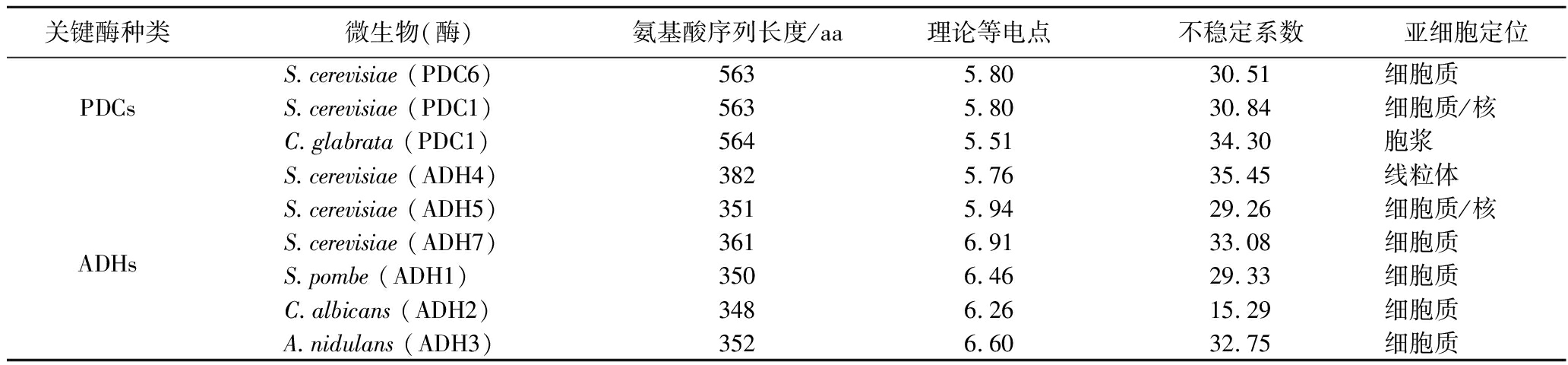
关键酶种类微生物(酶)氨基酸序列长度/aa理论等电点不稳定系数亚细胞定位S.cerevisiae (PDC6)5635.8030.51细胞质PDCsS.cerevisiae (PDC1)5635.8030.84细胞质/核C.glabrata (PDC1)5645.5134.30胞浆S.cerevisiae (ADH4)3825.7635.45线粒体S.cerevisiae (ADH5)3515.9429.26细胞质/核ADHsS.cerevisiae (ADH7)3616.9133.08细胞质S.pombe (ADH1)3506.4629.33细胞质C.albicans (ADH2)3486.2615.29细胞质A.nidulans (ADH3)3526.6032.75细胞质
酶的功能依赖于其三级结构。目前已通过实验确定三级结构的仅有来自S.cerevisiae的PDC6,采用同源建模方法对其他微生物的PDCs和ADHs三级结构进行了预测,对比结果显示,各PDCs的三级结构相差不大;除来自Candida的ADH外,其他微生物ADHs三级结构与所比对S.cerevisiae的ADH三级结构差距较大(表2),其功能上是否存在差异有待进一步研究。
表2 几种代表性微生物的PDCs和ADHs的三级结构对比
Table 2 Comparison of the tertiary structures of PDCs and ADHs from several representative microorganisms
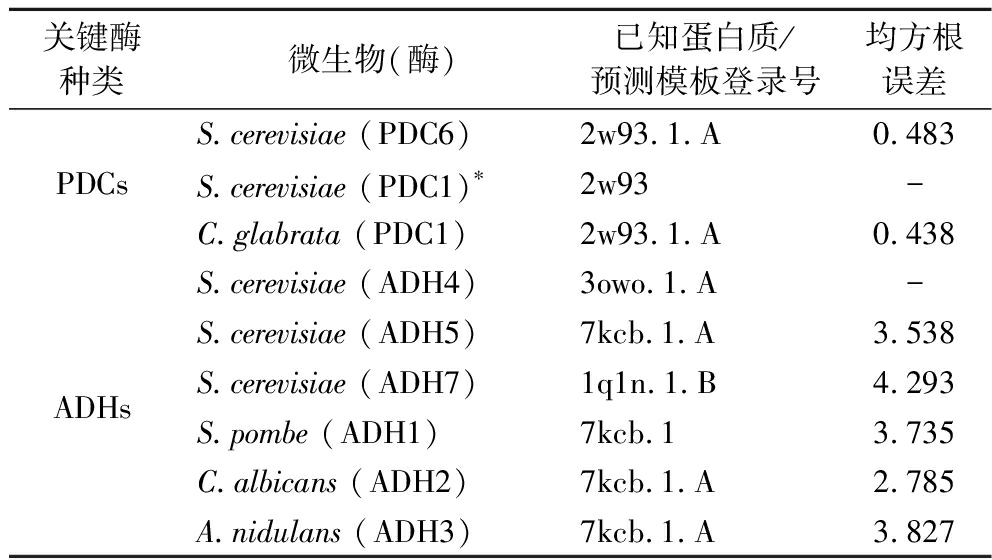
关键酶种类微生物(酶)已知蛋白质/预测模板登录号均方根误差S.cerevisiae (PDC6)2w93.1.A0.483PDCsS.cerevisiae (PDC1)∗2w93-C.glabrata (PDC1)2w93.1.A0.438S.cerevisiae (ADH4)3owo.1.A-S.cerevisiae (ADH5)7kcb.1.A3.538ADHsS.cerevisiae (ADH7)1q1n.1.B4.293S.pombe (ADH1)7kcb.13.735C.albicans (ADH2)7kcb.1.A2.785A.nidulans (ADH3)7kcb.1.A3.827
注:*表示该关键酶在PDB数据库中具有已知的3D结构;-代表酿酒酵母的关键对照酶,均方根误差值为与来自S.cerevisiae的关键酶三级结构的对比结果(均方根误差<3时认为2个结构相似)。
2.4 几种PDCs和ADHs与可减少高级醇生成中药材组分的结合能大小分析
茯苓、黄芪、人参、甘草、白术和桑叶是已报道的可减少酿酒中高级醇生成的药食两用原料[10-11],可能的机制包括:抑制微生物生长代谢[11]、影响氨基酸分解产生高级醇、促进高级醇转化为酯等风味组分[25]。其具体作用位点尚不清楚。中药材小分子组分直接与酶结合抑制其活性是可能的作用方式之一。将从这几种药材中搜集到的共67种组分与9种来自不同微生物的PDCs和ADHs进行分子对接。结合能预测结果(表3)显示,较多的中药材小分子组分与PDCs和ADHs的结合能小于-5.0 kcal/mol,提示有较好的亲和力[26]。中药材组分小分子可能与位于PDCs和ADHs的特定位点的氨基酸残基相互作用,改变蛋白质的构象和功能[15],进而改变PDCs和ADHs活性从而影响高级醇的生成,但具体使通过什么方式抑制PDCs和ADHs活性还有待进一步探究。在几种中药材中,甘草中与PDCs和ADHs具有较高亲和力的组分数量最多;白术中的3种组分与极大多数不同的PDCs和ADHs均有较好的亲和力;人参中的组分与多数PDCs和ADHs有较低的结合能,可能是因为这几种中药材组分小分子含有特定的化学基团,能形成较强的氢键,使得其与PDCs和ADHs结合比较稳定[27]。
表3 几种代表性微生物的PDCs和ADHs与中药材组分小分子对接的结合能
Table 3 Binding energies of PDCs and ADHs from several representative microorganisms with small molecules of Chinese herbs

关键酶种类微生物(酶)最低结合能/(kcal/mol)茯苓(8)黄芪(12)人参(8)甘草(25)白术(3)桑叶(11)S.Cerevisiae (PDC6)-6.70(1)-6.62(9)-7.66(5)-6.89(21)-6.60(3)-6.23(7)PDCsS.Cerevisiae (PDC1)-5.71(2)-6.72(7)-6.78(5)-7.85(21)-6.62(3)-7.09(7)C.glabrata (PDC1)-5.78(1)-6.79(7)-8.45(5)-8.49(18)-6.52(3)-6.66(7)S.Cerevisiae (ADH4)-7.62(3)-7.29(11)-7.44(5)-7.40(24)-8.25(3)-7.70(7)S.Cerevisiae (ADH5)-7.17(5)-6.39(10)-9.51(5)-7.72(25)-6.62(3)-8.21(6)ADHsS.Cerevisiae (ADH7)-6.47(4)-6.28(7)-7.51(6)-6.74(22)-7.16(3)-7.62(8)S.pombe (ADH1)-6.40(5)-6.79(5)-6.20(5)-6.63(12)-6.92(2)-7.08(3)C.albicans (ADH2)-5.82(4)-6.42(3)-6.26(4)-6.64(15)-6.12(3)-5.86(4)A.nidulans (ADH3)-6.28(3)-6.49(3)-6.19(4)-6.34(9)-5.66(2)-6.01(3)
注:第二行括号中的数字为该中药材中小组分物质数量;第三行以下数字为结合能低于-5的组分数量;结合能<-5.0 kcal/mol表示表明配体分子能和受体蛋白具有较好的亲和力[26]。
2.5 从PDCs和ADHs的角度看酿酒中高级醇的控制
2.5.1 前体
α-酮异己酸、α-酮异戊酸和α-酮丁酸分别是异戊醇、异丁醇和正丙醇的直接前体(图1),在Ehrlich途径中,它们分别来自亮氨酸、缬氨酸和苏氨酸;在Harris途径中,它们来自经糖酵解变成丙酮酸后的进一步代谢。由于丙酮酸是涉及多种代谢物的中间体,调控难度较大。在酿酒中高级醇生成控制上主要考虑调整氨基酸的供给。原料中的蛋白质是发酵过程中氨基酸的主要来源。不同原料品种的粗蛋白含量相差较大。研究表明,高级醇生成量与原料中的粗蛋白含量呈正相关,选择蛋白质含量低的原料,减少氨基酸生成,是降低高级醇水平的方式之一[28-29]。另一方面,当某种必需氨基酸不足时,酵母会通过Harris途径合成氨基酸来满足自身生长需求,若此过程中氮源不足,糖代谢中间产物α-酮酸会因无法转变为相应氨基酸而积累,并在α-酮酸脱羧酶及醇脱氢酶的作用下生成高级醇(图1)。因此发酵物料中碳、氮源的种类、数量和比例,是影响高级醇生成的重要因素。
2.5.2 PDCs和ADHs的微生物来源
如前文所述,PDCs和ADHs可来自酿酒酵母等多种微生物。在酿酒生产过程中,酵母菌起酒化和形成风味物质的作用,霉菌主要起糖化作用,不能通过抑制这些微生物实现降低高级醇生成的目的。但可考虑抑制一些具有PDCs和ADHs活性的杂菌如Zymomonas、Acetobacter、Pichia等,以减少高级醇的生成。不同的酿酒酵母菌株高级醇生成量的差异可达50%~100%,选育优良的酿酒酵母菌株是减少高级醇生成的有效方式[30-32],但在复杂的混菌发酵体系中,强化优良菌株的作用发挥通常会受到很多因素的影响。
2.5.3 PDCs和ADHs基因的表达
PDCs和ADHs的基因的敲除或过量表达,可改变α-酮酸的分解代谢,从而调控酿酒中高级醇的合成水平。KONDO等[33]构建ADH6过表达菌株YTD16,异丁醇提高了2.6倍;YOSHIMOTO等[34]的研究显示,酿酒酵母PDC1的缺失会导致异戊醇的生成量降低31%,过表达PDC1会使异戊醇的生成增加。ATSUMI等[35]的研究显示,过表达大肠杆菌和酿酒酵母的ADH2基因显著提高异戊醇和异丁醇含量。LIANG等[36]研究发现ADH7基因缺失可减少异戊醇和异丁醇等6种高级醇的生成。由于法规限制,基因工程菌目前尚不能应用于食品发酵。但通过其他方式调控PDCs和ADHs基因表达仍可考虑。如合理外源添加可同化氮源,可下调PDC1、PDC5、PDC6、ADH3、ADH4、ADH5、ADH6等基因表达,从而减少高级醇生成[37]。
2.5.4 PDCs和ADHs酶活力
从理论上讲,PDCs和ADHs的酶活力可受发酵温度和pH等发酵参数影响。如在一定范围内,酵母菌的高级醇生成量随发酵温度的升高而增加;初始pH值可影响酿酒中高级醇的生成[38];适当降低发酵温度和初始pH值可减少酿酒中高级醇的生成[39-43]。但这些参数可能影响的发酵环节较多,目前尚无针对PDCs和ADHs的具体探讨。一般而言,酿酒生产中传统的成熟工艺操作参数不会做大幅度调整。如前文所述,外源添加中药材或其他天然组分也可能影响PDCs和ADHs活性,是调控酿酒发酵中高级醇生成的一种可行方式。但中药材的作用靶点通常较为复杂,其详细调控机制和应用方式优化还有待进一步研究。
3 结论
PDCs和ADHs是催化相应α-酮酸中间体生成异戊醇、异丁醇和正丙醇的关键酶。PDCs和ADHs的序列均来自真菌,且大多数来自酵母菌属,少数来自曲霉属;所选不同微生物的PDCs理论等电点在5.51~5.80之间,ADHs理论等电点为5.76~6.60;无跨膜结构和信号肽且均属于稳定蛋白。亚细胞定位预测结果显示,所选不同微生物的PDCs和ADHs多数位于细胞质,少数位于细胞核、胞浆、线粒体,综合这些预测结果推断PDCs和ADHs均为胞内酶。分子对接实验表明,大多数中药材小分组分与PDCs和ADHs的结合能均小于-5.0 kcal/mol,表明中药材组分小分子和PDCs和ADHs有较好的亲和力,其中人参、甘草、白术尤其值得关注。
[1] HU Y L, YANG Q, CHEN D, et al.Study on microbial communities and higher alcohol formations in the fermentation of Chinese Xiaoqu Baijiu produced by traditional and new mechanical technologies[J].Food Research International, 2021, 140:109876.
[2] WANG Z, SUN X Z, LIU Y C, et al.Characterization of key aroma compounds in Xiaoqu liquor and their contributions to the sensory flavor[J].Beverages, 2020, 6(3):42.
[3] 格绒泽仁, 皇甫洁, 韩兴林, 等.浓香型白酒饮后不适感关键高级醇类物质关联性判定新方法[J].食品与发酵工业, 2019, 45(14):191-195.GERONG Z R, HUANG F J, HAN X L, et al.A method for determining associations between drinking discomforts and key higher alcohols in strong-aroma Baijiu[J].Food and Fermentation Industries, 2019, 45(14):191-195.
[4] 冯鹏鹏, 孙丽静, 肖冬光, 等.啤酒酵母高级醇的代谢与调控研究进展[J].食品研究与开发, 2021, 42(8):153-159.FENG P P, SUN L J, XIAO D G, et al.Research progress on metabolism and regulation of higher alcohols in beer yeast[J].Food Research and Development, 2021, 42(8):153-159.
[5] CUI D Y, LIU L, ZHANG X Y, et al.Using transcriptomics to reveal the molecular mechanism of higher alcohol metabolism in Saccharomyces cerevisiae[J].Food Bioscience, 2023, 51:102227.
[6] LI P, LI T, ZHANG C Y, et al.Effect of ILV2 deletion and ILV3 or/and ILV5 overexpression in Saccharomyces uvarum on diacetyl and higher alcohols metabolism during wine fermentation[J].European Food Research and Technology, 2020, 246(3):563-572.
[7] 徐佳, 黄雪芹, 杨建飞, 等.酿酒酵母中BAT2基因敲除对桑葚酒中高级醇的影响[J].食品与发酵工业, 2021, 47(19):133-139.XU J, HUANG X Q, YANG J F, et al.BAT2 gene deletion in Saccharomyces cerevisiae affected on higher alcohols in mulberry wine[J].Food and Fermentation Industries, 2021, 47(19):133-139.
[8] 郝媛. 产丁醇脱氢酶微生物的筛选及其酶学性质的研究[D].呼和浩特:内蒙古农业大学, 2020.HAO Y.Screening of butanol-dehydrogenase producing microorganism and study on the enzymatic properties[D].Hohhot:Inner Mongolia Agricultural University, 2020.
[9] 雷学俊, 杨俊, 李丽, 等.添加中药材对米曲性能指标影响的规律性[J].食品研究与开发, 2015, 36(15):52-54.LEI X J, YANG J, LI L, et al.Investigating the effect of adding Chinese herbs on the properties of rice-koji[J].Food Research and Development, 2015, 36(15):52-54.
[10] 江威, 李强, 唐洁, 等.中药材对清香型白酒主要酿造微生物及风味物质的影响[J].中国酿造, 2023, 42(2):89-94.JIANG W, LI Q, TANG J, et al.Effects of Chinese medicinal materials on main brewing microorganisms and flavor components of light-flavor Baijiu[J].China Brewing, 2023, 42(2):89-94.
[11] 许必晏. 川法小曲酒中药材入曲对小曲清香白酒酒质影响研究[J].酿酒, 2020, 47(3):97-98.XU B Y.Effect of Xiaoqu seasoned with Chinese medicinal material on quality of Fen favor Sichuan Xiaoqu liquor[J].Liquor Making, 2020, 47(3):97-98.
[12] 张欢, 高胜美, 王跃飞, 等.中药“曲剂”发酵的物质和功能变化及机制研究进展[J].中草药, 2021, 52(8):2473-2479.ZHANG H, GAO S M, WANG Y F, et al.Research progress on material and functional changes and fermentation mechanism of “fermented preparation” of traditional Chinese medicine[J].Acupuncture Research, 2021, 52(8):2473-2479.
[13] 宋光伟, 江涛, 葛勤, 等.中药及中药有效成分对酶的影响[J].医药导报, 2009, 28(8):1055-1057.SONG G W, JIANG T, GE Q, et al.Effects of Chinese medicine and its active components on enzymes[J].Herald of Medicine, 2009, 28(8):1055-1057.
[14] 张海凤, 董亚琳, 胡萨萨, 等.五种中药对两种不同来源α-葡萄糖苷酶活性的抑制作用比较[J].中药材, 2008,31(7):1024-1027. ZHANG H F, DONG Y L, HU S S, et al.The comparison about inhibition of five Chinese herbal medicines to two different resources α-glycosidase[J].Journal of Chinese Medicinal Materials, 2008,31(7):1024-1027.
[15] WANG H R, CHENG Y, ZHANG X, et al.Comparative analysis of physicochemical properties, ginsenosides content and α-amylase inhibitory effects in white ginseng and red ginseng[J].Food Science and Human Wellness, 2023, 12(1):14-27.
[16] EL-DALATONY M M, SAHA S, GOVINDWAR S P, et al.Biological conversion of amino acids to higher alcohols[J].Trends in Biotechnology, 2019, 37(8):855-869.
[17] 樊静雅, 谷欣哲, 梁清文, 等.白酒发酵过程中异戊醇合成机制与减控研究进展[J].中国酿造, 2023, 42(5):1-8.FAN J Y, GU X Z, LIANG Q W, et al.Research progress in mechanism of isoamyl alcohol synthesis and its reduction control during Baijiu fermentation[J].China Brewing, 2023, 42(5):1-8.
[18] 孙中贯, 刘琳, 王亚平, 等.酿酒酵母高级醇代谢研究进展[J].生物工程学报, 2021, 37(2):429-447.SUN Z G, LIU L, WANG Y P, et al.Higher alcohols metabolism by Saccharomyces cerevisiae:A mini review[J].Chinese Journal of Biotechnology, 2021, 37(2):429-447.
[19] 朱碧云, 李浩明.丙酮酸脱羟酶及其应用研究[J].生命科学, 2010, 22(11):1184-1191.ZHU B Y, LI H M.Reviews on pyruvate decarboxylase and its application[J].Chinese Bulletin of Life Sciences, 2010, 22(11):1184-1191.
[20] KEN C F, TZENG S J, WEN L S, et al.A Rigidoporus vinctus alcohol dehydrogenase and its characterization[J].Journal of the Chinese Chemical Society, 2016, 63(3):308-312.
[21] 任宇婷. 传统清香型白酒发酵过程中高级醇合成机理研究[D].呼和浩特:内蒙古农业大学, 2022.REN Y T.Study on the synthesis mechanism of higher alcohol in the fermentation process of traditional light-flavor Baijiu[D].Hohhot:Inner Mongolia Agricultural University, 2022.
[22] DE SMIDT O, DU PREEZ J C, ALBERTYN J.The alcohol dehydrogenases of Saccharomyces cerevisiae:A comprehensive review[J].FEMS Yeast Research, 2008, 8(7):967-978.
[23] 王乐. 基于微生物多样性分析探究北方浓香型白酒高级醇含量偏高的原因及解决措施[D].呼和浩特:内蒙古农业大学, 2022.WANG L.Exploring the reasons and solutions for the high content of higher alcohol in northern Luzhou-flavor liquor based on microbial diversity analys[D].Hohhot:Inner Mongolia Agricultural University, 2022.
[24] 陈桂梅. 基于功能菌群扰动的红曲酒高级醇代谢调控[D].福州:福州大学, 2021.CHEN G M.Metabolic regulation of higher alcohol in Hongqu Jiu based on the disturbance of functional microflora[D].Fuzhou:Fuzhou University, 2021.
[25] 张宇, 吴正云, 朱宇, 等.制曲药材的选择及配方规律探讨[J].酿酒科技, 2018(11):17-20.ZhANG Y, WU Z Y, ZHU Y, et al.Selection of starter-making medicinal herbs and study of the common rules in starter-making formulas[J].Liquor-Making Science &Technology, 2018(11):17-20.
[26] 肖瑀晗, 吕昕昱, 张莹凡, 等.藤椒精油抗芽孢杆菌生物被膜关键组分的分子对接虚拟筛选与活性评价[J/OL].食品科学, 2024.https://link.cnki.net/urlid/11.2206.TS.20231229.1420.010.XIAO Y H, LV X Y, ZHANG Y F, et al.Virtual screening and activity evaluation of key antibiofilm components in green Sichuan pepper essential oil against Bacillus amyloliquefaciens based on molecular docking[J/OL].Food Science, 2024.https://link.cnki.net/urlid/11.2206.TS.20231229.1420.010.
[27] 吴祥贵, 邸欣, 王鑫, 等.中药材中血管紧张素转化酶抑制剂的筛选及其有效成分预测[J].沈阳药科大学学报, 2016, 33(2):120-126.WU X G, DI X, WANG X, et al.Screening of angiotensin-converting enzyme inhibitors and their efficacy prediction in traditional Chinese medicine[J].China Industrial Economics, 2016, 33(2):120-126.
[28] 李宝生, 杨凯环, 苏建如, 等.不同高粱酿造性能与单粮清香型白酒品质的关联性研究[J].食品与发酵工业, 2021, 47(22):55-62.LI B S, YANG K H, SU J R, et al.Correlation between the brewing performance of different sorghum varieties and the quality of single grain light-aroma Baijiu[J].Food and Fermentation Industries, 2021, 47(22):55-62.
[29] 姚贤泽, 杨生智, 万贤平, 等.不同品种糯高粱酿造小曲清香型白酒差异研究[J].酿酒科技, 2020(8):61-64;69.YAO X Z, YANG S Z, WAN X P, et al.Differences in Qingxiang Xiaoqu Baijiu produced by different varieties of glutinous sorghum[J].Liquor-Making Science &Technology, 2020(8):61-64;69.
[30] 陈良强, 吴群, 徐岩.酱香型白酒低产杂醇油粟酒裂殖酵母特性的研究[J].工业微生物, 2013, 43(3):1-6.CHEN L Q, WU Q, XU Y.Characteristics of low fusel alcohol yielded by Schizosaccharomyces pombe in Maotai-flavor liquor-making[J].Industrial Microbiology, 2013, 43(3):1-6.
[31] 张翠英, 张艳英, 齐亚楠, 等.低产高级醇酿酒酵母工程菌株在小曲酒酿造中的应用[J].酿酒科技, 2013(7):62-64.ZHANG C Y, ZHANG Y Y, QI Y N, et al.Application of a Saccharomyces cerevisiae engineering strain with low-yield of higher alcohols in the production of Xiaoqu liquor[J].Liquor-Making Science &Technology, 2013(7):62-64.
[32] 李秋志, 刘姣, 王国明, 等.不同添加量高产酯低产高级醇酵母菌在芝麻香白酒酿造中的作用[J].现代食品, 2019(10):56-60.LI Q Z, LIU J, WANG G M, et al.Different dosage high ester low yield higher alcohol yeast application in sesame liquor brewing[J].Modern Food, 2019(10):56-60.
[33] KONDO T, TEZUKA H, ISHII J, et al.Genetic engineering to enhance the Ehrlich pathway and alter carbon flux for increased isobutanol production from glucose by Saccharomyces cerevisiae[J].Journal of Biotechnology, 2012, 159(1-2):32-37.
[34] YOSHIMOTO H, FUKUSHIGE T, YONEZAWA T, et al.Pyruvate decarboxylase encoded by the PDC1 gene contributes, at least partially, to the decarboxylation of alpha-ketoisocaproate for isoamyl alcohol formation in Saccharomyces cerevisiae[J].Journal of Bioscience and Bioengineering, 2001, 92(1):83-85.
[35] ATSUMI S, HANAI T, LIAO J C.Non-fermentative pathways for synthesis of branched-chain higher alcohols as biofuels[J].Nature, 2008, 451(7174):86-89.
[36] LIANG Z C, HE B, LIN X Z, et al.Effect of ADH7 gene loss on fusel oil metabolism of Saccharomyces cerevisiae for Huangjiu fermentation[J].LWT, 2023, 175:114444.
[37] VIDAL E E, DE BILLERBECK G M, SIM ES D A, et al.Influence of nitrogen supply on the production of higher alcohols/esters and expression of flavour-related genes in cachaça fermentation[J].Food Chemistry, 2013, 138(1):701-708.
ES D A, et al.Influence of nitrogen supply on the production of higher alcohols/esters and expression of flavour-related genes in cachaça fermentation[J].Food Chemistry, 2013, 138(1):701-708.
[38] 柳新宇, 石韶琦, 武宇昊, 等.果蔬发酵酒中高级醇的研究进展[J].中国果菜, 2020, 40(12):19-23;28.LIU X Y, SHI S Q, WU Y H, et al.Research progress of higher alcohols in fermented wine of fruits and vegetables[J].China Fruit &Vegetable, 2020, 40(12):19-23;28.
[39] 朱会霞. 发酵条件对葡萄酒中高级醇的影响研究[J].酿酒科技, 2013(4):50-52.ZHU H X.Study on the effects of fermenting conditions on higher alcohols content in grape wine[J].Liquor-Making Science &Technology, 2013(4):50-52.
[40] 郭辉祥, 冯平, 王东, 等.固态白酒中杂醇油分布规律与工艺关联性解析[J].酿酒科技, 2018(11):53-58.GUO H X, FENG P, WANG D, et al.Distribution rules and technical correlations of fusel oil in Baijiu by solid-state fermentation[J].Liquor-Making Science &Technology, 2018(11):53-58.
[41] 黄志久, 张宿义, 童文华, 等.白酒酿造过程中高级醇的产生及控制技术研究进展[J].酿酒, 2022, 49(2):19-24.HUANG Z J, ZHANG S Y, TONG W H, et al.The research progress of production and control technology of higher alcohols in the brewing process of Baijiu[J].Liquor Making, 2022, 49(2):19-24.
[42] 罗惠波, 卫春会, 宗绪岩, 等.响应面法优化桑葚酒低产高级醇发酵条件的研究[J].酿酒科技, 2013(1):85-88.LUO H B, WEI C H, ZONG X Y, et al.Optimization of the fermenting conditions of mulberry wine by response surface method for low-yield of higher alcohols[J].Liquor-Making Science &Technology, 2013(1):85-88.
[43] 于涛. 苹果酒工艺条件优化及高级醇生成控制的研究[D].济南:山东轻工业学院, 2012.YU T.Study on the optimizing technology and control of formation of higher alcohol during cider fermentation[D].Jinan:Shandong Institute of Light Industry, 2012.