番茄是茄科番茄属的草本植物,在我国新疆、内蒙古地区种植面积最广。新疆番茄酱出口量约占全球贸易总量的1/4,番茄酱占新疆所有番茄加工品出口的95%左右[1]。番茄酱在加工过程中产生大量皮渣,约占加工用料的40%[2]。番茄皮渣中含有丰富的功能成分,如果胶、番茄红素、膳食纤维等。然而目前这些副产物常用作动物饲料进行低值化利用,造成极大资源浪费[3]。
果胶是一种酸性杂多糖,主要存在于植物的初生细胞壁和胞间层中[4]。果胶主要由α-1,4-糖苷键连接的半乳糖醛酸主链,还含有鼠李糖、半乳糖、甘露糖、岩藻糖、果糖等组成的侧链。果胶主要包括3个结构域:聚半乳糖醛酸(homogalacturonan, HG)、鼠李糖半乳糖醛酸聚糖I型(RG-I)、鼠李糖半乳糖醛酸聚糖Ⅱ型(RG-Ⅱ)。HG是果胶的主要结构,由线性半乳糖醛酸链组成。RG-I型由鼠李糖和半乳糖醛酸组成的二糖单元重复连接,鼠李糖O-4位被阿拉伯聚糖或半乳聚糖替代。RG-Ⅱ主要由线性半乳糖醛酸链组成,侧链为鼠李糖、半乳糖、岩藻糖、木聚糖组成的杂多糖[5]。
不同来源的果胶结构和理化性质不同,其应用品质如流变学性质和凝胶性质也不同。果胶可用作增稠剂、凝胶剂和乳化剂等,还具有抗氧化、调节免疫和抗癌等生理活性,广泛应用于食品、医药和化妆品等领域[6]。目前商业果胶主要来源于苹果皮渣、柑橘皮渣和甜菜浆等。我国每年消耗的果胶超过1 500 t,其中80%以上依靠进口[7]。
番茄皮渣中果胶含量丰富,具有很好的开发价值和应用前景。目前对番茄皮渣果胶的研究主要集中于绿色高效提取技术的研发[8-10],然而番茄果胶与商品果胶的性质结构和应用品质的比较鲜见报道。本研究以柑橘果胶和苹果果胶为对照,研究番茄果胶理化性质、结构特征和流变学性质,以期为番茄皮渣的高值化利用提供参考。
1 材料与方法
1.1 材料与试剂
苹果果胶(货号:93854),Sigma-Aldrich公司;柑橘果胶,衢州果胶有限公司;番茄皮渣,来自中粮屯河昌吉番茄制品有限公司,为番茄酱加工废弃物,经自然晾晒后打粉备用。
无水乙醇、浓硫酸、硝酸钠、三氟乙酸、乳糖、咔唑试剂、酚酞、氢氧化钠、盐酸、氯仿、磷酸盐缓冲液、柠檬酸缓冲液(分析纯),北京化工厂;溴化钾(光谱纯),天津市光复精细化工研究所;甲醇、乙腈(色谱纯),上海赛默飞世尔科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(色谱纯)、葡聚糖标准品,西格玛奥德里奇贸易有限公司。
1.2 仪器与设备
Sigma 3-18K冷冻离心机,德国Sigma公司;SalvisLab VC-50真空干燥烘箱,瑞士 Renggli AG 公司;CM-700D分光测色仪,日本Konica Minolta公司;UV-1800紫外分光光度计,日本Shimazu有限公司;Agilent LC1200高效液相色谱仪,美国安捷伦科技有限公司;EFAA DC12氮吹仪,上海安谱公司;尼高力6700型傅里叶变换红外光谱仪,美国Thermo Fisher Scientific公司;AR1500ex流变分析仪,美国TA Instruments公司。
1.3 实验方法
1.3.1 番茄果胶的制备
采用传统水浴提取法制备番茄果胶。将番茄皮渣加入预热至85 ℃的pH值为1.4的提取液中,料液比为1∶50(g∶mL),85 ℃水浴振荡提取90 min,冷却后离心取上清液(10 000 r/min,20 min,18 ℃)。向上清液加入2倍体积的95%(体积分数)乙醇溶液,静置过夜使果胶充分析出。用400目滤布过滤分离果胶沉淀,分别使用70%、90%乙醇溶液和无水乙醇对果胶清洗处理,重复2次,用以除去色素和游离糖,清洗后40 ℃真空干燥4 h,得到番茄果胶样品。
1.3.2 商品果胶的纯化
为除去商品果胶中的杂质,对苹果果胶和柑橘果胶进行纯化。使用去离子水配制1%(质量分数)的果胶溶液,加入2倍体积的95%乙醇溶液,静置过夜使果胶充分析出。用400目滤布过滤分离果胶沉淀,分别使用70%、90%乙醇溶液和无水乙醇对果胶清洗处理,重复2次,除去色素和游离糖,清洗后40 ℃真空干燥4 h,得到纯化后的果胶。
1.3.3 基本理化指标
1.3.3.1 色泽
用分光测色仪测定果胶样品的色泽[11]。
1.3.3.2 半乳糖醛酸含量
采用咔唑-硫酸法测定半乳糖醛酸含量。取2 mg果胶样品加入10 mL水溶解,向5 mL果胶样品中加入3 mL浓硫酸,在沸水浴中加热10 min后迅速冷却,加入0.5 mL 0.15%咔唑试剂,静置30 min后采用分光光度计测量530 nm处的吸光度[12]。
1.3.3.3 酯化度
采用滴定法测定果胶酯化度。取0.01 g果胶样品和0.1 g NaCl,加入10 mL水溶解并搅拌1 h,加入酚酞,用0.1 mol/L的NaOH滴定至粉红色记录体积V1,加入15 mL 0.25 mol/L 的NaOH搅拌30 min后加入15 mL 0.25 mol/L HCl混匀,用0.1 mol/L NaOH再次滴定记录体积V2,通过公式(1)计算酯化度[13]:
酯化度![]()
(1)
式中:V1,样品溶液的初滴定度,mL;V2,样品溶液的皂化滴定度,mL。
1.3.3.4 分子质量分布
采用高效液相-凝胶渗透色谱法测定果胶的分子质量分布。采用示差折光检测器(refractive index detector,RID)和OHpak SB-804HQ柱,流动相为0.1 mol/L硝酸钠溶液,进样体积20 μL,流速0.45 mL/min,柱温35 ℃。配制葡聚糖标准溶液,根据标准曲线计算果胶样品的峰位分子质量[14]。
1.3.3.5 单糖组成
采用高效液相色谱法测定果胶样品的单糖组成。取2 mg果胶样品添加2 mL 2 mol/L三氟乙酸置于110 ℃条件下水解8 h,冷却至室温后氮吹仪吹干,添加甲醇吹干,重复2次,吹干后加入纯水混匀,加入NaOH溶液、乳糖、1-苯基-3-甲基-5-吡唑啉酮混匀,70 ℃水浴30 min,加入盐酸溶液和氯仿萃取,重复2次,过滤后用高效液相色谱仪分析。色谱柱:ZORBAX Eclipse XDB-C18分离柱(4.6 mm×250 mm,5 μm);流动相A相:15%(体积分数)乙腈+0.05 mol/L 磷酸盐缓冲溶液(pH 6.9);B相:40%(体积分数)乙腈+0.05 mol/L磷酸盐缓冲溶液(pH 6.9);检测器波长为250 nm,柱温25 ℃,流速1.0 mL/min,进样体积为20 μL[15]。
1.3.3.6 傅立叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)
将3~5 mg干燥果胶粉末和200 mg干燥溴化钾粉末在研钵中研磨均匀,制成透明压片,用傅里叶红外光谱仪在400~4 000 cm-1范围内进行光谱扫描[16]。
1.3.4 流变学性质
1.3.4.1 静态流变学性质
a)表观黏度
用0.1 mol/L pH 3.0的柠檬酸缓冲液将样品果胶配制成2%的果胶溶液,采用AR1500型流变分析仪测定不同来源果胶的表观黏度,峰值保持模式,锥板60 mm 2°,温度25 ℃,剪切速率100 s-1,测试时间1 min,间隔时间10 s [17]。
b)黏流活化能
不同来源果胶水溶液的表观黏度随温度变化的情况采用AR1500型流变仪进行分析。1%(质量分数)的果胶水溶液用0.1 mol/L pH 3.0的柠檬酸缓冲溶液配制。测定条件:稳态剪切模式,锥板60 mm 2°,间隙53 μm,温度变化范围20~40 ℃,剪切速率10 s-1。利用Arrhenius方程对结果进行拟合,根据公式(2)计算黏流活化能:
(2)
式中:ηa为表观黏度,Pa·s;Aη为预指数常数,Pa·s;Ea为黏流活化能,kJ/mol;R表示通用气体常数,kJ/(mol·K),T为绝对温度,K。
c)流变特性
不同来源果胶的流变特性采用AR1500型流变分析仪进行分析[17]。用柠檬酸缓冲溶液将样品果胶配制成2%的果胶水溶液,用流变分析仪测定不同来源果胶的黏度和剪切应力随剪切速率变化的情况,采用稳态模式,锥板60 mm 2°,温度25 ℃,剪切速率变化范围1~100 s-1,变量扫描为对数模式。
1.3.4.2 动态黏弹性
采用AR1500流变仪进行流变学分析,配制20 g/L的果胶溶液,加热至90 ℃,与CaCl2溶液混合至果胶质量浓度为10 g/L,Ca2+质量浓度为0.3 g/L,采用60 mm平行钢板,间隙1 mm,频率扫描和温度扫描前进行应变扫描试验,确定线性黏弹性范围,所有振荡试验的应力为5%(在线性黏弹性应变范围内)[18]。
1.4 数据统计分析
所有试验均重复3次,数据处理应用SPSS 26和Origin 2021数据处理软件进行方差分析和绘图。
2 结果与分析
2.1 色泽
色泽是影响果胶应用的重要指标。由表1可知,与苹果果胶和柑橘果胶相比,番茄果胶的L*值、a*值和C*显著较低;番茄果胶的b*值低于苹果果胶,大于柑橘果胶,表明番茄果胶色泽偏暗,颜色较浅。
表1 不同来源果胶的色泽
Table 1 Color of pectins from different sources

样品L∗a∗b∗C∗番茄果胶32.00±0.00c-0.01±0.02b0.20±0.02b0.20±0.02c苹果果胶33.23±0.02b0.40±0.01a3.30±0.01a3.32±0.02a柑橘果胶33.53±0.02a0.42±0.01a-0.55±0.02c0.69±0.02b
注:数值为平均值±标准差(SD) (n = 3);不同的小写上标字母表示差异有统计学意义(P<0.05)(下同)。
2.2 酯化度和半乳糖醛酸含量
酯化度是指酯化的半乳糖醛酸残基占总半乳糖醛酸总量的百分含量。果胶根据酯化度的不同分为高酯果胶和低酯果胶,高酯果胶指酯化度高于50%的果胶,酯化度低于50%的果胶称为低酯果胶。如表2所示,苹果果胶和柑橘果胶的酯化度分别为(55.93±1.67)%、(69.92±0.87)%,为高酯果胶。番茄果胶的酯化度为(47.40±0.79)%,为低酯果胶。GRASSINO等[19]以罐头厂的番茄皮渣为原料提取番茄果胶,酯化度为81.5%~82.7%。SENGAR等[10]将新鲜番茄进行蒸汽漂烫去皮,提取番茄皮中的果胶,所得果胶的酯化度为59.76%~76%。ZHANG等[20]从黑番茄皮渣中提取果胶,果胶酯化度为20.75%~45.4%。产生这些差异的原因可能是番茄皮渣来源或者原料预处理方式的不同。前人采用漂烫(100 ℃,15 min)[10]、冻干(24 h)[20]等方法对番茄皮渣进行预处理,有效抑制酶活,然后提取果胶;而本研究使用的番茄皮渣来自未经钝酶处理,自然晾晒而成。原料中残留的果胶甲酯酶催化果胶脱酯,因而果胶酯化度较低。
表2 不同来源果胶的酯化度和半乳糖醛酸含量
Table 2 Degree of esterification, GalA content,ηa, and Ea of pectins from different sources
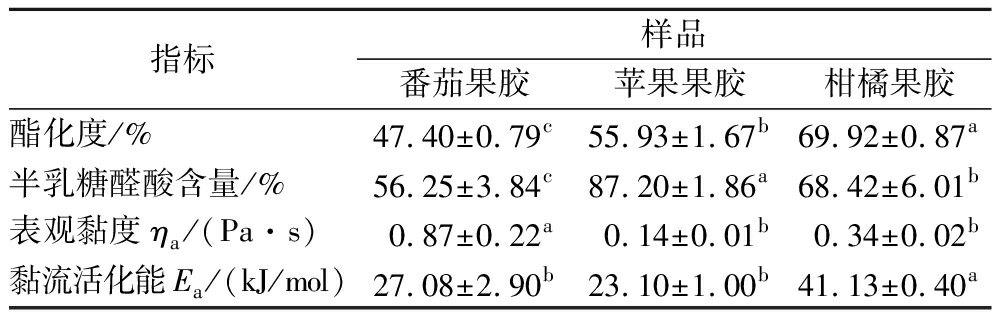
指标样品番茄果胶苹果果胶柑橘果胶酯化度/%47.40±0.79c55.93±1.67b69.92±0.87a半乳糖醛酸含量/%56.25±3.84c87.20±1.86a68.42±6.01b表观黏度ηa/(Pa·s)0.87±0.22a0.14±0.01b0.34±0.02b黏流活化能Ea/(kJ/mol)27.08±2.90b23.10±1.00b41.13±0.40a
果胶主要是由α-糖苷键链接而成的半乳糖醛酸组成,还含有鼠李糖、阿拉伯糖、海藻糖、木糖等单糖。一般用半乳糖醛酸(galacturonic acid,GalA)含量表征果胶的纯度。如表2所示,番茄果胶的GalA含量[(56.25±3.84)%]显著低于苹果果胶[(87.20±1.86)%]和柑橘果胶[(68.42±6.01)%],这说明番茄果胶的聚半乳糖醛酸(HG)含量较少。
2.3 分子质量分布
分子质量是果胶最重要的性质指标之一,与果胶应用品质密切相关。果胶分子质量越高,凝胶性和黏度越高,在食品中的增稠和凝胶效果越好[21]。3种果胶的分子质量分布情况如图1所示,出峰时间越早,分子质量越大。苹果果胶和柑橘果胶均含有2个分子质量级分,而番茄果胶有5个级分组成,说明苹果果胶和柑橘果胶的均一性相对较高。番茄果胶的峰I前出现明显的小峰(峰0),说明番茄果胶中有分子质量较大的组分。由保留时间(表3)可以看出,番茄果胶峰I的出峰时间与苹果果胶和柑橘果胶相比没有显著差异。而峰Ⅱ的出峰顺序为柑橘果胶、番茄果胶和苹果果胶。进一步计算得到3种果胶的峰位分子质量(表3),3种果胶峰I的峰位分子质量没有显著差异,而番茄果胶的峰Ⅱ分子质量介于柑橘果胶和苹果果胶之间。
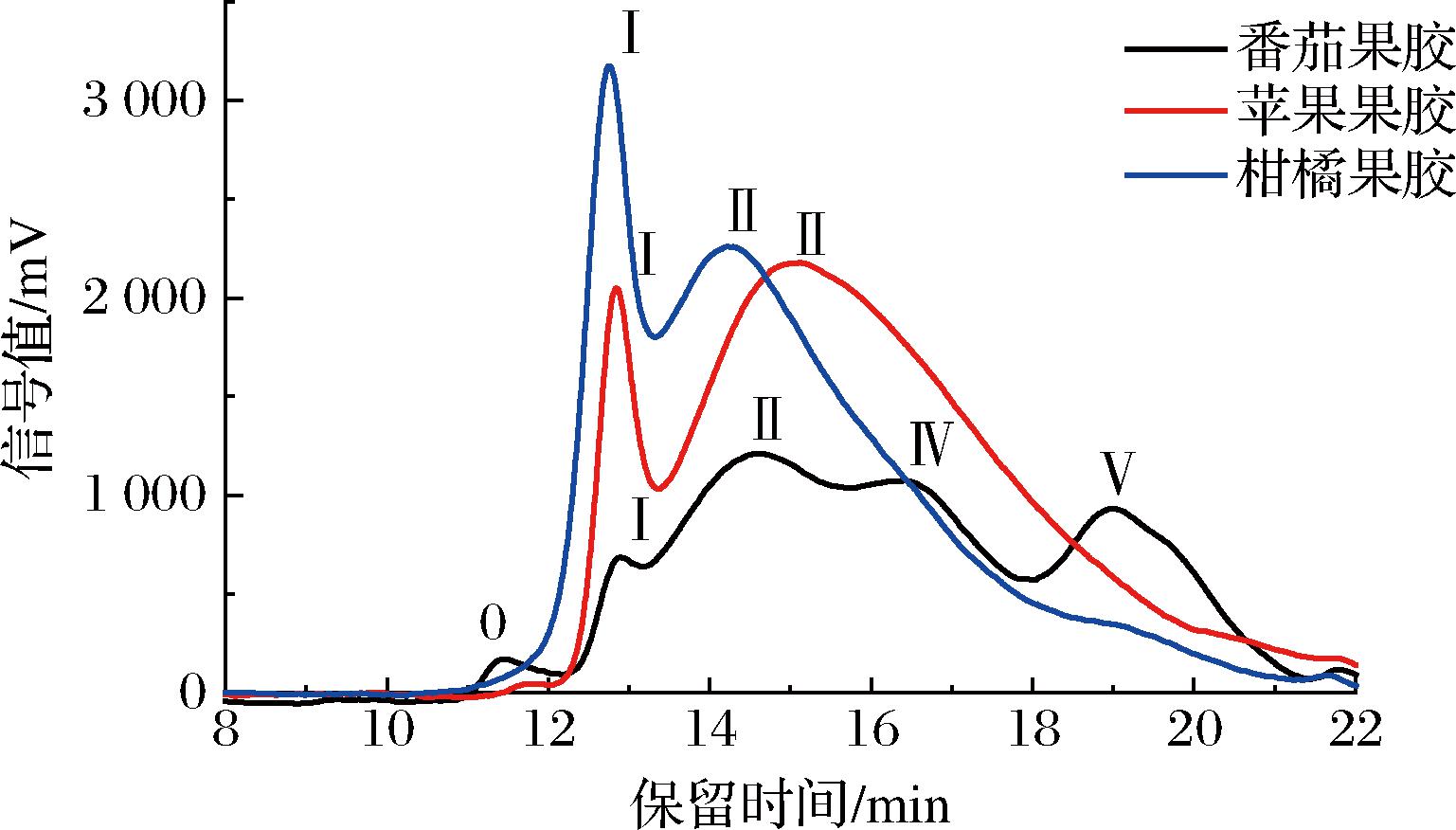
图1 不同来源果胶的分子质量分布
Fig.1 Molar distribution of pectins from different sources
表3 不同来源果胶的保留时间和峰位分子质量
Table 3 Retention time and peak molar mass of pectins from different sources
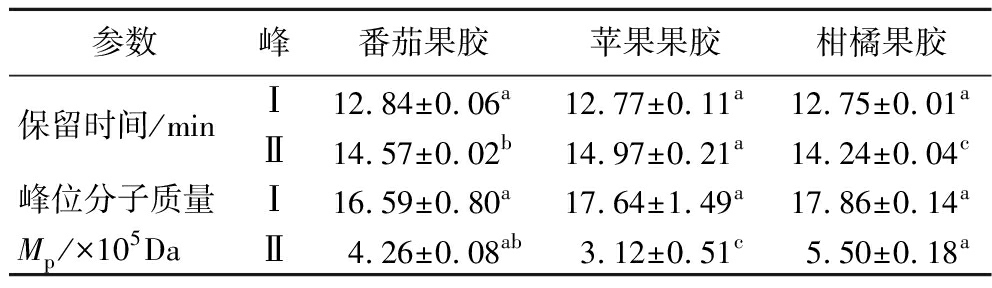
参数峰番茄果胶苹果果胶柑橘果胶保留时间/minⅠ12.84±0.06a12.77±0.11a12.75±0.01aⅡ14.57±0.02b14.97±0.21a14.24±0.04c峰位分子质量Ⅰ16.59±0.80a17.64±1.49a17.86±0.14aMp/×105DaⅡ4.26±0.08ab3.12±0.51c5.50±0.18a
2.4 FT-IR
采用傅里叶变换红外光谱法对不同来源果胶的官能团组成进行分析比较,结果如图2所示。3种果胶在400~4 000 cm-1范围内具有果胶类化合物的特征吸收峰。为进一步分析将其分为3个区域:1 800~4 000、1 500~1 800、400~1 500 cm-1。
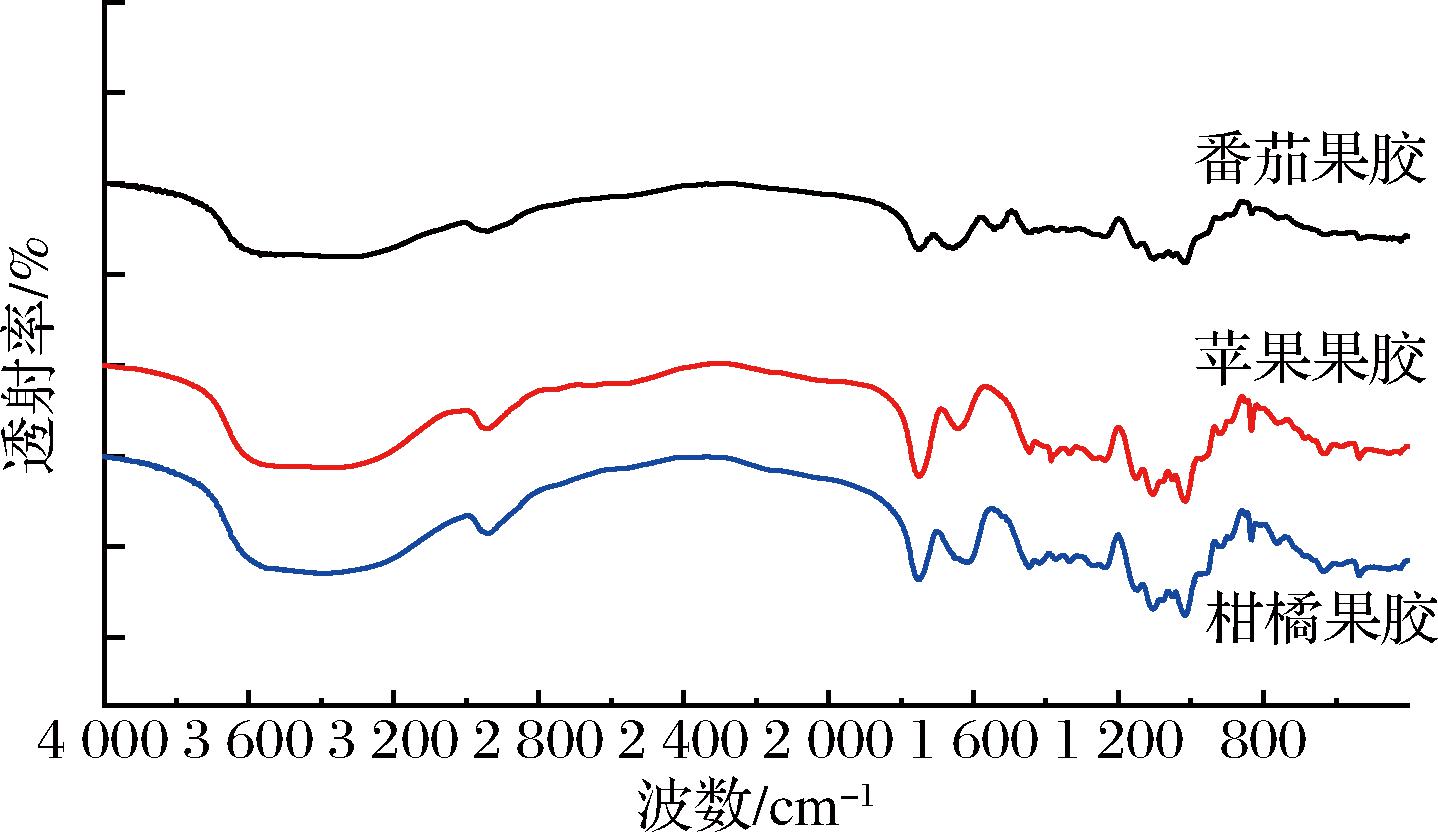
图2 不同来源果胶的傅里叶变换红外光谱
Fig.2 FT-IR spectra of pectins from different sources
在1 800~4 000 cm-1内,主要有2个峰3 455 cm-1和2 935 cm-1,分别是O—H伸缩振动吸收峰和C—H伸缩振动峰,这2个峰是多糖的特征吸收峰[22]。C—H伸缩振动峰(2 800~3 000 cm-1)与更宽的O—H谱带(2 500~3 600 cm-1)重叠。在此区域内,3种果胶没有显著性差异。
1 500~1 800 cm-1内有2个相对较强的吸收峰1 749 cm-1和1 630 cm-1,1 749 cm-1是酯基(COOCH3)和羧基(COOH)的C![]() O 伸缩振动,1 630 cm-1对应羧酸根离子(COO-)的C
O 伸缩振动,1 630 cm-1对应羧酸根离子(COO-)的C![]() O伸缩振动。很多研究用这2个峰计算果胶酯化度,酯化度越低,1 749 cm-1的峰高或峰面积越低或越小,而1 630 cm-1峰高或峰面积越高或越大[16,23]。由图3可知,苹果果胶和柑橘果胶1 749 cm-1和1 630 cm-1吸收强度的比值显著大于番茄果胶,说明苹果果胶和柑橘果胶的酯化程度更高,与酯化度的测定结果一致。
O伸缩振动。很多研究用这2个峰计算果胶酯化度,酯化度越低,1 749 cm-1的峰高或峰面积越低或越小,而1 630 cm-1峰高或峰面积越高或越大[16,23]。由图3可知,苹果果胶和柑橘果胶1 749 cm-1和1 630 cm-1吸收强度的比值显著大于番茄果胶,说明苹果果胶和柑橘果胶的酯化程度更高,与酯化度的测定结果一致。

a-黏度;b-剪切应力
图3 不同来源果胶溶液黏度和剪切应力随剪切速率的变化曲线
Fig.3 Changes in viscosity and shear stress as a function of shear rate of pectin solutions from different sources
400~1 500 cm-1为碳水化合物的特征指纹区。900~1 200 cm-1对应糖苷键和吡喃环的骨架C—O和C—C振动。2种果胶均有1 140、1 108、1 018 cm-1 3个峰,分别对应C—O伸缩振动、呋喃糖、吡喃糖,说明这3种果胶的单糖组成大体相同。在此区域中,3种果胶没有显著性差异。
2.5 单糖组成
单糖组成反映果胶的结构特征,对果胶的性质和生物活性具有重要影响。如表4所示,3种果胶的单糖组成具有显著差异,苹果果胶和柑橘果胶的半乳糖醛酸含量显著大于番茄果胶,与前面的硫酸咔唑法测定结果一致。除了岩藻糖(fucose,Fuc)外,其他单糖含量具有显著差异。其中,番茄果胶的甘露糖、鼠李糖和半乳糖含量显著较大,苹果果胶的葡萄糖和木聚糖含量较高,柑橘果胶的阿拉伯糖含量较高。通过计算,得到果胶线性化程度GalA/(Rha+Ara+Gal),苹果果胶的线性化程度最高,其次为柑橘果胶。Rha/GalA 表征果胶RG结构与HG结构的比例。番茄果胶的Rha/GalA值最大,说明番茄果胶的RG结构比例相对较高,其次为柑橘果胶和苹果果胶。(Ara+Gal)/Rha表征果胶RG-I结构的支链分支程度。3种果胶中,柑橘果胶的RG-I结构的分支程度最大,番茄果胶的分支程度最小。单糖组成结果说明番茄果胶的RG-I结构含量较高但分支化程度较低。RG-I结构的侧链分支有利于果胶分子间的相互作用和凝胶结构的形成[24]。
表4 不同来源果胶的单糖组成
Table 4 Monosaccharide composition of pectins from different sources

指标番茄果胶苹果果胶柑橘果胶甘露糖Man/mol%5.24±0.35a0.76±0.17b1.28±0.01b鼠李糖Rha/mol%14.69±0.40a7.90±0.05c9.91±0.23b葡萄糖Glu/mol%4.19±0.03b6.91±0.08a3.01±0.05c半乳糖Gal/mol%24.1±0.27a11.21±0.29c22.13±0.69b木聚糖Xyl/mol%2.02±0.06b7.20±0.24a0.87±0.01c阿拉伯糖Ara/mol%4.10±0.04c5.14±0.19b5.39±0.51a岩藻糖Fuc/mol%0.48±0.01b0.63±0.01a0.46±0.04b半乳糖醛酸GalA/mol%45.17±0.95c60.26±0.90a56.95±0.95bGalA/(Rha+Ara+Gal)1.05±0.04c2.49±0.08a1.52±0.06bRha/GalA0.33±0.02a0.13±0.00c0.17±0.00b(Ara+Gal)/Rha1.92±0.04b2.07±0.07b2.78±0.19a
2.6 流变学性质
2.6.1 静态流变学性质
如图3-a和图3-b所示,剪切速率越大果胶溶液的黏度越低,表明3种果胶均为剪切变稀的假塑性流体。采用Origin软件对剪切应力-剪切速率的流变特性曲线进行Herschel-bulkley模型拟合,拟合结果如表5所示,R2值均大于0.95,说明相关性较好。番茄果胶和苹果果胶、柑橘果胶的流变特性指数n和稠度系数k具有显著的差异,番茄果胶的稠度系数高于苹果果胶和柑橘果胶,说明其黏度较高增稠性较好。3种果胶的流变特性指数均小于1,说明果胶溶液在此条件下表现为非牛顿流体中剪切变稀的假塑性流体,苹果果胶和柑橘果胶的流变特性指数接近1,说明这2种果胶溶液更接近牛顿流体性质。ηa为剪切速率为0.1时的表观黏度,如表2所示,番茄果胶的表观黏度(0.87 Pa·s)显著大于柑橘果胶(0.34 Pa·s)和苹果果胶(0.14 Pa·s),说明番茄果胶的黏度更高,增稠性更好,柑橘果胶次之,苹果果胶的黏度最低。
表5 不同来源果胶溶液的流变特性指数和稠度系数
Table 5 Rheological property index and consistency coefficient of apparent viscosity of pectin solutions from different sources
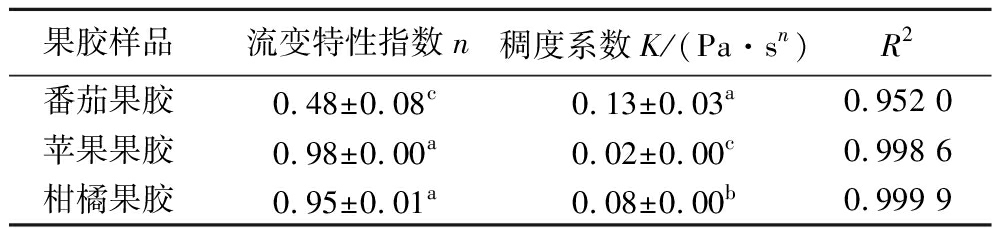
果胶样品流变特性指数n稠度系数K/(Pa·sn)R2番茄果胶0.48±0.08c0.13±0.03a0.952 0苹果果胶0.98±0.00a0.02±0.00c0.998 6柑橘果胶0.95±0.01a0.08±0.00b0.999 9
注:数值为均数±标准差(SD)(n=3),每列内不同小写上标字母表示差异有统计学意义(P<0.05)。
2.6.2 动态黏弹性
果胶多糖溶液具有黏性和弹性的双重特性,能够反映聚合物的凝胶性质。在线性黏弹区域范围内,储能模量(G′)与样品的弹性行为有关,损耗模量(G″)归因于黏性行为,通过对两者关系的考察,可以反映样品的原始结构形态。损耗角正切(tanδ)是低频振荡下G″与G′的比值,是评估动态流变性质的另一个重要的指标。tanδ值越大则表示样品的流动性越好,tanδ越小则表示样品的凝胶性越好。
图4-a和图4-b为3种果胶凝胶G′和G″随频率变化的关系图,所有样品的G′均大于G″,且均随着频率的增加而增加,表现出良好的频率依赖性,属于典型的多聚物凝胶动态黏弹性变化特征,说明样品具有凝胶特性[25]。番茄果胶的G′和G″最大,说明番茄果胶分子间相互作用更强,形成的凝胶黏弹性更强。如图4-c所示,随着角频率的增加,3种果胶的tanδ值逐渐降低,说明果胶溶液体系凝胶网络结构逐渐增强,胶凝性增强,表现出更有弹性的流动性质。番茄果胶和柑橘果胶的tanδ值没有显著差异,均大于苹果果胶,说明番茄果胶和柑橘果胶形成的凝胶在较低频率下主要表现为黏性特征。
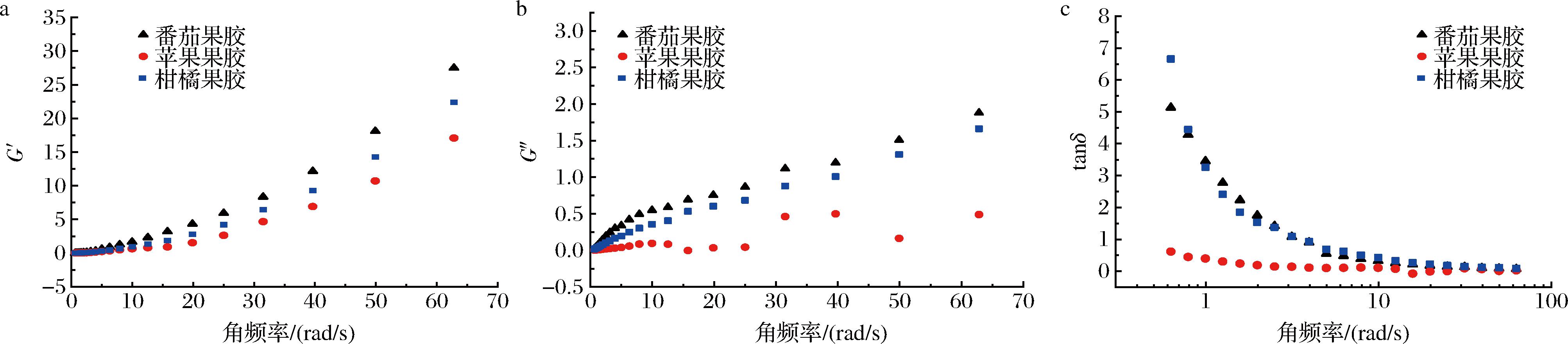
a-G′;b-G″;c-tanδ
图4 不同来源果胶溶液G′, G″和tanδ随频率的变化曲线
Fig.4 Frequency depedence of G′, G″, and tanδ of pectin solutions from different sources
图5为3种果胶凝胶降温过程中G′和G″的变化情况。在降温过程中,番茄果胶和柑橘果胶的G′和G″显著升高,苹果果胶变化平缓。说明前2种果胶凝胶降温过程中网络结构逐渐增强,胶凝性增强。3种果胶的tanδ值均小于1,说明3种果胶凝胶主要表现为弹性特征。在降温过程中,3种果胶的tanδ值均增加,柑橘果胶和番茄果胶的变化趋势更明显,说明前2种果胶在凝胶结构形成过程中黏性特性变化更大。
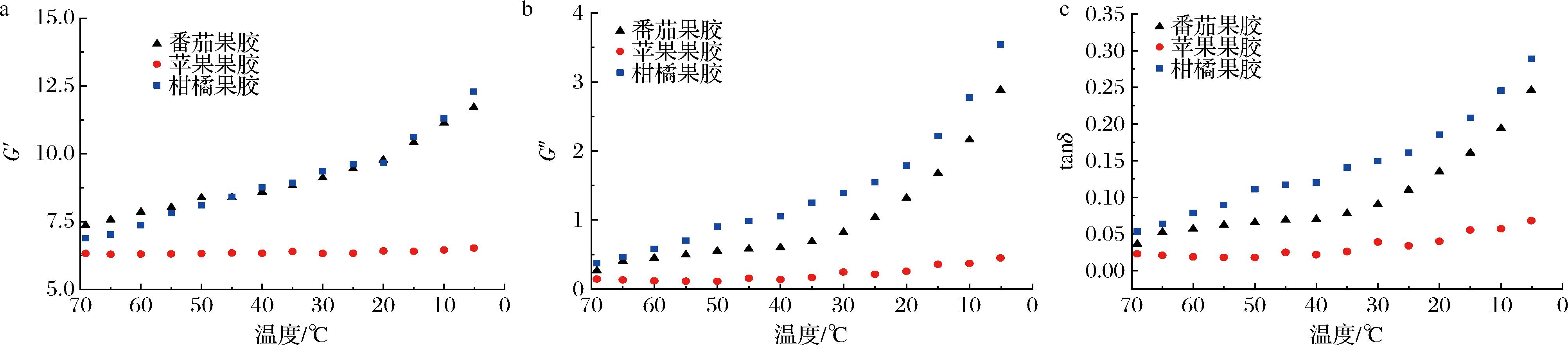
a-G′;b-G″;c-tanδ
图5 不同来源果胶溶液G′、G″和tanδ随温度的变化曲线
Fig.5 Temperature depedence of G′, G″, and tanδ of pectin solutions from different sources
3 结论
a)本研究对番茄皮渣果胶结构特性和流变学性质进行了研究。结果表明,番茄果胶的半乳糖醛酸含量为56.25%,酯化度为47.40%,属于低酯果胶。番茄果胶的颜色较浅,呈淡黄色。番茄果胶的中性糖组成占比从高到低依次为半乳糖、鼠李糖、甘露糖、葡萄糖、阿拉伯糖和岩藻糖,其RG-I含量较高,但RG-I区域的分支化度较低。
b)番茄果胶属于非牛顿流体中的假塑性流体,具有剪切变稀的现象。其表观黏度较高,黏流活化能显著小于柑橘果胶,说明番茄果胶的黏度较高且具有较好的温度稳定性。在动态流变学实验中,番茄果胶的储能模量大于损耗模量,说明其更多的表现为弹性而非黏性。番茄果胶的储能模量和损耗模量大于柑橘果胶和苹果果胶,说明其黏弹性更高。
[1] 李凯, 谭丹.新疆番茄产业国际竞争力分析[J].现代商业, 2018 (35):65-68.LI K, TAN D.Analysis on international competitiveness of tomato industry in Xinjiang[J].Modern Business, 2018(35):65-68.
[2] NOBRE B P, PALAVRA A F, PESSOA F L P, et al.Supercritical CO2 extraction of trans-lycopene from Portuguese tomato industrial waste[J].Food Chemistry, 2009, 116(3):680-685.
[3] 张学杰, 郭科, 苏艳玲.果胶研究新进展[J].中国食品学报, 2010, 10(1):167-174.ZHANG X J, GUO K, SU Y L.A review on the recent advance in pectin research[J].Journal of Chinese Institute of Food Science and Technology, 2010, 10(1):167-174.
[4] 杨宇华, 徐晓斌, 黄佳艳.响应面法优化超声波辅助提取沃柑皮中果胶工艺研究[J].中国食品添加剂, 2022, 33(4):55-62.YANG Y H, XU X B, HUANG J Y.Optimization of ultrasonic-assisted extraction of pectin from Orah peel by response surface methodology[J].China Food Additives, 2022, 33(4):55-62.
[5] PADMA I S, SANDHYA R, NISHA P.Advances and prospects in the food applications of pectin hydrogels[J].Critical Reviews in Food Science and Nutrition, 2022, 62(16):4393-4417.
[6] 许文婷, 吴金妮, 罗静雯, 等.超声波辅助木聚糖酶法提取沃柑皮果胶的工艺优化[J].粮食与油脂, 2023, 36(8):78-82.XU W T, WU J N, LUO J W, et al.Optimization of ultrasound-assisted xylanase extraction of pectin from Orah peel[J].Cereals &Oils, 2023, 36(8):78-82.
[7] 徐仰仓, 赵炳赫, 衣丽霞, 等.果胶的结构、提取及应用研究进展[J].福建技术师范学院学报, 2021, 39(5):437-442.XU Y C, ZHAO B H, YI L X, et al.Research progress on the structure, extraction and application of pectin[J].Journal of Fujian Polytechnic Normal University, 2021, 39(5):437-442.
[8] GRASSINO A N, ![]() D, et al.Ultrasound assisted extraction and characterization of pectin from tomato waste[J].Food Chemistry, 2016, 198:93-100.
D, et al.Ultrasound assisted extraction and characterization of pectin from tomato waste[J].Food Chemistry, 2016, 198:93-100.
[9] MORALES-CONTRERAS B E, ROSAS-FLORES W, CONTRERAS-ESQUIVEL J C, et al.Pectin from husk tomato (Physalis ixocarpa brot.):Rheological behavior at different extraction conditions[J].Carbohydrate Polymers, 2018, 179:282-289.
[10] SENGAR A S, RAWSON A, MUTHIAH M, et al.Comparison of different ultrasound assisted extraction techniques for pectin from tomato processing waste[J].Ultrasonics Sonochemistry, 2020, 61:104812.
[11] LI Z X, ZHANG J R, ZHANG H, et al.Effect of different processing methods of hawthorn on the properties and emulsification performance of hawthorn pectin[J].Carbohydrate Polymers, 2022, 298:120121.
[12] 周宏炫, 谭书明, 陈萍, 等.炮制法对三叶木通果皮果胶提取及理化性质的影响[J].食品与生物技术学报, 2022, 41(3):75-82.ZHOU H X, TAN S M, CHEN P, et al.Effects of processing methods on extraction and physicochemical properties of pectin from Akebia trifoliata peel[J].Journal of Food Science and Biotechnology, 2022, 41(3):75-82.
[13] 吴韧, 刘爽, 马宽, 等.豆腐柴果胶多糖理化指标及乳化性质[J].食品与发酵工业, 2024,50(9):174-181.WU R, LIU S, MA K, et al.Physicochemical indexes and emulsification properties of pectin polysaccharide from Premna microphylla Turcz[J].Food and Fermentation Industries, 2024,50(9):174-181.
[14] RAMOS-AGUILAR O P, DE ![]() ORNELAS-PAZ J D, RUIZ-CRUZ S, et al.Effect of ripening and heat processing on the physicochemical and rheological properties of pepper pectins[J].Carbohydrate Polymers, 2015, 115:112-121.
ORNELAS-PAZ J D, RUIZ-CRUZ S, et al.Effect of ripening and heat processing on the physicochemical and rheological properties of pepper pectins[J].Carbohydrate Polymers, 2015, 115:112-121.
[15] LIU H Y, DENG L Z, DAI T T, et al.Emulsifying and emulsion stabilization mechanism of pectin from Nicandra physaloides (linn.) gaertn seeds:Comparison with apple and citrus pectin[J].Food Hydrocolloids, 2022, 130:107674.
[16] LIU X, LIU J N, BI J F, et al.Effects of high pressure homogenization on pectin structural characteristics and carotenoid bioaccessibility of carrot juice[J].Carbohydrate Polymers, 2019, 203:176-184.
[17] FEI X, JONES O G, REUHS B L, et al.Soluble pectin acts as a particle stabilizer of tomato suspensions:The impact on tomato products rheological characterization[J].LWT, 2021, 139:110508.
[18] SOUSA A G, NIELSEN H L, ARMAGAN I, et al.The impact of rhamnogalacturonan-I side chain monosaccharides on the rheological properties of citrus pectin[J].Food Hydrocolloids, 2015, 47:130-139.
[19] GRASSINO A N, HALAMBEK J, ![]() S, et al.Utilization of tomato peel waste from canning factory as a potential source for pectin production and application as tin corrosion inhibitor[J].Food Hydrocolloids, 2016, 52:265-274.
S, et al.Utilization of tomato peel waste from canning factory as a potential source for pectin production and application as tin corrosion inhibitor[J].Food Hydrocolloids, 2016, 52:265-274.
[20] ZHANG W, XIE F, LIU X H, et al.Pectin from black tomato pomace:Characterization, interaction with gallotannin, and emulsifying stability properties[J].Starch-Stärke, 2019, 71(3-4):1800172.
[21] ZHI Z J, CHEN J L, LI S, et al.Fast preparation of RG-I enriched ultra-low molecular weight pectin by an ultrasound accelerated Fenton process[J].Scientific Reports, 2017, 7(1):541.
[22] LI Q Q, LI J, LI H, et al.Physicochemical properties and functional bioactivities of different bonding state polysaccharides extracted from tomato fruit[J].Carbohydrate Polymers, 2019, 219:181-190.
[23] HU X N, MA T, AO L, et al.Effect of high hydrostatic pressure processing on textural properties and microstructural characterization of fresh-cut pumpkin (Cucurbita pepo)[J].Journal of Food Process Engineering, 2020, 43(4):e13379.
[24] ZHENG J Q, CHEN J L, ZHANG H, et al.Gelling mechanism of RG-I enriched citrus pectin:Role of arabinose side-chains in cation- and acid-induced gelation[J].Food Hydrocolloids, 2020, 101:105536.
[25] IKEDA S, NISHINARI K.“Weak gel”-type rheological properties of aqueous dispersions of nonaggregated κ-carrageenan helices[J].Journal of Agricultural and Food Chemistry, 2001, 49(9):4436-4441.