四川泡菜是中国最著名的发酵蔬菜之一,以其丰富的营养和独特的酸香风味深受大众的喜爱,被誉为“川菜之骨”,在国内外享有盛誉[1]。萝卜是四川盆地种植的主要作物之一,制作泡菜是其最重要的贮藏和加工方式,萝卜泡菜的制作和食用距今已有1 500多年历史[2]。
微生物对发酵蔬菜产品品质至关重要,它的生长代谢直接影响泡菜的风味和口感,其代谢产物是泡菜酸香风味的重要来源[3]。以往研究者对泡菜中微生物的关注主要聚焦于乳酸菌:陈功等[4]采用聚合酶链式反应-变性梯度胶凝胶电泳技术研究泡菜优势微生物菌群,初步确定植物乳杆菌、肠膜明串珠菌、短乳杆菌及耐乙醇片球菌等乳酸菌是四川泡菜发酵的优势菌群。XIAO等[5]通过高通量测序对四川泡菜发酵期间微生物多样性和风味化合物动态分析发现Lactobacillus、Leuconostoc、Achromobacter、Pediococcu与风味形成密切相关。RAO等[6]对不同种类四川泡菜的菌群结构分析发现Lactobacillus和Pediococcus是豇豆泡菜的特征微生物,Lactococcus和Fructobacillus是萝卜泡菜的特征微生物。这些研究均表明乳酸菌可能对泡菜发酵过程中的品质稳定具有关键作用。
然而,对直投式乳酸菌菌剂发酵研究表明,单一的乳酸菌发酵其风味不及自然发酵醇厚[7],这说明自然发酵过程中其他菌群对泡菜品质也具有重要作用。张文娟等[8]通过接种不同比例的酿酒酵母发酵泡菜发现酿酒酵母会增加泡菜中酯类物质的种类和相对含量,降低乙醇相对含量,使泡菜的风味更加醇厚协调。王艳等[9]通过研究不同比例乳酸菌和酵母菌对白萝卜泡菜品质的影响发现乳酸菌粉与酵母菌粉按1∶1质量比添加时白萝卜泡菜的pH与亚硝酸盐峰值显著降低,具有较好的产品品质与风味。这些研究表明酵母菌对泡菜品质稳定亦具有重要贡献作用,然而,目前关于酵母菌对泡菜品质的影响研究主要采取加入单一发酵剂的方式,对于母水中本身富含的酵母菌群对泡菜品质的影响研究还鲜有报道。
因此本次实验通过构建无酵母母水体系,对比常规母水体系和无酵母母水体系发酵萝卜汁中的微生物、有机酸含量、理化品质及挥发性风味物质的情况,明确酵母菌对发酵萝卜品质的影响,以期为提高发酵萝卜产品品质稳定性提供理论基础。
1 材料与方法
1.1 材料与试剂
红皮萝卜、小米辣、胡萝卜、仔姜购于成都市锦江区当地菜市场;八角、花椒、久大泡菜盐、干辣椒、太古冰糖购于成都市锦江区当地红旗连锁超市;6 L泡菜坛,购于成都市锦江区当地菜市场。
MRS培养基、孟加拉红培养基,青岛海博生物技术有限公司;氯化钠,成都金山试剂有限公司;3,5-二硝基水杨酸溶液,Codow氪道-广州和为医药科技有限公司;0.1 mol/L氢氧化钠标准溶液,阿拉丁试剂有限公司;硫酸,成都科隆试剂有限公司。
1.2 仪器与设备
SW-CJ-IFD型超净工作台,苏州净化设备有限公司;GHP—9160型隔水式恒温培养箱,上海一恒科学仪器有限公司;LS-75H型立式压力蒸汽灭菌锅,江阴滨江医疗设备有限公司;Synergy HTX型多功能酶标仪,美国BioTek Instruments,Inc.;Centrifuge 5810R型台式冷冻离心机,德国Eppendorf公司;JA5003 N型分析天平,上海佑科仪器仪表有限公司;Seven Compact S210型pH计,梅特勒-托利多仪器(上海)有限公司;PR4202ZH型电子天平,上海奥豪斯仪器有限公司;Metrohm 855全自动滴定仪,瑞士万通有限公司;Agilent 1260型高效液相色谱仪、HP6890/5973气质联用色谱仪,安捷伦科技有限公司;SPME萃取头(50/30 μm DVB/CAR/PDMS),美国Supelco公司。
1.3 实验方法
1.3.1 无酵母/常规母水准备
将2 000 mL老泡菜水均分为2份,向其中一份老泡菜水中加入2%(质量分数)的葡萄糖和0.25 g那他霉素[10],另一份仅加入2%的葡萄糖,置于(25±1) ℃培养箱中进行密封发酵,每日取1 mL泡菜水于孟加拉红培养基中,(30±1) ℃培养72 h,直至加入那他霉素母水孟加拉红培养基上无酵母菌生长,此时泡菜水为无酵母母水/常规母水原液。将母水原液分别与1 000 mL盐度为4%的灭菌盐水混合均匀即为本次实验用无酵母/常规母水。
1.3.2 试验设计
为探究母水中酵母菌群对发酵萝卜品质的影响,排除萝卜本身携带微生物的干扰,故采用灭菌萝卜汁来进行发酵。共设计2组试验,常规母水组(DZ组):100 mL泡菜母水+50 mL灭菌萝卜汁;无酵母母水组(WJM组):100 mL无酵母母水+50 mL灭菌萝卜汁。每组3个平行,置于(25±1) ℃恒温培养箱中静置发酵。取发酵0、1、3、6、9 d泡菜发酵液用于指标测定。
灭菌萝卜汁制备方法:1 000 g红皮萝卜洗净切成小块后与蒸馏水按照1∶1的质量比加入打浆机中进行匀浆处理,用6层纱布过滤出萝卜汁,将萝卜汁煮沸除去上层浮沫,分装到200 mL丝口瓶中进行高压蒸汽灭菌,121 ℃灭菌15 min。
1.3.3 理化指标测定[11]
pH值测定:分别取0、1、3、6、9 d泡菜发酵液10 mL,使用pH计进行测定,pH计用pH值为4.0和pH值为6.8的标准缓冲液进行校正,每组3个平行。
总酸测定:参照GB 12456—2021《食品中总酸的测定》方法中的pH计电位滴定法,用0.1 mol/L氢氧化钠分别对0、1、3、6、9 d泡菜发酵液总酸进行滴定,每组3个平行。
还原糖测定:采用3,5-二硝基水杨酸法进行测定,分别取0、1、3、6、9 d泡菜发酵液1 mL于25 mL比色管中,加入2 mL 3,5-二硝基水杨酸溶液,混合均匀后置于沸水浴中反应3 min后取出立即冷却,用蒸馏水定容至比色管25 mL刻度处,混合均匀后将样品加入96孔板中,于540 nm处用酶标仪测定吸光度,同时用葡萄糖标准溶液制备标准曲线,根据标准曲线公式计算样品还原糖含量,每组3个平行。
1.3.4 有机酸测定[11]
采用高效液相色谱法测定发酵液有机酸含量,每组3个平行。样品预处理:取1 mL泡菜发酵液,10 000×g离心10 min,用0.22 μm滤器过膜置于4 ℃冰箱备用。色谱条件:色谱柱:HPX-87H300×7.8 mm;检测器:紫外检测器;流动相:0.005 mol/L硫酸溶液;流速0.6 mL/min;紫外检测器检测波长215 nm;柱温30 ℃;进样量5 μL。以保留时间定性,以峰面积定量,检测有机酸的含量。
1.3.5 微生物含量测定[11]
无菌条件下取混合均匀的泡菜发酵液于0.9%(质量分数)的生理盐水中进行梯度稀释,选取适宜的样品梯度稀释液,分别取100 μL涂布于MRS培养基和孟加拉红培养基(为确保WJM组未被酵母污染,每次取1 mL未稀释发酵液用孟加拉红平板倾注法进行计数),MRS培养基平板置于厌氧条件下(36±1) ℃培养72 h,计数为乳酸菌数量,孟加拉红培养基平板于(30±1) ℃培养72 h,计数为真菌数量。
1.3.6 挥发性风味物质测定[12]
取5 mL样品于20 mL顶空进样瓶中,加入20 μL浓度为73 μL/mL的辛酸甲酯作为内标,在60 ℃下平衡15 min,萃取45 min后进行上样检测。GC-MS条件:色谱柱:VF-WaxMS(30 m×0.25 mm×0.25 μm);进样口温度270 ℃,不分流进样;升温程序:起始温度40 ℃,保持5 min,然后以4 ℃/min升温至100 ℃,最后以6 ℃/min升温至230 ℃,保持10 min;氦气以1 mL/min流速用做柱载气。数据分析:以NIST08谱库检索为主,辅助人工解析图谱,将各化合物的质谱图与标准谱图相对照,对匹配度>750的物质进行分析。采用保留指数并结合已有文献报道进行物质的定性分析,通过内标法进行物质的相对定量。
1.4 数据处理与统计学分析
采用Microsoft Office Excel 2019对实验数据进行运算和分析,采用Graphpad Prism v9.0.0.121软件进行绘图,并用SPSS 20.0软件分析数据之间的差异显著性,P<0.05为具有显著差异,P<0.01为具有极显著差异,主成分分析(principal component analysis,PCA)和正交偏最小二乘分析(orthogonal partial least squares discrimination analysis,OPLS-DA)采用SIMCA 14.1进行作图。
2 结果与分析
2.1 发酵过程中乳酸菌及酵母菌含量变化
微生物的生长繁殖和相互作用不仅控制着发酵的进程,同时还会产生丰富的营养成分和独特的风味物质[13-14]。为确定母水中酵母菌对泡菜微生物含量的影响,对两组发酵萝卜汁发酵过程中的乳酸菌和酵母菌总数进行测定,结果见图1。由图1-A可知DZ组酵母菌呈现先增加后平稳最后下降的趋势,WJM组酵母菌直至发酵结束均未生长。从图1-B可知,两组处理乳酸菌在发酵过程中总体均呈现先上升后趋于稳定的趋势,这是因为发酵前期萝卜汁为乳酸菌生长提供了丰富的营养物质,使得乳酸菌大量生长繁殖,而后期由于营养物质的消耗以及乳酸的大量积累使其生长受到抑制,因此含量趋于稳定。结合图1-A和图1-B可看出乳酸菌与酵母菌生长存在拮抗作用,发酵前期,酵母菌迅速增长对乳酸菌生长造成抑制,导致DZ组发酵1 d时乳酸菌较发酵0 d未增长,而WJM组发酵1 d较发酵0 d增长了0.67 lg CFU/mL,发酵后期随着营养的消耗和乳酸菌生长,使酵母菌数量呈现下降的趋势。但两组乳酸菌发酵3 d后差异较小,最终都稳定在约7.8 lg CFU/mL,表明母水中的酵母菌对乳酸菌生长的抑制作用主要发生在发酵前期。综上所述,母水中酵母菌与乳酸菌生长存在拮抗作用,酵母菌在发酵初期会抑制乳酸菌的生长,但发酵后期乳酸菌又会反过来抑制酵母菌的生长。
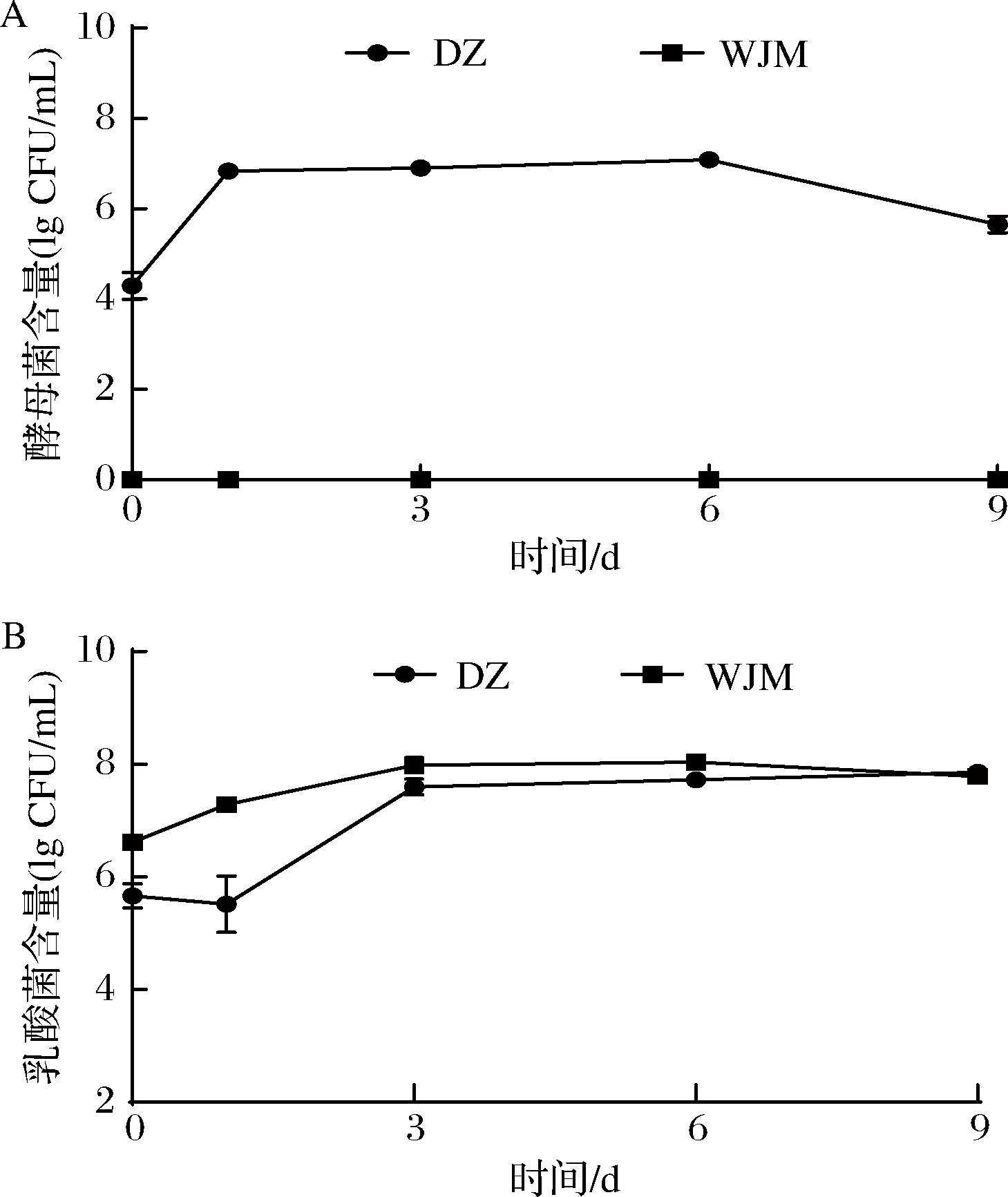
A-酵母菌;B-乳酸菌
图1 DZ与WJM两组在发酵过程中微生物含量变化
Fig.1 Changes of microbial contents in DZ and WJM groups during fermentation
2.2 发酵过程中还原糖、pH及总酸含量的变化
为进一步确定母水中酵母菌对发酵萝卜品质的影响,对其还原糖、pH值和总酸进行测定,结果如图2所示。由图2-A可知,两组处理的还原糖在发酵过程中均呈现下降趋势,处理组间还原糖的消耗速度具有极显著差异(P<0.01),WJM组对还原糖的消耗速度远低于DZ组。结果表明酵母菌的存在会显著促进糖代谢进程,DZ组还原糖的迅速消耗可能会影响乳酸菌代谢产酸。pH值和总酸是影响泡菜风味的重要指标,同时也是反映微生物在特定环境下代谢活动情况的综合参数[15]。由图2-B和图2-C可知,随着发酵的进行,两组处理pH值均呈现下降趋势,WJM组pH值下降趋势强于DZ组。但总酸含量变化趋势不同,WJM组总酸含量呈现持续增长的趋势,而DZ组总酸含量呈现先增加后减少的趋势,发酵3 d后WJM组总酸含量极显著高于DZ组(P<0.01)。结果表明,母水中的酵母菌加快了糖代谢进程,使发酵3 d后乳酸菌没有充足的营养物质代谢产酸,导致DZ组总酸含量极显著低于WJM组,这与张文娟等[8]研究酿酒酵母对萝卜泡菜的影响中总酸的变化情况一致。
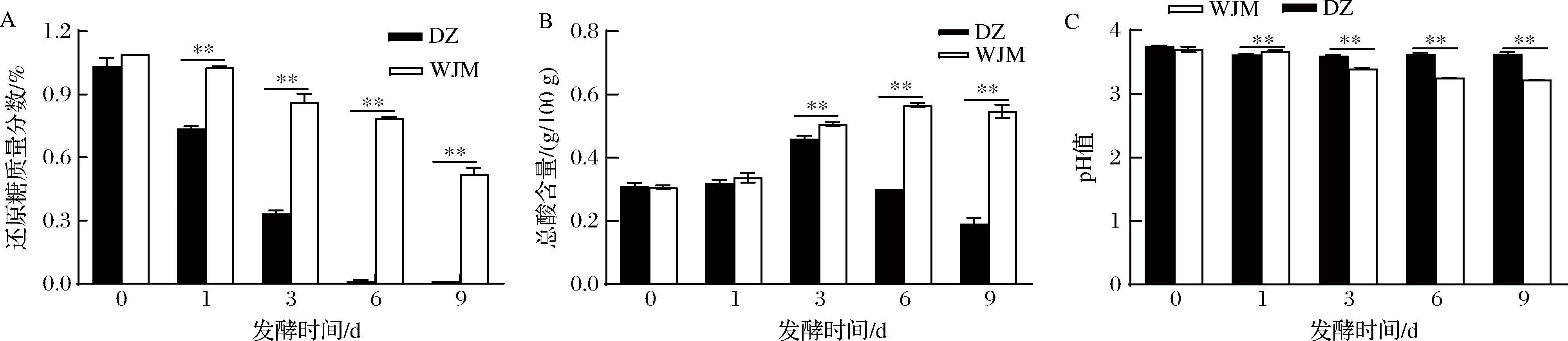
A-还原糖;B-总酸;C-pH值
图2 DZ与WJM两组在发酵过程中理化品质的变化
Fig.2 Changes of physicochemical indexes of DZ and WJM groups during fermentation
注:**代表差异极显著(P<0.01)(下同)。
2.3 发酵过程中有机酸含量的变化
有机酸不仅可以反映泡菜的发酵程度,同时也影响着泡菜的风味和品质,是泡菜品质测定的重要指标之一[16-17]。图3分别表示两组萝卜汁发酵过程中苹果酸(图3-A)、琥珀酸(图3-B)、乳酸(图3-C)及乙酸(图3-D)的含量变化情况。从图3-A、图3-B可以看出,两组发酵萝卜汁苹果酸和琥珀酸含量总体呈现下降的趋势,其中DZ组苹果酸消耗更快,WJM组琥珀酸消耗更快。刘延岭等[18]研究提出酵母菌可通过苹果酸-乙醇发酵将苹果酸转化为乙醇,这可能是DZ组苹果酸消耗较快的原因。本实验琥珀酸的变化与王芮东等[19]的研究结果相似,但由于本实验是发酵萝卜汁,不存在后续渗透溶出,所以发酵初始琥珀酸含量已达到最高值。

A-苹果酸;B-琥珀酸;C-乳酸;D-乙酸
图3 DZ与WJM两组在发酵过程中有机酸含量的变化
Fig.3 Changes of organic acid contents in DZ and WJM groups during fermentation
乳酸和乙酸可以提升泡菜的香气,对泡菜的风味口感有着重要影响[20]。从图3-C可知WJM组乳酸含量在发酵9 d内均呈现持续上升的趋势,而DZ组乳酸含量总体变化不大,该结果与图2-B中总酸的变化情况相似,推测主要原因是营养物质的消耗差异造成的酸代谢差异。由图3-D可知两组处理乙酸含量变化趋势一致,均呈现发酵前3 d下降后期增长的趋势,但总体乙酸含量DZ组显著高于WJM组(P<0.01)。梁璋成等[21]研究发现酵母菌酸代谢主要产物是乳酸、乙酸和琥珀酸,LIU等[22]发现酵母培养物可以提高回肠中乳酸菌和芽孢杆菌的丰度。故推测母水中酵母菌可能通过自身酸代谢直接影响乙酸含量或通过改变乳酸菌菌群结构间接造成酸代谢差异。综上所述,母水中酵母菌能够加速苹果酸的代谢,可能通过加速营养物质的消耗、自身酸代谢以及影响乳酸菌菌群结构使发酵液中乳酸含量下降,乙酸含量增加。
2.4 酵母菌对发酵萝卜汁挥发性风味物质的影响
2.4.1 挥发性风味物质统计分析
采用HS-SPME-GC-MS对两组萝卜汁发酵9 d的挥发性风味成分进行分析,通过数据库比对,两组萝卜汁发酵结束共检出137种挥发性风味物质,其中醇类化合物34种,酯类化合物24种,烃类化合物21种,酚类化合物12种,酸类化合物9种,酮类化合物9种,醛类化合物9种,杂环类化合物8种,含硫化合物7种,胺类化合物3种,其他化合物1种。图4是两组发酵萝卜汁各类挥发性风味物质相对含量分布图,从图4中可以看出醇类物质是两组发酵萝卜汁最主要的挥发性风味物质,这与张文娟等[8]的研究结果相似。两组间各类风味物质相对含量存在一定差异,DZ组含有更多的醇类酯类和酸类化合物,而WJM组则含有更多的胺类、酚类和含硫化合物。醇类、酸类和酯类化合物是赋予泡菜风味的主要化合物,醇类和酯类化合物多具有令人愉悦的香气和芬芳的水果香味,酸类化合物通过挥发性的乙酸和乙酸乙酯呈现出的“酸香”味是发酵蔬菜中独特的气味[23]。胺类、酚类和含硫化合物通常会产生刺激性气味和特殊的异味,且阈值较低[24],对发酵萝卜汁的风味具有重要影响。

图4 DZ和WJM组发酵终点各类挥发性风味物质占比
Fig.4 Proportion of various volatile flavor substances in DZ and WJM samples at the end of fermentation
为明确两组间挥发性风味物质是否存在显著差异以确定酵母菌对其的影响,对两组数据进行PCA,结果如图5所示。从图5可知,PC1和PC2的累计贡献率为88.6%,且两组处理挥发性风味物质分布在坐标轴的两侧,说明两组处理间挥发性风味物质具有明显差异,酵母菌对发酵萝卜汁风味具有显著影响。
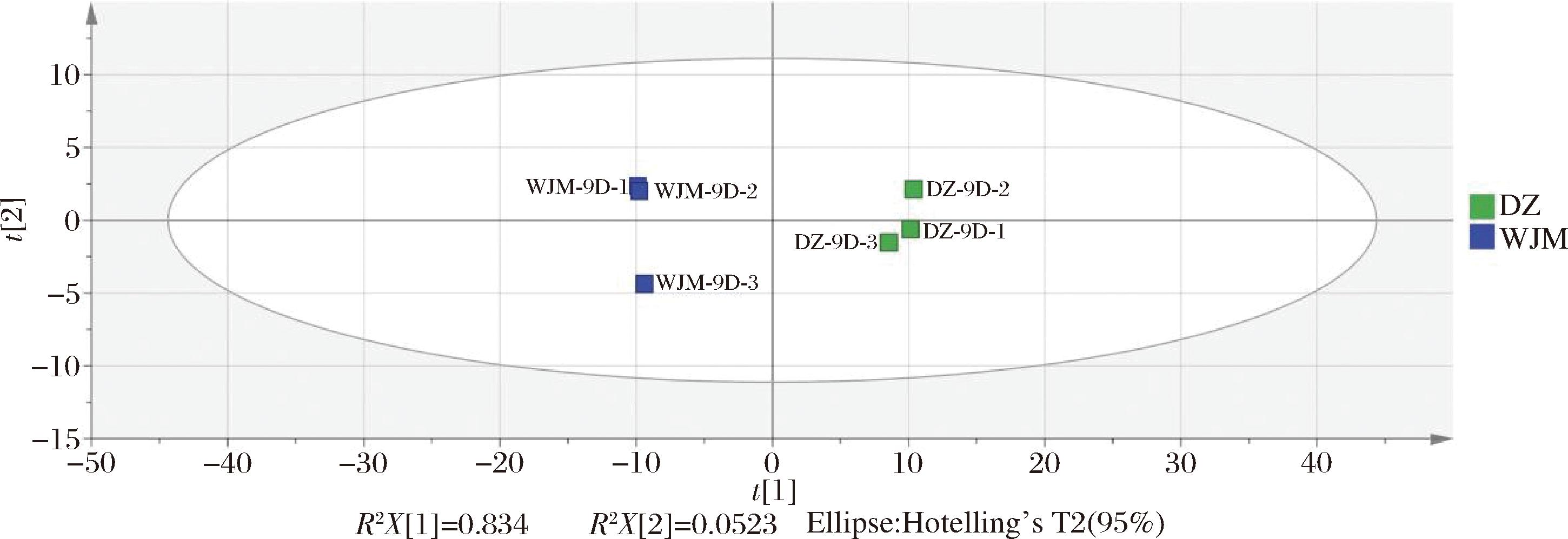
图5 DZ组和WJM组风味物质PCA
Fig.5 PCA plot of flavor substances among DZ and WJM groups
2.4.2 主要差异性挥发性风味物质分析
为进一步分析两组处理间差异性挥发性风味物质,明确酵母菌对发酵萝卜挥发性风味物质的影响,对两组发酵萝卜汁挥发性风味物质建立OPLS-DA模型,结果如图6所示。与PCA结果一致,两组处理间挥发性风味物质具有显著差异。共鉴定出VIP>1的差异物质19种,包括6种醇类化合物、5种烃类化合物、4种酯类化合物、2种胺类化合物、1种酸类化合物和1种酚类化合物,各物质具体含量见表1。
表1 两组发酵萝卜汁VIP>1的差异挥发性风味化合物
Table 1 Differential volatile flavor compounds (VIP>1) between two fermented radish juice groups
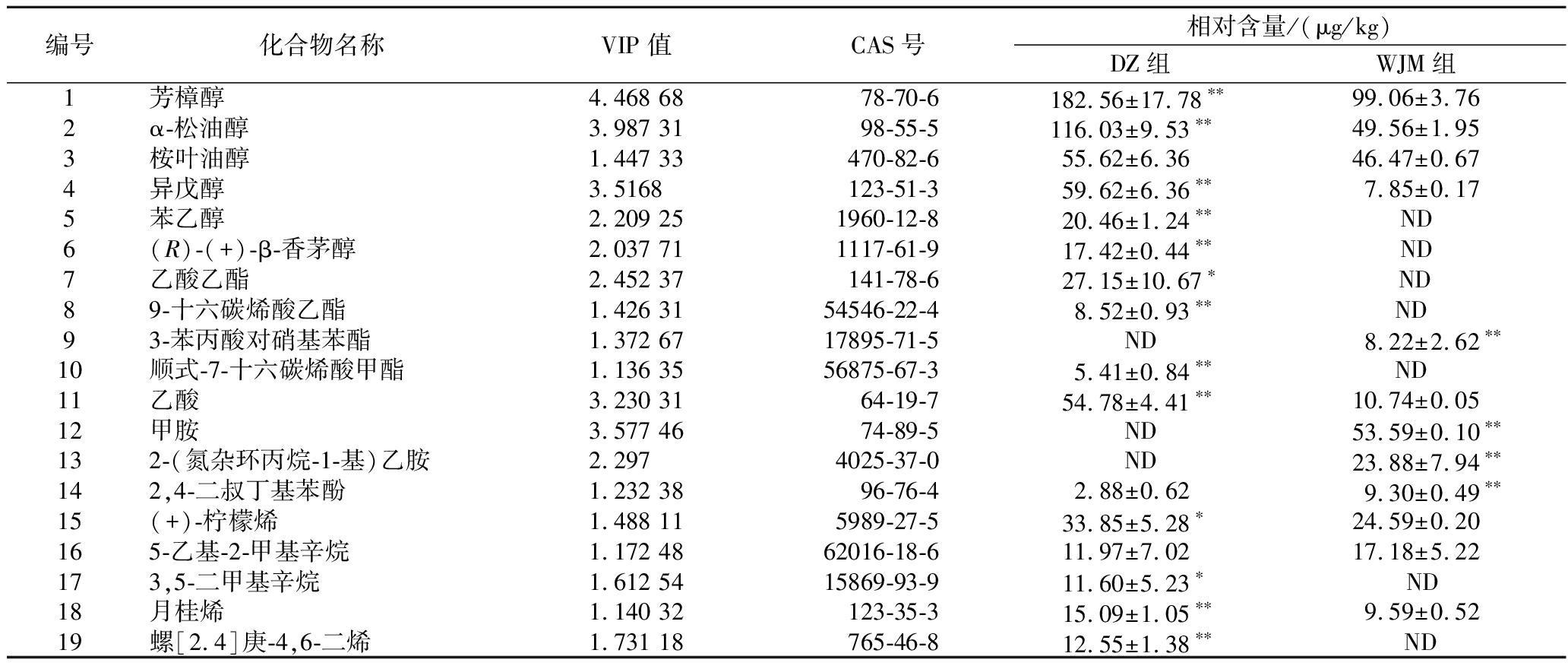
编号化合物名称VIP值CAS号相对含量/(μg/kg)DZ组WJM组1芳樟醇4.468 6878-70-6182.56±17.78∗∗99.06±3.762α-松油醇3.987 3198-55-5116.03±9.53∗∗49.56±1.953桉叶油醇1.447 33470-82-655.62±6.3646.47±0.674异戊醇3.5168123-51-359.62±6.36∗∗7.85±0.175苯乙醇2.209 251960-12-820.46±1.24∗∗ND6(R)-(+)-β-香茅醇2.037 711117-61-917.42±0.44∗∗ND7乙酸乙酯2.452 37141-78-627.15±10.67∗ND 89-十六碳烯酸乙酯1.426 3154546-22-48.52±0.93∗∗ND 93-苯丙酸对硝基苯酯1.372 6717895-71-5ND8.22±2.62∗∗10顺式-7-十六碳烯酸甲酯1.136 3556875-67-35.41±0.84∗∗ND 11乙酸3.230 3164-19-754.78±4.41∗∗10.74±0.0512甲胺3.577 4674-89-5ND53.59±0.10∗∗132-(氮杂环丙烷-1-基)乙胺2.2974025-37-0ND23.88±7.94∗∗142,4-二叔丁基苯酚1.232 3896-76-42.88±0.629.30±0.49∗∗15(+)-柠檬烯1.488 115989-27-533.85±5.28∗24.59±0.20165-乙基-2-甲基辛烷1.172 4862016-18-611.97±7.0217.18±5.22173,5-二甲基辛烷1.612 5415869-93-911.60±5.23∗ ND18月桂烯1.140 32123-35-315.09±1.05∗∗9.59±0.5219螺[2.4]庚-4,6-二烯1.731 18765-46-812.55±1.38∗∗ ND
注:“ND”表示未检出,“*”表示P<0.05,“**”表示P<0.01。
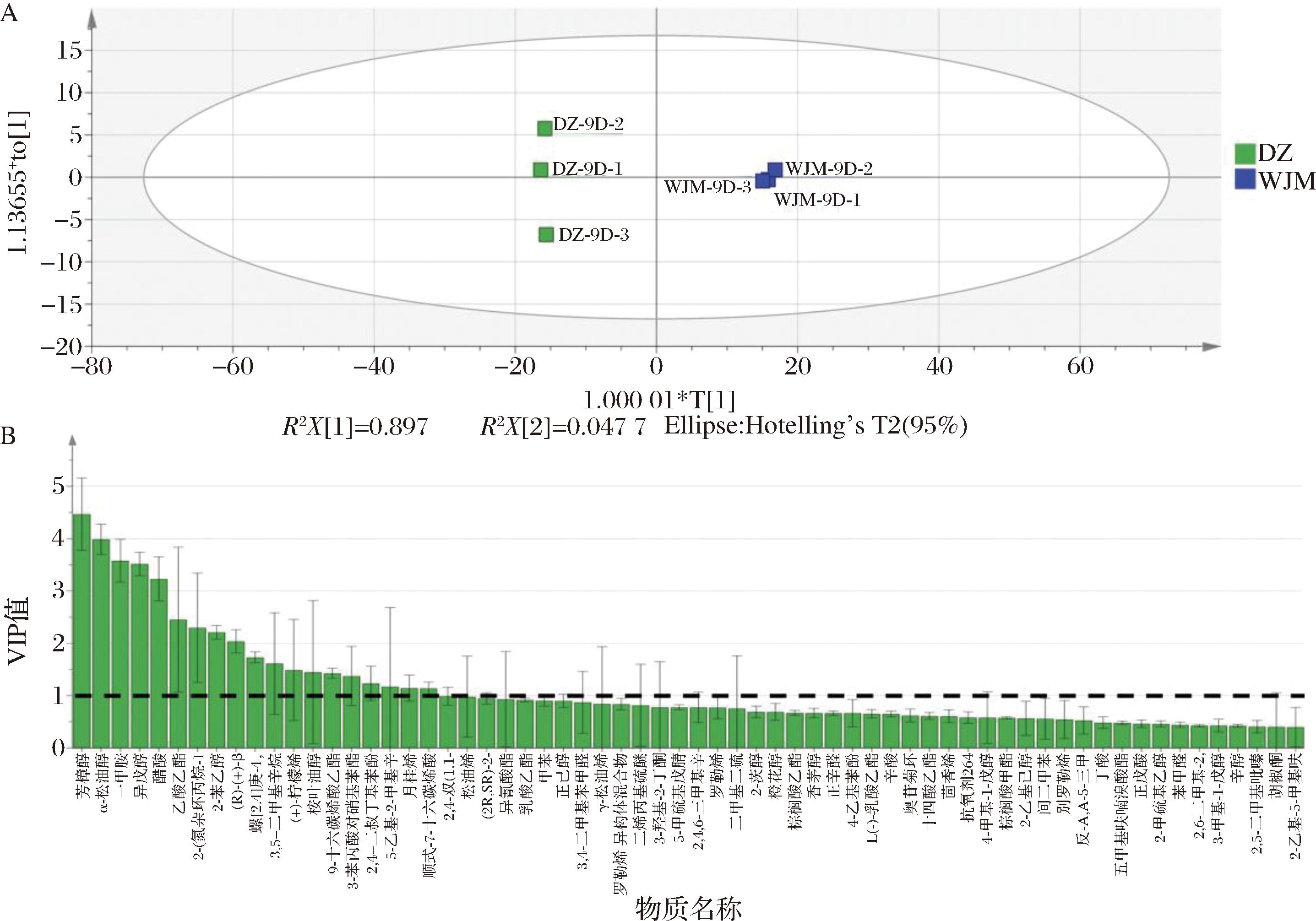
A-OPLS-DA得分图;B-VIP图
图6 DZ组和WJM组风味物质OPLS-DA分析
Fig.6 OPLS-DA of flavor substances among DZ and WJM groups
醇类物质是泡菜中常见的挥发性风味物质,通常具有令人愉悦的香气。从表1可知DZ组6种醇类物质含量均高于WJM组,其中苯乙醇和(R)-(+)-β-香茅醇仅在DZ组检出。苯乙醇是由酵母利用糖或苯丙氨酸代谢产生的高级醇,赋予泡菜花香[25]。(R)-(+)-β-香茅醇是β-香茅醇的对映异构体,能够抑制念珠菌的生物活性[26],可能对提高泡菜安全性具有一定作用。芳樟醇具有绿茶清香和玫瑰花香,是赋予泡菜香气的重要成分;α-松油醇具有木质花香,是发酵胡萝卜浆的主要芳香物质之一[27];异戊醇具有酒味和麦芽香味。这5种挥发性风味物质在DZ组中的相对含量均极显著高于WJM组,表明酵母的存在能够赋予萝卜泡菜更强的花香风味。
微生物发酵产生的酸和醇会转化为酯类物质,酯类物质在泡菜中呈现怡人的甜味和果香、花香等香气[15]。从表1可知VIP>1的4种酯类物质3种仅在DZ组检出,一种仅在WJM组检出。有研究表明酵母能够利用葡萄糖代谢产生乙酸和乙醛,并在自身酯化酶的作用下合成乙酸乙酯,赋予泡菜水果香、花香和甜香[28]。9-十六碳烯酸乙酯能够赋予泡菜柔和的清香和花果香[29]。两种酯类仅在DZ组检出,表明酵母能够赋予泡菜更丰富的花果香。
乙酸是本实验VIP>1的唯一酸类物质,且其在DZ组的相对含量极显著高于WJM组,与前文有机酸的结果一致。
原料中的一些游离氨基酸和蛋白质水解产生的氨基酸在一系列酶的作用下,会转化为酸类、醇类、含硫化合物、苯甲醛和挥发性酚等挥发性风味成分[23]。胺类、酚类化合物通常会产生刺激性气味和特殊的异味,本实验中VIP值>1的两种胺类物质仅在WJM组检出,其中甲胺具有氨气的刺激性异味。2,4-二叔丁基苯酚是本实验VIP值>1的唯一酚类物质,在DZ组中的相对含量极显著低于WJM组,何小燕等[30]研究发现它与烧烤味呈现正相关,可能对风味具有贡献作用。
饱和烃类风味阈值较高,且一般香气较弱或无气味,对风味贡献较弱[31],因此本文不多做赘述。萜烯类化合物大都阈值较低,且具有花香、水果香,对风味贡献较大[32]。其中(+)-柠檬烯具有柠檬香味,月桂烯具有什锦水果和柑橘香。两种化合物均在DZ组中有较高含量,说明酵母菌能够赋予萝卜泡菜更浓厚的水果香。
综上所述,母水中的酵母菌能够赋予发酵萝卜更丰富的风味成分,使其具有更浓厚的花果香。
3 结论
本试验通过对比有无酵母两组萝卜汁发酵过程中的微生物数量、还原糖、pH值、总酸和有机酸的含量差异,发现酵母菌与乳酸菌生长存在一定的拮抗作用,酵母菌对乳酸菌生长的抑制作用主要发生在发酵初期。酵母菌可能通过加速营养物质的消耗、自身的酸代谢和改变乳酸菌菌群结构使发酵液中总酸含量下降,有机酸组成改变。挥发性风味成分是反映发酵蔬菜品质的一个重要指标,对挥发性风味物质分析结果表明母水中酵母菌群能够增加发酵蔬菜中醇类、酯类和酸类物质总含量,降低胺类酚类等物质总含量,赋予萝卜泡菜更强的花果香,对提高发酵萝卜风味品质具有重要意义。
[1] 陈功, 夏有书, 张其圣, 等.从中国泡菜看四川泡菜及泡菜坛[J].中国酿造, 2010, 29(8):5-8.CHEN G, XIA Y S, ZHANG Q S, et al.Discussion of Sichuan Pickles and pickle jars from the view of Chinese Pickles[J].China Brewing, 2010, 29(8):5-8.
[2] YANG J X, CAO J L, XU H Y, et al.Bacterial diversity and community structure in Chongqing radish paocai brines revealed using PacBio single-molecule real-time sequencing technology[J].Journal of the Science of Food and Agriculture, 2018, 98(9):3234-3245.
[3] JUNG J Y, LEE S H, LEE H J, et al.Effects of Leuconostoc mesenteroides starter cultures on microbial communities and metabolites during kimchi fermentation[J].International Journal of Food Microbiology, 2012, 153(3):378-387.
[4] 陈功, 余文华, 张其圣, 等.四川泡菜与乳酸菌的研究[J].中国酿造, 2012, 31(9):151-154.CHEN G, YU W H, ZHANG Q S, et al.Research of Sichuan Paocai and lactic acid bacteria[J].China Brewing, 2012, 31(9):151-154.
[5] XIAO M Y, XIONG T, PENG Z, et al.Correlation between microbiota and flavours in fermentation of Chinese Sichuan Paocai[J].Food Research International, 2018, 114:123-132.
[6] RAO Y, QIAN Y, TAO Y F, et al.Characterization of the microbial communities and their correlations with chemical profiles in assorted vegetable Sichuan pickles[J].Food Control, 2020, 113:107174.
[7] 王秋霞, 路建东, 金玲, 等.乳酸菌菌种差异对泡菜发酵风味的影响[J].粮食与食品工业, 2016, 23(1):41-46.WANG Q X, LU J D, JIN L, et al.The influence of lactic acid bacteria strains on the flavor of pickles[J].Cereal &Food Industry, 2016, 23(1):41-46.
[8] 张文娟, 陈安特, 韩宇琴, 等.酿酒酵母对萝卜泡菜发酵的影响[J].食品与发酵工业, 2017, 43(8):134-137.ZHANG W J, CHEN A T, HAN Y Q, et al.Effects of Saccharomyces cerevisiae on the fermentation of radish pickle[J].Food and Fermentation Industries, 2017, 43(8):134-137.
[9] 王艳, 胡跃, 方红美, 等.白萝卜泡菜加工工艺的研究[J].食品工业科技, 2021, 42(11):185-191.WANG Y, HU Y, FANG H M, et al.Study on processing technology of pickled radish[J].Science and Technology of Food Industry, 2021, 42(11):185-191.
[10] 王贵芳, 赵少华.那他霉素的特性及其在食品中的应用[J].中国食品添加剂, 2006(2):144-151.WANG G F, ZHAO S H.Characteristic of natamycin and application in food industry[J].China Food Additives, 2006(2):144-151.
[11] YANG X Z, HU W Z, JIANG A L, et al.Effect of salt concentration on quality of Chinese northeast sauerkraut fermented by Leuconostoc mesenteroides and Lactobacillus plantarum[J].Food Bioscience, 2019, 30:100421.
[12] 谭春梅, 梅源, 陈龙等.复合香辛料在不同粉碎和浸提工艺下挥发性风味物质的差异分析[J].中国调味品, 2023, 48(11):11-17.TAN C M, MEI Y, CHEN L, et al.Difference analysis of volatile flavor substances of compound spices under different grinding and extraction processes[J].China Condiment, 2023, 48(11):11-17.
[13] 顾晶晶, 张亮.微生物发酵工程对食品营养及保健功能的影响[J].中国食品, 2022(5):137-139.GU J J, ZHANG L.Effect of microbial fermentation engineering on food nutrition and health care function[J].China Food, 2022(5):137-139.
[14] 周袁璐, 师苑, 陆跃乐, 等.传统发酵过程微生物互作研究进展[J].中国食品学报, 2021, 21(11):349-358.ZHOU Y L, SHI Y, LU Y L, et al.Research progress on microbial interaction in traditional fermentation[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(11):349-358.
[15] 欧雪, 吴梦西, 廖一漠, 等.不同盐浓度对接种发酵萝卜泡菜品质的影响[J].四川农业大学学报, 2022, 40(3):438-448.OU X, WU M X, LIAO Y M, et al.Effects of different salt concentrations on the quality of radish pickles produced by inoculated fermentation[J].Journal of Sichuan Agricultural University, 2022, 40(3):438-448.
[16] KADER A A.Flavor quality of fruits and vegetables[J].Journal of the Science of Food and Agriculture, 2008, 88(11):1863-1868.
[17] 王芮东, 李楠, 卫博慧, 等.高效液相色谱法测定甘蓝泡菜发酵过程中的有机酸[J].食品工业科技, 2018, 39(6):236-240.WANG R D, LI N, WEI B H, et al.Determination of organic acids in the fermentation process of cabbage kimchi by HPLC[J].Science and Technology of Food Industry, 2018, 39(6):236-240.
[18] 刘延岭, 邓林, 陶瑞霄.降解苹果酸酵母菌的筛选及鉴定[J].食品科技, 2020, 45(3):8-12.LIU Y L, DENG L, TAO R X.Screening and identification of yeast degrading malic acid[J].Food Science and Technology, 2020, 45(3):8-12.
[19] 王芮东, 李楠, 卫博慧, 等.不同发酵方式萝卜泡菜中有机酸的变化分析[J].中国调味品, 2021, 46(5):139-143.WANG R D, LI N, WEI B H, et al.Analysis of the changes of organic acids in pickled radish with different fermentation methods[J].China Condiment, 2021, 46(5):139-143.
[20] 杨君, 贺云川, 何家林, 等.榨菜腌制过程中有机酸变化[J].食品科学, 2012, 33(19):182-187.YANG J, HE Y C, HE J L, et al.Variations in organic acids in mustard during pickling[J].Food Science, 2012, 33(19):182-187.
[21] 梁璋成, 何志刚, 林晓婕, 等.黄酒酿造酵母菌发酵过程的有机酸代谢研究[J].福建农业学报, 2016, 31(3):289-292.LIANG Z C, HE Z G, LIN X J, et al.Study on organic acid metabolism of rice wine yeast durling fermentation[J].Fujian Journal of Agricultural Sciences, 2016, 31(3):289-292.
[22] LIU Y C, CHENG X, ZHEN W R, et al.Yeast culture improves egg quality and reproductive performance of aged breeder layers by regulating gut microbes[J].Frontiers in Microbiology, 2021, 12:633276.
[23] 李子怡, 邓淼, 王燕, 等.发酵蔬菜中的挥发性成分及其影响因素探讨[J].中国酿造, 2022, 41(12):26-30.LI Z Y, DENG M, WANG Y, et al.Study on volatile components of fermented vegetables and their influencing factors[J].China Brewing, 2022, 41(12):26-30.
[24] GARICANO VILAR E, O′SULLIVAN M G, KERRY J P, et al.Volatile compounds of six species of edible seaweed:A review[J].Algal Research, 2020, 45:101740.
[25] 苏柯冉, 刘野, 何聪聪, 等.三种萃取方法结合GC-O-MS分析香糟卤中挥发性香气成分[J].现代食品科技, 2015, 31(8):340-347.SU K R, LIU Y, HE C C, et al.Comparative analysis of volatile aroma components of xiangzaolu via the combination of three extraction methods and gas chromatography-olfactometry-mass spectrometry(GC-O-MS)[J].Modern Food Science and Technology, 2015, 31(8):340-347.
[26] SILVA D, DINIZ-NETO H, CORDEIRO L, et al.(R)-(+)-β-Citronellol and (S)-(-)-β-citronellol in combination with amphotericin B against Candida spp.[J].International Journal of Molecular Sciences, 2020, 21(5):1785.
[27] 熊涛, 马晓娟.植物乳杆菌NCU166发酵胡萝卜浆风味物质的分析[J].食品科学, 2013, 34(2):152-154.XIONG T, MA X J.Analysis of flavor compounds from Lactobacillus plantarum-fermented carrot slurry[J].Food Science, 2013, 34(2):152-154.
[28] 程伟, 彭兵, 汪焰胜, 等.清香型酒醅中一株产乙酸乙酯酵母菌的筛选及其应用性能分析[J].酿酒, 2018, 45(5):43-47.CHENG W, PENG B, WANG Y S, et al.Screening of one yeast strain with high-yield of ethyl acetate from Fen-flavor liquor fermenting-grains and analysis of its application performance[J].Liquor Making, 2018, 45(5):43-47.
[29] 乔惠田, 黄潇潇, 遆永瑞等.花蜜酒发酵工艺优化及成分分析[J].食品工业科技, 2021, 42(21):25-32.QIAO H T, HUANG X X, TI Y R, et al.Fermentation process optimization and component analysis of nectar wine[J].Science and Technology of Food Industry, 2021, 42(21):25-32.
[30] 何小燕, 田洪磊, 詹萍, 等.鸡肉香精最适风味前体PLSR分析与研究[J].现代食品科技, 2016, 32(10):268-275.HE X Y, TIAN H L, ZHAN P, et al.Analysis and study of the desirable precursor of the chicken flavor based on PLSR[J].Modern Food Science and Technology, 2016, 32(10):268-275.
[31] 杜勃峰, 李达, 肖仕芸, 等.基于HS-SPME-GC-MS及主成分分析综合评价贵州典型辣椒品种香气品质[J].食品研究与开发, 2019, 40(7):149-155.DU B F, LI D, XIAO S Y, et al.Comprehensive evaluation of aroma quality of different pepper based on HS-SPME-GC-MS and principal component analysis[J].Food Research and Development, 2019, 40(7):149-155.
[32] 刘艳敏, 吴拥军, 王亚娟, 等.贵州油辣椒挥发性风味物质分析[J].食品科学, 2013, 34(20):221-227.LIU Y M, WU Y J, WANG Y J, et al.Volatile flavor components analysis of fried pepper sauce in Guizhou Province[J].Food Science, 2013, 34(20):221-227.