酸枣仁作为中医临床治疗失眠的常用安神中药之一,源于鼠李科植物酸枣(Ziziphus jujuba Mill.var.spinosa(Bunge)Hue x H.F.Chou)的干燥成熟种子,具有养心补肝、宁心安神、敛汗生津等功效[1]。近年来,因酸枣仁药材及其产品对于失眠的改善效果显著,对原发性失眠[2]、老年失眠[3]、更年期失眠[4]等各类失眠具有显著的治疗效果。随着失眠人数的增加,酸枣仁药材受到了更多的关注。酸枣仁为种子类药材,含有丰富的蛋白质成分,约占酸枣仁药材质量的20%以上,为了综合利用酸枣仁资源,在目前对其主要次生代谢产物黄酮、皂苷类成分充分利用的基础上,有必要对酸枣仁中蛋白质类成分进行研究开发。
多肽作为蛋白质的水解产物,分子质量小,具有比蛋白质更强的生物活性和功能特性。不同分子质量的多肽所呈现的生物活性及功能特性有所差异。澳洲坚果多肽、黑籽瓜种子多肽和红花籽多肽等的研究都表明不同分子质量多肽的生物活性、功能特性及稳定性等具有显著差异[5-7]。本实验以酸枣仁药材为研究对象,以不同的水解条件制备酸枣仁多肽,用超滤法分离酸枣仁多肽,得到4个分子质量不同的多肽组分,通过研究4个多肽组分的溶解度、吸油性、起泡性、起泡稳定性、乳化性及乳化稳定性,旨在筛选得到功能特性最强的组分,为酸枣仁多肽的进一步研究及其产品的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
酸枣仁药材,山西国泰中药股份有限公司,由山西中医药大学杜晨晖教授鉴定为鼠李科植物酸枣Ziziphus jujuba Mill.var.spinosa(Bunge)Hue x H.F.Chou的干燥成熟种子,批号:20221125;大豆油,批号:20231029,金龙鱼粮油食品股份有限公司;碱性蛋白酶,批号:RH140678,上海易恩化学技术有限公司;甘氨酸,批号:DSTDG006801,德斯特生物科技有限公司;茚三酮,批号:C15045443,麦克林生化科技有限公司。
1.2 仪器与设备
HA220-50-06超临界CO2萃取仪,江苏华安科研仪器有限公司;Amicon@Ultra超滤离心管(3、10 kDa),美国Millipore公司;Vivaspin Turbo15超滤离心管(5 kDa),赛多利斯公司;UV-6100S紫外可见分光光度计,上海元析仪器有限公司;DE-100 g万能粉碎机,浙江红景天工贸有限公司;LGJ-10G真空冷冻干燥机,北京四环启航科技有限公司。
1.3 实验方法
1.3.1 酸枣仁脱脂粉的制备
根据实验室前期研究基础。将酸枣仁药材粉碎,过二号筛,置于萃取釜中。工艺条件为:50 ℃,25 MPa,90 min。超临界萃取结束后,将萃取釜中的酸枣仁粉末取出得到酸枣仁脱脂粉。
1.3.2 酸枣仁蛋白的提取
根据实验室前期研究,用碱溶酸沉法提取酸枣仁蛋白。以蒸馏水作为提取溶剂。精密称取酸枣仁脱脂粉与20倍的蒸馏水混合,调节溶液pH值至9.0,60 ℃水浴1 h,3 000 r/min离心10 min,去除沉淀,收集上清液,调节pH值至4.0,静置一夜,6 000 r/min离心10 min,收集沉淀,沉淀用蒸馏水溶解,透析,冷冻干燥备用。
1.3.3 酸枣仁多肽的制备
1.3.3.1 不同水解方法的比较
酸水解和酶水解为多肽制备的常用方法,因此本研究比较了这2种方法的水解效果。
酸水解法[8]:精密称取0.5 g酸枣仁蛋白,加入5 mol/L HCl溶液50 mL,90 ℃水解12 h,取出后冷却,过滤,水定容至50 mL,用1 mol/L NaOH溶液调pH至中性,收集上清液。
酶水解法[9]:精密称取0.5 g酸枣仁蛋白,以底物浓度5%,酶添加量2%,pH=9,60 ℃水浴3 h,结束后将水解液置于沸水中灭酶10 min,冷却,调节水解液pH至中性,离心收集上清液。
1.3.3.2 水解度的测定
取2 mL 50 μg/mL的甘氨酸溶液与1 mL茚三酮溶液混匀,沸水浴15 min。冷却,加40%(体积分数)乙醇溶液5 mL,静置反应15 min,于570 nm波长检测吸光度。取多肽水解液,稀释至可测浓度,按照公式(1)计算待测多肽的含量,按照公式(2)计算水解度[10]:
多肽含量![]()
(1)
式中:c,甘氨酸溶液的质量浓度,μg/mL;A2,待测水解液的吸光度值;A1,甘氨酸溶液的吸光度值;V1,水解液总体积,mL。
水解度![]()
(2)
式中:m,多肽含量,mg;V1,水解液总体积,mL;W,水解前蛋白的质量,g;V2,显色时用稀释的体积,mL。
1.3.4 酸枣仁多肽的分离
多肽可通过不同型号的超滤离心管而实现梯度分离,将上述水解液依次用不同的超滤膜分离,得到不同分子质量的多肽段。取上述制备的多肽溶液,加入截留相对分子质量为10 kDa的超滤离心管中,4 000 r/min离心10 min,小心吸取离心管内管的液体,可得到ZSSPP-I(>10 kDa)组分,离心管底部液体则为相对分子质量<10 kDa的多肽组分。小心吸取离心管外管液体放入截留量为5 kDa的超滤离心管内管中,相同条件下进行离心分离,内管液体为相对分子质量在5~10 kDa的组分,即得ZSSPP-Ⅱ(5~10 kDa)组分,离心管外管则含相对分子质量<5 kDa的组分。同理再用截留相对分子质量3 kDa的超滤离心管进行超滤离心,即可得ZSSPP-Ⅲ(3~5 kDa)、ZSSPP-Ⅳ(<3 kDa)组分。各组分冷冻干燥备用。
1.3.5 不同多肽功能特性研究
1.3.5.1 溶解度
分别称取50 mg不同分子质量的酸枣仁多肽,加水10 mL,充分振荡,分别调pH值至2、4、6、8、10,充分混匀后静置1 h,8 000 r/min离心10 min,取上清液用考马斯亮蓝法测定含量,根据公式(3)计算不同分子质量多肽的溶解度[11]:
溶解度![]()
(3)
式中:c1,样品多肽溶液的含量,g/mL;c2,上清液多肽含量,g/mL。
1.3.5.2 吸油性
分别称取4个不同分子质量的酸枣仁多肽,转移至离心管中,与2 mL大豆油混匀,分别在温度为20、40、60、80、100 ℃水浴30 min,4 000 r/min离心20 min,弃去上清液,根据公式(4)计算吸油性[12]:
吸油性![]()
(4)
式中:M1,吸油前多肽质量,g;M2,吸油前多肽与离心管质量和,g;M3,吸油后多肽与离心管质量和,g。
1.3.5.3 起泡性与起泡稳定性
分别配制0.3%(质量分数)的不同分子质量的酸枣仁多肽溶液,分别用1 mol/L的NaOH溶液或HCl溶液将pH值调至2、4、6、8、10,以20 000 r/min的均质1.5 min。完成后立即记录体积,记为V1。根据公式(5)计算起泡性。室温静置10 min,再次记录体积,记为V2,根据公式(6)计算泡沫稳定性[13]:
起泡性![]()
(5)
式中:V0,多肽溶液均质前的体积,mL;V1,均质后多肽溶液的体积,mL。
泡沫稳定性![]()
(6)
式中:V2,静置10 min后多肽溶液的体积,mL;V1,均质后多肽溶液的体积,mL。
1.3.5.4 乳化性与乳化稳定性
乳化活性指数(emulsifying activity index,EAI)表示乳化性,用乳化稳定性指数(emulsion stability index,ESI)表示乳化稳定性。配制0.3%不同分子质量的酸枣仁多肽溶液,调节溶液的pH值分别为2、4、6、8、10,加入大豆油5 mL,20 000 r/min匀浆1 min,结束后即从底部吸取50 μL乳状液,混合5 mL 0.1%(质量分数)十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液,于500 nm测定吸光度值。静置10 min,同上述方法测定吸光度值。分别根据公式(7)、公式(8)计算EAI和ESI[14]:
(7)
式中:A0,样品吸光度值;N,稀释倍数;c,多肽溶液的质量浓度,g/mL;Φ,混合体系中油相体积分数,2/3;L,光程长,1 cm。
(8)
式中:A0,样品吸光度值;Δt,静置时间,10 min;At,静置10 min后样品吸光度值。
1.4 数据处理
所有实验重复3次,结果用平均值±标准差(mean±SD)表示。利用IBM SPSS Statistics 27软件对实验数据进行显著性分析,并采用GraphPad Prism 8软件处理实验数据并绘图。
2 结果与分析
2.1 不同水解方法的比较
酸水解法和酶水解法2种方法的水解度及水解产物有较大差别,水解结果分别为:酸水解法水解度(水解度=86.29%)>酶水解法水解度(水解度=50.76%)。酸水解得到的多肽中以ZSSPP-Ⅳ(<3 kDa)为主,ZSSPP-Ⅳ(<3 kDa)含量达90.67%;酶水解产物得到不同分子质量的多肽组分,其中ZSSPP-Ⅳ(<3 kDa)为44.73%,ZSSPP-I(>10 kDa)19.54%、ZSSPP-Ⅱ(5~10 kDa)16.31%、ZSSPP-Ⅲ(3~5 kDa)19.42%。酸水解较彻底,水解产物主要为分子质量小的肽,可能是因为酸水解的水解条件较剧烈,且对肽键的水解不具有专一性,水解程度高,一般可得到分子大小更均一或较小的肽或氨基酸;而酶水解中主要考察了蛋白酶水解条件,由于蛋白酶水解具有专一性,而且会受到蛋白质三级结构和氨基酸序列的影响[15],故水解产物中有不同分子质量的片段。
根据功能特性的研究结果,ZSSPP-I(>10 kDa)和ZSSPP-Ⅳ(<3 kDa)均为功能特性较强的组分,ZSSPP-Ⅱ(5~10 kDa)和ZSSPP-Ⅲ(3~5 kDa)也具有较强的吸油性和起泡性。在制备时,可通过改变水解条件,使目标组分的得率升高。ZSSPP-Ⅳ(<3 kDa)可通过酸水解法快速、大量制备,而分子质量>10 kDa的酸枣仁多肽组分在本研究中得率较低,为了提高得率,可利用酶水解法,通过调整不同的酶底比、温度和底物浓度等条件,适当降低水解度,提高大分子质量多肽组分的含量及得率。
2.2 不同分子质量酸枣仁多肽功能特性评价
实验中考察了酸枣仁多肽不同分子质量片段的溶解度、吸油性、起泡性、起泡稳定性、乳化性和乳化稳定性。
2.2.1 溶解度
溶解度对多肽的开发应用具有重要意义,溶解度越高,多肽的水合作用越强,越有助于发挥其功能特性[16]。由图1可以看出,不同pH值及分子质量大小会影响酸枣仁多肽的溶解度,蛋白质及多肽在其等电点时溶解度最小。当pH=4.0时,酸枣仁多肽的溶解度最低,各组分多肽的溶解度均低于12%。因此可认为酸枣仁多肽组分的等电点为pH=4.0;pH值大于或小于等电点(pH=4.0)时,酸枣仁多肽各组分的溶解度逐渐增大,pH=10.0时溶解度最高,ZSSPP-I和ZSSPP-Ⅲ的溶解度分别达到97.5%和95.9%,其他2个组分的溶解度也逐渐增大。可能是由于pH值在等电点时,多肽电荷少,分子极性低,静电排斥作用小,疏水性强,更容易发生聚集,导致沉淀,从而降低溶解度[17]。
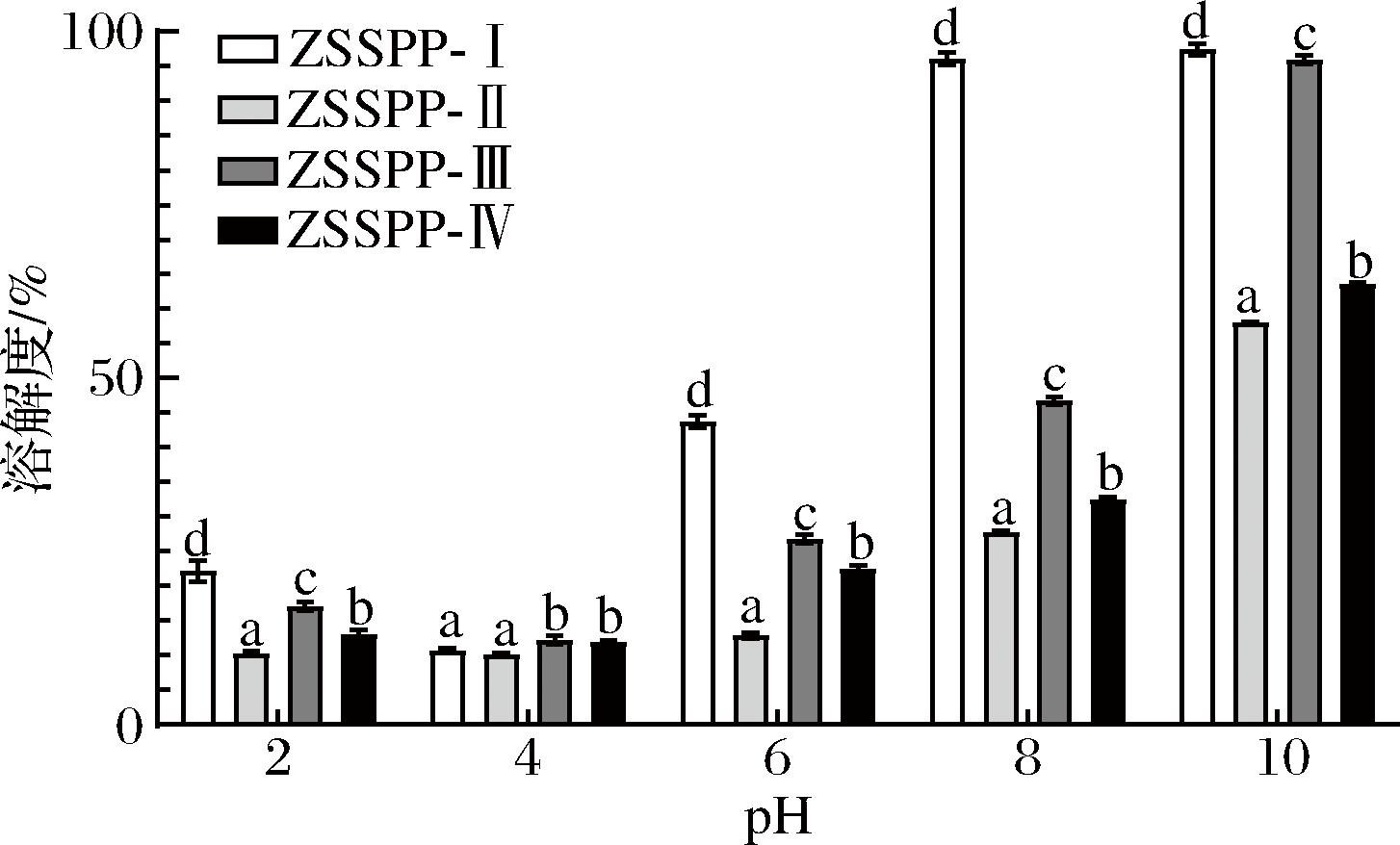
图1 不同分子质量多肽的溶解度
Fig.1 Solubility of peptides with different molecular weights
注:相同条件下不同字母上标表示差异显著(P<0.05)(下同)。
在相同pH值下,不同分子质量的酸枣仁多肽溶解度显著不同(P<0.05),说明酸枣仁多肽的分子质量、分子结构等对溶解度具有显著影响。溶解度顺序为:ZSSPP-I>ZSSPP-Ⅲ>ZSSPP-Ⅳ>ZSSPP-Ⅱ;ZSSPP-I溶解度相对较高,而其他三部分的溶解度较低,在不同pH条件下大多低于50%,由此可知酸枣仁多肽分子质量大于10 kDa的水溶性较好。ZSSPP-Ⅱ、ZSSPP-Ⅲ和ZSSPP-Ⅳ的溶解度较小,可能是因为它们分子暴露出更多疏水基团,水合作用弱,导致亲水性较弱,进而导致溶解度降低[18]。
2.2.2 吸油性
不同分子质量多肽吸油性的实验结果如图2所示,当温度从20 ℃升高至60 ℃,酸枣仁多肽的吸油性逐渐升高,温度到60 ℃时达到最大值,ZSSPP-I、ZSSPP-Ⅱ、ZSSPP-Ⅲ和ZSSPP-Ⅳ的吸油性分别为4.21%、4.28%、4.19%、2.59%。而温度由60 ℃升高至100 ℃,其吸油性反而降低,ZSSPP-I、ZSSPP-Ⅱ、ZSSPP-Ⅲ和ZSSPP-Ⅳ的平均吸油性为2.78%、2.74%、2.74%和1.10%。可能由于随着温度升高,肽链伸展,暴露出更多疏水残基,导致吸油性升高,温度由60 ℃升高至100 ℃时,温度过高,导致肽链聚合,多肽变性,从而导致吸油性降低[19]。
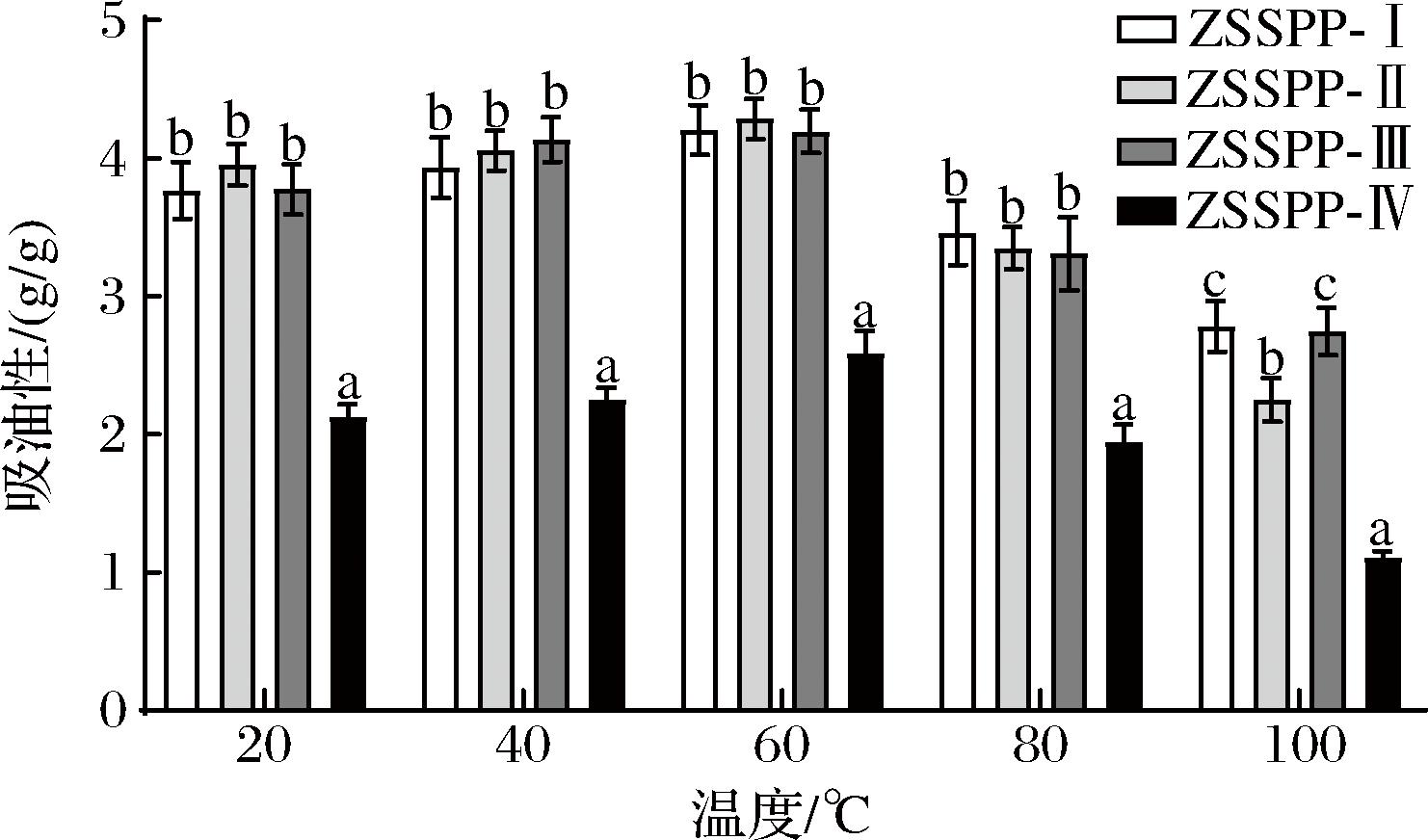
图2 不同分子质量多肽的吸油性
Fig.2 Oil absorption of peptides with different molecular weights
同一温度下,ZSSPP-I、ZSSPP-Ⅱ和ZSSPP-Ⅲ的吸油性显著高于ZSSPP-Ⅳ(P<0.05),可能是由于高分子质量的多肽含有较多的支链结构,有利于与脂类的结合,而ZSPP-Ⅳ多肽段可能由于分子质量小,支链结构少而不利于与脂类结合,导致吸油性最低[20]。
2.2.3 起泡性与泡沫稳定性
酸枣仁多肽各组分的起泡性随pH的变化如图3所示,泡沫稳定性变化如图4所示。结果表明,起泡性与起泡稳定性在pH值为4时最低,ZSSPP-I、ZSSPP-Ⅱ、ZSSPP-Ⅲ和ZSSPP-Ⅳ的起泡性分别为:31.5%、25.47%、28.47%、24.63%;起泡稳定性分别为:11.45%、4.14%、17.18%、12.09%。pH值在远离等电点(pH=4.0)时逐渐升高。起泡性与泡沫稳定性的结果与溶解度实验结果具有相同的趋势,可能是由于溶解度升高,导致溶液浓度及溶液黏性增大,有利于泡沫的形成;与冯俊[21]对茶籽粕多肽的起泡性和起泡稳定性的研究类似。
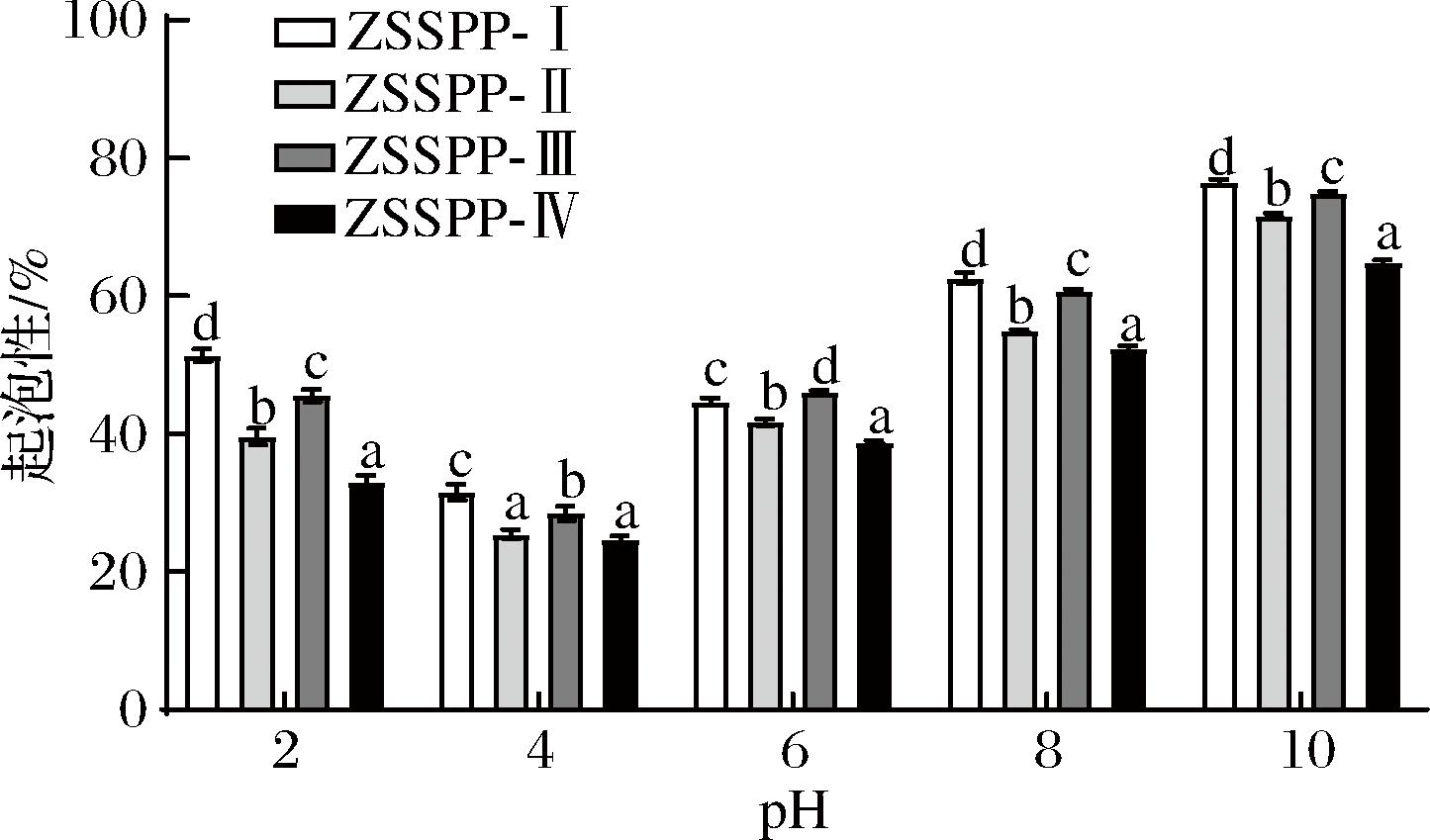
图3 不同分子质量多肽组分的起泡性
Fig.3 Foaming properties of peptide fractions with different molecular weights
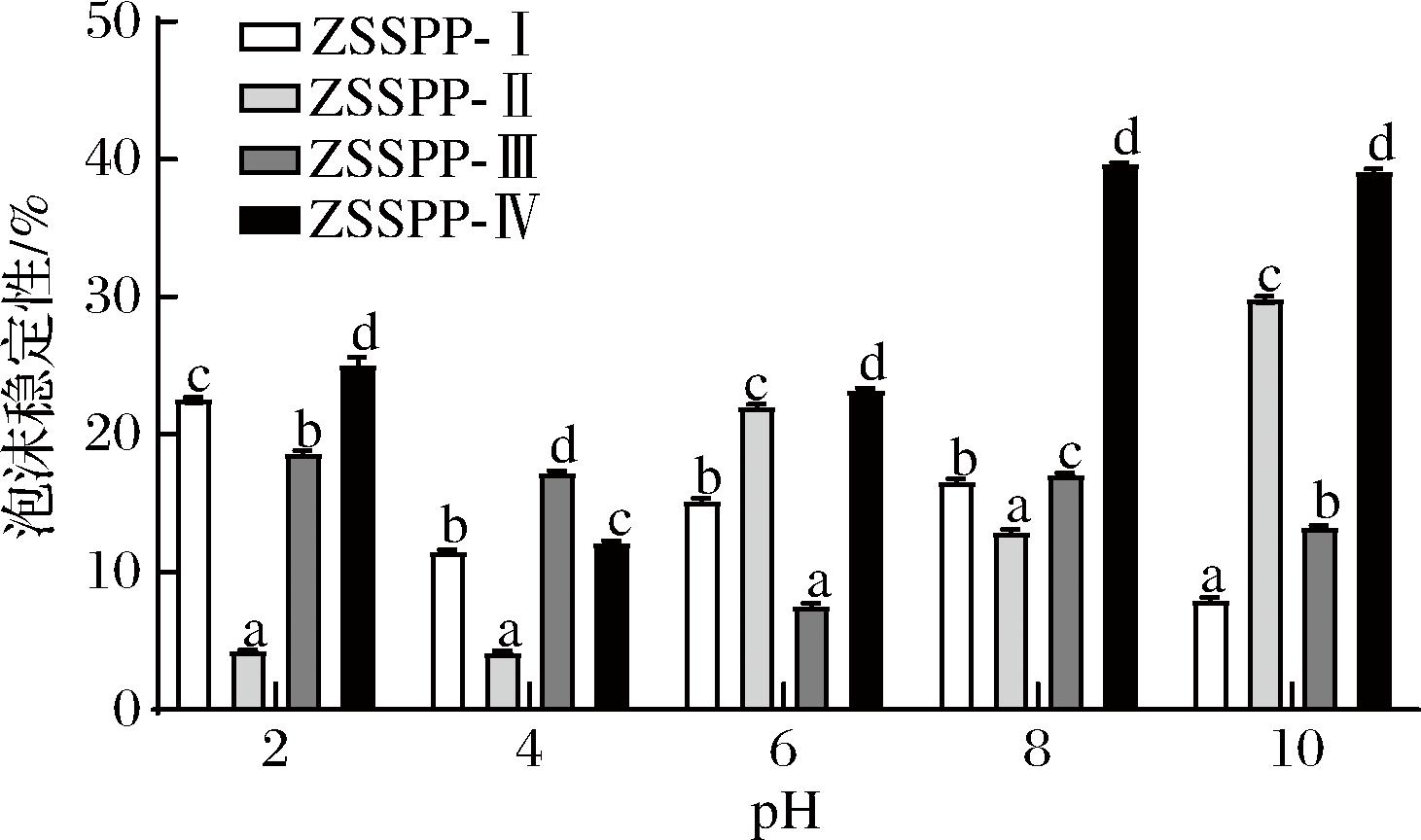
图4 不同分子质量多肽组分的泡沫稳定性
Fig.4 Foam stability of peptide components with different molecular weights
在同一pH条件下,酸枣仁多肽的起泡性顺序为:ZSSPP-I>ZSSPP-Ⅲ>SZPP-Ⅱ>ZSSPP-Ⅳ,ZSSPP-I的起泡性显著高于其他部分,pH值为8和10时,ZSSPP-I的起泡性即可达到62.5%和76.5%,可能由于ZSSPP-I组分分子质量较大,分子链较长或支链较多,更利于泡沫的形成;起泡稳定性的顺序相反,ZSSPP-Ⅳ>SZPP-Ⅱ>ZSSPP-Ⅲ>ZSSPP-I,ZSSPP-Ⅳ起泡稳定性最强,可能由于低分子质量的多肽能够形成更稳定的界面层,增加了分子界面的扩散速率,从而更有利于形成稳定的泡沫[22]。
2.2.4 乳化性与乳化稳定性
本研究分析了不同pH值下酸枣仁多肽的乳化性和乳化稳定性,结果如图5、图6所示,结果显示pH值为4.0时,2种特性均最弱,ZSSPP-I、ZSSPP-Ⅱ、ZSSPP-Ⅲ和ZSSPP-Ⅳ的乳化性分别为:27.24%、10.93%、13.66%、9.27%;乳化稳定性分别为:13.17%、22.64%、39.05%、39.10%。当pH值大于等电点(pH=4.0)时,其乳化性与乳化稳定性不断增强;pH值小于等电点(pH=4.0)时,其乳化性与乳化稳定性增强不明显。结果与酸枣仁多肽溶解度趋势一致,可能由于随着多肽溶液浓度的升高,黏度增强,有利于油相的分布,导致乳化性和乳化稳定性的升高[23]。
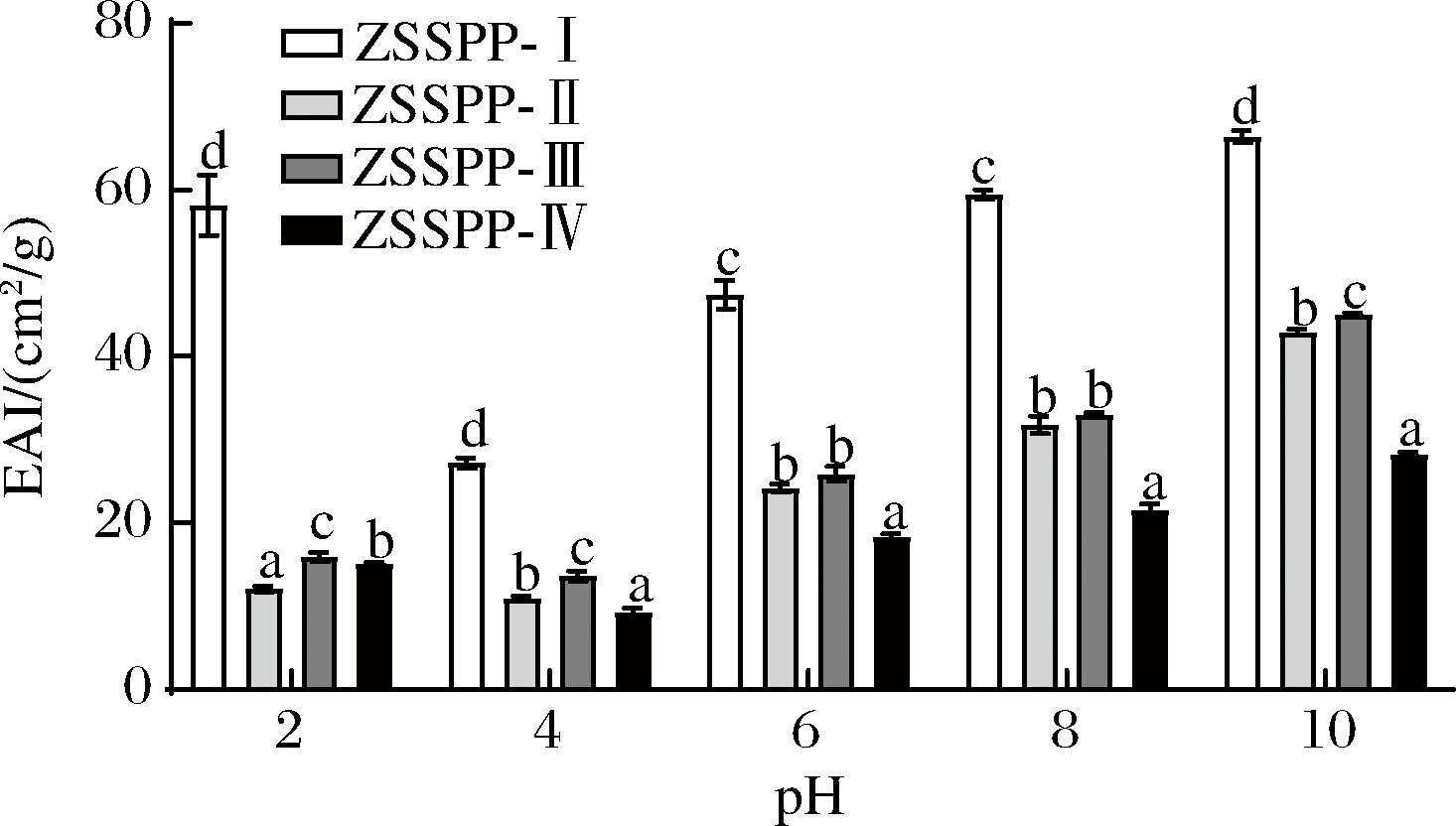
图5 不同分子质量多肽的乳化性
Fig.5 Emulsification of peptides with different molecular weights
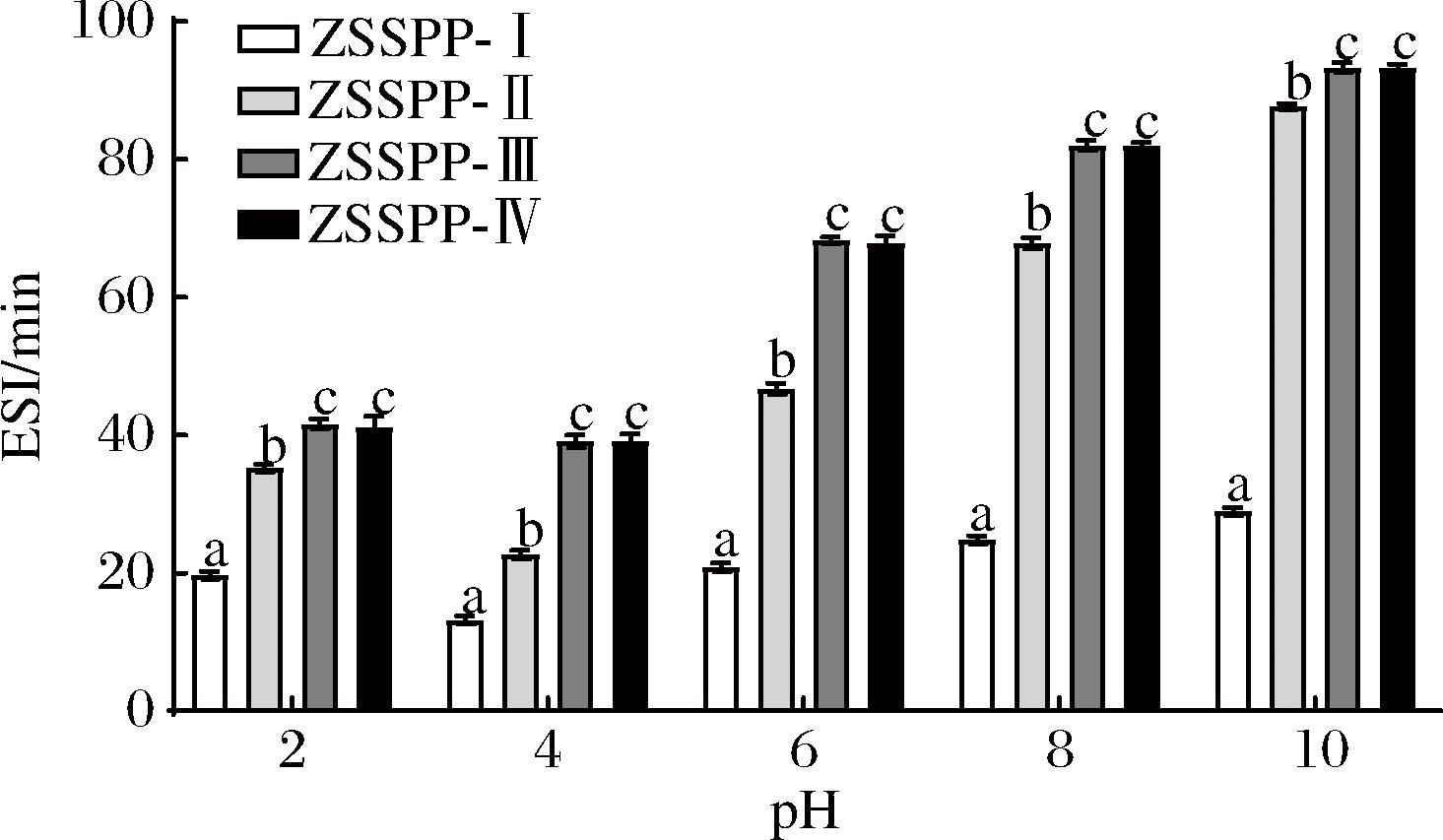
图6 不同分子质量多肽的乳化稳定性
Fig.6 Emulsification stability with peptides of different molecular weights
在同一pH值下,ZSSPP-I的乳化性显著高于其他三部分(P<0.05),而乳化稳定性低于其他三部分(P<0.05)。可能由于分子质量较小的酸枣仁多肽(<10 kDa),疏水基团暴露,不利于其在油-水界面的扩散和吸附,导致乳化性下降;疏水基团过多也会导致疏水作用增强,与脂类结合更稳定,从而有利于形成稳定的乳化体系,乳化稳定性增强[24]。
3 结论
本文比较了酸枣仁多肽的水解方法,并采用超滤法得到4个不同分子质量多肽片段ZSSPP-I(>10 kDa)、ZSSPP-Ⅱ(5~10 kDa)、ZSSPP-Ⅲ(3~5 kDa)、ZSSPP-Ⅳ(<3 kDa),结果表明酸水解法制备的多肽中以ZSSPP-Ⅳ为主,占比约90%,酶水解法制备水解度小,各分子质量组分更均衡,ZSSPP-Ⅳ(<3 kDa)44.73%、ZSSPP-Ⅲ(3~5 kDa)19.42%、ZSSPP-Ⅱ(5~10 kDa)16.31%、ZSSPP-I(>10 kDa)19.54%。因此在制备酸枣仁多肽时可根据功能特性或生物活性的不同,选择目标组分,再通过改变酶水解条件而得到不同组分;而酸水解法能快速将蛋白水解成小分子质量的肽和游离氨基酸,对于制备小分子肽具有重要意义。
功能特性研究表明,分子质量>10 kDa部分多肽的溶解度、吸油性、乳化性及起泡性等特性较强,适合于作为乳化剂、起泡剂等辅料或功能性配料用于食品或保健品的开发;分子质量小于3 kDa的组分起泡稳定性和乳化稳定性较强,同时也可通过酸水解法大量制备,作为添加剂可提高产品的稳定性。因此ZSSPP-I和ZSSPP-Ⅳ是酸枣仁多肽中具有较大开发价值的多肽段,后续还将对其结构及生物活性进行进一步研究,以期为酸枣仁多肽的开发利用提供参考,为酸枣仁药材的全方位应用提供实验基础研究。
[1] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,2004:426-427.Editorial Committee of Chinese Flora, Chinese Academy of Sciences.Flora of China [M].Beijing:Science Press,2004:426-427.
[2] 肖伟斌,曹丽娟.酸枣仁汤联合重复经颅磁刺激治疗原发性失眠的效果分析[J].中国医学创新,2023,20(32):103-106.XIAO W B, CAO L J.Analysis of the effect of Suanzaoren Decoction combined with repetitive transcranial magnetic stimulation in the treatment of primary insomnia[J].Medical Innovation of China,2023,20(32):103-106.
[3] 李子颢,李晟尧,郝雨昂,等.不同剂量酸枣仁治疗老年失眠的临床观察[J].中国民间疗法,2023,31(17):40-43.LI Z H, LI S Y, HAO Y A, et al.Clinical observation of different dosage of Semen Ziziphi spinosae in treating senile insomnia[J].China’s Naturopathy,2023,31(17):40-43.
[4] 黄丽娟.逍遥散合酸枣仁汤治疗更年期失眠症的临床疗效研究[J].现代诊断与治疗,2023,34(14):2081-2083.HUANG L J.Clinical study on Xiaoyao Powder combined with Suanzaoren Decoction in treating menopausal insomnia[J].Modern Diagnosis and Treatment,2023,34(14):2081-2083.
[5] 付镓榕,胡小静,马尚玄,等.不同分子量澳洲坚果多肽制备工艺与抗氧化活性[J].食品工业科技,2023,44(20):414-421.FU J R, HU X J, MA S X, et al.Preparation technology and antioxidant activities of different molecular weight Macadamia nut polypeptides[J].Science and Technology of Food Industry,2023,44(20):414-421.
[6] 齐希光,陆晓婷,张晖,等.不同分子量黑籽瓜种子多肽抗氧化能力的研究[J].食品工业科技,2016,37(9):74-80.QI X G, LU X T, ZHANG H, et al.Study on the in vitro antioxidant capacity of different molecular weight polypeptides of black seed-watermelon seeds[J].Science and Technology of Food Industry,2016,37(9):74-80.
[7] 刘晓艺,周玉岩,过利敏,等.不同分子量红花籽抗氧化肽稳定性研究[J].食品工业科技,2022,43(13):94-102.LIU X Y, ZHOU Y Y, GUO L M, et al.Study on the stability of antioxidant peptides from safflower seeds with different molecular weight[J].Science and Technology of Food Industry, 2022,43(13):94-102.
[8] 胡燃,张慜,陈世豪.酸水解麦麸蛋白质及氨基酸分析[J].食品与生物技术学报,2015,34(1):90-93.HU R, ZHANG M, CHEN S H.Hydrolysis of wheat bran protein by acid and amino acid analysis of hydrolyzate[J].Journal of Food Science and Biotechnology, 2015,34(1):90-93.
[9] 韩荣欣,张红印,沈颖昕,等.酸枣仁蛋白酶解产物功能特性及抗疲劳活性研究[J].食品研究与开发,2021,42(2):1-7.HAN R X, ZHANG H Y, SHEN Y X, et al.Study on functional characteristics and anti-fatigue activity of semen ziziphi spinosae protein hydrolysates[J].Food Research and Development,2021,42(2):1-7.
[10] 徐康,王远兴.半固态酶解法制备豆粕肽工艺的优化[J].中国食品学报,2023,23(7):278-288.XU K, WANG Y X.Optimization of preparation process of soybean meal peptides by semi-solid enzymatic hydrolysis[J].Journal of Chinese Institute of Food Science and Technology,2023,23(7):278-288.
[11] LATORRES J M, RIOS D G, SAGGIOMO G, et al.Functional and antioxidant properties of protein hydrolysates obtained from white shrimp (Litopenaeus vannamei)[J].Journal of Food Science and Technology,2018,55(2):721-729.
[12] 梁吉虹,俞燕芳,邓泽元,等.不同干燥方法对桑叶蛋白理化性质及营养特性的影响[J].食品研究与开发,2023,44(12):1-10.LIANG J H, YU Y F, DENG Z Y, et al.Effects of different drying methods on the physicochemical properties and nutritional properties of mulberry leaf proteins[J].Food Research and Development,2023,44(12):1-10.
[13] SANOVA L A, LISITSYN A N.Simulation of foaming ability, multiplicity, and foam stability of shampoo[J].Russian Journal of Applied Chemistry,2012,85(6):898-906.
[14] DABBOUR M, SAMI R, MINTAH B K, et al.Effect of drying techniques on the physical, functional, and rheological attributes of isolated sunflower protein and its hydrolysate[J].Processes,2021,10(1):13.
[15] 崔春,赵谋明,曾晓房,等.酸法和酶法水解植物蛋白的差异及原因探讨[J].中国调味品,2006, 31(7):9-13.CUI C, ZHAO M M, ZENG X F, et al.Review on the difference between HVP and EVP[J].China Condiment,2006, 31(7):9-13.
[16] LI Y, XUE C Y, QUAN W, et al.Assessment the influence of salt and polyphosphate on protein oxidation and Nε-(carboxymethyl)lysine and Nε-(carboxyethyl)lysine formation in roasted beef patties[J].Meat Science,2021,177:108489.
[17] GROSSMANN L, MCCLEMENTS D J.Current insights into protein solubility:A review of its importance for alternative proteins[J].Food Hydrocolloids,2023,137:108416.
[18] ADEBIYI A P,ALUKO R E.Functional properties of protein fractions obtained from commercial yellow field pea(Pisum sativum L.) seed protein isolate[J].Food Chemistry,2011,128(4):902-908.
[19] 傅亚珍.蛋白质溶液可逆热变性及其与肽链构象关系的研究[J].生物物理学报,1994, 10(1):1-5.FU Y Z. Study on reversible thermal denaturation of protein solution and its relationship with peptide chain conformation[J]. Acta Biophysica Sinica, 1994, 10(1):1-5.
[20] 于明晓,郭顺堂.挤压组织化对脱脂花生蛋白粉持水性和持油性的影响[J].食品工业科技,2007,28(1):87-90.YU M X, GUO S T.The effects of extruding texturization on the water-holding capacity and oil-holding capacity of defatted peanut protein powder[J].Science and Technology of Food Industry, 2007,28(1):87-90.
[21] 冯俊.茶籽粕多肽的制备、理化性质及降血糖活性研究[D].合肥:合肥工业大学,2021.FENG J. Preparation, physicochemical properties and hypoglycemic activity of tea seed meal polypeptide[D]. Hefei: Hefei University of Technology, 2021.
[22] 张婷,陈美如,于一丁,等.生物酶解影响蛋白起泡特性的因素及机理研究进展[J].食品科学,2022,43(7):298-304.ZHANG T, CHEN M R, YU Y D, et al.Progress in understanding the factors influencing the effect of enzymatic hydrolysis on protein foaming characteristics and the underlying mechanisms[J].Food Science, 2022,43(7):298-304.
[23] GEERTS M E J, NIKIFORIDIS C V, VAN DER GOOT A J, et al.Protein nativity explains emulsifying properties of aqueous extracted protein components from yellow pea[J].Food Structure,2017, 14:104-111.
[24] KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al.Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as influenced by the degree of hydrolysis and enzyme type[J].Food Chemistry,2007,102(4):1317-1327.