丁酸梭菌(Clostridium butyricum)又名酪酸梭菌,属于厚壁菌门(Firmicutes)芽孢杆菌科(Bacillaceae)梭菌属(Clostridium)[1],广泛存在于人和动物肠道、粪便以及酒窖泥、土壤和奶酪等厌氧环境中,因能够大量产生丁酸而得名。目前已被广泛应用于医药、食品、养殖和饲料等行业[2],市场需求量大。丁酸梭菌具有良好的益生性能和抗逆性能,可通过与肠道微生物的相互作用来改善肠道屏障功能,对肠道损伤和炎症发挥保护作用[3-4]。丁酸梭菌是一种专性厌氧、可产生芽孢的革兰氏阳性菌[5-6],从应用的角度看,其芽孢菌剂是最为理想的产品形式[7]。
丁酸梭菌存在发酵水平低、菌剂的活菌数低、货架期短以及生产成本高等问题与市场需求形成巨大反差。目前该菌普遍发酵水平在108~109数量级[8],且芽孢形成率较低。深入研究丁酸梭菌的发酵条件,实现其高密度培养与高芽孢形成率是解决上述问题的重要措施。
刘宇琴等[9]采用均匀试验设计与响应面分析方法联用,优化发酵培养基使丁酸梭菌在摇瓶水平最大活菌数达到1.81×109 CFU/mL。朱曦等[10]采用单因素试验优化发酵培养基和发酵工艺可将丁酸梭菌芽孢数达2.28×109 CFU/mL,芽孢形成率可达90%。本文在前人研究的基础上,进一步优化了丁酸梭菌的发酵条件,同时采用分阶段控制pH的策略,在5 L发酵罐上实现丁酸梭菌的高密度发酵和高产芽孢,为进一步开发丁酸梭菌制剂奠定了基础。
1 材料与方法
1.1 菌株与试剂
1.1.1 菌株
丁酸梭菌JNF,江南大学系统发酵与制药工程实验室保藏菌种。
1.1.2 试剂
D(+)-无水葡萄糖、D(+)-果糖、木糖、甘露糖、半乳糖、麦芽糖、蔗糖、乳糖、纤维二糖、海藻糖、可溶性淀粉、羧甲基纤维素钠、L-半胱氨酸盐酸盐、牛肉浸膏、无水乙酸钠、氯化钠、柠檬酸铵、硫酸铵、尿素、鱼粉蛋白胨、大豆蛋白胨、硫酸亚铁、硫乙醇酸钠、抗坏血酸、磷酸氢二钾、柠檬酸三钠、硫酸锰、硫酸镁、氯化钙、琼脂、氢氧化钠、氨水、盐酸,国药集团化学试剂有限公司;阿拉伯糖、来苏糖、低聚木糖、低聚果糖、低聚麦芽糖、低聚半乳糖,低聚异麦芽糖、大豆低聚糖、棉子糖、水苏糖、果胶、菊糖、革兰氏染色液,源叶生物科技有限公司;胰蛋白胨、酵母浸粉,赛默飞世尔科技有限公司;玉米浆,上海阿拉丁生化科技股份有限公司。
1.1.3 培养基
强化梭菌培养基(reinforced clostridium medium,RCM)(g/L):牛肉浸粉10.00、蛋白胨10.00、酵母浸粉3.00、可溶性淀粉1.00、葡萄糖5.00、乙酸钠 3.00、氯化钠5.00、L-半胱氨酸盐酸盐0.50,pH值6.8±0.1,121 ℃灭菌15 min。
亚硫酸铁琼脂培养基(g/L):胰蛋白胨15.00、大豆蛋白胨5.00、酵母浸膏5.00、偏重亚硫酸钠1.00、柠檬酸铁铵1.00、琼脂20.00,pH值7.6±0.1,121 ℃灭菌15 min。
活化培养基和基础发酵培养基均为RCM培养基,计数培养基为亚硫酸铁琼脂培养基。
1.2 仪器与设备
Whitley DG250厌氧箱,英格兰Don Whitley Scientific公司;XSP-BM-2CB光学显微镜,上海彼爱姆光学仪器制造有限公司;S22型微量pH计,上海Mettler Toledo仪器有限公司;UV-1000分光光度计,上海翱艺仪器有限公司;GF150DA高压灭菌锅,美国Zealway公司;SW-CJ-1FD超净工作台,苏州净化设备有限公司;Accuri C6 Plus流式细胞仪,美国碧迪公司;Auvon细菌计数板,北京海富达科技有限公司;5 L发酵罐,汇森生物设备镇江有限公司。
1.3 实验方法
1.3.1 菌种活化
将丁酸梭菌接种于RCM固体培养基中,倒置于厌氧培养箱(80% N2、10% CO2、10% H2)中37 ℃恒温培养24 h。挑其单菌落接种到液体培养基并厌氧培养至对数生长中期,得到活化后的种子液。
1.3.2 菌体量测定
将活化后的丁酸梭菌种子液以3%的接种量接入100 mL RCM培养基中厌氧培养24 h,每2 h取样。将待测液以空白RCM培养基作为对照,用分光光度计测定菌悬液的OD600值;将待测菌悬液稀释合适浓度后采用细菌计数板和流式细胞仪计菌体量[11]。绘制出不同方法测定出的丁酸梭菌生长曲线,确定菌体量测定方法。
1.3.3 残糖质量浓度测定
按照胥聆铭等[12]报道的方法测残糖量。
1.3.4 芽孢计数方法
取菌液于80 ℃水浴加热10 min后再用稀释平板计数法测定芽孢数。芽孢率计算如公式(1)所示:
产孢率![]()
(1)
1.3.5 培养基组分单因素试验
分别考察不同碳源、氮源、无机盐以及除氧剂在不同浓度时对丁酸梭菌生长的影响。发酵实验采用装100 mL培养基的250 mL三角瓶,丁酸梭菌种子液以3%的接种量接入培养基,置于37 ℃厌氧箱培养20 h。
1.3.6 响应面试验优化培养基组分
以单因素试验结果为基础,选取可溶性淀粉、酵母浸粉和磷酸氢二钾3个因素进行优化。以可溶性淀粉、酵母浸粉和磷酸氢二钾的单因素试验最优结果为零水平,以高于或低于零水平1个实际步长为高水平和低水平,步长设定为单因素试验梯度的一半。其他成分按单因素试验最优结果添加。
1.3.7 培养条件优化
在三角瓶规模采用优化后的最佳培养基组分为基础进行发酵条件的优化,分别考察不同温度、接种量以及初始pH值对菌体量的影响,初始pH值利用3 mol/L HCl和NaOH溶液调节。
1.3.8 发酵过程中pH值优化
在上述优化培养基以及培养条件基础上,将活化后的丁酸梭菌种子液接种于5 L发酵罐,于37 ℃条件下进行发酵。当pH值降至设定值后,通过流加10%氨水进行pH调控。
1.3.9 分阶段调控pH策略
在5 L发酵罐中,发酵至pH值降为5.5后保持直至刚进入稳定期,随后调节pH值为6.0直至发酵结束。
1.3.10 镜检染色
将发酵液取样涂片,通过革兰氏染色法染色,利用光学显微镜观察丁酸梭菌形态。
1.4 数据统计与分析
实验中每个实验值均是3次平行实验的平均值,不同组间的差异显著性采用 IBM SPSS Statistics 26.0软件进行单因素 ANOVA 分析,P<0.05 则认为差异显著;采用 GraphPad Prism 8.0 进行折线图和柱形图的绘制,中心复合试验运用 Design Expert 13 软件进行数据分析。
2 结果与分析
2.1 菌体量测定方法确定
由于丁酸梭菌严格厌氧,其营养体状态下菌体量难以通过平板计数获得,故分别考察了分光光度计、细菌计数板和流式细胞仪3种方法检测丁酸梭菌发酵过程中的菌体量,结果如图1所示。各个检测点细菌计数板计数结果和流式细胞仪检测结果基本吻合,由于OD值无法区分培养过程中菌体和芽孢这两种形式,故本实验采用细菌计数板来检测该菌生长情况。该菌在培养2 h后进入对数生长期,在4~10 h迅速生长,随后进入稳定期,在20 h菌体量达到最大,菌体量为7.8×108个/mL。因此后期发酵优化实验均选择丁酸梭菌培养20 h时进行计数检测。
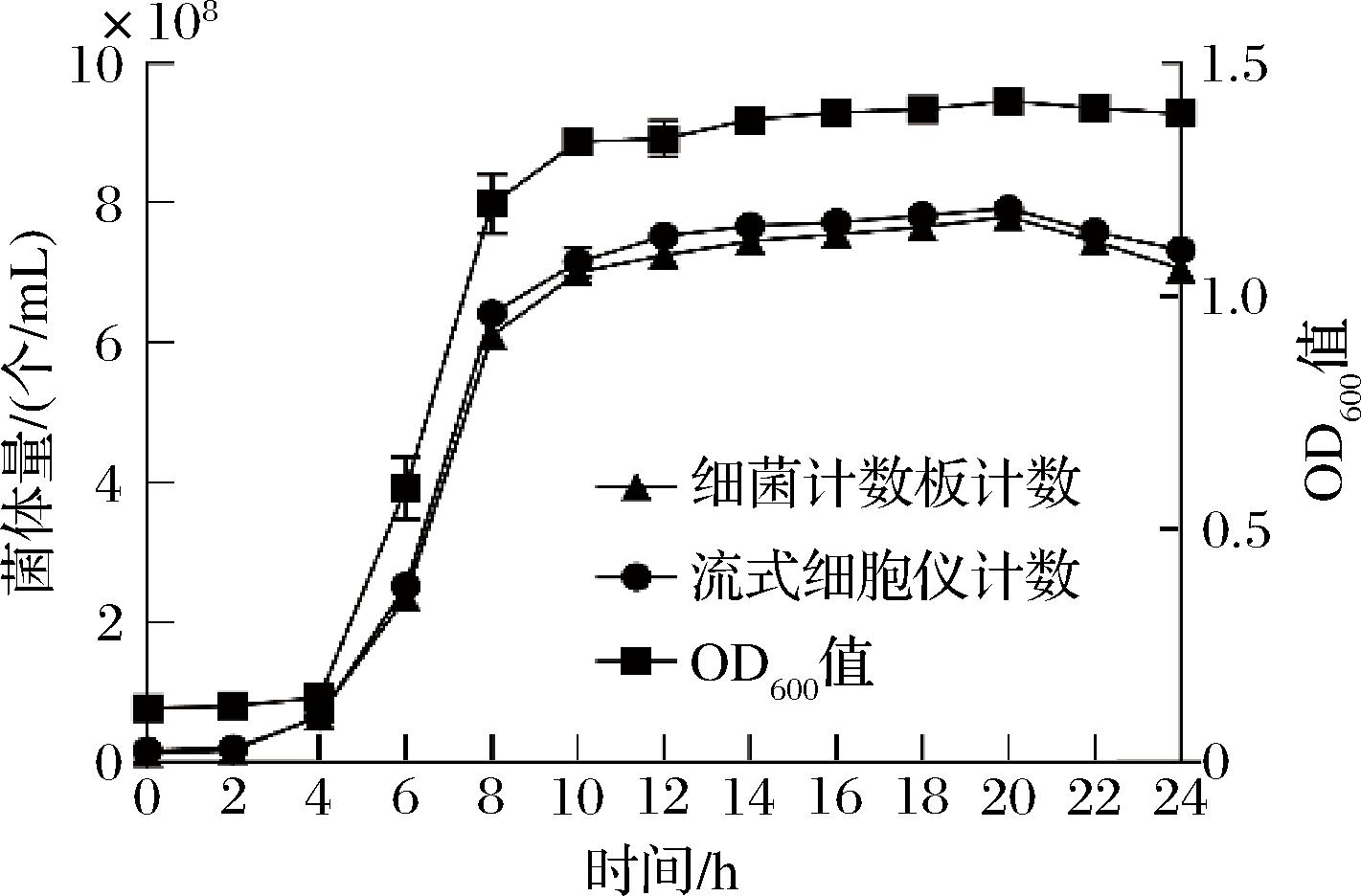
图1 不同方法测定的丁酸梭菌生长曲线
Fig.1 The growth curve of Clostridium butyricumdetermined by different methods
2.2 不同碳源对丁酸梭菌生长的影响
碳源作为微生物的能量来源之一,对微生物的生长具有重要作用[13-14]。分别考察了常见的3种五碳糖、4种六碳糖、5种双糖、8种低聚糖和4种多糖作为碳源对丁酸梭菌生长情况的影响,培养基中碳源质量浓度设置为10 g/L,结果如图2-a所示。除了3种五碳糖、海藻糖、低聚木糖以及羧甲基纤维素钠不能被利用外,其余碳源均能被该菌利用,其中以可溶性淀粉为唯一碳源时最佳,菌体量可达8.8×108 个/mL,该结果与邢宏观等[15]的研究基本一致。继而考察了不同浓度的可溶性淀粉对该菌生长的影响,结果如图2-b所示。当可溶性淀粉质量浓度在2~10 g/L,丁酸梭菌菌体量随着可溶性淀粉浓度增加而增加。进一步提高可溶性淀粉浓度对菌体生长没有影响,并且至发酵20 h后仍有较多的残糖。综合考虑,选择10 g/L可溶性淀粉为初始碳源浓度。

a-碳源种类;b-可溶性淀粉初始质量浓度
图2 不同碳源以及可溶性淀粉初始质量浓度对丁酸梭菌菌体量和剩余残糖的影响
Fig.2 Effects of different carbon sources and initial concentration of soluble starch on the biomass and residual sugar of Clostridium butyricum
注:不同小写字母表示菌体量具有显著性差异(P<0.05),不同大写字母表示残糖具有显著性差异(P<0.05)(下同)。
2.3 不同氮源对丁酸梭菌生长的影响
分别考察了9种氮源对该菌生长的影响,培养基中氮源质量浓度设置为20 g/L,结果见图3-a。丁酸梭菌在柠檬酸铵、硫酸铵以及玉米浆为唯一氮源的培养基中不生长,在其余氮源中均能生长。其中以酵母浸粉为氮源时,丁酸梭菌生长最好,培养20 h后丁酸梭菌菌体量可达9.3×108 个/mL。接着对不同初始浓度酵母浸粉对该菌生长的影响进行考察,结果如图3-b所示。随着酵母浸粉浓度的增加,菌体量随之变化,当酵母浸粉质量浓度为30 g/L时,该菌生长最为良好,菌体量可达1.05×109个/mL。
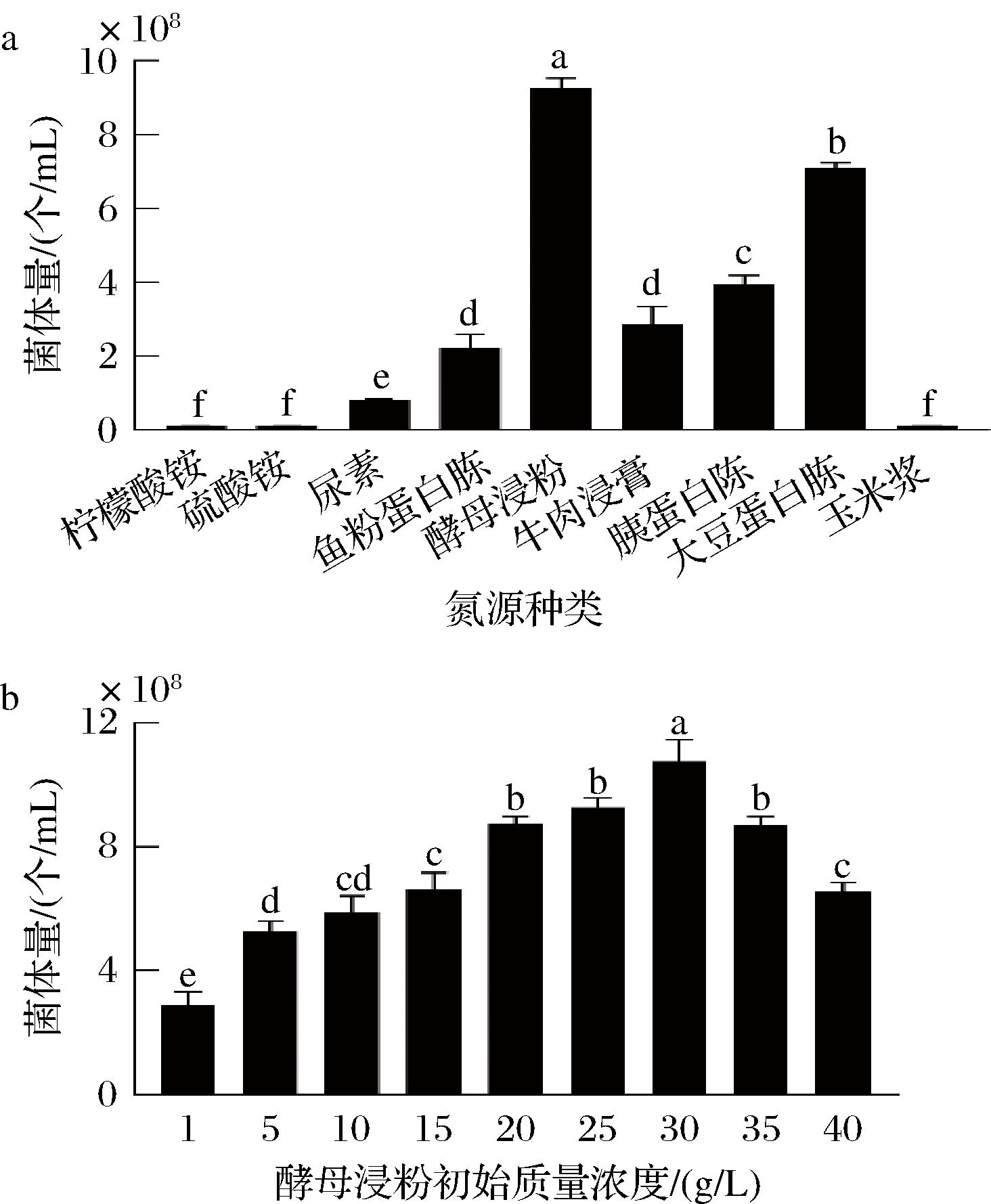
a-氮源种类;b-酵母浸粉初始质量浓度
图3 不同氮源以及酵母浸粉初始质量浓度对丁酸梭菌菌体量的影响
Fig.3 Effects of different nitrogen sources and initial concentration of yeast extract on the biomass ofClostridium butyricum
2.4 不同无机盐对丁酸梭菌生长的影响
Ca2+、Mg2+、Zn2+、Mn2+、Na+和K+是文献报道中最常见的影响菌体生长的金属离子[16-17],分别考察了7种无机盐对该菌生长的影响,实验结果如图4所示。0.8 g/L氯化钙、0.6 g/L硫酸镁、0.2 g/L硫酸锰、5 g/L磷酸氢二钾和4 g/L乙酸钠分别是促进丁酸梭菌生长的最佳添加量。柠檬酸三钠并未显著提高丁酸梭菌菌体量(P>0.05),而硫酸锌则表现为对该菌生长的抑制作用。添加5 g/L磷酸氢二钾对丁酸梭菌的菌体量有显著提高。这可能是因为磷酸盐既参与了磷脂、核酸以及多种辅酶的构成,同时还在代谢调节方面发挥着重要作用[18]。因此选择在后续实验发酵培养基中添加0.8 g/L氯化钙、0.6 g/L硫酸镁、0.2 g/L硫酸锰、5 g/L磷酸氢二钾和4 g/L乙酸钠。

a-氯化钙;b-硫酸镁;c-硫酸锰;d-硫酸锌;e-乙酸钠;f-磷酸氢二钾;g-柠檬酸三钠
图4 无机盐对丁酸梭菌菌体量的影响
Fig.4 Effect of mineral salts on the biomass of Clostridium butyricum
2.5 除氧剂对丁酸梭菌生长的影响
丁酸梭菌是严格厌氧菌,在培养过程中需要维持无氧环境。考察了4种常见具有清除培养基中活性氧(reactive oxygen species,ROS)能力的试剂对该菌生长的影响[19-20]。实验结果如图5所示,相比于未添加除氧剂的培养基,添加半胱氨酸盐酸盐后,丁酸梭菌菌体量得到显著提高。其最适添加量为0.5 g/L。在该培养条件下,丁酸梭菌菌体量可达1.57×109个/mL。
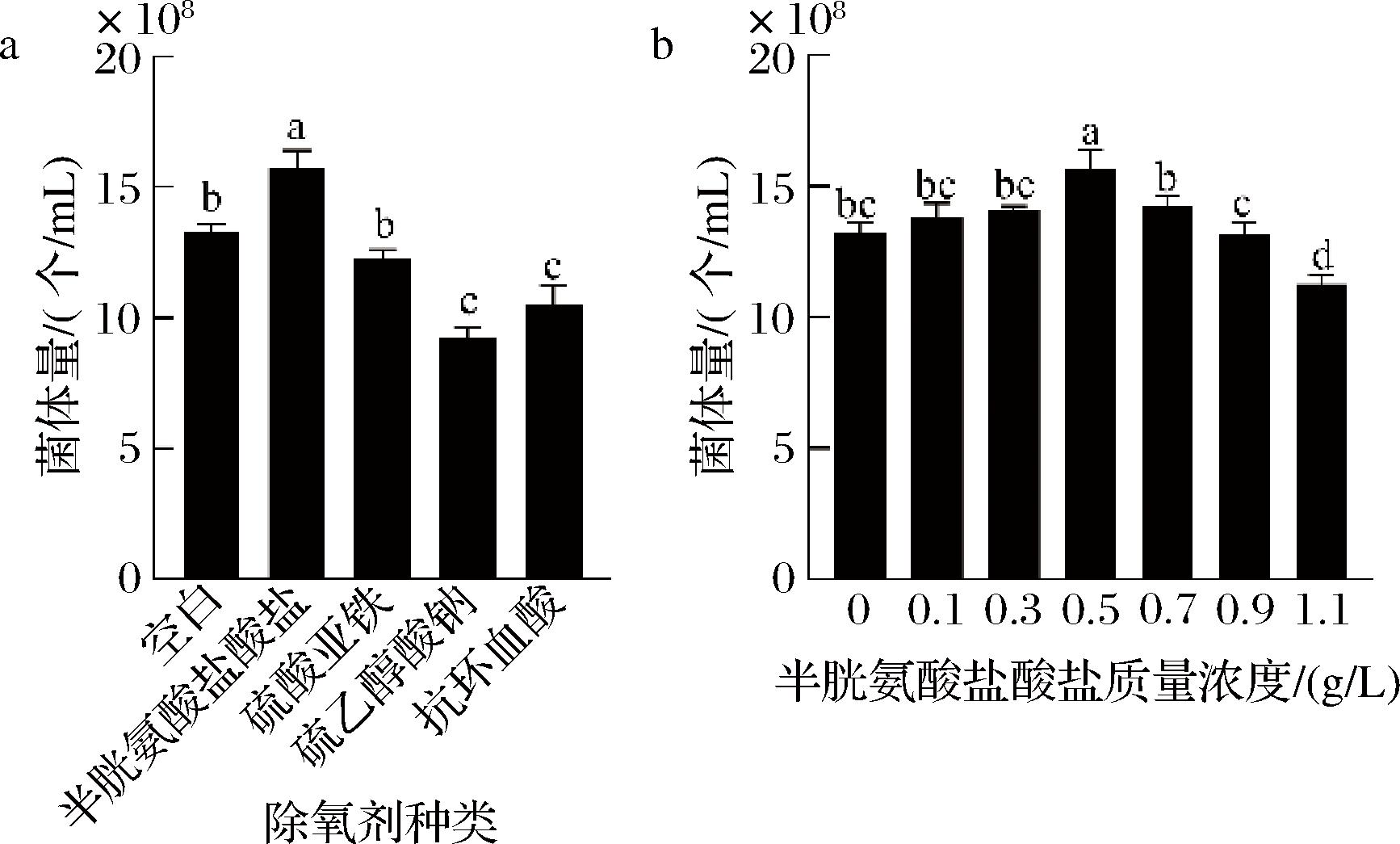
a-除氧剂种类;b-半胱氨酸盐酸盐质量浓度
图5 不同除氧剂和添加量对丁酸梭菌菌体量的影响
Fig.5 Effect of different oxygen scavengers and dosages on the biomass of Clostridium butyricum
2.6 响应面实验
碳源、氮源和无机盐是影响菌体生长的主要因素,刘瑾等[21]通过响应面分析发现碳氮源浓度对丁酸梭菌菌体生长影响显著,与上述单因素试验结果类似。同时实验发现添加磷酸氢二钾能显著提高菌体量。因此选择以上三因素进行响应面分析,根据单因素试验结果确定可溶性淀粉、酵母浸粉和磷酸氢二钾的浓度取值范围。以其浓度为自变量,分别用A、B、C表示,并以丁酸梭菌菌体量(y)为响应值。实验因素与水平见表1,实验结果见表2,回归模型方差分析结果见表3。
表1 中心复合试验设计因素与水平
Table 1 Factors and levels of central composite experiments design

试验水平可溶性淀粉/(g/L)酵母浸粉/(g/L)磷酸氢二钾/(g/L)-17.527.54.0010.030.05.0+112.532.56.0
表2 中心复合试验结果
Table 2 The results of central composite experiments
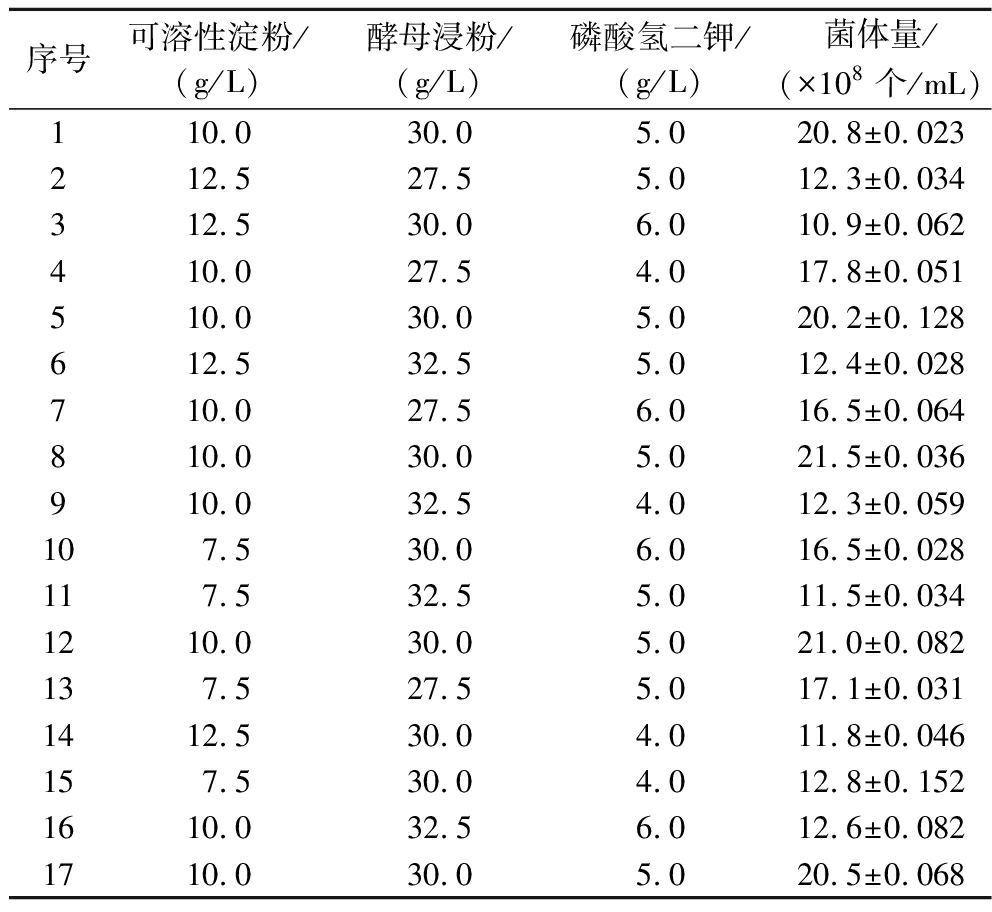
序号可溶性淀粉/(g/L)酵母浸粉/(g/L)磷酸氢二钾/(g/L)菌体量/(×108个/mL)110.030.05.020.8±0.023212.527.55.012.3±0.034312.530.06.010.9±0.062410.027.54.017.8±0.051510.030.05.020.2±0.128612.532.55.012.4±0.028710.027.56.016.5±0.064810.030.05.021.5±0.036910.032.54.012.3±0.059107.530.06.016.5±0.028117.532.55.011.5±0.0341210.030.05.021.0±0.082137.527.55.017.1±0.0311412.530.04.011.8±0.046157.530.04.012.8±0.1521610.032.56.012.6±0.0821710.030.05.020.5±0.068
表3 回归模型方差分析结果
Table 3 The results of variance analysis of regression model
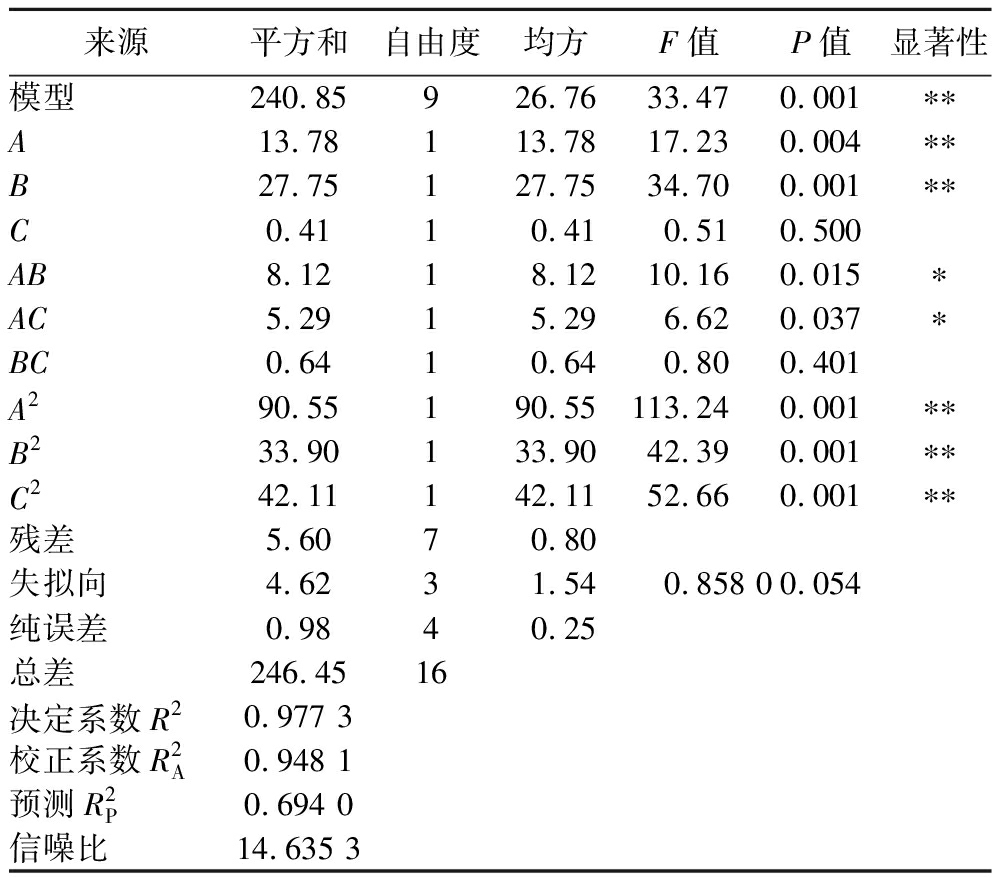
来源平方和自由度均方F值P值显著性模型240.85926.7633.470.001∗∗A13.78113.7817.230.004∗∗B27.75127.7534.700.001∗∗C0.4110.410.510.500AB8.1218.1210.160.015∗AC5.2915.296.620.037∗BC0.6410.640.800.401A290.55190.55113.240.001∗∗B233.90133.9042.390.001∗∗C242.11142.1152.660.001∗∗残差5.6070.80失拟向4.6231.540.858 00.054纯误差0.9840.25总差246.4516决定系数R20.977 3校正系数R2A0.948 1预测R2P0.694 0信噪比14.635 3
注:“*”“**”分别表示 P<0.05、P<0.01 水平差异显著。
经过二次多项回归拟合后,得到以下回归方程预测模型:y=20.80-1.31A-1.86B+0.23C+1.43AB-1.15AC+0.40BC-4.62A2-2.84B2-3.16C2。
由表3可知,模型P=0.001,决定系数R2=0.977 3,且模型失拟项的P值为0.054,影响不显著,说明建立的模型可以较好地反映不同条件下丁酸梭菌菌体量变化情况。因此可以用该回归方程对丁酸梭菌生长情况进行分析和预测。
对回归模型进行分析,AB和AC的P值<0.05,说明可溶性淀粉与酵母浸粉和可溶性淀粉与磷酸氢二钾的交互作用显著,其曲面图如图6-a和图6-b所示;BC的P值>0.05,说明酵母浸粉与磷酸氢二钾的交互作用不显著,其曲面线图如图6-c所示。利用Design Expert 13软件分析模型极值,得到丁酸梭菌发酵培养基中可溶性淀粉、酵母浸粉和磷酸氢二钾对应的质量浓度参数为10.34、30.96、5.12 g/L,此条件下丁酸梭菌菌体量预测值为2.13×109个/mL。为了证实上述优化实验的准确性,在三角瓶规模进行发酵实验验证。丁酸梭菌实际菌体量为2.10×109个/mL,同预测结果相近,说明本研究所建立的数学模型可靠。
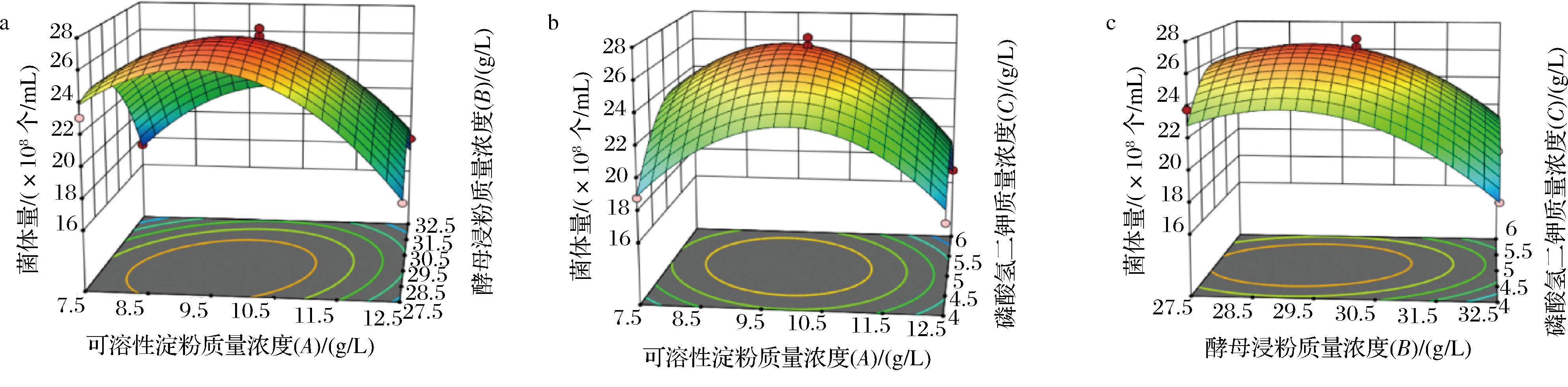
a-可溶性淀粉和酵母浸粉交互;b-可溶性淀粉和磷酸氢二钾交互;c-酵母浸粉和磷酸氢二钾交互
图6 三因素交互作用对丁酸梭菌菌体量影响的曲面图
Fig.6 Surface plots for interaction effects of three factors on the biomass of Clostridium butyricum
2.7 丁酸梭菌发酵条件优化
在三角瓶规模考察了温度、接种量以及培养基初始pH值对该菌生长的影响,结果如图7所示。丁酸梭菌在37 ℃培养时生长最为良好;在最优的接种量1%时,菌体量可达2.30×109个/mL;初始pH值为7.0时,菌体量最高为2.36×109个/mL。其最优发酵条件与李妍等[22]的研究结果基本一致。

a-温度;b-接种量;c-初始pH值
图7 不同、接种量和初始pH值对丁酸梭菌菌体量的影响
Fig.7 Effects of different temperature、inoculation amounts and initial pH on the biomass of Clostridium butyricum
2.8 pH值对菌体生长及产孢的影响
丁酸梭菌发酵过程中,有机酸大量积累,发酵液pH值快速下降,进而影响菌体生长和产孢情况。利用5 L发酵罐进一步探究了发酵液pH值对丁酸梭菌的生长和产孢的影响,结果如图8所示。当发酵液从初始pH值降低至5.5并维持pH值为5.5,丁酸梭菌生长最好,刚进入稳定期菌体量达3.33×109 个/mL,但几乎不产生芽孢;而发酵液pH值维持在6.0~7.0时,丁酸梭菌生长受到抑制(P<0.05),但产孢率可达到90%以上。说明发酵过程中pH值是影响丁酸梭菌生长和产孢的重要因素,这与胥聆铭等[12]观察到的结果相似,因而考虑分阶段调控pH值,以达到同时兼顾该菌的生长和产孢的目的。

图8 不同pH值对丁酸梭菌菌体量和产孢的影响
Fig.8 Effect of different pH values on the biomass and sporulation of Clostridium butyricum
2.9 分阶段调控pH对丁酸梭菌生长与产孢的影响
采用流加氨水分阶段调控pH,进一步研究该策略下丁酸梭菌的生长与产孢情况,结果如图9所示。在5 L发酵罐中,发酵初始pH值为7.0,发酵6 h pH值降低至5.5,保持该pH值发酵至10 h时菌体量可达3.3×109个/mL,比优化前提高了3.23倍。随后将pH值上调至6.0,继续发酵至22 h,此时菌体量为3.1×109个/mL,芽孢数可达2.9×109 CFU/mL,芽孢形成率为93%。通过革兰氏染色对发酵过程中的细菌进行观察,结果如图10所示,该菌在对数期(0~10 h)为营养体形态;当菌体生长进入稳定期后,通过上调pH至6.0,在14~16 h时形成芽孢;发酵至22 h时,芽孢形成率可达90%以上。上述研究工作为进一步研制高活性的丁酸梭菌菌剂奠定了基础。
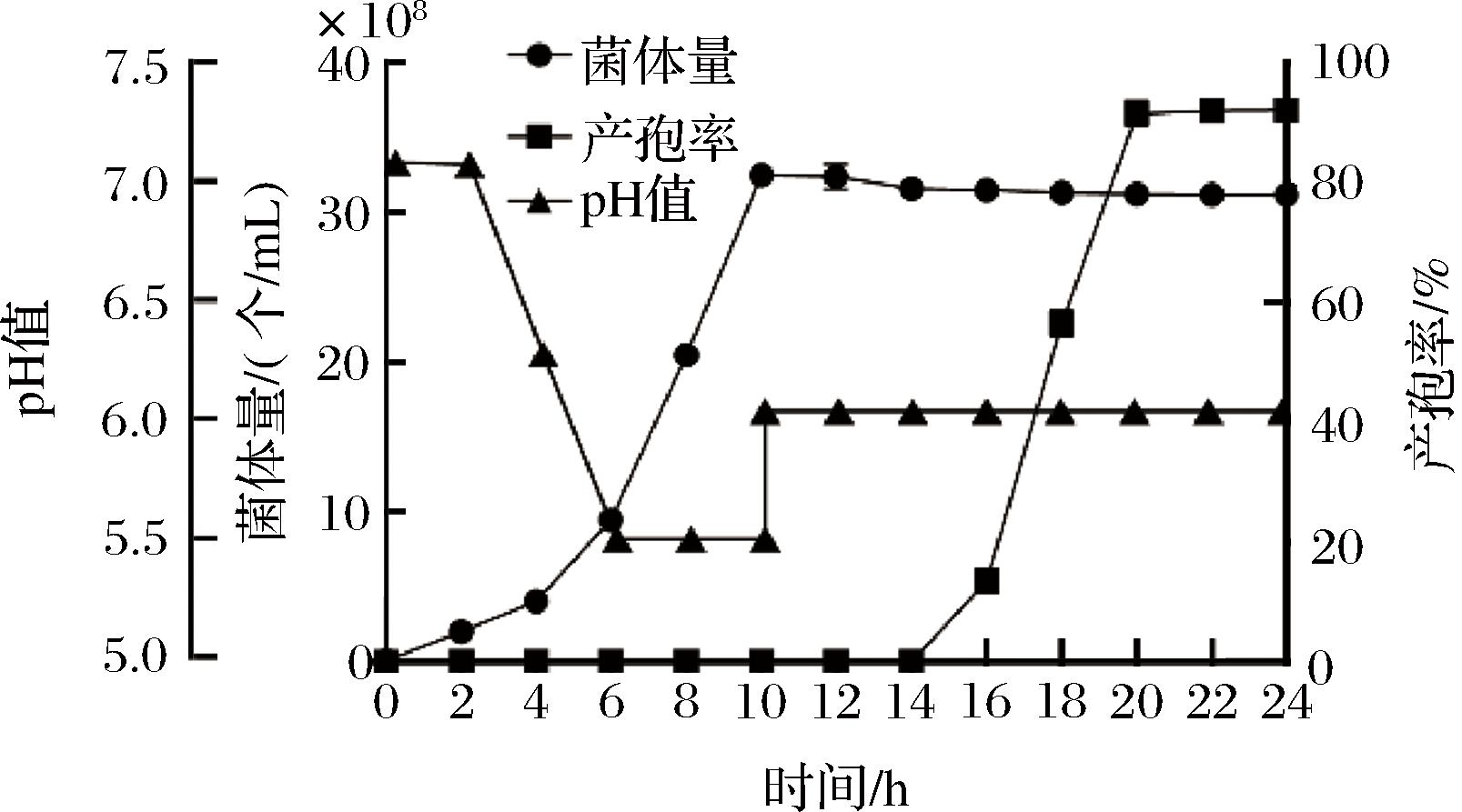
图9 分阶段调控pH值对丁酸梭菌菌体量和产孢的影响
Fig.9 The effect of staged pH regulation on the biomass and sporulation of Clostridium butyricum

图10 分阶段发酵过程中丁酸梭菌的形态变化
Fig.10 Morphological changes of Clostridium butyricum during staged fermentation
3 结论与讨论
本文通过单因素试验和响应面实验,在三角瓶规模优化了丁酸梭菌的培养基组成,具体组分为:10.34 g/L可溶性淀粉、30.96 g/L酵母浸粉、5.12 g/L磷酸氢二钾、4.00 g/L乙酸钠、0.50 g/L半胱氨酸盐酸盐、0.80 g/L氯化钙、0.60 g/L硫酸镁、0.20 g/L硫酸锰。最佳的发酵条件:培养温度为37 ℃、接种量1%、初始pH值为7.0。使用5 L发酵罐优化丁酸梭菌发酵过程pH,发现5.5为最适生长pH值,6.0为最适产孢pH值。在5 L发酵罐上通过分阶段调控pH策略:第一阶段初始pH 7.0,发酵6 h;第二阶段从发酵6 h到10 h,通过流加氨水保持pH值为5.5;第三阶段发酵10 h时上调pH值为6.0直至发酵结束。在此发酵工艺下,丁酸梭菌在5 L发酵罐最大菌体量为3.3×109 个/mL,比优化前(7.8×108 个/mL)提高了3.23倍;发酵结束时,芽孢数为2.9×109 CFU/mL,产孢率为93%。与未优化方案相比,采用分阶段调控pH的策略可实现丁酸梭菌高密度培养并达到高产孢率的目的。
[1] 梁丽潇, 叶金云, 李爱科, 等.丁酸梭菌的特性及其在水产动物中的应用研究进展[J].中国饲料, 2023(19):87-95.LIANG L X, YE J Y, LI A K, et al.Progress on the characteristics of Clostridium butyricum and its application in aquatic animals[J].China Feed, 2023(19):87-95.
[2] 陈俊超, 附俊杰, 刘军, 等.丁酸梭菌的益生特性及其活性代谢产物[J].食品研究与开发,2023, 44 (23):145-152.CHEN J C, FU J J, LIU J, et al.Probiotic characteristics and active metabolites of Clostridium butyricum[J].Food Research and Development,2023, 44 (23):145-152.
[3] LIU M, UYANGA V A, CAO X K, et al.Regulatory effects of the probiotic Clostridium butyricum on gut microbes, intestinal health, and growth performance of chickens[J].The Journal of Poultry Science, 2023, 60(2):2023011.
[4] STOEVA M K, GARCIA-SO J, JUSTICE N, et al.Butyrate-producing human gut symbiont, Clostridium butyricum, and its role in health and disease[J].Gut Microbes, 2021, 13(1):1-28.
[5] WYDAU-DEMATTEIS S, LOUIS M, ZAHR N, et al.The functional dlt operon of Clostridium butyricum controls the D-alanylation of cell wall components and influences cell septation and vancomycin-induced lysis[J].Anaerobe, 2015, 35(Pt B):105-114.
[6] ZOU W, YE G B, ZHANG K Z, et al.Analysis of the core genome and pangenome of Clostridium butyricum[J].Genome, 2021, 64(1):51-61.
[7] CAI L Y, HARTANTO R, ZHANG J, et al.Clostridium butyricum improves rumen fermentation and growth performance of heat-stressed goats in vitro and in vivo[J].Animals (Basel), 2021, 11(11):3261.
[8] 吴天福, 谢小林, 陈美标, 等.丁酸梭菌厌氧发酵机制及高密度厌氧发酵方式研究进展[J].食品与机械, 2020, 36(1):222-229.WU T F, XIE X L, CHEN M B, et al.Research progress on anaerobic fermentation mechanism and high-density anaerobic fermentation of Clostridium butyrate [J].Food and Machinery, 2020, 36(1):222-229.
[9] 刘宇琴, 董云鹏, 蔡俊.丁酸梭菌发酵培养基优化研究[J].饲料研究, 2023, 46(3):71-77.LIU Y Q, DONG Y P, CAI J.Optimization of fermentation medium for Clostridium butyricum[J].Feed Research, 2023, 46(3):71-77.
[10] 朱曦, 李英俊, 梅余霞, 等.丁酸梭菌MY-Z高密度发酵培养基及发酵工艺的优化[J].养殖与饲料, 2022, 21(11):21-27.ZHU X, LI Y J, MEI Y X, et al.Optimization of high density fermentation medium and fermentation process of Clostridium butyricum MY-Z[J].Animals Breeding and Feed, 2022, 21(11):21-27.
[11] FROSSARD A, HAMMES F, GESSNER M O.Flow cytometric assessment of bacterial abundance in soils, sediments and sludge[J].Frontiers in Microbiology, 2016, 7:903.
[12] 胥聆铭, 朱莉, 詹晓北, 等.蜡样芽孢杆菌高密度发酵条件与过程的优化[J].食品与生物技术学报, 2023, 42(8):46-53.XU L M, ZHU L, ZHAN X B, et al.Optimization of high cell density fermentation conditions and process of Bacillus cereus[J].Journal of Food Science and Biotechnology, 2023, 42(8):46-53.
[13] MOHAMMED S, BEHERA H T, DEKEBO A, et al.Optimization of the culture conditions for production of Polyhydroxyalkanoate and its characterization from a new Bacillus cereus sp.BNPI-92 strain, isolated from plastic waste dumping yard[J].International Journal of Biological Macromolecules, 2020, 156:1064-1080.
[14] ZHAO Y, XU Y F, YU F, et al.Identification of a novel phospholipase D gene and effects of carbon sources on its expression in Bacillus cereus ZY12[J].Journal of Microbiology, 2018, 56(4):264-271.
[15] 邢宏观, 林建国, 钟雪兆, 等.响应面法优化丁酸梭菌发酵培养工艺[J].食品工业科技, 2016, 37(19):237-243.XING H G, LIN J G, ZHONG X Z,et al.Optimization of fermentation process for Clostridium butyricum using response surface methodology[J].Science and Technology of Food Industry, 2016, 37(19):237-243.
[16] GROOT M N, KLAASSENS E, DE VOS W M, et al.Genome-based in silico detection of putative manganese transport systems in Lactobacillus plantarum and their genetic analysis[J].Microbiology (Reading), 2005, 151(Pt 4):1229-1238.
[17] LENZ C A, VOGEL R F.Effect of sporulation medium and its divalent cation content on the heat and high pressure resistance of Clostridium botulinum type E spores[J].Food Microbiology, 2014, 44:156-167.
[18] 张文芝, 郭坚华.微生物发酵工艺优化研究进展[J].广东农业科学, 2013, 40(6):114-117.ZHANG W Z, GUO J H.Research advances in microbial fermentation process optimization[J].Guangdong Agricultural Sciences, 2013, 40(6):114-117.
[19] MAI S, WANG G Y, WU P F, et al.Interactions between Bacillus cereus CGMCC 1.895 and Clostridium beijerinckii NCIMB 8052 in coculture for butanol production under nonanaerobic conditions[J].Biotechnology and Applied Biochemistry, 2017, 64(5):719-726.
[20] WOODS D R, JONES D T.Physiological responses of Bacteroides and Clostridium strains to environmental stress factors[J].Advances in Microbial Physiology, 1986, 28:1-64.
[21] 刘瑾, 赵华.响应面法优化丁酸梭菌快速增殖基础培养基[J].中国调味品, 2023, 48(2):65-70.LIU J, ZHAO H.Optimization of basic medium for Clostridium butyricum rapid proliferation by response surface methodology[J].China Condiment, 2023, 48(2):65-70.
[22] 李妍, 李拖平, 孙勇勇.培养条件对酪酸梭菌增殖生长的影响[J].食品工业科技, 2013, 34(18):217-221.LI Y, LI T P, SUN Y Y.Effects of cultural conditions on the growth of Clostridium butyricum[J].Science and Technology of Food Industry, 2013, 34(18):217-221.