西兰花是一种味道鲜美、对人体有益的十字花科蔬菜,因其花球为深绿色,又叫绿花菜。西兰花不仅营养价值高,还含有硫代葡萄糖苷、萝卜硫素等抗癌化合物,素有“蔬菜皇冠”的美誉,深受全球消费者的青睐[1]。然而西兰花采收后呼吸代谢旺盛,在常温下1~2 d就会失水萎蔫、出现黄化甚至腐烂变质的现象,导致品质下降,失去商品价值。随着生活方式的改变,鲜切西兰花因其能方便消费者烹饪,同时大幅减少厨余垃圾,具有广阔的市场前景[2]。然而鲜切加工会加剧西兰花的损伤,引起组织软化、水分流失加快,更易受到微生物侵染,贮藏期大幅缩短,影响其商品价值和市场流通[3]。因此,亟需研究便捷安全高效的保鲜技术来提高采后鲜切西兰花的贮藏品质。
双乙酰广泛存在于植物精油、葡萄酒、烘焙咖啡、蜂蜜和多种发酵食品中,以其黄油般的香气和味道而闻名,是美国食品药品监督管理局认定的一般公认安全类物质[4]。双乙酰属于我国食品添加剂国家标准(GB 2760—2014《食品安全国家标准 食品添加剂使用标准》)允许使用的食用香料,常用于黄油、干酪、酸奶油等乳制品生产,赋予产品类似黄油的风味[5]。此外,已有研究表明,双乙酰可作为一种安全高效的新型抗真菌剂,应用于葡萄、草莓和兰州百合的采后贮藏保鲜中[6-7]。SINGH等[8]报道称,双乙酰可以抑制植物激素介导下拟南芥叶片的衰老过程,并有效延缓叶绿素的降解。LI等[4]研究发现,双乙酰能有效抑制乙烯的生成和活性氧(reactive oxygen species, ROS)的积累,从而保持果蔬良好的贮藏品质。上述研究表明,双乙酰在提高果蔬采后贮藏品质、延长贮藏期方面有十分重要的研究和应用价值。
本实验前期采用不同浓度的双乙酰溶液(0、0.5、1、2、5、10 mL/L)处理鲜切西兰花。结果发现,不同浓度的双乙酰均能够保持鲜切西兰花的贮藏品质,其中5 mL/L处理的鲜切西兰花外观品质最佳。基于此,本试验以西兰花为试验材料,采用5 mL/L双乙酰溶液处理鲜切西兰花,研究其对贮藏期间鲜切西兰花品质和抗氧化能力的影响,以期为鲜切西兰花的采后品质保持提供新的理论支撑和技术参考。
1 材料与方法
1.1 材料与试剂
西兰花品种为“优秀”,购买于山东省济南市历城区某生鲜超市。挑选直径约13~15 cm,颜色鲜绿、花球紧凑、成熟度基本一致、无机械伤害和虫害的西兰花作为试验材料。
磷酸氢二钾、磷酸二氢钾、氢氧化钠、无水乙醇、甲醇、牛血清蛋白、三氯乙酸、G-250考马斯亮蓝、愈创木酚、硫代巴比妥酸(均为分析纯),国药集团化学试剂有限公司;丙酮(分析纯),烟台远东精细化工有限公司;DPPH(分析纯),北京索莱宝科技有限公司;邻苯二酚(分析纯),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
CR-400色差仪,日本Konica Minolta公司;WZ-108手持式折光仪,浙江托普仪器有限公司;UV-6100紫外可见分光光度计,上海元析仪器有限公司;PK-16A台式高速冷冻离心机,湖南平科科学仪器有限公司;PHB-4 pH计,上海仪电科学仪器有限公司。
1.3 实验方法
1.3.1 样品处理
用消毒过的小刀沿距离花球底部约2 cm处切下直径约为4 cm的西兰花小花球。将切好的西兰花小花球随机分为2组,分别在5 mL/L双乙酰(处理组)和蒸馏水(对照组)中浸泡10 min,浸泡结束后,风干鲜切西兰花表面水分,装入聚乙烯保鲜盒中,每盒约250 g,置于(10±1) ℃,湿度85%~90%条件下贮藏12 d。每3 d取样1次,共取样5次,且每次各个处理取样平行3组。取样后用液氮迅速冷冻,于-80 ℃保存,以备后续指标的测定。
1.3.2 指标测定
1.3.2.1 色差、叶绿素的测定
色差参考XU等[9]的方法测定,用色差仪测定。
叶绿素含量参考LUO等[10]的方法测定,其计算如公式(1)所示:
叶绿素含量![]()
(1)
式中:V表示提取液总体积,mL;m表示西兰花样品质量,g。
1.3.2.2 失重率、硬度、可溶性固形物(total soluble solid, TSS)、可溶性蛋白的测定
失重率采用称重法测定,用%表示。
失重率![]()
(2)
硬度参考王佳捷等[11]的方法并略作修改,采用TA.XT plus型质构仪测定。
TSS参考谭芸秀等[2]的方法,用手持式折光仪测定,以百分数表示(%)。
可溶性蛋白参考焦贺等[12]的方法,采用考马斯亮蓝G-250测定。
1.3.2.3 丙二醛(malondialdehyde, MDA)、过氧化氢(H2O2)的测定
MDA参考曹建康等[13]的方法测定,其计算如公式(3)所示:
丙二醛含量/(μmol/g)
(3)
式中:V表示样品提取液总体积,mL;Vs表示测定时所取样品提取液体积,mL;m表示西兰花样品质量,g。
H2O2使用南京建成生物工程研究所试剂盒测定。
1.3.2.4 DPPH自由基清除能力、羟自由基清除能力的测定
DPPH自由基清除能力参考谢晓宇[14]的方法测定,以95%(体积分数)乙醇参比调零,于517 nm处测定吸光度值。
羟自由基清除能力参考巴良杰等[15]的方法测定,其计算如公式(4)所示:
羟自由基清除能力![]()
(4)
1.3.2.5 抗氧化酶活性的测定
过氧化氢酶(catalase, CAT)使用南京建成生物工程研究所试剂盒测定;超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)参考曹建康等[13]的方法测定。
1.3.2.6 总酚、苯丙氨酸解氨酶(phenylalamine ammonia lyase, PAL)、多酚氧化酶(polyphenol oxidase, PPO)活性的测定
总酚参考SUN等[16]的方法测定,以没食子酸绘制标准曲线。
PAL、PPO参考曹建康等[13]的方法测定。
1.4 数据处理
每个指标平行测定3次,结果以平均值±标准差表示。采用SPSS 26.0软件对测得的数据进行差异显著性检验(单因素ANOVA检验),并使用Origin 2022软件进行制图和相关性分析(Pearson法)。
2 结果与分析
2.1 双乙酰处理对鲜切西兰花外观颜色的影响
黄化是西兰花品质劣变最直观的表现。如图1所示,随着时间的延长,西兰花逐渐失绿转黄。在贮藏第6天,对照组开始表现出黄化现象,在贮藏第12天时西兰花花球已经严重黄化,失去商品价值;然而双乙酰处理组显著延缓了西兰花的黄化,直至贮藏第9天时,西兰花花球仍保持绿色,外观品质良好,在贮藏第12天时,才出现轻微黄化的现象。由此可见,双乙酰处理在提高西兰花贮藏品质,延缓黄化和衰老,提高贮藏期方面有明显效果。
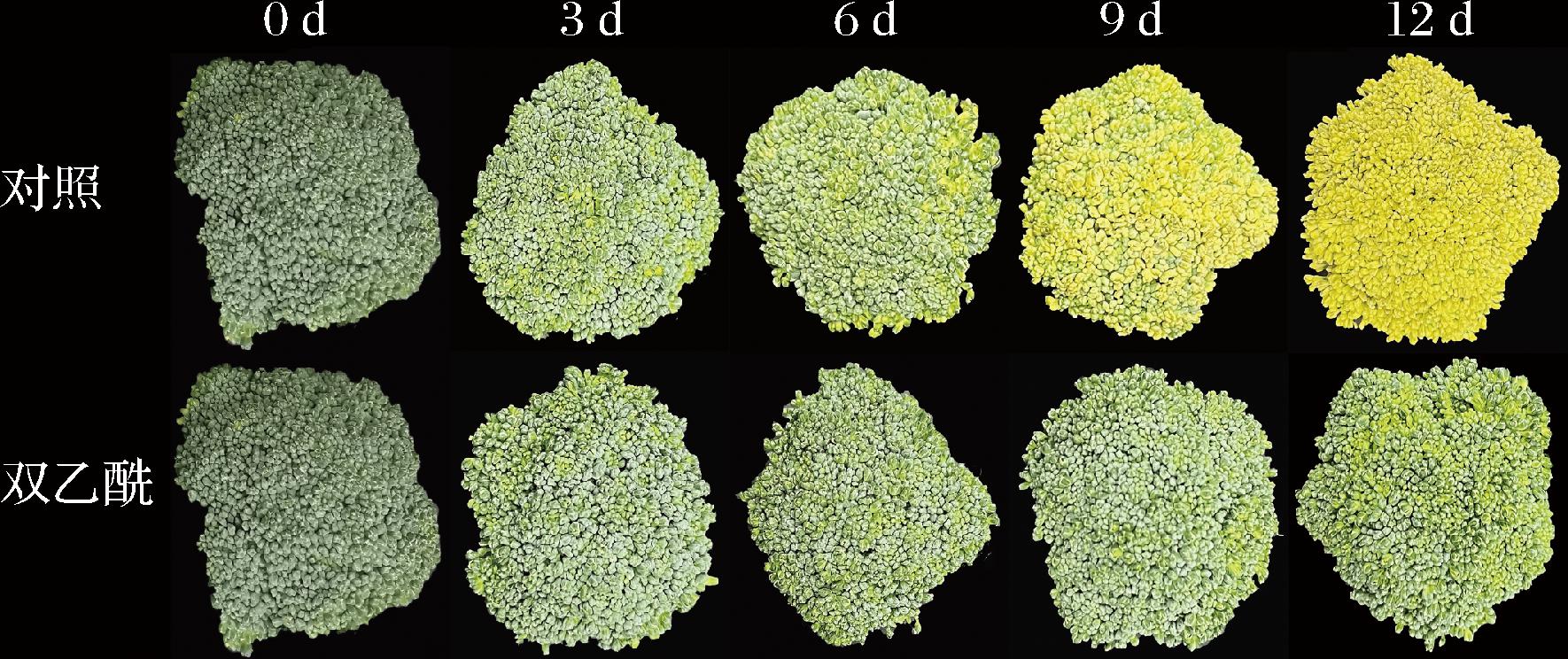
图1 双乙酰处理对西兰花外观品质的影响
Fig.1 Effect of diacetyl treatment on appearance quality of broccoli
2.2 双乙酰处理对鲜切西兰花色泽和叶绿素含量的影响
2.2.1 双乙酰处理对鲜切西兰花色泽的影响
西兰花在采后贮藏过程中,根据色泽可以直观地判断其衰老程度。由图2-A可知,在贮藏期间,各组鲜切西兰花的L*值都呈上升的趋势,且处理组L*值始终低于对照组(P<0.01)。在贮藏结束时,对照组鲜切西兰花的L*值比处理组高29.53%。由图2-B可以得出,随着时间的延长,a*值也逐渐增加。在贮藏过程中,双乙酰处理显著抑制了a*值的增加,延缓了鲜切西兰花由绿变红。在贮藏第12天时,处理组鲜切西兰花的a*值绝对值是对照组的1.26倍,差异极显著(P<0.01)。如图2-C所示,2组鲜切西兰花b*值随着贮藏时间的延长呈上升趋势,b*值的逐渐增加表明鲜切西兰花开始由绿变黄,然而双乙酰处理显著抑制了b*值的增加(P<0.01),在贮藏结束时,对照组鲜切西兰花的b*值比处理组高57.54%。综上所述,双乙酰处理显著抑制了L*、a*、b*值的增加,延缓了鲜切西兰花的黄化,具有良好的护色效果。

A-L*;B-a*;C-b*;D-叶绿素含量
图2 双乙酰处理对鲜切西兰花L*、a*、b*、叶绿素含量的影响
Fig.2 Effects of diacetyl treatment on L*, a*, b*, and chlorophyll content of fresh-cut broccoli
注:*表示同一贮藏时间2组差异显著相关(P<0.05);**表示极显著相关(P<0.01)(下同)。
2.2.2 双乙酰处理对鲜切西兰花叶绿素含量的影响
采后西兰花的成熟和衰老伴随着花球的由绿变黄,而叶绿素的降解是导致西兰花黄化的主要原因之一。由图2-D可看出,在12 d的贮藏过程中,鲜切西兰花中叶绿素含量逐渐下降,双乙酰处理显著抑制了叶绿素的降解。贮藏的前3 d,叶绿素含量快速下降,可能是由于采收后呼吸作用增强所致[16]。在贮藏结束时,处理组鲜切西兰花叶绿素含量比对照组多95.83%,差异极显著(P<0.01)。综上所述,双乙酰处理能够较好地保持贮藏过程中鲜切西兰花叶绿素含量,从而保持西兰花的绿色,延缓衰老及黄化,与颜色参数结果一致。
2.3 双乙酰处理对鲜切西兰花失重率、硬度、TSS和可溶性蛋白含量的影响
2.3.1 双乙酰处理对鲜切西兰花失重率的影响
失重率可以反映果蔬品质的劣变程度。由图3-A可以得出,贮藏期间鲜切西兰花的失重率逐渐增加,并且双乙酰处理组的鲜切西兰花质量损失始终低于对照组,贮藏中期开始出现显著性差异(P<0.05)。在贮藏第12天,对照组失重率为10.25%,而双乙酰处理组的失重率仅为3.35%,差异显著(P<0.05)。由此表明,双乙酰处理可有效抑制鲜切西兰花在贮藏过程中质量的损失,维持良好的感官品质。

A-质量损失率;B-硬度;C-可溶性固形物;D-可溶性蛋白含量
图3 双乙酰处理对鲜切西兰花质量损失率、硬度、可溶性固形物和可溶性蛋白含量的影响
Fig.3 Effect of diacetyl treatment on mass loss rate, hardness, soluble solids, and soluble content of fresh-cut broccoli
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3.2 双乙酰处理对鲜切西兰花硬度的影响
硬度是衡量果蔬成熟度和贮藏性的重要品质指标之一。随着成熟衰老的进程,采后果蔬的硬度逐渐降低。由图3-B可以看出,在贮藏过程中,鲜切西兰花的硬度逐渐下降,且双乙酰处理组鲜切西兰花硬度始终高于对照组,在贮藏中期开始出现显著性差异(P<0.05)。在贮藏第12天,双乙酰处理组和对照组的鲜切西兰花硬度分别比初始时下降了7.98%和12.14%。由此表明,双乙酰处理有助于延缓鲜切西兰花的软化,保持良好的感官品质和硬度,其原因可能是双乙酰处理抑制了细胞壁相关代谢酶的活性和细胞膨压的降低[17]。
2.3.3 双乙酰处理对鲜切西兰花TSS的影响
TSS可判定采后果蔬的耐贮藏性。由图3-C可看出,TSS含量在贮藏期间逐渐减少。贮藏过程中双乙酰处理组TSS含量始终高于对照组,在贮藏前中期存在显著性差异(P<0.05),并且在贮藏中期,处理组TSS含量比贮藏初期低14.76%,而对照组则低18.79%。在贮藏第12天,处理组鲜切西兰花中TSS含量是对照组的1.04倍,具有显著性差异(P<0.05)。由此表明,双乙酰处理可以减缓鲜切西兰花TSS的下降,提高其贮藏性,延缓衰老。
2.3.4 双乙酰处理对鲜切西兰花可溶性蛋白含量的影响
可溶性蛋白含量是果蔬中的重要物质,既是营养成分,又是能量供给物质[18]。由图3-D可以看出,随着贮藏时间的延长,2组鲜切西兰花中可溶性蛋白含量逐渐下降,且双乙酰处理组显著高于对照组(P<0.05)。在贮藏结束时,双乙酰处理组可溶性蛋白的含量是对照组的1.05倍。韩颖等[18]研究也表明,随着西兰花贮藏时间的延长,其组织中可溶性蛋白含量不断下降。由此可见,双乙酰处理可维持鲜切西兰花中可溶性蛋白的含量,有效维持采后贮藏西兰花中的营养品质。
2.4 双乙酰处理对鲜切西兰花MDA和抗氧化能力的影响
2.4.1 双乙酰处理对鲜切西兰花MDA含量的影响
MDA是果实贮藏过程中膜脂过氧化的重要指标,因此,细胞膜脂质过氧化的程度可以直接用MDA的变化来反映[19]。由图4-A可以看出,随着贮藏时间的延长,2组鲜切西兰花的MDA含量增加,且双乙酰处理组的MDA含量始终低于对照组。在前3 d内,2组的MDA含量差异不显著,但贮藏3 d后,对照组鲜切西兰花的MDA含量显著高于双乙酰处理组(P<0.05),直至贮藏结束。在贮藏第12天时,双乙酰处理组中MDA含量为3.66 μmol/g,而对照组为6.44 μmol/g,比处理组高了75.96%,存在极显著性差异(P<0.01)。先前的研究表明,西兰花的黄化伴随着MDA含量的急剧上升,这与本研究的结果一致[20]。综上,双乙酰处理显著抑制了鲜切西兰花贮藏过程中膜脂过氧化,从而延缓西兰花的黄化,提高其货架期。
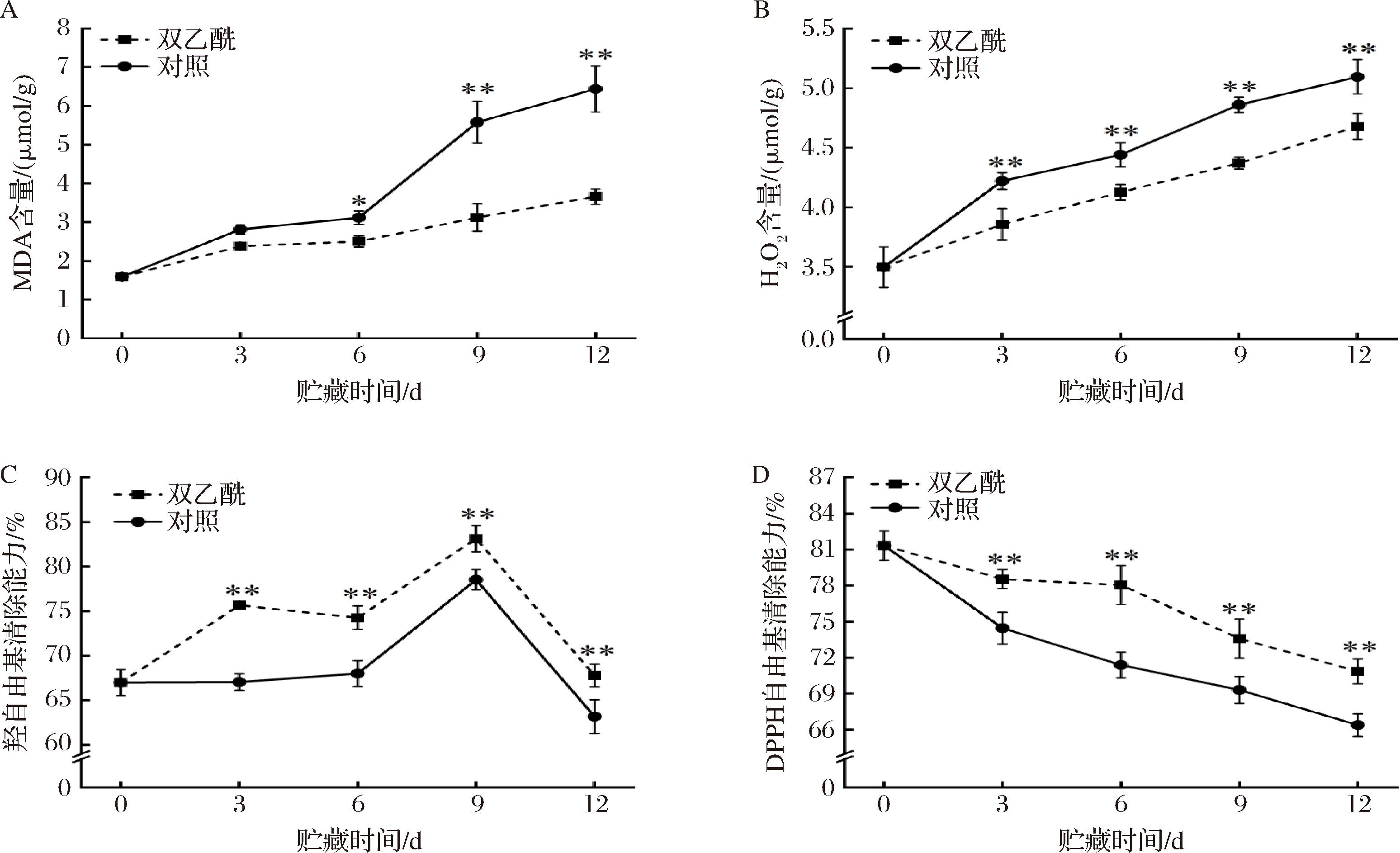
A-MDA含量;B-H2O2含量;C-羟自由基清除能力;D-DPPH自由基清除能力
图4 双乙酰处理对鲜切西兰花MDA含量、H2O2含量、羟自由基清除能力和DPPH自由基清除能力的影响
Fig.4 Effects of diacetyl treatment on MDA content, H2O2 content, hydroxyl radical scavenging ability, and DPPH radical scavenging ability of fresh-cut broccoli
2.4.2 双乙酰处理对鲜切西兰花抗氧化能力的影响
如图4-B所示,随着贮藏时间的延长,各组的H2O2含量逐渐增加。在整个贮藏期间,双乙酰处理组H2O2含量始终显著低于对照组(P<0.01)。在贮藏结束时,双乙酰处理组鲜切西兰花中H2O2含量为4.68 μmol/g,而对照组中H2O2含量为5.10 μmol/g,比双乙酰处理组高8.97%。由图4-C可以看出,在贮藏期间,各组羟自由基清除率整体先升高后降低,在贮藏第9天时达到峰值,此后,羟自由基清除率迅速下降。在整个贮藏期间,双乙酰处理组羟自由基清除率始终显著高于对照组(P<0.01)。在贮藏结束时,双乙酰处理组羟自由基清除率比对照组高7.31%。由图4-D可以看出,随着贮藏时间延长,DPPH自由基清除能力逐渐下降,且双乙酰处理组始终显著高于对照组(P<0.01)。贮藏结束时,双乙酰处理组和对照组的鲜切西兰花DPPH自由基清除能力分别比初始时下降了9.02%和14.69%,且有极显著性差异(P<0.01)。综上所述,双乙酰处理显著抑制了H2O2含量的增加和MDA的积累,并提高了鲜切西兰花的自由基清除能力,这可能是由于双乙酰抑制膜脂过氧化作用所致,从而提高抗氧化能力,延缓西兰花黄化,维持其感官品质。
2.5 双乙酰处理对鲜切西兰花抗氧化酶活性的影响
CAT、SOD和POD是清除ROS的重要抗氧化酶类。如图5-A所示,在贮藏期间,各组鲜切西兰花中的CAT活性都表现出先上升后下降的趋势。2组鲜切西兰花的CAT活性在贮藏第9天时都达到了最大值,分别为394.07 U/mg和333.33 U/mg。除第6天外,双乙酰处理组鲜切西兰花中CAT活性始终显著高于对照组(P<0.05)。在贮藏结束时,双乙酰处理组CAT活性为318.52 U/mg,是对照组的1.30倍。如图5-B所示,随着贮藏时间的延长,2组鲜切西兰花中SOD活性逐渐上升。在贮藏前3 d,2组SOD活性迅速增加,之后缓慢增加直至贮藏结束。除第6天外,双乙酰处理组鲜切西兰花SOD活性均始终显著高于对照组(P<0.05)。在贮藏结束时,双乙酰处理组鲜切西兰花SOD活性是对照组的1.02倍。由图5-C可以得出,在整个贮藏期间,各组POD活性逐渐上升。贮藏3 d后,双乙酰处理组鲜切西兰花POD活性显著高于对照组(P<0.05)。在贮藏结束时,双乙酰处理组和对照组POD活性分别为初始时的1.72倍和1.43倍,有显著性差异(P<0.05)。综上所述,双乙酰通过调节CAT、SOD和POD的活性,有效抑制了ROS的积累,从而提高了贮藏期内鲜切西兰花的营养品质,延缓了西兰花的黄化和衰老。

A-CAT活性;B-SOD活性;C-POD活性
图5 双乙酰处理对鲜切西兰花CAT活性、SOD活性和POD活性的影响
Fig.5 Effects of diacetyl treatment on CAT activity, SOD activity, and POD activity of fresh-cut broccoli
2.6 双乙酰处理对鲜切西兰花PAL、PPO活性和总酚含量的影响
PAL是果蔬苯丙烷代谢途径的关键酶,参与酚类物质等多种次生代谢物的生物合成[21]。如图6-A所示,随着贮藏时间的延长,各组PAL活性呈先上升后下降的趋势。在整个贮藏期间,双乙酰处理组的PAL活性均显著高于对照组(P<0.05)。贮藏最后一天,双乙酰处理组的PAL活性是对照组的1.45倍,表明双乙酰处理提高了鲜切西兰花在贮藏过程中PAL活性。
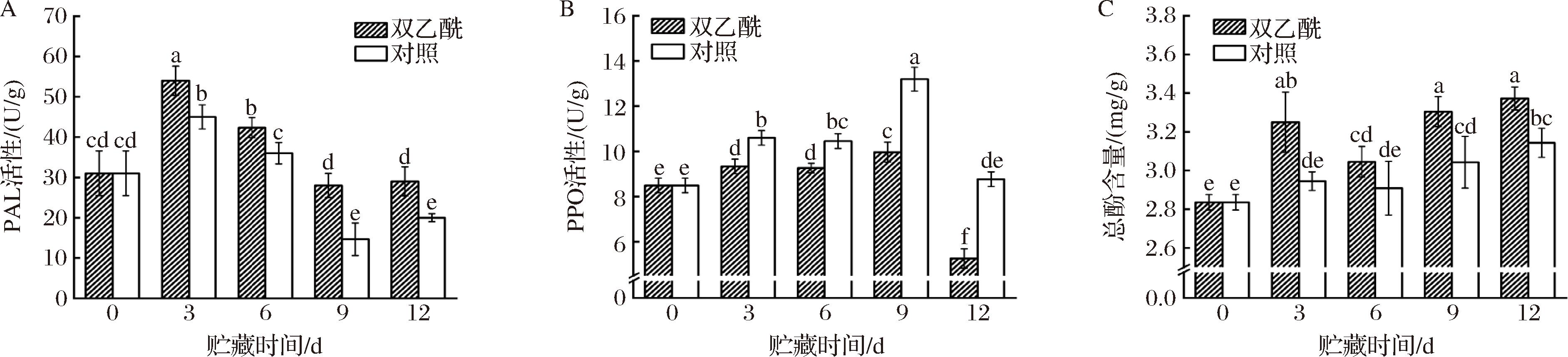
A-PAL活性;B-PPO活性;C-总酚含量
图6 双乙酰处理对鲜切西兰花PAL活性、PPO活性和总酚含量的影响
Fig.6 Effects of diacetyl treatment on PAL activity, PPO activity, and total phenol content of fresh-cut broccoli
果蔬中的酚类物质氧化主要是由于PPO的催化,此过程会引起果蔬褐变,进而影响果蔬的营养品质和外观品质[22]。由图6-B中可看出,随着贮藏时间的延长,2组PPO的活性变化呈先升高后降低趋势,在贮藏第9天时,PPO活性达到最大值,此时对照组鲜切西兰花PPO活性比处理组高32.39%。在12 d的贮藏过程中,处理组的PPO活性显著低于对照组(P<0.05)。在贮藏最后一天,对照组的PPO活性是处理组的1.67倍,表明双乙酰处理有效抑制了鲜切西兰花在贮藏过程中PPO活性。
如图6-C所示,随着贮藏时间的延长,2组总酚含量呈上升趋势。除贮藏第6天外,对照组中鲜切西兰花总酚含量均显著低于双乙酰处理组(P<0.05)。贮藏结束时,双乙酰处理组和对照组总酚含量分别比初始时高18.94%和10.83%。由此可见,双乙酰处理可有效维持鲜切西兰花中总酚含量。综上,双乙酰处理激活了PAL的活性,抑制了PPO的活性,从而减缓了酚类物质的氧化,提高了总酚的含量,较好地维持了鲜切西兰花的贮藏品质和外观品质。
2.7 相关性分析
图7为双乙酰处理鲜切西兰花在贮藏期间各指标之间的相关性分析。由图7可知,失重率与L*值、MDA和过氧化氢含量呈正显著相关,与叶绿素、硬度、TSS以及可溶性蛋白含量呈负显著相关。该结果表明,双乙酰处理可减缓鲜切西兰花在贮藏过程中失水萎蔫现象,减少鲜切西兰花中叶绿素的降解以及可溶性蛋白等营养物质的损失,同时抑制MDA和过氧化氢的积累,减少活性氧积累对细胞的伤害,维持鲜切西兰花良好的外观品质。
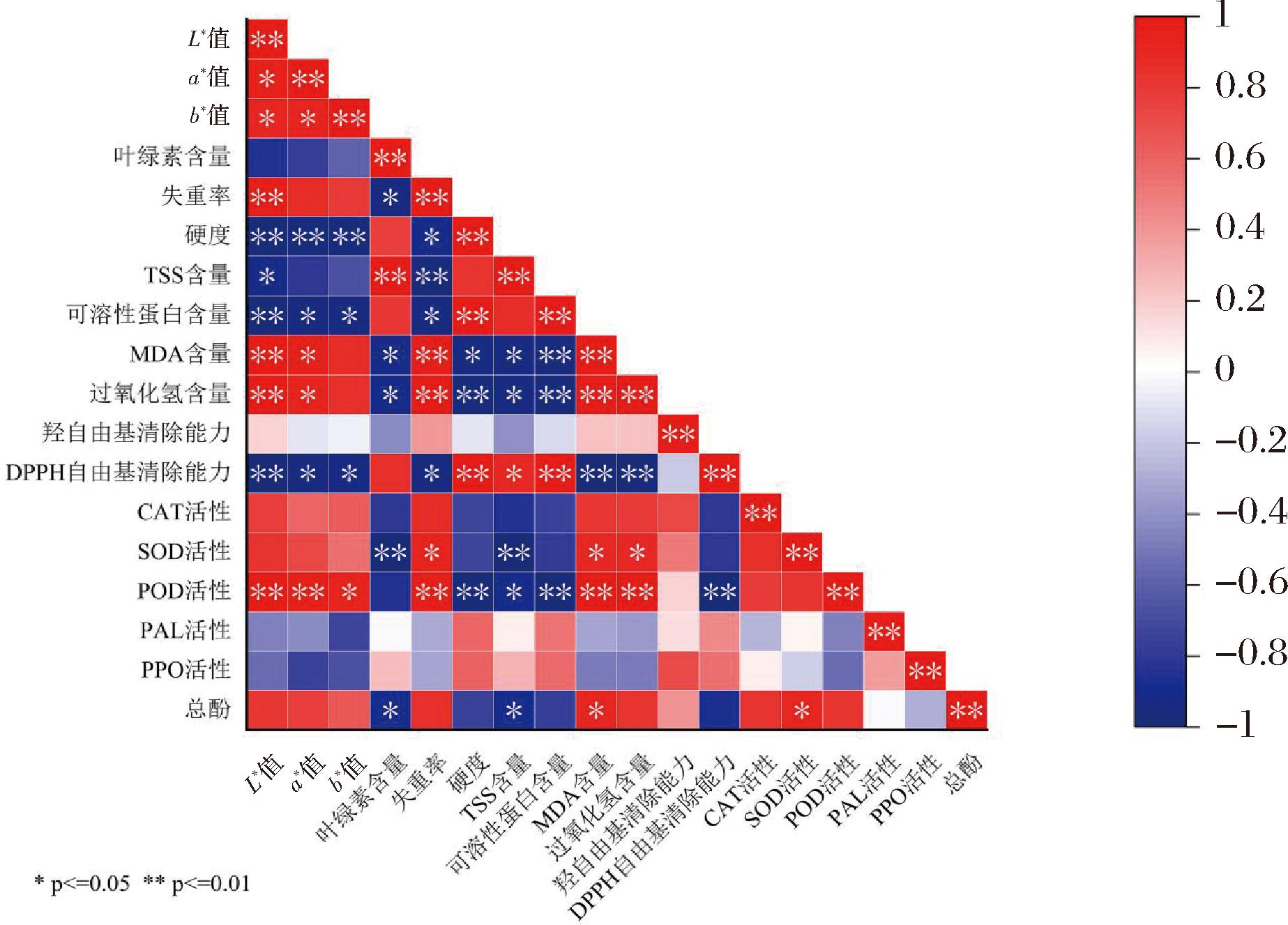
图7 双乙酰处理鲜切西兰花各指标间的相关性分析
Fig.7 Correlation analysis of each indexes in fresh-cut broccoli treated with diacetyl
注:红色表示正相关,蓝色表示负相关。
3 结论
新鲜西兰花采收后含水量高且呼吸代谢旺盛,极易失水萎蔫,而鲜切处理后导致组织结构破坏,更是加快了西兰花贮藏品质的下降[23]。本文研究结果发现,与对照相比,双乙酰处理显著抑制了鲜切西兰花L*、a*和b*值的上升,减少了质量损失,并保持了较高的硬度、可溶性固形物、可溶性蛋白含量。此外,双乙酰处理还显著延缓了叶绿素含量的下降,这可能是由于双乙酰的2个酮基起到共同保护叶绿素的作用[8],进而维持了鲜切西兰花的良好色泽和贮藏品质。
在果蔬成熟衰老过程中,ROS的产生和清除代谢失衡,导致ROS过度积累,造成细胞损伤[20]。研究表明,抗氧化酶系统作为一种清除ROS的有效途径,在抵抗非生物胁迫和维持果蔬品质方面发挥着重要作用[19]。CAT、SOD和POD是果蔬中常见的抗氧化酶,其中超氧阴离子自由基被SOD催化,进而分解成O2和H2O2,而H2O2进一步被CAT和POD分解为H2O和O2[24]。因此,SOD、CAT和POD协同作用共同减少果蔬成熟衰老过程中的氧化损伤。先前的研究表明,较高的抗氧化酶活性可以减少果蔬在贮藏过程中的H2O2和MDA的积累,从而减轻氧化胁迫对膜的损伤,提高采后果蔬的品质[25]。JIANG等[26]研究发现,红光照射西兰花显著提高了POD、CAT和APX活性,降低了MDA含量,有效保持了西兰花的感官品质。曾媛等[27]通过1-甲基环丙烯处理西兰花发现可有效提高POD、APX和SOD活性,取得良好的保鲜效果。本研究发现,双乙酰处理保持了较高的CAT、SOD和POD活性,抑制了H2O2的生成和MDA的积累。这与LING等[7]发现用双乙酰处理降低了兰州百合中MDA积累的结果相似,并且POD、CAT和SOD活性也显著增加,表明双乙酰可以通过调节抗氧化能力来维持兰州百合的贮藏品质,提高其抗菌性。此外,自由基的清除率可以直观反映果蔬的抗氧化能力,本研究发现,双乙酰处理显著延缓了鲜切西兰花DPPH自由基和羟自由基清除率的降低,有效提高了鲜切西兰花的抗氧化能力,且LING等[7]研究发现双乙酰对DPPH自由基有较强的清除能力,本研究与其研究结果相一致。可见,双乙酰可以通过激活抗氧化能力来抑制ROS的产生,从而减轻氧化胁迫对细胞膜的损伤,保持鲜切西兰花的贮藏品质,延缓其衰老。
PAL参与酚类化合物等次生代谢物的生物合成,研究表明,总酚含量可能与PAL活性有直接关系[28]。ZHANG等[20]研究发现,西兰花中PAL活性的增强使总酚含量不断积累,阚娟等[29]的研究也得出了同样的结果。在本研究中,双乙酰处理的鲜切兰花中总酚含量不断增加,这可能是由于PAL酶活性被激活的原因。此外,随着果蔬衰老,细胞结构被破坏,使得PPO活性增强,加速果蔬中的酚类物质的氧化,导致果蔬褐变,降低其外观品质[21]。王盼盼等[30]研究发现芥末精油复合1-甲基环丙烯可显著抑制PPO活性,维持较高的总酚含量,进而抑制绿花菜褐变的发生,保持良好的外观品质。本研究中,双乙酰处理处理显著抑制了鲜切西兰花中PPO活性,从而减缓了酚类物质的氧化,提高了总酚含量,维持了贮藏过程中鲜切西兰花良好的营养品质和外观品质。
综上所述,双乙酰处理在维持鲜切西兰花的贮藏品质以及提高抗氧化能力方面具有显著效果,保持了良好的色泽,并延缓了西兰花贮藏过程中黄化的发生,延长其贮藏期。双乙酰作为一种安全的物质,具有显著的抗菌和抗氧化作用,可用于不同果蔬的保鲜。本研究结果为双乙酰在鲜切西兰花保鲜方面的应用提供了理论基础,今后将进一步对其保鲜作用机理作深入探讨。
[1] LEE Y S, KU K M, BECKER T M, et al.Chemopreventive glucosinolate accumulation in various broccoli and collard tissues:Microfluidic-based targeted transcriptomics for by-product valorization[J].PLoS One, 2017, 12(9):e0185112.
[2] 谭芸秀, 李丽, 李永才, 等.壳聚糖和褪黑素复合涂膜处理对鲜切西兰花品质及叶绿素变化的影响[J].食品科学, 2023, 44(21):184-192.TAN Y X, LI L, LI Y C, et al.Effect of chitosan coating combined with melatonin on the quality and chlorophyll change of fresh-cut broccoli[J/OL].Food Science, 2023, 44(21):184-192.
[3] AIAMLA-OR S, KAEWSUKSAENG S, SHIGYO M, et al.Impact of UV-B irradiation on chlorophyll degradation and chlorophyll-degrading enzyme activities in stored broccoli (Brassica oleracea L.Italica Group) florets[J].Food Chemistry, 2010, 120(3):645-651.
[4] LI X T, MENG Z, MALIK A U, et al.Maintaining the quality of postharvest broccoli by inhibiting ethylene accumulation using diacetyl[J].Frontiers in Nutrition, 2022, 9:1055651.
[5] HERNANDEZ-VALDES J A, SOLOPOVA A, KUIPERS O P.Development of Lactococcus lactis biosensors for detection of diacetyl[J].Frontiers in Microbiology, 2020, 11:1032.
[6] LI G J, CHEN Y, ZHANG Z Q, et al.2, 3-Butanedione suppresses gray mold of postharvest fruit by activating the autophagy of Botrytis cinerea[J].Postharvest Biology and Technology, 2022, 193:112057.
[7] LING L J, PANG M M, LUO H, et al.Antifungal activity of diacetyl, a volatile organic compound, on Trichoderma lixii F2 isolated from postharvest Lanzhou lily bulbs[J].Food Bioscience, 2023, 52:102365.
[8] SINGH S K, SUN Y Z, YANG Y, et al.Bacterial diacetyl suppresses abiotic stress-induced senescence in Arabidopsis[J].Journal of Integrative Plant Biology, 2022, 64(6):1135-1139.
[9] XU D Y, ZUO J H, FANG Y L, et al.Effect of folic acid on the postharvest physiology of broccoli during storage[J].Food Chemistry, 2021, 339:127981.
[10] LUO F, CHENG S C, CAI J H, et al.Chlorophyll degradation and carotenoid biosynthetic pathways:Gene expression and pigment content in broccoli during yellowing[J].Food Chemistry, 2019, 297:124964.
[11] 王佳捷, 孙颖, 刘雅慈, 等.压差预冷对西兰花贮藏品质的影响[J].食品与发酵工业, 2023, 49(23):227-235.WANG J J, SUN Y, LIU Y C, et al.Forced air pre-cooling effect on broccoli storage quality and reactive oxygen species metabolism[J].Food and Fermentation Industries, 2023, 49(23):227-235.
[12] 焦贺, 孟敌, 韩颖, 等.微酸性电解水对采后香葱抑菌特性及贮藏品质的影响[J/OL].食品科学, 2024.http://kns.cnki.net/kcms/det ail/11.2206.TS.20230830.1216.021.html.JIAO H, MENG D, HAN Y, et al.Effect of slightly acidic electrolyzed water treatment on the antibacterial properties and storage quality of postharvest chives[J/OL].Food Science, 2024.http://kns.cnki.net/kcms/detail/11.2206.TS.20230830.1216.021.html.
[13] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.CAO J K, JIANG W B, ZHAO Y M.Experimental Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[14] 谢晓宇. 采后西兰花保鲜技术研究[D].南京:南京农业大学, 2020.XIE X Y. Study on preservation technology of postharvest broccoli[D]. Nanjing: Nanjing Agricultural University, 2020.
[15] 巴良杰, 孙雁征, 罗冬兰, 等.丁香酚对西番莲保鲜效果及品质的影响[J].食品科学, 2023, 44(21):239-248.BA L J, SUN Y Z, LUO D L, et al.Effect of eugenol on preservation and quality of passion fruit[J].Food Science, 2023, 44(21):239-248.
[16] SUN Y Y, LUO M L, GE W Y, et al.Phenylpropanoid metabolism in relation to peel browning development of cold-stored ‘Nanguo’ pears[J].Plant Science, 2022, 322:111363.
[17] 何雪莲, 韩丽春, 郑鄢燕, 等.NO处理对黄金勾豆角采后贮藏品质的影响[J].食品科学, 2023, 44(7):220-228.HE X L, HAN L C, ZHENG Y Y, et al.Effect of NO treatment on postharvest storage quality of golden hook bean[J].Food Science, 2023, 44(7):220-228.
[18] 韩颖, 安容慧, 孙莹, 等.微酸性电解水对采后西兰花贮藏品质的影响[J].食品工业科技, 2023, 44(5):338-346.HAN Y, AN R H, SUN Y, et al.Effect of slightly acidic electrolyzed water on the storage quality of postharvest broccoli[J].Science and Technology of Food Industry, 2023, 44(5):338-346.
[19] MENG X Y, CHEN C, SONG T, et al.Effect of nano-silica coating combined with pressurized Ar treatment on postharvest quality and reactive oxygen species metabolism in sweet cherry fruit[J].Food Chemistry, 2022, 374:131715.
[20] ZHANG X, YANG Q X, LUO M L, et al.Insights into profiling of p-coumaric acid treatment on delaying the yellowing of broccoli[J].Postharvest Biology and Technology, 2023, 201:112371.
[21] 朱志鹏, 白羽嘉, 段继华, 等.半胱氨酸处理对鲜切肉苁蓉贮藏效果的影响[J/OL].食品与发酵工业, 2024.DOI:10.13995/j.cnki.11-1802/ts.037226.ZHU Z P, BAI Y J, DUAN J H, et al.Effect of treatments with cysteine on storage of fresh-cut Cistanchesherba[J/OL].Food and Fermentation Industries, 2024.DOI:10.13995/j.cnki.11-1802/ts.037226.
[22] 甘婉莹, 邓孟胜, 张杰, 等.γ-氨基丁酸对鲜切马铃薯贮藏品质的影响[J].现代食品科技, 2023, 39(10):178-184.GAN W Y, DENG M S, ZHANG J, et al.Effect of γ-aminobutyric acid on the storage quality of fresh-cut potato[J].Modern Food Science and Technology, 2023, 39(10):178-184.
[23] 刘泽松, 史君彦, 左进华, 等.UV-C和LED红光复合处理对西兰花贮藏品质的影响[J].食品科学, 2020, 41(17):238-245.LIU Z S, SHI J Y, ZUO J H, et al.Effect of combined UV-C and red light emitting diode irradiation on storage quality of broccoli[J].Food Science, 2020, 41(17):238-245.
[24] HUAN C, JIANG L, AN X J, et al.Potential role of reactive oxygen species and antioxidant genes in the regulation of peach fruit development and ripening[J].Plant Physiology and Biochemistry, 2016, 104:294-303.
[25] 王洁琼, 王军萍, 朱丽娟, 等.褪黑素对低温贮藏期间荠菜衰老和抗氧化能力的影响[J].食品科学, 2022, 43(17):263-271.WANG J Q, WANG J P, ZHU L J, et al.Effect of melatonin on the senescence and antioxidant capacity of Capsella bursa-pastoris during low-temperature storage[J].Food Science, 2022, 43(17):263-271.
[26] JIANG A L, ZUO J H, ZHENG Q L, et al.Red LED irradiation maintains the postharvest quality of broccoli by elevating antioxidant enzyme activity and reducing the expression of senescence-related genes[J].Scientia Horticulturae, 2019, 251:73-79.
[27] 曾媛, 韩欣如, 薛思玥, 等.采后熏蒸1-甲基环丙烯对西兰花保鲜效果的影响及主成分分析[J].食品工业科技, 2022, 43(4):332-340.ZENG Y, HAN X R, XUE S Y, et al.Effect of 1-methylcyclopropene fumigation on preservation of broccoli and principal component analysis[J].Science and Technology of Food Industry, 2022, 43(4):332-340.
[28] XU F, TANG Y C, DONG S Q, et al.Reducing yellowing and enhancing antioxidant capacity of broccoli in storage by sucrose treatment[J].Postharvest Biology and Technology, 2016, 112:39-45.
[29] 阚娟, 火统斌, 谢王晶, 等.1-MCP和UV-C处理对采后苹果抗氧化活性的影响[J].食品工业科技, 2019, 40(3):281-285.KAN J, HUO T B, XIE W J, et al.Effect of 1-MCP and UV-C on antioxidant capacity in apple (Malus pumila Mil.) fruit during storage[J].Science and Technology of Food Industry, 2019, 40(3):281-285.
[30] 王盼盼, 管维良, 孙志栋, 等.芥末精油复合1-甲基环丙烯保鲜处理对绿花菜贮藏期间品质的影响[J].食品工业科技, 2024,45(11):270-279.WANG P P, GUAN W L, SUN Z D, et al.The effect of mustard essential oil combined 1-methylcyclopropene preservation treatment on the quality of broccoli during refrigerated storage[J].Science and Technology of Food Industry, 2024,45(11):270-279.