南湖菱(Trapa acornis Nakano)是浙江省嘉兴市特有的水产经济植物,因其表面没有尖角,又被称为无角菱。其薄壳、肉质嫩滑,果肉甘甜多汁,成熟的菱中含有大量的淀粉、蛋白质、氨基酸和维生素A、B、E等多种营养物质[1],为菱中佳品。南湖菱还具有极高的药用价值,中医认为,生吃菱角有清热的功效,煮熟后食用可以明目、益气健脾[2]。此外,菱壳提取物还具有护肝、抗氧化[3]和抗衰老等功效,逯鑫等[4]研究指出,南湖菱壳中的没食子酰葡萄糖还表现出抗肿瘤的药理活性。然而,尽管南湖菱果实营养丰富,采摘后却容易腐烂变质,在常温下2~3 d就会失去商品价值,无法进行外运销售,导致采后损失率较高,从而限制了其市场的发展[5]。因此,解决南湖菱果实的保鲜贮藏问题有重要的理论意义和实际意义。近年来,国内外主要采用物理和化学方式进行保鲜,如紫外线照射、超高压处理、气调库保鲜等,尽管这些保鲜技术取得了令人满意的效果[6],但物理保鲜技术成本较高,不适用大规模生产;化学保鲜剂如一氧化氮(NO)、二氧化氮(NO2)等对人体和环境有潜在的危害。因此,当前果蔬保鲜研究热点逐渐聚焦于安全环保、可食性的天然物质涂膜技术。
从蛋白质、脂质、多糖以及他们的衍生物中提取的可生物降解聚合物已经应用于研发具有生物活性的可食用薄膜,尤其是基于多糖的可食用涂膜被认为是最为有效的食品保存方法之一[7]。海藻多糖因其良好的保湿、抗氧化、抗菌、成膜和安全等特性,在食品和医药领域得到广泛应用。在此背景下,罗爱国[8]以中式猪肉香肠为试验对象,制备钝顶螺旋藻多糖-壳聚糖混合涂膜进行保鲜研究,研究发现,用钝顶螺旋藻多糖进行涂膜处理的中式香肠组能够更有效地清除DPPH自由基,降低脂质过氧化,并能有效地提高香肠的抗氧化能力,从而改善香肠的风味和整体可接受性。ZHANG等[9]以海藻酸钠和琼脂为原料,成功制备了海藻多糖抗菌保鲜双层膜。这些研究不仅在食品保鲜领域取得了显著的成果,而且为海藻多糖的进一步应用提供了有益的经验。侯萍等[10]提取麒麟菜中的多糖成分,将其与海藻酸钠进行混合涂膜,在一定程度上延长了荔枝的保鲜期。目前,海藻多糖中的海藻酸钠、马尾藻多糖[11]、石莼多糖[12]和海带多糖[13]等已被证明具有良好的保鲜效果。近几年,研究发现紫球藻多糖具有强水溶性[14],且能够形成透明、黏度高的溶液,同时具有抗氧化[15]、抑菌[16]等功效,这些特性使得紫球藻多糖在果蔬保鲜领域具备了优越的性能,有望为新型、可持续的保鲜技术提供有力的支持和推动。BALTI等[17]用紫球藻多糖混合涂膜凡纳滨对虾(Penaeus vannamei),探究冷藏过程中理化性质、细菌水平和感官特征的影响,证明了紫球藻多糖的保鲜作用。
目前,有关紫球藻多糖在果实贮藏中应用的报道较少,为填补这一研究空白,本研究以紫球藻多糖为主要原料,探讨其在南湖菱果实保鲜中的潜在作用,并结合主成分分析(principal component analysis, PCA)法,将11个保鲜探究指标降维为2个主成分,综合探究紫球藻多糖对南湖菱的保鲜效果。本研究通过开发紫球藻多糖在南湖菱果实采后贮藏中的应用,期望为海藻多糖涂膜在南湖菱果实保鲜方面提供理论依据,为可持续、有效的贮藏方法提供新的视角和理念。
1 材料与方法
1.1 材料与试剂
本研究中使用的紫球藻(Porphyridium cruentum)原种由中国科学院水生生物研究所的淡水藻种库提供,采用稀释、平皿法等方法对其进行分离、纯化、鉴定,获得了高纯度的紫球藻;南湖菱(Trapa acornis Nakano)购于浙江省嘉兴市南湖区,采购当日进行处理;HepG2人肝癌细胞系,誉驰上海细胞库提供;金黄色葡萄球菌菌种和枯草杆菌菌种,中国工业微生物菌种资源保护与控制中心CICC提供。
1.2 仪器与设备
EnSight多功能酶标仪,深圳市科时达电子科技有限公司;UV1800PC紫外分光光度计,上海菁华科技仪器有限公司;PE-10AC冷冻干燥机,北京博医康实验仪器有限公司。
1.3 实验方法
1.3.1 紫球藻多糖的提取
采用平板光生物反应器对紫球藻进行连续光照,稳定后进行收集、离心分离。取上清液,旋蒸浓缩,添加等体积的10%三氯乙酸,于4 ℃冰箱过夜。进一步用3倍体积的乙醇沉淀,过滤,透析,冷冻干燥,得到紫球藻多糖[18]。准确称取多糖粉末,配制成5 mg/mL和10 mg/mL的多糖溶液,并进行超声、灭菌处理。
1.3.2 原材料处理
供试材料为南湖菱,选择大小、形状、色泽和成熟度相同,无病虫害的正常南湖菱果实,用清水冲净,然后用蒸馏水清洗2~3次,烘干,后将其随机分为3个组,每组20个。涂膜操作参考黎星延等[19]的方法并稍作修改,将处理好的果实分别在蒸馏水、5 mg/mL、10 mg/mL的紫球藻多糖溶液中浸泡涂膜2 min。浸没完成后取出自然风干30 min,称重后放入聚乙烯容器中贮存。在(15±1) ℃(10 d)条件下,将所有果实贮藏在恒温箱中,每隔2 d取样对果实各项鲜度指标进行测定。
1.3.3 多糖表征与保鲜指标测定
1.3.3.1 抑菌性试验
抑菌试验采用罗爱国[8]的方法,并加以修改。将15 mL灭菌处理过的培养基注入培养皿中,冷却后添加200 μL的菌液(金葡菌或枯草杆菌),均匀涂覆于平皿上,培养24 h,制得带菌平板;同时另取 200 μL 不同质量浓度梯度(0.313、0.625、1.25、2.5、5 mg/mL)紫球藻多糖涂布平板制成带药平板。用无菌打孔器在带菌平板上打孔,制成菌饼,将菌饼的带菌一面贴在带药平板表面,3个/平板,处理好的平板放入培养箱中,48 h后测量菌圈直径。
1.3.3.2 细胞毒性
将HepG2细胞悬液置于96孔板中,于37 ℃,5% CO2下培养24 h。随后,将原培养液移除,用PBS洗涤2~3次,分别添加200 μL不同浓度的紫球藻多糖,并设空白对照(无多糖处理)。将平板置于培养箱中培养24 h,然后除去培养液,取新的培养液与Cell Counting Kit-8(简称CCK-8)溶液以9∶1的体积比混合,向平板中加入100 μL该混合液。将平板重新置于温育室中培养4 h,在450 nm波长处测定吸光值,并按照公式(1)计算细胞存活率。
细胞存活率![]()
(1)
式中:A1为试验孔(多糖处理组)的吸光度;A2为空白孔吸光度;A3为对照孔(正常组)的吸光度。
1.3.3.3 保鲜指标测定
a)失重率
根据公式(2)计算失重率。
失重率![]()
(2)
式中:m1为初始果实质量,g;m2为取样当天果实质量,g。
b)可滴定酸、可溶性糖和可溶性蛋白含量测定
可滴定酸的测定参考ZHU等[20]的方法并适当修改。将南湖菱果实的可食用的部分进行四等分,然后混合,准确称取2 g果实与5 mL蒸馏水冰浴匀浆,在4 ℃条件12 000×g离心15 min,取果实匀浆上清液于烧杯中,用0.01 mol/L NaOH溶液进行滴定,直到溶液的pH值显示为8.1~8.3,记录NaOH滴定时的用量,每组重复3次,结果以柠檬酸计,以%表示。
可溶性糖含量的测定:苯酚硫酸法[21]。可溶性蛋白含量的测定:考马斯亮蓝染色法[22]。
c)总酚含量和维生素C含量测定
测定总酚的含量时参考SU等[23]的方法,但稍作改进。将果实上清与预冷的80%甲醇溶液、福林酚混匀,静置5 min后,添加7%的碳酸钠,25 ℃避光保存1 h,在765 nm下用80%的甲醇水作空白,对该反应系统的吸收值进行测量,总酚类的含量单位为mg/g。
维生素C含量的测定采用采用2, 6-二氯靛酚(2, 6-dichloroindophenol)滴定法[24],将果实上清液和适量10 g/L的草酸均匀混合,然后在锥形瓶中用2, 6-二氯靛酚滴定,直至出现鲜红色且15 s后仍未消失,即以此为终点,并以mg/100 mg为单位计算结果。
d)丙二醛(malondialdehyde, MDA)含量的测定
丙二醛含量的测定采用硫代巴比妥酸(toxylbutyl acid, TBA)法[24],将南湖菱果实提取液上清和三氯乙酸混匀,添加TBA,经沸水浴30 min后,冷却到室温,离心取上清液依次在450、532、600 nm处进行比色,按照公式(3)进行计算MDA含量:
MDA含量/(μmol/L)=6.45×(A1-A2)-0.56×A3
(3)
式中:A1为样品在532 nm处的吸光值;A2为样品在600 nm处的吸光值;A3为样品在450 nm处的吸光值。
e)氧自由基清除率的测定
DPPH自由基的测定采用罗爱国[8]的方法,并作以修改。取不同处理组的南湖菱果实提取上清液置于96孔板中,设置样品组和空白组,分别加入DPPH醇溶液和95%乙醇溶液,并设含DPPH醇溶液和蒸馏水的对照组,在室温和避光条件下处理30 min,在517 nm波长处测量,DPPH自由基清除率计算如公式(4)所示:
DPPH自由基清除率![]()
(4)
式中:A1为样品组吸光度;A2为空白组吸光度;A3为对照组吸光度。
羟自由基的测定参考TOOR等[25]的方法,取果实提取液1 mL,依次加入硫酸亚铁、过氧化氢、水杨酸-乙醇溶液,混合均匀后于在37 ℃环境下孵育30 min,后测量510 nm波长处吸光值,羟自由基清除率用公式(5)表示:
羟自由基清除率![]()
(5)
式中:A1为用蒸馏水代替上清液时体系的吸光度;A2为用蒸馏水代替过氧化氢和上清液时体系的吸光度;A3为样品处理体系的吸光度。
f)抗氧化酶活力的测定
为评估抗氧化防御系统的效能,进行过氧化物酶(peroxidase, POD)和多酚氧化酶(polyphenol oxidase, PPO)的活力测定。POD活力采用南京建成过氧化物酶测定试剂盒的方法测定;PPO活性的测定参考了詹丽娟[26]的研究,并进行了适度的修改。活力单位均表示为U/g(以鲜重计)。
1.4 数据分析与处理
本研究对每一项指标都进行了3次以上的测量,此外,本文还使用IBM SPSS 26软件进行数据处理及统计,使用Origin 64软件制作图表,并使用单因素方差分析法(One-way ANOVA)认为P<0.05具有统计学意义。
2 结果与分析
2.1 紫球藻多糖涂膜的抑菌试验
由表1的数据可以得知,紫球藻多糖对2种供试菌表现出明显的抑菌效果。随着紫球藻多糖浓度的逐渐增加,枯草芽孢杆菌和金黄色葡萄球菌的菌圈直径均呈递减的趋势。不同浓度下,金葡菌的菌圈直径明显小于枯草杆菌,说明多糖对金葡菌的抑制作用明显高于枯草杆菌,在5 mg/mL的条件下,紫球藻多糖对金葡菌的抑制作用最明显。然而,在低质量浓度下,如0.313 mg/mL和0.625 mg/mL,紫球藻多糖的抑菌效果并未表现出显著性差异(P>0.05)。这说明在较低浓度下,紫球藻多糖对两者的抑菌效果相对较弱,没有呈现明显的差异。这一发现为我们更深入理解紫球藻多糖的抑菌机制提供了有益的参考。
表1 紫球藻多糖抑菌结果
Table 1 Antibacterial results of Porphyridium cruentum polysaccharide

供试菌种菌圈直径/mm5 mg/mL2.5 mg/mL1.25 mg/mL0.625 mg/mL0.313 mg/mL0 mg/mL金黄色葡萄球菌6.37±0.15e6.83±0.06d7.47±0.12c7.93±0.06b8.27±0.12b9.30±0.46a枯草芽孢杆菌 7.73±0.12e8.33±0.15d8.73±0.12c9.03±0.15b9.20±0.10b9.57±0.21a
注:同一行数据上角标小写字母相同代表组间差异无显著性(P>0.05),而各字母组之间差异有显著性(P<0.05)。
2.2 细胞毒性
对紫球藻多糖溶液的体外细胞毒性进行了评估,采用CCK-8法检测不同组细胞活力情况,结果如表2所示,经不同浓度紫球藻多糖处理24 h后,细胞存活率均在85%以上,且经0.1 mg/mL多糖处理组与空白对照组相比细胞存活率有所上升,说明紫球藻多糖对生物细胞无毒性,可以用来保鲜食品的研究。
表2 紫球藻多糖对HepG2细胞的细胞毒性
Table 2 Porphyridium cruentum polysaccharide on HepG2 cells

分组细胞存活率/%空白组100.000±0.0740.01 mg/mL99.726±0.0180.05 mg/mL96.657±0.0970.1 mg/mL102.828±0.0800.5 mg/mL87.212±0.054
2.3 紫球藻多糖涂膜对南湖菱失重率的影响
南湖菱果实的外果皮呈不规则的瘤突状,中表皮存在细小维管束,而内果皮的细胞间隙含有果胶物质[27],复杂的果皮结构导致南湖菱果实在采后极易失水。图1结果表明,贮藏10 d后,经5 mg/mL和10 mg/mL多糖涂膜处理果实失重率分别为4.55%和4.78%,不同紫球藻多糖涂膜组均显著降低了南湖菱果实在贮藏期间的水分流失。失水是由果壳孔漏失而造成的,涂膜在果壳表形成一层膜,防止水的扩散,从而减少果实的重量损失[28];另一方面涂膜处理能够阻隔一部分氧气进入果壳内,减少果实呼吸作用产生的水分。此外,紫球藻多糖本身具有一定的保湿性能,有助于果实保持一定的水分含量。因此,多糖涂膜处理不仅能够减缓水分流失,还能有效保护果实的贮藏品质。
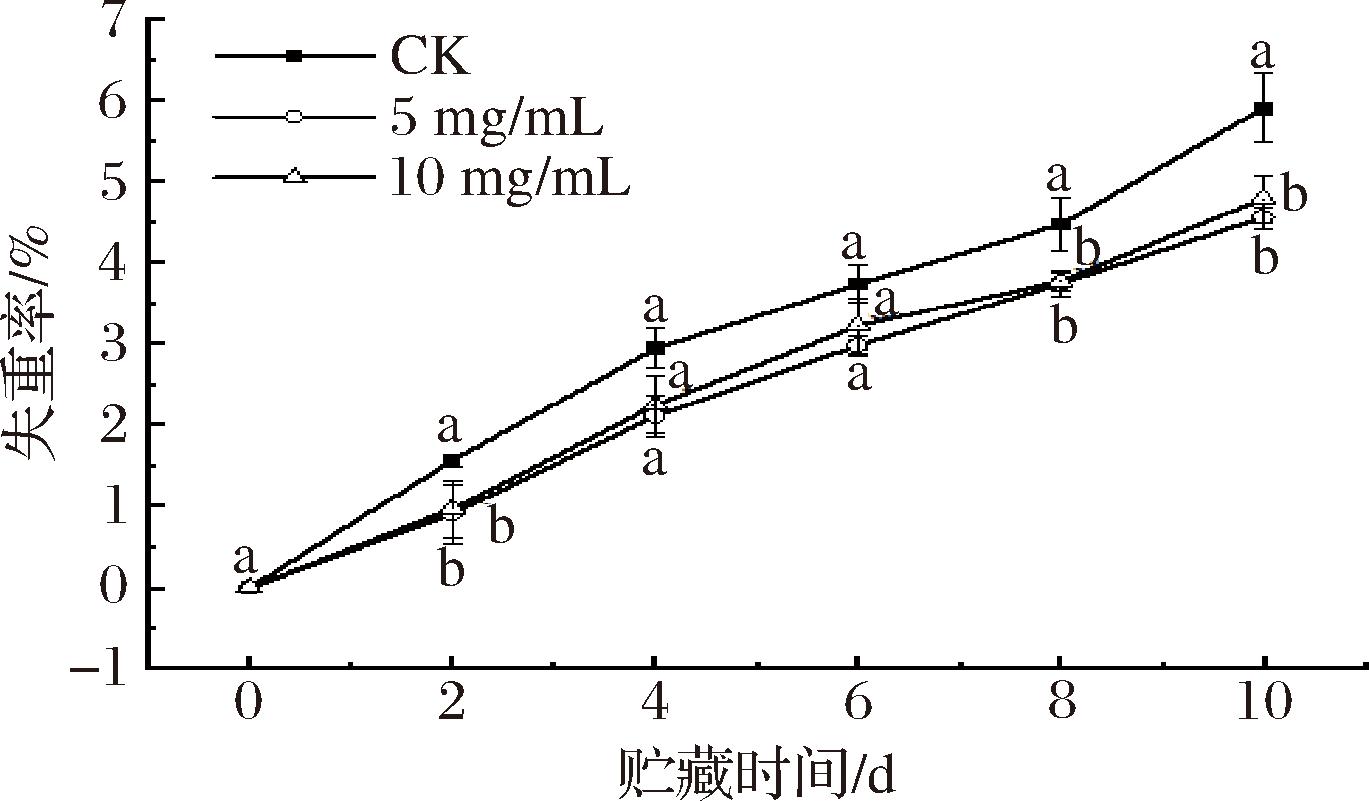
图1 紫球藻多糖涂膜处理对南湖菱失重率的影响
Fig.1 The effect of Porphyridium cruentum polysaccharide coating treatment on the weight loss rate of Trapa acornis Nakano
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4 紫球藻多糖涂膜对南湖菱可滴定酸、可溶性糖和可溶性蛋白含量的影响
果实中可滴定酸是所有有机酸的总称,其含量是评估果实品质的一个重要指标[29]。在果实成熟阶段,有机酸作为呼吸基质,为各种生命活动提供必需的中间产物。由图2可以看出,南湖菱中可滴定酸随贮存时间的延长呈先上升后下降的趋势,这一变化是由于南湖菱果实中的糖类分解转化为有机酸,导致其含量在一段时间内有不同幅度的升高。在贮藏的第10天,经5 mg/mL涂膜组和10 mg/mL涂膜组果实的可滴定酸质量分数分别是对照组的1.38倍和1.89倍,原因可能是涂膜处理使其具有渗透性,形成高CO2环境,进而限制了果实的呼吸过程[30],确保其在贮藏期间有较高的贮藏品质,此结果具有统计学意义(P<0.05)。
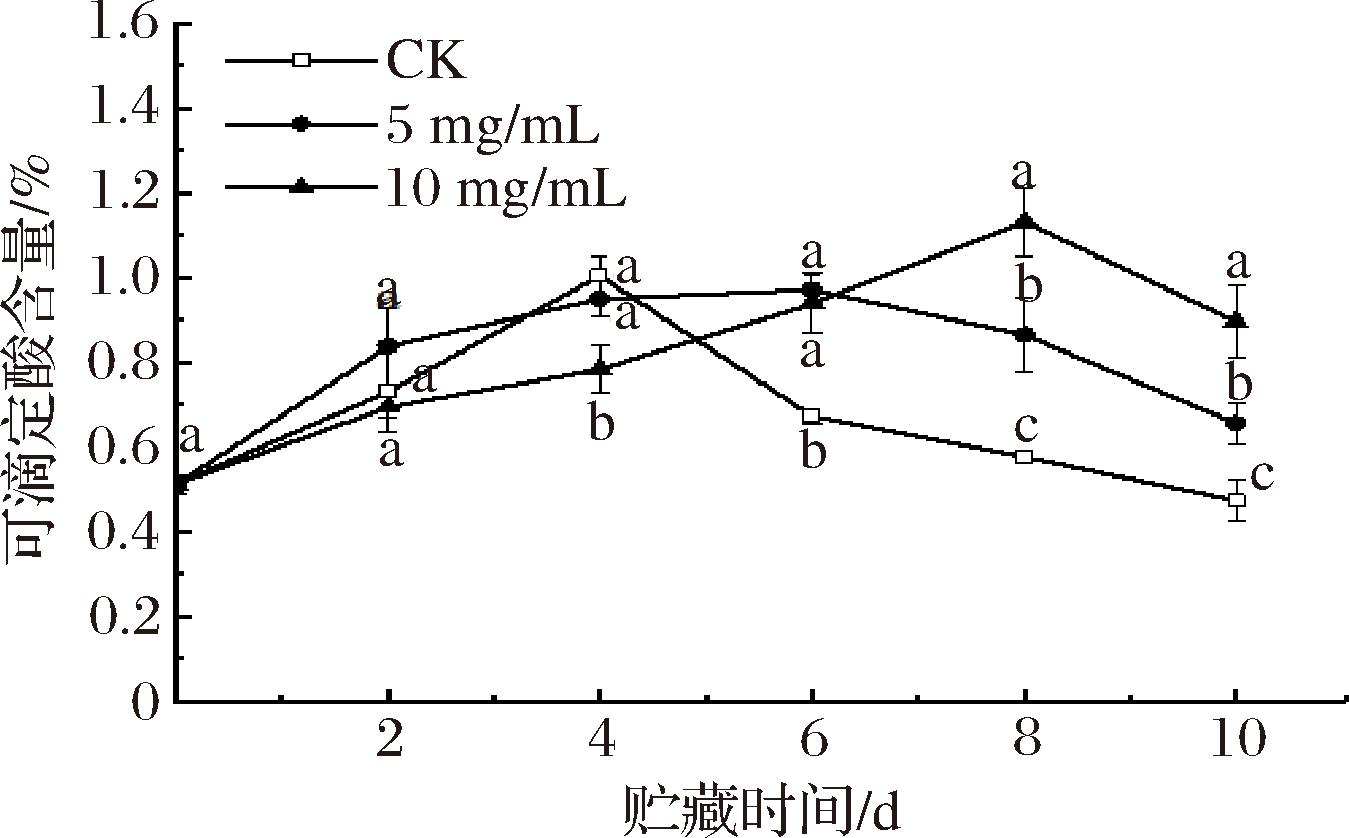
图2 紫球藻多糖涂膜处理对南湖菱可滴定酸的影响
Fig.2 The effect of Porphyridium cruentum polysaccharide coating treatment on the titratable acidity of Trapa acornis Nakano
贮藏期间南湖菱果实中可溶性糖含量的变化如图3-a所示,其含量呈现出先升高后降低的趋势,这可能是由于贮藏前期果实中的大分子化合物逐渐转化为可溶性糖和有机物,因此,在贮藏过程中,果实中的可溶性糖含量有不同程度的上升。然而,随着贮藏时间的延长,果实内微生物繁殖消耗碳源以及果实呼吸代谢作用,导致可溶性糖含量下降。结果表明,多糖涂膜后4 d,多糖涂膜组的可溶性糖含量显著高于对照组(P<0.05)。由图3-b可知,南湖菱果实在采后可溶性蛋白含量呈现出先增后减的趋势,贮藏第4天后,对照组和2种浓度紫球藻多糖涂膜组果实中可溶性蛋白均开始下降,但在不同的涂膜处理条件下,处理组的可溶性蛋白质的含量均高于对照组。尤其是10 mg/mL多糖涂膜处理组的抑制效果较显著。这表明,紫球藻多糖处理可以有效降低南湖菱采后代谢活动,进而减缓果实的衰老过程。
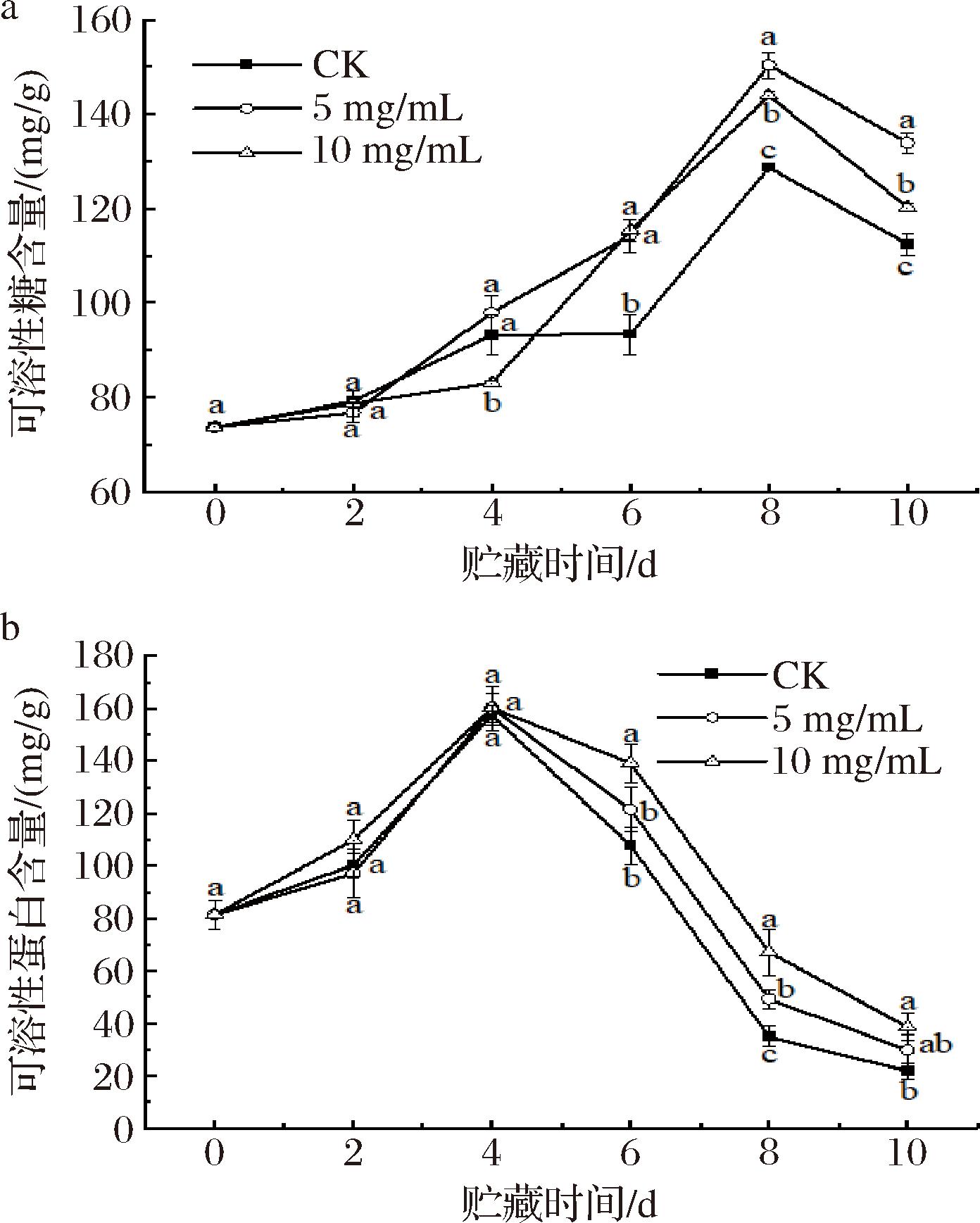
a-可溶性糖含量;b-可溶性蛋白含量
图3 紫球藻多糖涂膜处理对南湖菱可溶性糖和可溶性蛋白质含量的影响
Fig.3 The effect of Porphyridium cruentum polysaccharide coating treatment on the content of soluble sugars and soluble proteins of Trapa acornis Nakano
2.5 紫球藻多糖涂膜对南湖菱总酚含量和维生素C含量测定
由图4-a可知,南湖菱果实的总酚含量呈先升后降趋势,3组均于第2天达到峰值,其中5 mg/mL涂膜组和10 mg/mL涂膜组果实的总酚峰值含量分别为14.03 mg/g和13.80 mg/g,是对照组含量的1.15倍和1.13倍,这说明涂膜处理加速了果实中总酚的合成积累,并在贮藏初期呈迅速增加的趋势。结果表明,在贮藏过程中、后期,果皮总酚类物质的含量都有一定程度的降低,但涂膜处理组的含量比对照高(P<0.05)。值得注意的是,不同浓度的多糖涂膜处理并无太大差异。
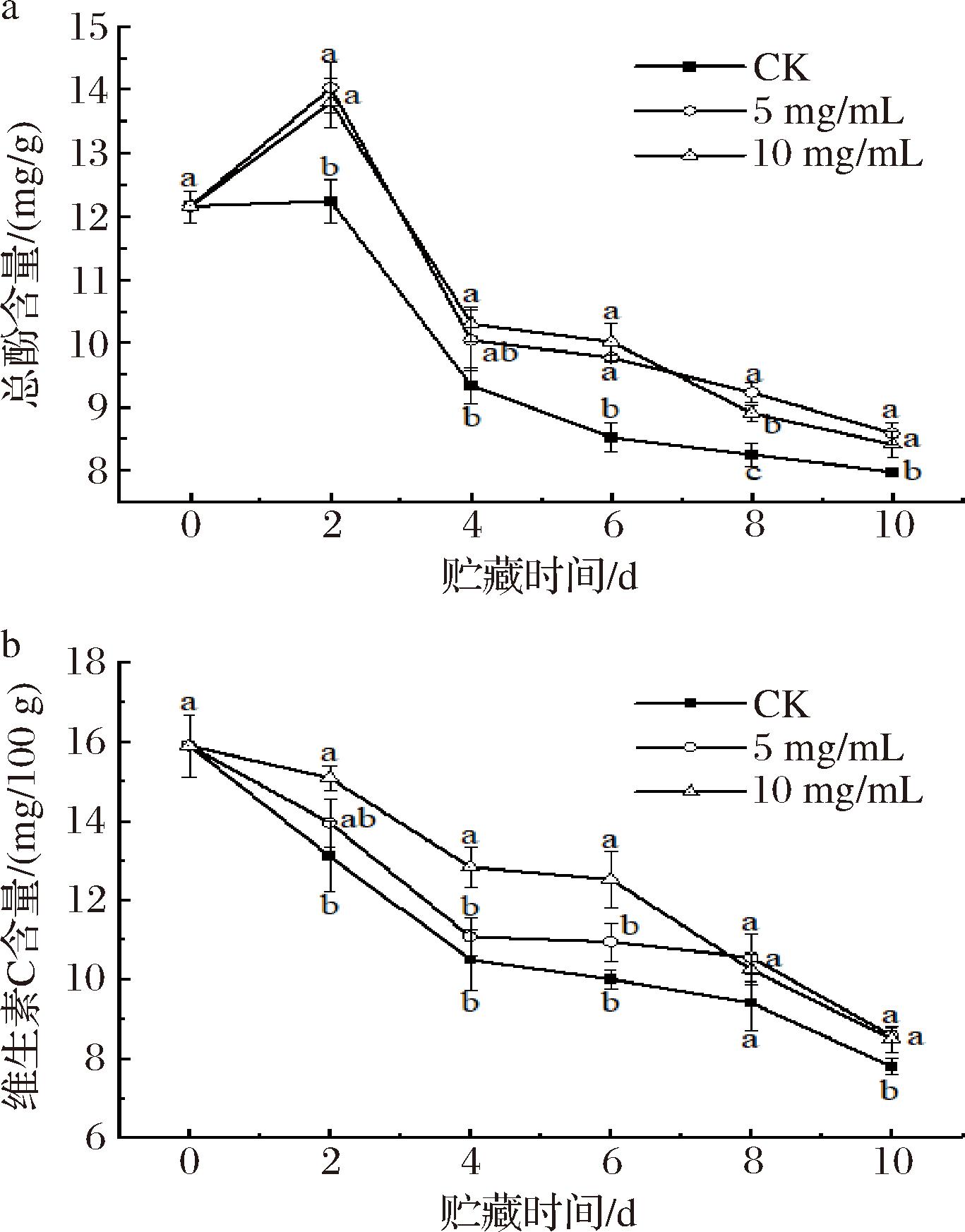
a-总酚含量;b-维生素C含量
图4 紫球藻多糖涂膜处理对南湖菱总酚和维生素C含量的影响
Fig.4 The effect of Porphyridium cruentum polysaccharide coating treatment on the content of total phenols and vitamin C of Trapa acornis Nakano
维生素C广泛参与人体多重生理代谢过程,因此维生素C通常被用来评价果实的营养和保鲜效果[31]。如图4-b所示,南湖菱采后维生素C含量随贮存时间的延长而降低,且经过2种浓度紫球藻多糖涂膜处理的南湖菱果实中的维生素C含量下降速率均小于对照组,这一现象可能是由于涂膜后果皮中渗透的氧含量降低了(氧气是抗坏血酸氧化反应必不可少的一部分),从而使抗坏血酸氧化酶活力降低。另一方面,紫球藻多糖具有抗氧化作用[32],在一定程度上可以抑制氧化反应的发生,有效地缓解南湖菱果实被氧化分解,从而延长贮藏期。
2.6 紫球藻多糖涂膜对南湖菱MDA含量的影响
MDA是脂质在氧化应激下产生的化合物,其含量能够反映脂质过氧化和细胞膜老化的程度[33]。如图5所示,随着贮藏时间的延长,MDA含量逐渐升高,而涂膜处理的则明显降低,这一差异具有统计学意义(P<0.05)。因此,多糖涂膜处理有助于减少细胞膜脂的氧化过程,可以延缓MDA含量的升高,从而达到延长南湖菱果实贮藏期的目的,但不同浓度的涂膜处理组无显著性差异。
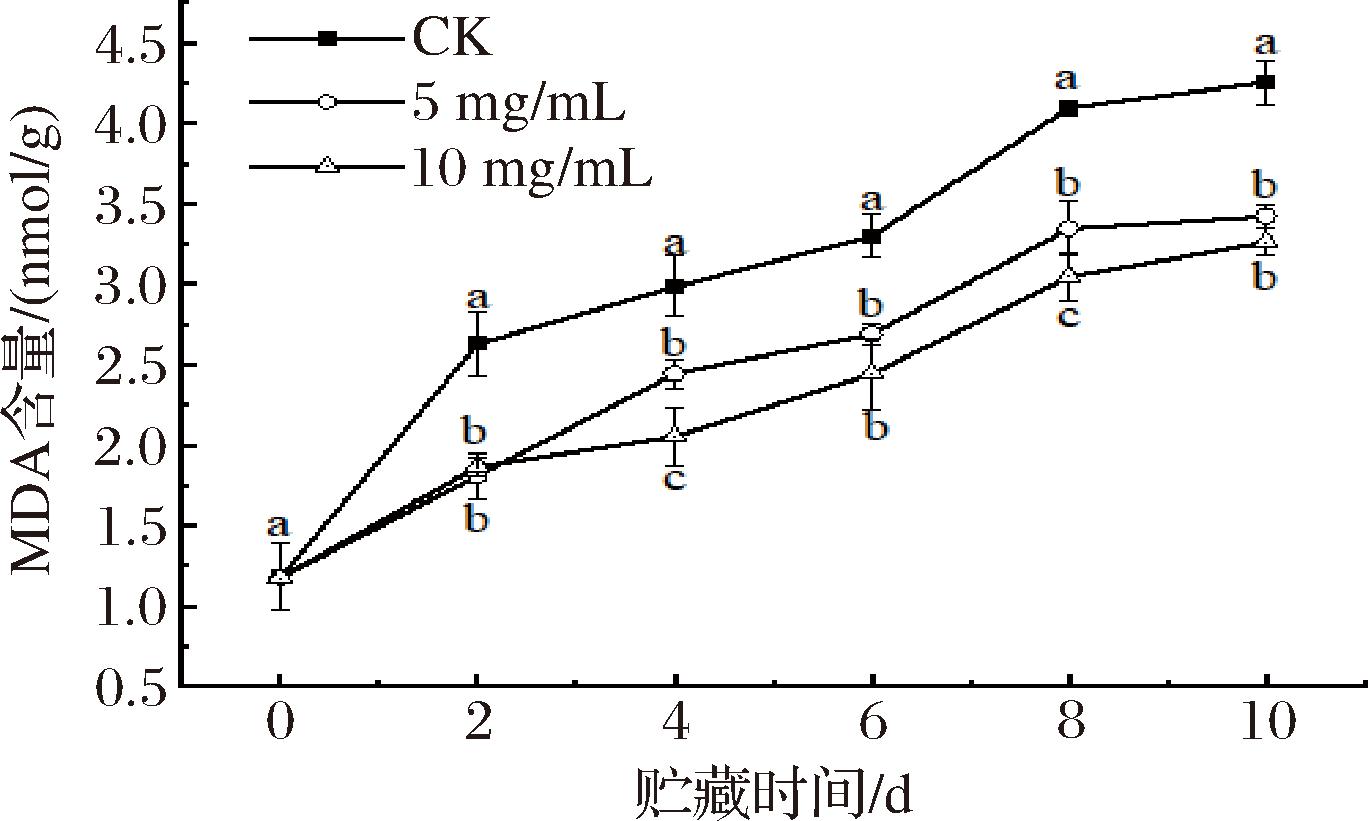
图5 紫球藻多糖涂膜处理对南湖菱MDA含量的影响
Fig.5 The effect of Porphyridium cruentum polysaccharide coating treatment on the content of MDA of Trapa acornis Nakano
2.7 紫球藻多糖涂膜对DPPH自由基和羟自由基清除率的影响
采后果实抗氧化能力是衡量其品质的一个重要指标,其抗氧化能力能够很好地反映其自身的抗氧化能力[34]。本研究以南湖菱果为材料,从DPPH自由基清除能力和羟自由基清除能力两个方面分析果实在储藏期间的抗氧化能力变化。由图6可知,南湖菱果实在贮藏期内,紫球藻多糖涂膜组和对照组的DPPH自由基清除率和羟自由基清除率呈现先上升后下降的趋势,且在整个贮藏过程中,涂膜组的DPPH自由基和羟自由基清除率一直保持在较高水平。各南湖菱处理组氧自由基清除率在贮藏第2天达到峰值后开始下降,在贮藏的第10天,与对照组相比,多糖5 mg/mL涂膜组和10 mg/mL涂膜组的DPPH自由基清除率分别提高了5.21%和2.62%,羟自由基清除率分别提高了6.82%和8.68%,各处理均呈现显著差异(P<0.05)。这突显了采用紫球藻多糖涂膜的潜在优势,可为果实品质的维持提供科学依据。

a-DPPH自由基清除率;b-羟自由基清除率
图6 紫球藻多糖涂膜处理对南湖菱DPPH自由基清除能力和羟自由基清除能力的影响
Fig.6 The effect of Porphyridium cruentum polysaccharide coating treatment on the DPPH· scavenging ability and ·OH scavenging ability of Trapa acornis Nakano
2.8 紫球藻多糖涂膜对抗氧化酶活力的影响
植物中的抗氧化酶如POD、PPO和抗坏血酸过氧化物酶(ascorbate peroxidase, APX)等,发挥着调控氧化还原反应的关键作用。POD催化酚类物质和抗坏血酸氧化,导致褐变,因此抑制POD活性可以有效延缓果蔬的褐变进程。根据图7-a,对照组和涂膜处理组果实的POD活力均呈现先上升后下降的趋势,均在贮藏第8天达到峰值后出现活力缓慢下降。值得注意的是,未进行涂膜处理的对照组的POD活性在整个贮藏期间一直高于5 mg/mL和10 mg/mL多糖涂膜组。在贮藏后期的第10天,对照组的POD活性分别是2组涂膜组的1.12倍和1.11倍,差异显著(P<0.05)。PPO能够催化果蔬中的多酚物质氧化成醌类物质,并引起深褐色沉淀物的聚合,是引起褐变的主要酶类[35]。图7-b显示,3组果实的PPO活力在贮藏0~8 d均呈上升趋势,之后逐渐降低。多糖涂膜处理显著降低了果实PPO活力(P<0.05),2组多糖涂膜处理之间没有显著差异。在贮藏第8天,对照组的PPO活性峰值为32.367 U/g,分别比5 mg/mL和10 mg/mL涂膜组高出1.32倍和1.24倍。
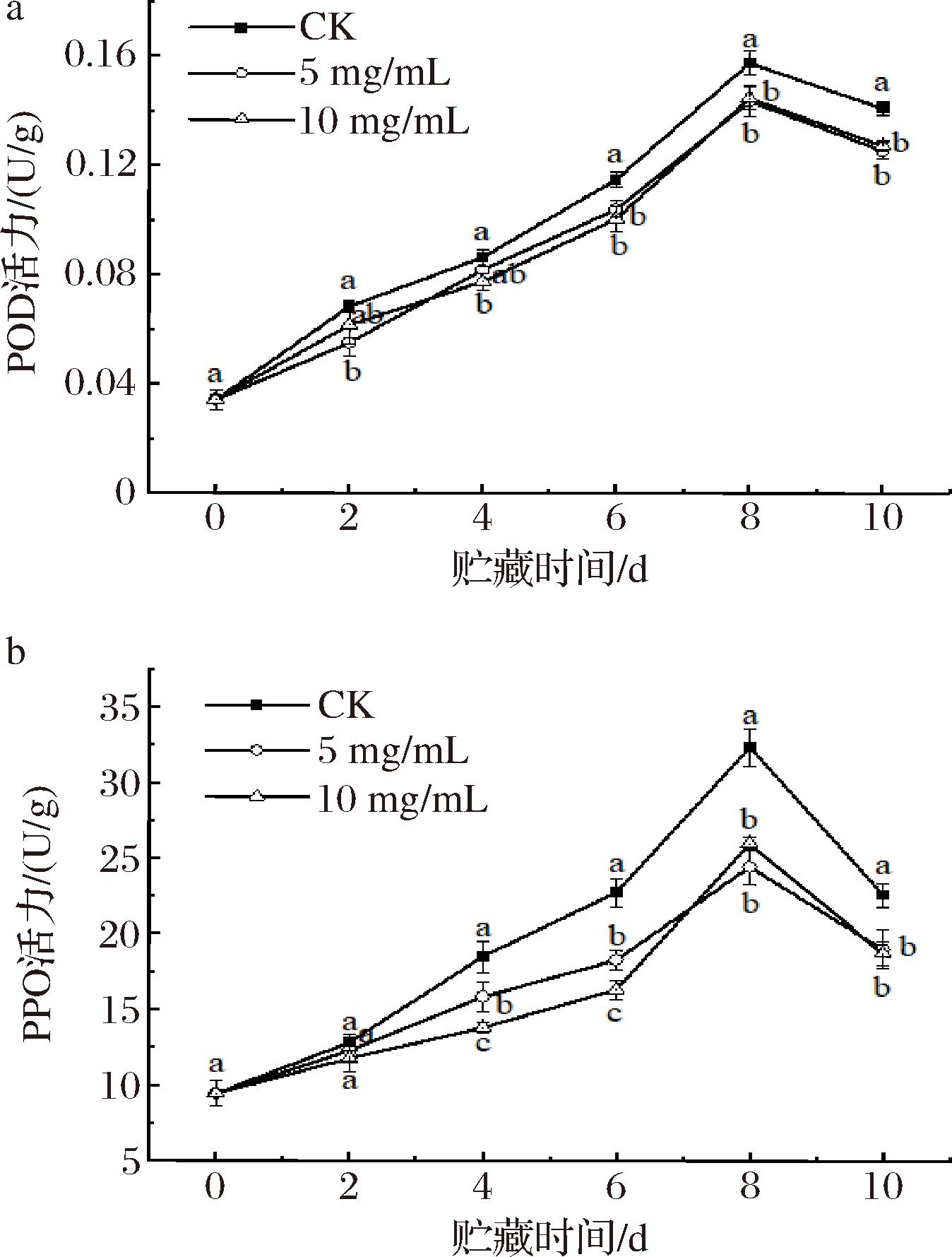
a-POD活力;b-PPO活力
图7 紫球藻多糖涂膜处理对南湖菱POD活力和PPO活力的影响
Fig.7 The effect of Porphyridium cruentum polysaccharide coating treatment on thePOD ability and PPO ability ofTrapa acornis Nakano
2.9 主成分分析
为了进一步探究涂膜处理对南湖菱果实贮藏品质的影响,以及综合分析不同指标在南湖菱贮藏期间与南湖菱果实贮藏品质的关系,采用PCA将不同指标对贮藏品质的贡献进行量化和可视化[36],PCA可以通过降维处理将多种变量整合成几个较少的综合指标[37]。选择失重率、可滴定酸、可溶性糖、可溶性蛋白、总酚、维生素C、MDA含量、氧自由基清除能力和抗氧化酶活性等11项指标的初始值进行均一化,以消除各指标间的差异。随后将均一化结果进行KMO和Bartlett’s球形检测,得到KMO=0.636>0.5,P≈0.000<0.005,证明变量存在显著相关性,以上筛选指标可以进行主成分分析。由表3可以看出,前2个主成分的特征值均大于1,累积贡献率达86.364%,可以很好地反映原始数据中包含的大部分信息。因此,提取前2个成分作为南湖菱果实贮藏品质的重要主成分,即PC1和PC2。
表3 多糖涂膜处理对南湖菱果实贮藏品质影响的特征值和贡献率
Table 3 Characteristic values and contribution rates of the effect of polysaccharide coating treatment on the storage quality of Trapa acornis Nakano
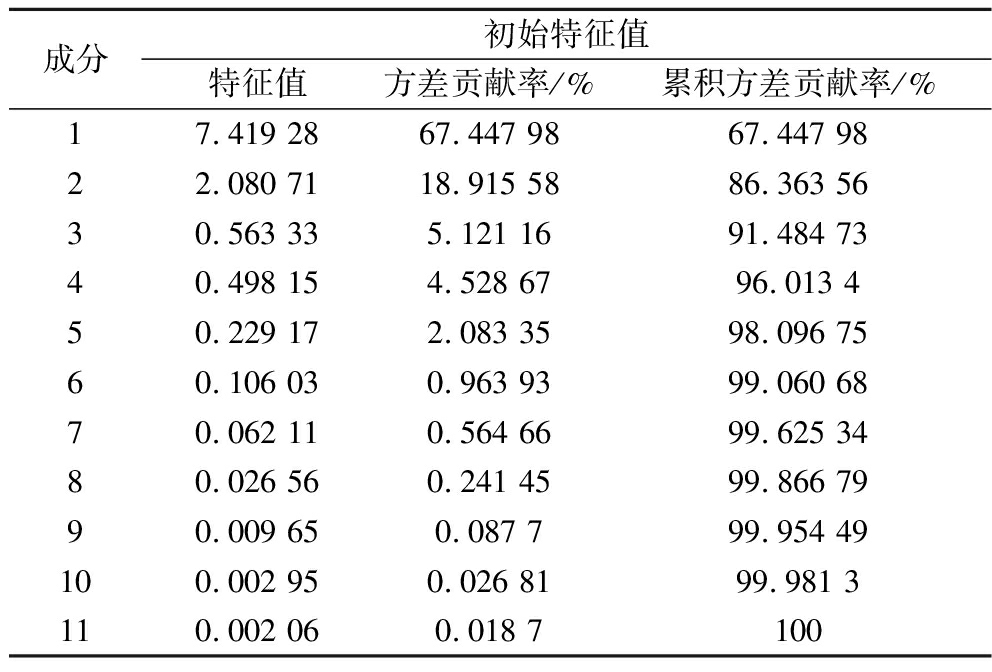
成分初始特征值特征值方差贡献率/%累积方差贡献率/%17.419 2867.447 9867.447 9822.080 7118.915 5886.363 5630.563 335.121 1691.484 7340.498 154.528 6796.013 450.229 172.083 3598.096 7560.106 030.963 9399.060 6870.062 110.564 6699.625 3480.026 560.241 4599.866 7990.009 650.087 799.954 49100.002 950.026 8199.981 3110.002 060.018 7100
根据图8-a的PCA,可滴定酸质量分数、可溶性糖含量、PPO活力、POD活力、MDA含量和失重率与PC1呈正相关;可滴定酸质量分数、可溶性糖含量、可溶性蛋白含量、氧自由基清除率、抗氧化酶活力、MDA含量及失重率与PC2呈正相关。其中,可溶性糖含量、PPO活力、POD活力、MDA含量和失重率这5种指标的载荷相近,说明他们之间存在协同关系。以这11个因子的载荷作为系数,构建了PC1和PC2的线性方程(6)和方程(7),并以累积方差贡献率为系数,按照公式(8)计算涂膜处理组和对照组对南湖菱保鲜效果的综合得分(F)。F得分越低,代表果实的综合品质越好。由图8-b可知,南湖菱果实的PCA综合得分在贮藏时间的延长过程中呈现先升高后小幅度降低的趋势。在贮藏第6天,3组的综合得分均已超越临界值0,说明果实已发生明显劣变。在贮藏第8天,对照组的果实劣变严重,得分达到2.912,而两种浓度多糖涂膜的保鲜组的综合得分差异不大。综上所述,紫球藻多糖涂膜作为一种有效的保鲜技术,能够在南湖菱果实的贮藏过程中减缓品质的下降,显示出显著的保鲜效果。在贮藏前6 d,5 mg/mL的紫球藻多糖涂膜处理显示出最佳的保鲜效果。随着贮藏时间的延长,不同浓度的多糖涂膜处理效果在后期表现出较小的差异,这表明在一定浓度范围内,紫球藻多糖涂膜的保鲜效果相对稳定。
F1=0.350X1-0.065X2+0.320X3-0.204X4-0.340X5-0.343X6+0.344X7-0.193X8-0.322X9+0.354X10+0.333X11
(6)
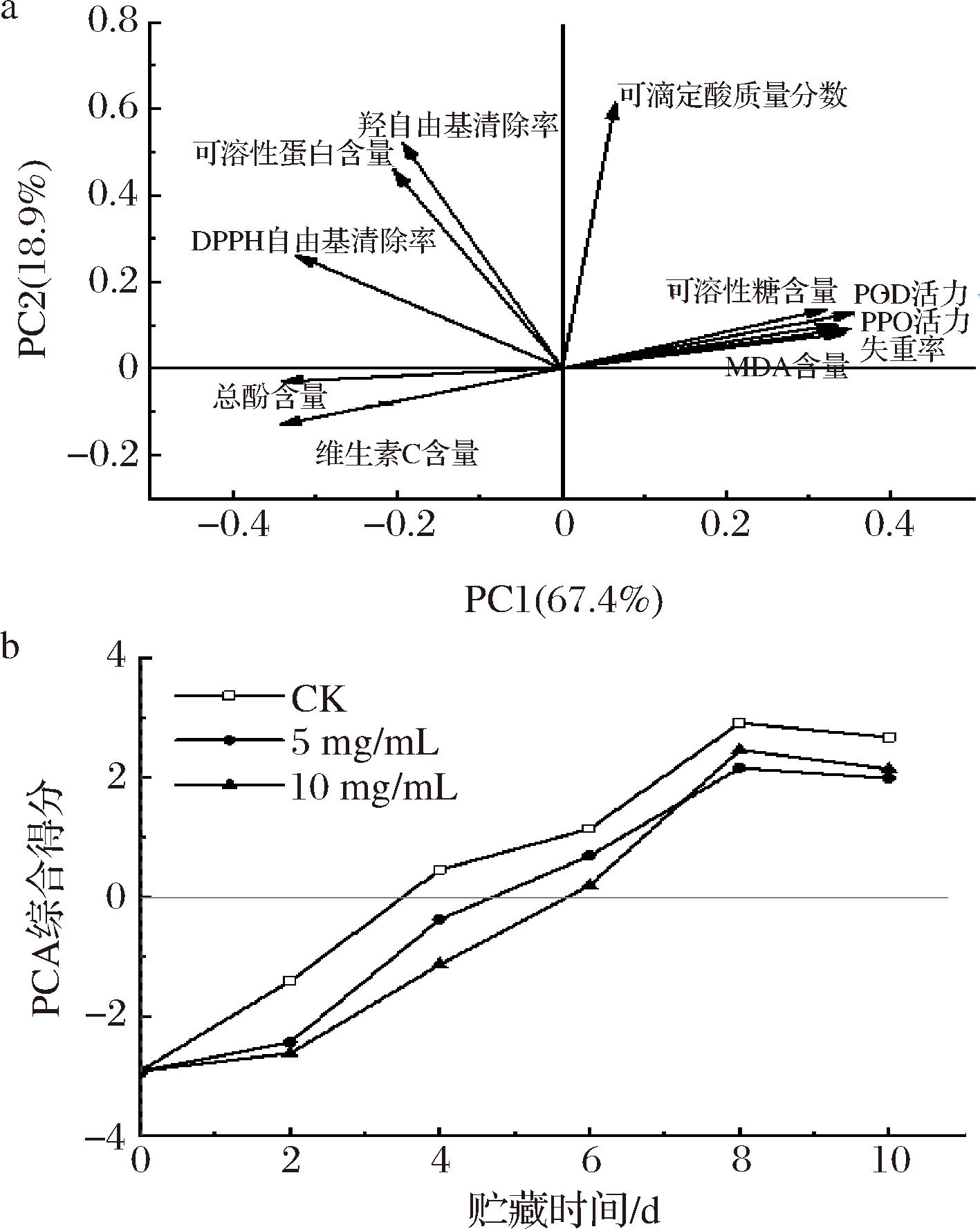
a-主成分分析图;b-不同处理组的主成分综合得分图
图8 PCA分析涂膜对南湖菱贮藏品质的影响
Fig.8 PCA analysis of the effect of coating on the storage quality of Trapa acornis Nakano
式中:X1~X11分别为失重率、可滴定酸、可溶性糖、可溶性蛋白、总酚、维生素C、MDA、羟自由基、DPPH自由基清除能力和抗氧化酶活性等指标在PC1中的载荷。
F2=0.093X1+0.612X2+0.136X3+0.457X4-0.030X5-0.129X6+0.081X7+0.520X8+0.261X9+0.129X10+0.102X11
(7)
式中:X1~X11分别为失重率、可滴定酸、可溶性糖、可溶性蛋白、总酚、维生素C、MDA、羟自由基、DPPH自由基清除能力和抗氧化酶活性等指标在PC2中的载荷。
(8)
3 讨论
在果蔬采后贮藏的过程中,由于外界许多不利的因素,果蔬体内活性氧的代谢水平失衡,活性氧物质不断积累,对果蔬造成严重的损害,最终引起果蔬迅速的衰老腐烂[38]。为了解决这一关键问题,涂膜技术迅速发展,该技术是通过在食物表面添加可食成膜材料,起到阻隔、抑制呼吸、降低水分散失、保持硬度等功能,对提升食品品质与安全具有重要意义。涂膜技术因其工艺简单,效果明显,安全性高,被认为是一种适用于各种食品的绿色防腐技术,在果品的贮藏方面有着很大的发展前景[39]。研究表明,海藻多糖主要通过2种方式来起到保鲜作用,首先是通过控制水果的呼吸作用来控制其衰老过程,多糖涂膜可在果皮上可形成一层保护性薄膜,能够减少果蔬食品的呼吸代谢和水分蒸发,从而保持食品的新鲜度和品质[40];其次是通过有效隔离微生物、抑制其生长和繁殖来保鲜,多种海藻多糖提取物已经通过抑菌实验初筛,具有广谱的抑菌活性,在果蔬保鲜中得到应用。如,陈海秀[41]的研究显示,8 mg/mL的岩藻多糖对E.coli、S.aureus的生长有明显的抑制作用;高玉杰等[42]对浒苔多糖进行了体外抑菌试验,结果显示其具有良好的抑菌活性。然而,在本研究的预实验中,涵盖了从0.313~10 mg/mL的紫球藻多糖质量浓度梯度,以评估其抑菌效果。尽管在10 mg/mL的紫球藻多糖浓度下观察到了抑菌活性,但抑菌效果不如低浓度的好。进一步分析发现,高浓度的紫球藻多糖由于其较高的黏性,在涂布过程中可能导致培养基上形成不均匀的涂层,这影响了抑菌效果的准确评估。此外,涂膜保鲜是一个涉及多种因素的复杂过程,包括空气隔绝、蒸腾作用以及微生物生长环境等,而多糖浓度仅是众多影响因素之一,还有pH、温度等因素的影响。因此,我们认为在0.313~5 mg/mL的质量浓度范围内已足以观察到紫球藻多糖的抑菌效果,决定不将10 mg/mL的抑菌试验结果纳入本论文。
本研究深入探讨了紫球藻多糖涂膜在南湖菱果实保鲜中的应用效果,发现紫球藻多糖涂膜处理在多个方面对南湖菱果实的贮藏品质产生影响。涂膜处理降低了南湖菱果实采后失重率,这是由于紫球藻多糖较好的成膜性,保水保湿效果较好,有效地降低贮藏过程中的蒸腾作用;同时,涂膜处理还抑制了丙二醛积累,减缓了可溶性糖、可溶性蛋白、总酚和维生素C等关键成分含量的下降趋势;维持了较高可滴定酸含量等,这一结果与ZHAN等[28]研究发现基本一致。同时,紫球藻多糖的成膜能力还在南湖菱表面形成一层阻氧膜,有效降低了POD和PPO酶活性,从而抑制酶促褐变。进一步进行PCA建模分析,发现失重率、可溶性糖含量和MDA含量可能存在协同作用,对照组在贮藏第10天的综合得分较高于其他组,证明其劣变最严重。同样,LI等[43]也认为,使用藻多糖和多酚混合涂膜组可以更好地保持太平洋白虾的感官品质,延长贮藏期。然而,实验发现,在南湖菱贮藏的第10天,其表面已经出现较严重褐化,果实出水以及发出令人不适的气味,因此通过紫球藻多糖涂膜延长南湖菱果实贮藏期只能作为一种短期的保鲜方式。
4 结论
综上所述,本研究通过利用紫球藻多糖的成膜性、抑菌性、无毒性和抗氧化性,对南湖菱果实的保鲜效果进行探究。结果表明,紫球藻多糖涂膜能够有效降低采后失重率,减缓关键营养成分的下降,抑制酶促褐变,从而在多个方面提升南湖菱果实的贮藏品质。PCA建模分析进一步验证了质量浓度为5 mg/mL和10 mg/mL的紫球藻多糖涂膜处理均可以维持采后南湖菱较高的品质,从而延缓果实的衰老,延长贮藏期,其中,5 mg/mL多糖涂膜组整体表现最佳。尽管如此,在实际应用中还需要结合冷藏处理、真空包装等其他保鲜技术,以达到更好的保鲜效果。这些发现不仅为海藻多糖涂膜处理的实际应用提供了科学依据,也进一步为食品领域涂膜技术提供了新的有效成分。
[1] 蔡丽玲, 赵惠明. 南湖菱营养成分及无机元素含量分析[J]. 食品研究与开发, 2003, 24(4):95-97.CAI L L, ZHAO H M. Determination of nutritional composition and mineral content of Nanhu water caltrop[J]. Food Research and Development, 2003, 24(4):95-97.
[2] 潘安. 南湖菱[J]. 开卷有益(求医问药), 2014(10):74.PAN A. Nanhuling[J]. Journal for Beneficial Readines Drug Informations &Medical Advices, 2014(10):74.
[3] KANG W Y. Antioxidant activities, a-glucosidase inhibitory effect in vitro and antihyperglycemic of Trapa acornis shell in alloxan-induced diabetic rats[J]. Journal of Medicinal Plants Research, 2011, 5(31): 6805-6812.
[4] 逯鑫, 吕涛, 占扎君, 等. 南湖菱壳中没食子酰葡萄糖的纯化工艺及抗肿瘤作用研究[J]. 浙江农业科学, 2023, 64(6):1560-1567. LU X, LYU T, ZHAN Z J, et al. Study on purification technology and anti-tumor effect of galloylglucose from South Lake water chestnut shell[J]. Journal of Zhejiang Agricultural Sciences, 2023, 64(6):1560-1567.
[5] 姚倩文, 吴颖越, 吴漪澜, 等. 嘉兴南湖菱产业发展策略研究[J]. 时代经贸, 2016, 13(6):29-31.YAO Q W, WU Y Y, WU Y L, et al. Study on the development strategy of Jiaxing Nanhu Ling industry[J]. Economic &Trade Update, 2016, 13(6):29-31.
[6] 蒋雨, 艾静汶, 王淋靓. 热带特色水果荔枝与龙眼的采后贮藏保鲜技术研究进展[J]. 农产品加工(上半月), 2016(1):63-66.JIANG Y, AI J W, WANG L L. Research progress on postharvest preservation technology of tropical fruit Litchi and Longan[J]. Academic Periodical of Farm Products Processing, 2016(1):63-66.
[7] GENNADIOS A, HANNA M A, KURTH L B. Application of edible coatings on meats, poultry and seafoods: A review[J]. LWT-Food Science and Technology, 1997, 30(4):337-350.
[8] 罗爱国. 钝顶螺旋藻多糖的分离纯化、生物活性及其在肉制品保鲜中的应用[D]. 太原: 山西大学, 2018.LUO A G. Isolation, purification, biological activity and application of polysaccharide from Spirulina platensis in meat preservation[D]. Taiyuan: Shanxi University, 2018.
[9] ZHANG B, LIU Y, WANG H H, et al. Characterization of seaweed polysaccharide-based bilayer films containing essential oils with antibacterial activity[J]. LWT, 2021, 150:111961.
[10] 侯萍, 李铭, 陈冬梅, 等. 麒麟菜多糖对荔枝涂膜保鲜效果的研究[J]. 中国果菜, 2017, 37(4):5-8.HOU P, LI M, CHEN D M, et al. Preservation effect of Eucheuma polysaccharide on Litchi[J]. China Fruit Vegetable, 2017, 37(4):5-8.
[11] 李保华. 马尾藻多糖提取条件的优化、多糖复合膜的制备及其特性和应用研究[D]. 南京: 南京农业大学, 2015.LI B H. Optimization of extraction conditions of Sargassum polysaccharide, preparation, characteristics and application of polysaccharide composite membrane[D]. Nanjing: Nanjing Agricultural University, 2015.
[12] SHAO P, ZHANG H Y, NIU B, et al. Antibacterial activities of R-(+)-limonene emulsion stabilized by Ulva fasciata polysaccharide for fruit preservation[J]. International Journal of Biological Macromolecules, 2018, 111:1273-1280.
[13] 刘文龙, 雷英杰, 杨玉琴, 等. 海带多糖协同电子束辐照对生鲜猪肉的保鲜作用[J]. 食品研究与开发, 2022, 43(18):34-40.LIU W L, LEI Y J, YANG Y Q, et al. Effect of kelp polysaccharide addition and electron beam irradiation on fresh pork preservation[J]. Food Research and Development, 2022, 43(18):34-40.
[14] 张威, 王敏, 朱劲华, 等. 硒化紫球藻胞外粗多糖的理化性质初步研究[J]. 中国海洋药物, 2006, 25(4):34-36.ZHANG W, WANG M, ZHU J H, et al. Preliminary research of the physiochemical properties of selenium exopolysaccharide from Porphyridium sp.(Se-PSP)[J]. Chinese Journal of Marine Drugs, 2006, 25(4):34-36.
[15] DE JESUS RAPOSO M F, DE MORAIS A M M B, SANTOS COSTA DE MORAIS R M. Influence of sulphate on the composition and antibacterial and antiviral properties of the exopolysaccharide from Porphyridium cruentum[J]. Life Sciences, 2014, 101(1-2):56-63.
[16] TANNIN-SPITZ T, BERGMAN M, VAN-MOPPES D, et al. Antioxidant activity of the polysaccharide of the red microalga Porphyridium sp[J]. Journal of Applied Phycology, 2005, 17(3):215-222.
[17] BALTI R, BEN MANSOUR M, ZAYOUD N, et al. Active exopolysaccharides based edible coatings enriched with red seaweed (Gracilaria gracilis) extract to improve shrimp preservation during refrigerated storage[J]. Food Bioscience, 2020, 34:100522.
[18] 石全见. 紫球藻多糖的分子修饰及其体外抗氧化作用[D]. 烟台: 烟台大学, 2009.SHI Q J. Molecular modification of Porphyridium porphyridium polysaccharide and its antioxidant activity in vitro[D]. Yantai: Yantai University, 2009.
[19] 黎星延, 黄丽金, 刘汉美, 等. 不同分子量壳聚糖涂膜对采后西番莲果实贮藏品质的影响[J]. 食品工业科技, 2023, 44(22):319-326.LI X Y, HUANG L J, LIU H M, et al. Effect of chitosan coating with different molecular weights on the storage quality of postharvest passion fruit(Passiflora edulis Sims)[J]. Science and Technology of Food Industry, 2023, 44(22):319-326.
[20] ZHU T, TAN W R, DENG X G, et al. Effects of brassinosteroids on quality attributes and ethylene synthesis in postharvest tomato fruit[J]. Postharvest Biology and Technology, 2015, 100:196-204.
[21] 祝义伟, 周令国, 叶宸志, 等. 香菇柄中可溶性糖的测定[J]. 农产品加工, 2015(6):43-45.ZHU Y W, ZHOU L G, YE C Z, et al. Determination of the soluble sugars in mushroom stem[J]. Farm Products Processing, 2015(6):43-45.
[22] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 293.
[23] SU Z H, HU M J, GAO Z Y, et al. Apple polyphenols delay senescence and maintain edible quality in Litchi fruit during storage[J]. Postharvest Biology and Technology, 2019, 157:110976.
[24] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 176.
[25] TOOR R K, SAVAGE G P. Antioxidant activity in different fractions of tomatoes[J]. Food Research International, 2005, 38(5):487-494.
[26] 詹丽娟. 壳聚糖和热处理对南湖菱贮藏品质和生理的影响以及PPO特性研究[D]. 杭州: 浙江大学, 2006.ZHAN L J. Effects of chitosan and heat treatment on storage quality and physiology of south lake Trapa and study on PPO characteristics[D]. Hangzhou: Zhejiang University, 2006.
[27] 朱红薇, 芮品质, 张成文, 等. 南湖菱生药学研究[J]. 嘉兴学院学报, 2012, 24(6):43-47.ZHU H W, RUI P Z, ZHANG C W, et al. Pharmacognostic study on Trapa acornis NaKano[J]. Journal of Jiaxing University, 2012, 24(6):43-47.
[28] ZHAN L J, HU J Q, ZHU Z J. Shelf life extension of minimally processed water caltrop (Trapa acornis Nakano) fruits coated with chitosan[J]. International Journal of Food Science &Technology, 2011, 46(12):2634-2640.
[29] 贾思曈, 张子迪, 陈存坤, 等. 低温等离子体处理对冬枣贮藏品质及风味物质的影响[J/OL]. 食品与发酵工业, 2024. https://doi.org/10.13995/j.cnki.11-1802/ts.036633.JIA S T, ZHANG Z D, CHEN C K, et al. The effect of low-temperature plasma treatment on the storage quality and flavor substances of winter jujube[J/OL]. Food and Fermentation Industries, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.036633.
[30] 刘敏, 张岚, 王丹, 等. 壳聚糖/藜麦蛋白/柑橘精油复合膜对圣女果保鲜效果的影响[J]. 中国食品添加剂, 2023, 34(8):230-237.LIU M, ZHANG L, WANG D, et al. Effects of chitosan/quinoa protein/citrus essential oil composite film on the preservation of cherry tomatoes[J]. China Food Additives, 2023, 34(8):230-237.
[31] 李姗姗, 钟献坤, 杨黎, 等. 三种植物精油对樱桃番茄保鲜效果的影响[J]. 北方园艺, 2020(23):108-114.LI S S, ZHONG X K, YANG L, et al. Effects of three essential oil on preservation of cherry tomato[J]. Northern Horticulture, 2020(23):108-114.
[32] 刘红辉, 李敏, 汲红丽, 等. 紫球藻胞外多糖抗氧化和保湿性能的研究[J]. 食品研究与开发, 2014, 35(5):1-6.LIU H H, LI M, JI H L, et al. Antioxidation and moisture retention activity of extracellular polysaccharides from Porphyridium cruentum[J]. Food Research and Development, 2014, 35(5):1-6.
[33] IMAHORI Y, BAI J H, BALDWIN E. Antioxidative responses of ripe tomato fruit to postharvest chilling and heating treatments[J]. Scientia Horticulturae, 2016, 198:398-406.
[34] 谭琳, 周兆禧, 王甲水, 等. 海南山竹果实不同部位多酚提取物抗氧化活性、乙酰胆碱酯酶和α-葡萄糖苷酶抑制活性研究[J]. 广东农业科学, 2018, 45(1): 102-107.TAN L, ZHOU Z X, WANG J S, et al. Antioxidant activity, acetylcholine esterase and α-glucosidase inhibitory activity of tthe poly-phenol extractives from peel and pulp of Garcinia mangostana fruit grown in Hainan province[J]. Guangdong Agricultural Science, 2018, 45(1): 102-107.
[35] 尹琳琳, 张雪, 卢世凤, 等. 短波紫外照射协同壳聚糖涂膜处理对鲜切甘蔗的保鲜效果[J]. 食品与发酵工业, 2022, 48(6):218-224.YIN L L, ZHANG X, LU S F, et al. The preservative effect of UV-C combined with chitosan coating on fresh-cut sugarcane[J]. Food and Fermentation Industries, 2022, 48(6):218-224.
[36] 田由. 不同苹果品种及加工关键参数对非浓缩还原苹果汁品质的影响[D]. 西安: 陕西师范大学, 2018.TIAN Y. Effects of different apple varieties and key processing parameters on the quality of not from concentrate apple juice[D]. Xi’an: Shaanxi Normal University, 2018.
[37] 陈楚英, 万春鹏, 简火仔, 等. 基于冷藏温度对新余蜜桔采后贮藏品质影响的主成分分析[J]. 分子植物育种, 2019, 17(6):2019-2024.CHEN C Y, WAN C P, JIAN H Z, et al. Effects of different cold storage temperature on postharvest quality of Xinyu tangerines[J]. Molecular Plant Breeding, 2019, 17(6):2019-2024.
[38] BHATTACHARJEE S. Reactive oxygen species and oxidative burst: Roles in stress, senescence and signal transduction in plants[J]. Current Science, 2005, 89(7): 1113-1121.
[39] 洪理杰, 范阳, 刘秉珍, 等. 苦荞粗多糖涂膜处理对中国樱桃的保鲜效果[J]. 食品工业科技, 2021, 42(14):296-301.HONG L J, FAN Y, LIU B Z, et al. Preservation effect of Tartary buckwheat crude polysaccharide coating on Chinese cherry[J]. Science and Technology of Food Industry, 2021, 42(14):296-301.
[40] 侯萍, 马军, 李铭, 等. 海藻多糖用于食品涂膜保鲜的研究现状[J]. 热带农业科学, 2016, 36(4):82-85.HOU P, MA J, LI M, et al. Research progress of seaweed polysaccharide for food preservation[J]. Chinese Journal of Tropical Agriculture, 2016, 36(4):82-85.
[41] 陈海秀. 海洋硫酸多糖抗菌活性研究及在肉类保鲜中的应用[D]. 厦门: 集美大学, 2016.CHEN H X. Study on antibacterial activity of marine sulfated polysaccharide and its application in meat preservation[D]. Xiamen: Jimei University, 2016.
[42] 高玉杰, 吕海涛. 浒苔多糖和硒化浒苔多糖抑菌作用研究[J]. 食品科技, 2013, 38(1):195-198; 205.GAO Y J, LYU H T. Antimibacterial activities of Enteromorpha polysaccharide and selenium Enteromorpha polysaccharide[J]. Food Science and Technology, 2013, 38(1):195-198; 205.
[43] LI Y C, YANG Z Y, LI J R. Shelf-life extension of Pacific white shrimp using algae extracts during refrigerated storage[J]. Journal of the Science of Food and Agriculture, 2017, 97(1):291-298.