甘南是中国十个藏族自治州之一,位于中国甘肃省西南部,平均海拔2 960 m,平均气温1.7 ℃,拥有特有畜产资源“甘南牦牛”,2017年被授予“中国牦牛乳都”称号。牦牛乳富含蛋白质、必需氨基酸、脂肪、乳糖和矿物质等营养素,营养价值极高,是藏族牧民生存的重要营养来源[1]。牦牛乳含有丰富的免疫球蛋白、乳铁蛋白、亚油酸、α-亚麻酸、共轭亚油酸、二十碳四烯酸(arachidonic acid, ARA)、二十碳五烯酸(eicosapentaenoic acid, EPA)、二十二碳六烯酸(docosahexaenoic acid, DHA)以及超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、辅酶Q10、过氧化氢酶(catalase, CAT)、溶菌酶、乳糖酶等生物活性酶[2]。研究发现,牦牛乳中含有的乳清蛋白[3]、α-乳白蛋白[4]、乳脂球膜(milk fat globule membrane, MFGM)[5]、矿物质铁、锌、锰[6]以及维生素C[7]等,使牦牛乳具有抗氧化功能特性,且牦牛乳总抗氧化能力随海拔升高而增加,这可能与自然环境条件海拔越高,牦牛受到的氧化胁迫越大有关[8-9]。此外,研究认为牦牛乳的抗氧化活性源于其蛋白质中的生物活性肽和从天然发酵分离出来的乳酸菌[10]。MOON等[11]也研究证实,乳源的抗氧化物质对于自由基可以起到抑制其形成以及清除已形成自由基的能力,同时可抑制活性氧的形成。
利用体外实验评价天然产物的抗氧化活性,具有高效、快速的优点[9]。而利用小鼠等哺乳动物模型研究天然物质的抗氧化活性已较为普遍,但这一方法存在成本高、周期长、操作复杂等问题,不便于开展体内功能研究。斑马鱼是国际认可的新型模式生物,具有体积小、繁殖周期短、产卵量大、胚胎透明、生理结构和功能与哺乳动物高度相似等特点,且具有对哺乳类动物实验预测性强、可比度高等优点,已被广泛用于天然产物体内抗氧化活性的评价[12-13]。因此,为评价牦牛乳抗氧化效果,本实验拟通过体外抗氧化评价、斑马鱼动物实验,研究甘南牦牛乳的抗氧化活性及效果,为牦牛乳应用于抗氧化功能性食品开发、提升牦牛乳价值,带动藏区经济发展提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
牦牛乳,采自甘南州夏河县野生放牧牦牛,共采集20头牦牛乳样,取250 mL乳样装入无菌取样瓶中,采集完毕后,密封并迅速冷藏,于2 h内运回实验室。将乳样混匀后分装于250 mL无菌取样瓶中,冷冻至-20 ℃以下备用;斑马鱼,由杭州环特生物科技股份有限公司养鱼中心繁殖提供,实验动物使用许可证号为:SYXK(浙)2022-0004,饲养管理符合国际AAALAC认证(认证编号:001458)要求,IACUC伦理审查号:IACUC-2023-6615-01。
甲基纤维素、乙酰-L-半胱氨酸、甲萘醌,上海阿拉丁生化科技股份有限公司;二甲基亚砜,Sigma公司;Cell ROXTM Green Reagent,Invitrogen公司;BCA蛋白浓度测定试剂盒,博士德生物工程有限公司;超氧化物歧化酶试剂盒,南京建成生物工程研究所;DPPH,上海麦克林生化科技有限公司;无水乙醇、盐酸、硫酸亚铁、H2O2,天津百世化工有限公司;邻苯三酚、Tris,天津市光复科技发展有限公司;水杨酸,天津市科密欧化学试剂有限公司。
1.2 仪器与设备
SZX7解剖显微镜,OLYMPUS公司;AZ100电动聚焦连续变倍荧光显微镜,Nikon公司;CP214精密电子天平,OHAUS公司;6孔板,浙江贝兰伯生物科技有限公司;96孔板,Nest Biotech公司;SPARK多功能酶标仪,TECAN公司;Sorvall ST16高速冷冻离心机,Thermo公司;全自动样品快速研磨仪,上海净信实验设备科技部;T6紫外分光光度计,北京普析通用仪器有限责任公司;pHS-3C酸度计,上海佑科仪器仪表有限公司。
1.3 实验方法
1.3.1 甘南牦牛乳体外抗氧化效果评价
1.3.1.1 羟自由基清除率测定
由于Fe2+氧化H2O2产生的羟自由基可氧化水杨酸生成有色体系,并在510 nm处有最大吸收,当加入清除羟自由基的物质时,会与水杨酸竞争羟自由基,减少有色物质生成,降低吸光度值。利用此原理,参考检测方法[14],本试验具体操作为:分别吸取牦牛乳1.0、2.0、3.0、4.0、5.0 mL定容至10 mL容量瓶,得到不同添加量的牦牛乳稀释液,依次取牦牛乳稀释液2.0 mL,加入9.0 mmol/L的FeSO4 1.0 mL、9.0 mmol/L水杨酸-乙醇溶液2.0 mL、4.4 mmol/L H2O2 2.0 mL、蒸馏水2.0 mL,37 ℃水浴30 min后在510 nm测吸光度值Ax;用蒸馏水代替H2O2,得本底吸收Ax0,蒸馏水代替牦牛乳,得空白值A0;该试验以蒸馏水做参比,该试验重复3次。羟自由基清除率的计算如公式(1)所示:
羟自由基清除率![]()
(1)
1.3.1.2 超氧阴离子自由基清除率测定
参考采用邻苯三酚自氧化法[14]:吸取pH值为8.2、浓度为50 mmol/L的Tris-HCl溶液4.5 mL,分别吸取牦牛乳1.0、2.0、3.0、4.0、5.0 mL定容至10 mL容量瓶,得到不同添加量的牦牛乳稀释液,依次取牦牛乳稀释液1.0 mL,混匀,室温反应25 min,然后分别加入3.0 mmol/L邻苯三酚溶液1.0 mL反应5 min。经波长扫描,试液在325 nm处有最大吸收,测得其吸光度值Ax;用重蒸水代替牦牛乳,得空白值A0;用重蒸水代替邻苯三酚溶液得本底吸收Ax0;该试验重复3次。超氧阴离子自由基清除率的计算如公式(2)所示:
超氧阴离子自由基清除率![]()
(2)
1.3.1.3 DPPH自由基清除率测定
DPPH自由基是一种稳定的人工合成自由基,具有典型紫色,在517 nm处有最大吸收,当它与提供一个电子的自由基清除剂作用时可生成无色产物,紫色变浅。参考卢野[15]测定方法:吸取0.2 mmol/L DPPH储备液2.0 mL、分别吸取牦牛乳0.4、0.8、1.2、1.6、2.0 mL定容至10 mL容量瓶,得到不同添加量的牦牛乳稀释液,依次取牦牛乳稀释液2.0 mL,混匀,于室温避光显色30 min,5 200 r/min离心5 min,取上清液在517 nm处测得吸光度值Ai;用无水乙醇代替牦牛乳,测得吸光度值A0;吸取2.0 mL牦牛乳,无水乙醇2.0 mL,测得吸光度值Aj;该试验重复3次。DPPH自由基清除率的计算如公式(3)所示:
DPPH自由基清除率![]()
(3)
1.3.2 甘南牦牛乳体内抗氧化效果评价
1.3.2.1 实验动物饲养
选择黑色素等位基因突变斑马鱼(AL品系)饲养于杭州环特生物科技股份有限公司养鱼中心28 ℃的养鱼用水中(水质:每1 L反渗透水中加入200 mg速溶海盐,电导率为450~550 μS/cm;pH值为6.5~8.5;硬度为50~100 mg/L CaCO3),光照周期为14 h光照/10 h黑暗。以自然成对交配繁殖方式进行,受精后3 d(3 dpf)的斑马鱼用于实验[16]。
1.3.2.2 给药剂量考察
随机选取发育正常且阶段一致的3 dpf AL品系斑马鱼于6孔板中,每孔30尾,用牦牛乳含量为12.5、25.0、50.0、100、200 μL/mL的养鱼水处理。同时设置模型对照组和正常对照组。除正常对照组外,其余各组均给予浓度为2.00 μmol/L甲萘醌(维生素K3)水溶液建立斑马鱼氧化损伤模型。28 ℃处理24 h后,观察统计各组斑马鱼的死亡数量并及时移除,以幼鱼不出现死亡或其他毒性表现的最大浓度为牦牛乳对模型斑马鱼的最大给药剂量,即最大检测浓度(maximum toxic concentration, MTC)。
1.3.2.3 甘南牦牛乳体内抗氧化效果评价
随机选取发育正常且阶段一致的3 dpf AL品系斑马鱼于6孔板中,每孔30尾,用牦牛乳含量为12.5、25.0、50.0 μL/mL的养鱼水处理。阳性对照组给予62.5 μg/mL质量浓度的N-乙酰-L-半胱氨酸水溶液,同时设置模型对照组和正常对照组。除正常对照组外,其余各组均给予浓度为2.00 μmol/L甲萘醌(维生素K3)水溶液建立斑马鱼氧化损伤模型。28 ℃处理24 h后,将各组斑马鱼用Cell ROXTM Green Reagent避光染色30 min,并用养鱼水清洗3遍。各组随机选取10尾斑马鱼置于荧光显微镜下拍照,以斑马鱼卵黄囊荧光强度(B)的统计学分析结果评价牦牛乳抗氧化功效,抗氧化效果评价的计算如公式(4)所示:
抗氧化效果![]()
(4)
1.3.2.4 甘南牦牛乳对斑马鱼体内抗氧化酶活力的影响
随机选取发育正常且阶段一致的3 dpf AL品系斑马鱼于6孔板中,每孔30尾,用牦牛乳含量为12.5、25.0、50.0 μL/mL的养鱼水处理。阳性对照组给予62.5 μg/mL质量浓度的N-乙酰-L-半胱氨酸水溶液,同时设置模型对照组和正常对照组,每孔容量为3 mL,每个实验组设置3平行。除正常对照组外,其余各组均给予浓度为2.00 μmol/L甲萘醌(维生素K3)水溶液建立斑马鱼氧化损伤模型。28 ℃处理24 h后,收集各实验组斑马鱼,用BCA蛋白浓度测定试剂盒检测斑马鱼的蛋白浓度,同时按照SOD检测试剂盒的说明书进行操作,用全波长多功能酶标仪检测各实验组斑马鱼的SOD活力,以该指标的统计学分析结果评价牦牛乳的抗氧化功效。
1.4 统计分析
利用Excel 2010、SPSS 26.0软件进行统计学分析,P<0.05表明差异具有统计学意义。统计学处理结果用mean±SE表示。
2 结果与分析
2.1 甘南牦牛乳体外抗氧化效果评价
羟自由基是活性氧中最活泼的自由基,是对生物体危害最大的自由基,超氧阴离子自由基是生物体内主要的自由基之一,可引起生物体内脂质过氧化,而DPPH自由基是一种稳定的自由基,被广泛应用于体外抗氧化能力评价[17-19]。因此,本实验选择羟自由基、超氧阴离子自由基以及DPPH自由基作为评价牦牛乳体外抗氧化效果的指标。
2.1.1 羟自由基清除能力
由图1可知,牦牛乳添加量为20~100 μL/mL时,对羟自由基的清除率为89.5%~99.7%,随着牦牛乳质量浓度的增大,对羟自由基清除能力先保持基本不变,后有所下降,当牦牛乳添加量为20 μL/mL时,对羟自由基的清除率最大(99.7%),说明牦牛乳对羟自由基具有很强的清除能力。
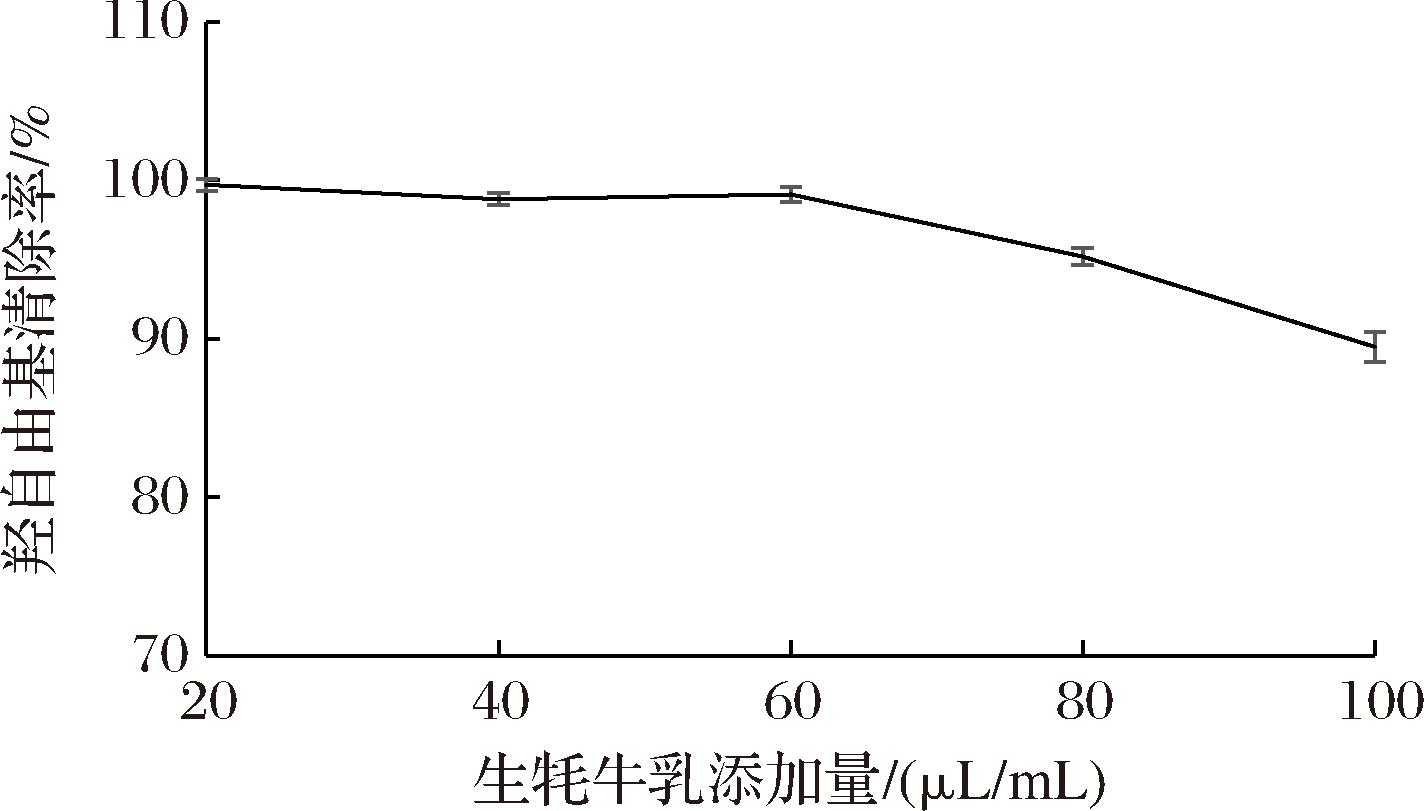
图1 牦牛乳羟自由基清除能力
Fig.1 Hydroxyl radical scavenging ability of yak milk
2.1.2 超氧阴离子自由基清除能力
由图2可知,牦牛乳添加量为20~100 μL/mL,对超氧阴离子自由基的清除率为75.45%~90.31%,随着牦牛乳质量浓度的增大,对超氧阴离子自由基清除能力逐渐增强,当牦牛乳添加量为80 μL/mL时,对超氧阴离子自由基的清除率最大(90.31%),说明牦牛乳具有很好的清除超氧阴离子自由基的能力。
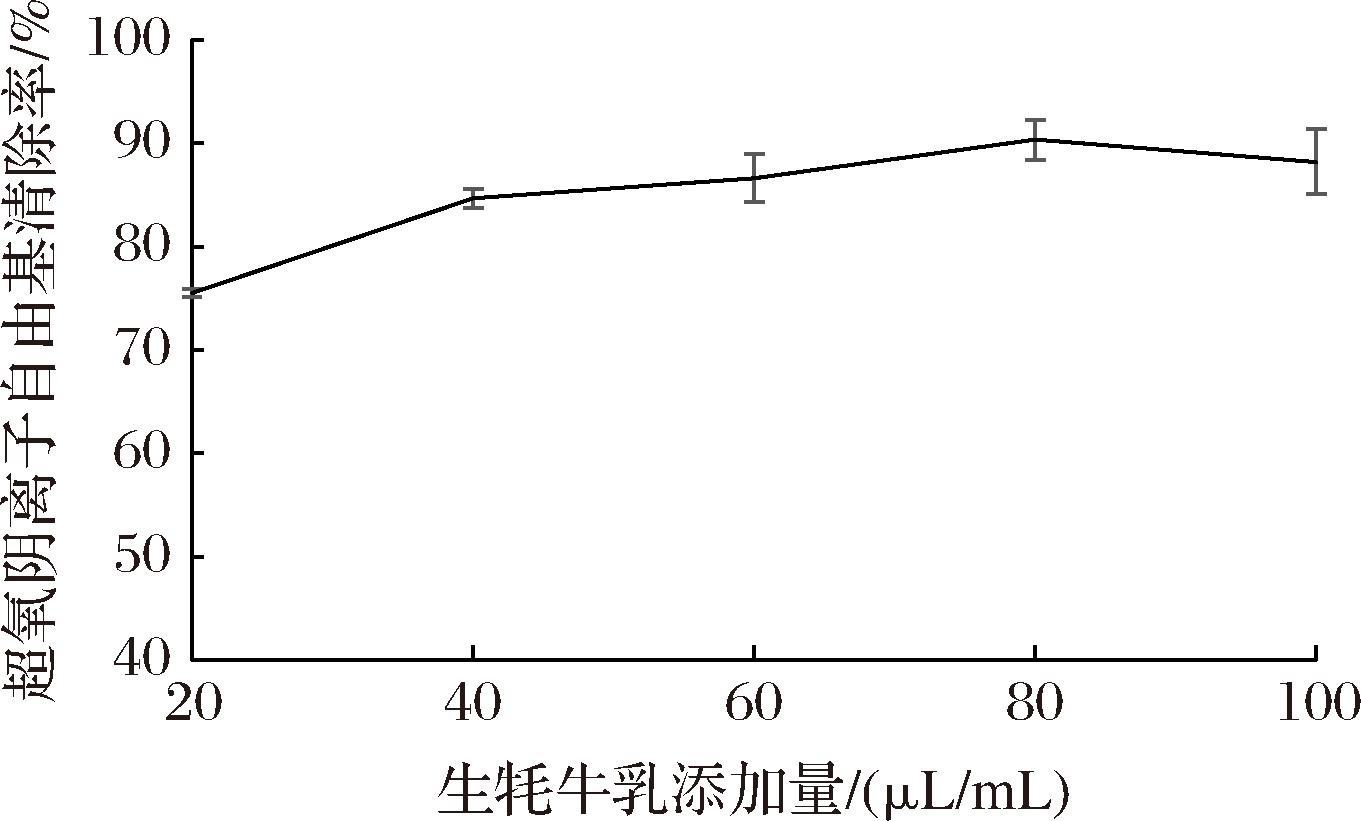
图2 牦牛乳超氧阴离子自由基清除能力
Fig.2 Superoxide anion scavenging capacity of yak milk
2.1.3 DPPH自由基清除能力
由图3可知,牦牛乳添加量为20~100 μL/mL时,DPPH自由基清除率为80.6%~92.65%;随牦牛乳质量浓度的增大,对DPPH自由基清除能力先增强,后呈现下降趋势,当牦牛乳添加量为60 μL/mL时,对DPPH自由基清除率最大(92.65%),说明牦牛乳具有很好的清除DPPH自由基的能力。
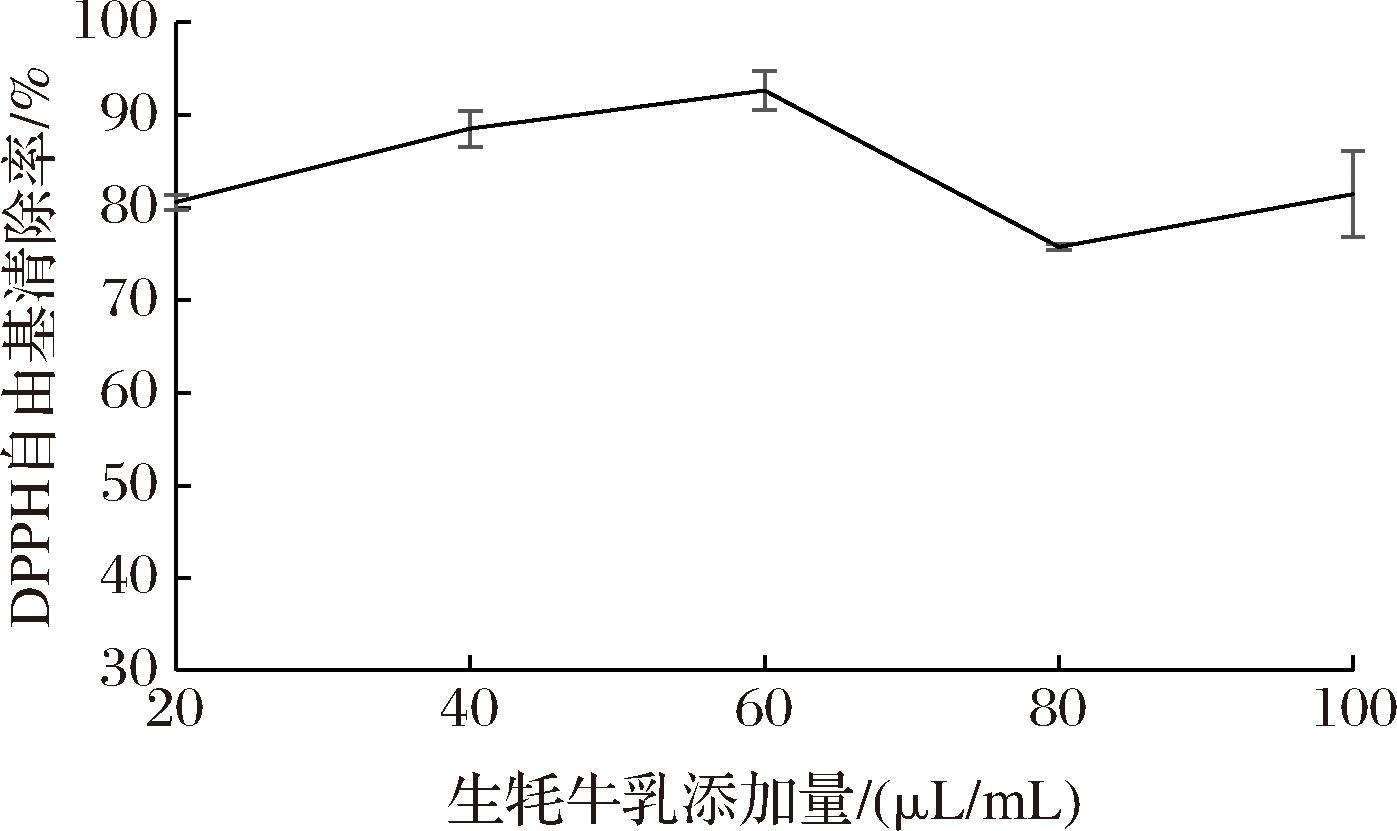
图3 牦牛乳DPPH自由基清除能力
Fig.3 DPPH free radical scavenging ability of yak milk
2.2 甘南牦牛乳体内氧化效果评价
2.2.1 给药剂量考察
由于牦牛乳在斑马鱼上的耐受浓度未知,因此需要开展预实验,每个浓度梯度选用30尾斑马鱼,设置浓度梯度来确定牦牛乳在斑马鱼上的MTC,为抗氧化功效评价提供参考和依据。实验具体检测结果见表1。
表1 斑马鱼最大检测浓度摸索实验结果(n=30)
Table 1 Experimental results of maximum detection concentration of zebrafish(n=30)
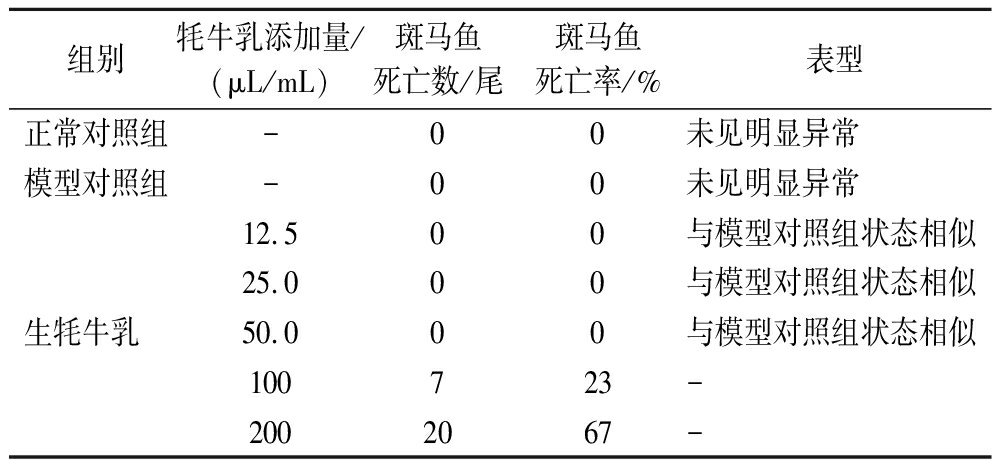
组别牦牛乳添加量/(μL/mL)斑马鱼死亡数/尾斑马鱼死亡率/%表型正常对照组-00未见明显异常模型对照组-00未见明显异常12.500与模型对照组状态相似25.000与模型对照组状态相似生牦牛乳 50.000与模型对照组状态相似100723-2002067-
由表1可以看出,在本实验条件下,斑马鱼给予牦牛乳喂养的添加量在50.0 μL/mL以下时,实验组斑马鱼与模型对照组和正常对照组斑马鱼状态相似,未出现死亡现象,且未观察到任何异常的心脏毒性、肝脏毒性、肾脏毒性、肠道毒性、行为异常等毒性表型。在牦牛乳添加量为100 μL/mL时,斑马鱼的死亡率为23%,当牦牛乳添加量达到200 μL/mL时,斑马鱼死亡率达到67%。即随着牦牛乳添加量增加,斑马鱼的死亡数量逐渐增大,说明牦牛乳对斑马鱼的毒性与浓度有关,呈正相关性。牦牛乳对斑马鱼的最大耐受浓度为50.0 μL/mL。
2.2.2 甘南牦牛乳体内抗氧化效果评价
甲萘醌是一种氧化剂,能产生活性氧(reactive oxygen species, ROS)自由基,当自由基产生量大于机体清除自由基能力时,则会发生氧化应激反应。过量的ROS会造成氧化损伤,氧化损伤与衰老、癌症、心脑血管疾病、阿尔茨海默氏症、帕金森等神经性退行疾病的发生息息相关[20]。Cell ROXTM绿色试剂是一种DNA染料,具有细胞通透性,原本无荧光或者在还原状态荧光非常弱,氧化后与DNA结合,发出荧光信号,它的信号主要定位在细胞核和线粒体中,氧化应激试剂产生的荧光可通过传统荧光显微镜、高含量成像和分析、微板荧光测定法或流式细胞仪检测[21]。经过特异性荧光染色,发生氧化应激反应的斑马鱼荧光染色会加深,可通过斑马鱼卵黄囊荧光强度反映斑马鱼体内活性氧的含量,进而评价牦牛乳的抗氧化效[16,22]。体内抗氧化效果评价实验各处理组均选用30尾斑马鱼,实验组斑马鱼选用给药剂量预实验所确定的MTC给予牦牛乳。各处理组斑马鱼卵黄囊荧光强度检测结果如图4所示。
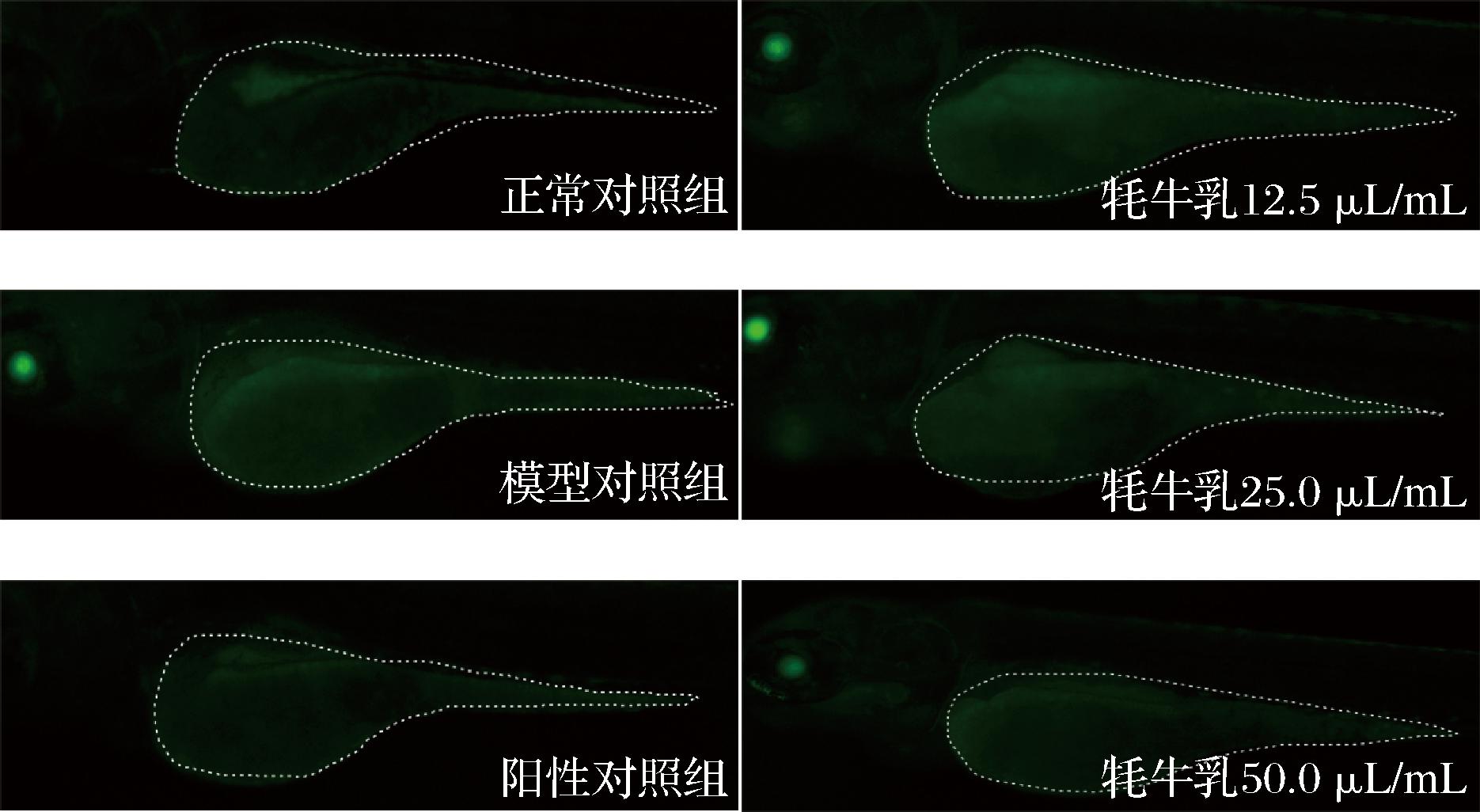
图4 牦牛乳处理后斑马鱼卵黄囊荧光强度典型图
Fig.4 Typical fluorescence intensity of yolk sac of zebrafish treated
注:黄色虚线框内为分析区域。
由图4、表2可以看出,和正常对照组比较,模型对照组斑马鱼卵黄囊荧光强度显著增大,说明氧化损伤模型是有效的,斑马鱼体内存在大量的ROS自由基。各实验组斑马鱼卵黄囊荧光强度虽高于阳性对照组(给予62.5 μg/mL质量浓度的N-乙酰-L-半胱氨酸),但均低于模型对照组,说明在本实验条件下,牦牛乳可抑制斑马鱼体内活性氧的产生,牦牛乳具有抗氧化活性,此结果与ZHANG等[23]研究结果一致。随着牦牛乳质量浓度增大,各实验组斑马鱼卵黄囊荧光强度逐渐降低,说明牦牛乳抗氧化效果逐渐增强,当牦牛乳添加量为50.0 μL/mL时,对斑马鱼的抗氧化效果达到43.25%,说明牦牛乳的抗氧化活性与其浓度呈正比,且高剂量组(牦牛乳添加量50.0 μL/mL)与模型对照组之间具有显著差异(P<0.001)。
表2 牦牛乳抗氧化功效评价实验结果(n=10)
Table 2 Experimental results of antioxidant efficacy evaluation of raw yak milk (n=10)
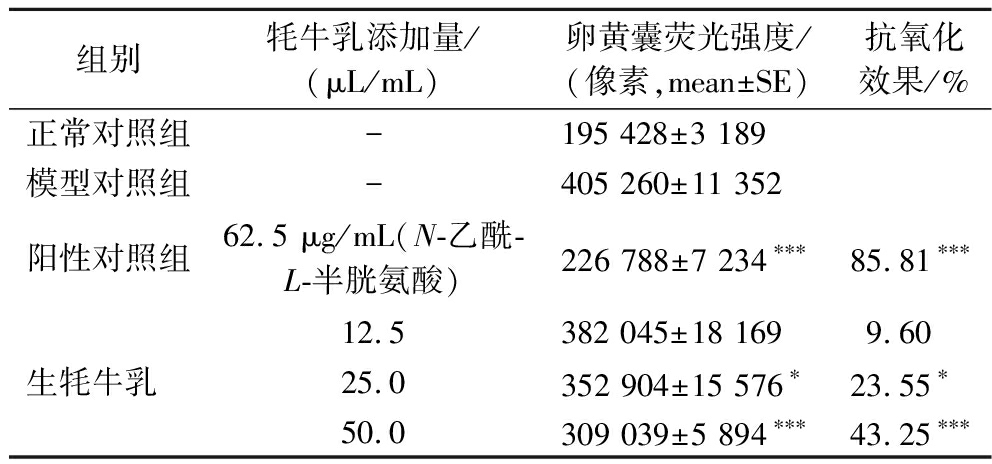
组别牦牛乳添加量/(μL/mL)卵黄囊荧光强度/(像素,mean±SE)抗氧化效果/%正常对照组-195 428±3 189 模型对照组-405 260±11 352 阳性对照组62.5 μg/mL(N-乙酰-L-半胱氨酸)226 788±7 234∗∗∗85.81∗∗∗12.5382 045±18 169 9.60生牦牛乳 25.0352 904±15 576∗ 23.55∗50.0309 039±5 894∗∗∗43.25∗∗∗
注:与模型对照组比较,*表示P<0.05,***表示P<0.001(下同)。
2.2.3 甘南牦牛乳对斑马鱼体内抗氧化酶活力的影响
SOD可清除ROS,将超氧自由基转换为氧气和过氧化物,进而对机体起到保护作用[24]。由表3、图5可以看出,模型对照组斑马鱼体内SOD活力明显低于正常对照组,且存在显著差异(P<0.001),说明氧化损伤模型对斑马鱼体内SOD活力具有很大的破坏。与模型对照组相比,不同质量浓度的牦牛乳均极显著提高了斑马鱼SOD活力(P<0.001),且与阳性对照组存在显著差异(P<0.01),说明牦牛乳可显著增强斑马鱼体内SOD活力,进一步说明牦牛乳具有抗氧化功效。
表3 牦牛乳SOD活力测定实验结果(n=3)
Table 3 Experimental results of determination of SOD activity in raw yak milk (n=3)
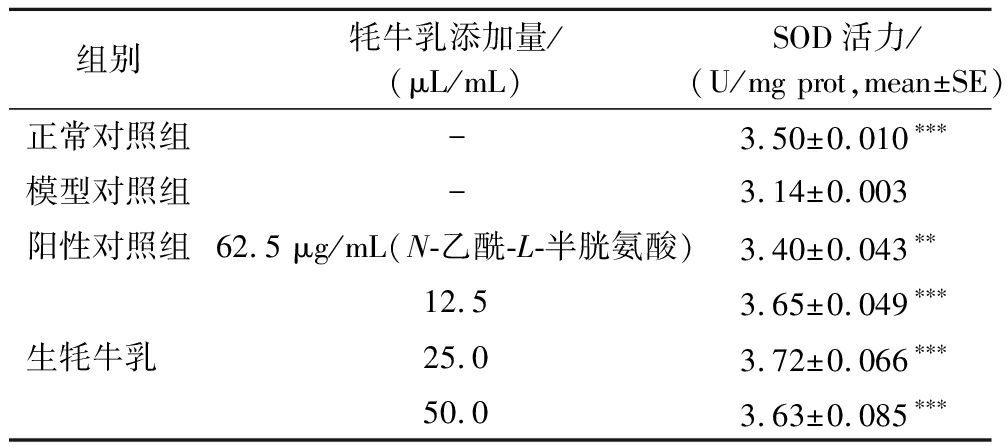
组别牦牛乳添加量/(μL/mL)SOD活力/(U/mg prot,mean±SE)正常对照组-3.50±0.010∗∗∗模型对照组-3.14±0.003阳性对照组62.5 μg/mL(N-乙酰-L-半胱氨酸)3.40±0.043∗∗12.53.65±0.049∗∗∗生牦牛乳 25.03.72±0.066∗∗∗50.03.63±0.085∗∗∗
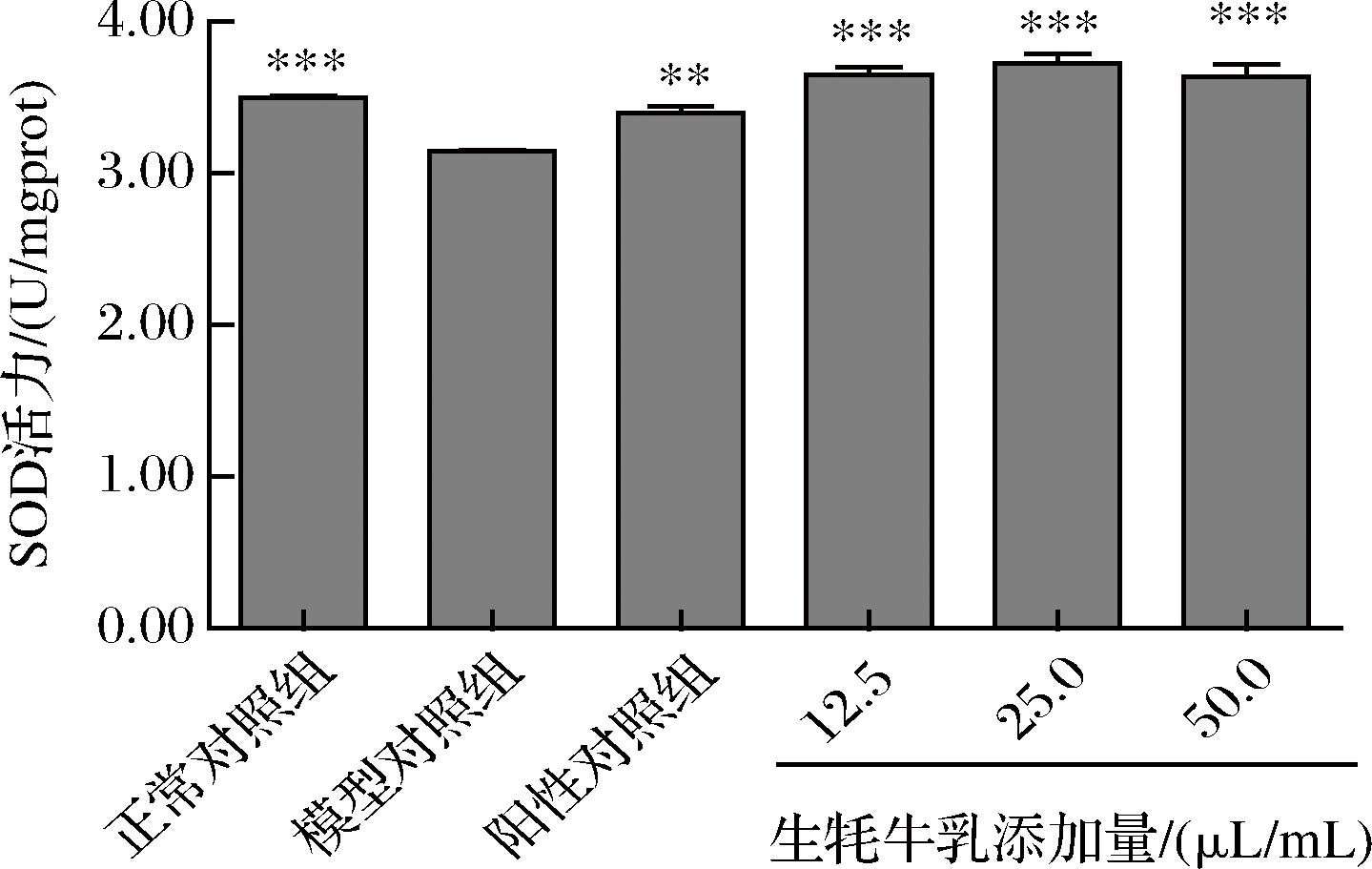
图5 牦牛乳处理后斑马鱼SOD活力
Fig.5 SOD activity of zebrafish treated with raw yak milk
3 结论
经体外抗氧化实验,牦牛乳具有清除羟自由基、DPPH自由基以及超氧阴离子自由基的能力,且与其质量浓度呈正相关。斑马鱼对牦牛乳的最大耐受添加量为50 μL/mL,在此质量浓度下,可显著降低斑马鱼体内活性氧的产生,对斑马鱼的抗氧化效果达到43.25%,提高斑马鱼体内抗氧化酶活力,从而提高斑马鱼的抗氧化能力,且在安全浓度范围内,牦牛乳体内抗氧化效果与其质量浓度呈正相关,进一步证实牦牛乳具有抗氧化效果。本实验结果表明,甘南牦牛乳具有较强的抗氧化效果,牦牛乳可作为抗氧化功能性食品开发的原料,以此提高牦牛乳的附加值。
[1] LIN K, ZHANG L W, HAN X, et al.Yak milk casein as potential precursor of angiotensin I-converting enzyme inhibitory peptides based on in silico proteolysis[J].Food Chemistry, 2018, 254:340-347.
[2] 宋礼, 罗丽, 李顺成, 等.甘南牦牛乳功能性营养成分含量研究[J].食品工业, 2022, 43(10):323-325.SONG L, LUO L, LI S C, et al.Study on the contents of functional nutrients in Gannan yak milk[J].The Food Industry, 2022, 43(10):323-325.
[3] DRAGANIDIS D, KARAGOUNIS L G, ATHANAILIDIS I, et al.Inflammaging and skeletal muscle:Can protein intake make a difference[J].The Journal of Nutrition, 2016, 146(10):1940-1952.
[4] 崔光欣. 青藏高原高寒植物及牦牛奶抗氧化特性研究[D].兰州:兰州大学, 2016.CUI G X.Antioxidant property of alpine plants and yak milk on Qinghai-Tibetan Plateau[D].Lanzhou:Lanzhou University, 2016.
[5] ZHAO L L, DU M, GAO J, et al.Label-free quantitative proteomic analysis of milk fat globule membrane proteins of yak and cow and identification of proteins associated with glucose and lipid metabolism[J].Food Chemistry, 2019, 275:59-68.
[6] 郭咏梅. 硒通过TrxRl、MAPK信号通路缓解奶牛乳腺上皮细胞氧化应激的机理研究[D].呼和浩特:内蒙古农业大学, 2020.GUO Y M.Mechanism of Selenium alleviating oxidative stress in bovine mammary epithelial cells through modulation of TrxRl/ MAPK signaling pathways[D].Hohhot:Inner Mongolia Agricultural University, 2020.
[7] 高宇, 汪家琦, 戴智勇, 等.牦牛乳营养组分及功能特性研究进展[J].乳业科学与技术, 2021, 44(3):43-49.GAO Y, WANG J Q, DAI Z Y, et al.Review of research on nutritional components and functional characteristics of yak milk[J].Journal of Dairy Science and Technology, 2021, 44(3):43-49.
[8] ZHANG J Z, LI D F.Effect of conjugated linoleic acid on inhibition of prolyl hydroxylase 1 in hearts of mice[J].Lipids in Health and Disease, 2012, 11:22.
[9] 代安娜, 杨具田, 丁波, 等.牦牛乳组分及功能特性研究进展[J].动物营养学报, 2022, 34(6):3443-3453.DAI A N, YANG J T, DING B, et al.Research progress on components and functional characteristics of yak milk[J].Chinese Journal of Animal Nutrition, 2022, 34(6):3443-3453.
[10] WANG D D, ZHOU Y X, ZHENG X P, et al.Yak milk:Nutritional value, functional activity, and current applications[J].Foods, 2023, 12(11):2090.
[11] MOON J, LEE S, JEONG S, et al.Free radical-scavenging activities and cytoprotective effect of polyphenol-rich ethyl acetate fraction of guava (Psidium cattleianum) leaves on H2O2-treated HepG2 cell[J].Journal of the Korean Society for Applied Biological Chemistry, 2013, 56:687-694.
[12] YANG Y, ZHENG K D, MEI W J, et al.Anti-inflammatory and proresolution activities of bergapten isolated from the roots of Ficus hirta in an in vivo zebrafish model[J].Biochemical &Biophysical Research Communications, 2018, 496(2):763-769.
[13] KIM E A, LEE S H, KO C I, et al.Protective effect of fucoidan against AAPH-induced oxidative stress in zebrafish model[J].Carbohydrate Polymers, 2014, 102:185-191.
[14] 李爽, 刘小芳, 冷凯良, 等.大西洋鳕鱼骨胶原蛋白肽的抗氧化活性及稳定性研究[J].食品与发酵工业, 2024,50(16):50-56. LI S, LIU X F, LENG K L, et al.Antioxidant activity and stability of collagen peptides from Atlantic cod (Gadus morhua) bone[J].Food and Fermentation Industries, 2024,50(16):50-56.
[15] 卢野. 混合驴乳发酵配方优化及体外抗氧化研究[D].阿拉尔:塔里木大学, 2021.LU Y.Optimization of fermentation formula and in vitro antioxidation of mixed donkey milk[D].Ala’er:Tarim University, 2021.
[16] 刘海波, 支媛, 汪会玲, 等.基于斑马鱼幼鱼的抗氧化物筛选模型建立及其应用[J].中国食品卫生杂志, 2022, 34(5):871-877. LIU H B, ZHI Y, WANG H L, et al.Establishment and application of antioxidant screening model based on zebrafish larva[J].Chinese Journal of Food Hygiene, 2022, 34(5):871-877.
[17] HE Z, GUO Y J, CHEN J Z, et al.Unsaturated phospholipid modified FeOCl nanosheets for enhancing tumor ferroptosis[J].Journal of Materials Chemistry. B, 2023, 11(9):1891-1903.
[18] 郑鑫鑫, 黄青.天然虾青素清除超氧阴离子的抗氧化能力[J].食品研究与开发, 2023, 44(14):8-12;162.ZHENG X X, HUANG Q.Antioxidant activity of natural astaxanthin for scavenging superoxide anion[J].Food Research and Development, 2023, 44(14):8-12;162.
[19] 王银玲, 薛玉洋, 孙浩彬, 等.桑叶提取物体外抗氧化活性及其对黄羽肉鸡抗氧化能力的影响[J].动物营养学报, 2023, 35(8):5059-5068.WANG Y L, XUE Y Y, SUN H B, et al.In vitro antioxidant activity of mulberry leaf extract and its effects on antioxidant capacity of yellow feather broilers[J].Chinese Journal of Animal Nutrition, 2023, 35(8):5059-5068.
[20] BARNHAM K J, MASTERS C L, BUSH A I.Neurodegenerative diseases and oxidative stress[J].Nature Reviews. Drug Discovery, 2004,3(3):205-214.
[21] 徐懿乔, 陈星辉, 黄燕烽, 等.一种利用斑马鱼模型评价抗氧化和淡斑亮肤功效的方法:中国, CN112107697A[P].2020-12-22.XU Y Q, CHEN X H, HUANG Y F, et al.A method for evaluating antioxidant and lightening-spot brightening-skin efficacy using zebrafish model:China, CN112107697A[P].2020-12-22.
[22] BLADEN C L, KOZLOWSKI D J, DYNAN W S.Effects of low-dose ionizing radiation and menadione, an inducer of oxidative stress, alone and in combination in a vertebrate embryo model[J].Radiation Research, 2012, 178(5):499-503.
[23] ZHANG W, CAO J L, WU S Z, et al.Anti-fatigue effect of yak milk powder in mouse model[J].Dairy Science &Technology, 2015, 95(2):245-255.
[24] 朱文卿, 朱姗姗, 何秋霞, 等.牛蒡多糖与绿原酸对斑马鱼氧化损伤的协同抗氧化作用[J].中国食品学报, 2022, 22(4):95-103.ZHU W Q, ZHU S S, HE Q X, et al.Synergistic antioxidant effect of burdock polysaccharide and chlorogenic acid on oxidative damage in zebrafish[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(4):95-103.