米香型白酒主要以大米为原料,小曲为糖化发酵剂,采用固态、半固态或液态的发酵方式,经过蒸馏、陈酿和勾兑等工艺而制成[1],其中糖化和发酵过程主要步骤如下,将大米等原料除杂后浸泡,而后摊凉冷却,加入小曲拌匀入缸,依据温度、水分和糖度等指标控制糖化时间,并加入酿造用水进行半固态发酵,其发酵周期一般为8~14 d[2]。因其酿造方式的独特性,米香型白酒与酱香型、清香型、浓香型等白酒在风味上表现出明显的差异[3]。米香型白酒素以“清、甜、爽、净”四字见长[4],“蜜香清雅、入口绵柔、落口爽净、口味怡畅”是其最主要的感官特征,乳酸乙酯、乙酸乙酯、β-苯乙醇是其主体香气成分[5]。
微生物对白酒风味物质和品质起着决定性作用,白酒发酵过程中的微生物主要包括霉菌、酵母和细菌等[6]。霉菌可以通过分泌水解酶、蛋白酶、脂肪酶等胞外酶,将原料中的淀粉等大分子物质降解为葡萄糖等小分子物质,以支撑其他微生物的生长,同时也会产生一些风味物质或其前体[7]。酵母是重要的产乙醇及风味物质的微生物[8]。乳酸菌是米香型白酒发酵过程的绝对优势细菌,能够产生有机酸,可促进酯类物质的形成[9]。米香型白酒采用固态糖化,半固态发酵方式,较短的发酵周期使得米香型白酒微生物群落与其他类型白酒发酵表现出一定的差异,该过程的微生物群落结构尚不明确,解析该过程微生物群落多样性和演替规律并探究糖化对发酵的贡献有利于揭示米香型白酒酿造机理并为生产提供一定的参考依据。
随着组学技术的发展,高通量测序技术可以有效揭示酿造过程中微生物的群落结构及变化规律,但其具有一定的局限性,因为16S rRNA无法提供关于群落基因组功能基因的直接信息[10]。近年来随着生物信息学工具的开发,PICRUSt能有效预测细菌群落的功能潜力[11],随着算法的迭代更新,PICRUSt2已逐渐取代PICRUSt1并成为最流行的功能谱预测工具之一,对群落预测有更高的准确性和灵活性[12]。PICRUSt2结合16S rRNA测序数据可有效预测微生物群落的潜在功能,为功能微生物的判定提供一定的支撑[13],预测糖化与发酵过程微生物群落在功能上的差异和共性有助于了解糖化对发酵的贡献。本文拟通过解析米香型白酒糖化、发酵过程中的微生物群落演替规律和代谢功能特征,探究糖化对发酵的影响,为后续促进米香型白酒酿造过程微生物群落的可控性和提升米香型白酒品质提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
本实验所用的样品均来自广西省某米香型白酒厂,糖化和发酵过程具体取样位置如图1所示。总糖化时间为49 h,取样位置为糖化醪的中间层固定的2个点,每隔6 h进行取样,糖化终点取样时间为49 h,即糖化取样时间点分别为0、6、12、18、24、36、42、49 h。糖化结束后,加入1.5倍水的体积进行发酵,总发酵时间为12 d。由于固形物在整个发酵阶段均为上浮状态,因此为了保证取样的均一性,对固态发酵物和液态发酵液分别取样后混匀。其中固态发酵物取样方式为:在每个陶坛内取中间层的3个固定点的固形物100 g。液态发酵液取样方式为:收集液态部分的中间层的样品100 g,并与固态发酵物混匀,保证固态发酵物与液态发酵液呈1∶1的质量比,发酵取样时间点分别为0、1、3、5、8、12 d。
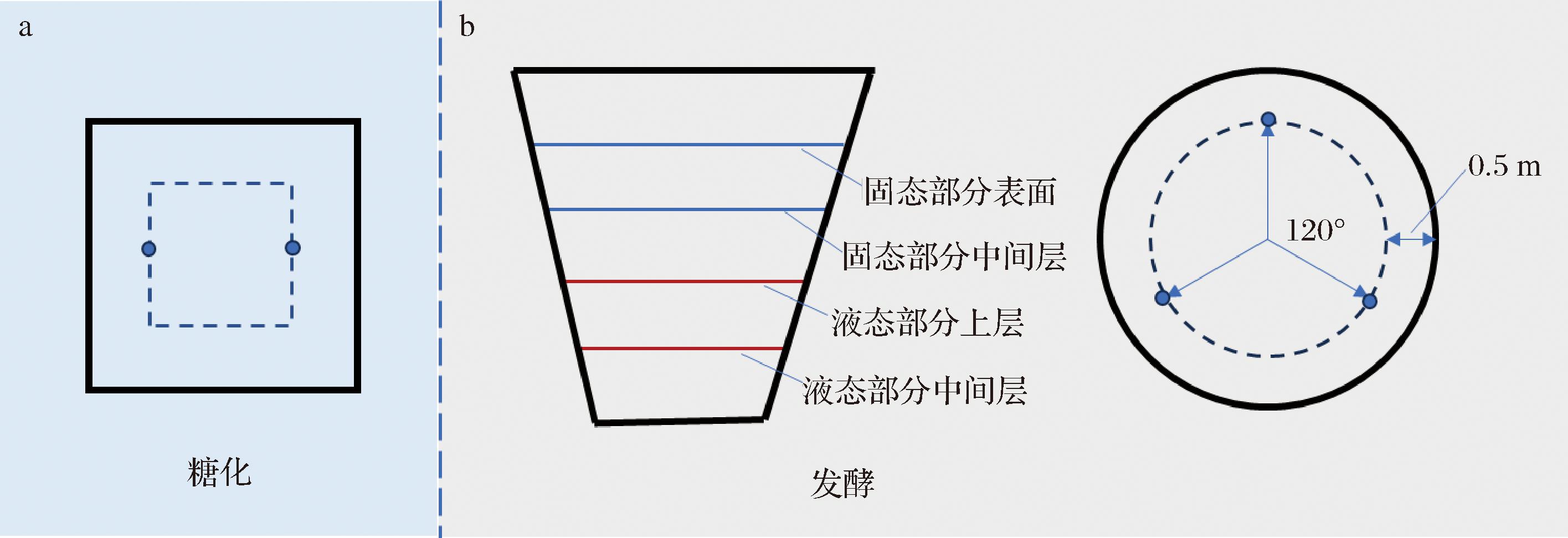
a-糖化取样点;b-发酵取样点
图1 糖化、发酵过程取样示意图
Fig.1 Sampling locations of Saccharification and fermentation
1.1.2 试剂
葡萄糖、乙醇(色谱纯)、氯化钠、氯化钙、10%(质量分数)十二烷基磺酸钠、三氯甲烷、异戊醇等,试剂均为分析纯。
1.2 仪器与设备
Agilent 1260液相色谱仪,Agilent公司;NANODROP 8000核酸浓度检测仪,赛默飞世尔科技有限公司;Milli-Q超纯水系统,Millipore公司;Mini-Bead-Beater-8细胞破碎仪,上海玉博生物科技有限公司;Avanti J-E冷冻离心机,Beckman Coulter公司。
1.3 实验方法
1.3.1 微生物宏基因组提取
提取糖化、发酵过程酒醅的宏基因组,主要流程为称取酒醅样品并收集细胞沉淀,破碎细胞后采用饱和酚-氯仿法[14]提取细胞DNA。
1.3.2 高通量测序
细菌、真菌引物及扩增程序参见文献[15]。使用Illumina MiSeq测序平台用于2×300 bp配对末端测序,通过DADA2进行原始数据的处理,将相似度为99%的序列聚类为ASV[16]。
1.3.3 乙醇、葡萄糖测定
制备酒醅浸提液,0.22 μm滤头过滤后用于HPLC检测[17]。
1.3.4 多元统计分析
相关性分析:计算发酵过程中平均相对丰度>3%的细菌与代谢途径的Person相关系数,P<0.05具有显著性意义,并通过Adobe Illustrator 2023可视化。
微生物群落潜在功能预测分析:采用PICRUSt2预测糖化、发酵过程中细菌群落功能,通过Microsoft Office Excel 2021进行数据处理和统计学分析,利用OriginPro 2023、Adobe Illustrator 2023绘图。
主成分分析:通过OriginPro 2023软件对酿造过程不同时间点的微生物属进行主成分分析并绘图。
微生物群落演替距离:基于Bray-Curtis距离计算相邻取样时间点的微生物差异性,获得的差异值除以对应的间隔时间点,以获得演替距离[18]。
2 结果与分析
2.1 米香型白酒酿造过程葡萄糖、乙醇变化规律
葡萄糖、乙醇是糖化、发酵过程的重要指标,通过HPLC测定葡萄糖、乙醇随时间延长的变化规律,可有效判定糖化、发酵进行的程度。如图2所示,糖化起始葡萄糖含量增加,30 h后由于消耗葡萄糖的微生物大量繁殖,其含量略微降低。糖化为发酵起始提供葡萄糖,发酵过程葡萄糖含量持续下降并在第5天耗尽,发酵0~3 d,含水量丰富的半固态发酵环境,微生物可以充分的进行营养物质的交换,葡萄糖快速消耗,使得该过程代谢剧烈。乙醇在发酵前期快速生成,发酵第5天时达到最大,总体呈现先增加后略微降低的趋势。
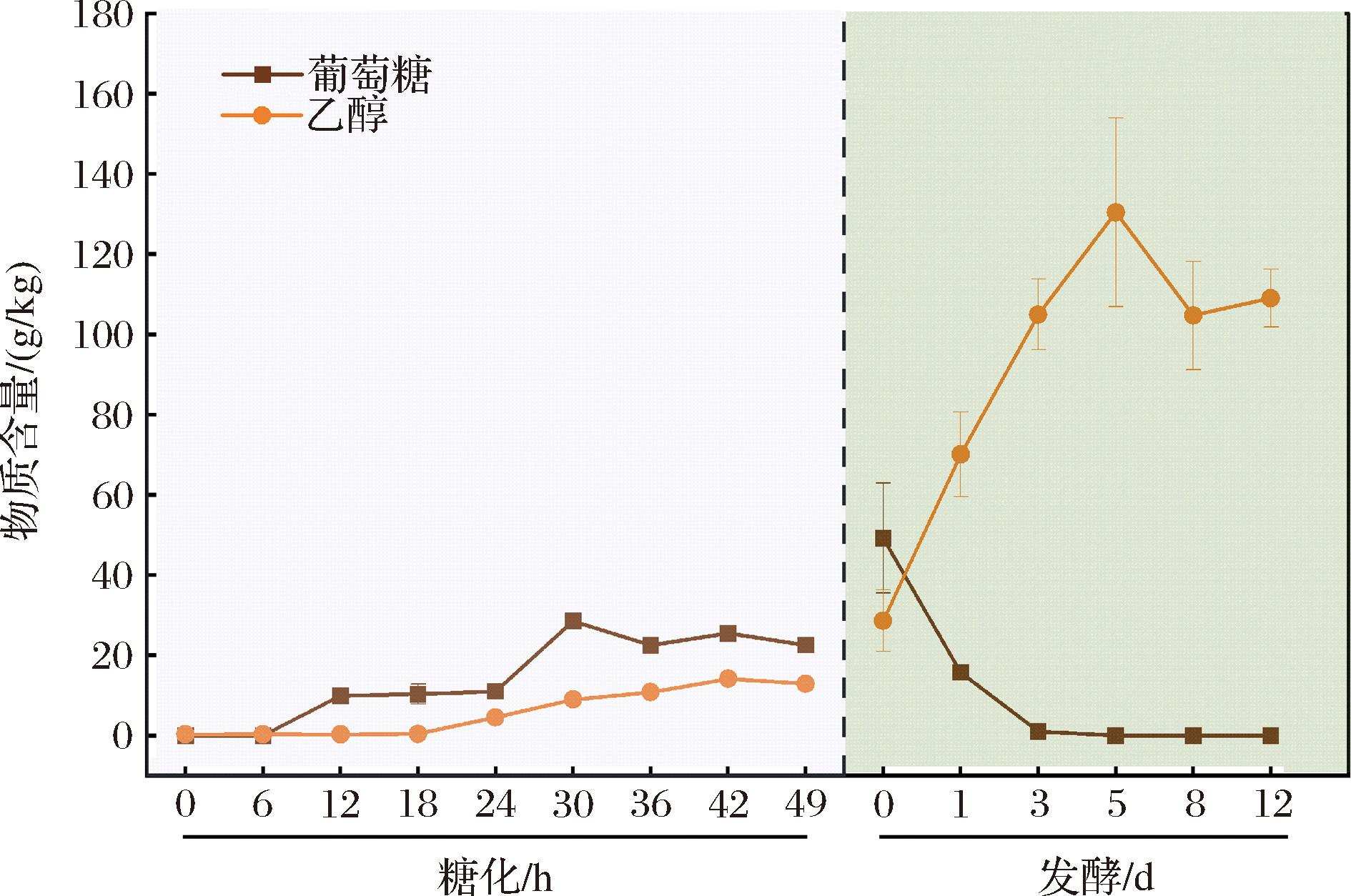
图2 糖化、发酵过程葡萄糖、乙醇变化规律
Fig.2 The changes of glucose and ethanol during saccharification and fermentation
2.2 米香型白酒酿造过程微生物群落结构
通过高通量测序揭示糖化、发酵过程中微生物群落结构,样本中ASV最大相对丰度>1%的细菌属有12个(图3-a),乳酸菌属(Lactobacillus)、片球菌属(Pediococcus)、魏斯氏属(Weissella)是绝对优势微生物属(平均相对丰度>10%)[19],其平均相对丰度分别为27.07%、21.00%、12.47%。Lactobacillus在糖化过程中逐渐增加,并在发酵第1天丰度最高,随后略微降低。由于Lactobacillus对乙醇含量高的环境表现出较强的耐受性[20],且发酵酸性和厌氧环境有助于Lactobacillus的繁殖并抑制其他微生物生长[21],这可能是Lactobacillus在整个发酵过程占据绝对优势的原因之一。

a-细菌相对丰度;b-真菌相对丰度;c-细菌PCA分析;d-真菌PCA分析
图3 糖化、发酵过程微生物群落结构和主成分分析
Fig.3 The relative abundance of microbial genus and principal component analysis during saccharification and fermentation
注:最大相对丰度<1%的属被归类为“others”,其中T0、T18、T49分别表示糖化0、18、49 h;F0、F1、F3、F5、F8、F12分别表示发酵0、1、3、5、8、12 d(下同)。
ASV最大相对丰度>1%的真菌属有5个(图3-b),其中绝对优势微生物有酵母属(Saccharomyces)、复膜孢酵母属(Saccharomycopsis)、根霉属(Rhizopus),平均相对丰度分别为52.70%、29.28%、13.04%。低水活度的环境有利于Rhizopus在糖化阶段被富集并提供关键糖化酶(α-淀粉酶和葡萄糖淀粉酶等),为发酵阶段乙醇含量的增加提供一定保障[7]。由于米香型白酒发酵周期较短,小曲糖化过程中富集到的真菌属较少,微生物结构相对简单,Saccharomyces在发酵前期丰度增加并与Saccharomycopsis竞争营养物质,随着发酵的进行,营养物质的消耗以及醇类、酸类物质的增加[22],Saccharomycopsis、Rhizopus生长受到胁迫,Saccharomyces占据绝对优势。通过主成分分析微生物群落发现,细菌群落中PC1解释了34.7%,PC2解释了35.9%,共解释了70.6%(图3-c),真菌群落中PC1解释了28.1%,PC2解释了65.1%,共解释了93.2%(图3-d),结果表明,不同时间点的真菌群落在糖化过程差异大,而细菌群落在发酵过程差异更大,变化更剧烈。
2.3 米香型白酒酿造过程群落演替规律
为进一步探究糖化、发酵过程微生物群落多样性变化规律,分别计算细菌和真菌的α多样性指数,结果如图4所示。在糖化和发酵过程中细菌多样性指数显著高于真菌(P<0.05)。糖化过程中,细菌和真菌的多样性指数均在第18天时达到最高(其Shannon指数分别为2.93±0.08、1.42±0.05)。发酵过程中,细菌的Shannon指数基本呈现稳步上升的趋势(图4-a),到了发酵末期,由于营养物质的消耗以及其他酸类、醇类化合物的胁迫作用,多样性下降,其Shannon指数在发酵第3天达到最大值(Shannon指数为3.281 15±0.080 7)。真菌的Shannon指数在糖化末期(第49天)与发酵初期(第0天)接近(图4-b),该结果表明糖化末期可能为发酵过程提供起始真菌。为进一步表征米香型白酒微生物动力学,依据相邻采样时间之间的Bray-Curtis距离来定量微生物演替距离,细菌(图4-c)和真菌(图4-d)分别在发酵前期(0~1 d)和糖化前期(0~18 h)演替距离大,均在1~3 d快速下降,表明发酵前期是微生物剧烈变化的关键阶段,该方法可为通过控制糖化终止时间来控制发酵起始微生物提供一定的数据支撑。

a-细菌多样性;b-真菌多样性;c-细菌的演替距离;d-真菌的演替距离
图4 糖化、发酵过程微生物群落Shannon指数和微生物演替距离分析
Fig.4 The analysis of Shannon index and microbial succession distance of microbial communities during saccharification and fermentation
注:通过Bray-Curtis距离与对应时间间隔的比值表示演替距离。
2.4 糖化、发酵过程细菌群落功能预测
本研究利用PICRUSt2对糖化发酵过程中细菌属的功能进行预测。对糖化、发酵过程中平均相对丰度>1%的KEGG代谢途径进行富集并分类,如图5-a所示。糖化、发酵过程细菌属主要参与代谢(metabolism)、环境信息处理(environmental information processing)、细胞信息处理(cell information processing)、细胞过程(cellular processing)四大一级代谢途径。该过程主要富集到17条二级代谢途径,这些功能为微生物群落的稳定性提供一定的保障。碳水化合物代谢(carbohydrate metabolism)和膜转运(membrane transport)等代谢途径表明酿造过程中微生物群落代谢活跃,并具有利用和交换周围环境资源的能力。核苷酸代谢(nucleotide metabolism)、氨基酸代谢(amino acid metabolism)、复制和修复(replication and repair)以及翻译(translation)等功能可促进微生物群落中细胞的转录、生长和死亡,以及微生物的繁殖和互作等[23]。为了进一步了解酿造过程细菌属相关的潜在功能贡献,探究了细菌属与二级代谢途径的相关性(图5-b),Lactobacillus、Pediococcus、Weissella主要参与膜转运、脂质代谢、萜类和多酮类化合物等代谢。其中Lactobacillus群落提供与膜转运、碳水化合物代谢、氨基酸代谢、核苷酸代谢等途径相关的潜在功能,并与11种代谢活动呈现一定的相关性,Lactobacillus广泛参与各类代谢活动为其在发酵后期占据绝对优势地位提供功能支撑和竞争优势。此外乳酸菌的碳水化合物代谢产物,如丙酮酸、琥珀酸和半乳糖等,可以促进酵母的生长[24],反过来酵母合成的氨基酸[25]可以支持乳酸菌的生长[26],酵母和乳酸菌的协同作用一定程度上促进它们成为米香型白酒酿造过程中发酵优势微生物。

a-PICRUSt2预测随时间变化的微生物潜在功能;b-细菌属与代谢的相关性分析
图5 PICRUSt2预测糖化、发酵过程中微生物功能和细菌属与代谢途径的相关性分析
Fig.5 Predicting the Functions of Microorganisms through PICRUSt2 and correlation analysis between Bacteria and metabolic pathways during saccharification and fermentation
注:metabolism of terpemids and polyketides:萜类和聚酮类代谢;metabolism of other amino acids:其他氨基酸代谢;glycan biosynthesis and metabolism:聚糖生物合成和代谢;metabolism of cofactors and vitamins:辅因子和维生素代谢;lipid metabolism:脂类代谢;energy metabolism:能量代谢;nucleotide metabolism:核苷酸代谢;amino acid metabolism:氨基酸代谢;carbohydrate metabolism:碳水化合物代谢;signal transduction:信号转导;membrane transport:膜转运;translation:翻译;replication and repair:复制和修复;transcription:转录;folding, sorting and degradation:折叠,分类和降解;cell motility:细胞运动;xenobiotics biodegradation and metabolism:外源性生物降解和代谢;others:其他;a:通过KEGG富集到一级(右侧)、二级(左侧)代谢通路;others中包括糖化、发酵过程中平均相对丰度<1%的或功能信息尚不明确的代谢途径;b:基于Spearman相关性进行分析,深蓝色代表负相关性,深红色代表正相关;颜色越深,椭圆越小,相关性越强,“*”,P<0.05,“**”,P<0.01,“***”,P<0.001。
2.5 糖化为发酵提供细菌群落碳水化合物代谢基础
葡萄糖在微生物的作用下发酵形成乙醇、乳酸等产物,这些物质是判断米香型白酒酿造过程顺利进行的重要指标之一,因此探究米香型白酒糖化、发酵过程碳水化合物代谢能在一定程度上解析糖化与发酵的联系。通过PICRUSt2预测功能并重点关注碳水化合物代谢中与葡萄糖消耗、乙醇、乳酸形成相关的糖酵解/糖异生代谢途径,结果如图5所示。细菌群落中参与糖酵解/糖异生途径的功能酶共有38种(图6-a),糖化、发酵过程平均相对丰度>1%的有19种(图6-b)。相对丰度最高的功能酶为2,3-二磷酸甘油酸依赖性/非依赖性磷酸甘油酸变位酶([EC:5.4.2.11]/[EC:5.4.2.12]),可将3-磷酸甘油醛转变为2-磷酸甘油醛,是糖酵解途径中关键步骤[27]。丙酮酸通过丙酮酸脱氢酶E1/E2([EC:1.2.4.1]/[EC:2.3.1.12])形成乙酰辅酶A,L-乳酸脱氢酶([EC:1.1.1.27])将丙酮酸转化为乳酸,乙醛经过醇脱氢酶([EC:1.1.1.1])合成乙醇。这些功能酶在糖化末期与发酵初期相对丰度类似,且均在糖化过程富集并随着发酵的进行相对丰度增加,以上研究表明糖化为发酵提供与碳水化合物代谢相关的功能酶。碳水化合物代谢在微生物群落塑造方面起着重要作用,特别是碳水化合物活性酶(CAZymes)在一定程度上为确定微生物群落的代谢能力提供理论支撑[28],该类酶参与复杂碳水化合物和糖复合物的组装和分解,这些能力可为某些细菌提供竞争优势[29]。
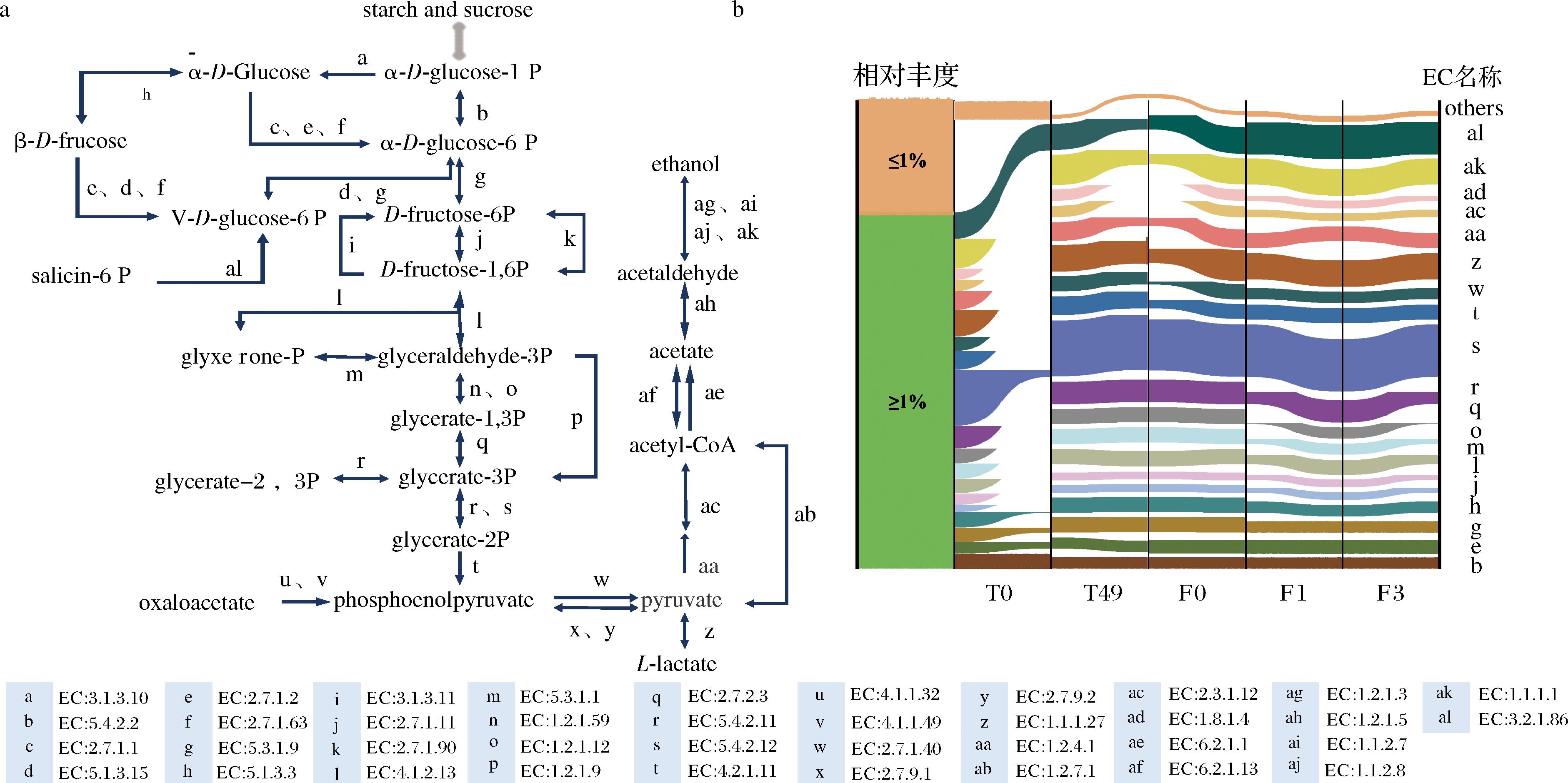
a-糖酵解/糖异生途径;b-糖酵解/糖异生途径相关功能酶的相对丰度变化桑基图
图6 PICRUSt2预测糖化、发酵过程糖酵解/糖异生代谢途径中的功能酶和相对丰度变化
Fig.6 Predicts functional enzymes by PICRUSt2 and the relative abundance of those enzymes in the glycolytic/gluconeogenic metabolic pathways during saccharification and fermentation processes
注:starch and sucrose:淀粉和蔗糖;α-D-glucose-1P:α-D-葡萄糖-1P;α-D-glucose:α-D-葡萄糖;α-D-glucose-6P:α-D-葡萄糖-6P;β-D-fructose:β-D-果糖;β-D-fructose-6P:β-D-果糖-6P;D-fructose-6P:D-果糖-6P;D-fructose-1,6P:D-果糖-1,6P;glyceradehyde-3P:3-磷酸甘油醛;glyxerone-P:磷酸二羟丙酮;glycerate-2,3P:2,3-磷酸甘氨酸;glycerate-1,3P:1,3-磷酸甘油酸;glycerate-3P:3-磷酸甘油酸;glycerate-2P:2-磷酸甘油酸;Phosphoenolpyruvate:磷酸烯醇丙酮酸;oxaloacetate:草酰乙酸;pyruvate:丙酮酸;L-lactate:L-乳酸;acetyl-CoA:乙酰辅酶A;acetate:乙酸;acetaldehyde:乙醛;ethanol:乙醇;a:碳水化合物功能酶代谢与葡萄糖消耗,乙醇、乳酸和合成相关的主要代谢途径,小写字分别对应糖化、发酵过程中该途径相关功能酶的EC号;b:糖化、发酵过程中平均相对丰度<1%的功能酶被归类为“others”。
3 结论
本研究通过高通量测序技术结合多样性分析和演替距离分析揭示了米香型白酒糖化、发酵过程的微生物菌群结构和演替规律,对后续控制发酵顺利进行以及调控米香型白酒风味和品质具有重要的价值。米香型白酒固态糖化、半固态发酵的工艺导致其微生物属结构相对简单,真菌以Saccharomyces为主,细菌以Lactobacillus为主。糖化、发酵过程细菌多样性高于真菌多样性,微生物演替距离表明糖化阶段真菌演替剧烈,发酵阶段细菌演替剧烈。发酵前期水含量丰富的环境促进微生物进行营养物质的交换等,该阶段微生物代谢非常活跃,葡萄糖被大量消耗并快速合成乙醇。糖化末期与发酵初期细菌结构类似,糖化为发酵初期提供合适的细菌微生物群落。通过PICRUSt2预测微生物群落的潜在功能以解析糖化与发酵之间的联系,结果表明大部分功能酶在糖化过程被富集,进入并影响发酵过程。与碳水化合物代谢相关的功能酶大量被富集到糖酵解/糖异生代谢途径中,这些功能酶的增加为发酵过程乳酸、乙醇的合成提供保障。碳水化合物在塑造微生物群落方面起着重要作用,为细菌提供一定的竞争优势,Lactobacillus与碳水化合物代谢呈现显著的正相关性,以上可能是发酵末期Lactobacillus占据绝对优势的原因之一。本研究为解析米香型酿造过程微生物群落结构和演替规律及功能特征提供一定的理论依据,后续可通过控制糖化结束的时间结合研究优势微生物之间的互作等方式进一步调控发酵过程微生物菌群结构及酒醅风味物质的代谢,进而提高米香型白酒的品质。
[1] 余洁瑜, 刘功良, 白卫东, 等.米香型白酒的研究进展[J].中国酿造, 2021, 40(1):29-32.YU J Y, LIU G L, BAI W D, et al.Research progress on rice-flavor Baijiu[J].China Brewing, 2021, 40(1):29-32.
[2] HU Y L, LEI X Y, ZHANG X M, et al.Characteristics of the microbial community in the production of Chinese rice-flavor Baijiu and comparisons with the microflora of other flavors of Baijiu[J].Frontiers in Microbiology, 2021, 12:673670.
[3] YIN X, YOSHIZAKI Y, IKENAGA M, et al.Manufactural impact of the solid-state saccharification process in rice-flavor Baijiu production[J].Journal of Bioscience and Bioengineering, 2020, 129(3):315-321.
[4] 杨锦才. 小曲米香型白酒的香味物质[J].酿酒科技, 1981(4):24-28.YANG J C.Flavor substances of Xiaoqu rice flavor Baijiu[J].Liquor-Making Science &Technology, 1981(4):24-28.
[5] 江坤文. 初探小曲米酒米香的来由[J].广州食品工业科技, 1986(3):12-19.JIANG K W.Exploring the origin of rice fragrance in Xiaoqu rice wine[J].Modern Food Science and Technology, 1986(3):12-19.
[6] WU Q, ZHU Y, FANG C, et al.Can we control microbiota in spontaneous food fermentation? Chinese liquor as a case example[J].Trends in Food Science &Technology, 2021, 110:321-331.
[7] WANG B W, WU Q, XU Y, et al.Synergistic effect of multiple saccharifying enzymes on alcoholic fermentation for Chinese Baijiu production[J].Applied and Environmental Microbiology, 2020, 86(8):e00013-e00020.
[8] 王薇, 吴群, 徐岩.清香型白酒固态酿造过程中酵母种群结构和多样性分析[J].微生物学通报, 2012, 39(9):1272-1279.WANG W, WU Q, XU Y.Identification and analysis of yeast community structure in Chinese light-style liquor brewing process[J].Microbiology China, 2012, 39(9):1272-1279.
[9] 张龙, 梁振荣, 郝俊光, 等.乳酸菌对米香型白酒发酵过程中乳酸和乳酸乙酯产生的影响研究[J].酿酒科技, 2022(11):29-35.ZHANG L, LIANG Z R, HAO J G, et al.Effect of lactic acid bacteria on the production of lactic acid and ethyl lactate during the fermentation of Mixiang Baijiu[J].Liquor-Making Science &Technology, 2022(11):29-35.
[10] YANG C, MAI J H, CAO X, et al.ggpicrust2:An R package for PICRUSt2 predicted functional profile analysis and visualization[J].Bioinformatics, 2023, 39(8):btad470.
[11] LANGILLE M G I, ZANEVELD J, CAPORASO J G, et al.Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J].Nature Biotechnology, 2013, 31(9):814-821.
[12] DOUGLAS G M, MAFFEI V J, ZANEVELD J R, et al.PICRUSt2 for prediction of metagenome functions[J].Nature Biotechnology, 2020, 38(6):685-688.
[13] YANG L, XIAN C, LI P, et al.The spatio-temporal diversity and succession of microbial community and its environment driving factors during stacking fermentation of Maotai-flavor Baijiu[J].Food Research International, 2023, 169:112892.
[14] 李小龙, 芝麻香型白酒发酵过程微生物群落演替及其驱动因素[D].无锡:江南大学, 2019.LI X L.Microbial community succession and its drivers during roasted sesame-flavor liquor fermentation[D].Wuxi:Jiangnan University, 2019.
[15] 王石垒. 气候因子对清香型白酒酿造菌群驱动机制的解析及酿造菌群合成微生物组的构建[D].无锡:江南大学, 2021.WANG S L.The driving mechanism of climate factors on the microbiota of Chinese light aroma type liquor and construction of the synthetic microbiota[D].Wuxi:Jiangnan University, 2021.
[16] CALLAHAN B J, MCMURDIE P J, ROSEN M J, et al.DADA2:High-resolution sample inference from Illumina amplicon data[J].Nature Methods, 2016, 13(7):581-583.
[17] JIANG J, LIU Y C, LI H H, et al.Modeling and regulation of higher alcohol production through the combined effects of the C/N ratio and microbial interaction[J].Journal of Agricultural and Food Chemistry, 2019, 67(38):10694-10701.
[18] JI X A, YU X W, WU Q, et al.Initial fungal diversity impacts flavor compounds formation in the spontaneous fermentation of Chinese liquor[J].Food Research International, 2022, 155:110995.
[19] WANG X S, DU H, XU Y.Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J].International Journal of Food Microbiology, 2017, 244:27-35.
[20] HUANG X N, FAN Y, MENG J, et al.Laboratory-scale fermentation and multidimensional screening of lactic acid bacteria from Daqu[J].Food Bioscience, 2021, 40:100853.
[21] 万兵. 酱香型白酒酿造过程中酿酒酵母和面包乳杆菌交互作用机制解析[D].无锡:江南大学, 2022.WANG B.Interaction mechanism analysis of Saccharomyces cerevisiae and Lactobacillus panis during the brewing process of Jiang-flavor liquor[D].Wuxi:Jiangnan University, 2022.
[22] LI K M, CHEN Y R, LIU T, et al.Analysis of spatial distribution of bacterial community associated with accumulation of volatile compounds in Jiupei during the brewing of special-flavor liquor[J].LWT, 2020, 130:109620.
[23] LIU W H, CHAI L J, WANG H M, et al.Bacteria and filamentous fungi running a relay race in Daqu fermentation enable macromolecular degradation and flavor substance formation[J].International Journal of Food Microbiology, 2023, 390:110118.
[24] GABRIELLI N, MAGA-NTEVE C, KAFKIA E, et al.Unravelling metabolic cross-feeding in a yeast-bacteria community using 13C-based proteomics[J].Molecular Systems Biology, 2023, 19(4):e11501.
[25] PONOMAROVA O, GABRIELLI N, SÉVIN D C, et al.Yeast creates a niche for symbiotic lactic acid bacteria through nitrogen overflow[J].Cell Systems, 2017, 5(4), 345-357.e6.
[26] CHEN C, XIONG Y, XIE Y H, et al.Metabolic characteristics of lactic acid bacteria and interaction with yeast isolated from light-flavor Baijiu fermentation[J].Food Bioscience, 2022, 50(Part A):102102.
[27] DUMINIL P, DAVANTURE M, OURY C, et al.Arabidopsis thaliana 2,3-bisphosphoglycerate-independent phosphoglycerate mutase 2 activity requires serine 82 phosphorylation[J].The Plant Journal, 2021, 107(5):1478-1489.
[28] AAKKO J, PIETIL S, TOIVONEN R, et al.A carbohydrate-active enzyme (CAZy) profile links successful metabolic specialization of Prevotella to its abundance in gut microbiota[J].Scientific Reports, 2020, 10(1):12411.
S, TOIVONEN R, et al.A carbohydrate-active enzyme (CAZy) profile links successful metabolic specialization of Prevotella to its abundance in gut microbiota[J].Scientific Reports, 2020, 10(1):12411.
[29] WARDMAN J F, BAINS R K, RAHFELD P, et al.Carbohydrate-active enzymes (CAZymes) in the gut microbiome[J].Nature Reviews Microbiology, 2022, 20(9):542-556.