手撕牛肉是四川特色休闲肉干制品,具有低脂肪高蛋白的优点,同时富含脂肪酸、氨基酸、钾、锌、镁、铁等矿物质及维生素,且胆固醇含量比其他肉类食品低[1]。手撕牛肉含有丰富的营养物质,是微生物生长的良好介质,若处理不当极易腐败变质,影响其贮藏期。为追求更长的贮藏期,生产者普遍采用高温灭菌处理,如热风干燥、高温蒸煮、油炸熟制等[2]。经过高温处理后的肉制品蛋白质结构会发生变化[3],风味和营养成分也会有一定程度的损失[4],甚至产生多种威胁人体健康的有害物质[5]。现代人不仅要求吃饱,还要求吃的健康,因此,需要一种更为健康、环保的加工方式来延长手撕牛肉贮藏期。
辐照是一种新型冷杀菌技术,具有杀灭微生物、肉质嫩化、延长贮藏期等功效,现已广泛运用于食品、中药材保藏等领域。已有研究证明辐照具有高温相同的灭菌效果[6],辐照在降低腊牛肉微生物含量的同时能提高腊牛肉的色泽[7];此外研究表明辐照能够对肉中残留的亚硝酸盐产生一定的降解作用[8]。相比传统食品保鲜技术,辐照保藏技术在保持肉类产品食用安全方面更加方便高效,可满足消费者对肉类高品质和食用安全的要求。
高通量测序技术(high-throughput sequencing)又称二代测序技术,能一次对几十万到几百万条DNA分子进行测定,常用于微生物多样性研究[9]。通过提取样品微生物总DNA,应用高通量测序技术可以鉴定出不可培养的微生物种类,还能确定不同种类微生物的相对丰度[10]。食品富含丰富的营养物质,在贮藏中微生物之间相互竞争使得种群关系处于不断变化中,最终导致食品腐败。手撕牛肉的腐败主要由微生物导致,辐照能够杀死微生物,但辐照对微生物种类的影响还未知,辐照后手撕牛肉在贮藏期微生物种群动态变化情况研究还是空白。因此,本研究采用不同剂量电子束辐照处理手撕牛肉,运用高通量测序技术分析其贮藏期微生物多样性,评估不同剂量辐照对微生物种类及含量的影响,研究贮藏期手撕牛肉微生物种类动态变化情况,深入探讨辐照延长贮藏期机理,以期为手撕牛肉的防腐保鲜提供理论依据,也为电子束辐照灭菌技术的运用奠定基础。
1 材料与方法
1.1 材料与试剂
手撕牛肉真空包装,每袋大小2 cm×5 cm,质量11~13 g,未经高温灭菌,由某食品有限公司提供。
平板计数琼脂培养基,青岛高科技工业园海博生物技术有限公司;基因组DNA提取试剂盒、琼脂糖凝胶回收试剂盒,美国Omega科技公司;rTaq DNA聚合酶、DNA Marker,日本Takara公司;引物338F/806R,北京擎科生物科技股份有限公司成都分公司;琼脂糖,美国Invitrogen生命技术公司。
1.2 仪器与设备
SX-500高压灭菌锅,日本Tom Digital Biology公司;CJ-1450超净工作台,苏信环境科技有限公司;5415R高速离心机、5531PCR仪,德国Eppendorf公司;iBright CL1000凝胶成像系统、NanoDrop NC2000紫外-可见分光光度计,美国Thermo Fisher Scientific公司;DYY-6C电泳仪,北京六一仪器厂;GJ-2高能电子加速器,四川润祥辐照技术有限公司;PE250高通量测序仪,美国Illumina公司。
1.3 实验方法
1.3.1 样品处理
手撕牛肉制作好后,4 ℃条件下运送至四川润祥辐照技术有限公司采用高能电子加速器辐照处理。辐照能量10 MeV,功率20 kW;辐照剂量2、5、8 kGy,以未辐照样品为对照(CK)。
1.3.2 菌落总数测定
辐照好的手撕牛肉于(25±2) ℃条件下贮藏,参照国家标准GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》在辐照当天及贮藏期每隔10 d取样,测定菌落总数含量。共测定7次,贮藏时间为60 d。测定菌落总数的同时随机抽取各组样品于-80 ℃保藏,用于后续微生物多样性分析,每组3个平行。
1.3.3 总DNA提取及高通量测序
根据手撕牛肉菌落总数测定结果,选择贮藏0、10、40 d样品,参照说明书,使用E.Z.N.A.® Soil DNA Kit试剂盒提取基因组DNA。使用1 g/100 mL琼脂糖凝胶电泳检测DNA的提取效果,紫外-可见分光光度计检测DNA提取质量。经检验合格后,利用引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)对细菌的V3~V4区域进行PCR扩增。PCR扩增体系为:10×PCR Buffer 5 μL,dNTP 4 μL,DNA聚合酶0.25 μL,基因组DNA 2 μL,上下游引物各1 μL,用ddH2O补足至50 μL。PCR扩增程序为:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃下延伸1 min,30个循环;72 ℃下稳定延伸10 min。PCR产物经2%琼脂糖凝胶电泳检测后,参照说明书,使用E.Z.N.A.®胶回收试剂盒回收PCR产物。紫外-可见分光光度计检测胶回收产物质量,合格后送至苏州帕诺米克生物医药科技有限公司在Illumina Miseq PE250平台上进行测序。
1.3.4 生物信息学分析
使用Trimmomatic将测序得到的原始序列进行质控和过滤。使用Flash根据原始序列之间的重叠关系进行双端序列拼接,然后用Uchinme剔除嵌合体。使用Uparse根据97%的相似性对非重复序列的操作分类单位(operational taxonomic units,OTU)进行聚类。基于OUT聚类分析结果,使用Mothur分析不同组样品Alpha多样性。使用RDP Class参照细菌Silva数据库(http:∥www.arb-silva.de)对OTU代表性序列进行分类注释和分析,设置置信阈值为0.7,并在门和属分类水平上对样本的细菌多样性进行统计。分类水平上数据采用SPSS进行LSD及Duncan显著差异性(P<0.05)分析,使用Origin绘制样品相对丰度图。
2 结果与分析
2.1 不同剂量辐照对手撕牛肉菌落总数的影响
根据国家标准GB 2726—2016《食品安全国家标准 熟肉制品》要求,手撕牛肉菌落总数最大限量为105 CFU/g。由表1可知,刚制作好的手撕牛肉菌落总数为6.5×102 CFU/g,满足标准;但贮藏10 d菌落总数增长为2.6×105 CFU/g,超过限度标准。经2 kGy剂量处理后的手撕牛肉菌落总数明显降低,贮藏20 d后菌落总数达到105 CFU/g,超过限度标准;经5 kGy剂量处理后的手撕牛肉检出少量菌落,在贮藏40 d后菌落总数超过限度标准;经8 kGy剂量处理后的手撕牛肉菌落总数未检出,在贮藏60 d内菌落总数仍控制在国家标准限度范围内。本研究结果表明随着辐照剂量的增加,对手撕牛肉的杀菌效果越高,与前人研究结果一致[7]。
表1 不同剂量辐照手撕牛肉贮藏期菌落总数 单位:CFU/g Table 1 Total bacterial count of shredded beef with different doses electron beam irradiation during storage

辐照剂量/kGy0 d10 d20 d30 d40 d50 d60 d0(CK)6.5×1022.6×105-----21.2×1021.54×1031.1×105----5401.5×1022.5×1021.6×1031.5×105--8NDND301.6×1024.5×1021.2×1038.4×103
注:-表示未检测;ND表示未检出。
辐照杀菌是利用放射性60Co或137Cs发出的γ射线,或利用电子加速器产生的电子束或X射线在一定的剂量范围内照射物品,通过直接或间接的作用引起生物体DNA、RNA、蛋白质、脂类等有机分子的化学键断裂、蛋白质与DNA分子交联、DNA序列中碱基的改变,导致细菌、病毒、昆虫等的死亡,延长食品保质期[11]。通常情况下,微生物数量越多,杀灭需要的辐照剂量越高;辐照剂量越高,杀菌效果越好[12]。
2.2 不同剂量辐照手撕牛肉贮藏期细菌Alpha多样性分析
Alpha多样性可以反应不同剂量处理组间菌群丰富度与多样性的差别。Chaol指数用于表示菌群丰富度,值越大表明群落丰富度越高;Shannon和Simpson指数用于表示菌群多样性,Shannon指数值越高表明样品群落多样性越高,Simpson指数越大则表明群落多样性越低;Coverage为覆盖率,反映群落覆盖度。由表2可知,各样品的Coverage指数(OTU覆盖率)都达到99%以上,表明测序深度好,序列未被检出的可能性小,结果可用于群落多样性分析。随着辐照剂量的增加,Chaol指数越小,表明增加辐照剂量可减少微生物的丰富度。同时,贮藏时间增加,各处理组Chaol指数减小,猜想是由于一些好氧菌和微好氧菌在真空包装条件下被抑制,或辐照间接作用导致辐射敏感菌死亡,使得贮藏后期微生物丰富度逐渐降低。在CK组,Shannon指数随着贮藏时间先减小后增大,而Simpson指数先增大后减小,这是由于前期腐败微生物大量繁殖,后期营养物质消耗,腐败微生物死亡导致。在2 kGy剂量组,Shannon指数随着贮藏期先增大后减小,这是由于前期辐照的间接作用导致优势菌受到抑制、耐辐射微生物生长,贮藏后期存活下的腐败菌大量繁殖导致。在5 kGy和8 kGy剂量组,Shannon指数随着贮藏时间逐渐减小,这是由于辐照剂量过大,直接杀死了辐射敏感菌,在贮藏中由于存活下的腐败菌大量繁殖导致。前人研究发现,不同种类的微生物对辐照的耐受能力不同[13],甚至同属、同种的不同微生物间也存在差异。从常有的微生物种类来看,耐辐射性依次为芽胞菌>酵母菌>霉菌>革兰氏阳性菌>革兰氏阴性菌[12]。
表2 Alpha多样性指数
Table 2 Alpha diversity indexes
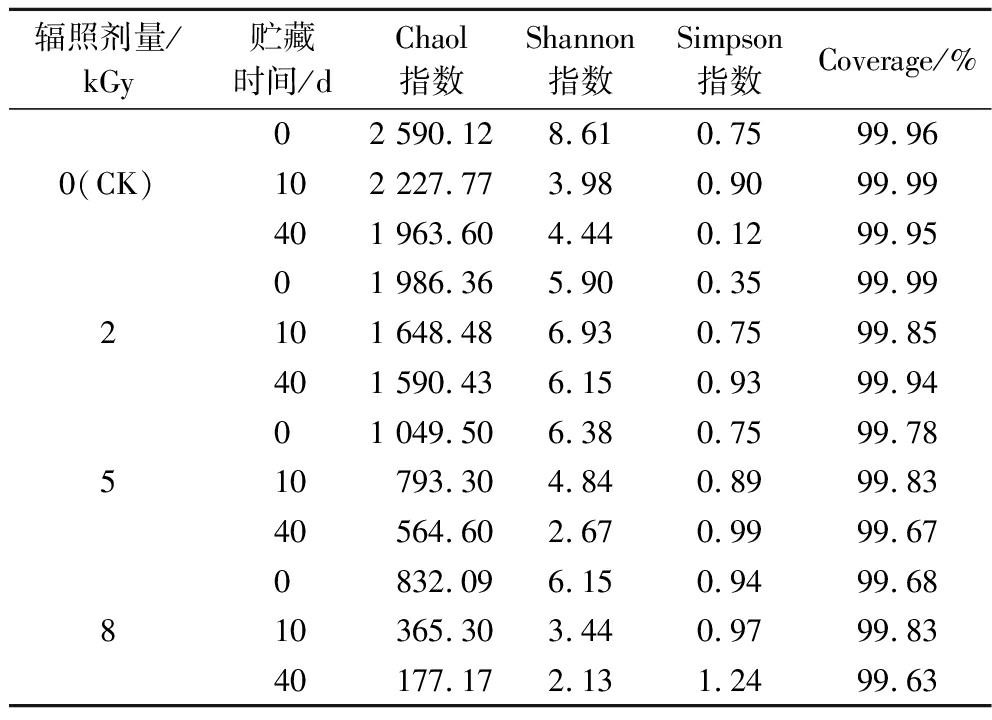
辐照剂量/kGy贮藏时间/dChaol指数Shannon指数Simpson指数Coverage/%02 590.128.610.7599.960(CK)102 227.773.980.9099.99401 963.604.440.1299.9501 986.365.900.3599.992101 648.486.930.7599.85401 590.436.150.9399.9401 049.506.380.7599.78510793.304.840.8999.8340564.602.670.9999.670832.096.150.9499.68810365.303.440.9799.8340177.172.131.2499.63
2.3 不同剂量辐照手撕牛肉贮藏期细菌群落结构分析
2.3.1 基于门水平的细菌群落结构分析
图1为36个样品除去未分类的菌群,剩余细菌菌群在门水平下相对丰度排名前5的群落结构分布图。从图1可以看出厚壁菌门(Firmicutes)是手撕牛肉的绝对优势菌门,其次为变形菌门(Proteobacteria)。不同处理组在贮藏期厚壁菌门相对丰度为52.03%~89.39%,变形菌门相对丰度为4.64%~29.35%。研究发现碎牛肉中的优势菌门为厚壁菌门和变形菌门[14];车丽娜等[15]对卤牛肉微生物多样性进行分析,15个样品贮藏期优势菌门为厚壁菌门、变形菌门和蓝菌门(Cyanobacteria);西藏地区的牦牛肉中主要优势菌门为蓝菌门和变形菌门[16]。本研究结果结合前人研究,发现肉制品中的主要优势菌门为厚壁菌门和变形菌门。
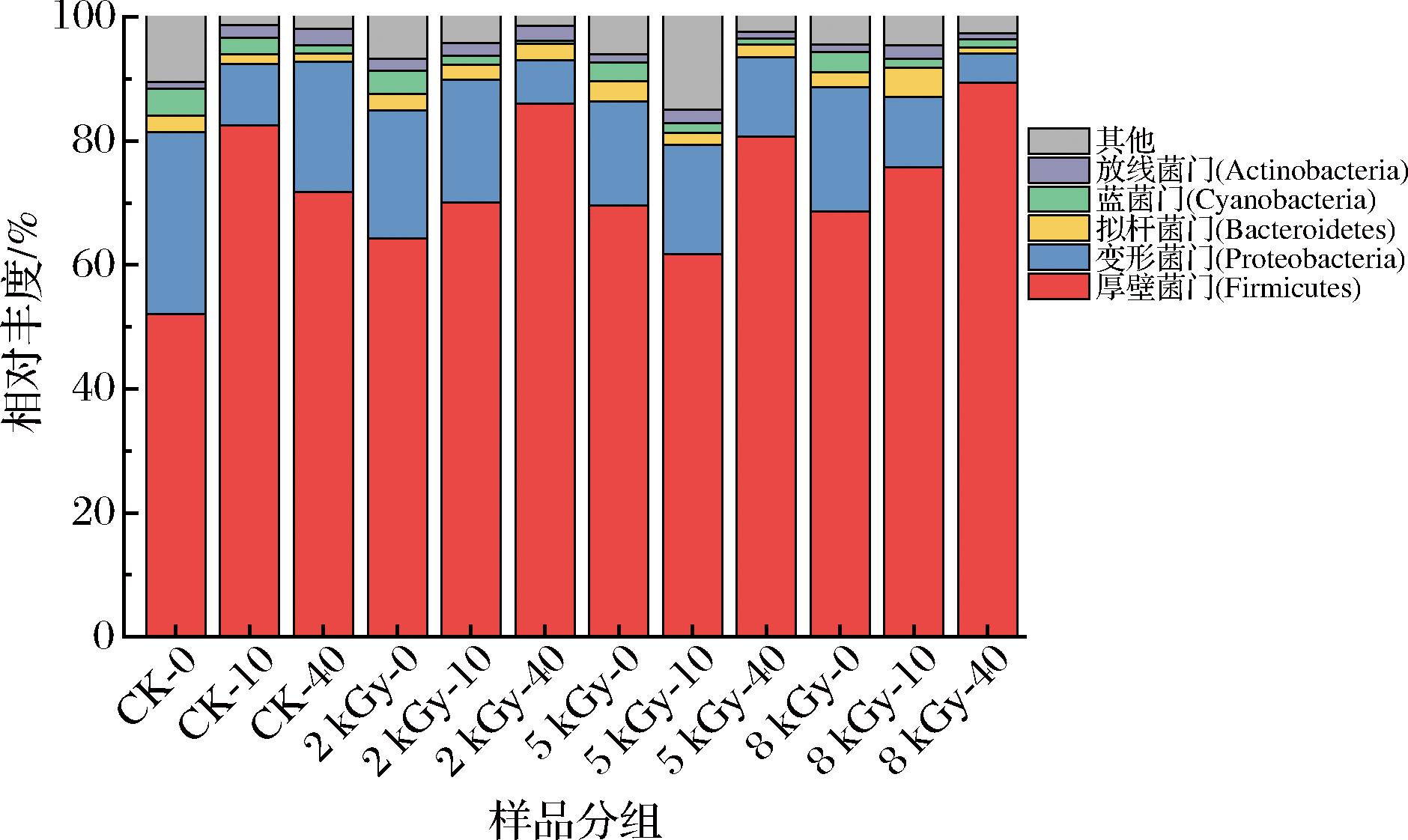
图1 基于门分类水平上的样品菌群分布图
Fig.1 Bacterial distribution pattern at the phylum level
厚壁菌门为革兰氏阳性菌,很多可以产生芽孢,抵抗脱水和极端环境,该门主要包括一些芽孢杆菌、乳酸杆菌和葡萄球菌等,是高蛋白食品中常见的优势腐败菌[15]。变形菌门为革兰氏阴性菌,包括大肠杆菌、沙门氏菌、霍乱弧菌、幽门螺杆菌等,多为辐射敏感菌[17]。牛肉是高蛋白食品,为厚壁菌门微生物生长提供了丰富的营养物质,同时革兰氏阳性菌抗辐射能力优于革兰氏阴性菌[12],所以随着辐照剂量的增加,厚壁菌门相对丰度增加。但在贮藏期,不同剂量辐照处理组基于门水平的微生物群落结构发生不同变化,猜想这是由于贮藏期微生物之间竞争繁殖导致。
2.3.2 基于属水平的细菌群落结构分析
图2显示的是36个样品除去未分类菌群,剩余细菌菌群在属水平下相对丰度排名前10的群落结构分布情况。在贮藏0 d,CK组优势菌属为肠杆菌属(Enterobacter,25.94%)、葡萄球菌属(Staphylococcus,17.28%)、芽孢杆菌属(Bacillus,11.19%)和乳杆菌属(Lactobacillus,10.82%),2 kGy组优势菌属和CK组相同,但相对丰度不同,芽孢杆菌属(24.62%)和葡萄球菌属(18.29%)相对丰度增加,肠杆菌属(15.16%)和乳杆菌属(7.64%)相对丰度减少。5 kGy组和8 kGy组优势菌属相同,为芽孢杆菌属、不动杆菌属(Acinetobacter)、葡萄球菌属和乳杆菌属,相对丰度分别为29.43%、13.52%、12.76%、8.21%(5 kGy)和28.15%、17.13%、15.26%、7.81%(8 kGy)。从图2中我们可以看出,随着辐照剂量的增加,芽孢杆菌属和不动杆菌属相对丰度提高,肠杆菌属相对丰度减少。这是由于芽孢杆菌属能产生具有抵抗极端环境能力的芽孢,能够在辐射条件下存活[18];而肠杆菌属包含多数辐射敏感菌[17],在辐射条件下不能存活。采用γ射线和电子束辐照处理冷鲜鸡,经辐照处理后的样品在贮藏期间不动杆菌属相对丰度大幅度提升[19],与本研究结果一致,说明部分不动杆菌微生物具有耐辐射能力。
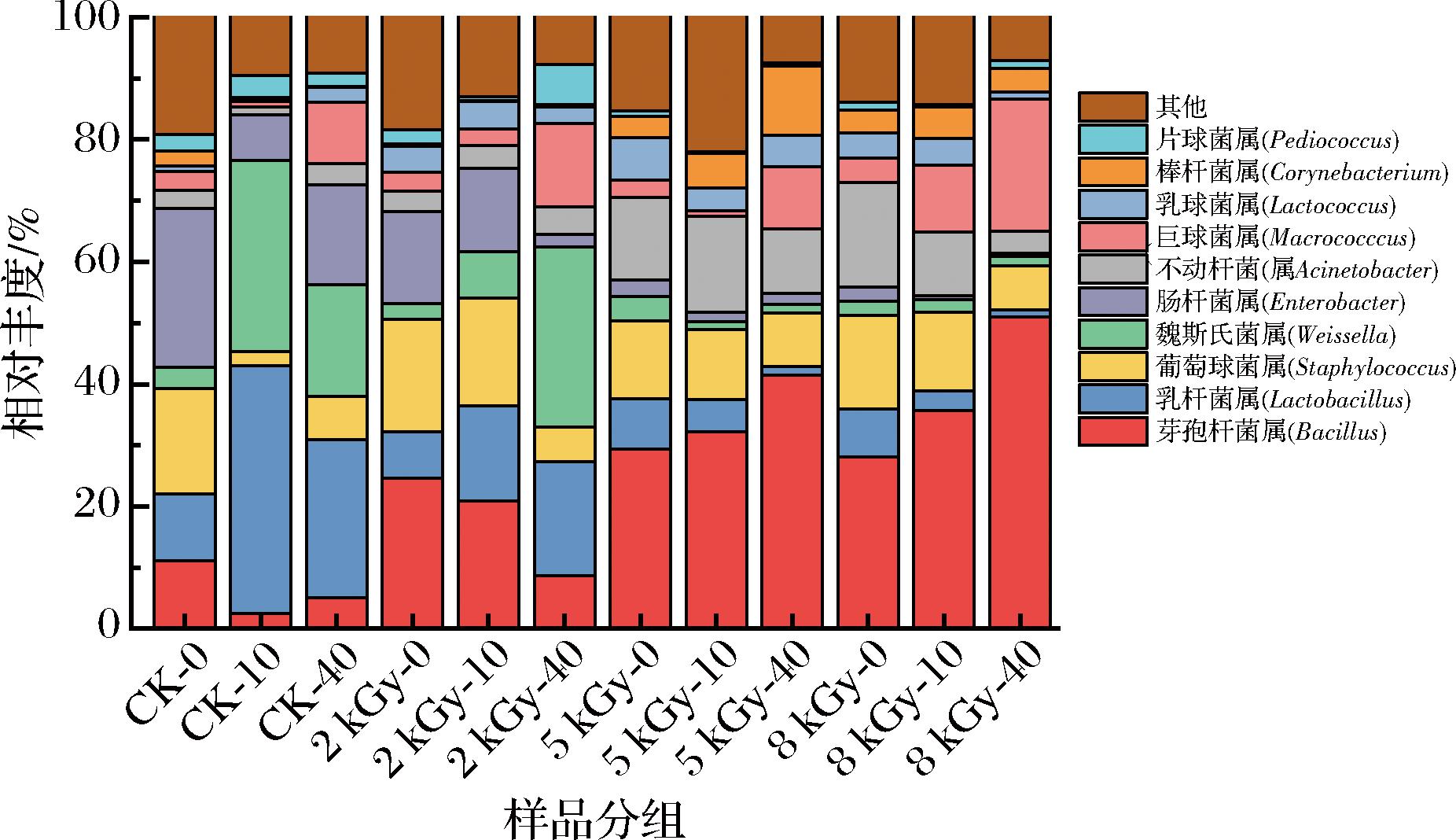
图2 基于属分类水平上的样品菌群分布图
Fig.2 Bacterial distribution pattern at the genus level
在贮藏10 d和40 d时,优势菌群呈不断变化的趋势。CK组贮藏10 d时,优势菌变为乳杆菌属(40.53%)和魏斯氏菌属(Weissella,31.21%),贮藏40 d后优势菌仍为乳杆菌属(25.88%)和魏斯氏菌属(18.38%),同时肠杆菌属(16.94%)和巨球菌属(Macrococccus,10.03%)相对丰度增加。2 kGy组在贮藏10 d时,优势菌与0 d相同,贮藏40 d时优势菌为魏斯氏菌属(29.47%)、乳杆菌属(18.63%)和巨球菌属(13.63%)。5 kGy组在贮藏10 d和40 d时优势菌属与0 d相似,为芽孢杆菌属、不动杆菌属和葡萄球菌属,相对丰度分别为32.17%、15.63%、11.54%(10 d)和41.48%、10.57%、8.73%(40 d)。8 kGy组在贮藏10 d时优势菌群为芽孢杆菌属(35.72%)、葡萄球菌属(12.95%)、巨球菌属(10.98%)和不动杆菌属(10.36%),贮藏40 d时优势菌属为芽孢杆菌属(50.94%)、巨球菌属(21.56%)和葡萄球菌属(7.15%)。经显著差异性分析,相比贮藏0 d,贮藏10 d和40 d时CK组和2 kGy组魏斯氏菌属相对丰度显著增加(P<0.05),乳杆菌属相对丰度显著增加(P<0.05),葡萄球菌属相对丰度显著降低(P<0.05),肠杆菌属相对丰度一直在一个较高水平;5 kGy组和8 kGy组芽孢杆菌属相对丰度随贮藏时间显著增加(P<0.05),乳杆菌属相对丰度随贮藏时间显著减少(P<0.05),不动杆菌属相对丰度一直在一个较高水平。
研究发现魏斯氏菌属能够引起真空包装袋中肉制品的腐败[20],芽孢杆菌属中部分菌株为兼性厌氧菌,能够在真空包装条件下良好生长,是腐败肉制品中的优势腐败菌[21]。郑瑞生等[22]分析正常和腐败熟成牛肉的优势细菌,发现腐败熟成牛肉的优势菌为变形菌门的不动杆菌属;卤牛肉在贮藏后期巨大球菌属和肠杆菌属为优势菌属[15]。乳杆菌属和葡萄球菌属为有益菌,常存在发酵食品中。葡萄球菌属可耐受高盐环境,是烟熏腊肉产生特殊风味的关键因子[23],是新鲜香肠中的主要微生物[24]。乳杆菌属在发酵过程中可起产酸的作用,抑制肠杆菌属的生长,部分菌株还能降低发酵过程中生物胺和亚硝酸盐的产生[25]。
本研究结合前人研究表明不同处理组在贮藏后期都产生了发酵;魏斯氏菌属是CK组2 kGy组腐败绝对优势菌属,肠杆菌属也在腐败中起着重要作用;芽孢杆菌属是5 kGy组和8 kGy组优势腐败菌属,不动杆菌属也为牛肉制品主要腐败微生物。综上,不同剂量辐照处理不仅影响手撕牛肉初始微生物群落结构,同时影响其贮藏期微生物多样性。这很可能也是其保质期不同的关键原因。
3 结论与讨论
本研究以未辐照(CK)样品为对照,采用2、5、8 kGy剂量电子束辐照处理手撕牛肉,参照国标GB 2726—2016(食品安全国家标准 熟肉制品)测定贮藏期菌落总数,运用高通量测序技术分析贮藏期微生物群落多样性。结果表明随着辐照剂量增加,菌落总数减少,保质期延长。Alpha多样性分析显示辐照剂量增加,微生物丰富度减少;贮藏时间延长,微生物丰富度减少。在门水平,不同剂量处理组在贮藏期优势菌均为厚壁菌门和变形菌门。在属水平,辐照剂量增加,芽孢杆菌属和不动杆菌属相对丰度提高,肠杆菌属相对丰度减少;贮藏10 d和40 d,CK组和2 kGy组魏斯氏菌属相对丰度显著增加(P<0.05),乳杆菌属相对丰度显著增加(P<0.05),葡萄球菌属相对丰度显著降低(P<0.05),肠杆菌属相对丰度在较高的一个水平;5 kGy组和8 kGy组随着贮藏时间延长芽孢杆菌属相对丰度显著增加(P<0.05),乳杆菌属相对丰度显著减少(P<0.05),不动杆菌属相对丰度在较高水平。表明魏斯氏菌属是CK组2 kGy组腐败绝对优势菌属,肠杆菌属也在腐败中起着重要作用;芽孢杆菌属是5 kGy组和8 kGy组优势腐败菌属,不动杆菌属也为牛肉制品主要腐败微生物。综合结果表明,不同剂量辐照处理不仅影响手撕牛肉初始菌落总数和微生物群落结构,同时影响其保质期及贮藏期微生物群落多样性。本研究结果为高能电子束辐照加工技术运用于手撕牛肉杀菌保鲜提供了科学依据。
[1] 王佳佳, 邓源喜, 王丹丹, 等.牛肉的营养价值及牛肉嫩化技术的研究进展[J].肉类工业, 2019(9):55-58.WANG J J, DENG Y X, WANG D D, et al.Research progress on tenderizing technology of beef and nutritive value of beef[J].Meat Industry, 2019(9):55-58.
[2] AYK N DINÇER E.Dried meat products obtained by different methods from past to present[J].Food Reviews International, 2023, 39(5):2457-2476.
N DINÇER E.Dried meat products obtained by different methods from past to present[J].Food Reviews International, 2023, 39(5):2457-2476.
[3] 康怀彬, 邹良亮, 张慧芸, 等.高温处理对牛肉蛋白质化学作用力及肌原纤维蛋白结构的影响[J].食品科学, 2018, 39(23):80-86.KANG H B, ZOU L L, ZHANG H Y, et al.Effect of high temperature treatment on chemical forces of beef proteins and structure of myofibrillar protein[J].Food Science, 2018, 39(23):80-86.
[4] 高天丽, 李林强, 张兰, 等.3种高温处理方式对羊肉营养成分含量的影响[J].食品与发酵工业, 2017, 43(2):166-173.GAO T L, LI L Q, ZHANG L, et al.Effects of high-temperature treatment on nutrient composition of mutton[J].Food and Fermentation Industries, 2017, 43(2):166-173.
[5] 张兰, 高天丽, 刘永峰, 等.八种中式烹饪工艺对牛肉中多环芳烃、反式脂肪酸和亚硝酸盐的影响[J].中国农业科学, 2017, 50(6):1126-1138.ZHANG L, GAO T L, LIU Y F, et al.Effects of eight Chinese style cuisine methods on polycyclic aromatic hydrocarbons, trans-fatty acids and nitrite of beef[J].Scientia Agricultura Sinica, 2017, 50(6):1126-1138.
[6] 赵文颖, 刘丹丹, 靳健乔, 等.辐照灭菌处理对中式酱牛肉理化性能的影响[J].食品与机械, 2022, 38(3):133-138.ZHAO W Y, LIU D D, JIN J Q, et al.Effects of irradiation on physico-chemical property of Chinese soy-sauced beef[J].Food &Machinery, 2022, 38(3):133-138.
[7] 肖蓉, 徐昆龙, 彭伟国, 等.辐照保鲜对腊牛肉品质影响的初探[J].食品科技, 2004,29(8):74-76;81.XIAO R, XU K L, PENG W G, et al.Brief study on effect of radiation on the quality of cured beef[J].Food Science and Technology, 2004,29(8):74-76;81.
[8] 毛青秀. 辐照对腊制品中亚硝酸盐降解效果与机理研究[D].长沙:中南大学, 2013.MAO Q X.Research on Irradiation degradation effect and mechanism of nitrite in bacon[D].Changsha:Central South University, 2013.
[9] REUTER J A, SPACEK D V, SNYDER M P.High-throughput sequencing technologies[J].Molecular Cell, 2015, 58(4):586-597.
[10] 高乾坤, 焦琳舒, 杜贺超, 等.高通量测序分析不同产地带鱼冷藏时微生物群落多样性[J].食品科学, 2018, 39(18):127-132.GAO Q K, JIAO L S, DU H C, et al.High-throughput sequencing analysis of microbial community diversity of hairtail from different waters during chilled storage[J].Food Science, 2018, 39(18):127-132.
[11] 何凯锋, 陈秀金, 臧鹏, 等.辐照杀菌技术对食品品质的影响及控制研究进展[J].食品与发酵工业, 2023, 49(10):299-305.HE K F, CHEN X J, ZANG P, et al.Research progress on effect of irradiation sterilization on food quality and its control[J].Food and Fermentation Industries, 2023, 49(10):299-305.
[12] 徐攀, 许竞地, 陈谦, 等.高能电子束辐照对黄精微生物及品质的影响[J].食品与发酵工业, 2024, 50(1):67-72.XU P, XU J D, CHEN Q, et al.Effects of high-energy electron beam irradiation on microbial load and quality of Polygonati rhizoma[J].Food and Fermentation Industries, 2024, 50(1):67-72.
[13] ZHANG H F, SECK H L, ZHOU W B.Inactivation of Salmonella typhimurium, Escherichia coli O157∶H7, Staphylococcus aureus, and Listeria monocytogenes in cardamom using 150 KeV low-energy X-ray[J].Innovative Food Science &Emerging Technologies, 2021, 67:102556.
[14] DOSTER E, THOMAS K M, WEINROTH M D, et al.Metagenomic characterization of the microbiome and resistome of retail ground beef products[J].Frontiers in Microbiology, 2020, 11:541972.
[15] 车丽娜, 赵良忠, 周晓洁.基于高通量测序的湘派卤牛肉细菌多样性分析[J].食品与机械, 2023, 39(2):113-119;197.CHE L N, ZHAO L Z, ZHOU X J.Bacterial diversity analysis of Xiangpai brined beef based on high-throughput sequencing[J].Food &Machinery, 2023, 39(2):113-119;197.
[16] WEN R X, LYU Y C, LI X A, et al.High-throughput sequencing approach to reveal the bacterial diversity of traditional yak jerky from the Tibetan regions[J].Meat Science, 2021, 172:108348.
[17] 孔秋莲, 郑琦, 颜伟强, 等.不同辐照工艺对牛肉糜杀菌效果及感官品质的影响[J].上海农业学报, 2023, 39(4):131-139.KONG Q L, ZHENG Q, YAN W Q, et al.Effects of irradiation methods on sterilization and sensory quality of minced beef[J].Acta Agriculturae Shanghai, 2023, 39(4):131-139.
[18] 王文娟, 蒋导航, 缪玲玲, 等.芽孢杆菌产胞外多糖对大肠杆菌的60Co、UVB、低能氮离子的辐射保护作用研究[J].中国酿造, 2012, 31(3):124-127.WANG W J, JIANG D H, MIAO L L, et al.The protection of exopolysaccharide from the fermentation broth of Bacillus sp.on E.coli against 60Co, UVB, nitrogen ion implantation radiation[J].China Brewing, 2012, 31(3):124-127.
[19] 肖欢, 翟建青, 刘芝平, 等.60Co γ-射线及电子束辐照对冷鲜鸡菌群多样性的影响[J].食品工业科技, 2020, 41(4):74-79.XIAO H, ZHAI J Q, LIU Z P, et al.Effects of 60Co γ-ray and electron beam irradiation on the bacterial community diversity of cold fresh chicken[J].Science and Technology of Food Industry, 2020, 41(4):74-79.
[20] NIEMINEN T T, VIHAVAINEN E, PALORANTA A, et al.Characterization of psychrotrophic bacterial communities in modified atmosphere-packed meat with terminal restriction fragment length polymorphism[J].International Journal of Food Microbiology, 2011, 144(3):360-366.
[21] 刘珊, 吴香, 黄俊逸, 等.杀菌和贮藏方式对酱牛肉的微生物和品质的影响[J].食品科技, 2020, 45(3):151-158.LIU S, WU X, HUANG J Y, et al.Effects of sterilization and storage methods on microbes and quality of sauced beef[J].Food Science and Technology, 2020, 45(3):151-158.
[22] 郑瑞生, 邹菊琴, 王丹妮, 等.高通量测序分析正常及腐败熟成牛肉和牛舌细菌多样性[J].食品安全质量检测学报, 2023, 14(8):262-267.ZHENG R S, ZOU J Q, WANG D N, et al.Analysis of bacterial diversity in normal and spoiled aged beef and beef tongue by high-throughput sequencing[J].Journal of Food Safety &Quality, 2023, 14(8):262-267.
[23] 刘雨萱, 任冠洁, 鲁家璇, 等.市售四川腊肉中微生物群落结构及生物胺的相关性研究[J].食品与发酵工业, 2022, 48(16):163-168;174.LIU Y X, REN G J, LU J X, et al.Microbial community structure and biogenic amine content in commercial Sichuan bacon[J].Food and Fermentation Industries, 2022, 48(16):163-168;174.
[24] 滕安国, 张芹, 蒋怡, 等.不同储藏时期香肠菌群结构的变化及优势腐败菌研究[J].现代食品科技, 2019, 35(2):40-46.TENG A G, ZHANG Q, JIANG Y, et al.Studyies on the microbial profiles and dominant spoilage bacteria in sausage during different storage periods[J].Modern Food Science and Technology, 2019, 35(2):40-46.
[25] ZHANG Y, ZHANG J B, LIN X P, et al.Lactobacillus strains inhibit biogenic amine formation in salted mackerel (Scomberomorus niphonius)[J].LWT, 2022, 155:112851.