鞘氨醇菌属因具有特殊的膜外成分——鞘氨醇脂(胶)而命名。根据16S rRNA序列、多胺类型和2-羟基脂肪酸模式的差异,研究者将其划分为4个属,鞘氨醇单胞菌属(Sphingomonas)、鞘氨醇杆菌属(Sphingobium)、鞘氨醇盒菌属(Sphingopyxis)及新鞘氨醇杆菌属(Novosphingobium),共同组成鞘氨醇杆菌科(Sphingomonads)[1]。
鞘氨醇胶主要由鞘氨醇单胞菌属产生,然而,在适当的培养环境中,如碳源和氮源充足的条件下,鞘氨醇杆菌科的其他属也可能分泌新型鞘氨醇胶。这些新型鞘氨醇胶可能因略微不同的结构而具备不同的流变性能,从而呈现不同的应用价值。新型鞘氨醇胶的发现有助于了解生物的多样性。此外,尽管鞘氨醇胶具有极高的应用价值,但受到低产量和高成本的制约,目前仍未得到广泛应用。因此,如何通过调整pH、温度、溶氧、搅拌速度、氮源和发酵策略等因素,以提高鞘氨醇胶的产量,成为提高其工业化生产的关键[2]。
鞘氨醇胶的主链由重复寡糖单位组成,其主链相对保守,为‘-葡萄糖-葡萄糖醛酸-葡萄糖-X-’,其中X可以是鼠李糖或甘露糖。鞘氨醇胶的侧链基团种类及连接方式具有多样性,主要包括含有乙酰基或甘油酰基的酰基侧链,以及含有鼠李糖、甘露糖的糖基侧链。这种多样性决定了不同种类鞘氨醇胶具有不同的理化特性,使其具备增稠、胶凝、耐酸、耐高温、耐盐和乳化等独特性质[3]。
目前已发现的鞘氨醇胶种类包括结冷胶(gellan gum, S-60)、威兰胶(welan gum, S-130)、鼠李胶(rhamsan gum, S-194)、定优胶(diutan gum, S-657)、S-88、S-198和NW-11等[4-5]。结冷胶的主要结构为线性四糖重复单元聚合体,由β-1,3-D-葡萄糖、β-1,4-D-葡萄糖醛酸、β-1,4-D-葡萄糖、α-1,4-L-鼠李糖连接而成,其侧链含有乙酰基和甘油酰基,平均分子质量约为500 kDa。结冷胶存在2种形式,分别为高酰基结冷胶(天然结冷胶)和低酰基结冷胶(经物理化学方法脱去酰基),具有稳定性好、透明度高、凝胶强度高、温度滞后性、假塑性、流动性、良好的配伍性、优越的呈味性能和风味释放性,广泛应用于食品、医药、环境保护、土壤生物修复等领域[6-7]。威兰胶的结构与结冷胶类似,其主链结构由四糖重复单元β-1,3-D-葡萄糖、β-1,4-D-葡萄糖醛酸、β-1,4-D-葡萄糖、α-1,4-L-鼠李糖组成,侧链由L-甘露糖基和L-鼠李糖基组成,乙酰基占2.8%~7.5%,平均分子质量为8 000 kDa。威兰胶具有良好的稳定性、悬浮性、乳化性、增稠性和独特的剪切稀化性能,且无毒性,目前被广泛应用于食品、生物医药和石油开采等领域作为稳定剂、乳化剂和增稠剂等[8]。
新鞘氨醇杆菌目前的研究主要集中在降解多环芳烃(如菲、苯并蒽、苯并芘等)[9]、生产类胡萝卜(如虾青素、玉米黄素等)[10]以及降解木质素[11]等方面,对其胞外多糖研究较少。鉴于新鞘氨醇杆菌属和鞘氨醇单胞菌属之间的同源性,本文旨在对从福建药白曲中筛选的新鞘氨醇杆菌D6的培养条件进行优化,并对其胞外多糖的性质和结构进行详细分析。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
新鞘氨醇杆菌D6为本实验室从福建药白曲中筛选并保藏于江南大学粮食发酵与食品生物制造国家工程研究中心陆健教授实验室(菌株保藏号为:JNSG00009762)。
1.1.2 培养基
LB培养基(g/L):NaCl 10.0,胰蛋白胨10.0,酵母提取物5.0,琼脂20(固体)。
SOC培养基(g/L):葡萄糖10.0,酵母提取物5.0,蛋白胨20.0,NaCl 0.5,KCl 0.2,MgCl2 1.0,MgSO4·7H2O 1.2。
基础发酵培养基(g/L):葡萄糖30.0,酵母膏1.0,蛋白胨3.0,MgSO4·7H2O 0.4,K2HPO4 3.0,KH2PO4 2.0。
1.1.3 主要试剂
品红、丹宁酸、亚甲基蓝,上海麦克林生化科技股份有限公司;豆粕粉,江苏省农垦麦芽有限公司;橄榄油,无锡京沪时代超市;PMP(1-苯基-3-甲基-5-吡唑啉酮)色谱纯,北京伊诺凯科技有限公司;单糖标准品,美国Sigma生物公司;3000 Da 透析袋,北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
PCR仪,德国Eppendorf股份公司;FD-1A-50型真空冷冻干燥机,江苏天翎仪器有限公司;Synergy H1型酶标仪,南京拜尔沃克智能科技有限公司;DM2000 LED型光学显微镜,德国徕卡仪器有限公司;DEAE-Sepharose Fast Flow型高效凝胶过滤色谱,北京索莱宝科技有限公司;Agilent 1260高效液相色谱仪,配备紫外检测器,美国安捷伦科技公司;NEXUS型傅里叶红外光谱仪,美国尼高力仪器公司;热重分析仪,瑞士梅特勒-托利多公司;Brookfield DV2T黏度计,美国博勒飞公司。
1.3 实验方法
1.3.1 产胞外多糖新鞘氨醇杆菌的鉴定
参照REN等[12]的方法,应用丹宁媒染染色法鉴定菌株是否产胞外多糖。
1.3.2 新鞘氨醇杆菌D6的产糖曲线测定
参照王萍[13]的方法,将D6活化后,接种至基础发酵培养基,30 ℃ 220 r/min培养72 h,每6 h取样,测定OD600值、pH值,绘制生长曲线;利用苯酚-硫酸法测定胞外多糖产量。
1.3.3 新鞘氨醇杆菌D6发酵培养基的优化
采用单因素试验,分别测定不同碳源、最佳碳源添加量(10.0~50.0 g/L)、不同氮源、最佳氮源添加量(2.0~4.0 g/L)、不同金属离子、最佳金属离子添加量(0.8~2.4 mmol/L)对菌株D6胞外多糖产量的影响。
1.3.4 新鞘氨醇杆菌D6发酵条件优化
使用最优发酵培养基,采用单因素试验,在500 mL三角瓶中探究不同培养条件,即分别测定发酵温度(20~40 ℃)、转速(150~300 r/min)、装液量(50~200 mL)、种龄(18~36 h)和接种比例(1%~15%, 体积分数)对菌株D6胞外多糖产量的影响。
1.3.5 测定方法
OD600值的测定:每6 h取样1 mL,以空白培养基为对照,于酶标仪600 nm处测定吸光值,根据实际情况,用无菌水将发酵液稀释至OD600值<1.5,将测得的数值乘以相应稀释倍数,即为发酵液的实际吸光值。
菌体干重的测定:发酵结束后,取10 mL发酵培养基加入20 mL无菌水,混匀,沸水浴20 min冷却,13 000 r/min 30 min离心,收集沉淀,用无菌水洗涤沉淀,放置于鼓风干燥箱将菌体沉淀烘干至恒重。
1.3.6 发酵工艺响应面实验
根据单因素试验结果,选取蔗糖添加量(A)、豆粕粉添加量(B)、硫酸锰添加量(C)为自变量,利用Design-expert 软件进行Box-Behnken试验设计,以D6胞外多糖产量为响应值,进行3因素3水平的试验确定最优发酵条件。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design
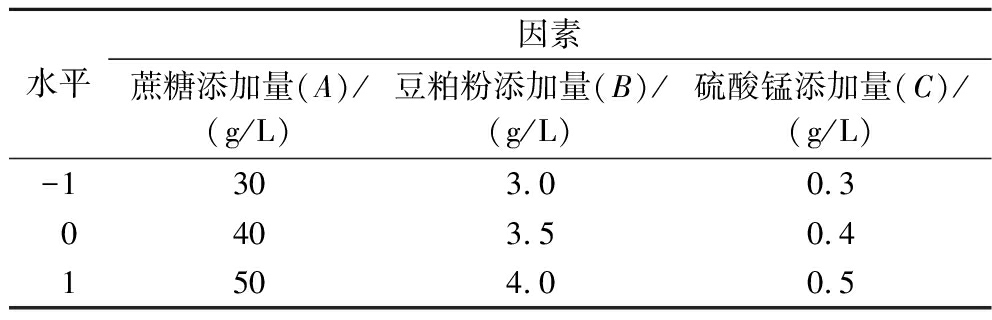
水平因素蔗糖添加量(A)/(g/L)豆粕粉添加量(B)/(g/L)硫酸锰添加量(C)/(g/L)-1303.00.30403.50.41504.00.5
1.3.7 胞外多糖的分离纯化
发酵液沸水浴20 min,冷却,13 000 r/min 30 min离心收集上清液加入2 倍体积无水乙醇,4 ℃过夜沉淀,13 000 r/min 15 min离心收集沉淀,60 ℃烘干,去离子水复溶。参照蔡国林[14]的方法对多糖进行纯化。于20 mmol/L磷酸盐缓冲液(pH 7.0)溶解,上样于DEAE-Sepharose色谱柱,利用梯度NaCl-磷酸盐缓冲液洗脱,流速1 mL/min,利用苯酚硫酸法示踪多糖含量,按峰合并含糖洗脱液,经透析、冷冻干燥,得到纯化的胞外多糖。
1.3.8 胞外多糖的组成成分分析
参考陈艳丽[15]的方法测定纯化的胞外多糖样品的中性糖、糖醛酸含量;采用秦方等[16]的方法乙酰基含量。
1.3.9 胞外多糖纯度和分子质量测定
采用蔡国林[14]的方法测定多糖EPS-3的分子质量。多分散性指数(polydispersity)采用公式(1)计算,聚合度(degree of polymerization, DP)采用公式(2)计算:
多分散性指数![]()
(1)
聚合度![]()
(2)
式中:Mw,重均分子质量;Mn,数均分子质量。
1.3.10 胞外多糖的物理特性分析
采用Brookfield DV2T黏度计测定不同浓度多糖溶液在不同温度、不同剪切速率下的黏度变化,分析其流变特性[17]。
称取5 mg多糖于铝制坩埚内,压盖密封,置于TGA2热重分析仪,以10 ℃/min的速率升温,采集50~600 ℃的热失重数据绘制热重曲线(thermogravimetric, TG)、微商热重曲线(derivative thermogravimetric, DTG)[18]。
0.5、1.0、1.5 g/L 胞外多糖水溶液与等量的疏水性底物(橄榄油、甲苯、正己烷、十六烷、石油醚)以体积比1∶1混合,使用涡旋振荡仪涡旋5 min后,再使用手持均质机在18 000 r/min条件下均质10 min,室温静置,分别于1、24、48、72 h测定乳化率作为乳化指数(emulsifying index, EI),乳化率为乳化层体积与总体积的比[19]。
1.3.11 胞外多糖单糖组成分析
参照乔梦如[20]的方法,采用基于PMP柱前衍生HPLC法测定EPS-3的单糖组成。
1.3.12 傅里叶红外光谱
称取1 mg 多糖EPS-3,于玛瑙研钵中与100 mg KBr混合均匀,研磨后压片,制成直径7 mm薄片,使用傅里叶红外光谱仪对其进行测试,以空气为背景,扫描范围:4 000~400 cm-1;扫描次数:32次;分辨率:16 s-1,使用OMNIC进行数据采集和图谱分析[14]。
1.4 数据处理
使用Origin 2023、Excel 2021软件绘图,使用Design Expert 13软件进行试验设计,采用SPSS 27进行数据分析统计,实验数据以均值±标准差表示。
2 结果与分析
2.1 新鞘氨醇杆菌的鉴定
新鞘氨醇杆菌经丹宁媒染和电镜观察(图1),发现存在大量蓝色物质环绕在细胞周围,表明该菌株可分泌大量的胞外多糖物质。
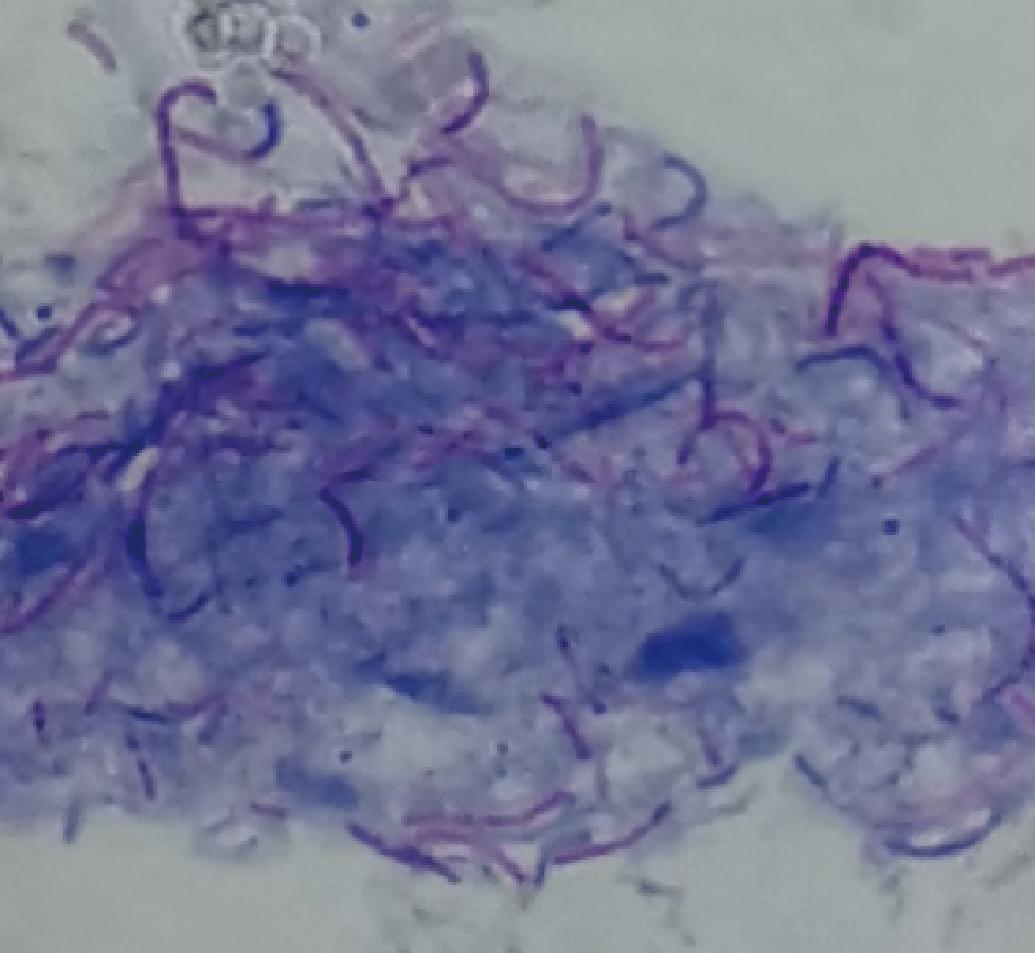
图1 D6菌落丹宁染色图
Fig.1 Tannins staining plot of D6
2.2 新鞘氨醇杆菌D6生长曲线及产糖曲线
菌株D6生长曲线及产糖曲线如图2所示,在发酵过程中,菌液pH基本不变,菌株保持在弱酸性环境下生长。菌体的生长和胞外多糖的分泌具有同步性,在接种后的6 h内进入菌对数生长期,菌体量迅速增加;50 h后达到稳定期,72 h时OD600值达到7.13±0.07。而胞外多糖(extracellular polysaccharide,EPS)的产量也在发酵过程的64 h达到最高水平,即(3.81±0.11) g/L,与已报道的N.rosa Ikeda-3[21]所产胞外多糖2.7 g/L处于相近水平。
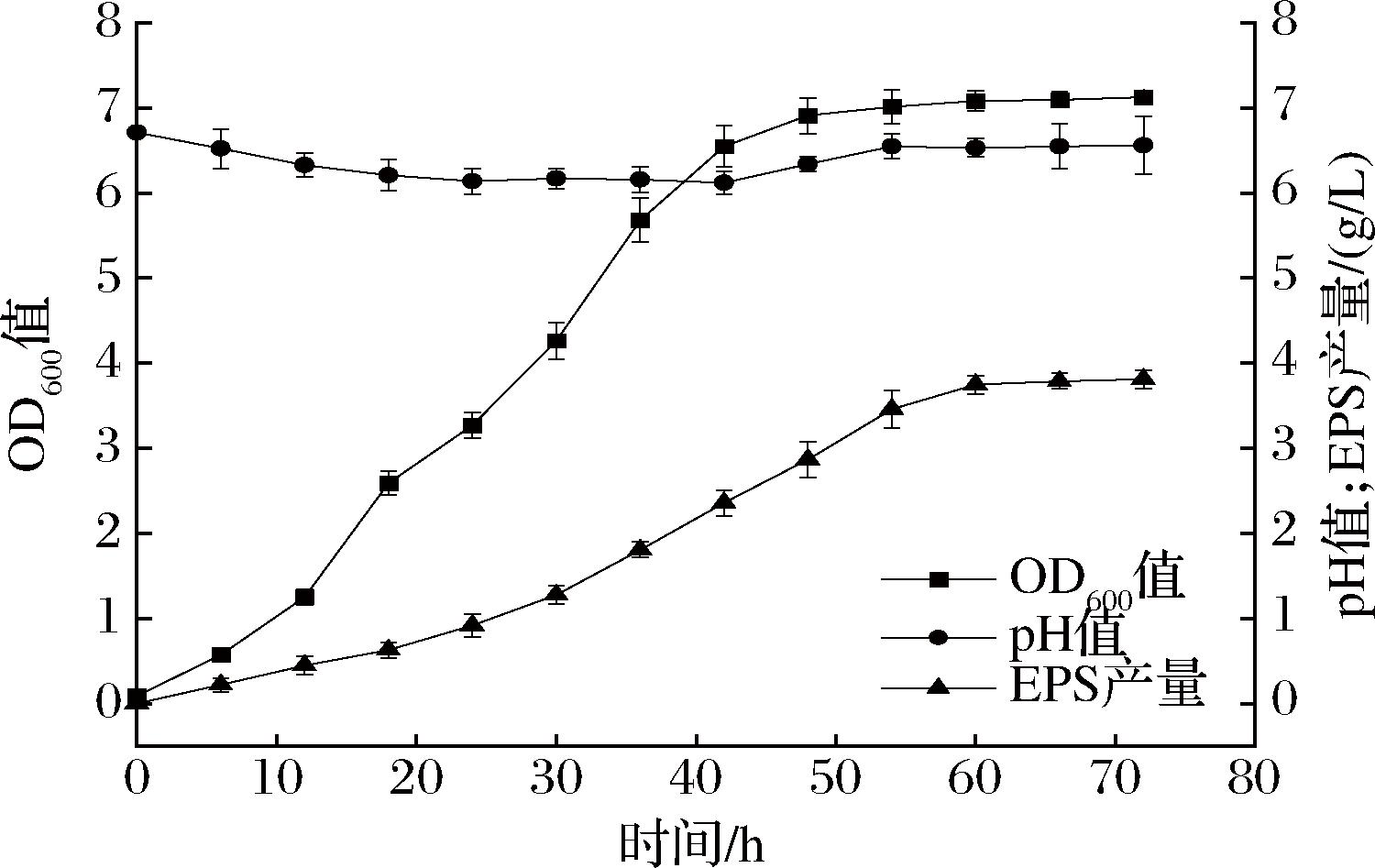
图2 D6生长曲线、产多糖曲线
Fig.2 Growth curve and polysaccharide production curve of D6
2.3 培养基组分对新鞘氨醇杆菌合成胞外多糖的影响
本研究分别选用30 g/L葡萄糖、淀粉、木糖、乳糖、蔗糖作为碳源,研究其对N.sp. D6生长和EPS产量的影响,结果如图3-A、图3-B所示,当以蔗糖为碳源时,菌株的生长和EPS产量最高。蔗糖质量浓度为40 g/L时,EPS产量达到最大值(4.66±0.14) g/L;进一步提高蔗糖浓度,EPS产量下降,推测高浓度的蔗糖产生较大的渗透压,对菌体细胞产生渗透压胁迫,不利于细胞生长和EPS的合成。
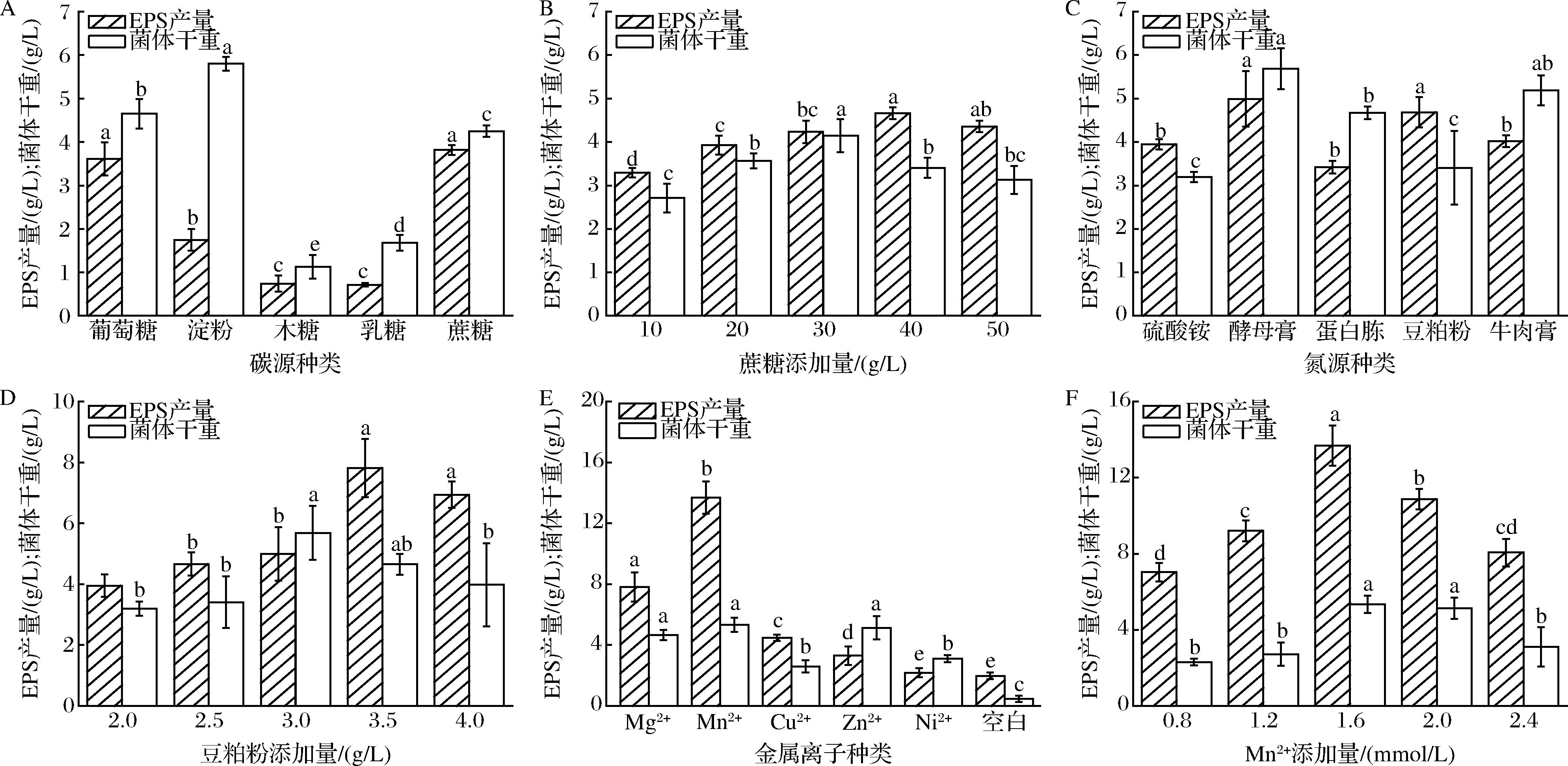
A-碳源种类;B-蔗糖添加量;C-氮源种类;D-豆粕粉添加量;E-金属离子种类;F-Mn2+添加量
图3 培养基组分对D6生长和EPS产量的影响
Fig.3 Effects of medium component on D6 growth and EPS yield
注:不同小写字母表示差异显著(P<0.05)(下同)。
氮源对微生物的正常生理代谢至关重要。如图3-C所示,酵母膏和豆粕粉对EPS的产量接近,但是,豆粕粉为氮源时,菌体干重较酵母膏的更少,即单位细胞所产的胞外多糖更多,在提取胞外多糖时去除菌体更方便,而且,豆粕粉为农业副产品,对比酵母膏价格更低,有利于大规模应用,所以,豆粕粉是N.sp. D6产EPS的最适有机氮源。进一步考察了豆粕粉浓度对菌体生长及EPS产量的影响(图3-D),结果显示在添加3.5 g/L豆粕粉时,EPS产量达到最大值(7.81±0.96) g/L。
金属离子对于维持细胞结构稳定以及调节细胞渗透压具有重要作用,对微生物代谢也有着重要影响[22]。本研究分别考察了Mg2+、Mn2+、Cu2+、Zn2+、Ni2+等金属离子对N. sp. D6生长及EPS产量影响,结果如图3-E所示,不同二价金属离子对菌体生长及EPS合成具有不同程度的促进作用,其中Mn2+的作用最显著,EPS产量最高。本研究进一步探究了不同浓度Mn2+对N.sp. D6生长及EPS产量的影响,结果表明(图3-F),在Mn2+添加量为0.4 g/L时,EPS产量达到最高值(13.68±1.06) g/L。
2.4 发酵条件对新鞘氨醇杆菌合成胞外多糖的影响
温度对于胞外多糖合成酶的活力、胞外多糖的运输和溶解度具有重要的影响[23]。本研究采用不同温度培养N.sp. D6,结果显示(图4-A),在20~40 ℃,EPS产量先增加后减少,当温度为30 ℃时EPS产量达到最大值(13.68±0.16) g/L。

A-温度;B-转速;C-装液量;D-种龄;E-接种比例
图4 发酵条件对N.sp.D6生长和EPS产量的影响
Fig.4 Effects of fermentation conditions on D6 growth and EPS yield
在结冷胶发酵生产中溶氧(dissolved oxygen,DO)具有重要影响,一般通过控制搅拌速度和装液比例适当增加溶氧以提高结冷胶产量[24]。如图4-B所示,在摇床转速150~300 r/min范围内,EPS产量随着转速的增加呈现先增加后下降的趋势,当摇床转速为250 r/min时,EPS含量最高,为(14.98±0.31) g/L。同时,本研究在500 mL发酵瓶中考察装入不同装液量对菌体干重和EPS产量的影响,结果如图4-C所示,当装液量为100 mL/500 mL时,胞外多糖产量达到最大,为(14.95±0.43) g/L。
种龄和接种量对于工业化生产EPS和降低成本具有重要意义[25]。如图4-D所示,种龄为24 h时,EPS产量达到最大值,为(15.57±0.4) g/L;接种量为5%时(图4-E),EPS产量达到最大值,为(16.57±0.53) g/L。
2.5 响应面分析
发酵条件优化试验设计及结果见表2,以EPS产量为响应值,对中心组合试验结果进行多元回归拟合,得到EPS产量的二次回归模型方程为:Y=22.494-0.722 5A+1.04B+1.12C+0.827 5AB-0.122 5AC-0.197 5BC-2.530 75A2-3.385 75B2-1.965 75C2。模型决定系数R2=0.935 3。
表2 D6发酵条件优化响应面分析
Table 2 Response surface analysis for D6 fermentation conditions optimization
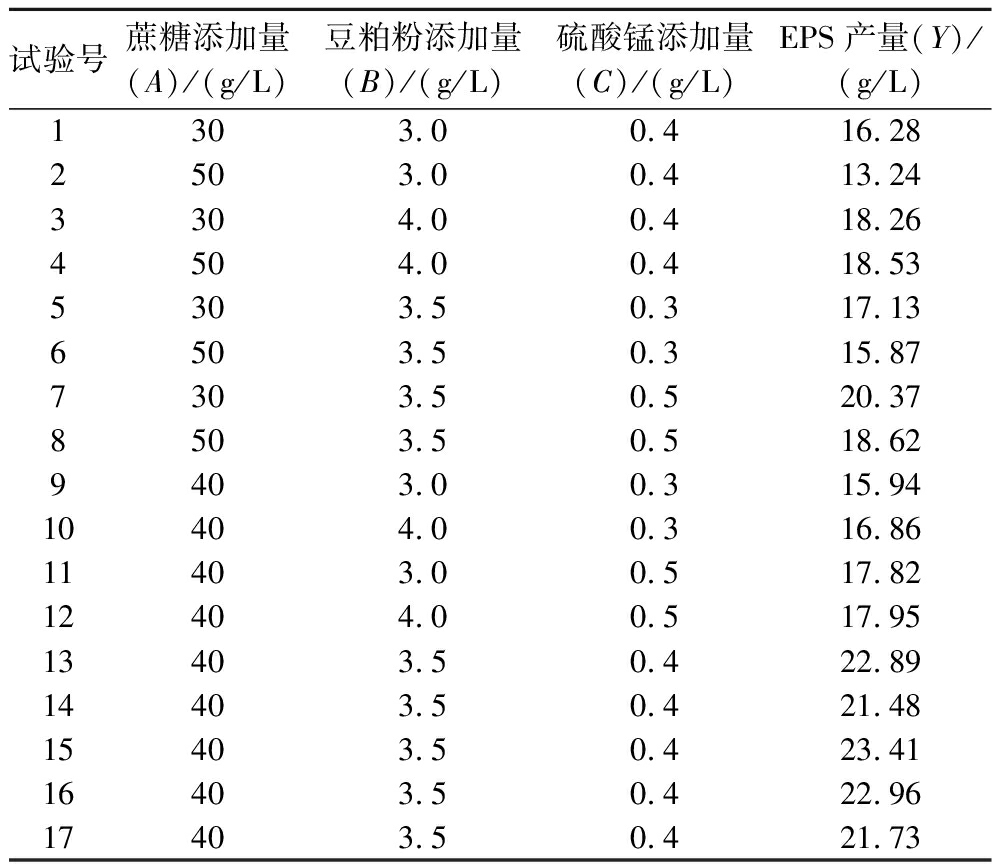
试验号蔗糖添加量(A)/(g/L)豆粕粉添加量(B)/(g/L)硫酸锰添加量(C)/(g/L)EPS产量(Y)/(g/L)1303.00.416.282503.00.413.243304.00.418.264504.00.418.535303.50.317.136503.50.315.877303.50.520.378503.50.518.629403.00.315.9410404.00.316.8611403.00.517.8212404.00.517.9513403.50.422.8914403.50.421.4815403.50.423.4116403.50.422.9617403.50.421.73
由回归模型方差分析(表3)可知,模型P值<0.05,极显著,失拟项P值>0.05,不显著,说明回归模型与实测值能较好地拟合。
表3 回归模型方差分析
Table 3 Variance analysis of regression model
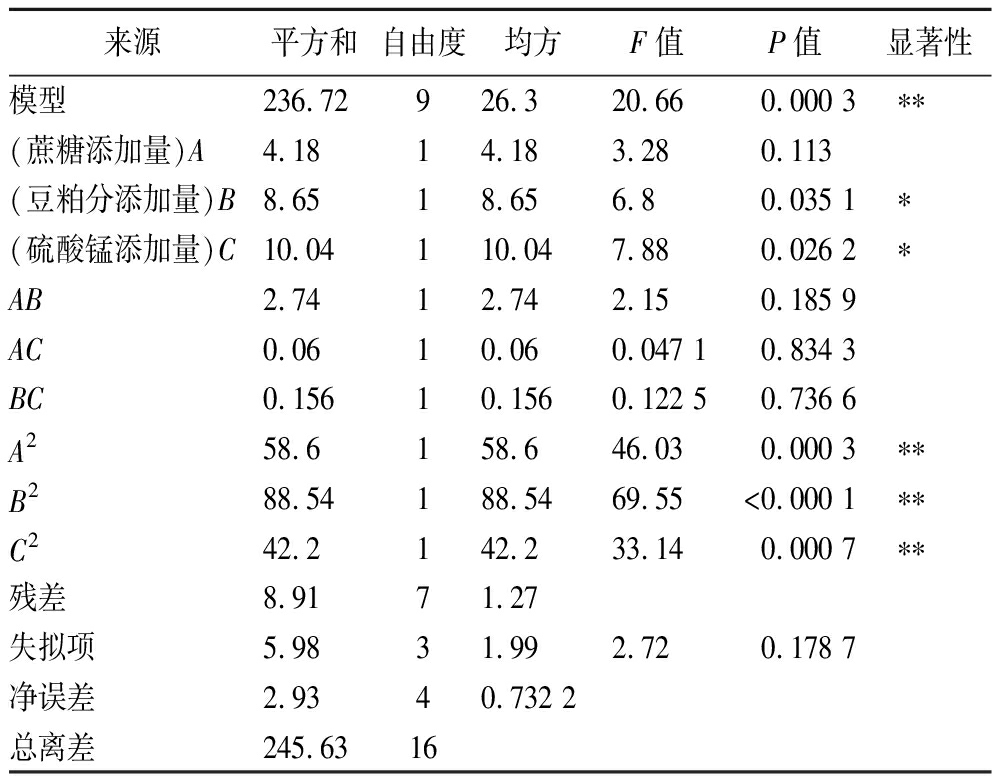
来源平方和自由度均方F值P值显著性模型236.72926.320.660.000 3∗∗(蔗糖添加量)A4.1814.183.280.113(豆粕分添加量)B8.6518.656.80.035 1∗(硫酸锰添加量)C10.04110.047.880.026 2∗AB2.7412.742.150.185 9AC0.0610.060.047 10.834 3BC0.15610.1560.122 50.736 6A258.6158.646.030.000 3∗∗B288.54188.5469.55<0.000 1∗∗C242.2142.233.140.000 7∗∗残差8.9171.27失拟项5.9831.992.720.178 7净误差2.9340.732 2总离差245.6316
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
采用Design-Expert 13.0.1 对回归方程进行求解,得到D6产EPS的最优发酵培养基为:蔗糖添加量38.72 g/L、豆粕添加量为3.57 g/L、硫酸锰添加量为0.43 g/L,在此条件下,EPS产量理论值为22.77 g/L。为便于实际操作,将最优发酵培养基调整为:蔗糖添加量39.0 g/L、豆粕添加量为3.6 g/L、硫酸锰添加量为0.4 g/L,在此条件下进行3次验证试验,得到平均产糖率为(22.38±0.43) g/L,其与理论值接近,说明模型和实际情况拟合程度高,证明该模型可行,与优化前比较,EPS产量提高了5.87倍。
2.6 新鞘氨醇杆菌胞外多糖的结构表征
2.6.1 胞外多糖分离纯化
经粗提的EPS为混合多糖,本研究利用弱阴离子交换层析DEAE-Sepharose Fast Flow 对其进行进一步分离纯化,结果如图5-A所示,洗脱后共得到3个多糖组分,分别命名为EPS-1、EPS-2、EPS-3,EPS-1中91.3%为中性多糖、无糖醛酸和乙酰基;EPS-2中82.5%为中性多糖,10.7%为糖醛酸,2.6%为乙酰基;EPS-3中64.7%为中性多糖,22.3%为糖醛酸,5.2%为乙酰基,说明EPS-2和EPS-3为酸性多糖或含有酸性基团的糖类复合物。其中,EPS-3为0.5 mol/L NaCl-磷酸缓冲液洗脱峰,其带有更多的负电荷,含有更多酸性多糖和乙酰基,乙酰基含量对鞘氨醇胶的黏度有着较大的影响[5],所以本实验后续以EPS-3为研究对象。高效凝胶排阻色谱(high performance gel filtration chromatography,HPGFC)显示EPS-3为单一峰(图5-B),表明其为均一多糖,经与系列标准分子质量葡聚糖对比计算,EPS-3重均分子质量为565 kDa,略低于结冷胶S-60(520 kDa)和威兰胶(800 kDa),其多分散性指数为9.56,聚合度约为5 846。
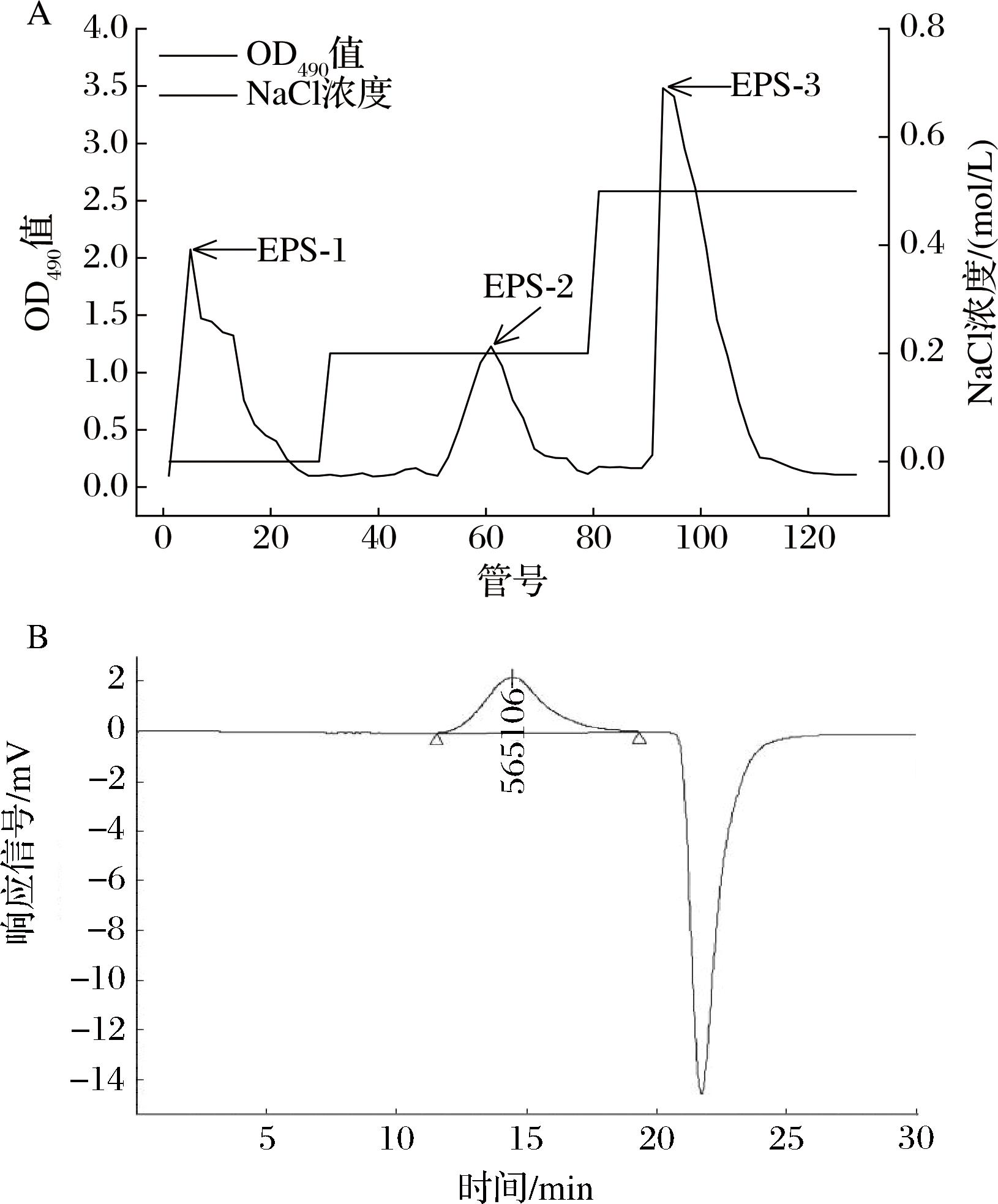
A-DEAE-Sepharose纯化多糖;B-EPS-3分子质量分析
图5 分离纯化和分子质量分析
Fig.5 Separation, purification, and MW analysis of EPS-3
2.6.2 单糖组成
基于PMP柱前衍生HPLC法(图6),鉴定EPS-3由甘露糖、半乳糖醛酸、葡萄糖和半乳糖4种单糖组成,其摩尔比为1.0∶3.7∶3.6∶2.3。
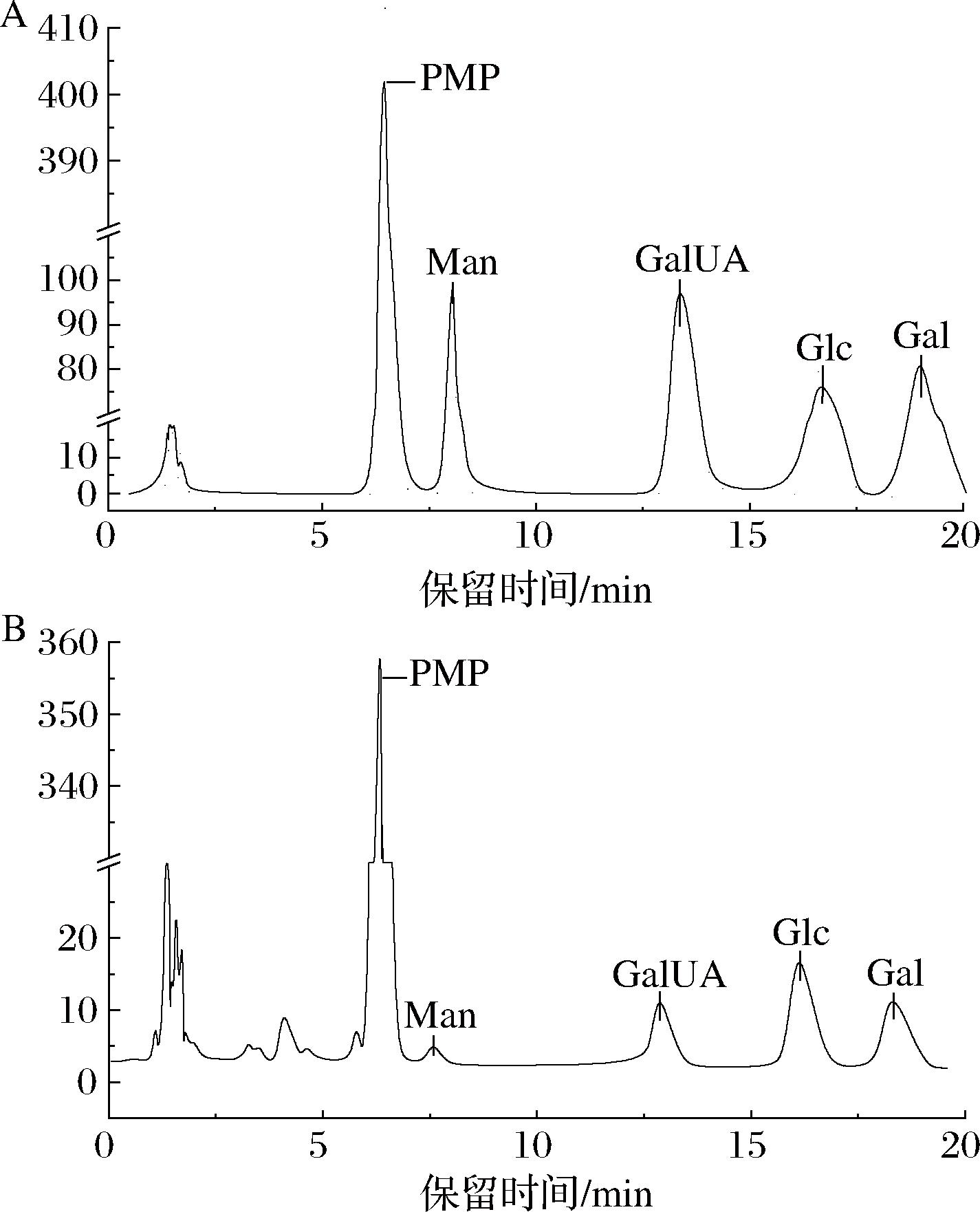
A-单糖标准品衍生化色谱图;B-胞外多糖水解液衍生化色谱图
图6 单糖标准品及D6胞外多糖水解液的HPLC色谱图
Fig.6 HPLC chromatography of monosaccharide standards and EPS hydrolysate
2.6.3 红外光谱
多糖EPS-3的红外光谱(图7)显示了其典型的多糖信号,在3 271.11 cm-1附近具有O—H伸缩振动和变形振动引起的宽而强的吸收峰,是糖类羟基的典型吸收峰;在2 929.69 cm-1处由于C—H拉伸振动引起的吸收峰,为糖类亚甲基的吸收峰;在1 721.22 cm-1处有强吸收峰则表示多糖含有羰基;在1 603.71 cm-1和1 408.38 cm-1附近具有由C—O伸缩振动形成的COO—的特征吸收峰,表明样品中存在糖醛酸;1 140.01 cm-1和1 016.14 cm-1为吡喃糖环中C—O—C的C—O—H伸缩振动引起的吸收峰,表明分子中存在吡喃糖;在898.63 cm-1和809.70 cm-1
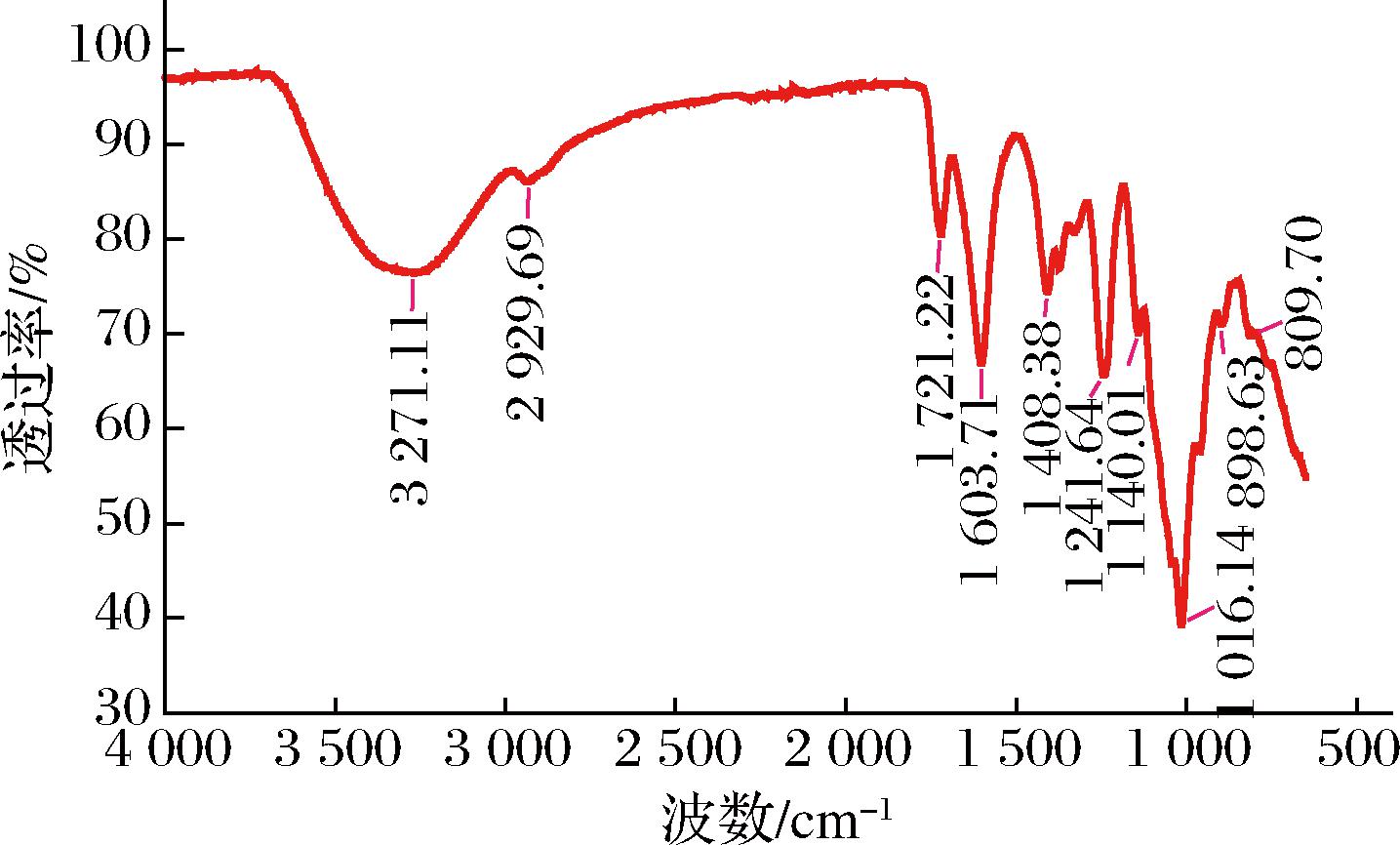
图7 胞外多糖的傅里叶红外光谱
Fig.7 FT-IR spectrum of D6 EPS
的特征吸收峰为吡喃糖1-位上αC1—H和βC1—H的伸缩振动引起,证实样品中存α型糖苷键和β型糖苷键[15]。
2.7 新鞘氨醇杆菌胞外多糖的性质表征
2.7.1 假塑性和流变性
在相同浓度下(图8-A),在20~100 ℃,随着温度升高,多糖水溶液的黏度无显著变化,表明D6胞外多糖的水溶液具有良好的热稳定性。如图8-B所示,在相同的剪切力(转速)下,随着胞外多糖浓度的增加,多糖溶液黏度增加,表明D6所产胞外多糖具有增稠性质;在相同浓度条件下,随着剪切力的增加,多糖水溶液黏度下降,发生非牛顿假塑性行为或强烈的剪切稀化行为[17]。
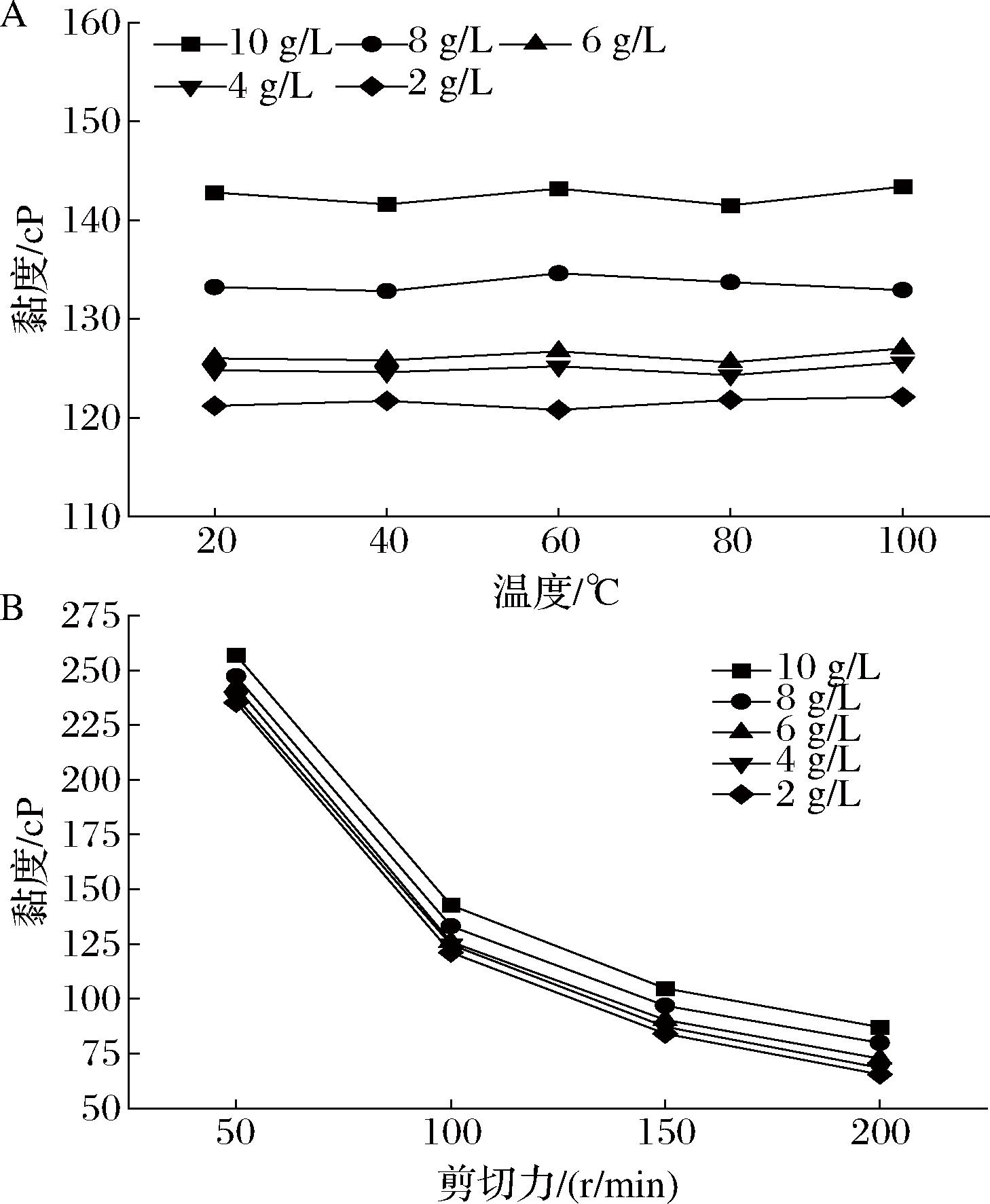
A-温度;B-剪切力
图8 D6胞外多糖水溶液在不同剪切速率、不同温度下的黏度
Fig.8 Viscosity of D6 EPS at variant shear rates and temperatures
2.7.2 乳化性
乳化剂可以将2种不溶的液相体系分散成一种液体,在一定程度上2种溶液之间保持较好的稳定性,被广泛应用于化工、食品、医药、石油等行业[26]。EPS-3水溶液对疏水性底物的乳化率如表4所示,在相同多糖浓度和时间条件下,EPS-3对石油醚的乳化率均高于其他疏水性底物,对十六烷乳化性次之。随着时间延长,同一浓度多糖溶液对同种疏水性底物的乳化性逐渐下降,48 h时,胞外多糖对十六烷、石油醚的乳化率仍在40%以上,72 h时石油醚的乳化率略有下降但仍保持在45%以上。郑梅霞等[27]研究发现,24 h时,4 g/L的低酰基结冷胶对二甲苯的乳化率为60%。以上结果表明,D6胞外多糖对十六烷、石油醚具有较好的乳化作用,推测其在石油开采领域具有一定的应用潜力。
表4 胞外多糖的乳化指数
Table 4 Emulsification index of D6 EPS

疏水性底物多糖水溶液质量浓度/(g/L)EI1/%EI24/%EI48/%EI72/%0.534.45±2.330.25±1.227.85±1.926.48±2.3橄榄油1.038.75±2.436.15±3.233.68±0.931.58±1.11.542.55±2.539.18±0.937.88±0.733.22±4.40.546.95±2.343.78±3.636.39±2.931.52±1.6甲苯 1.048.96±0.945.07±1.539.78±0.932.15±0.81.553.55±2.349.45±3.742.00±0.532.65±2.10.546.33±1.843.25±3.140.27±0.737.57±1.3正己烷1.047.75±2.645.38±2.942.00±0.538.58±0.61.549.45±3.746.05±3.238.52±2.136.25±1.20.549.28±1.345.3±1.743.78±1.839.62±1.8十六烷1.055.69±1.846.17±2.146.32±1.939.89±0.61.559.85±2.645.38±2.942.14±0.738.81±2.30.555.77±2.353.27±0.248.12±1.145.30±1.7石油醚1.058.61±0.853.68±1.750.25±1.346.17±2.11.558.89±2.655.36±0.749.73±0.545.38±2.9
2.7.3 热稳定性
不同的EPS具有不同的降解温度,具体取决于其成分。如图9所示,TG和DTG曲线显示了EPS-3在温度变化过程中的失重和热降解温度特性[28]。在加热过程中,D6胞外多糖发生2次明显的失重过程,第一阶段(50~214 ℃)为水分的损失,共损失15.33%,最大降解速率发生97.5 ℃;第二阶(214~550 ℃)为多糖的降解反应,共损失27.41%,EPS-3的降解速率增加,最大降解速率为发生在277 ℃,至324.5 ℃降解速率先减小后增大,最终残留质量为57.26%。以上结果表明,D6胞外多糖在214 ℃以下具有较好的热稳定性,超过214 ℃降解反应发生,多糖结构被破坏,影响其物理性质。D6菌株胞外多糖与结冷胶[29]和威兰胶[30]热稳定性相似。
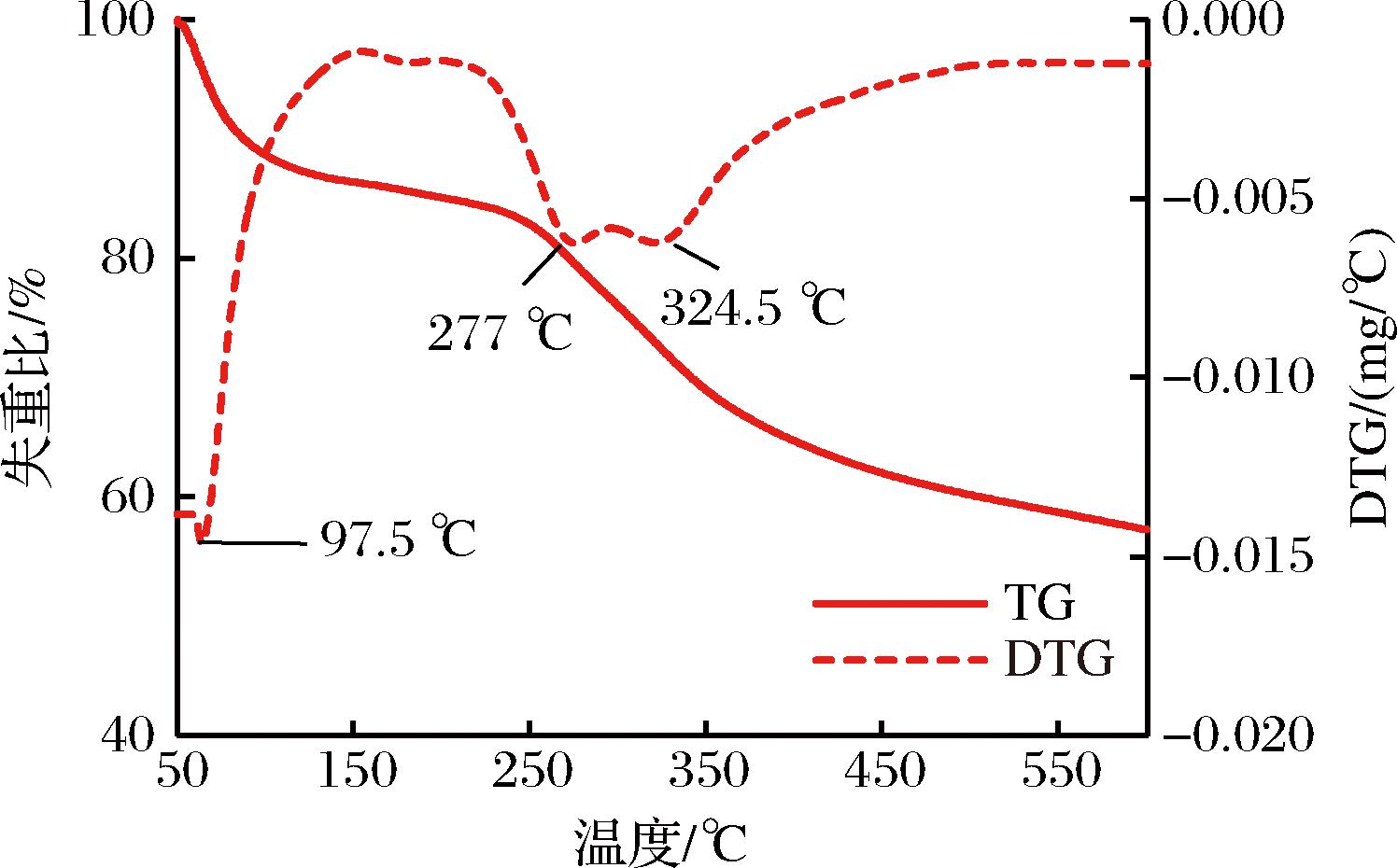
图9 EPS-3的热重分析
Fig.9 Thermal-gravimetric analysis of EPS-3
3 结论
本研究从福建药白曲中分离得到一株产胞外多糖的新鞘氨醇杆菌D6,通过单因素试验和响应面法对其产胞外多糖的发酵条件进行了优化,优化后胞外多糖产量从(3.81±0.11) g/L提高至(22.38±0.43) g/L。采用离子交换层析分离纯化胞外多糖,发现其由甘露糖、半乳糖醛酸、葡萄糖和半乳糖4种单糖组成,各单糖摩尔比为1.0∶3.7∶3.6∶2.3,其乙酰基含量为5.2%,重均分子质量为565 kDa。胞外多糖水溶液具有非牛顿假塑性行为和强烈的剪切稀化行为,在214 ℃以下具有较好的热稳定性,且对十六烷、石油醚具有一定的乳化性能。本研究为新鞘氨醇杆菌属EPS的研究和应用提供参考资料。
[1] SHARMA M, KHURANA H, SINGH D N, et al.The genus Sphingopyxis:Systematics, ecology, and bioremediation potential-A review[J].Journal of Environmental Management, 2021, 280(prepublish):111744.
[2] 刘艳如, 林勇, 郑怡, 等.深层发酵培养的虎奶菇多糖对3种小球藻的凝集作用[J].福建师范大学学报(自然科学版), 2010, 26(2):106-110.LIU Y R, LIN Y, ZHENG Y, et al.Agglutination of three kinds of Chlorella cells by polysaccharides from Pleurotus tuber-regium by submerged fermentation[J].Journal of Fujian Normal University (Natural Science Edition), 2010, 26(2):106-110.
[3] BANIK R M, KANARI B, UPADHYAY S N.Exopolysaccharide of the gellan family:Prospects and potential[J].World Journal of Microbiology and Biotechnology, 2000, 16(5):407-414.
[4] 程斌, 李晓雁, 潘奕臣, 等.三赞胶降解菌的筛选鉴定及降解产物的抗氧化活性分析[J].天津农学院学报, 2019, 26(4):43-48.CHENG B, LI X Y, PAN Y C, et al.Screening, identification of sanxan-degrading microorganisms and antioxidant activities of degradation product[J].Journal of Tianjin Agricultural University, 2019, 26(4):43-48.
[5] GARC A M C, ALFARO M C, MU
A M C, ALFARO M C, MU OZ J.Rheology of sheared gels based on low acyl-gellan gum[J].Food Science and Technology International, 2016, 22(4):325-332.
OZ J.Rheology of sheared gels based on low acyl-gellan gum[J].Food Science and Technology International, 2016, 22(4):325-332.
[6] 郑丽圆, 李宛莹, 喻林兵, 等.少动鞘氨醇单胞菌合成结冷胶研究进展[J].食品与发酵工业, 2024, 50(3):298-303.ZHENG L Y, LI W Y, YU L B, et al.Advances in the biosynthesis of gellan gum by Sphingomonas paucimobilis[J].Food and Fermentation Industries, 2024, 50(3):298-303.
[7] 温成荣. 魔芋葡甘聚糖/小分子对结冷胶类糖晶态的影响[D].福州:福建农林大学, 2014.WEN C R.The Effects of konjac glucomannan and micromolecule on crystal structure of gellan family gum[D].Fuzhou:Fujian Agriculture and Forestry University, 2014.
[8] KAUR V, BERA M B, PANESAR P S, et al.Welan gum:Microbial production, characterization, and applications[J].International Journal of Biological Macromolecules, 2014, 65:454-461.
[9] 崔志松, 邵宗泽.一株海洋新鞘氨醇杆菌phe-8(Novosphingobium sp.)的PAHs降解基因和降解特性[J].厦门大学学报(自然科学版), 2006(S1):257-261.CUI Z S, SHAO Z Z.Characterization of a PAHs degrading marine strain Novosphingobium sp.Phe-8 and its degradative genes[J].Journal of Xiamen University (Natural Science), 2006(S1):257-261.
[10] 刘晓瑞. 一株鞘氨醇杆菌合成类胡萝卜素的分子机制和代谢杂环的氧化压力研究[D].上海:上海交通大学, 2013.LIU X R.Molecular mechanism of carotenoid synthesis and oxidative stress analysis in the degradation of heterocycles by a Sphingobium yanoikuyae[D].Shanghai:Shanghai Jiaotong University, 2013.
[11] 曹舒祺, 陈梦婕, 侯贤锋, 等.新鞘氨醇单胞菌预处理对木材结构及酶解的影响[J].林产工业, 2022, 59(4):9-13.CAO S Q, CHEN M J, HOU X F, et al.Effect of Novosphingobium sp.pretreatment on the structure and enzymolysis of two kinds of wood[J].China Forest Products Industry, 2022, 59(4):9-13.
[12] REN G, WANG Z, LI Y, et al.Effects of lipopolysaccharide core sugar deficiency on colanic acid biosynthesis in Escherichia coli[J].Journal of Bacteriology, 2016, 198(11):1 576-1 584.
[13] 王萍. 鞘氨醇单胞菌的筛选鉴定及其胞外多糖的研究[D].厦门:集美大学, 2012.WANG P.Screening and indentification of Sphingomonos sp.W4-3 and the study on its exopolysaccharide[D].Xiamen:Jimei University, 2012.
[14] 蔡国林. 解淀粉芽孢杆菌胞外多糖的结构及其益生作用机制[D].无锡:江南大学, 2020.CAI G L.The structure of exopolysaccharide from Bacillus amyloliquefaciens and its probiotic mechanism[D].Wuxi:Jiangnan University, 2020.
[15] 陈艳丽. 不同海洋生境来源微生物胞外多糖的结构及抗氧化活性研究[D].青岛:中国海洋大学, 2013.CHEN Y L.Structure and antioxidant activity of different marine habitats sources extracellular polysaccharides[D].Qingdao:Ocean University of China, 2013.
[16] 秦方, 詹晓北, 朱莉, 等.Gellan Gum(激冷胶)中酰基含量的测定[J].食品与机械, 1997(5):32-33.QIN F, ZHAN X B, ZHU L, et al.Acyl determination in gellan gum[J].Food &Machinery, 1997(5):32-33.
[17] XU X P, NIE Z M, ZHENG Z Y, et al.Production and rheological properties of welan gum produced by Sphingomonas sp.ATCC 31555 with different nitrogen sources[J].Journal of Molecular Microbiology and Biotechnology, 2017, 27(1):55-63.
[18] 王之强, 王远哲, 王静伊, 等.不同增塑剂对结冷胶薄膜性能的影响[J].食品与发酵工业, 2023, 49(9):186-193.WANG Z Q, WANG Y Z, WANG J Y, et al.Effects of different plasticizers on properties of gellan gum films[J].Food and Fermentation Industries, 2023, 49(9):186-193.
[19] MENEGHINE A K, MORETTO C, CASTELLANE T C L, et al.Production, characterization and bioemulsifying activity of an exopolysaccharide produced by Sphingomonas sp.isolated from freshwater[J].Journal of Polymers and the Environment, 2017, 25(4):1080-1086.
[20] 乔梦如, 王云, 贾哲, 等.基于柱前衍生-HPLC法研究焦栀子炮制过程单糖组成及含量变化[J].中草药, 2023, 54(7):2096-2105.QIAO M R, WANG Y, JIA Z, et al.Composition and content change of monosaccharide in Gardeniae Fructus Praeparatus during heat processing based on pre-column derivatization HPLC method[J].Chinese Traditional and Herbal Drugs, 2023, 54(7):2096-2105.
[21] MATSUYAMA H, KAMESAKI T, SASAKI R, et al.Production of two types of exopolysaccharide by Novosphingobium rosa[J].Journal of Bioscience and Bioengineering, 2003, 95(2):152-156.
[22] 李兴恺, 张耀根, 姚皓昱, 等.毛韧革菌胞外多糖的结构表征、抗氧化活性研究及发酵条件优化[J].食品与发酵工业, 2022, 48(21):36-41.LI X K, ZHANG Y G, YAO H Y, et al.Structure characterization, antioxidant activity and fermentation optimization of exopolysaccharide from Stereum hirsutum NX-22[J].Food and Fermentation Industries, 2022, 48(21):36-41.
[23] ZHANG M, HONG M T, WANG Z H, et al.Temperature stress improved exopolysaccharide yield from Tetragenococcus halophilus:Structural differences and underlying mechanisms revealed by transcriptomic analysis[J].Bioresource Technology, 2023, 390:129863.
[24] DREVETON É, MONOT F, BALLERINI D, et al.Effect of mixing and mass transfer conditions on gellan production by Auromonas elodea[J].Journal of Fermentation and Bioengineering, 1994, 77(6):642-649.
[25] 于文娜, 于连升, 王烁, 等.乳酸片球菌J1产胞外多糖发酵条件优化[J].中国农学通报, 2024, 40(6):143-151.YU W N, YU L S, WANG S, et al.Exopolysaccharide production by Pediococcus acidilactici J1:Fermentation conditions optimization[J].Chinese Agricultural Science Bulletin, 2024, 40(6):143-151.
[26] ZHAO D, JIANG J, DU R P, et al.Purification and characterization of an exopolysaccharide from Leuconostoc lactis L2[J].International Journal of Biological Macromolecules, 2019, 139:1224-1231.
[27] 郑梅霞, 朱育菁, 陈峥, 等.12种食品胶的乳化性能比较研究[J].食品工业, 2018, 39(4):188-190.ZHENG M X, ZHU Y J, CHEN Z, et al.A comparative study of emulsion properties of 12 food gum[J].The Food Industry, 2018, 39(4):188-190.
[28] XUE Z H, CHEN Y, JIA Y N, et al.Structure, thermal and rheological properties of different soluble dietary fiber fractions from mushroom Lentinula edodes (Berk.) Pegler residues[J].Food Hydrocolloids, 2019, 95:10-18.
[29] VERMA S K, PANDEY V S, BEHARI M Y K.Gellan gum-g-N-vinyl-2-pyrrolidone:Synthesis, swelling, metal ion uptake and flocculation behavior[J].International Journal of Biological Macromolecules, 2015, 72:1292-1300.
[30] WANG H, CHEN F, LI D, et al.Viscosity and structure characterization of the 1-bromohexadecane-modified welan gum in the saline solution[J].Energy &Fuels, 2022, 36(12):6597-6605.