肠道是人体主要的消化器官和重要的免疫器官,不仅参与对营养物质的吸收和转运,还能够抵抗外来病原体和有害物质的入侵。肠道屏障被称为“身体健康的第一道防线”,主要由黏液层、共生细菌、肠上皮细胞和免疫细胞组成。按类型可将屏障分为以黏液层、肠上皮细胞和细胞间紧密连接结构为主的物理机械屏障,以黏蛋白、消化液和抗菌肽为主的化学屏障,以肠道内正常共生菌群为主的微生物屏障,以及以肠黏膜淋巴组织、免疫细胞和细胞因子为主的免疫屏障[1]。机械屏障是肠道屏障的主要组成部分,包括M细胞、杯状细胞、潘氏细胞、内分泌细胞和柱状上皮细胞在内的肠上皮细胞层相互协同作用,形成一个物理和免疫网络,维持肠道屏障的功能和稳态。肠上皮细胞间的紧密连接(tight junction,TJ)是细胞旁通透性的主要决定因素,由跨膜蛋白家族(Occludin和Claudin)、膜周蛋白家族(Zonula Occludens,ZO)等构成,使得相邻的细胞紧密贴合,起着选择性通透和维持细胞内环境稳态等作用[2]。多项研究已发现,许多疾病与肠道屏障功能受损有关,如肠易激综合征、炎症性肠病(克罗恩病和溃疡性结肠炎)、糖尿病等,也包括神经系统相关疾病,如重度抑郁、阿尔兹海默病和自闭症等[3]。因此,保持肠道屏障完整性对人体健康具有重要作用。
脂多糖(lipopolysaccharides,LPS)是革兰氏阴性菌细胞壁的主要成分,主要由脂质和多糖构成。LPS是免疫系统强有力的刺激物,可特异性刺激Toll样受体4(toll-like receptor 4,TLR4),导致多效性的细胞因子/趋化因子产生,触发炎症信号级联反应,进而调节炎症、先天性免疫和适应性免疫反应[4]。人体结肠内存在大量革兰氏阴性共生细菌,其与革兰氏阳性菌在健康的人体肠道中保持着平衡。然而,当肠道菌群失衡,革兰氏阴性菌丰度增加,肠腔内LPS水平的升高则会导致肠道炎症,并破坏肠上皮屏障功能。LPS透过肠屏障进入血液后,会进一步导致全身免疫反应[5]。临床研究发现在炎症性肠病和败血症患者的外周血液中LPS水平显著升高。此外,LPS还与心血管疾病、糖尿病和肥胖等慢性病有关[6]。
根据世界卫生组织(World Health Organization,WHO)的定义,益生菌是一种活的微生物,当人体摄入足够的量时会对宿主产生健康益处。例如,嗜热链球菌的胞外多糖能够通过增加肠上皮细胞间紧密连接的表达,缓解炎症反应,保护肠道屏障完整性免受LPS的破坏[7]。鼠李糖乳杆菌CY12通过上调TJ蛋白表达,减少活性氧(reactive oxygen species,ROS)积累以及通过抑制TLR4/NF-κB信号通路减少炎症细胞因子,抑制LPS诱导的Caco-2细胞肠上皮功能的损伤[8]。QIAO等[9]发现副干酪乳酪杆菌BD5115的发酵乳上清液可以通过上调MYC信号通路促进肠上皮细胞增殖,2-羟基-3-甲基丁酸可能是效应物质。
鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)属于乳酪杆菌属,是一种对机体健康具有多种有益影响的重要益生菌,被广泛用于发酵乳制品中。鼠李糖乳酪杆菌KF7是从中国云南开菲尔中分离出来的益生菌菌株,前期的研究发现该菌株在体外具有抗氧化作用[10]。目前,现有文献中尚没有关于鼠李糖乳酪杆菌KF7发酵乳上清液对肠道屏障保护作用及其机制的相关研究。因此,本研究利用Caco-2细胞(一种人结直肠腺癌细胞,其结构和功能类似于人小肠上皮细胞)构建细胞单层屏障[11],探究鼠李糖乳酪杆菌KF7发酵乳上清液对LPS诱导的屏障损伤的保护作用及其可能的作用机制,为保护人体肠道屏障提供一种有前途的功能性益生菌发酵乳制品,拓宽该菌株作为益生菌的应用范围。
1 材料与方法
1.1 材料与试剂
鼠李糖乳酪杆菌KF7,光明乳业研究院菌种保藏库;人结直肠腺癌Caco-2细胞株,上海生化细胞所。
脱脂乳粉,新西兰恒天然公司;DeMan, Rogosa and Sharpe(MRS)肉汤培养基,德国Merck公司;L-(+)-乳酸,生工生物工程(上海)股份有限公司;Minimum Essential Medium(MEM)培养基、PBS、冻存液,康宁(上海)有限公司;胎牛血清(Foetal Bovine Serum,FBS),Hyclone公司;胰蛋白酶-EDTA(0.25%)、抗生素(青霉素-链霉素),赛默飞世尔科技(中国)有限公司。
LPS、异硫氰酸荧光素-右旋糖苷(FITC-Dextran40,FD40),Sigma-Aldrich公司;Cell Counting Kit-8(CCK-8)试剂盒、丙二醛(malondialdehyde, MDA)含量检测试剂盒、ROS检测试剂盒,碧云天试剂有限公司;TaKaRa MiniBEST Universal RNA Extraction Kit,宝日医生物技术(北京)有限公司;Fast King一步法除基因组cDNA第一链合成预混试剂,天根生化科技(北京)有限公司;QuantiNova SYBR Green PCR Kit试剂盒,凯杰生物技术(上海)有限公司;qRT-PCR引物,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
Transwell小室,Greiner bioone公司;Spectra M5酶标仪,Molecular Devices公司;Milli-cell® ERS-2细胞电阻仪,Merck公司;3×32well PCR系统,Life Technologies公司;QuantStudio3实时荧光定量PCR仪,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 鼠李糖乳酪杆菌KF7发酵乳上清液和空白脱脂乳上清液的制备
根据王超越等[12]的方法,略有改动。
鼠李糖乳酪杆菌KF7发酵乳上清液的制备:将MRS固体培养基上活化得到的单菌落接种到3 mL的灭菌10%脱脂乳中,37 ℃恒温条件下发酵凝乳。将上述发酵液按照3%(体积分数,下同)的接种量接种到灭菌10%脱脂乳中继续培养20 h后,即得到鼠李糖乳酪杆菌KF7发酵乳(8.7×108 CFU/mL),pH值为4.3。9 000 r/min,4 ℃ 离心10 min,弃沉淀,将上清液pH值调至7.3后,再次9 000 r/min,4 ℃ 离心10 min,弃沉淀,取上清液,并用0.22 μm滤膜过滤作为后续干预样品,-20 ℃贮存备用。
空白脱脂乳上清液的制备:称取10%的脱脂乳粉加入无菌水中,118 ℃灭菌15 min。在10%脱脂乳中滴加L-(+)-乳酸,调整pH值至4.3。9 000 r/min,4 ℃ 离心10 min,弃沉淀,将上清液pH值调至7.3。用0.22 μm滤膜过滤作为后续干预样品,-20 ℃贮存备用。
1.3.2 CCK-8检测
根据LUO等[13]的方法,略有改动。Caco-2细胞用含20%胎牛血清和1%抗生素的MEM培养液置于37 ℃,5%CO2的细胞培养箱中培养。生长到对数期后,将Caco-2细胞以2×105个细胞每孔的浓度接种到96孔板中,培养24 h后,将培养液置换为不含胎牛血清的MEM培养液继续培养20 h。去除旧培养液,分别加入含有1%、3%、5%、8%、10%(体积分数,下同)鼠李糖乳酪杆菌KF7发酵乳上清液或空白脱脂乳上清液的MEM培养液,正常对照组(NC)为不含任何干预样品的MEM培养液。培养24 h后加入10 μL的CCK-8溶液,并在培养箱中孵育2 h。在480 nm波长下检测其吸光度值。
1.3.3 细胞单层跨上皮电阻的检测
根据HUO等[14]的方法,略有改动。生长到对数期后,将Caco-2细胞以2×105个细胞/孔的浓度接种在Transwell聚碳酸酯膜(0.4 μm孔)上,每2 d更换培养基并检测其电阻值。待单层电阻值相对稳定后,先分别加入含有1%、3%和5%鼠李糖乳酪杆菌KF7发酵乳上清液的MEM培养液并培养4 h,再加入10 μg/mL的LPS处理24 h造成细胞单层屏障损伤。分组如下:正常对照组(NC)、LPS模型组(LPS)、低剂量KF7组(1% KF7+LPS)、中剂量KF7组(3% KF7+LPS)和高剂量KF7组(5% KF7+LPS)。分别在处理前和处理后使用电阻仪测量跨上皮细胞电阻(transepithelial electrical resistance, TEER)值。TEER值及变化情况按公式(1)、公式(2)计算:
TEER/(Ω·cm2)=(TEER细胞组-TEER空白组)×Transwell聚碳酸酯膜面积
(1)
TEER变化率![]()
(2)
1.3.4 细胞单层通透性的检测
根据HUO等[14]的方法,略有改动。待电阻稳定后,在处理前后分别在Transwell插入器的上端侧加入500 μL含1 mg/mL FD40的MEM培养液,基底侧加入1.5 mL MEM培养液,培养2 h后,取100 μL基底侧培养液于96孔板中,480 nm激发波长,520 nm发射波长下检测吸光度。根据标准曲线计算2 h透过细胞单层的FD40浓度。表观渗透系数(apparent permeability coefficients, Papp)和通透性变化情况按公式(3)、公式(4)计算:
(3)
Papp的变化率![]()
(4)
式中:dQ指时间变量t的无限小变化量(dt)2 h时间内FD40通过的量=透过细胞单层的FD40浓度×培养液体积(100 μL);A是Transwell聚碳酸酯膜面积,cm2;C是FD40标记的初始质量浓度,μg/mL。
1.3.5 ROS和MDA的测定
待生长到对数期后,将Caco-2细胞以4×105个细胞每孔的浓度接种到6孔板,过夜培养后去除旧培养液,分别加入含有1%、3%和5% 鼠李糖乳酪杆菌KF7发酵乳上清液的MEM培养液,培养4 h后,加入10 μg/mL的LPS处理24 h。分别按照ROS和MDA试剂盒说明书进行测定。
1.3.6 实时荧光定量PCR
使用实时荧光定量PCR检测紧密连接蛋白相关基因ZO-1、Claudin-1、Occiudin表达;抗氧化相关基因核因子E2相关因子2(nuclear factor-erythroid 2-related factor,Nrf2)和NAD(P)H:醌氧化还原酶1[NAD(P)H:quinone oxidoreductase 1,NQO1]的表达;炎症反应相关基因,包括促炎细胞因子TNF-α、IL-1β、IL-6、IL-8,抗炎细胞因子TGF-β、IL-10,炎症信号通路NF-κB p65、髓样分化因子88(myeloid differentiation factor 88,MyD88)及下游信号分子肌球蛋白轻链激酶(myosin lightchain kinase,MLCK)的基因表达。
1.3.6.1 RNA的提取
将处于对数期的Caco-2细胞以2×105个细胞每孔的浓度接种到6孔板上,过夜培养后去除旧培养液,分别加入含有1%、3%和5%鼠李糖乳酪杆菌KF7发酵乳上清液的MEM培养液,培养4 h,再加入10 μg/mL的LPS处理24 h。根据RNA提取试剂盒说明进行操作。
1.3.6.2 cDNA的合成
按照FastKing一步法除基因组cDNA第一链合成预混试剂盒说明进行操作。
1.3.6.3 PCR扩增
所用引物序列见表1,其中β-actin为内参基因。PCR扩增体系参考QuantiNova SYBR Green PCR Kit试剂盒的说明,反应体系20 μL,循环次数40次。
表1 引物序列
Table 1 Primer sequence

名称上游引物下游引物参考文献ZO-1AGCCTTGCAAAGCCAGCTCAAGTGGCCTGGATGGGTTCATAG[12]Claudin-1TGGTCAGGCTCTCTTCACTGTTGGATAGGGCCTTGGTGTT[12]OccludinACTTCAGGCAGCCTCGTTACCCTGATCCAGTCCTCCTCCA[12]Nrf2CAGCTTTTGGCGCAGACATTAGCTCCTCCCAAACTTGCTC[15]NQO1CGGAGTGGCATTCTGCATTTCCAGGCGTTTCTTCCATCCT[15]TNF-αGAGGCCAAGCCCTGGTATGCGGGCCGATTGATCTCAGC[16]IL-1βAGCTACGAATCTCCGACCACCGTTATCCCATGTGTCGAAGAA[16]IL-6GACAGCCACTCACCTCTTCATTCACCAGGCAAGTCTCCTC[16]IL-8ACACAGAGCTGCAGAAATCAGGGGCACAAACTTTCAGAGACAG[16]TGF-βGCTGCTGTGGCTACTGGTGCCATAGATTTCGTTGTGGGTTTC[17]IL-10TCAGGGTGGCGACTCTATTGGGCTTCTTCTAAATCGTTC[17]MyD88GCATATGCCTGAGCGTTTCGTAGACCAGACACAGGTGCCA[16]NF-κB p65GTGGGGACTACGACCTGAATGGGGGCACGATTGTCAAAGATG[16]MLCKCCCGAGGTTGTCTGGTTCAAAGCAGGTGTACTTGGCATCGT[16]β-actinGTCACCAACTGGGACGACATTAGCAACGTACATGGCTGGG[12]
1.4 数据处理分析
使用GraphPad Prism 8进行统计分析及统计图的制作。所有数据均以均值 ± 标准差表示。除细胞活力、电阻和ROS含量使用t检验外,其余组间比较均使用单因素方差分析进行比较。P<0.05被认为差异具有统计学意义。显著差异由 *P<0.05,**P<0.01,***P<0.001,****P<0.000 1以及不同小写字母表示,ns及相同小写字母代表组间无显著性差异。
2 结果与分析
2.1 鼠李糖乳酪杆菌KF7发酵乳上清液和空白脱脂乳上清液对Caco-2细胞存活率的影响
为了成功利用Caco-2细胞在体外构建肠上皮单层细胞屏障模型,首先采用CCK-8法检测空白脱脂乳上清液和鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞存活率的影响,从而确定后续实验的干预范围。
如图1-a所示,与NC组相比,1%、3%和5%的空白脱脂乳上清液对Caco-2细胞的存活率无显著影响,8%和10%的空白脱脂乳上清液则对细胞存活率有显著的抑制作用(P<0.001和P<0.000 1)。

a-空白脱脂乳上清液对Caco-2细胞存活率的影响;b-鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞存活率的影响
图1 空白脱脂乳上清液和鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞存活率的影响
Fig.1 Effect of skim milk supernatant and Lacticaseibacillus rhamnosus KF7 fermented milk supernatant on Caco-2 cell viability
注:图中ns表示无显著差异、*表示P<0.05、**表示P<0.01、***表示P<0.001、****表示P<0.000 1。
如图1-b所示,与NC组相比,1%、3%和5%的鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞存活率没有抑制作用[细胞活力分别为是(101.49±0.58)%、(100.75±2.08)%、(101.82±0.44)%],其中1%,3%和5%的鼠李糖乳酪杆菌KF7发酵乳上清液还能够略微提高细胞存活率(P<0.05和P<0.01)。但8%以上的鼠李糖乳酪杆菌KF7发酵乳上清液会显著降低细胞存活率(P<0.000 1)。
以上结果表明,1%、3%和5%的空白脱脂乳上清液和鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞均无毒性作用,可以作为下一步实验的合适干预剂量。此外,本课题小组前期发表的实验结果显示单纯的脱脂乳上清液对跨上皮电阻和紧密连接蛋白相关基因的表达均无显著影响[13]。因此,后续实验中省略了空白脱脂乳上清液,直接使用经鼠李糖乳酪杆菌KF7发酵后的脱脂乳上清液做进一步的研究。
2.2 鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞单层屏障跨上皮电阻和通透性的影响
如图2-a、图2-b所示,与NC组相比,LPS显著诱导Caco-2细胞单层跨上皮电阻降低以及通透性升高(P=0.004 2,P=0.011 7)。与LPS组相比,鼠李糖乳酪杆菌KF7发酵乳上清液的干预能够显著升高细胞单层跨上皮电阻(P=0.026 7,P=0.002 4,P=0.014 1),其中高剂量KF7组显著降低Caco-2细胞单层通透性(P=0.034 6)。以上结果表明,鼠李糖乳酪杆菌KF7发酵乳上清液能够保护肠上皮细胞单层免受LPS诱导的屏障功能损伤。
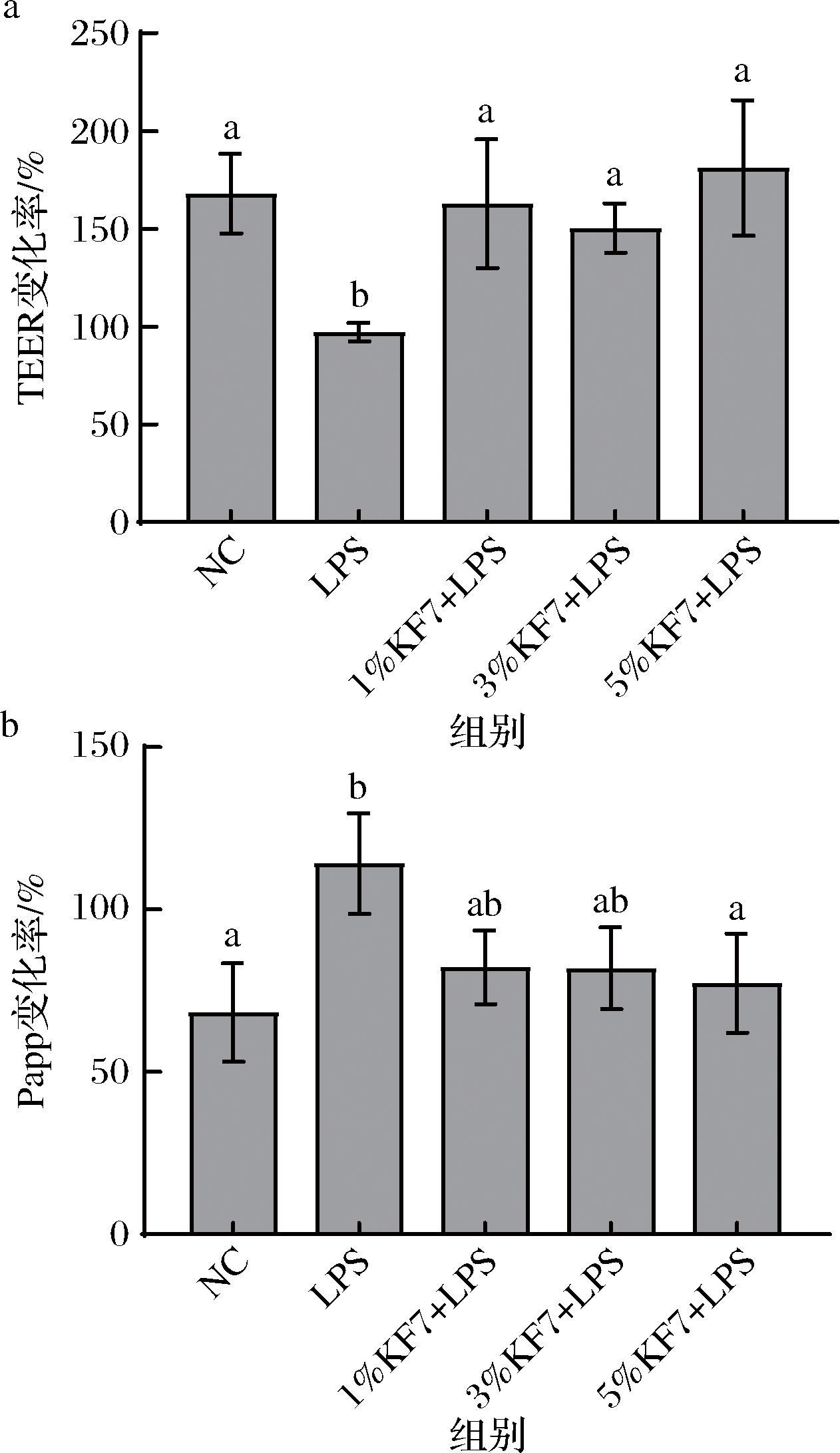
a-细胞单层跨上皮电阻;b-细胞单层通透性
图2 鼠李糖乳酪杆菌KF7发酵乳上清液对细胞单层跨上皮电阻和通透性的影响
Fig.2 Effect of Lacticaseibacillus rhamnosus KF7 fermentation of milk supernatant on TEER and permeability of cell monolayers
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞紧密连接蛋白相关基因表达的影响
如图3所示,与NC组比较,LPS组中Claudin-1和Occludin基因表达显著降低(P=0.012 7、P=0.003 9),ZO-1基因表达出现下降趋势,但无显著性差异。鼠李糖乳酪杆菌KF7发酵乳上清液的干预可以不同程度地上调由LPS引起的紧密连接蛋白相关基因表达的下降,其中高剂量的发酵乳上清液对Claudin-1和Occludin基因表达的改善作用最显著(P=0.033 3、P=0.016 2)。以上结果表明,鼠李糖乳酪杆菌KF7发酵乳上清液能够改善LPS诱导的Caco-2细胞间紧密连接蛋白相关基因的表达。
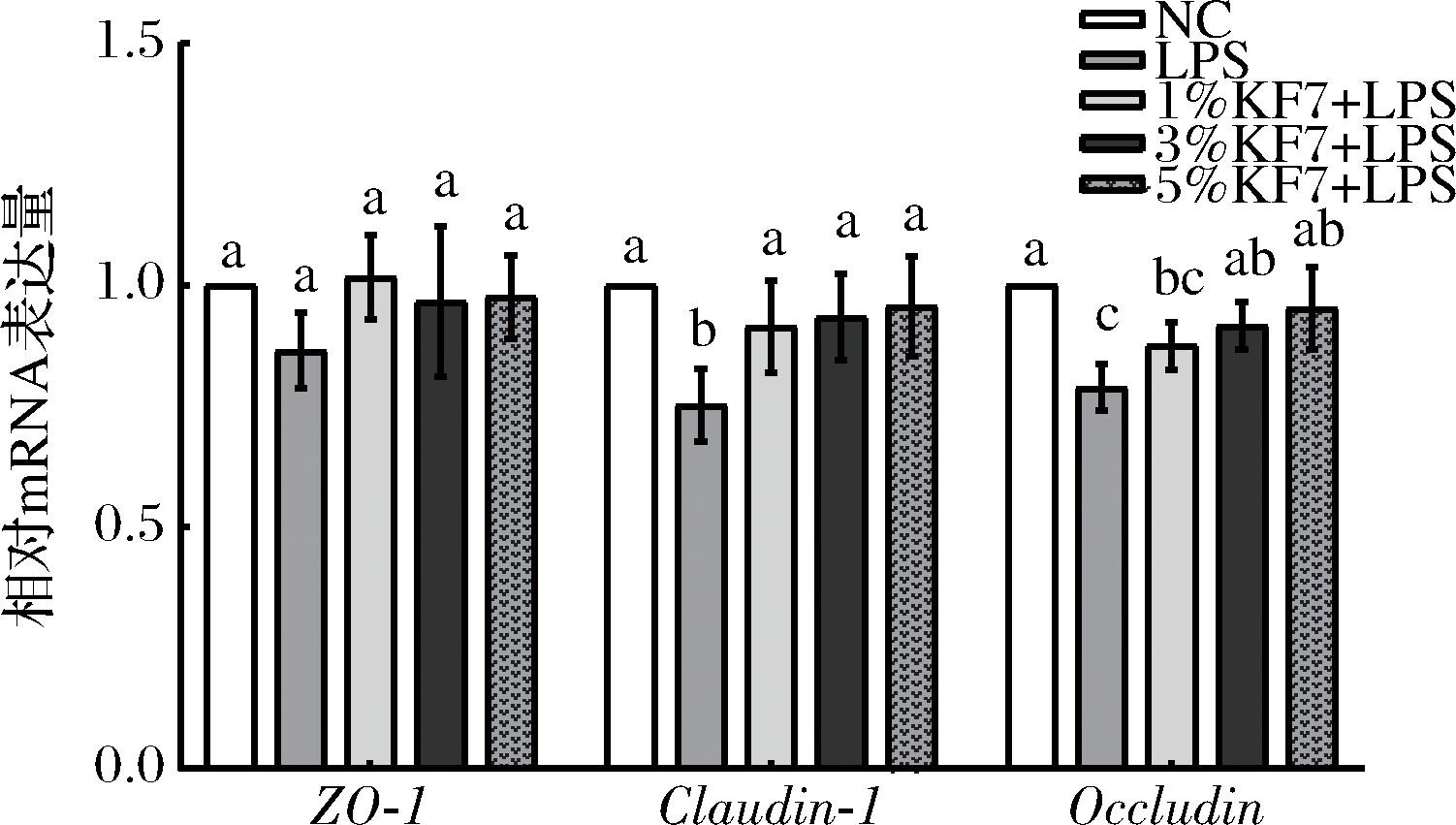
图3 鼠李糖乳酪杆菌KF7发酵乳上清液对紧密连接蛋白相关基因表达的影响
Fig.3 Effect of Lacticaseibacillus rhamnosus KF7 fermentation of milk supernatant on the expression of tight junction protein-related genes
2.4 鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞氧化应激的影响
2.4.1 鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞ROS和MDA含量的影响
如表2所示,与NC组相比,LPS诱导Caco-2细胞ROS和MDA水平显著升高(P<0.001,P<0.05)。与LPS组相比,鼠李糖乳酪杆菌KF7发酵乳上清液虽不能显著降低LPS诱导的ROS升高,但低、高剂量KF7组显著降低了MDA的含量(P<0.05)。以上结果表明,鼠李糖乳酪杆菌KF7的发酵乳上清液能够在一定程度上保护Caco-2细胞单层,降低LPS诱导的氧化应激。
表2 鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞ROS和MDA含量的影响
Table 2 Effect of Lacticaseibacillus rhamnosus KF7 fermentation of milk supernatant on ROS and MDA content in Caco-2 cells
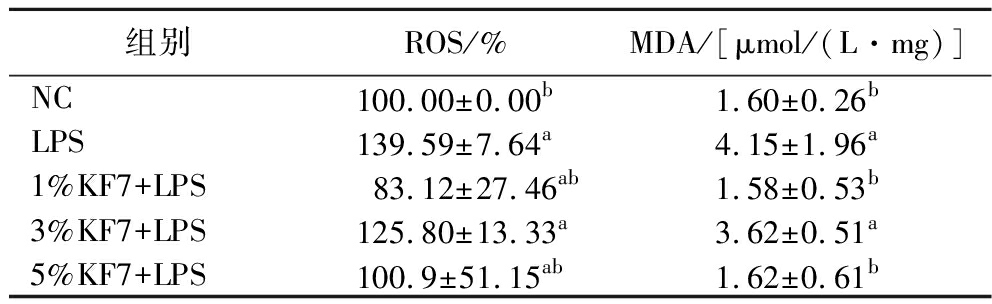
组别ROS/%MDA/[μmol/(L·mg)]NC100.00±0.00b1.60±0.26bLPS139.59±7.64a4.15±1.96a1%KF7+LPS83.12±27.46ab1.58±0.53b3%KF7+LPS125.80±13.33a3.62±0.51a5%KF7+LPS100.9±51.15ab1.62±0.61b
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4.2 鼠李糖乳酪杆菌KF7发酵乳上清液对抗氧化基因Nrf2和NQO1的影响
Nrf2抗氧化通路是已知的在人体内源性抗氧化系统中具有重要作用的通路之一,Nrf2是其中的关键因子,可调节下游抗氧化分子如NQO1的表达以拮抗氧化应激[18]。
如图4所示,与NC组相比,LPS组表现出抑制Caco-2细胞中Nrf2和NQO1表达的趋势,但没有统计学差异。与LPS组相比,鼠李糖乳酪杆菌KF7发酵乳上清液干预后,高剂量组显著上调了Nrf2和NQO1的表达水平(P=0.038 4,P=0.003 4)。以上结果表明,鼠李糖乳酪杆菌KF7的发酵乳上清液可能通过激活细胞内Nrf2/NQO1通路,降低LPS诱导的Caco-2细胞单层氧化应激水平。
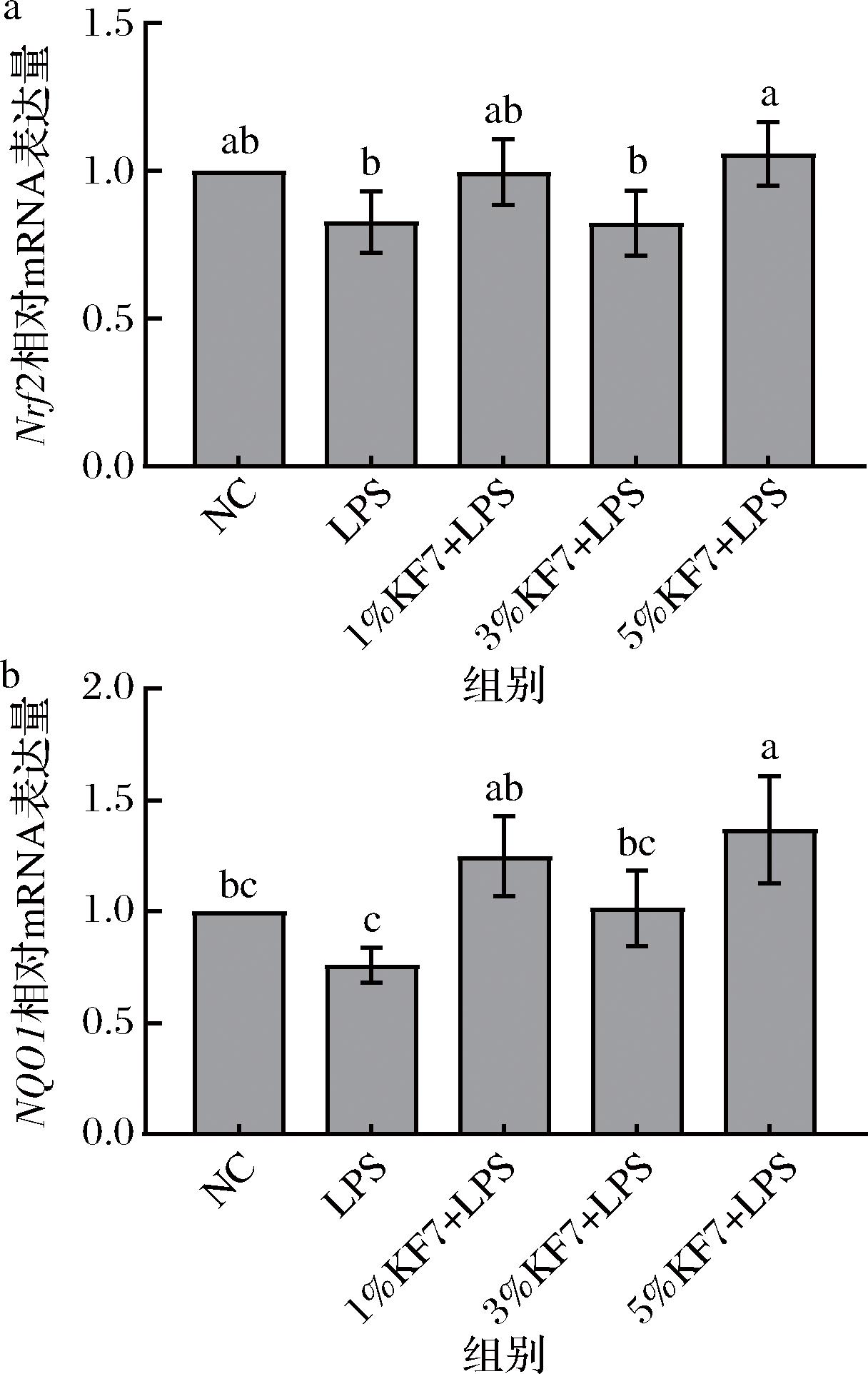
a-抗氧化基因Nrf2的表达水平;b-抗氧化基因NQO1的表达水平
图4 鼠李糖乳酪杆菌KF7发酵乳上清液对抗氧化基因表达的影响
Fig.4 Effect of Lacticaseibacillus rhamnosus KF7 fermented milk supernatant on antioxidant gene expression
2.5 鼠李糖乳酪杆菌KF7发酵乳上清液对Caco-2细胞中炎症反应的影响
2.5.1 鼠李糖乳酪杆菌KF7发酵乳上清液对促炎细胞因子的影响
如图5所示,与NC组相比,LPS组显著上调了促炎细胞因子TNF-α、IL-1β、IL-6和IL-8的表达水平(P<0.05)。相比LPS组,高剂量KF7组显著降低TNF-α的表达水平(P=0.020 5),低、中、高剂量KF7组均显著降低IL-1β和IL-6的表达水平(P<0.05),但对IL-8的表达水平影响不明显。

a-促炎细胞因子TNF-α的表达水平;b-促炎细胞因子IL-1β的表达水平;c-促炎细胞因子IL-6的表达水平;d-促炎细胞因子IL-8的表达水平
图5 鼠李糖乳酪杆菌KF7发酵乳上清液对促炎细胞因子表达水平的影响
Fig.5 Effect of Lacticaseibacillus rhamnosus KF7 fermented milk supernatant on pro-inflammatory cytokines gene expression
2.5.2 鼠李糖乳酪杆菌KF7发酵乳上清液对抗炎细胞因子的影响
由图6可知,与NC组相比,LPS组和KF7组均对TGF-β的表达水平影响不显著,但LPS可以显著下调抗炎细胞因子IL-10的表达水平(P=0.02),而相比LPS组,鼠李糖乳酪杆菌KF7发酵乳上清液均可以显著上调IL-10的表达(P<0.001)。以上结果表明,鼠李糖乳酪杆菌KF7的发酵乳上清液能够保护Caco-2细胞单层,降低因LPS诱导的炎症反应。

a-抗炎细胞因子TGF-β的表达水平;b-抗炎细胞因子IL-10的表达水平
图6 鼠李糖乳酪杆菌KF7发酵乳上清液对抗炎细胞因子基因表达的影响
Fig.6 Effect of Lacticaseibacillus rhamnosus KF7 fermented milk supernatant on anti-inflammatory cytokines gene expression
2.5.3 鼠李糖乳酪杆菌KF7发酵乳上清液对炎症信号通路及下游信号分子的影响
MyD88和NF-κB p65是炎症信号通路中的关键分子,可以调控炎症因子(TNF-α、IL-1β、IL-6和IL-8等)的表达[19]。如图7所示,与NC组相比,LPS组的MyD88和NF-κB p65基因表达水平均显著升高(P<0.001),而与LPS组相比,低、中、高剂量KF7组均能显著降低这2个基因的表达水平(P<0.001)。此外,本研究还检测了MLCK的基因表达情况,发现LPS显著增加了MLCK基因的表达(P=0.000 9),而在KF7组中其表达水平显著降低(P<0.01)。MLCK在各种组织器官中广泛表达,主要功能是催化肌球蛋白轻链(myosin light chain,MLC)的磷酸化以调节细胞的收缩,MLCK过表达可以导致相邻细胞间隙增大[20]。以上结果表明,鼠李糖乳酪杆菌KF7的发酵乳上清液可能通过抑制炎症信号通路中的关键分子改善LPS诱导的细胞炎症反应,以及炎症因子导致的细胞间通透性增加,从而恢复肠道屏障功能。
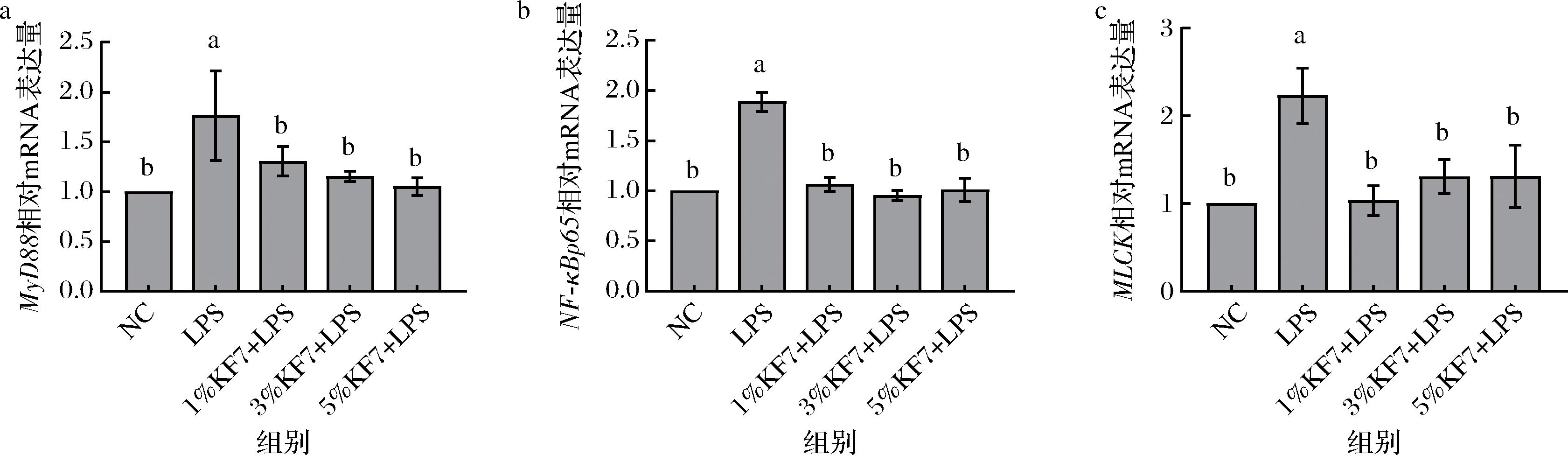
a-MyD88的表达水平;b-NF-κB p65的表达水平;c-MLCK的表达水平
图7 鼠李糖乳酪杆菌KF7发酵乳上清液对炎症信号通路及下游信号MLCK基因表达的影响
Fig.7 Effect of Lacticaseibacillus rhamnosus KF7 fermented milk supernatant on inflammatory signaling pathway and downstream signaling MLCK gene expression
3 讨论
肠道屏障完整性受损与包括炎症性肠病(inflammatory bowel disease,IBD)在内的多种肠道疾病有关,临床上常用抗生素、抗炎药、氨基水杨酸盐和皮质类固醇进行治疗,但长期使用会导致肠道内微生物群的异常改变、机体抗药性以及恶性肿瘤易感性增加等。通过饮食干预(如益生菌)来预防或改善肠道屏障可能是一个有应用的策略[21]。
来源于人结直肠腺癌的Caco-2细胞,在体外培养条件下生长并达到融合后,自发分化为肠上皮细胞,表现出成熟肠细胞的多种形态和功能特征。与其他肠炎细胞模型相比,Caco-2细胞除了可以被用于研究炎症反应以外,接种于多孔聚碳酸酯膜上的Caco-2细胞还能够形成致密的细胞单层,被广泛应用于评价营养物质和外源性物质在肠道中的转运情况,以及研究肠上皮屏障的完整性[22-23]。LPS是最常用的Caco-2细胞单层刺激剂,可在体外触发炎症反应,模拟肠上皮屏障功能障碍[24]。因此,本研究利用LPS诱导Caco-2细胞单层屏障模型损伤,研究鼠李糖乳酪杆菌KF7发酵乳上清液对屏障功能的保护作用,结果发现KF7发酵乳上清液能够保护Caco-2细胞单层屏障免受LPS诱导的炎症反应和氧化应激,上调细胞间紧密连接蛋白相关基因的表达,改善细胞单层跨上皮电阻并降低其通透性,从而恢复Caco-2细胞单层屏障完整性。
位于肠上皮细胞侧膜顶端的TJ是决定细胞旁通透性的主要因素,包括在TJ结构和通透性中起着至关重要作用的紧密连接蛋白Occludin、Claudins、ZO等。跨膜蛋白Claudin家族(Claudin-1~27)的主要功能包括维持细胞极性、屏障功能以及选择通透功能。其中,Claudin-1主要参与肠上皮屏障的形成。Occludin具有4个跨膜结构域、2个细胞外环和1个细胞内环,包含一个短N端和一个长C端。长C端与多种TJ蛋白相互作用,例如通过与ZO-1蛋白的结合,Occludin能够与肌动蛋白细胞骨架连接,从而发挥维持屏障功能的作用。ZO-1是构成TJ的重要成分之一,其表达下调或活性降低会影响细胞间紧密连接形成,阻碍肠黏膜发挥防御屏障功能,因此常被用来作为观察紧密连接屏障功能和通透性功能的指标之一[25-56]。TJ在上皮单层中的完整性可以通过量化的指标,例如TEER和异硫氰酸荧光素右旋糖苷或酚红测定的细胞旁通透性来表示,从而确定肠屏障损伤的程度[14]。已有研究发现,特定的双歧杆菌菌株干预可以使Caco-2细胞单层电阻值增加,通透性降低,但对紧密连接蛋白没有显著影响[27]。复配益生菌制剂(包含鼠李糖乳杆菌、乳双歧杆菌和长双歧杆菌)可促进Caco-2细胞单层中Claudin-1蛋白的表达,并在mRNA水平上以剂量依赖性的方式增加ZO-1的表达[28]。ZHOU等[29]发现植物乳杆菌BSG201683能降低LPS诱导的Caco-2细胞单层屏障通透性增加,上调紧密连接蛋白的表达。相似地,本研究结果表明低、中、高剂量的鼠李糖乳酪杆菌KF7发酵乳上清液能够保护Caco-2细胞单层屏障结构的完整性,将异常下降的TEER值和升高的通透性恢复到正常水平,并且显著上调Occludin和Claudin-1基因的表达。
ROS是线粒体呼吸、代谢或特定酶的副产物,是细胞日常正常代谢的结果。当ROS的产生与抗氧化能力失去平衡,就会发生氧化应激,导致DNA、蛋白质损伤和细胞凋亡[30]。MDA是脂质过氧化的生物标志物,可反映机体内脂质过氧化的程度,从而间接反映细胞损伤程度[15]。Nrf2是一种重要的转录因子,参与细胞对氧化应激的防御机制,在氧化应激下上调细胞防御中的抗氧化酶。NQO1是Nrf2的下游基因,编码NAD(P)H:醌氧化还原酶1,是一种抗细胞氧化应激的保护酶。Nrf2/NQO1信号通路的激活被认为是细胞用于抵消氧化应激的有效抗氧化防御机制[18]。在炎症过程中,肠屏障被破坏,表现为跨上皮电阻降低和细胞旁通透性增加。这种炎症过程还会伴随着氧化应激的增加,而氧化应激又会进一步损害上皮屏障。多项研究已经发现,乳杆菌具有抗氧化能力,能够改善和调节氧化应激反应。例如,深海植物乳杆菌 L.plantarum BF1-13菌株的发酵上清液可以缓解H2O2造成的Caco-2细胞单层氧化应激和TJs损伤[31]。WANG等[32]发现Lactobacillus plantarum ZDY2013和Bifidobacterium bifidum WBIN03的益生菌混合物在H2O2诱导的HT-29细胞模型和右旋糖酐硫酸钠(dextran sulfate sodium, DSS)诱导的小鼠溃疡性结肠炎模型中均具有显著的抗炎和抗氧化作用。与之相比,本研究发现,LPS 处理也会使细胞发生氧化损伤,使Caco-2细胞中ROS和MDA的含量显著升高,并在一定程度上下调Nrf2和NQO1基因的表达水平,抑制细胞内源性Nrf2/NQO1抗氧化通路;鼠李糖乳酪杆菌KF7发酵乳上清液能够有效降低细胞内MDA的含量,且在高剂量的情况下激活Nrf2/NQO1信号通路,保护Caco-2细胞免受氧化应激损伤。
TLR/MyD88/NF-κB信号通路是机体炎症体系中的重要途径,广泛存在于各种组织细胞中,参与多种疾病的发生与调控。TLR是一种跨膜蛋白,能够识别多种类型的病原相关分子模式(pathogen associated molecular pattern, PAMP),如脂多糖、病毒双链RNA等,引起机体炎症免疫应答[33]。MyD88(Myeloid Differentiation factor 88)是此通路中的重要转导蛋白,可以使信号向下游转导的重要节点。MyD88已被发现在LPS活化通路中起重要作用。给敲除MyD88基因的小鼠腹腔注射高剂量的LPS,可存活超过96 h,且血清中TNF-α、IL-1β和IL-6的含量不增加;而未敲除MyD88基因的小鼠则在96 h内全部死亡[34]。NF-κB是负责调节先天性和适应性免疫应答的主要转录因子。在机体中,NF-κB通常以p50和p65结合形成的异二聚体发挥作用。在静息状态下,异二聚体与抑制因子(inhibitory κB,IκB)结合而呈无活性的状态存在;当受到刺激时,IκB被磷酸化后发生泛素化降解,释放出p50/p65复合物,并被转运至细胞核内与特定基因启动子结合,从而调控炎症因子(TNF-α,IL-1β,IL-6和IL-8等)的表达[19]。阻断NF-κB p65可有效阻断NF-κB途径的激活[35]。TGF-β和IL-10是抗炎细胞因子,在控制肠道稳态和免疫中起着关键作用[36]。MLCK的主要功能是催化MLC的磷酸化以调节细胞的收缩。临床研究表明,在人类炎性肠病患者的回肠以及结肠组织中,MLCK表达以及肌球蛋白磷酸化水平均显著上升[37]。肠上皮细胞之间的紧密连接附近存在一个称为紧密连接周围肌动球蛋白环(perijunctional actomyosinring,PAMR)的结构。MLCK通过磷酸化MLC,引起PAMR收缩,牵引与之相连接的紧密连接蛋白,从而增大相邻细胞间隙,增加肠上皮细胞间通透性[20]。TNF-α和IL-1β已被发现分别通过激活ERK1/2 酶活性和NF-κB p65,导致MLCK高表达[38]。HUANG等[39]的研究结果发现一株分离自中国酸菜的Weissella cibaria MW01能够通过抑制NF-κB的核易位,介导MLCK-pMLC通路失活,从而降低LPS诱导的Caco-2细胞内炎症因子的表达,保护肠上皮屏障功能。与之类似,本研究也发现,鼠李糖乳酪杆菌KF7发酵乳上清液可以显著降低LPS诱导的MyD88和NF-κB p65基因的表达,下调促炎细胞因子TNF-α、IL-1β、IL-6的表达以及MLCK的表达,上调抗炎细胞因子IL-10的表达,从而降低Caco-2细胞的炎症反应并修复肠道屏障功能损伤。
综上所述,鼠李糖乳酪杆菌KF7发酵乳上清液具有保护Caco-2细胞单层屏障免受LPS诱导的肠上皮屏障功能损伤。在机制上,鼠李糖乳酪杆菌KF7发酵乳上清液可能通过增加紧密连接蛋白的表达恢复屏障结构完整,通过促进Nrf2/NQO1信号通路拮抗氧化应激,通过抑制TLR/MyD88/NF-κB信号通路及下游MLCK的基因表达改善炎症反应和肠上皮细胞间通透性。与现有其他研究相比,本研究使用鼠李糖乳酪杆菌KF7发酵乳上清液,而不是菌体作为干预样品,研究了其对肠上皮屏障功能的保护、对紧密连接蛋白表达的促进以及炎症反应的调节作用,除此以外,对细胞内氧化应激反应的改善作用也做了初步的研究。未来我们将通过动物及临床试验进一步验证和探究该菌株的发酵乳制品在改善肠道屏障功能中的作用和具体机制,为其作为一种有前途的保护肠道健康的功能性产品提供基础和支持。
[1] PETERSON L W, ARTIS D.Intestinal epithelial cells:Regulators of barrier function and immune homeostasis[J].Nature Reviews Immunology, 2014, 14(3):141-153.
[2] 赵海君, 钱易, 崔毓桂, 等.紧密连接的结构与功能[J].国际生殖健康/计划生育杂志, 2013, 32(5):384-386.ZHAO H J, QIAN Y, CUI Y G, et al.Tight junction:Structure and function[J].Journal of International Reproductive Health/Family Planning, 2013, 32(5):384-386.
[3] DE LA FUENTE M.The role of the microbiota-gut-brain axis in the health and illness condition:A focus on Alzheimer’s disease[J].Journal of Alzheimers Disease, 2021, 81(4):1345-1360.
[4] RHEE S H.Lipopolysaccharide:Basic biochemistry, intracellular signaling, and physiological impacts in the gut[J].Intestinal Research, 2014, 12(2):90-95.
[5] SODHI C P, SHI X H, RICHARDSON W M, et al.Toll-like receptor-4 inhibits enterocyte proliferation via impaired β-catenin signaling in necrotizing enterocolitis[J].Gastroenterology, 2010, 138(1):185-196.
[6] HE S S, GUO Y H, ZHAO J X, et al.Ferulic acid ameliorates lipopolysaccharide-induced barrier dysfunction via microRNA-200c-3p-mediated activation of PI3K/AKT pathway in Caco-2 cells[J].Frontiers in Pharmacology, 2020, 11:376.
[7] CHEN Y, ZHANG M, REN F Z.A role of exopolysaccharide produced by Streptococcus thermophilus in the intestinal inflammation and mucosal barrier in Caco-2 monolayer and dextran sulphate sodium-induced experimental murine colitis[J].Molecules, 2019, 24(3):513.
[8] ZHENG J S, AHMAD A A, YANG Y Y, et al.Lactobacillus rhamnosus CY12 enhances intestinal barrier function by regulating tight junction protein expression, oxidative stress, and inflammation response in lipopolysaccharide-induced Caco-2 cells[J].International Journal of Molecular Sciences, 2022, 23(19):11162.
[9] QIAO Z Y, WANG X H, WANG C Y, et al.Lactobacillus paracasei BD5115-derived 2-hydroxy-3-methylbutyric acid promotes intestinal epithelial cells proliferation by upregulating the MYC signaling pathway[J].Frontiers in Nutrition, 2022, 9:799053.
[10] 李瑞盈, 张怡琳, 游春苹.鼠李糖乳杆菌B6抗氧化活性和细胞保护作用研究[J].食品与发酵工业, 2022, 48(17):57-63.LI R Y, ZHANG Y L, YOU C P.Effects of antioxidant activity and cell protection of Lactobacillus rhamnosus B6[J].Food and Fermentation Industries, 2022, 48(17):57-63.
[11] 孟云, 徐宇航, 吴龙, 等.Caco-2单细胞模型及共培养模型的应用进展[J].中国药学杂志, 2023, 58(14):1271-1275.MENG Y, XU Y H, WU L, et al.Progress in the application of Caco-2 single cell model and co-culture model[J].Chinese Pharmaceutical Journal, 2023, 58(14):1271-1275.
[12] 王超越, 韩瑨, 郭诚笑, 等.副干酪乳酪杆菌BD5115代谢产物对肠上皮屏障完整性的增强作用及其效应物质的初步研究[J].中国微生态学杂志, 2022, 34(11):1254-1261;1268.WANG C Y, HAN J, GUO C X, et al.Enhancing effect of Lacticaseibacillus paracasei BD5115 metabolites on intestinal epithelial barrier integrity and the effectors:A preliminary study[J].Chinese Journal of Microecology, 2022, 34(11):1254-1261;1268.
[13] LUO M, LUO D, LIU J, et al.Ameliorative effect of the probiotic peptide against benzo(α)pyrene-induced inflammatory damages in enterocytes[J].International Immunopharmacology, 2022, 112:109255.
[14] HUO J Y, PEI W H, LIU G Y, et al.Huangshui polysaccharide exerts intestinal barrier protective effects through the TLR4/MyD88/NF-κB and MAPK signaling pathways in Caco-2 cells[J].Foods, 2023, 12(3):450.
[15] 冯雪, 刘雅清, 刘滨, 等.黄芩汤通过Nrf2信号通路对Caco-2细胞抗氧化应激作用的机制[J].中国实验方剂学杂志, 2023, 29(7):29-37.FENG X, LIU Y Q, LIU B, et al.Anti-oxidative stress effect and mechanism of Huangqintang on caco-2 cells through Nrf2 signaling pathway[J].Chinese Journal of Experimental Traditional Medical Formulae, 2023, 29(7):29-37.
[16] 王超越. 副干酪乳酪杆菌BD5115代谢产物对肠上皮屏障完整性的增强作用及其效应物质的初步研究[D].上海:上海海洋大学, 2023.WANG C Y.Enhancement of intestinal epithelial barrier integrity by Lactobacillus paracasei BD5115 metabolites and preliminary study of its effectors[D].Shanghai:Shanghai Ocean University, 2023.
[17] KANMANI P, KIM H.Functional capabilities of probiotic strains on attenuation of intestinal epithelial cell inflammatory response induced by TLR4 stimuli[J].BioFactors, 2019, 45(2):223-235.
[18] YU C, XIAO J H.The Keap1-Nrf2 system:A mediator between oxidative stress and aging[J].Oxidative Medicine and Cellular Longevity, 2021, 19:6635460.
[19] GILMORE T D.Introduction to NF-κB:Players, pathways, perspectives[J].Oncogene, 2006, 25(51):6680-6684.
[20] GRAHAM W V, HE W Q, MARCHIANDO A M, et al.Intracellular MLCK1 diversion reverses barrier loss to restore mucosal homeostasis[J].Nature Medicine, 2019, 25(4):690-700.
[21] CRUZ B C D S, DE SOUSA MORAES L F, DE NADAI MARCON L, et al.Evaluation of the efficacy of probiotic VSL#3 and synbiotic VSL#3 and yacon-based product in reducing oxidative stress and intestinal permeability in mice induced to colorectal carcinogenesis[J].Journal of Food Science, 2021, 86(4):1448-1462.
[22] SAMBUY Y, DE ANGELIS I, RANALDI G, et al.The Caco-2 cell line as a model of the intestinal barrier:Influence of cell and culture-related factors on Caco-2 cell functional characteristics[J].Cell Biology and Toxicology, 2005, 21(1):1-26.
[23] LIU Z W, CHEN B H.Caco-2 cell monolayers and it's application in toxicological research[J].Journal of Hygiene Research, 2004, 33(6):756-759.
[24] HUO J Y, WU Z Y, SUN W Z, et al.Protective effects of natural polysaccharides on intestinal barrier injury:A review[J].Journal of Agricultural and Food Chemistry, 2022, 70(3):711-735.
[25] SUZUKI T.Regulation of intestinal epithelial permeability by tight junctions[J].Cellular and Molecular Life Sciences, 2013, 70(4):631-659.
[26] CARIO E, GERKEN G, PODOLSKY D K.Toll-like receptor 2 enhances ZO-1-associated intestinal epithelial barrier integrity via protein kinase C[J].Gastroenterology, 2004, 127(1):224-238.
[27] AL-SADI R, DHARMAPRAKASH V, NIGHOT P, et al.Bifidobacterium bifidum enhances the intestinal epithelial tight junction barrier and protects against intestinal inflammation by targeting the toll-like receptor-2 pathway in an NF-κB-independent manner[J].International Journal of Molecular Sciences, 2021, 22(15):8070.
[28] DI VITO R, CONTE C, TRAINA G.A multi-strain probiotic formulation improves intestinal barrier function by the modulation of tight and adherent junction proteins[J].Cells, 2022, 11(16):2617.
[29] ZHOU Y, DUAN L, ZENG Y, et al.The panda-derived Lactiplantibacillus plantarum BSG201683 improves LPS-induced intestinal inflammation and epithelial barrier disruption in vitro[J].BMC Microbiology, 2023, 23(1):249.
[30] 李兴太, 张春英, 仲伟利, 等.活性氧的生成与健康和疾病关系研究进展[J].食品科学, 2016, 37(13):257-270.LI X T, ZHANG C Y, ZHONG W L, et al.Advances in generation of reactive oxygen species associated with health and diseases[J].Food Science, China, 2016, 37(13):257-270.
[31] 刁小真. 深海乳酸菌代谢产物保护Caco-2细胞紧密连接的研究[D].上海:上海海洋大学, 2018.DIAO X Z. Study on the protection of tight junction of Caco-2 cells by metabolites of deep-sea lactic acid bacteria[D]. Shanghai: Shanghai Ocean University, 2018.
[32] WANG Y Y, GUO Y L, CHEN H, et al.Potential of Lactobacillus plantarum ZDY2013 and Bifidobacterium bifidum WBIN03 in relieving colitis by gut microbiota, immune, and anti-oxidative stress[J].Canadian Journal of Microbiology, 2018, 64(5):327-337.
[33] 吴燕燕, 王易.Toll样受体信号通路中MyD88的研究进展[J].免疫学杂志, 2012, 28(3):262-265.WU Y Y, WANG Y.The progress in the MyD88-dependent receptor signaling pathway[J].Immunological Journal, 2012, 28(3):262-265.
[34] ADACHI O, KAWAI T, TAKEDA K, et al.Targeted disruption of the MyD88 gene results in loss of IL-1- and IL-18-mediated function[J].Immunity, 1998, 9(1):143-150.
[35] AHMAD R, RAINA D, JOSHI M D, et al.MUC1-C oncoprotein functions as a direct activator of the nuclear factor-kappaB p65 transcription factor[J].Cancer Research, 2009, 69(17):7013-7021.
[36] MINSHAWI F, LANVERMANN S, MCKENZIE E, et al.The generation of an engineered interleukin-10 protein with improved stability and biological function[J].Frontiers in Immunology, 2020, 11:1794.
[37] BLAIR S A, KANE S V, CLAYBURGH D R, et al.Epithelial myosin light chain kinase expression and activity are upregulated in inflammatory bowel disease[J].Laboratory Investigation, 2006, 86(2):191-201.
[38] 周子娟, 王亮, 李雅婵, 等.肌球蛋白轻链激酶与炎症性疾病关系的研究进展[J].大连医科大学学报, 2017, 39(1):78-80.ZHOU Z J, WANG L, LI Y C, et al.Research progress of myosin light chain kinase and inflammatory disease[J].Journal of Dalian Medical University, 2017, 39(1):78-80.
[39] HUANG L P, CUI K, MAO W H, et al.Weissella cibaria attenuated LPS-induced dysfunction of intestinal epithelial barrier in a Caco-2 cell monolayer model[J].Frontiers in Microbiology, 2020, 11:2039.