功能性食品可改善人们的生活,食物中的生物活性物质在疾病预防和降低异常风险中发挥着重要作用[1]。醋是发酵功能性食品,发酵后醋的营养特性直接影响到消费者的身体健康。发酵过程使用的原料尤其药食同源的原料如甘蔗、天麻和滇黄精不同,以及在发酵过程中发挥作用的微生物不同,酿造的醋表现出的风味特征也不同[2]。目前,国内外关于醋类的研究主要是传统粮食醋和以苹果、蓝莓等水果为原料的果醋,以板栗为原料的发酵醋产品鲜有报道。
板栗,是壳斗科栗属植物,原产地是中国,已有2 500多年的种植历史[3]。板栗口感细腻,气味清香,是木本粮食作物;既有经济价值,又有营养价值,富含淀粉、蛋白质、抗坏血酸、胡萝卜素等营养成分,具有健脾养胃、止血消肿、预防骨质疏松和延缓衰老等作用[4];板栗中富含的多糖、多酚、脂肪酸等生物活性成分,又赋予板栗抗氧化、清除自由基等功效。由于板栗加工产品较为单一,高附加值产品少,因此,提高板栗产品附加值,充分利用板栗资源,成为板栗深加工的研究重点。
目前,在板栗的加工中存在一些突出的问题,如板栗采收期短、易腐烂、不耐贮藏,大大降低了板栗的资源利用率。近年来,国内外的学者研究方向主要聚焦在板栗原料活性成分的研究和产品的开发,而关于板栗经过一系列深加工后的生物活性成分研究鲜有报道。多酚,是一类具有多种酚环结构的生物活性化合物,是饮食中最丰富的活性成分,大量研究表明多酚具有抗氧化、抗菌抗炎、抗癌和抗糖尿病的作用[5]。因此,本文以板栗为原料酿造板栗醋,对板栗醋中的多酚进行提取纯化,并对纯化后的多酚进行结构鉴定和减肥降脂功能的研究。本试验研究的成果可为拓宽板栗深加工领域、新型保健醋的研究开发以及板栗醋多酚的功能性研究提供理论指导和科学依据。
1 材料与方法
1.1 材料与试剂
早丰板栗,河北省唐山市迁西县;没食子酸、无水碳酸钠、氢氧化钠,天津欧博凯化工有限公司;福林酚、无水乙醇、二甲苯、多聚甲醛、10004160中性树胶,国药集团化学试剂有限公司;DM130,上海麦克林生化科技股份有限公司;6~8周龄C57BL/6雄性小鼠(许可证号:SCXK(苏)2020-0009),江苏西山生物技术有限公司;E-BC-K109-S总胆固醇比色法测试盒、E-BC-K261-M甘油三酯比色法测试盒、E-EL-M0002c ADP/Acrp30(Adiponectin) ELISA Kit、E-EL-M3008 LEP(Leptin) ELISA Kit,武汉伊莱瑞特生物科技股份有限公司;BA4097苏木素、BA4099伊红染液,珠海北索生物技术有限公司;MBS262817 Hepatic lipase(HL) ELISA Kit,艾美捷科技有限公司。
1.2 仪器与设备
HH-4数显恒温水浴锅,常州越新仪器制造有限公司;SPX-250B-Z生化培养箱,上海博迅实业有限公司医疗设备厂;HZQ-X100恒温振荡培养箱,苏州培英实验设备有限公司;L530台式低速离心机,湖南湘仪设备有限公司;UV2600A型紫外可见分光光度计,龙尼柯(上海)仪器有限公司;Q5200DB型数控超声波清洗器,昆山市超声仪器有限公司;APU-1200真空冷冻干燥机,北京五洲东方科技发展有限公司;API4000三重四级杆值质谱液质联用仪,安捷伦科技有限公司;日立7100血生化分析仪,深圳市永利鑫科技有限公司;SHZ-82电热恒温培养箱,常州智博瑞仪器制造有限公司;51119000酶标仪,赛默飞世尔有限公司。
1.3 实验方法
1.3.1 板栗醋发酵的工艺流程
板栗醋发酵的工艺流程[6]如下:
板栗去壳→打浆过滤→酶解、糖化→离心过滤→糖酸调整→酒精发酵→杀菌→醋酸发酵→离心过滤→成品灭菌
1.3.2 板栗醋中功能性成分的测定
对板栗醋中功能性成分多酚、多糖和黄酮进行测定,并与米醋、苹果醋进行对比。
1.3.2.1 板栗醋多酚含量的测定
板栗醋多酚含量的测定采用Folin-Ciocalte法[7]。准确称取5 mg没食子酸至100 mL容量瓶中并用蒸馏水定容,分别吸取0.2、0.4、0.6、0.8、1.0 mL于具塞刻度试管,加蒸馏水至1 mL,再加1 mL福林酚试剂,3 mL 20%(质量分数)碳酸钠溶液,蒸馏水定容至10 mL,混匀,30 ℃水浴静置1 h,在765 nm处测定吸光值,同时做空白对照。板栗醋稀释10倍量取1 mL,代替上述没食子酸标准溶液,用上述方法测定,将测定的吸光度值代入方程中。
1.3.2.2 板栗醋多糖含量的测定
板栗醋多糖含量的测定采用苯酚-硫酸法[8]。准确称取1 mg无水葡萄糖至100 mL容量瓶中并用蒸馏水定容,分别吸取0.2、0.4、0.6、0.8、1.0 mL于具塞刻度试管,加蒸馏水至1 mL,再加1 mL 6%(质量分数)苯酚溶液和5 mL的浓硫酸溶液,混匀,40 ℃水浴保持10 min,取出后冷水浴5 min,同时做空白对照,在490 nm处测定吸光度值。板栗醋稀释100倍吸取1 mL,代替上述的葡萄糖溶液,用上述方法测定,将测定的吸光度值代入方程中。
1.3.2.3 板栗醋黄酮含量的测定
板栗醋黄酮含量的测定参照GB/T 19777—2013 《地理标志产品 山西老陈醋》。吸取10 mL芦丁标准储备液于100 mL容量瓶并定容,吸取0.0、0.5、1.0、2.0、3.0、4.0 mL芦丁标准溶液于25 mL具塞比色管,加水至10 mL,加1 mL亚硝酸钠溶液,摇匀,放置6 min,加1 mL硝酸铝溶液,混匀,放置6 min;加4 mL氢氧化钠溶液,加水至刻度,摇匀,放置15 min,以试剂空白调节零点,在510 nm处测定吸光度。以吸光度为纵坐标,芦丁的质量为横坐标,绘制工作曲线。吸取2 mL样品溶液2份,按上述操作,其中一份不加硝酸铝溶液,做样品空白,测定吸光度,测得样品吸光度减去空白吸光度,代入方程中。
1.3.3 板栗醋多酚的提取纯化
板栗醋多酚的提取参考马妮等[9]的方法。准确称取一定量的板栗醋,设置一定料液比和乙醇体积分数,混合均匀,放置1 h后,一定温度下超声辅助提取一定时间,取出后立即以5 000 r/min离心15 min,取上清液,45 ℃蒸发浓缩至一定体积,得到板栗醋多酚提取液。提取后的多酚按照一定比例稀释,按照1.3.2.1节方法测定吸光度,代入标准曲线中,按照公式(1)计算提取量:
多酚提取量![]()
(1)
式中:C,待测溶液的多酚质量浓度,mg/mL;V,提取液体积,mL;N,稀释倍数;m,称取的板栗醋多酚溶液的质量,g。
板栗醋多酚的纯化参考WANG等[10]的方法。利用DM130大孔树脂在最佳吸附、解吸时间、树脂添加量、多酚体积、多酚质量浓度和乙醇体积分数下进行纯化,收集纯化后的多酚液,浓缩至一定体积,置于-80 ℃后进行冷冻干燥24 h,密封保存。称取一定量纯化后的板栗醋多酚,蒸馏水溶解并定容,得到板栗醋多酚的溶液,按照公式(2)计算多酚纯度:
多酚纯度![]()
(2)
式中:C,板栗醋多酚溶液的质量浓度,mg/mL;V,多酚定容体积,mL;m,纯化后板栗醋多酚干重,mg。
1.3.4 板栗醋多酚的结构鉴定
1.3.4.1 紫外光谱分析
将板栗醋多酚配制成1 mg/mL的甲醇溶液,在200~700 nm进行紫外扫描,观察其特征吸收峰,对多酚纯化物中含有的物质进行初步判定。
1.3.4.2 红外光谱分析
将1 mg板栗醋多酚与约80 mg干燥的KBr粉末于玛瑙钵中轻轻研磨,研磨均匀并压片,压片在红外光谱仪中先对纯KBr薄片进行背景扫描,再对含有样品的KBr薄片进行扫描,扫描范围4 000~400 cm-1,得到多酚的红外光谱图。
1.3.4.3 多酚组成液质联用分析
样品处理:称取1 g板栗醋多酚置于10 mL离心管中,加入5 mL 70%(体积分数)甲醇溶液,振荡混匀,超声30 min,离心,取上清液置于液相小瓶中待测。
HPLC-MS色谱条件:Agilent Poroshell 120 EC-C18色谱柱(3 mm×50 mm,2.7 μm),流动相A:0.5%甲酸水,流动相C:乙腈溶液,流速:0.6 mL/min,梯度洗脱程序:流动相C初始体积分数为5%,保持1 min,8 min后升至25%,12 min后升至60%,13 min升至100%,保持4 min,16.1 min降至5%,保持5 min。进样量:10 μL,柱温:35 ℃。
MS扫描条件:正离子扫描模式:喷雾电压5.5 kV;脱溶剂温度500 ℃,脱溶剂气(N2)1 000 L/h;负离子扫描模式:喷雾电压4.5 kV;脱溶剂温度500 ℃;脱溶剂气(N2)1 000 L/h。
1.3.5 板栗醋多酚减肥降脂功能的测定
1.3.5.1 试验分组及小鼠处理
选择6~8周龄C57BL/6雄性小鼠,20只,在温度(23±2) ℃,湿度45%~65%,12 h昼、12 h夜循环环境中提供无菌饲料和水,适应性饲养一周。
将试验小鼠均分为5组,分别为正常对照组(普通饲料、生理盐水灌胃)、高脂模型组(高脂饲料、生理盐水灌胃)、低剂量多酚组[高脂饲料、50 mg/(kg·d)板栗醋多酚灌胃]、中剂量多酚组[高脂饲料、150 mg/(kg·d)灌胃]、高剂量多酚组[高脂饲料、300 mg/(kg·d)灌胃],每天观察小鼠精神状态、食欲、死亡情况等。
试验结束前72 h从每个笼中收集粪便,并在-20 ℃下保存。在第6周试验结束,过夜禁食12 h后,通过毛细管穿刺眼眶后收集血液,收集血清。脱颈处死小鼠,快速取出肝脏、心脏等器官,清洗后吸干水分并称重,保存在-80 ℃冰箱备用。谨慎地取下小鼠的皮下脂肪组织(腹股沟皮下)和棕色脂肪组织(肩胛骨间)、肾周脂肪及附睾脂肪垫组织。
1.3.5.2 多酚对小鼠体重、脏器和脂肪的影响
对各组小鼠体重、脏器及脂肪进行称重,并分别按照公式(3)、公式(4)计算脏器系数和脂肪系数:
脏器系数![]()
(3)
脂肪系数![]()
(4)
式中:m1,各脏器质量,g;m,小鼠处死前体质量,g;m2,各脂肪质量,g。
1.3.5.3 多酚对小鼠血清水平的影响
对各组小鼠使用毛细血管眼眶取血,EP管收集,室温静置分层后,4 ℃ 3 000 r/min离心10 min。收取上清液-80 ℃保存,进行血常规检测。按照试剂盒说明测定血清中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、游离脂肪酸(free fatty acid,FFA)水平。
1.3.5.4 多酚对小鼠粪便总胆固醇和甘油三酯的影响
称取0.5 g左右粪便,加入0.1 mL PBS混匀,10 000~12 000 r/min离心10 min,取上清液按照试剂盒测定TC、TG浓度。
1.3.5.5 多酚对小鼠肝脏组织的影响
对各组小鼠肝脏拍照,观察肝脏组织形态变化,进行苏木素-伊红染色(hemat eineosin,HE)染色。
1.3.5.6 多酚对瘦素、脂联素和肝脂酶水平的影响
取出保存于-80 ℃冰箱的各组肝组织,剪取部分肝组织,剪碎后加入0.1 mL细胞裂解液进行裂解,充分研磨后10 000×g~12 000×g离心10 min,取上清液测定每组细胞的蛋白浓度,剩余部分根据试剂盒说明做ELISA检测。
1.4 数据统计分析
所有数据均表示为平均值±标准差(Mean±SD),做3次平行试验;使用单因素方差分析(one-way analysis of variance,ANOVA)检验和SPSS 26.0软件,显著性标准设定为P≤0.05;Origin 2018绘图。
2 结果与分析
2.1 板栗醋功能性成分的研究
板栗醋、米醋和苹果醋功能性成分的比较如表1所示。研究表明,发酵醋中由于含有多酚类化合物等功能性成分,具有刺激食欲、减肥、降脂、抗癌、抗高血压等有益作用[11-12]。将板栗醋与米醋、苹果醋相比,板栗醋中的多酚含量分别为苹果醋、米醋的11、22倍;多糖含量约为米醋的10倍,与苹果醋接近;黄酮含量均明显高于米醋和苹果醋。由此可知,板栗醋与米醋、苹果醋相比,其生物活性成分中多酚的相对含量最高;长期以来,多酚一直被认为具有许多促进健康的作用,因此,将多酚作为板栗醋的特征功能性成分进行深一步的研究。
表1 板栗醋、米醋、苹果醋功能性成分的比较 单位:mg/mL Table 1 Comparison of functional components of chestnut vinegar,rice vinegar and apple cider vinegar
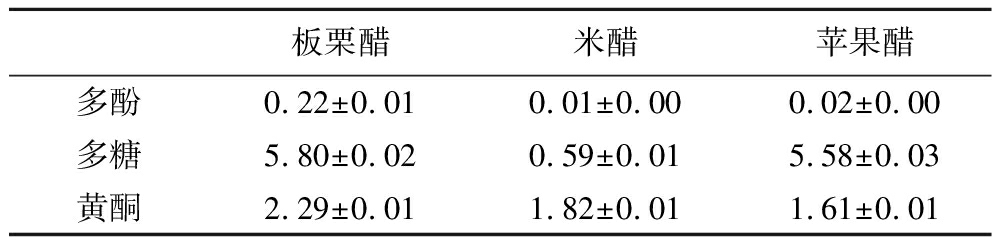
板栗醋米醋苹果醋多酚0.22±0.010.01±0.000.02±0.00多糖5.80±0.020.59±0.015.58±0.03黄酮2.29±0.011.82±0.011.61±0.01
2.2 板栗醋多酚提取纯化结果分析
通过超声波辅助提取法进行板栗醋多酚的提取,并通过单因素、正交试验进行优化,获得最佳提取条件:料液比(g∶mL)为1∶6,乙醇体积分数为60%,超声温度为60 ℃,超声时间为40 min,经优化,板栗醋多酚的提取量为207.73 mg/g。
提取后的板栗醋多酚通过DM130大孔树脂进行纯化,大孔树脂的静态吸附和解吸动力学试验表明,最佳的吸附和解吸时间分别为4 h和3 h,板栗醋多酚的最佳纯化条件为树脂添加量为3 g,多酚质量浓度为0.3 mg/mL,多酚体积为40 mL,乙醇体积分数为60%,经优化,板栗醋多酚的纯度为23.30%。
2.3 板栗醋多酚的结构鉴定结果分析
2.3.1 紫外光谱分析
采用紫外吸收光谱对酚类化合物进行结构分析和鉴定,紫外吸收光谱在210~215 nm处为多酚化合物的E2和K带,在230~235、275~280 nm处为多酚化合物的B带;其中黄酮类化合物的紫外吸收光谱在200~400 nm处有2个主要的紫外吸收带,即峰带Ⅰ 300~400 nm和峰带Ⅱ 220~280 nm;天然酚型儿茶素单体一般在270~280 nm附近有特征吸收峰;酚酸类物质一般在260~330 nm处有特征吸收峰。如图1所示,板栗醋多酚单体在带Ⅰ和带Ⅱ均具有吸收峰,符合黄酮类化合物的特征;在280 nm附近的吸收峰符合天然酚型儿茶素的特征;在260~330 nm的吸收峰符合酚酸类物质的特征;经初步鉴定,板栗醋多酚符合多酚类化合物的典型特征。
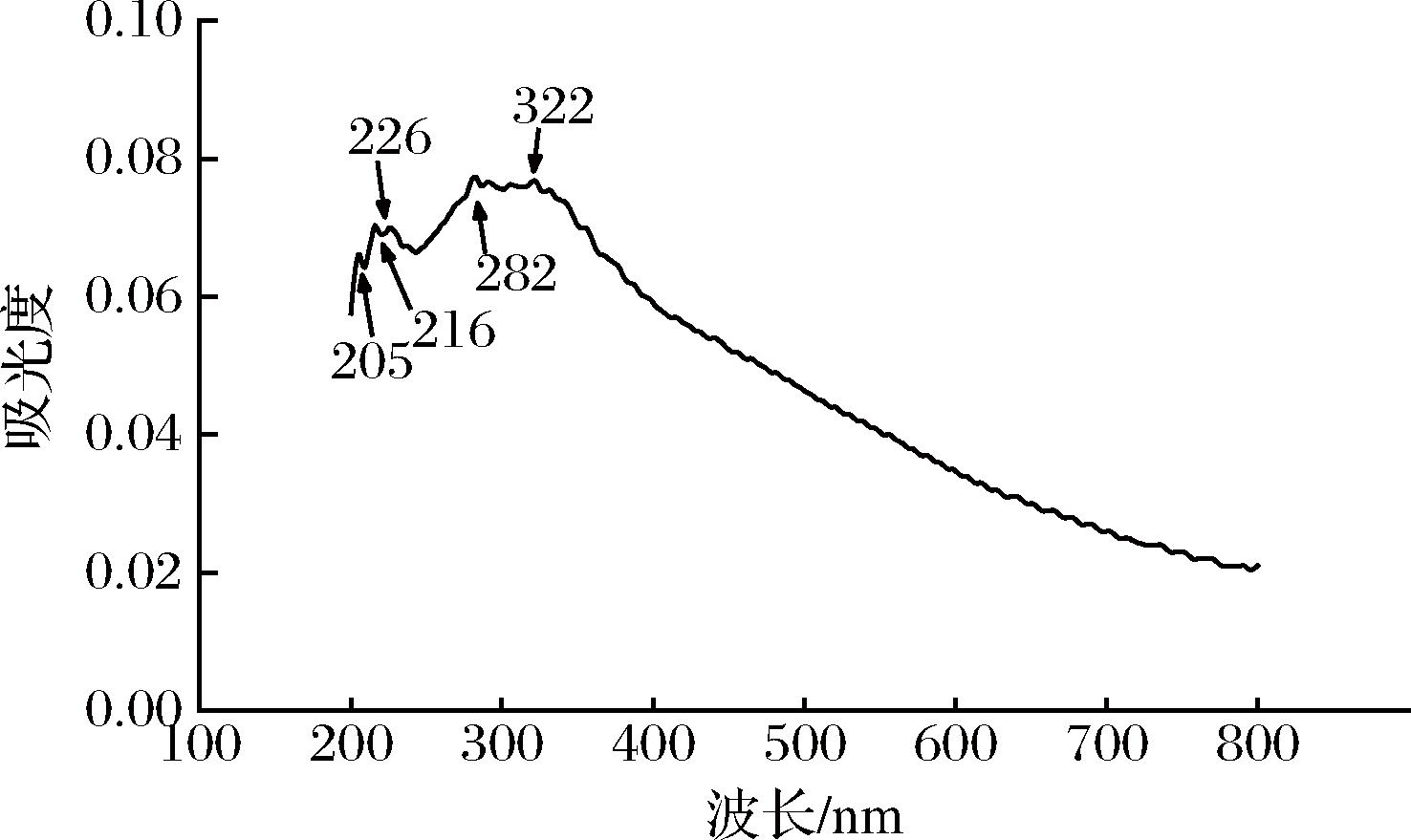
图1 板栗醋多酚的紫外吸收光谱图
Fig.1 Ultraviolet absorption spectra of polyphenols from chestnut vinegar
2.3.2 红外光谱图分析
多酚结构中含有一个或多个苯环和不同数量的羟基、羰基和羧基[13]。化合物的酚羟基的伸缩振动出现在红外波数3 400~3 200 cm-1左右;苯环上C—H键的伸缩振动出现在波数3 000~2 700 cm-1左右;C![]() O键伸缩振动出现在波数1 900~1 650 cm-1;芳环上的骨架振动出现在波数1 700~1 450 cm-1;羟基的C—O伸缩振动出现在波数1 300~1 000 cm-1,以此确定取代基情况,根据红外光谱可快速确定酮、醛、酸、酯等有机化合物的官能团,如图2所示,3 392.72、2 931.75、1 651.04、1 544.95、1 409.94、1 272.99、1 139.91、1 072.40、1 028.04 cm-1处均具有特征峰,表明化合物含有酚羟基、苯环、羧基等特征结构,具有多酚典型特征的官能团,因此,符合多酚类物质的红外光谱特征。
O键伸缩振动出现在波数1 900~1 650 cm-1;芳环上的骨架振动出现在波数1 700~1 450 cm-1;羟基的C—O伸缩振动出现在波数1 300~1 000 cm-1,以此确定取代基情况,根据红外光谱可快速确定酮、醛、酸、酯等有机化合物的官能团,如图2所示,3 392.72、2 931.75、1 651.04、1 544.95、1 409.94、1 272.99、1 139.91、1 072.40、1 028.04 cm-1处均具有特征峰,表明化合物含有酚羟基、苯环、羧基等特征结构,具有多酚典型特征的官能团,因此,符合多酚类物质的红外光谱特征。
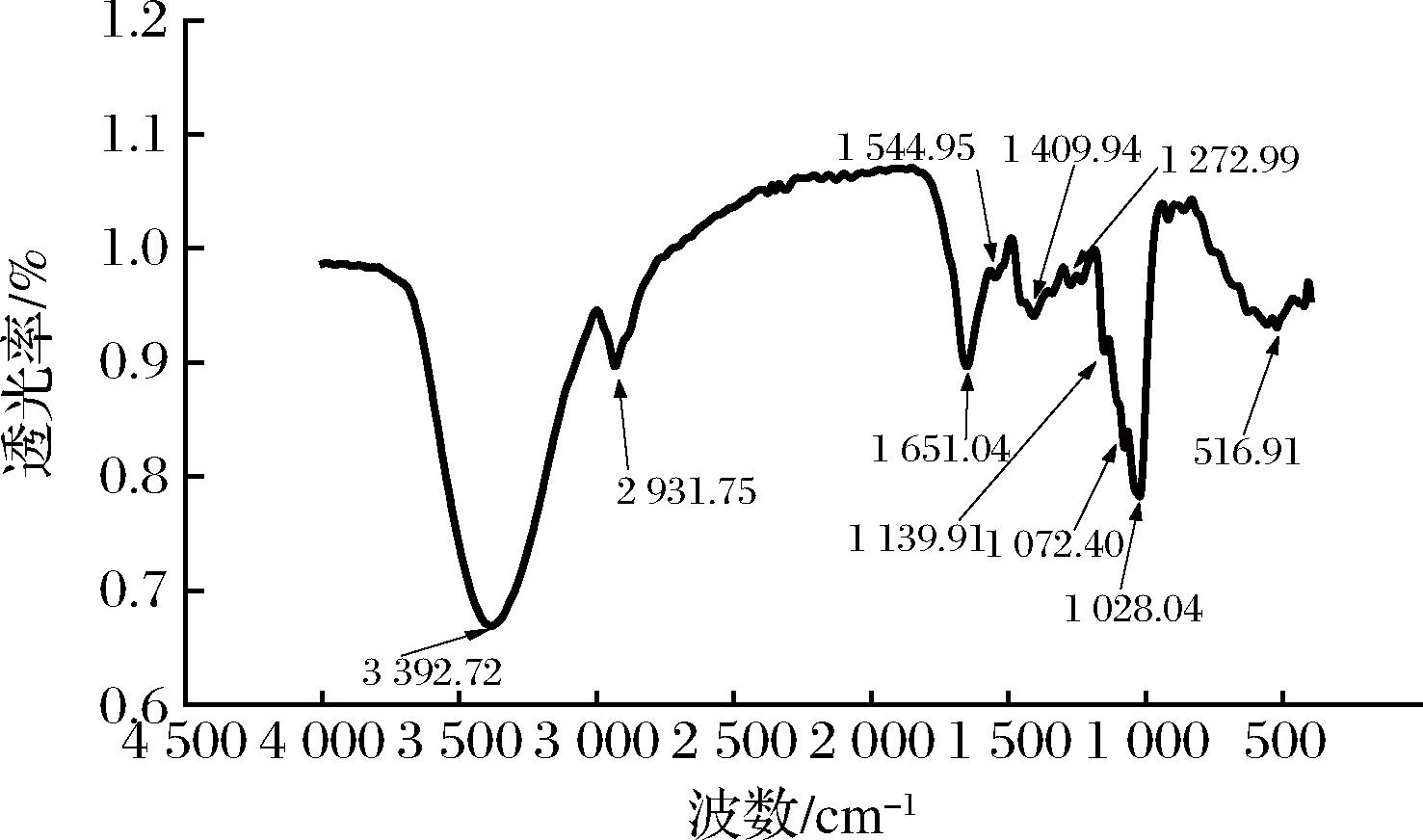
图2 板栗醋多酚的红外光谱图
Fig.2 Infrared spectra of chestnut vinegar polyphenols
2.3.3 液质联用分析
采用HPLC-MS对板栗醋多酚进行定性和定量分析,确定出板栗醋多酚化合物中存在的单个多酚,板栗醋多酚提取物中化合物的HPLC-MS鉴定结果如表2所示。板栗醋多酚提取物在正负离子模式下共鉴定出12种酚类化合物,其中负离子模式下含量较高的有芥子酸、阿魏酸和儿茶素,分别为15 395.6、8 864.4、2 821.6 ng/mL,正离子模式下含量较高的有芥子酸、丁香酸和香草酸,分别为7 315.8、6 166.5、4 995.8 ng/mL。在这些物质中,较高含量的羟基肉桂酸家族的酚酸(芥子酸、阿魏酸),与羟基苯甲酸(丁香酸、香草酸)相比,具有更高的抗氧化性,赋予了多酚化合物降低血脂、预防肝脏损伤的作用。
表2 板栗醋多酚液相色谱-质谱分析结果
Table 2 Results of chestnut vinegar polyphenols analyzed by liquid chromatography-mass spectrometry
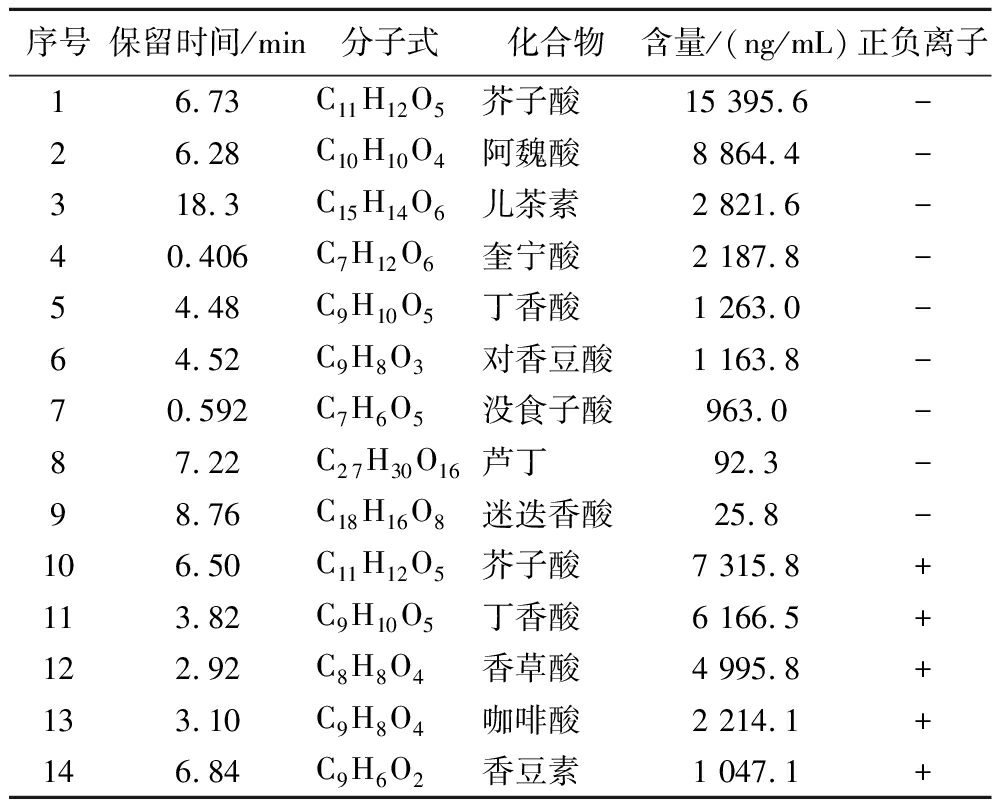
序号保留时间/min分子式化合物含量/(ng/mL)正负离子16.73C11H12O5芥子酸15 395.6-26.28C10H10O4阿魏酸8 864.4-318.3C15H14O6儿茶素2 821.6-40.406C7H12O6奎宁酸2 187.8-54.48C9H10O5丁香酸1 263.0-64.52C9H8O3对香豆酸1 163.8-70.592C7H6O5没食子酸963.0-87.22C27H30O16芦丁92.3-98.76C18H16O8迷迭香酸25.8-106.50C11H12O5芥子酸7 315.8+113.82C9H10O5丁香酸6 166.5+122.92C8H8O4香草酸4 995.8+133.10C9H8O4咖啡酸2 214.1+146.84C9H6O2香豆素1 047.1+
2.4 板栗醋多酚减肥降脂活性分析
2.4.1 多酚对小鼠脏器、脂肪的影响
多酚对小鼠体重、脏器系数和脂肪系数的影响如表3和表4所示。
表3 不同组别小鼠体重及脏器系数
Table 3 Body weight and organ coefficients of mice with different groups

组别体重/g心脏系数/%肝脏系数/%脾脏系数/%肾脏系数/%胸腺系数/%正常对照组 27.50±2.320.46±0.014.15±0.510.32±0.071.32±0.210.15±0.02高脂模型组 34.45±2.22∗∗∗0.36±0.02∗∗∗4.18±0.510.25±0.04∗1.05±0.07∗0.16±0.03低剂量多酚组31.50±1.92∗0.39±0.02∗∗∗4.30±0.200.24±0.04∗1.08±0.11∗0.16±0.02中剂量多酚组30.13±2.15##0.40±0.02∗∗#4.16±0.450.29±0.041.17±0.040.18±0.02高剂量多酚组29.88±1.32##0.42±0.04∗##4.00±0.360.29±0.041.32±0.26#0.18±0.03
注:*均表示与空白对照组进行比较统计,*表示P<0.05,**表示P<0.01,***表示P<0.001;#均表示与高脂模型组进行比较统计,#表示P<0.05,##表示P <0.01,###表示P <0.001(下同)。
表4 不同组别小鼠的脂肪系数 单位:%
Table 4 Adiposity coefficients of mice with different groups
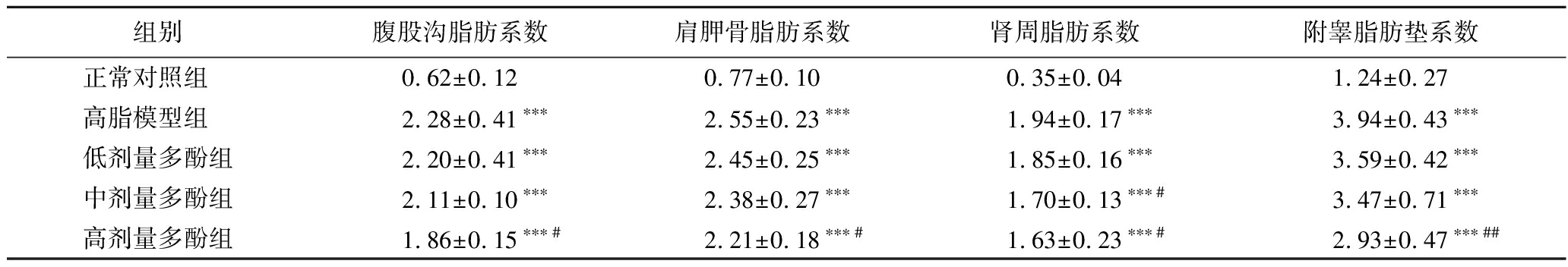
组别腹股沟脂肪系数肩胛骨脂肪系数肾周脂肪系数附睾脂肪垫系数正常对照组 0.62±0.120.77±0.100.35±0.041.24±0.27高脂模型组 2.28±0.41∗∗∗2.55±0.23∗∗∗1.94±0.17∗∗∗3.94±0.43∗∗∗低剂量多酚组2.20±0.41∗∗∗2.45±0.25∗∗∗1.85±0.16∗∗∗3.59±0.42∗∗∗中剂量多酚组2.11±0.10∗∗∗2.38±0.27∗∗∗1.70±0.13∗∗∗#3.47±0.71∗∗∗高剂量多酚组1.86±0.15∗∗∗#2.21±0.18∗∗∗#1.63±0.23∗∗∗#2.93±0.47∗∗∗##
体重的逐渐增加是模型组动物的标志,这也代表着多酚试验的进行性进展。如表3所示,与正常对照组相比,高脂模型组显著增加了小鼠的体重(P<0.001);与高脂模型组相比,中、高剂量的板栗醋多酚显著减轻了小鼠的体重(P<0.01),低剂量效果不显著;与正常对照组相比,高脂模型组显著降低了小鼠的心脏、脾脏、肾脏系数(P<0.05;P<0.001);与高脂模型组相比,中、高剂量的板栗醋多酚显著提高了心脏系数(P<0.05;P<0.01),低剂量效果不显著;高剂量的板栗醋多酚显著提高了肾脏系数(P<0.05),低、中剂量效果不显著;板栗醋多酚对小鼠的肝脏、脾脏、胸腺系数在统计学分析上没有显著性差异(P>0.05)。
如表4所示,与正常对照组相比,高脂模型组显著提高了小鼠各脂肪系数(P<0.001);与高脂模型组相比,高剂量的板栗醋多酚显著降低了腹股沟脂肪、肩胛骨脂肪和附睾脂肪垫系数(P<0.05;P<0.01);低、中剂量效果不显著;中、高剂量的板栗醋多酚显著降低了肾周脂肪系数(P<0.05),低剂量效果不显著。可见,不同剂量的板栗醋多酚可不同程度地减轻高脂饮食引起的脂肪变化,其中高剂量效果最明显,因此,板栗醋多酚对体重减轻、脏器损伤和脂肪变性的缓解有明显作用,具有显著的减肥效果。
2.4.2 多酚对小鼠血脂水平的影响
多酚对小鼠血清中TC、TG、HDL-C、LDL-C、ALT、AST、FFA的影响如表5和表6所示。
表5 不同组别小鼠血清中TC、TG、HDL-C、LDL-C的含量
Table 5 TC, TG, HDL-C, and LDL-C contents in different groups of mice serum

组别TC/(mg/dL)TG/(mmol/L)HDL-C/(mmol/L)LDL-C/(mmol/L)正常对照组 2.90±0.141.41±0.102.06±0.070.24±0.05高脂模型组 6.00±0.38∗∗∗2.25±0.23∗∗∗1.82±0.09∗∗0.86±0.10∗∗∗低剂量多酚组5.49±0.43∗∗∗1.93±0.22∗∗∗#1.93±0.140.79±0.16∗∗∗中剂量多酚组4.35±0.66∗∗∗###1.69±0.12∗###1.95±0.080.64±0.17∗∗∗#高剂量多酚组4.02±0.60∗∗###1.58±0.15###2.06±0.07##0.57±0.07∗∗∗##
表6 不同组别小鼠血清中ALT、AST、FFA的含量
Table 6 ALT, AST, and FFA contents in different groups of mice serum
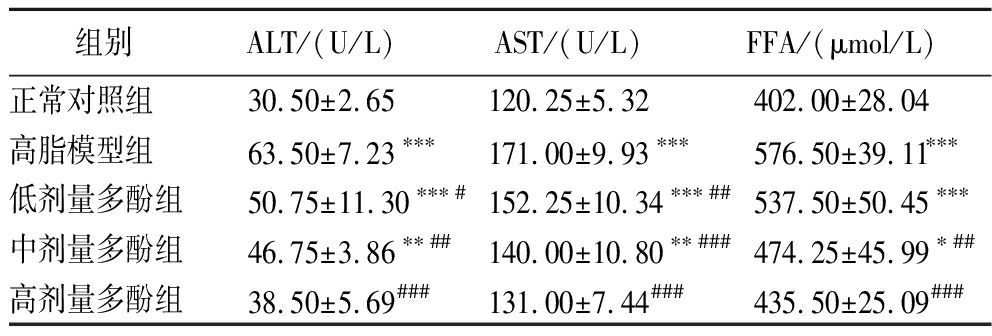
组别ALT/(U/L)AST/(U/L)FFA/(μmol/L)正常对照组30.50±2.65120.25±5.32402.00±28.04高脂模型组63.50±7.23∗∗∗171.00±9.93∗∗∗576.50±39.11∗∗∗低剂量多酚组50.75±11.30∗∗∗#152.25±10.34∗∗∗##537.50±50.45∗∗∗中剂量多酚组46.75±3.86∗∗##140.00±10.80∗∗###474.25±45.99∗##高剂量多酚组38.50±5.69###131.00±7.44###435.50±25.09###
长期摄入高能量食物是导致肥胖和高脂血症的主要原因,而心血管疾病的发生概率与TG和TC的含量密切相关。研究表明,TG水平每增加1 mmol/L,冠心病发生的概率就会显著增加12%~37%,与此同时,糖尿病、肾病的患病风险也会增加[14];TC在机内各种激素的合成中起着重要作用,其含量过高会极大地促使机体患心血管疾病;LDL-C作为将胆固醇运送到肝外组织的主要运输工具,当LDL-C超过一定水平,其携带的胆固醇在动脉壁上积存,从而导致动脉硬化的发生,同时还会损坏心脏健康,而HDL-C能将胆固醇从肝组织携带回肝脏进行代谢,具有抗动脉粥样硬化的作用,并经胆汁排出,有效防止肝外组织细胞中游离胆固醇的积聚。如表5所示,与正常对照组相比,高脂模型组显著提高了血清中TC、TG水平(P<0.001),患病概率升高;与高脂模型组相比,中、高剂量的板栗醋多酚显著降低了TC水平(P<0.001),低剂量效果不显著;低、中、高剂量的板栗醋多酚显著降低了TG水平(P<0.05;P<0.001)。与正常对照组相比,高脂模型组显著提高了LDL-C水平(P<0.001)以及显著降低了HDL-C水平(P<0.01),表明高脂饮食喂养的小鼠血脂水平已出现紊乱;与高脂模型组相比,中、高剂量的板栗醋多酚显著降低了LDL-C水平(P<0.05;P<0.01),低剂量效果不显著;高剂量的板栗醋多酚显著提高了HDL-C水平(P<0.01),低、中剂量效果不显著。因此,一定剂量的板栗醋多酚具有良好的降血脂功效,可有效调节高脂饮食引起的脂质代谢异常,降低高脂饮食引起的动脉粥样硬化、心血管疾病的风险,且具有剂量依存关系。
多数肝炎患者血清转氨酶的含量与肝细胞损伤程度呈正相关,只要有微量的转氨酶渗透到血浆中,血清中ALT和AST活性就会显著升高,当肝细胞或某些组织受损时,转氨酶开始渗入血浆,提高血液中的转氨酶水平[15],因此,ALT、AST水平升高是肝损伤的表征。
如表6所示,与正常对照组相比,高脂模型组显著提高了ALT和AST水平(P<0.001),这表明长期摄入高脂饮食会对小鼠的肝脏造成明显损伤;与高脂模型组相比,低、中、高剂量的板栗醋多酚显著降低了ALT、AST水平(P<0.05;P<0.01;P<0.001)。因此,试验表明,板栗醋多酚可有效清除体内自由基,发挥强抗氧化作用,从而减轻高脂饮食诱导的肝脏氧化损伤,对小鼠肝脏有良好的保护作用,有效降低肝脏病变等疾病的发病风险,并表现出剂量依存关系。
高脂饮食的肥胖小鼠内脏脂肪组织中的脂肪分解产生了大量的游离脂肪酸,进而引起三酰甘油和胆固醇合成增加。如表6所示,与正常对照组相比,高脂模型组显著提高了血清中的FFA水平(P<0.001);与高脂模型组相比,中、高剂量的板栗醋多酚显著降低了FFA水平(P<0.01;P<0.001),脂类代谢得到了明显的改善,同时表现出剂量依存关系,低剂量效果不显著。
2.4.3 多酚对小鼠粪便总胆固醇和甘油三酯的影响
多酚对小鼠粪便总胆固醇和甘油三酯的影响。
如表7所示,与正常对照组相比,高脂模型组显著提高了粪便中TC和TG水平(P<0.001);与高脂模型组相比,低、中、高剂量的板栗醋多酚显著降低了粪便中TC水平(P<0.05;P<0.001);中、高剂量的板栗醋多酚显著降低了粪便中TG水平(P<0.01;P<0.001),低剂量效果不显著,且表现出剂量依赖性。
表7 不同组别小鼠粪便中TC、TG的含量 单位:mmol/kg Table 7 Levels of TC and TG in different groups of mice feces

组别TCTG正常对照组 2.09±0.501.33±0.18高脂模型组 6.55±0.83∗∗∗2.58±0.25∗∗∗低剂量模型组5.25±0.13∗∗∗#2.29±0.14∗∗∗中剂量模型组4.59±0.54∗∗∗###1.98±0.17∗∗##高剂量模型组3.45±0.42∗###1.74±0.20∗###
2.4.4 多酚对小鼠肝脏的影响
不同组小鼠肝脏形态及HE染色结果如图3和图4所示。

a-正常对照组;b-高脂模型组;c-低剂量多酚组;d-中剂量多酚组;e-高剂量多酚组
图3 不同组别小鼠的肝脏形态
Fig.3 Liver morphology of different groups of mice
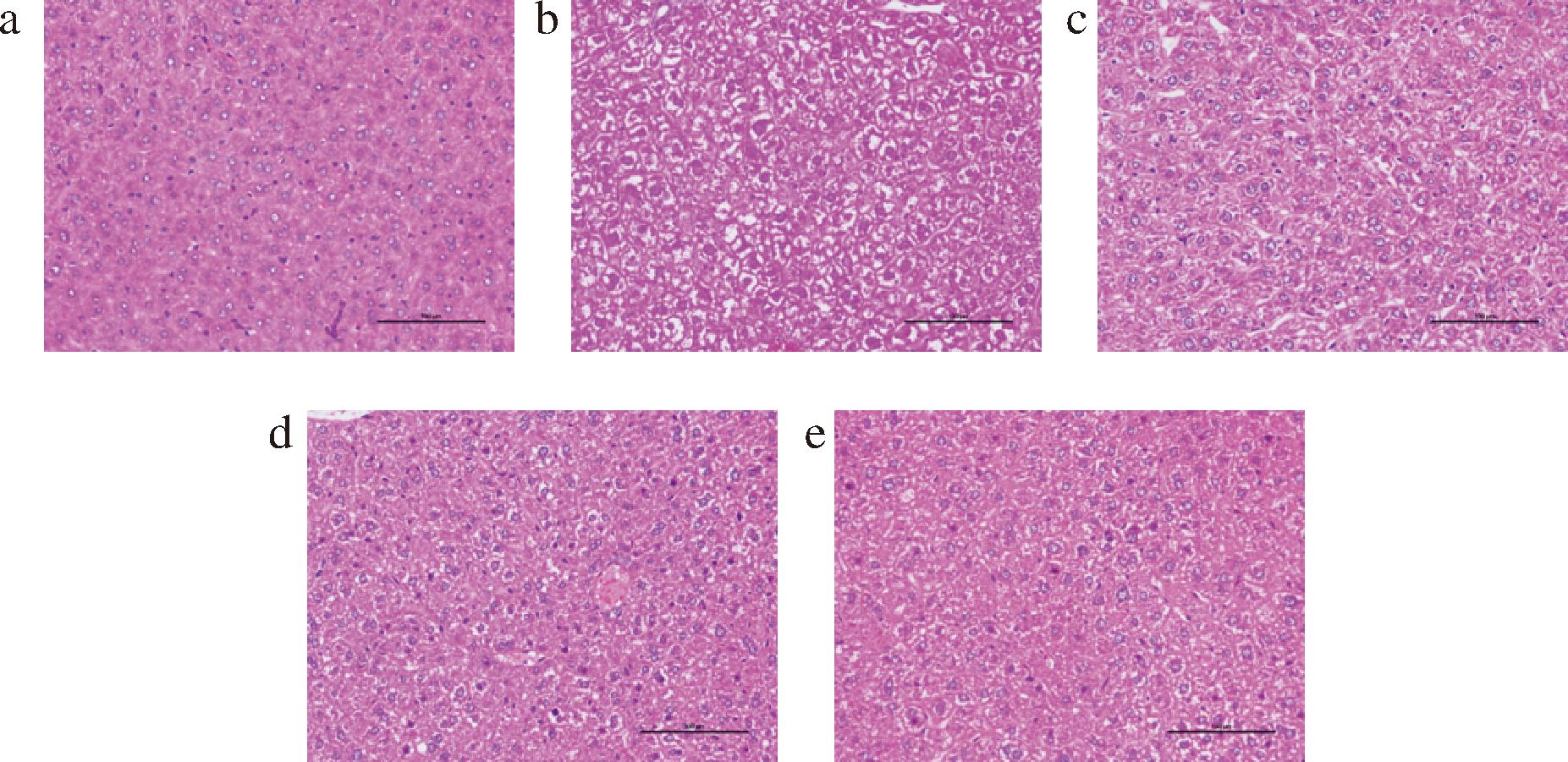
a-正常对照组;b-高脂模型组;c-低剂量多酚组;d-中剂量多酚组;e-高剂量多酚组
图4 不同组别小鼠肝脏的HE染色
Fig.4 HE staining of different groups of mice livers
将各组小鼠取血后,肝脏拍照,如图3所示,各组小鼠肝脏肉眼未观察到明显的病理变化。
如图4所示,正常对照组小鼠的肝细胞排列紧密、结构完整、形态正常,细胞质丰富均匀,未发生较明显的变性、坏死等变化。
大量空泡化就是脂肪肝的典型特征,与正常对照组相比,高脂模型组的肝脏切片显示肝脏脂肪变性,内部充满大小不等的空泡,脂滴增加;与高脂模型组比较,低、中、高剂量的板栗醋多酚组肝脏切片中脂滴和空泡数量依次明显减少,脂肪变性大大减轻,因此,试验表明板栗醋多酚具有良好的抑制肝损伤、预防脂肪肝的作用,且存在剂量依赖性。
2.4.5 板栗醋多酚对瘦素、脂联素和肝脂酶水平的影响
板栗醋多酚对瘦素、脂联素和肝脂酶水平的影响如表8所示。
表8 不同组别小鼠的瘦素、脂联素、肝脂酶的含量 单位:ng/mg Table 8 The contents of leptin, adiponectin, and liver lipase in different groups of mice
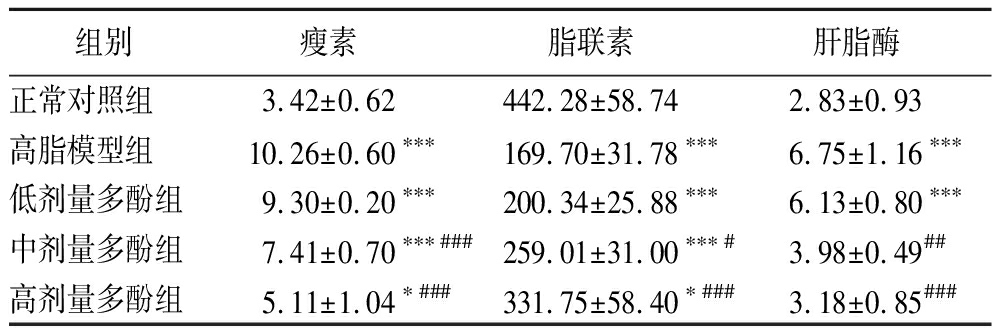
组别瘦素脂联素肝脂酶正常对照组 3.42±0.62442.28±58.742.83±0.93高脂模型组 10.26±0.60∗∗∗169.70±31.78∗∗∗6.75±1.16∗∗∗低剂量多酚组9.30±0.20∗∗∗200.34±25.88∗∗∗6.13±0.80∗∗∗中剂量多酚组7.41±0.70∗∗∗###259.01±31.00∗∗∗#3.98±0.49##高剂量多酚组5.11±1.04∗###331.75±58.40∗###3.18±0.85###
瘦素在肥胖相关代谢疾病中发挥着重要的作用,能释放厌食因子,降低食欲,调节饮食行为,可有效减少食物摄入和脂肪的合成、增加能量消耗以及促进脂质分解。研究表明,瘦素水平与体脂成正比,肥胖程度越高,瘦素水平就越高,且常伴有瘦素抵抗[16],这可能是引起肥胖的主要因素,瘦素水平与许多代谢性疾病如代谢综合征、肥胖密切相关。脂联素是脂肪组织分泌的一种蛋白质,伴随着脂肪组织的增加而减少,与脂肪总量呈负相关,肥胖可能导致脂联素信号功能紊乱[17]。由表8可知,与正常对照组相比,高脂模型组显著提高了瘦素水平(P<0.001);与高脂模型组相比,中、高剂量的板栗醋多酚显著降低了瘦素水平(P<0.001),低剂量效果不显著;与正常对照组相比,高脂模型组显著降低了脂联素水平(P<0.001);与高脂模型组相比,中、高剂量的板栗醋多酚显著提高了脂联素水平(P<0.05;P<0.001),低剂量效果不显著。
肝脂酶是一种具有酯酶活性的脂肪酶,是参与脂蛋白代谢的关键酶之一,它能水解各种脂蛋白中的甘油三酯和磷脂,改变脂蛋白颗粒的大小和密度,随着血浆中脂肪酶及其活性的增加,小颗粒致密LDL水平升高,加速了高血脂的发生。有药物研究表明,血脂升高是机体患动脉粥样硬化的重要因素,动脉粥样硬化患者使用洛伐他丁后,随着血液中肝脂酶含量的降低,动脉狭窄程度明显改善。由表8可知,与正常对照组相比,高脂模型组显著提高了肝脂酶水平(P<0.001),与高脂模型组相比,中、高剂量的板栗醋多酚显著降低了肝脂酶水平(P<0.01;P<0.001),低剂量效果不显著。
因此,板栗醋多酚通过调节瘦素、脂联素和肝脂酶水平,可以明显减少脂肪的合成,有效降低血脂和预防由高血脂、肥胖等引起的动脉粥样硬化的发生和高脂饮食诱发的肥胖症,并为肥胖症及其并发症的治疗提供了科学的试验依据,开辟了新的预防途径。
多酚是一类具有多元酚结构的次生代谢产物[18],由于其结构中的羟基能结合氢离子和清除自由基,使酚类化合物具有很高的清除活性来预防疾病[19]。研究表明,饮食中的多酚是一种广泛的生物活性物质,根据其化学结构,主要分为酚酸、类黄酮或非类黄酮,能够预防肥胖等非传染性疾病。液质联用定性定量表明,板栗醋多酚由9种酚酸和3种类黄酮类物质组成,其中酚酸类所占含量比例较大,是板栗醋多酚中的主要贡献者,具有广泛的生物活性,主要包括肉桂酸衍生物(C6-C3)如咖啡酸和苯甲酸衍生物(C6-C1)如没食子酸;先前的研究表明,咖啡酸、没食子酸是一些果醋发酵过程中主要的酚类化合物;咖啡酸能显著降低FFA、TG、TC水平和肝脏、脂肪等组织中的脂质含量, 有效改善高胆固醇血症,对肥胖小鼠具有潜在的减肥效果[20];没食子酸能有效清除DPPH自由基,口服没食子酸可明显降低肥胖小鼠的体重及改善小鼠的肝脏脂肪变性,显著抑制小鼠肝脏中与脂肪变性相关的基因水平,如ACC和FABR4 mRNA[21]。类黄酮类具有C6-C3-C6的基本碳架,结构源于苯并吡喃,由2个苯环通过3个碳原子结合在一起,因氧化程度的不同,分为黄酮、黄烷酮、黄烷醇如儿茶素、黄酮醇如芦丁等几类物质;其中儿茶素是具有减肥作用的主要黄酮类化合物,通过干扰多种信号转导途径发挥减肥作用[22],能有效降低胆固醇、抑制血管紧张素转化酶,预防心血管疾病;芦丁作为一种典型且重要的类黄酮类化合物,能明显改善血清指标水平,如提高HDL-C、TC水平,降低LDL-C水平[23],在治疗慢性疾病如高胆固醇血症、肥胖症、高血压等发挥着重要作用。因此,多酚以各自不同的生物活性,以及经羟基化、甲氧基化、脱糖基化、单体聚合等一系列结构变化形成的多酚衍生物,具有预防肥胖、抗菌抗炎等功能作用[24],不同多酚物质之间的相互作用和协同作用也会影响不同细胞内的信号传导途径,从而赋予多酚多样的生物活性。综上所述,板栗醋多酚的减肥降脂功效可能是由12种多酚的协同作用所致。
3 结论
板栗不仅具有丰富的营养成分,而且具有益气健脾、补肾强筋的良好保健作用,因此,其市场前景广阔。为开发板栗深加工产品,本试验将板栗作为醋类酿造的原料,酿制的板栗醋与米醋、苹果醋相比较,其多酚相对含量突出,因此,将多酚作为板栗醋的特征功能性成分进一步深入研究。本试验采用超声波辅助提取法对新型板栗醋多酚进行提取,利用DM130大孔树脂进行纯化,并使用紫外、红外光谱、液质联用技术对其结构组成进行鉴定,试验表明,板栗醋多酚提取物符合多酚的特征,并在正负离子模式下共鉴定出12种化合物,其中负离子模式下含量较高的有芥子酸、阿魏酸和儿茶素,分别为15 395.6、8 864.4、2 821.6 ng/mL,正离子模式下含量较高的有芥子酸、丁香酸和香草酸,分别为7 315.8、6 166.5、4 995.8 ng/mL。多酚的生物活性试验研究表明板栗醋多酚可以显著减轻肝脏、脂肪的质量,明显改善TC、TG、HDL-C、LDL-C、ALT、AST、FFA水平;大大减轻脂肪变性;有效调节瘦素、脂联素、肝脂酶水平;这表明板栗醋多酚具有良好的减肥降脂作用,有效降低肥胖症、脂肪肝和动脉粥样硬化等疾病发生的风险。新型板栗醋的研究为板栗深加工产品的开发提供了新的思路;在提高板栗产品附加值的同时,有利于提高板栗资源利用率;新型板栗醋多酚的研究为开发天然减肥降脂药物和保健产品,提供了科学的依据。
[1] COELHO E, GENISHEVA Z, OLIVEIRA J M, et al. Vinegar production from fruit concentrates: Effect on volatile composition and antioxidant activity[J]. Journal of Food Science and Technology, 2017, 54(12): 4112-4122.
[2] HO C W, LAZIM A M, FAZRY S, et al. Varieties, production, composition and health benefits of vinegars: A review[J]. Food Chemistry, 2017, 221: 1621-1630.
[3] 邓诗意, 殷萍, 张强, 等. 基于稳定同位素和矿物元素的板栗产地判别分析[J]. 食品科学, 2023, 44(12): 351-359.DENG S Y, YIN P, ZHANG Q, et al. Discrimination of the geographical origin of Chinese chestnut based on stable isotope and rare earth element fingerprint characteristics[J]. Food Science, 2023, 44(12): 351-359.
[4] LIU W M, WANG R R, LI J W, et al. Effects of different hydrocolloids on gelatinization and gels structure of chestnut starch[J]. Food Hydrocolloids, 2021, 120: 106925.
[5] RAINA J, FIRDOUS A, SINGH G, et al. Role of polyphenols in the management of diabetic complications[J]. Phytomedicine, 2024, 122: 155155.
[6] 刘庆双, 杨晓宽. 板栗醋发酵工艺优化及挥发性成分分析[J]. 食品研究与开发, 2024, 45(3): 163-173.LIU Q S, YANG X K. Fermentation technology and volatile constituents analysis of chestnut vinegar[J]. Food Research and Development, 2024, 45(3): 163-173.
[7] 叶杰, 倪莉. Folin-ciocalteu法测定黄酒中总多酚含量[J]. 福建轻纺, 2006(11): 66-69.YE J, NI L. Folin-ciocalteu method for determination of total polyphenols in rice wine[J]. The Light &Textile Industries of Fujian, 2006(11): 66-69.
[8] 胡美怡, 梁建兰, 李润峰, 等. 一种新型板栗黄酒多糖的提取分离及其体外免疫活性[J]. 食品科学, 2023, 44(8): 78-85.HU M Y, LIANG J L, LI R F, et al. Extraction, isolation and in vitro immunological activity of polysaccharides from wine made from glutinous rice and Chinese chestnut[J]. Food Science, 2023, 44(8): 78-85.
[9] 马妮, 刘慧燕, 方海田, 等. 红枣多酚提取工艺优化、成分及抗氧化活性分析[J]. 食品工业科技, 2022, 43(16): 246-254.MA N, LIU H Y, FANG H T, et al. Optimization of polyphenol extraction process, analysis of components and antioxidant activity of jujube[J]. Science and Technology of Food Industry, 2022, 43(16): 246-254.
[10] WANG X Y, WANG S S, HUANG S S, et al. Purification of polyphenols from distiller’s grains by macroporous resin and analysis of the polyphenolic components[J]. Molecules, 2019, 24(7): 1284.
[11] PADUREANU C, MAIER A, PADUREANU V, et al. The total content of polyphenols and the antioxidant properties of several berry vinegars[J]. Series II: ForestryoWood IndustryoAgricultural Food Engineering, 2022: 145-156.
[12] WU Q, KONG Y F, LIANG Y G, et al. Protective mechanism of fruit vinegar polyphenols against AGEs-induced Caco-2 cell damage[J]. Food Chemistry: X, 2023, 19: 100736.
[13] XIE S K, SONG J, FAN B Q, et al. Elucidation and regulation of polyphenols in the smoking process of Shanxi aged vinegar[J]. Foods, 2021, 10(7): 1518.
[14] 彭冰洁, 宋卓, 刘云龙, 等. 多酚类化合物对糖脂代谢影响的研究进展[J]. 食品科学, 2015, 36(17): 270-275.PENG B J, SONG Z, LIU Y L, et al. Impact of polyphenols on carbohydrate and lipids metabolism[J]. Food Science, 2015, 36(17): 270-275.
[15] 周宏炫, 黄颖, 谭书明, 等. 刺梨多酚对急性酒精中毒大鼠的解酒和护肝作用[J]. 食品科学, 2021, 42(17): 163-169.ZHOU H X, HUANG Y, TAN S M, et al. Anti-alcoholic and hepatoprotective effects of polyphenols from the fruit of Rosa roxburghii Tratt. in rats with acute alcoholism[J]. Food Science, 2021, 42(17): 163-169.
[16] MART NEZ-S
NEZ-S NCHEZ N. There and back again: Leptin actions in white adipose tissue[J]. International Journal of Molecular Sciences, 2020, 21(17): 6039.
NCHEZ N. There and back again: Leptin actions in white adipose tissue[J]. International Journal of Molecular Sciences, 2020, 21(17): 6039.
[17] LARSEN M A, ISAKSEN V T, PAULSSEN E J, et al. Postprandial leptin and adiponectin in response to sugar and fat in obese and normal weight individuals[J]. Endocrine, 2019, 66(3): 517-525.
[18] 蔡朋举, 孙爱东, 贾国梁. 植物多酚的抗炎功效及微胶囊化研究进展[J]. 中国食品学报, 2022, 22(7): 417-427. CAI P J, SUN A D, JIA G L. Research progress on anti-inflammatory activity and microencapsulation of plant polyphenols[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(7): 417-427.
[19] KASHYAP P, RIAR C S, JINDAL N. Optimization of ultrasound assisted extraction of polyphenols from Meghalayan cherry fruit (Prunus nepalensis) using response surface methodology (RSM) and artificial neural network (ANN) approach[J]. Journal of Food Measurement and Characterization, 2021, 15(1): 119-133.
[20] CHO A S, JEON S M, KIM M J, et al. Chlorogenic acid exhibits anti-obesity property and improves lipid metabolism in high-fat diet-induced-obese mice[J]. Food and Chemical Toxicology, 2010, 48(3): 937-943.
[21] SOUSA J N, PARAI SO A F, ANDRADE J M O, et al. Oral gallic acid improve liver steatosis and metabolism modulating hepatic lipogenic markers in obese mice[J]. Experimental Gerontology, 2020, 134: 110881.
SO A F, ANDRADE J M O, et al. Oral gallic acid improve liver steatosis and metabolism modulating hepatic lipogenic markers in obese mice[J]. Experimental Gerontology, 2020, 134: 110881.
[22] CAO Y Y, HAN S, LU H, et al. Targeting mTOR signaling by dietary polyphenols in obesity prevention[J]. Nutrients, 2022, 14(23): 5171.
[23] RASOULI H, FARZAEI M H, KHODARAHMI R. Polyphenols and their benefits: A review[J]. International Journal of Food Properties, 2017: 1-42.
[24] LATOS-BROZIO M, MASEK A. Structure-activity relationships analysis of monomeric and polymeric polyphenols (quercetin, rutin and catechin) obtained by various polymerization methods[J]. Chemistry &Biodiversity, 2019, 16(12): e1900426.