藏羊是青藏高原的特色畜资源,其肉质紧实,富含多种微量元素和维生素,如铁和锌、维生素B12[1]。除此之外,藏羊肉还含有丰富的不饱和脂肪酸,如单不饱和脂肪和多不饱和脂肪,可以有效降低胆固醇以及中风和心血管疾病的风险,帮助改善心脏健康[2]。肌原纤维蛋白(myofibrillar proteins, MPs)是肉制品中组成肌原纤维的主要蛋白,其空间结构与肉制品品质有紧密的联系,而MPs会受到温度、离子强度等的影响,导致其性质和结构发生改变[3],研究表明,加热会导致MPs变性,疏水基团暴露,影响肉的乳化稳定性[4]。不同的离子对肉的品质有明显的影响,如姬琛等[5]研究发现了Ca2+可以通过使肌动蛋白表达量下降影响肉品的嫩度;FLORES等[6]研究发现NaCl在干腌肉制品中显著影响风味物质的释放;MgCl2替代NaCl可以提高鸡肉的水分含量[7],降低猪肉MPs的汁液流失[8]。除此之外,MPs作为肉制品中重要蛋白组分,其在风味吸附和保留中起到很大的作用[9]。目前已有研究表明离子种类和强度会改变蛋白质的空间结构[10],诱发蛋白伸展或折叠,改变蛋白-蛋白相互作用,引起结合位点的暴露或包埋,导致对风味化合物的吸附差异。KÜHN等[11]认为加热会导致蛋白产生共价交联,影响部分结合位点的结构,从而使风味化合物从结合位点上释放。目前认为MPs吸附挥发性风味物质机理主要涉及两方面,一是其受到内源或外源因素的影响,暴露更多的疏水作用位点与氢键结合,再与风味化合物实现可逆结合[12];二是其发生变性,暴露色氨酸、赖氨酸等氨基酸残基或巯基与风味化合物实现不可逆结合[13]。我国是肉制品生产与消费大国,占世界肉类产量的四分之一;手抓藏羊肉作为西北地区的特色菜肴,得到了广大消费者的喜爱,而西北地区的新鲜藏羊肉运输到内地进行煮制后,其风味发生了很大的改变,赵冰等[14]研究发现不同区域的水中离子种类不同,影响羊肉中风味化合物的变化,而MPs是肌肉的结构蛋白,占肌肉蛋白总量的55%~65%,能提供丰富的人体必需氨基酸,决定了肉制品的功能特性和质构特性[3]。鉴于此,本研究以藏羊肉的MPs为对象,研究不同离子强度和加热处理对其结构、功能等方面的影响,同时采用顶空气相色谱-质谱联用技术(headspace gas chromatography-mass spectrometry, HS-GC-MS)分析不同条件下MPs结合特征风味物质的能力,为手抓藏羊肉的风味调控提供理论基础。
1 材料与方法
1.1 材料与试剂
手抓藏羊肉是西北地区传统的一种羊肉食用法,因用手抓吃,故得名。做法较简单,常以羊脊排为原料,放入清水中煮熟,加入适量食用盐调味,捞出后配以蘸料食用。
藏羊排:采集2023年4月份屠宰的来自青海省海北州海晏县的藏羊肉,挑选7月龄的3头外观健康、无病害症状、雌性的藏羊,收集其羊脊排部位。
KCl、NaCl、MgCl2、CaCl2,天津市河东区红岩试剂厂;BCA试剂、SDS-PAGE配制试剂盒,上海生工生物工程技术服务有限公司;考马斯亮蓝,上海麦克林生化科技有限公司。
1.2 仪器与设备
-80 ℃超低温冰箱,美国THERMO公司;GC-5977B气相色谱与质谱仪联用仪,安捷伦科技有限公司;LR-10M大容量高速冷冻离心机,湖南赫西仪器装备有限公司;Multiskan SkyHigh全波长酶标仪,赛默飞世尔科技公司,全波长紫外分光光度计、RF-530荧光分光光度计,日本Shimadzu。
1.3 藏羊肉MPs的提取
参考赵冰等[14]的方法并略作修改,取50 g绞碎的藏羊排肉,加入4倍体积的磷酸盐缓冲液,匀浆1 min,3 000×g冷冻离心15 min,取沉淀,重复4次,加入4倍体积的0.1 mol/L NaCl溶液,匀浆后用纱布过滤,取上清液,3 000×g冷冻离心15 min,沉淀即为MPs,于4 ℃条件冷藏。利用BCA法测定提取的MPs浓度。
1.4 不同离子强度和加热条件下MPs体系的制备
提取的MPs用磷酸盐缓冲液溶解,将质量浓度调整为5 mg/mL并分成13等份,分别添加NaCl、KCl、CaCl2和MgCl2,参照张桂艳[15]的方法将其浓度设置为0.2、0.4、0.6 mol/L,另做一组空白对照,将处理后13组样品分为两等份,一份做加热处理即90 ℃水浴30 min,处理后的样品于4 ℃条件保存。
1.5 溶解度的测定
将处理后的26组样品4 ℃条件下6 000×g冷冻离心15 min,取上清液及原液各20 μL于酶标板中,同时取梯度稀释的标准蛋白溶液20 μL于酶标板中,另取20 μL 50 mmol/L磷酸盐溶液(pH 6.5)做空白对照。加入200 μL BCA工作液,充分混匀,37 ℃孵化30 min,在562 nm记录吸光值,每个处理测定3次,溶解度的计算如公式(1)所示:
溶解度![]()
(1)
1.6 MPs小片化指数的测定
将处理后的26组样品在4 ℃条件下1 000 r/min离心10 min,取上清液,将溶液稀释至0.5 mg/mL,于可见分光光度计540 nm处测定吸光度,重复3次取平均值。小片化指数的计算如公式(2)所示:
小片化指数=A540×200
(2)
式中:A540,540 nm下的吸光值。
1.7 总巯基含量测定
将处理后的26组样品用磷酸盐缓冲液调至5 mg/mL,取1 mL样品加入9 mL的磷酸盐缓冲液(含8 mol/L的尿素),4 ℃条件下1 000 r/min离心15 min,取上清液,加入400 μL的乙酸钠溶液(含10 mol/L DNTB),40 ℃加热25 min,冷却后在412 nm处测定吸光值。总巯基含量的计算如公式(3)所示:
总巯基含量![]()
(3)
式中:A412,412 nm下的吸光值;D,样品稀释倍数;C,样品溶液质量浓度,mg/mL。
1.8 总羰基含量的测定
将处理后的26组样品用磷酸盐缓冲液调至5 mg/mL,取2份400 μL的样品,一份加入800 μL的2 mol/L盐酸溶液(含0.2%的DNPH),另一份加入800 μL的2 mol/L盐酸溶液作为空白对照,静置30 min后加入400 μL的三氯乙酸溶液,500×g离心5 min,随后加入1 mL乙醇-乙酸乙酯混合溶液(体积比1∶1)并1 000×g离心5 min,重复3次,在沉淀中加入1.5 mL的磷酸盐溶液(含6 mol/L盐酸胍),待蛋白质溶解后静置12 h,分别在280 nm和370 nm处测吸光值。总羰基含量的计算如公式(4)所示:
总羰基含量![]()
106×22 000
(4)
式中:A370,370 nm下的吸光值;A280,280 nm下的吸光值;0.43,样品量,mL;22 000,摩尔吸光系数,L/(mol×cm)。
1.9 表面疏水性测定
参照CHELH等[16]的方法略作修改。将处理后的26组样品稀释至5 mg/mL,磷酸盐缓冲液做空白对照,离心后取上清液400 μL并稀释10倍,用分光光度计在595 nm处测定吸光度值,表面疏水性以结合溴酚蓝的量表示,其计算如公式(5)所示:
溴酚蓝结合量![]()
(5)
式中:A对照和A样品分别为对照组和样品在595 nm下的吸光值。
1.10 MPs对特征风味化合物结合能力的检测
参考甘潇等[17]的方法略作修改。
1.10.1 风味储备液的制备
根据前期对手抓藏羊肉的风味物质进行测定,共筛选出5种相对含量较高的风味化合物作为手抓藏羊肉的特征风味化合物,将选定的5种特征风味化合物(正辛醛、正丁醇、正己醇、丙醛、正己醛)添加到棕色容量瓶中,蒸馏水定容至终含量为800 mg/kg,4 ℃冰箱保存。
1.10.2 样品处理
用含不同离子强度的溶液配制蛋白溶液,使其含量为4 mg/mL,并分别做加热和不加热处理。取5 mL上述样品溶液于顶空瓶内,分别加入100 μL各风味储备液,密封摇匀,4 ℃下冷藏吸附24 h。将冷藏吸附后的样品置于80 ℃下平衡30 min后,采用75 μm CAR/PDMS萃取头顶空吸附30 min。
1.10.3 GC-MS条件
参考胡远辉等[18]的方法进行测定。吸附能力的计算如公式(6)所示:
吸附能力![]()
(6)
式中:Ak,空白溶液中某一种挥发性化合物的峰面积;Ai,样品溶液某一种挥发性化合物的峰面积。
1.11 数据处理
运用IBM SPSS Statistics 26.0对数据进行方差分析和标准误差计算;Origin 2022绘图。
2 结果与分析
2.1 离子强度和加热对藏羊肉MPs溶解度的影响
图1为MPs在不同离子强度下加热前后的溶解度变化。未加热时,MPs在NaCl溶液中溶解度最高,其次是KCl和MgCl2,在CaCl2溶液中溶解度最低;说明MPs在Na+体系中的溶解性要优于K+、Mg2+和Ca2+体系,而Ca2+体系下MPs溶解度大大降低。吕汶丞[19]研究发现低浓度的Ca2+会增加MPs的溶解度,但高浓度的Ca2+浓度会导致α-肌动素和肌钙蛋白-T的降解,从而导致蛋白溶解度降低[20]。同时结果表明,随着Na+、K+、Mg2+浓度的增加,MPs的溶解度逐渐增加,在0.6 mol/L NaCl溶液中,MPs的溶解度为40.78%,为各处理组中溶解度最高。原因可能是MPs中的肌球蛋白在低浓度的盐溶液中成纤丝状,而在高浓度下成分散的单体导致MPs溶解度上升[21],这与周茹等[22]的研究结果一致。MPs经热处理后,所有离子浓度下的溶解度显著低于未处理的样品(P<0.05),原因是加热会诱导蛋白质变性和聚集,温度越高,变性和聚集越大,导致蛋白质溶解度降低[15]。
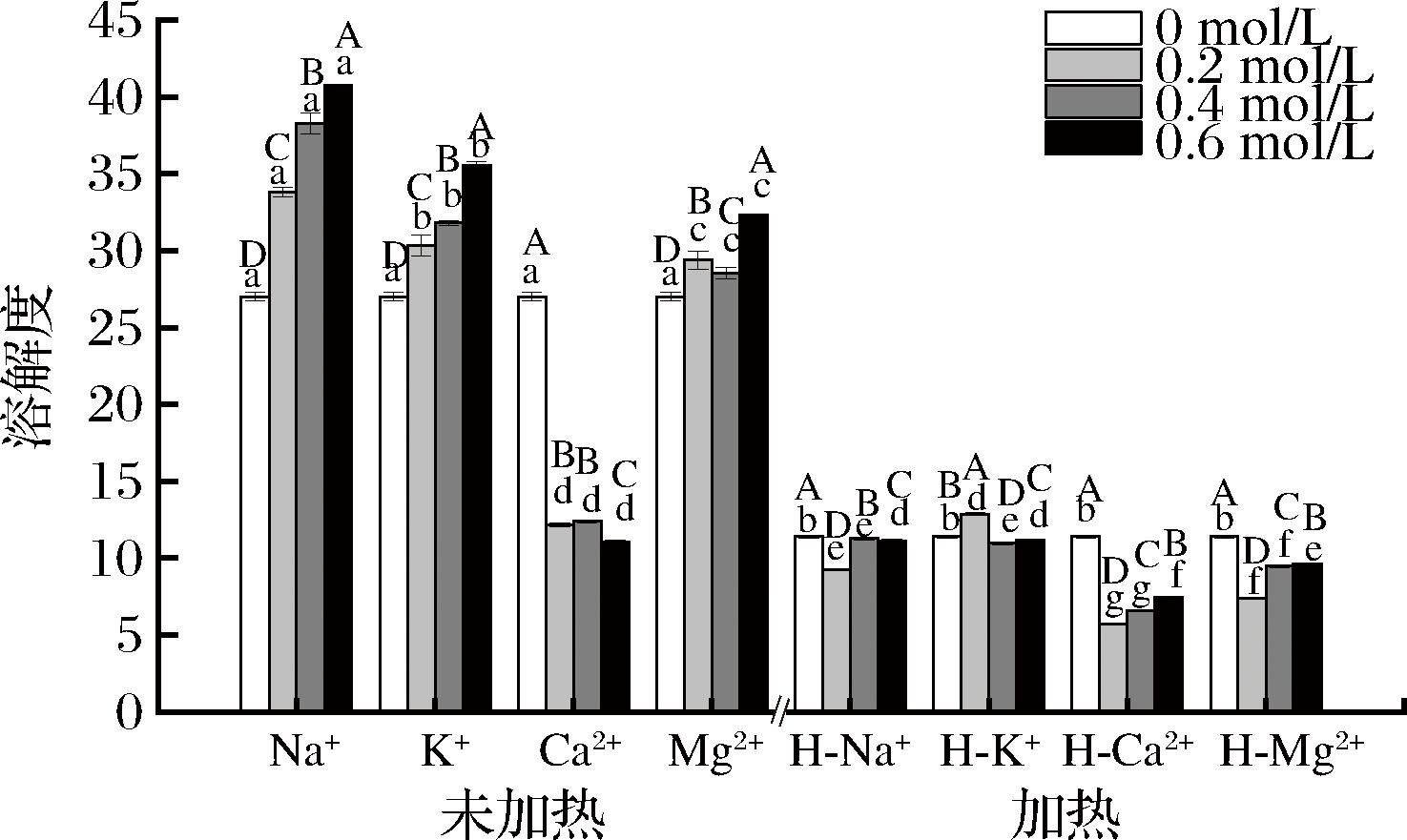
图1 离子强度和加热对藏羊肉MPs溶解度的影响
Fig.1 Effect of ionic strength and heating on the solubility of MPs in Tibetan mutton
注:“H”表示heat(加热);不同小写字母表示同一浓度的样品在不同处理条件下的差异显著(P<0.05),不同大写字母表示同处理条件下不同浓度样品的差异显著(P<0.05)(下同)。
2.2 离子强度和加热对藏羊肉MPs小片化指数的影响
肌原纤维小片化指数(myofibril fragmentation index, MFI)可以有效反映MPs的完整度[23]。当MFI值越大时,表明肌原纤维结构的完整度越低。由图2可知,经离子处理后的MPs小片化指数均上升,且经热处理后的MPs小片化指数均比未处理的要高,说明加热和离子处理均会导致MPs结构完整度降低,原因可能是当MPs加热后,肌动蛋白和肌动球蛋白发生解聚[15],同时随着离子浓度增加,MPs小片化指数呈上升趋势,原因可能是部分内源性蛋白酶活被激活,MPs水解增加,完整度降低。戴妍等[24]对猪肉进行欧姆加热,发现其肌原纤维小片化程度提高,这与本文研究结果一致。
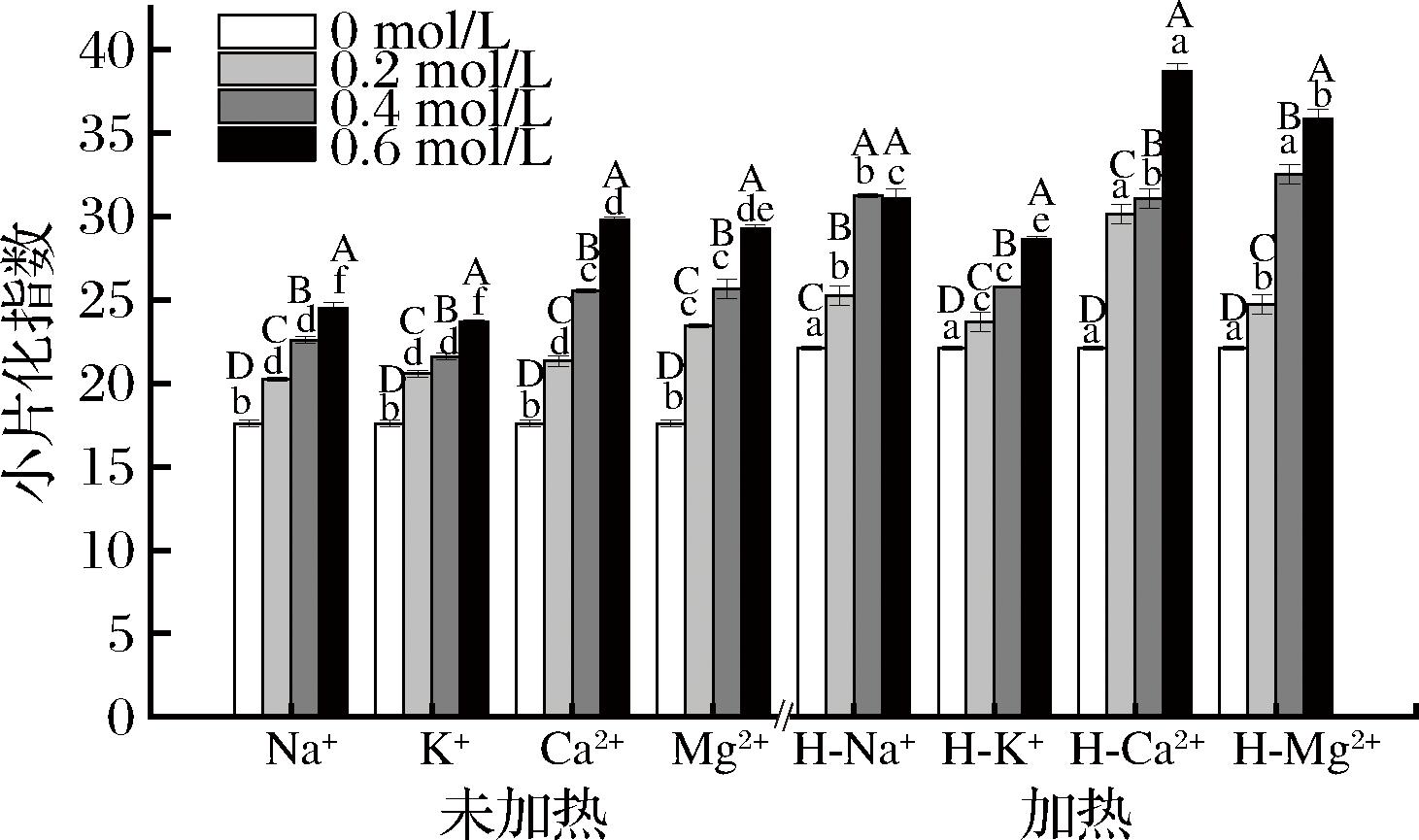
图2 离子强度和加热对藏羊肉MPs小片化指数的影响
Fig.2 Effect of ionic strength and heating on the index of miniaturization of MPs of Tibetan mutton
2.3 离子强度和加热对藏羊肉MPs总巯基含量的影响
蛋白质巯基损失是蛋白质氧化的标志之一,含硫氨基酸的巯基极易发生氧化反应[17]。图3的结果表明经离子处理和加热后的MPs总巯基含量均下降,说明加热和离子处理均会导致蛋白质氧化加重,原因是在肉体系中,过氧自由基可以从半胱氨酸的S—H基团中抽取氢原子以产生硫基自由基[25]。ZHANG等[26]认为巯基对蛋白质三级结构的稳定起重要作用,巯基含量的变化会引起MPs三级结构的变化。同时从结果中可以发现经Mg2+、Ca2+和热处理作用后均会导致MPs的总巯基含量降低,其中Ca2+和热处理共同作用下总巯基含量最低,原因是Mg2+和Ca2在化学性质上相似,均会诱导蛋白展开从而使巯水基团暴露并生成二硫键[27];而加热过程中会将暴露的巯基氧化形成二硫键,同时会使MPs变性形成聚集体,将之前暴露的巯基重新包裹,从而使得总巯基含量下降[28]。徐永霞等[29]发现加热处理会导致鱼MPs分子先伸展后聚合,总巯基含量随着热处理时间延长含量逐渐降低。
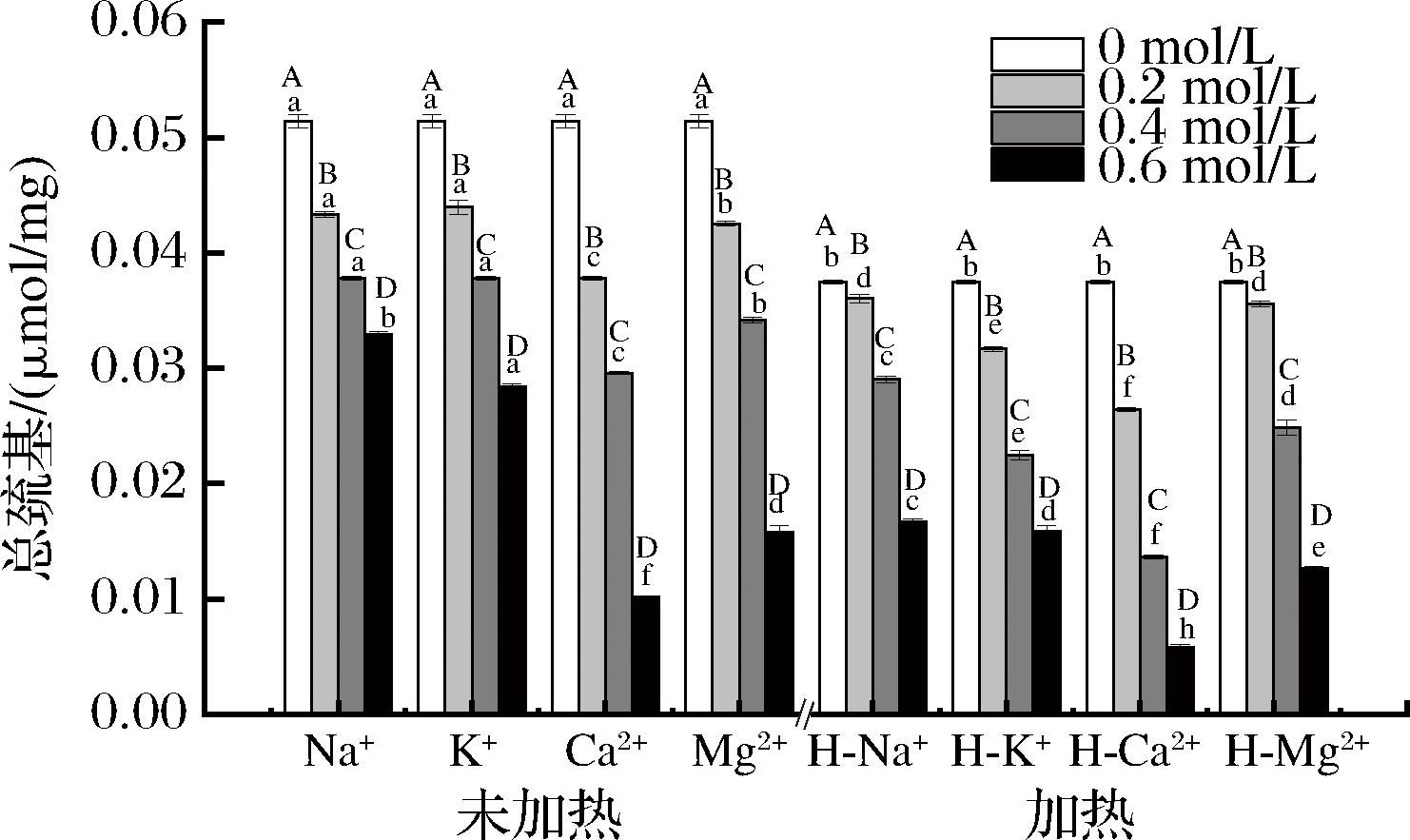
图3 离子强度和加热对藏羊肉MPs总巯基含量的影响
Fig.3 Effect of ionic strength and heating on the total sulfhydryl content of MPs in Tibetan mutton
2.4 离子强度和加热对藏羊肉MPs总羰基含量的影响
蛋白质羰基含量可以反映蛋白质氧化程度,蛋白质发生氧化时,其侧链的部分氨基酸易被转化成羰基基团[30]。由图4可知,加热和离子处理均会导致蛋白质氧化,随离子浓度的升高,蛋白质羰基含量显著增加(P<0.05)。前人在研究食盐对猪肉MPs氧化及功能特性时发现随着食盐添加量的增加,猪肉MPs总羰基含量上升,原因是NaCl可以抑制谷胱甘肽过氧化酶等内源性抗氧化酶,抑制了抗氧化酶对活性氧的清除作用[31-32],从而促进了自由基攻击肌肉蛋白侧链氨基酸,形成了醛或酮的衍生物,使羰基值增大。而WEN等[33]研究发现KCl可以降低羰基的含量,减缓蛋白质的氧化程度,图4的试验结果表明高浓度的钾离子处理下MPs的总羰基含量显著低于钠离子处理,说明钾离子与钠离子相比可以降低MPs的氧化程度。同时结果表明Ca2+和加热处理下羰基含量最高,说明Ca2+处理会加重MPs的氧化程度。
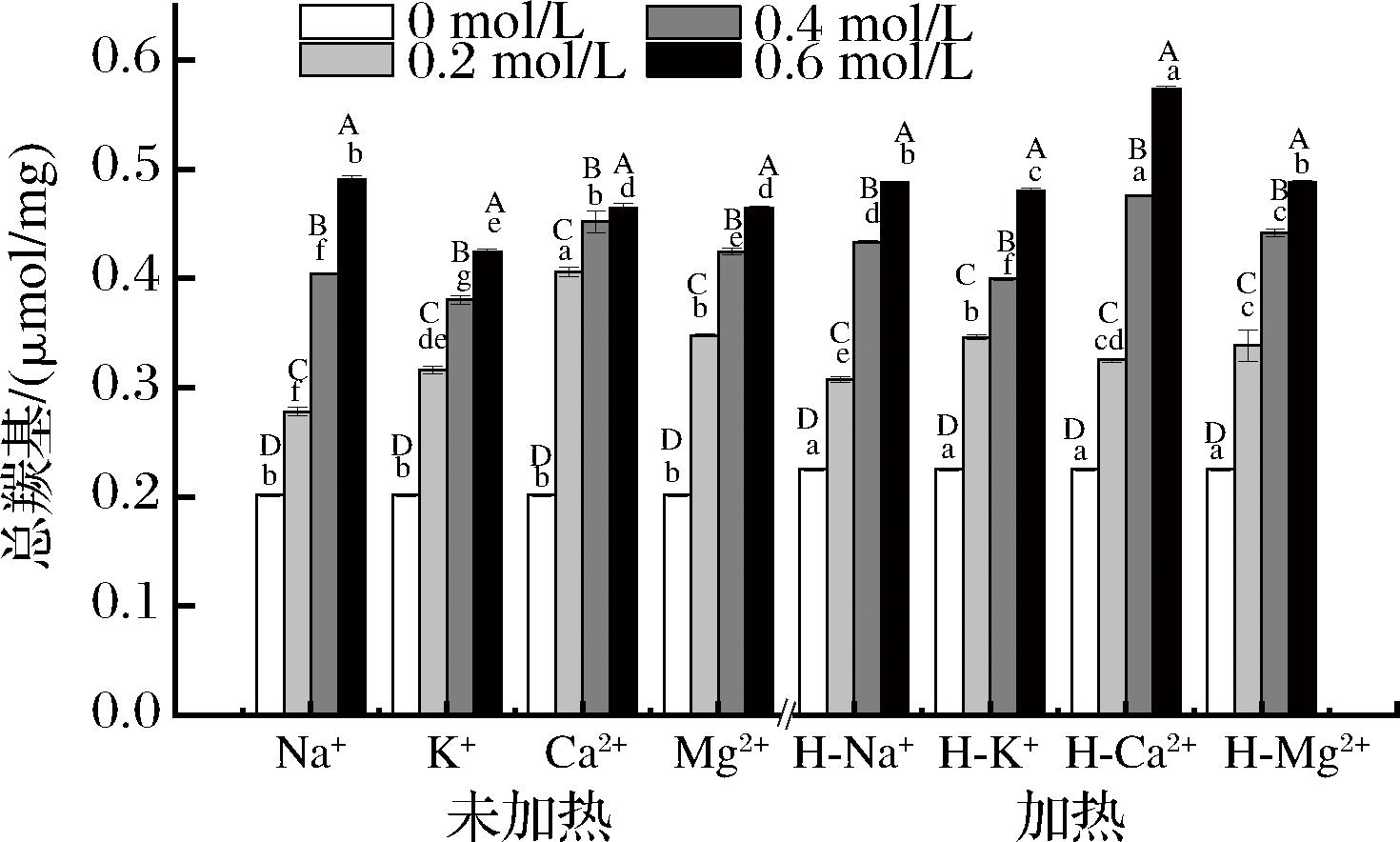
图4 离子强度和加热对藏羊肉MPs总羰基含量的影响
Fig.4 Effect of ionic strength and heating on the total carbonyl content of MPs of Tibetan mutton
2.5 离子强度和加热对藏羊肉MPs氢键含量的影响
氢键在蛋白质的构型中发挥着非常重要的作用,它可以帮助蛋白质分子保持稳定的三维结构,由图5可知,在没有离子作用的情况下,经加热后的MPs氢键含量显著下降(P<0.05),说明加热会诱导蛋白质分子间氢键相互作用。原因是热能会破坏蛋白质的氢键,从而导致其展开,最后发生聚集[34]。未加热时,经离子处理后氢键含量随着离子浓度的增大缓慢下降,其中钠钾离子处理下氢键的含量要显著低于钙镁离子处理(P<0.05);在加热的情况下,经离子处理后的氢键含量随离子浓度的增高逐渐上升,原因可能是未加热时,低浓度的离子作用先增加了MPs的β-折叠,然后随着浓度的升高转化为α-螺旋,导致分子间氢键减少[19],随着离子强度增加,自由基扩散造成更多MPs聚集,从而破坏静态屏蔽效应并削弱氢键[35]。加热和低离子强度(0.2 mol/L)作用下,MPs氧化程度加重,C![]() O和—NH基团之间的氢键断裂,导致氢键和α-螺旋的含量降低[36],因此氢键含量显著低于未加热处理,但随着离子强度的增加,MPs逐渐展开,α-螺旋断裂,形成了无规卷曲和β-折叠,氢键含量逐渐升高[29]。
O和—NH基团之间的氢键断裂,导致氢键和α-螺旋的含量降低[36],因此氢键含量显著低于未加热处理,但随着离子强度的增加,MPs逐渐展开,α-螺旋断裂,形成了无规卷曲和β-折叠,氢键含量逐渐升高[29]。
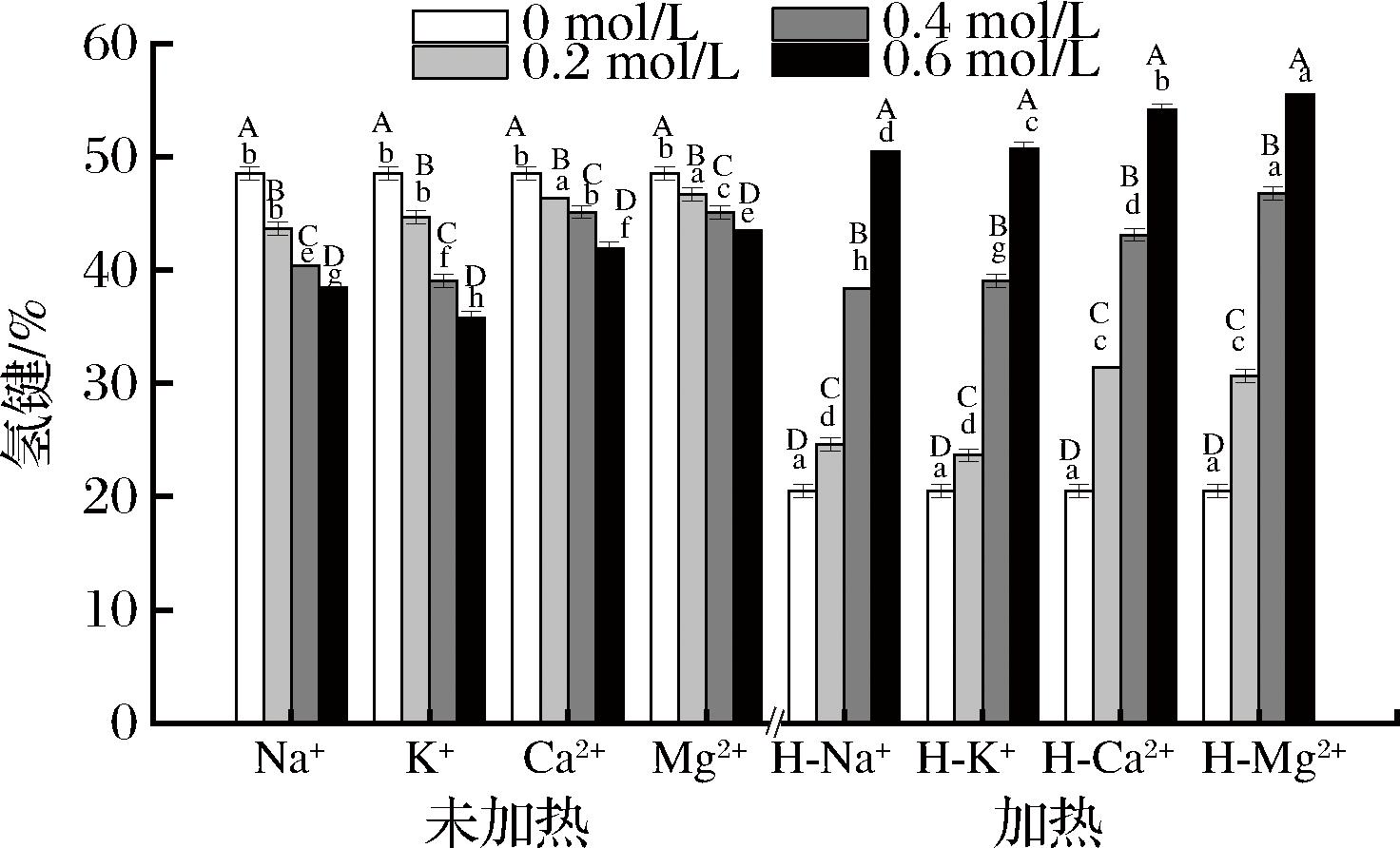
图5 离子强度和加热对藏羊肉MPs氢键含量的影响
Fig.5 Effect of ionic strength and heating on the hydrogen bonding content of MPs in Tibetan mutton
2.6 离子强度和加热对藏羊肉MPs表面疏水性的影响
表面疏水性普遍用于评价疏水性氨基酸残基在蛋白质表面的分布程度。由图6可知,在未经离子处理时,加热后的MPs表面疏水性上升,原因是加热会导致MPs多肽链的氧化断裂和蛋白质的片段化,使更多活性巯基开始暴露并参与到分子间相互作用[37],导致表面疏水性增加;同时结果表明离子处理也会加重MPs的氧化,原因是离子作用下会导致MPs产生较多的蛋白交联以及水解[37],导致更多的疏水基团暴露,从而表面疏水性显著增加(P<0.05),而随后各离子处理组增加量随浓度增加变得缓慢,可能是因为随氧化程度的加剧,疏水性基团在蛋白质表面达到饱和,表面疏水性趋于稳定[38]。
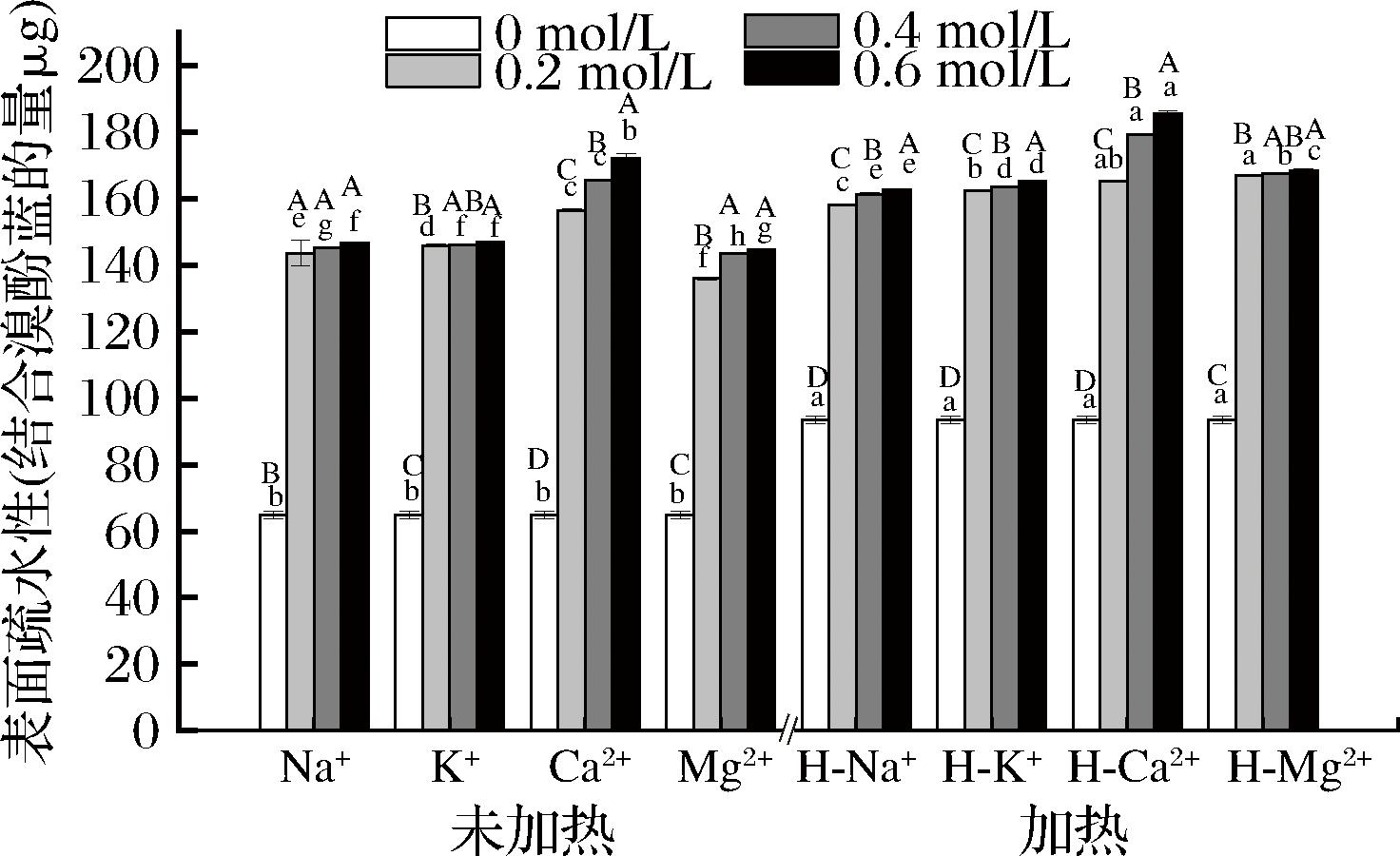
图6 离子强度和加热对藏羊肉MPs表面疏水性的影响
Fig.6 Effect of ionic strength and heating on the surface hydrophobicity of MPs of Tibetan mutton
2.7 不同离子强度及加热对MPs结合特征风味化合物能力的影响
实验前对藏羊肉的挥发性风味物质进行测定,发现丙醛、正丁醇、正己醇、正己醛和正丁醛均为藏羊肉的主要挥发性风味物质,正己醇和正己醛具有水果香气,正丁醛具有油脂香气;因此选择以上5种化合物作为藏羊肉的特征风味物质进行研究。图7分别表明不同离子强度及加热对MPs结合5种特征风味化合物的影响,纵坐标表示各特征风味化合物的自由比例,即经过处理后各特征风味化合物未与MPs结合的相对含量,自由比例越高,说明其与MPs结合能力越低,保留率越低。图7-A为丙醛在不同离子强度和加热处理条件下的自由比例,由结果可知,经加热及浓度为0.2 mol/L Na+和0.6 mol/L K+处理后,丙醛与MPs的结合力较低,未加热及0.6 mol/L Ca2+处理和加热后0.6 mol/L Mg2+处理后,丙醛与MPs的结合力最高;整体来看,随着浓度的增加,丙醛与MPs的结合力逐渐上升。
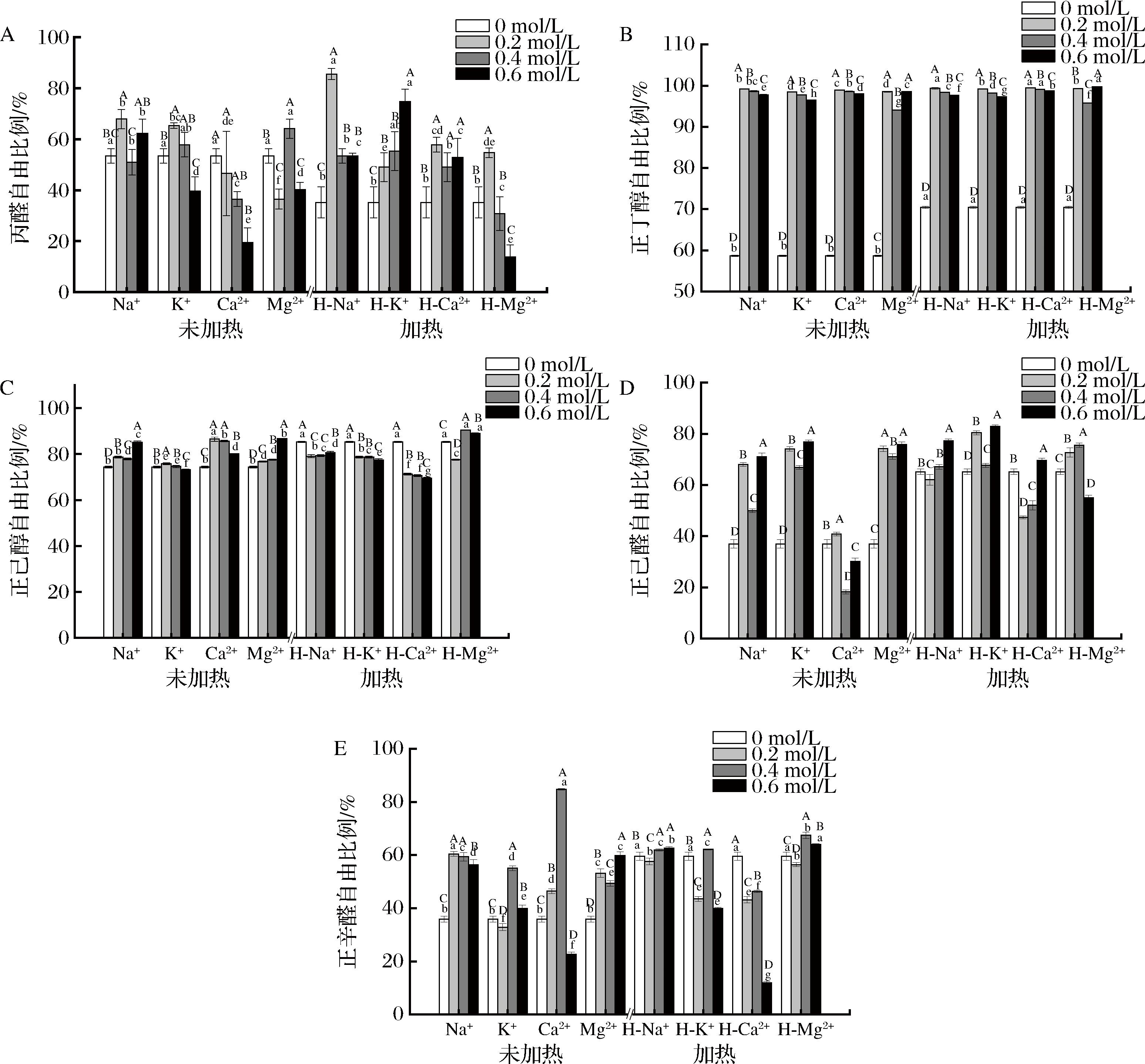
A-丙醛;B-正丁醇;C-正己醇;D-正己醛;E-正辛醛
图7 不同离子强度及加热对MPs结合特征风味化合物能力的影响
Fig.7 Effects of different ionic strengths and heating on the ability of MPs to bind characteristic flavor compounds
图7-B为正丁醇在不同离子强度和加热处理条件的自由比例,由结果可知,未经离子处理时,加热后的正丁醇保留率要显著低于未加热处理的组别,而离子处理后对正丁醇与MPs的结合力影响差异不大。
图7-C为正己醇在不同离子强度和加热处理条件的自由比例,由结果可知,未经离子处理时,加热后的正己醇保留率要显著低于未加热处理的组别,当离子浓度为0.2 mol/L时,各处理条件下,正己醇与MPs的结合力相对较低,Mg2+和加热处理下正己醇与MPs的结合力最低,Ca2+在加热后正己醇与MPs的结合力要显著高于未加热处理。
图7-D为正己醛在不同离子强度和加热处理条件的自由比例,由结果可知,未经离子处理时,加热后的正己醛与MPs的结合力要显著高于未加热处理的组别,K+处理下正己醛与MPs的结合力均较低,加热后,经0.2 mol/L Ca2+处理正己醛与MPs的结合力显著低于未加热,但随浓度变化其结合力呈不规律性变化。
图7-E为正辛醛在不同离子强度和加热处理条件的自由比例,由结果可知,未经离子处理时,加热后的正辛醛与MPs的结合力要显著低于未加热处理的组别,其中0.4 mol/L Ca2+处理在未加热的条件下正辛醛与MPs的结合力最低,加热后,Na+、K+、Mg2+处理正辛醛与MPs的结合力均低于加热前,Ca2+则相反。
总体上,加热后对正丁醇、正己醇和正辛醛与MPs的结合力要低于加热前,丙醛和正己醛在加热后与MPs的结合力要高于加热前,醛类与蛋白质的结合主要为疏水相互作用和氢键等的可逆结合,加热会导致蛋白质变性,影响蛋白质的结构进而影响其与风味物质的结合能力[39],当加热后,蛋白质之间的相互作用增强导致聚集沉降,使得暴露的结合位点被包埋,结合位点减少,从而醛类物质的结合能力下降[36],从而有利于风味物质的释放。WANG等[39]研究发现,醛类物质与蛋白质的结合能力随加热时间的延长呈现先增强后降低的趋势。由本试验结果可知,各离子对风味物质的结合能力不尽相同,但添加离子后各特征风味物质与MPs的结合力要低于未添加,风味物质的释放受到抑制。PÉREZ-JUAN等[40]研究发现添加氯化钠和氯化钾能削弱对醛酮类物质的吸附能力,这种情况被称为“盐析现象”。本试验结果中,各类化合物的自由比例随着离子的添加而有一定程度上升,说明MPs对特征风味化合物的吸附能力降低,且对不同特征风味物质的吸附能力存在差异,原因可能是各离子处理导致MPs的氧化程度不同,对MPs构象的改变也不同,暴露的结合位点也有差异,从而导致不同离子处理对MPs与特征风味化合物结合能力不同[3]。
3 结论
利用不同浓度的Na+、Mg2+、Ca2+和K+处理藏羊肉的MPs,并对其分别做加热和不加热处理,结果发现不同离子强度和加热处理均会加剧藏羊肉MPs的氧化,致使总巯基含量下降、总羰基含量上升,诱导蛋白质分子间氢键相互作用导致氢键含量上升,改变部分疏水性氨基酸结构,使更多疏水性基团暴露于蛋白质表面,同时导致MPs变性和聚集从而溶解性下降和MPs结构完整度降低。对于特征风味物质的吸附,加热处理会提升MPs对丙醛和正己醛的吸附能力,不同离子强度处理均会加强对风味物质的吸附能力从而影响风味物质的释放。因此,不同的离子强度和加热会通过影响MPs结构展开与聚合过程中暴露或改变风味结合位点从而影响MPs对风味物质的结合能力。
[1] 刘海珍, 焦小鹿. 青海藏羊肉中维生素含量及肉品安全性的分析研究[J]. 中国草食动物, 2006, 26(5):58-59.LIU H Z, JIAO X L. Analysis on vitamin content and meat safety of Tibetan mutton in Qinghai province[J]. China Herbivores, 2006, 26(5):58-59.
[2] 王朕朕, 罗海玲, 曲扬华, 等. 多不饱和酸的营养作用及饲养方式对其在羊肉中沉积的影响[C].第十一届(2014)中国羊业发展大会论文集. 遵义, 2014:170-172.
[3] 申辉. 猪肉肌原纤维蛋白与特定风味化合物的相互作用机制研究[D]. 广州: 华南理工大学, 2019.SHEN H. Study on the interaction mechanism between pork myofibrillar protein and specific flavor compounds[D]. Guangzhou: South China University of Technology, 2019.
[4] 杨玉玲, 游远, 彭晓蓓, 等. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J]. 中国农业科学, 2014, 47(10):2013-2020.YANG Y L, YOU Y, PENG X B, et al. Influence of heating on structure and gel properties of myofibrillar proteins from chicken breast muscle[J]. Scientia Agricultura Sinica, 2014, 47(10):2013-2020.
[5] 姬琛, 尤丽琴, 刘吉娟, 等. 滩羊肉嫩度形成中Ca2+的信号转导作用[J]. 中国食品学报, 2022, 22(12):214-223.JI C, YOU L Q, LIU J J, et al. The transduction role of Ca2+ in meat tenderness development of Tan sheep[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(12):214-223.
[6] FLORES M, GIANELLI M P, PÉREZ-JUAN M, et al. Headspace concentration of selected dry-cured aroma compounds in model systems as affected by curing agents[J]. Food Chemistry, 2007, 102(2):488-493.
[7] 林静, 刘斌, 李松林. 氯化钾、氯化钙和氯化镁部分替代食盐腌制对风鸡品质影响的研究[J]. 食品工业科技, 2016, 37(3):105-109.LIN J, LIU B, LI S L. Study on the influence of potassium, calcium and magnesium chloride as partial substitute for salt on the quality of air-dried chicken[J]. Science and Technology of Food Industry, 2016, 37(3):105-109.
[8] 魏朝贵. KCl和MgCl2部分替代NaCl条件下猪肉肌原纤维蛋白乳化特性及其应用研究[D]. 南京: 南京农业大学, 2014.WEI C G. Emulsion properties and application of pork myofibrillar fibrillar protein in the condition of partial substituting NaCl with KCl and MgCl2[D]. Nanjing: Nanjing Agricultural University, 2014.
[9] 聂若彤, 魏相茹, 张德权, 等. 肉制品中蛋白质、脂质及其相互作用吸附挥发性风味物质机理研究进展[J]. 肉类研究, 2023, 37(4):41-47.NIE R T, WEI X R, ZHANG D Q, et al. Mechanism of adsorption of volatile flavor compounds by proteins, lipids and their interaction in meat products: A review[J]. Meat Research, 2023, 37(4):41-47.
[10] BERARDO A, DEVREESE B, DE MAERE H, et al. Actin proteolysis during ripening of dry fermented sausages at different pH values[J]. Food Chemistry, 2017, 221:1322-1332.
[11] KÜHN J, CONSIDINE T, SINGH H. Interactions of milk proteins and volatile flavor compounds: Implications in the development of protein foods[J]. Journal of Food Science, 2006, 71(5): R72-R82.
[12] PÉREZ-JUAN M, FLORES M, TOLDR F. Model studies on the efficacy of protein homogenates from raw pork muscle and dry-cured ham in binding selected flavor compounds[J]. Journal of Agricultural and Food Chemistry, 2006, 54(13):4802-4808.
F. Model studies on the efficacy of protein homogenates from raw pork muscle and dry-cured ham in binding selected flavor compounds[J]. Journal of Agricultural and Food Chemistry, 2006, 54(13):4802-4808.
[13] DOU P P, FENG X C, CHENG X G, et al. Binding of aldehyde flavour compounds to beef myofibrillar proteins and the effect of nonenzymatic glycation with glucose and glucosamine[J]. LWT, 2021, 144:111198.
[14] 赵冰, 张顺亮, 李素, 等. 脂肪氧化对肌原纤维蛋白氧化及其结构和功能性质的影响[J]. 食品科学, 2018, 39(5):40-46.ZHAO B, ZHANG S L, LI S, et al. Effect of lipid oxidation on myofibrillar protein oxidation, structure and functional characteristics[J]. Food Science, 2018, 39(5):40-46.
[15] 张桂艳. 食盐和加热对肌原纤维蛋白与Ⅰ型胶原蛋白乳化特性的影响[D]. 郑州: 河南农业大学, 2022.ZHANG G Y. Effects of NaCl and heating on emulsifying properties of myofibrillar protein and type I collagen[D]. Zhengzhou: Henan Agricultural University, 2022.
[16] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4):681-683.
[17] 甘潇, 赵玲, 吴倩, 等. 氧化及不同离子强度下猪肉肌原纤维蛋白结合风味物质的研究[J]. 食品工业科技, 2022, 43(23):35-41.GAN X, ZHAO L, WU Q, et al. Effects of oxidation and different ionic environment on the binding of pork myofibrillar protein to flavor substances[J]. Science and Technology of Food Industry, 2022, 43(23):35-41.
[18] 胡远辉, 吕春霞, 廖慧琦, 等. NaCl处理对养殖大黄鱼肌原纤维蛋白风味吸附及结构的影响[J]. 食品与发酵工业, 2021, 47(14):202-209.HU Y H, LYU C X, LIAO H Q, et al. Effect of sodium chlorid treatment on flavor adsorption and structure of cultured large yellow croaker myofibrillar protein[J]. Food and Fermentation Industries, 2021, 47(14):202-209.
[19] 吕汶丞. Ca2+对手抓羊肉品质和肌原纤维蛋白结构和凝胶特性的影响研究[D]. 烟台: 烟台大学, 2023.LYU W C. Effects of Ca2+ on quality of hand-grabbed mutton and structure and gel properties of myofibrillar protein[D]. Yantai: Yantai University, 2023.
[20] 付苇娅, 周春霞, 朱潘红, 等. 3种离子强度下pH值对罗非鱼肌球蛋白溶解度及分子构象的影响[J]. 食品与发酵工业, 2017, 43(9): 64-70.FU W Y, ZHOU C X, ZHU P H, et al. Effect of pH on tilapia myosin solubility and conformation under three ionic strength solutions[J]. Food and Fermentation Industries, 2017, 43(9): 64-70.
[21] 张亮子. 草鱼肌球蛋白的分子结构及在溶液中的构象转变研究[D]. 武汉: 华中农业大学, 2015.ZHANG L Z. Research of molecular structure and conformational transition of grass carp myosin in solution[D]. Wuhan: Huazhong Agricultural University, 2015.
[22] 周茹, 倪渠峰, 林伟伟, 等. 肌原纤维蛋白溶解度对盐离子浓度的依赖性[J]. 中国食品学报, 2015, 15(3):32-39.ZHOU R, NI Q F, LIN W W, et al. The dependency of the myofibrils solubility on the ion concentration[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(3):32-39.
[23] 王颖, 李欣, 李铮, 等. 极限pH对羊肉宰后成熟过程中肌原纤维蛋白特型的影响[J]. 食品工业科技, 2019, 40(2):13-18.WANG Y, LI X, LI Z, et al. Effects of ultimate pH on the properties of myofibrillar proteins from ovine muscle during postmortem aging[J]. Science and Technology of Food Industry, 2019, 40(2):13-18.
[24] 戴妍, 邵乐乐, 邬威, 等. 欧姆加热解冻法对猪肉理化及氧化特性的影响[J]. 农产品加工, 2022(1):14-19.DAI Y, SHAO L L, WU W, et al. Influence of physical-chemical and oxidation characteristics of ohmically-cooking thawed pork batter[J]. Farm Products Processing, 2022(1):14-19.
[25] DAVIES M J. Protein oxidation and peroxidation[J]. Biochemical Journal, 2016, 473(7):805-825.
[26] ZHANG Z Y, YANG Y L, ZHOU P, et al. Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J]. Food Chemistry, 2017, 217:678-686.
[27] WANG S X, ZHANG Y M, CHEN L, et al. Dose-dependent effects of rosmarinic acid on formation of oxidatively stressed myofibrillar protein emulsion gel at different NaCl concentrations[J]. Food Chemistry, 2018, 243:50-57.
[28] LIU R, ZHAO S M, XIE B J, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids, 2011, 25(5):898-906.
[29] 徐永霞, 王瑞, 李学鹏, 等. 热处理对鱼肌原纤维蛋白结构及腥味物质结合能力的影响[J]. 中国食品学报, 2020, 20(9):131-138.XU Y X, WANG R, LI X P, et al. Effects of heat treatment on the structure of myofibrillar protein and binding ability with fishy odor compounds[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(9):131-138.
[30] BORONAT S, GARC A-SANTAMARINA S, HIDALGO E. Gel-free proteomic methodologies to study reversible cysteine oxidation and irreversible protein carbonyl formation[J]. Free Radical Research, 2015, 49(5):494-510.
A-SANTAMARINA S, HIDALGO E. Gel-free proteomic methodologies to study reversible cysteine oxidation and irreversible protein carbonyl formation[J]. Free Radical Research, 2015, 49(5):494-510.
[31] JIN G F, HE L C, YU X, et al. Antioxidant enzyme activities are affected by salt content and temperature and influence muscle lipid oxidation during dry-salted bacon processing[J]. Food Chemistry, 2013, 141(3):2751-2756.
[32] WU H Z, YAN W J, ZHUANG H, et al. Oxidative stability and antioxidant enzyme activities of dry-cured bacons as affected by the partial substitution of NaCl with KCl[J]. Food Chemistry, 2016, 201:237-242.
[33] WEN R X, HU Y Y, ZHANG L, et al. Effect of NaCl substitutes on lipid and protein oxidation and flavor development of Harbin dry sausage[J]. Meat Science, 2019, 156:33-43.
[34] 齐宝坤, 赵城彬, 李杨, 等. 热处理对大豆11S球蛋白溶解性和二级结构的影响[J]. 食品科学, 2018, 39(22):39-44.QI B K, ZHAO C B, LI Y, et al. Effect of heat treatment on solubility and secondary structure of soybean 11S glycinin[J]. Food Science, 2018, 39(22):39-44.
[35] WANG Z Y, XU W W, KANG N, et al. Microstructural, protein denaturation and water holding properties of lamb under pulse vacuum brining[J]. Meat Science, 2016, 113:132-138.
[36] WANG Y, ZHOU Y, LI P J, et al. Combined effect of CaCl2 and high pressure processing on the solubility of chicken breast myofibrillar proteins under sodium-reduced conditions[J]. Food Chemistry, 2018, 269:236-243.
[37] LI C Q, XIONG Y L, CHEN J. Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J]. Journal of Agricultural and Food Chemistry, 2012, 60(32):8020-8027.
[38] 李艳青, 孔保华, 杨赫鸿, 等. 自由基氧化引起鲤鱼肌原纤维蛋白结构的变化[J]. 食品科学, 2012, 33(13):70-74.LI Y Q, KONG B H, YANG H H, et al. Structural changes of common carp myofibrillar (MPI) influenced by hydroxyl radical system[J]. Food Science, 2012, 33(13):70-74.
[39] WANG K, ARNTFIELD S D. Effect of protein-flavour binding on flavour delivery and protein functional properties: A special emphasis on plant-based proteins[J]. Flavour and Fragrance Journal, 2017, 32(2):92-101.
[40] PÉREZ-JUAN M, FLORES M, TOLDR F. Effect of ionic strength of different salts on the binding of volatile compounds to porcine soluble protein extracts in model systems[J]. Food Research International, 2007, 40(6):687-693.
F. Effect of ionic strength of different salts on the binding of volatile compounds to porcine soluble protein extracts in model systems[J]. Food Research International, 2007, 40(6):687-693.